3.8. Acidobazická regulace
|
|
|
- Kateřina Kovářová
- před 9 lety
- Počet zobrazení:
Transkript
1 3.8. Acidobazická regulace Tabulka : Referenční intervaly Parametr Muži Ženy ph 7,37 7,43 7,37 7,43 pco 2 (kpa) 4,7 6,0 4,3 5,7 - aktuální HCO 3 (mmol/l) 23,6 27,6 21,8 27,2 - standardní HCO 3 (mmol/l) 22,5 26,9 21,8 26,8 base excess, BE (mmol/l) 3,0 až +1,5 2,0 až +3,0 Měřené parametry: ph = záporný dekadický logaritmus koncentrace volných vodíkových iontů pco 2 = parciální tlak oxidu uhličitého Odvozené parametry: aktuální HCO - 3 = počítá se v plasmě podle Henderson-Hasselbalchovy rovnice (viz dále) z naměřeného aktuálního ph a pco 2 - standardní HCO 3 = je koncentrací hydrogenkarbonátu v plasmě krve, ekvilibrované za standardních podmínek, tj. po nasycení vzduchem s pco 2 5,3 kpa a po 2 >13,0 kpa při teplotě 37 C base excess, odchylka bazí = množství silných kyselin nebo bazí, kterými je nutno titrovat 1 l plasmy nebo krve do ph 7,4 při pco 2 5,3 kpa a teplotě 37 C Stálost ph, nárazníkové systémy Systém acidobazické regulace (ABR) je slouží k udržování stálosti vnitřního prostředí z tak důležitého hlediska, jakým je aktivita H + iontů. Aktivita H + v krvi je velmi nízká (asi 40 nmol/l), proto se zpravidla vyjadřuje v jednotkách ph, které je definováno jako záporný dekadický logaritmus molární aktivity H +. Logaritmickou závislostí je dáno, že i malá změna ph odpovídá velké změně v aktivitě H +. Při poklesu ph se aktivita H + zvyšuje mnohem více, než o kolik při stejně velkém zvýšení ph naopak klesá. Pokles ph označujeme acidemie, zvýšení ph alkalemie. Stálost ph našeho vnitřního prostředí je udržována nárazníkovými systémy (pufry). Jsou to soustavy látek, které brání změně ph roztoku po přidání kyseliny nebo zásady. Kyselina je látka, schopná uvolňovat H +. Báze (zásada) je látka, která je schopná H + vázat. Kyseliny jsou
2 rozděleny na silné a slabé podle jejich schopnosti disociovat. Mírou disociace je hodnota pk, což je záporný dekadický logaritmus disociační konstanty kyseliny. Silné kyseliny mají hodnotu pk nízkou, slabé kyseliny vyšší (např. kyselina uhličitá má pk 6,1; mléčná 3,86; fosforečná 2,0). Nárazníky jsou tvořeny párem slabá kyselina a její sůl se silnou zásadou nebo naopak slabá zásada a její sůl se silnou kyselinou. Nárazníkové roztoky působí tak, že volné H + vážou ve formě slabé kyseliny. Ta je málo disociovaná, a tím se koncentrace H + udržuje poměrně stálá. ph nárazníkového roztoku je dáno rovnicí nazvanou podle svých autorů Henderson- Hasselbalchovou: ph = pk + log [soli] [kyseliny] ze vztahu vyplývá, že při konstantním pk závisí hodnota ph na poměru koncentrace soli ke koncentraci kyseliny. Nárazníkové systémy v krvi tvoří: 1. Hydrogenkarbonátový systém 53 % 2. Systém hemoglobin-oxyhemoglobin 35 % 3. Systém anorganických a organických fosfátů 5 % 4. Plazmatické bílkoviny 7 % Hydrogenkarbonátový systém tvoří největší podíl z nárazníkové kapacity krve. Je v rovnováze s ostatními nárazníkovými systémy. Pokud si jejich kyseliny označíme sumárně např. HBuf a báze Buf -, můžeme vzájemné vztahy mezi nárazníky, označované jako interakční reakce, znázornit schématem: Anion hydrogenkarbonátový tvoří sůl převážně s Na +. Tak jako každý nárazníkový systém má i tento systém svou variantu Hendersen-Hasselbalchovy rovnice, danou hodnotou pk kyseliny uhličité:
3 - [HCO3] ph = 6,1+ log [H CO ] 2 3 Výraz [H 2 CO 3 ] lze nahradit hodnotou pco 2. s, kde s je koeficientem rozpustnosti, kterým násobíme pco 2, abychom dostali [H 2 CO 3 ] v mmol/l. Pro pco 2 v kpa je tento koeficient 0,225. Hodnotu pco 2 považujeme za ukazatel nejen [H 2 CO 3 ], ale vzhledem k výše uvedené interakční reakci všech nárazníkových kyselin. U systému hemoglobin-oxyhemoglobin jde vlastně o systém dvou kyselin. Oxidovaný hemoglobin je silnější kyselina, která proton snadněji odštěpuje. Deoxygenovaný hemoglobin je slabší kyselina, která proton váže. V plicích, kde se zbavujeme CO 2 a tudíž i H + z disociované H 2 CO 3, dochází k oxidaci hemoglobinu a tedy i k větší disociaci H + z jeho molekuly. Ve tkáních, kde se hemoglobin stává redukovaný a kde jsou produkovány H +, hemoglobin naopak protony váže. Systém primárních a sekundárních fosfátů (H 2 PO - 4 a HPO 2-4 ) se uplatňuje především intracelulárně. V acidémii protony váže a uvolňuje K +, v alkalémii protony uvolňuje a K + naopak váže. S tím souvisí zvyšování kalemie v acidemii a její pokles v alkalemii. Pro většinu plazmatických bílkovin je hodnota fyziologického ph vyšší než odpovídá jejich izoelektrickému bodu. Proto mají negativní náboj (tvoří aniony) a jsou schopné vázat H +. Chovají se tedy jako báze. Uvedené nárazníky reagují jako jeden systém při zvýšení nebo snížení [H + ] z jakéhokoliv důvodu. Uveďme si např. situaci, kdy dochází k retenci CO 2 : Zátěž se rozloží na všechny systémy. Reakce, která díky tomuto propojení probíhá, se označuje jako interakční, jak již bylo výše uvedeno. Vývoj acidobazických poruch Základní poruchy ABR jsou čtyři: metabolická acidóza a alkalóza a respirační acidóza a alkalóza. Příčinami metabolických poruch jsou primární změny nezávisle proměnných veličin, diference silných bází (SID) a/nebo netěkavých slabých kyselin (A tot ). Podrobný popis těchto parametrů a příčin jejich změn bude uveden později. U respiračních poruch se primárně
4 mění hodnota pco 2. U respirační acidózy dochází k jejímu zvýšení (hyperkapnii) u respirační alkalózy ke snížení (hypokapnii). Nyní si připomeňme, jak se mění vztahy mezi parametry ABR při vývoji základních poruch. Všechny dále popsané děje jsou určeny k tomu, aby zabránily extrémní změně ph od začátku vzniku poruchy a aby se tato změna zmírnila až odstranila v dalším průběhu. K tomu slouží: 1. nárazníková reakce, 2. kompenzační reakce, 3. korekce poruchy. Nárazníková reakce probíhá okamžitě při vzniku poruchy. Mění se při ní vždy jedna složka nárazníkové dvojice báze : kyseliny (resp. pco 2 ). U metabolických poruch se mění hodnota celkového množství nárazníkových bází v krvi vyjádřená jako base excess (BE). U metabolické acidózy se snižuje, u alkalózy zvyšuje. Hodnota pco 2 se nemění. U respiračních poruch se naopak mění pco 2 a nemění BE. Výjimkou je těžká respirační acidóza, u níž pro zhoršenou difúzi kyslíku v plicích dochází nutně k laktátové acidóze z nedostatku kyslíku ve tkáních (hypoxie), která posunuje BE do záporných hodnot. Při kompenzační reakci dochází ke změně druhé složky nárazníkové dvojice, která se nezměnila při nárazníkové reakci. Její změna (snížení, zvýšení) je shodná se změnou první složky. Tím se poměr báze : kyseliny bude blížit fyziologickému, i když jejich absolutní množství bude shodně u obou buď zvýšeno či sníženo. V každém případě to způsobí posun ph směrem k hodnotám 7,4. Kompenzaci metabolických poruch zajišťují plíce. U metabolické acidózy je to hyperventilace vedoucí k hypokapnii, která se rozvíjí záhy po vzniku poruchy a dosahuje maxima do 24 h. U metabolické alkalózy spočívá kompezace v hypoventilaci, vedoucí k hyperkapnii. Kompenzaci respiračních poruch zajišťují ledviny. U respirační acidózy se retinují a generují HCO - 3. Zvýšeně se vylučují Cl - + vázané na NH 4 a protony vázané formou NH + 4 a H 2 PO - 4. U respirační alkalózy naopak vylučují HCO - 3 a Cl - s H + retinují. Vývoj parametrů ABR znázorňuje graf acidobazické regulace. Umožňuje grafickou vizuální představu vztahů mezi jednotlivými parametry Henderson-Hasselbalchovy rovnice a sledování vývoje při průběhu nárazníkové a kompenzační reakce.
5 Graf acidobazické regulace: NH = normální hodnoty, AMAC = akutní metabolická acidóza, AMAL = akutní metabolická alkalóza, ARAC = akutní respirační acidóza, ARAL = akutní respirační alkalóza, UMAC = ustálená metabolická acidóza, UMAL = ustálená metabolická alkalóza, URAC = ustálená respirační acidóza, URAL = ustálená respirační alkalóza. Tam, kde jsou na grafu hraniční oblasti základních poruch, jsou oblasti nálezů, typické pro smíšené poruchy (např. hyperkapnie + deficit bází = smíšená respirační a metabolická acidóza). Tam, kde jsou ale současně dvě poruchy protichůdné, tj. metabolická acidóza + metabolická alkalóza, jejich vliv na parametry ABR se ruší a ty mohou být téměř nebo zcela normální. Graf samozřejmě nevypovídá nic o příčině, či dokonce o více příčinách, jedné metabolické poruchy. To umožňuje až hodnocení vztahů mezi ionty a parametry ABR, popisované dále. Korekcí poruchy je úprava té složky nárazníkové dvojice, která se změnila při nárazníkové reakci. Korekci metabolických poruch zajišťují ledviny, pokud jsou toho schopny. Při metabolické acidóze moč acidifikují, při metabolické alkalóze alkalizují. Korekci těchto poruch dělá i lékař, když při metabolické acidóze podává alkalizující roztoky, při metabolické alkalóze roztoky acidifikující. Korekcí respiračních poruch je úprava pco 2 umělou plicní ventilací. Vztahy mezi iontovými systémy a acidobazickou rovnováhou Vše, co bylo výše popsáno vychází z klasického pojetí acidobazické rovnováhy, které bylo zavedeno dánskou školou před asi 40 lety (Astrup a Siggaard-Andersen). Limity tohoto pojetí byly zmíněny výše při popisu výhod a nevýhod grafu acidobazické regulace. Proto je výhodné, že na toto pojetí navázala moderní koncepce interpretace poruch acidobazické
6 rovnováhy, která vychází z její těsné souvislosti s iontogramem (Stewart 1983, Fencl 2000). Podle těchto autorů je stav acidobazické rovnováhy určován nezávisle proměnnými veličinami. V plazmě mezi ně patří: 1. pco 2 2. Diference silných iontů (SID). Je to diference mezi sumou všech silných (úplně disociovaných, chemicky nereagujících) kationtů (Na +, K +, Ca 2+, Mg 2+ ) a všemi silnými anionty (Cl - a další silné anionty). 3. Koncentrace netěkavých slabých kyselin (A tot ), tj. suma látkových koncentrací negativních nábojů albuminu a anorganického fosfátu (P i ). Žádná z dalších acidobazických proměnných (tj. ph, [HCO - 3 ], BE) se nemůže změnit primárně. Jsou to závislé hodnoty, které se mění jen v závislosti na změně nezávisle proměnných veličin. 1. Strong ion difference (SID mmol/l), výpočet uvádíme ve Fenclem zjednodušené podobě: SID = [HCO - 3 ]mmol/l + 0,28. [Alb] g/l + 1,8. [P i ]mmol/l Pi = koncentrace anorganických fosfátů, mmol/l; Alb = koncentrace albuminu, g/l. Referenční rozmezí je mmol/l. SID se zvyšuje při metabolické alkalóze z důvodu zvýšení koncentrace Na +, snížení koncentrace Cl -, event. při kombinaci obou těchto vlivů. SID se snižuje při metabolické acidóze z důvodů snížení koncentrace Na +, zvýšení koncentrace Cl -, event. při kombinaci obou těchto vlivů, a při zvýšení UA Neidentifikované (neměřené) anionty (UA -, mmol/l). Tato hodnota obsahuje anionty anorganických i organických kyselin: [UA - ] = [Na + ] + [K + ] + [Ca 2+ ] + [Mg 2+ ] ([Cl - ] + [SID]) Referenční rozmezí je 6 10 mmol/l. UA - se zvyšují při metabolické acidóze, způsobené zvýšením koncentrace organických i anorganických kyselin (např. při ketoacidóze, mléčné acidóze). 3. Anion gap (AG, mmol/l): AG = [Na + ] + [K + ] ([Cl - ] + [HCO - 3 ]) Referenční rozmezí je mmol/l. Významem tohoto jednoduchého výpočtu je upozornit na zvýšení UA -, ale je navíc ovlivněn i hodnotou fosfátů. Jde o výpočet starší než UA -, který přežívá i moderní Fenclovu koncepci. Je nutno vědět, že hodnota AG se snižuje při
7 - hypoalbuminémii. Poklesem albuminu o 1 g/l se vytvoří prostor pro zvýšení HCO 3 o 0,25 mmol/l. Takže např. při poklesu albuminémie ze 40 na 20 g/l se vytvořil předpoklad pro - zvýšení HCO 3 ze 24 na 29 mmol/l. Proto se doporučuje korekce výpočtu AG při hypoalbuminémii. AG corr = AG + 0,25. ([Alb] norm [Alb] zjišť ) 4. Korigované chloridy (Cl corr, mmol/l). Při hyponatrémii (nadbytku vody) se chloridémie sníží buď úměrně s poklesem sérového Na +, nebo relativně více či méně. Jak uvedeno výše, samotný pokles koncentrace silných iontů snižuje i prostor pro HCO - 3 v séru a vzniká acidóza z nadbytku vody. Je-li za této situace pokles sérových Cl - menší než pokles sérového Na +, je prostor pro HCO - 3 snížen ještě více a příčinami acidózy jsou jak nadbytek vody, tak relativní nadbytek Cl -. Je-li při hyponatrémii naopak pokles Cl - ještě výraznější, vytváří to větší prostor pro HCO - 3 a mírní nebo ruší acidózu z nadbytku vody. Zrcadlové situace nastávají při nedostatku vody, tj. hypernatrémii. Zjištěnou hodnotu sérových Cl - je proto nutno při současných změnách sérového Na + korigovat dle následujícího výpočtu: [Cl - ] korig = [Cl - ] zjišť. [Na + ] norm /[Na + ] zjišť Výpočtem se tedy zjistí, zda při aktuální dysbalanci natrémie je hodnota chloridů změněna více nebo méně, než odpovídá změně natrémie. Ze změn koncentrací netěkavých slabých kyselin, ovlivňujících ABR, se v praxi uplatňuje především hypoalbuminémie, která je velmi častá. Naopak hyperalbuminémie se u intenzivně léčených v praxi nevyskytuje vůbec. Vliv hypoalbuminémie na ABR byl již popsán výše v souvislosti s AG. U anorganických fosfátů je situace opačná, ABR ovlivňuje jejich zvýšení (např. při selhání ledvin), zatímco vliv poklesu Pi je zanedbatelný. Tabulka Příklad hodnocení vztahů mezi acidobazickou rovnováhou a ionty. Nemocný XY, diagnóza: trauma mozku, bronchopneumónie, selhání ledvin a oběhu. Měřené parametry Vypočítané parametry Na mmol/l HCO ,5 mmol/l K + 3,9 mmol/l AG zjist 15 mmol/l Ca 2+ 2,2 mmol/l AG korig 24 mmol/l Mg 2+ 0,8 mmol/l BE plazmy +1mmol/l
8 Cl - 96 mmol/l SID 29 mmol/l P i 0,4 mmol/l Cl - korig 103 mmol/l Albumin 10 g/l UA - 19 mmol/l ph 7,36 pco 2 5,7 kpa Hodnocení: Nález ABR v mezích fyziologických hodnot. snížení SID o 10 mmol/l je způsobeno zvýšením [UA - ] a nadbytkem plazmatické vody ([Na + ] = 133 mmol/l), měřené [Cl - ] sníženy, po korekci jsou ale normální, pokles SID je vyrovnáván hypoalbuminemickou alkalózou, výsledkem je normální BE i [HCO - 3], AG zjist neprokazuje MAC ze zvýšení [UA - ], tu ozřejmí teprve AG korig. Závěr: Smíšená porucha, acidóza z nadbytku neidentifikovaných aniontů a plazmatické vody. Hypoalbuminemická alkalóza. Hodnocení nálezů acidobazické rovnováhy vychází z klasické koncepce dánské školy, musí však být doplněno dopočítávanými parametry, které charakterizují vztahy mezi iontovými systémy a vlastními parametry acidobazické rovnováhy. Jedině takový přístup umožní diferencovat jednoduché a smíšené poruchy i více příčin jednotlivých poruch. Literatura 1. Jabor, A. Voda, ionty a modelování poruch vnitřního prostředí. Pardubice : Stapro, 1999, 162 s., Racek, J., Eiselt, J., Friedecký, B. et al. Klinická biochemie. Praha : Galén - Karolinum, 1999, 317 s., ISBN Zima, T., Kazda, A., Průša, R. et al. Laboratorní diagnostika. Praha : Galén, 2002, 728 s., ISBN
9
Acidobazická rovnováha a její vztahy k iontovému hospodářství. Klinické aplikace.
 Text použit s laskavým svolením autora. Acidobazická rovnováha a její vztahy k iontovému hospodářství. Klinické aplikace. Antonín Jabor Oddělení klinické biochemie Nemocnice Kladno Část 1. Relevantní parametry
Text použit s laskavým svolením autora. Acidobazická rovnováha a její vztahy k iontovému hospodářství. Klinické aplikace. Antonín Jabor Oddělení klinické biochemie Nemocnice Kladno Část 1. Relevantní parametry
Acidobazická rovnováha
 Acidobazická rovnováha Klepnutím lze upravit styl předlohy podnadpisů. MUDr. Jiří Dvorský, NMB Vnitřní prostředí Pod pojmem vnitřní prostředí chápeme extracelulární tekutinu (včetně jejího složení) omývající
Acidobazická rovnováha Klepnutím lze upravit styl předlohy podnadpisů. MUDr. Jiří Dvorský, NMB Vnitřní prostředí Pod pojmem vnitřní prostředí chápeme extracelulární tekutinu (včetně jejího složení) omývající
ABR a iontového hospodářství
 Poruchy acidobazické rovnováhy Patobiochemie a diagnostika poruch ABR a iontového hospodářství Regulace kyselosti vnitřního prostředí CO 2 NH 3 tvorba močoviny glutaminu H + HCO - 3 Martin Vejražka, 2007
Poruchy acidobazické rovnováhy Patobiochemie a diagnostika poruch ABR a iontového hospodářství Regulace kyselosti vnitřního prostředí CO 2 NH 3 tvorba močoviny glutaminu H + HCO - 3 Martin Vejražka, 2007
ABR a iontového hospodářství
 Poruchy acidobazické rovnováhy Patobiochemie a diagnostika poruch ABR a iontového hospodářství Připojte se! Room name: ABR http://b.socrative.com Regulace kyselosti vnitřního prostředí CO 2 NH 3 tvorba
Poruchy acidobazické rovnováhy Patobiochemie a diagnostika poruch ABR a iontového hospodářství Připojte se! Room name: ABR http://b.socrative.com Regulace kyselosti vnitřního prostředí CO 2 NH 3 tvorba
Acidobazické regulace
 ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE 2004 Acidobazické regulace Antonín Kazda kapitola ve skriptech 3.8 Klasifikace acidobazických ch poruch Porucha ACIDOSA ALKALOSA I. Respirační PCO2 II. Nerespirační
ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE 2004 Acidobazické regulace Antonín Kazda kapitola ve skriptech 3.8 Klasifikace acidobazických ch poruch Porucha ACIDOSA ALKALOSA I. Respirační PCO2 II. Nerespirační
Plasma a většina extracelulární
 Acidobazická rovnováha Tato prezentace je přístupná online Fyziologické ph Plasma a většina extracelulární tekutiny ph = 7,40 ± 0,02 Význam stálého ph Na ph závisí vlastnosti bílkovin aktivita enzymů struktura
Acidobazická rovnováha Tato prezentace je přístupná online Fyziologické ph Plasma a většina extracelulární tekutiny ph = 7,40 ± 0,02 Význam stálého ph Na ph závisí vlastnosti bílkovin aktivita enzymů struktura
Acidobazická rovnováha 11
 Acidobazická rovnováha 11 Iontogram krevní plazmy, AG, SID, BB s, pufrační systémy, hydrogenuhličitanový pufr. Poruchy acidobazické rovnováhy. 1. Jaký je princip měření a? 2. Které kyslíkové parametry
Acidobazická rovnováha 11 Iontogram krevní plazmy, AG, SID, BB s, pufrační systémy, hydrogenuhličitanový pufr. Poruchy acidobazické rovnováhy. 1. Jaký je princip měření a? 2. Které kyslíkové parametry
Stewart Fenclův koncept hodnocení poruch ABR
 Stewart Fenclův koncept hodnocení poruch ABR František Duška Klinika anesteziologie a resuscitace a Ústav lék. chemie a biochemie 3. LF UK Motto: Republika nepotřebuje chemiky! Roberspierre při vynášení
Stewart Fenclův koncept hodnocení poruch ABR František Duška Klinika anesteziologie a resuscitace a Ústav lék. chemie a biochemie 3. LF UK Motto: Republika nepotřebuje chemiky! Roberspierre při vynášení
Produkce kyselin v metabolismu Těkavé: 15,000 mmol/den kyseliny uhličité, vyloučena plícemi jako CO 2 Netěkavé kyseliny (1 mmol/kg/den) jsou vyloučeny
 Vnitřní prostředí a acidobazická rovnováha 13.12.2004 Vnitřní prostředí Sestává z posuzování složení extracelulární tekutiny z hlediska izohydrie (= optimální koncentrace ph) izoionie (= optimální koncentrace
Vnitřní prostředí a acidobazická rovnováha 13.12.2004 Vnitřní prostředí Sestává z posuzování složení extracelulární tekutiny z hlediska izohydrie (= optimální koncentrace ph) izoionie (= optimální koncentrace
Acidobazická rovnováha vývoj interpretace nálezn. lezů. A. Kazda
 Acidobazická rovnováha vývoj interpretace nálezn lezů A. Kazda Vyšet etřování acidobazické rovnováhy před p r. 1956 Bylo měřm ěřeno ph krve a vyšet etřen en celkový CO 2 (Total CO 2 ) např. van Slykeovým
Acidobazická rovnováha vývoj interpretace nálezn lezů A. Kazda Vyšet etřování acidobazické rovnováhy před p r. 1956 Bylo měřm ěřeno ph krve a vyšet etřen en celkový CO 2 (Total CO 2 ) např. van Slykeovým
P. Schneiderka, Ústav patologické fyziologie LFUP a OKB FN Olomouc
 P. Schneiderka, Ústav patologické fyziologie LFUP a OKB FN Olomouc Acidobazický stav organismu Verze 27.9. 2012 Úvod Za průkopníka znalostí o acidobazickém stavu organismu (ABS) lze považovat amerického
P. Schneiderka, Ústav patologické fyziologie LFUP a OKB FN Olomouc Acidobazický stav organismu Verze 27.9. 2012 Úvod Za průkopníka znalostí o acidobazickém stavu organismu (ABS) lze považovat amerického
Acidobazický stav organismu
 Acidobazický stav organismu Doc. MUDr. Petr Schneiderka CSc. Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických a klinických předmětů na LF UP a FZV UP Reg. č.: CZ.1.07/2.2.00/15.0313
Acidobazický stav organismu Doc. MUDr. Petr Schneiderka CSc. Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických a klinických předmětů na LF UP a FZV UP Reg. č.: CZ.1.07/2.2.00/15.0313
Vyšetřování a léčba poruch acidobazické rovnováhy
 Vyšetřování a léčba poruch acidobazické rovnováhy Vladimír Soška Oddělení klinické biochemie Fyziologické hodnoty ABR Parametr Jednotka Normální meze Kritické hodnoty ph 7.35-7.45 < 7.1; > 7.6 pco 2 kpa
Vyšetřování a léčba poruch acidobazické rovnováhy Vladimír Soška Oddělení klinické biochemie Fyziologické hodnoty ABR Parametr Jednotka Normální meze Kritické hodnoty ph 7.35-7.45 < 7.1; > 7.6 pco 2 kpa
Zpět k základům: poruchy acidobazické rovnováhy a vnitřního prostředí u komplikovaného pacienta Antonín Jabor, Janka Franeková
 Zpět k základům: poruchy acidobazické rovnováhy a vnitřního prostředí u komplikovaného pacienta Antonín Jabor, Janka Franeková PLM IKEM a 3. LF, UK Praha 7.10. 08:50 7.10 12:17 7.10. 16:44 8.10. 02:00
Zpět k základům: poruchy acidobazické rovnováhy a vnitřního prostředí u komplikovaného pacienta Antonín Jabor, Janka Franeková PLM IKEM a 3. LF, UK Praha 7.10. 08:50 7.10 12:17 7.10. 16:44 8.10. 02:00
 OBECNÁ CHEMIE František Zachoval CHEMICKÉ ROVNOVÁHY 1. Rovnovážný stav, rovnovážná konstanta a její odvození Dlouhou dobu se chemici domnívali, že jakákoliv chem.
OBECNÁ CHEMIE František Zachoval CHEMICKÉ ROVNOVÁHY 1. Rovnovážný stav, rovnovážná konstanta a její odvození Dlouhou dobu se chemici domnívali, že jakákoliv chem.
Jana Fauknerová Matějčková
 Jana Fauknerová Matějčková kyselina (HA) acidóza (acidémie) báze (B ) alkalóza (alkalémie) pufr ph = pk + log cs / ca koncentrace [H + ] v krvi udržována pomocí plic, ledvin a jater okolo 40 nm ph = log
Jana Fauknerová Matějčková kyselina (HA) acidóza (acidémie) báze (B ) alkalóza (alkalémie) pufr ph = pk + log cs / ca koncentrace [H + ] v krvi udržována pomocí plic, ledvin a jater okolo 40 nm ph = log
tělní buňky tělní tekutiny krev erythrocyty 7.28 thrombocyty 7.0 žaludeční šťáva buňky kosterního svalstva duodenální šťáva
 Acidobazická rovnováha homeostasa H + iontů Regulace vnitřního prostředí Udržování osmotické koncetrace solí, minerálů, eáů, Vztahy acidobazické rovnováhy Stálost = acidobazická rovnováha (stav) Regulace
Acidobazická rovnováha homeostasa H + iontů Regulace vnitřního prostředí Udržování osmotické koncetrace solí, minerálů, eáů, Vztahy acidobazické rovnováhy Stálost = acidobazická rovnováha (stav) Regulace
Soli. ph roztoků solí - hydrolýza
 Soli Soli jsou iontové sloučeniny vzniklé neutralizační reakcí. Např. NaCl je sůl vzniklá reakcí kyseliny HCl a zásady NaOH. Př.: Napište neutralizační reakce jejichž produktem jsou CH 3 COONa, NaCN, NH
Soli Soli jsou iontové sloučeniny vzniklé neutralizační reakcí. Např. NaCl je sůl vzniklá reakcí kyseliny HCl a zásady NaOH. Př.: Napište neutralizační reakce jejichž produktem jsou CH 3 COONa, NaCN, NH
Výpočty koncentrací. objemová % (objemový zlomek) krvi m. Vsložky. celku. Objemy nejsou aditivní!!!
 Výpočty koncentrací objemová % (objemový zlomek) Vsložky % obj. = 100 V celku Objemy nejsou aditivní!!! Příklad: Kolik ethanolu je v 700 ml vodky (40 % obj.)? Kolik promile ethanolu v krvi bude mít muž
Výpočty koncentrací objemová % (objemový zlomek) Vsložky % obj. = 100 V celku Objemy nejsou aditivní!!! Příklad: Kolik ethanolu je v 700 ml vodky (40 % obj.)? Kolik promile ethanolu v krvi bude mít muž
ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY
 ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY Klíčová slova: relativní atomová hmotnost (A r ), relativní molekulová hmotnost (M r ), Avogadrova konstanta (N A ), látkové množství (n, mol), molární hmotnost (M, g/mol),
ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY Klíčová slova: relativní atomová hmotnost (A r ), relativní molekulová hmotnost (M r ), Avogadrova konstanta (N A ), látkové množství (n, mol), molární hmotnost (M, g/mol),
Mendelova zemědělská a lesnická univerzita v Brně Agronomická fakulta Ústav morfologie, fyziologie a genetiky zvířat
 Mendelova zemědělská a lesnická univerzita v Brně Agronomická fakulta Ústav morfologie, fyziologie a genetiky zvířat Ukazatele acidobazické rovnováhy krve jalovic v průběhu výkrmu Bakalářská práce Vedoucí
Mendelova zemědělská a lesnická univerzita v Brně Agronomická fakulta Ústav morfologie, fyziologie a genetiky zvířat Ukazatele acidobazické rovnováhy krve jalovic v průběhu výkrmu Bakalářská práce Vedoucí
Acidobazická rovnováha (ABR)
 Acidobazická rovnováha (ABR) Definice ph ph = log c(h + ) ph = 7,4 c(h + ) = 40 nm (H + ) = ph kyselina látka odštěpující H + (Arrhenius) nebo donor H + (Brönsted) zásada látka odštěpující OH (Arrhenius)
Acidobazická rovnováha (ABR) Definice ph ph = log c(h + ) ph = 7,4 c(h + ) = 40 nm (H + ) = ph kyselina látka odštěpující H + (Arrhenius) nebo donor H + (Brönsted) zásada látka odštěpující OH (Arrhenius)
) se ve vodě ihned rozpouští za tvorby amonných solí (iontová, disociovaná forma NH 4+ ). Vzájemný poměr obou forem závisí na ph a teplotě.
 Amoniakální dusík Amoniakální dusík se vyskytuje téměř ve všech typech vod. Je primárním produktem rozkladu organických dusíkatých látek živočišného i rostlinného původu. Organického původu je rovněž ve
Amoniakální dusík Amoniakální dusík se vyskytuje téměř ve všech typech vod. Je primárním produktem rozkladu organických dusíkatých látek živočišného i rostlinného původu. Organického původu je rovněž ve
Acidobazická rovnováha H+ a ph Vodíkový iont se skládá z protonu, kolem něhož neobíhá žádný elektron. Proto je vodíkový iont velmi malý a je
 Acidobazická rovnováha 14.4.2004 H+ a ph Vodíkový iont se skládá z protonu, kolem něhož neobíhá žádný elektron. Proto je vodíkový iont velmi malý a je extrémně reaktivní. Má proto velmi hluboký vliv na
Acidobazická rovnováha 14.4.2004 H+ a ph Vodíkový iont se skládá z protonu, kolem něhož neobíhá žádný elektron. Proto je vodíkový iont velmi malý a je extrémně reaktivní. Má proto velmi hluboký vliv na
Hlavní ukazatele acidobazické rovnováhy
 Hlavní ukazatele acidobazické rovnováhy Pro vyšetření parametrů acidobazické rovnováhy (ABR) se odebírá krev arteriální nebo arterilizovaná. Arteriální krev se odebírá z artérií do heparinizovaných zkumavek
Hlavní ukazatele acidobazické rovnováhy Pro vyšetření parametrů acidobazické rovnováhy (ABR) se odebírá krev arteriální nebo arterilizovaná. Arteriální krev se odebírá z artérií do heparinizovaných zkumavek
3 Acidobazické reakce
 3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
Klinická fyziologie ABR sekce Základy oboru edukační lekce. Michal Horáček KARIM 2. LF UK a FN v Motole Praha
 Klinická fyziologie ABR sekce Základy oboru edukační lekce Michal Horáček KARIM 2. LF UK a FN v Motole Praha Hlavní ukazatel ABR: ph (resp. a[h + ]) ph = pondus hydrogenii, potential of hydrogen = vodíkový
Klinická fyziologie ABR sekce Základy oboru edukační lekce Michal Horáček KARIM 2. LF UK a FN v Motole Praha Hlavní ukazatel ABR: ph (resp. a[h + ]) ph = pondus hydrogenii, potential of hydrogen = vodíkový
VNITŘNÍ PROSTŘEDÍ. Biochemický ústav LF MU (V.P.) 2007
 1 VNITŘNÍ PROSTŘEDÍ Biochemický ústav LF MU (V.P.) 2007 2 Vnitřní prostředí: Claude Bernard, 1878: Co je vnitřní prostředí? Je to krev, ve skutečnosti však nikoliv celá, nýbrž tekutá část krve, krevní
1 VNITŘNÍ PROSTŘEDÍ Biochemický ústav LF MU (V.P.) 2007 2 Vnitřní prostředí: Claude Bernard, 1878: Co je vnitřní prostředí? Je to krev, ve skutečnosti však nikoliv celá, nýbrž tekutá část krve, krevní
Acidobazická rovnováha pro pokročilé. František Duška KAR FNKV
 Acidobazická rovnováha pro pokročilé František Duška KAR FNKV Republika nepotřebuje chemiky! Roberspierre při vynášení rozsudku trestu smrti nad Lavoisierem 8. května 1794 28 letý muž, alkoholik. Přichází
Acidobazická rovnováha pro pokročilé František Duška KAR FNKV Republika nepotřebuje chemiky! Roberspierre při vynášení rozsudku trestu smrti nad Lavoisierem 8. května 1794 28 letý muž, alkoholik. Přichází
Poruchy vnitřního prostředí. v intenzivní medicíně
 Poruchy vnitřního prostředí v intenzivní medicíně Vnitřní prostředí = extracelulární tekutina (plazma, intersticiální tekutina) Poruchy objemu a osmolality Poruchy iontů (Na, K, Ca, Mg, Cl) Poruchy acidobazické
Poruchy vnitřního prostředí v intenzivní medicíně Vnitřní prostředí = extracelulární tekutina (plazma, intersticiální tekutina) Poruchy objemu a osmolality Poruchy iontů (Na, K, Ca, Mg, Cl) Poruchy acidobazické
NÁVOD K POUŽITÍ VÁPNÍK 600 KATALOGOVÉ ČÍSLO 207
 NÁVOD K POUŽITÍ VÁPNÍK 600 KATALOGOVÉ ČÍSLO 207 POUŽITÍ Souprava Vápník 600 se používá ke kvantitativnímu stanovení koncentrace vápenatých iontů v séru a moči. SOUHRN V lidském organismu je vázána převážná
NÁVOD K POUŽITÍ VÁPNÍK 600 KATALOGOVÉ ČÍSLO 207 POUŽITÍ Souprava Vápník 600 se používá ke kvantitativnímu stanovení koncentrace vápenatých iontů v séru a moči. SOUHRN V lidském organismu je vázána převážná
Chemické výpočty II. Vladimíra Kvasnicová
 Chemické výpočty II Vladimíra Kvasnicová Převod jednotek pmol/l nmol/l µmol/l mmol/l mol/l 10-12 10-9 10-6 10-3 mol/l µg mg g 10-6 10-3 g µl ml dl L 10-6 10-3 10-1 L Cvičení 12) cholesterol (MW=386,7g/mol):
Chemické výpočty II Vladimíra Kvasnicová Převod jednotek pmol/l nmol/l µmol/l mmol/l mol/l 10-12 10-9 10-6 10-3 mol/l µg mg g 10-6 10-3 g µl ml dl L 10-6 10-3 10-1 L Cvičení 12) cholesterol (MW=386,7g/mol):
Acidobazická rovnováha
 Acidobazická rovnováha... přístupy Motol, 2019-04-16 Jak to vypadá v realitě? pouze arteriální odběry 15 000 nálezů ABL 800 Radiometer BEECT ABIC APH ACO2 7,8 18 7,6 7,4 7,2 16 14 12 10 7,0 8 6,8 6,6 6,4
Acidobazická rovnováha... přístupy Motol, 2019-04-16 Jak to vypadá v realitě? pouze arteriální odběry 15 000 nálezů ABL 800 Radiometer BEECT ABIC APH ACO2 7,8 18 7,6 7,4 7,2 16 14 12 10 7,0 8 6,8 6,6 6,4
rovnováha mezi acidifikujícími a alkalizujícími vlivy
 AB balance; úvod do patofy- siologických aspektů AB balance; introduction into pathophysiological aspects Prof. Dr. V. Pelouch, CSc. Co je acidobazická rovnováha? rovnováha mezi acidifikujícími a alkalizujícími
AB balance; úvod do patofy- siologických aspektů AB balance; introduction into pathophysiological aspects Prof. Dr. V. Pelouch, CSc. Co je acidobazická rovnováha? rovnováha mezi acidifikujícími a alkalizujícími
Faktory ovlivňující úspěšnost embryologické laboratoře
 Faktory ovlivňující úspěšnost embryologické laboratoře P. Trávník Sanatorium REPROMEDA s.r.o. 1 Úspěšnost AR ovlivňuje řada faktorů, něco jsme věděli, některé jsme poznali v průběhu let 1990 Sanatorium
Faktory ovlivňující úspěšnost embryologické laboratoře P. Trávník Sanatorium REPROMEDA s.r.o. 1 Úspěšnost AR ovlivňuje řada faktorů, něco jsme věděli, některé jsme poznali v průběhu let 1990 Sanatorium
2 Roztoky elektrolytů. Osmotický tlak
 Roztoky elektrolytů. Osmotický tlak 1. Doplněním uvedených schémat vyjádřete rozdílné chování různých typů látek po jejich rozpuštění ve vodě. Použijte symboly AB(aq), A + (aq), B - (aq). [s pevná fáze,
Roztoky elektrolytů. Osmotický tlak 1. Doplněním uvedených schémat vyjádřete rozdílné chování různých typů látek po jejich rozpuštění ve vodě. Použijte symboly AB(aq), A + (aq), B - (aq). [s pevná fáze,
3 Acidobazické reakce
 3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
Vliv infuzních roztoků na acidobazickou rovnováhu. Antonín Jabor IKEM Praha
 Vliv infuzních roztoků na acidobazickou rovnováhu Antonín Jabor IKEM Praha Fyziologický roztok Fyziologický roztok Incidence hyperchloridemie na konci operace je častá, je spojena s metabolickou acidózou,
Vliv infuzních roztoků na acidobazickou rovnováhu Antonín Jabor IKEM Praha Fyziologický roztok Fyziologický roztok Incidence hyperchloridemie na konci operace je častá, je spojena s metabolickou acidózou,
Jana Fauknerová Matějčková
 Jana Fauknerová Matějčková převody jednotek výpočet ph ph vodných roztoků ph silných kyselin a zásad ph slabých kyselin a zásad, disociační konstanta, pk ph pufrů koncentace 1000mg př. g/dl mg/l = = *10000
Jana Fauknerová Matějčková převody jednotek výpočet ph ph vodných roztoků ph silných kyselin a zásad ph slabých kyselin a zásad, disociační konstanta, pk ph pufrů koncentace 1000mg př. g/dl mg/l = = *10000
Acido-bázická rovnováha (ABR)
 1 Acido-bázická rovnováha (ABR) Vladimír Kollárik II. klinika anestéziológie a intenzívnej medicíny Fakultná nemocnica s poliklinikou F. D. Roosevelta Banská Bystrica CEEA 2017 Košice, 2 3 Prečo je dôležitý
1 Acido-bázická rovnováha (ABR) Vladimír Kollárik II. klinika anestéziológie a intenzívnej medicíny Fakultná nemocnica s poliklinikou F. D. Roosevelta Banská Bystrica CEEA 2017 Košice, 2 3 Prečo je dôležitý
Vybrané klinicko-biochemické hodnoty
 Vybrané klinicko-biochemické hodnoty Obecným výsledkem laboratorního vyšetření je naměřená hodnota, která může být fyziologická, zvýšená či snížená. Abychom zjištěnou hodnotu mohli takto zařadit, je třeba
Vybrané klinicko-biochemické hodnoty Obecným výsledkem laboratorního vyšetření je naměřená hodnota, která může být fyziologická, zvýšená či snížená. Abychom zjištěnou hodnotu mohli takto zařadit, je třeba
Úprava podzemních vod
 Úprava podzemních vod 1 Způsoby úpravy podzemních vod Neutralizace = odkyselování = stabilizace vody odstranění CO 2 a úprava vody do vápenato-uhličitanové rovnováhy Odstranění plynných složek z vody (Rn,
Úprava podzemních vod 1 Způsoby úpravy podzemních vod Neutralizace = odkyselování = stabilizace vody odstranění CO 2 a úprava vody do vápenato-uhličitanové rovnováhy Odstranění plynných složek z vody (Rn,
Potenciometrické stanovení disociační konstanty
 Potenciometrické stanovení disociační konstanty TEORIE Elektrolytická disociace kyseliny HA ve vodě vede k ustavení disociační rovnováhy: HA + H 2O A - + H 3O +, kterou lze charakterizovat disociační konstantou
Potenciometrické stanovení disociační konstanty TEORIE Elektrolytická disociace kyseliny HA ve vodě vede k ustavení disociační rovnováhy: HA + H 2O A - + H 3O +, kterou lze charakterizovat disociační konstantou
Analyzátory OPTI firmy ROCHE
 Analyzátory OPTI firmy ROCHE - øešení kritických situací Prof. MUDr. Jaroslav Racek, DrSc., MUDr. Vlasta Petøíková, Zuzana Pešková Ústav klinické biochemie a laboratorní diagnostiky Lékaøské fakulty UK
Analyzátory OPTI firmy ROCHE - øešení kritických situací Prof. MUDr. Jaroslav Racek, DrSc., MUDr. Vlasta Petøíková, Zuzana Pešková Ústav klinické biochemie a laboratorní diagnostiky Lékaøské fakulty UK
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls43951/2010
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls43951/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hydrogenuhličitan sodný 4,2% (w/v) - BRAUN infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls43951/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hydrogenuhličitan sodný 4,2% (w/v) - BRAUN infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ
Existují ideální iontové roztoky pro pacienty se SBS? Michal Žourek DPV Praha
 Existují ideální iontové roztoky pro pacienty se SBS? Michal Žourek DPV Praha 16.11.2007 Osnova Vstřebávání základních látek z GIT Hodnocení ABR Hodnocení změn: Na, K, Cl, Ca, P, Mg SBS a funkční změny
Existují ideální iontové roztoky pro pacienty se SBS? Michal Žourek DPV Praha 16.11.2007 Osnova Vstřebávání základních látek z GIT Hodnocení ABR Hodnocení změn: Na, K, Cl, Ca, P, Mg SBS a funkční změny
Diagnostika poruch acidobazické rovnováhy
 Návod do cvičení Diagnostika poruch acidobazické rovnováhy Úvod Stálost tzv. vnitřního prostředí je nezbytnou podmínkou života vyšších organismů. Důležitá je zejména hodnota ph. Na hodnotě ph závisí mimo
Návod do cvičení Diagnostika poruch acidobazické rovnováhy Úvod Stálost tzv. vnitřního prostředí je nezbytnou podmínkou života vyšších organismů. Důležitá je zejména hodnota ph. Na hodnotě ph závisí mimo
DIAGNÓZA JEDNODUCHÝCH A SMÍŠ ÍŠENÝCH PORUCH ACIDOBAZICKÉ ROVNOVÁHY. A. Kazda. Katedra klinické biochemie, IPVZ Praha UKBLD 1.
 DIAGNÓZA JEDNODUCHÝCH A SMÍŠ ÍŠENÝCH PORUCH ACIDOBAZICKÉ ROVNOVÁHY A. Kazda Katedra klinické biochemie, IPVZ Praha UKBLD 1. LF UK a VFN Záznamový list acidobazické regulace Graf acidobazické regulace (M.
DIAGNÓZA JEDNODUCHÝCH A SMÍŠ ÍŠENÝCH PORUCH ACIDOBAZICKÉ ROVNOVÁHY A. Kazda Katedra klinické biochemie, IPVZ Praha UKBLD 1. LF UK a VFN Záznamový list acidobazické regulace Graf acidobazické regulace (M.
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939. Název projektu: Investice do vzdělání - příslib do budoucnosti
 Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
Klasické nebo Stewartovo hodnocení poruch ABR?
 Klasické nebo Stewartovo hodnocení poruch ABR? Neboli naše mezery v acidobazi M. Kratochvíl, KARIM FN Brno Definice ph: záporný dekadický logaritmus koncentrace oxoniových iontů (40 nmol/l) Kyselina: donor
Klasické nebo Stewartovo hodnocení poruch ABR? Neboli naše mezery v acidobazi M. Kratochvíl, KARIM FN Brno Definice ph: záporný dekadický logaritmus koncentrace oxoniových iontů (40 nmol/l) Kyselina: donor
3 Acidobazické reakce
 3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
Disperzní soustavy a jejich vlastnosti
 Disperzní soustavy a jejich vlastnosti Disperzní soustavy Dispergované ástice Disperzní prost edí Typy disperzních soustav Disperzní prost edí Tuhé Disperg. ástice Tuhé Kapalné Plynné Název soustavy Slitiny,
Disperzní soustavy a jejich vlastnosti Disperzní soustavy Dispergované ástice Disperzní prost edí Typy disperzních soustav Disperzní prost edí Tuhé Disperg. ástice Tuhé Kapalné Plynné Název soustavy Slitiny,
Diagnostika a léčba poruch acidobazické rovnováhy. J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická
 Diagnostika a léčba poruch acidobazické rovnováhy J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická ph alkalita/acidita vnitřního prostředí 7,4 ± 0,04 mmol/l pco 2 respirační
Diagnostika a léčba poruch acidobazické rovnováhy J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická ph alkalita/acidita vnitřního prostředí 7,4 ± 0,04 mmol/l pco 2 respirační
DOPLŇKOVÝ STUDIJNÍ MATERIÁL CHEMICKÉ VÝPOČTY. Zuzana Špalková. Věra Vyskočilová
 DOPLŇKOVÝ STUDIJNÍ MATERIÁL CHEMICKÉ VÝPOČTY Zuzana Špalková Věra Vyskočilová BRNO 2014 Doplňkový studijní materiál zaměřený na Chemické výpočty byl vytvořen v rámci projektu Interní vzdělávací agentury
DOPLŇKOVÝ STUDIJNÍ MATERIÁL CHEMICKÉ VÝPOČTY Zuzana Špalková Věra Vyskočilová BRNO 2014 Doplňkový studijní materiál zaměřený na Chemické výpočty byl vytvořen v rámci projektu Interní vzdělávací agentury
VY_32_INOVACE_06A_07 Teorie kyselina zásad ANOTACE
 ŠKOLA: AUTOR: NÁZEV: TEMA: ČÍSLO PROJEKTU: Gymnázium Chomutov, Mostecká 3000, příspěvková organizace Mgr. Monika ŠLÉGLOVÁ VY_32_INOVACE_06A_07 Teorie kyselina zásad NEKOVY CZ.1.07/1.5.00/34.0816 DATUM
ŠKOLA: AUTOR: NÁZEV: TEMA: ČÍSLO PROJEKTU: Gymnázium Chomutov, Mostecká 3000, příspěvková organizace Mgr. Monika ŠLÉGLOVÁ VY_32_INOVACE_06A_07 Teorie kyselina zásad NEKOVY CZ.1.07/1.5.00/34.0816 DATUM
Vzdělávací oblast: Člověk a příroda Vzdělávací obor (předmět): Chemie - ročník: PRIMA
 Směsi Látky a jejich vlastnosti Předmět a význam chemie Vzdělávací oblast: Člověk a příroda Vzdělávací obor (předmět): Chemie - ročník: PRIMA Téma Učivo Výstupy Kódy Dle RVP Školní (ročníkové) PT K Předmět
Směsi Látky a jejich vlastnosti Předmět a význam chemie Vzdělávací oblast: Člověk a příroda Vzdělávací obor (předmět): Chemie - ročník: PRIMA Téma Učivo Výstupy Kódy Dle RVP Školní (ročníkové) PT K Předmět
Pro zředěné roztoky za konstantní teploty T je osmotický tlak úměrný molární koncentraci
 TRANSPORTNÍ MECHANISMY Transport látek z vnějšího prostředí do buňky a naopak se může uskutečňovat dvěma cestami - aktivním a pasivním transportem. Pasivním transportem rozumíme přenos látek ve směru energetického
TRANSPORTNÍ MECHANISMY Transport látek z vnějšího prostředí do buňky a naopak se může uskutečňovat dvěma cestami - aktivním a pasivním transportem. Pasivním transportem rozumíme přenos látek ve směru energetického
3. STRUKTURA EKOSYSTÉMU
 3. STRUKTURA EKOSYSTÉMU 3.4 VODA 3.4.1. VLASTNOSTI VODY VODA Voda dva významy: - chemická sloučenina 2 O - přírodní roztok plynné kapalné pevné Skupenství Voda jako chemická sloučenina 1 δ+ Základní fyzikální
3. STRUKTURA EKOSYSTÉMU 3.4 VODA 3.4.1. VLASTNOSTI VODY VODA Voda dva významy: - chemická sloučenina 2 O - přírodní roztok plynné kapalné pevné Skupenství Voda jako chemická sloučenina 1 δ+ Základní fyzikální
Biochemický ústav LF MU (E.T.) 2013
 Roztoky elektrolytů: ph, hydrolýza solí, pufry Biochemický ústav LF MU (E.T.) 2013 1 Pojmy, jejichž znalost ze střední školy je nezbytná pro porozumění přednášené látce : elektrolyty, jejich chování, typy
Roztoky elektrolytů: ph, hydrolýza solí, pufry Biochemický ústav LF MU (E.T.) 2013 1 Pojmy, jejichž znalost ze střední školy je nezbytná pro porozumění přednášené látce : elektrolyty, jejich chování, typy
KOMPLEXOMETRIE C C H 2
 Úloha č. 11 KOMPLEXOMETRIE Princip Při komplexotvorných reakcích vznikají komplexy sloučeniny, v nichž se k centrálnímu atomu nebo iontu vážou ligandy donor-akceptorovou (koordinační) vazbou. entrální
Úloha č. 11 KOMPLEXOMETRIE Princip Při komplexotvorných reakcích vznikají komplexy sloučeniny, v nichž se k centrálnímu atomu nebo iontu vážou ligandy donor-akceptorovou (koordinační) vazbou. entrální
BILANČNÍ PŘÍSTUP K MODELOVÁNÍ ACIDOBAZICKÉ ROVNOVÁHY A PŘENOSU KREVNÍCH PLYNŮ
 BILANČNÍ PŘÍSTUP K MODELOVÁNÍ ACIDOBAZICKÉ ROVNOVÁHY A PŘENOSU KREVNÍCH PLYNŮ Jiří Kofránek, Michal Andrlík, Stanislav Matoušek Anotace Navazujeme na popis našeho přístupu k modelování acidobazické rovnováhy
BILANČNÍ PŘÍSTUP K MODELOVÁNÍ ACIDOBAZICKÉ ROVNOVÁHY A PŘENOSU KREVNÍCH PLYNŮ Jiří Kofránek, Michal Andrlík, Stanislav Matoušek Anotace Navazujeme na popis našeho přístupu k modelování acidobazické rovnováhy
Ch - Stavba atomu, chemická vazba
 Ch - Stavba atomu, chemická vazba Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl
Ch - Stavba atomu, chemická vazba Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl
 Renální tubulární acidózy Akutní selhání ledvin Prerenální syndrom je dán schopností ledvin udržet v organismu sůl a vodu tváří v tvář zaznamenané hypoperfúzi ledvin. Při obnovení renální hemodynamiky
Renální tubulární acidózy Akutní selhání ledvin Prerenální syndrom je dán schopností ledvin udržet v organismu sůl a vodu tváří v tvář zaznamenané hypoperfúzi ledvin. Při obnovení renální hemodynamiky
Pavel Suk ARK, FN u svatéanny v Brně
 Pavel Suk ARK, FN u svatéanny v Brně anamnéza, klinika jaká porucha ABR je nejpravděpodobnější? vyvolávající porucha? jiné příčiny? smíšené poruchy ABR kompenzace? je adekvátní? klinická významnost? dynamika?
Pavel Suk ARK, FN u svatéanny v Brně anamnéza, klinika jaká porucha ABR je nejpravděpodobnější? vyvolávající porucha? jiné příčiny? smíšené poruchy ABR kompenzace? je adekvátní? klinická významnost? dynamika?
TEORETICKÁ ČÁST (70 BODŮ)
 Řešení okresního kola ChO kat. D 0/03 TEORETICKÁ ČÁST (70 BODŮ) Úloha 3 bodů. Ca + H O Ca(OH) + H. Ca(OH) + CO CaCO 3 + H O 3. CaCO 3 + H O + CO Ca(HCO 3 ) 4. C + O CO 5. CO + O CO 6. CO + H O HCO 3 +
Řešení okresního kola ChO kat. D 0/03 TEORETICKÁ ČÁST (70 BODŮ) Úloha 3 bodů. Ca + H O Ca(OH) + H. Ca(OH) + CO CaCO 3 + H O 3. CaCO 3 + H O + CO Ca(HCO 3 ) 4. C + O CO 5. CO + O CO 6. CO + H O HCO 3 +
Roztoky - elektrolyty
 Roztoky - elektrolyty Roztoky - vodné roztoky prakticky vždy vedou elektrický proud Elektrolyty látky, které se štěpí disociují na elektricky nabité částice ionty Původně se předpokládalo, že k disociaci
Roztoky - elektrolyty Roztoky - vodné roztoky prakticky vždy vedou elektrický proud Elektrolyty látky, které se štěpí disociují na elektricky nabité částice ionty Původně se předpokládalo, že k disociaci
1 DATA: CHYBY, VARIABILITA A NEJISTOTY INSTRUMENTÁLNÍCH MĚŘENÍ. 1.5 Úlohy. 1.5.1 Analýza farmakologických a biochemických dat
 1 DATA: CHYBY, VARIABILITA A NEJISTOTY INSTRUMENTÁLNÍCH MĚŘENÍ 1.5 Úlohy Úlohy jsou rozděleny do čtyř kapitol: B1 (farmakologická a biochemická data), C1 (chemická a fyzikální data), E1 (environmentální,
1 DATA: CHYBY, VARIABILITA A NEJISTOTY INSTRUMENTÁLNÍCH MĚŘENÍ 1.5 Úlohy Úlohy jsou rozděleny do čtyř kapitol: B1 (farmakologická a biochemická data), C1 (chemická a fyzikální data), E1 (environmentální,
Potenciometrie. Obr.1 Schema základního uspořádání elektrochemické cely pro potenciometrická měření
 Potenciometrie 1.Definice Rovnovážná potenciometrie je analytickou metodou, při níž se analyt stanovuje ze změřeného napětí elektrochemického článku, tvořeného indikační elektrodou ponořenou do analyzovaného
Potenciometrie 1.Definice Rovnovážná potenciometrie je analytickou metodou, při níž se analyt stanovuje ze změřeného napětí elektrochemického článku, tvořeného indikační elektrodou ponořenou do analyzovaného
TVRDOST, VODIVOST A ph MINERÁLNÍ VODY
 TRDOST, ODIOST A ph MINERÁLNÍ ODY A) STANOENÍ TRDOSTI MINERÁLNÍCH OD Prinip: Tvrdost, resp. elková tvrdost vody, je způsobena obsahem solí alkalikýh zemin vápník, hořčík, stronium a barium. Stronium a
TRDOST, ODIOST A ph MINERÁLNÍ ODY A) STANOENÍ TRDOSTI MINERÁLNÍCH OD Prinip: Tvrdost, resp. elková tvrdost vody, je způsobena obsahem solí alkalikýh zemin vápník, hořčík, stronium a barium. Stronium a
Toxické metabolity glykolaldehyd, kys. glykolová, kys. glyoxylová, kys. štavelová
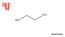 Marek Protuš C 2 H 6 O 2 Alkohol 1,2-ethandiol bezbarvá viskózní tekutina nasládlé chuti netoxický Molární hmotnost 62,068 g/mol Teplota tání 12,9 C Teplota varu 197,3 C Hustota 1,113 g/cm 3 Rozpustnost
Marek Protuš C 2 H 6 O 2 Alkohol 1,2-ethandiol bezbarvá viskózní tekutina nasládlé chuti netoxický Molární hmotnost 62,068 g/mol Teplota tání 12,9 C Teplota varu 197,3 C Hustota 1,113 g/cm 3 Rozpustnost
Základy pedologie a ochrana půdy
 Základy pedologie a ochrana půdy 6. přednáška VZDUCH V PŮDĚ = plynná fáze půdy Význam (a faktory jeho složení): dýchání organismů výměna plynů mezi půdou a atmosférou průběh reakcí v půdě Formy: volně
Základy pedologie a ochrana půdy 6. přednáška VZDUCH V PŮDĚ = plynná fáze půdy Význam (a faktory jeho složení): dýchání organismů výměna plynů mezi půdou a atmosférou průběh reakcí v půdě Formy: volně
Elektrochemie. 2. Elektrodový potenciál
 Elektrochemie 1. Poločlánky Ponoříme-li kov do roztoku jeho solí mohou nastav dva různé děje: a. Do roztoku se z kovu uvolňují kationty (obr. a), na elektrodě vzniká převaha elektronů. Elektroda se tedy
Elektrochemie 1. Poločlánky Ponoříme-li kov do roztoku jeho solí mohou nastav dva různé děje: a. Do roztoku se z kovu uvolňují kationty (obr. a), na elektrodě vzniká převaha elektronů. Elektroda se tedy
CELKOVÝ AKTIVNÍ CHLOR - VÝZNAM A INTERPRETACE
 Citace Kollerová L., Smrčková Š.: Celkový aktivní chlor význam a interpretace. Sborník konference Pitná voda 2008, s. 171-176. W&ET Team, Č. Budějovice 2008. ISBN 978-80-254-2034-8 CELKOVÝ AKTIVNÍ CHLOR
Citace Kollerová L., Smrčková Š.: Celkový aktivní chlor význam a interpretace. Sborník konference Pitná voda 2008, s. 171-176. W&ET Team, Č. Budějovice 2008. ISBN 978-80-254-2034-8 CELKOVÝ AKTIVNÍ CHLOR
Biogeochemické cykly vybraných chemických prvků
 Biogeochemické cykly vybraných chemických prvků Uhlík důležitý biogenní prvek cyklus C jedním z nejdůležitějších látkových toků v biosféře poměr mezi CO 2 a C org - vliv na oxidačně redukční potenciál
Biogeochemické cykly vybraných chemických prvků Uhlík důležitý biogenní prvek cyklus C jedním z nejdůležitějších látkových toků v biosféře poměr mezi CO 2 a C org - vliv na oxidačně redukční potenciál
KREVNÍ ELEMENTY, PLAZMA. Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje
 KREVNÍ ELEMENTY, PLAZMA Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Leden 2010 Mgr. Jitka Fuchsová KREV Červená, neprůhledná, vazká tekutina Skládá
KREVNÍ ELEMENTY, PLAZMA Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Leden 2010 Mgr. Jitka Fuchsová KREV Červená, neprůhledná, vazká tekutina Skládá
ZÁKLADNÍ ANALYTICKÉ METODY Vážková analýza, gravimetrie. Jana Sobotníková VÁŽKOVÁ ANALÝZA, GRAVIMETRIE
 Jana Sobotníková ZÁKLADÍ AALYTIKÉ METODY Vážková analýza, gravimetrie ke stažení v SIS nebo Moodle www.natur.cuni.cz/~suchan suchan@natur.cuni.cz jana.sobotnikova@natur.cuni.cz telefon: 221 951 230 katedra
Jana Sobotníková ZÁKLADÍ AALYTIKÉ METODY Vážková analýza, gravimetrie ke stažení v SIS nebo Moodle www.natur.cuni.cz/~suchan suchan@natur.cuni.cz jana.sobotnikova@natur.cuni.cz telefon: 221 951 230 katedra
Struktura. Velikost ionexových perliček Katex. Iontová výměna. Ionex (ion exchanger) Iontoměnič Měnič iontů. Katex (cation exchanger) Měnič kationtů
 Ionex (ion exchanger) Iontoměnič Měnič iontů gelová Struktura makroporézní Katex (cation exchanger) Měnič kationtů Anex (anion exchanger) Měnič aniontů Velikost ionexových perliček Katex Silně kyselý katex
Ionex (ion exchanger) Iontoměnič Měnič iontů gelová Struktura makroporézní Katex (cation exchanger) Měnič kationtů Anex (anion exchanger) Měnič aniontů Velikost ionexových perliček Katex Silně kyselý katex
Galvanický článek. Li Rb K Na Be Sr Ca Mg Al Be Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi As CU Hg Ag Pt Au
 Řada elektrochemických potenciálů (Beketova řada) v níž je napětí mezi dvojicí kovů tím větší, čím větší je jejich vzdálenost v této řadě. Prvek více vlevo vytěsní z roztoku kov nacházející se vpravo od
Řada elektrochemických potenciálů (Beketova řada) v níž je napětí mezi dvojicí kovů tím větší, čím větší je jejich vzdálenost v této řadě. Prvek více vlevo vytěsní z roztoku kov nacházející se vpravo od
Diagnostika a léčba poruch acidobazické rovnováhy. J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická
 Diagnostika a léčba poruch acidobazické rovnováhy J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická ph alkalita/acidita vnitřního prostředí 7,4 ± 0,04 mmol/l pco 2 respirační
Diagnostika a léčba poruch acidobazické rovnováhy J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická ph alkalita/acidita vnitřního prostředí 7,4 ± 0,04 mmol/l pco 2 respirační
Název: Exotermický a endotermický děj
 Název: Exotermický a endotermický děj 1) Kypřící prášek, skořápka či zinek s octem? Pomůcky: ocet, zinek, kypřící prášek, led, sůl, hydroxid sodný, skořápka, chlorid vápenatý, chlorid sodný, 4 větší zkumavky,
Název: Exotermický a endotermický děj 1) Kypřící prášek, skořápka či zinek s octem? Pomůcky: ocet, zinek, kypřící prášek, led, sůl, hydroxid sodný, skořápka, chlorid vápenatý, chlorid sodný, 4 větší zkumavky,
Chemické výpočty. = 1,66057. 10-27 kg
 1. Relativní atomová hmotnost Chemické výpočty Hmotnost atomů je velice malá, řádově 10-27 kg, a proto by bylo značně nepraktické vyjadřovat ji v kg, či v jednontkách odvozených. Užitečnější je zvolit
1. Relativní atomová hmotnost Chemické výpočty Hmotnost atomů je velice malá, řádově 10-27 kg, a proto by bylo značně nepraktické vyjadřovat ji v kg, či v jednontkách odvozených. Užitečnější je zvolit
TERMODYNAMICKÁ ROVNOVÁHA, PASIVNÍ A AKTIVNÍ TRANSPORT
 TERMODYNAMICKÁ ROVNOVÁHA, PASIVNÍ A AKTIVNÍ TRANSPORT Termodynamická rovnováha systému je charakterizována absencí spontánních procesů. Poněvadž práce může být konána pouze systémem, který směřuje ke spontánní
TERMODYNAMICKÁ ROVNOVÁHA, PASIVNÍ A AKTIVNÍ TRANSPORT Termodynamická rovnováha systému je charakterizována absencí spontánních procesů. Poněvadž práce může být konána pouze systémem, který směřuje ke spontánní
LCH/PAK01. 5 hodin cvičení
 Studijní program : Porodní asistence bakalářské studium - kombinovaná forma Název předmětu : Klinická biochemie Rozvrhová zkratka : LCH/PAK01 Rozvrh výuky : 5 hodin přednášek 5 hodin cvičení Zařazení výuky
Studijní program : Porodní asistence bakalářské studium - kombinovaná forma Název předmětu : Klinická biochemie Rozvrhová zkratka : LCH/PAK01 Rozvrh výuky : 5 hodin přednášek 5 hodin cvičení Zařazení výuky
HYDROSFÉRA 0,6% 2,14% 97,2%
 HYDROSFÉRA 0,6% 2,14% 97,2% PODZEMNÍ VODA Fosilní voda Proudící voda evapotranspirace Celkový odtok Přímý odtok infitrace Základní odtok VODA OBNOVITELNÝ PŘÍRODNÍ ZDROJ Hydrologický cyklus Zdrojem energie
HYDROSFÉRA 0,6% 2,14% 97,2% PODZEMNÍ VODA Fosilní voda Proudící voda evapotranspirace Celkový odtok Přímý odtok infitrace Základní odtok VODA OBNOVITELNÝ PŘÍRODNÍ ZDROJ Hydrologický cyklus Zdrojem energie
Technologie pro úpravu bazénové vody
 Technologie pro úpravu GHC Invest, s.r.o. Korunovační 6 170 00 Praha 7 info@ghcinvest.cz Příměsi významné pro úpravu Anorganické látky přírodního původu - kationty kovů (Cu +/2+, Fe 2+/3+, Mn 2+, Ca 2+,
Technologie pro úpravu GHC Invest, s.r.o. Korunovační 6 170 00 Praha 7 info@ghcinvest.cz Příměsi významné pro úpravu Anorganické látky přírodního původu - kationty kovů (Cu +/2+, Fe 2+/3+, Mn 2+, Ca 2+,
Acidobazická rovnováha - jasně a jednoduše
 Acidobazická rovnováha - jasně a jednoduše Michal Horáček KARIM 2. LF UK v FNM Praha ph, resp. a[h + ] rovnice 4. řádu: 3 nezávisle proměnné, 5 rychlostních konstant po zjednodušení: Acidobazická rovnováha
Acidobazická rovnováha - jasně a jednoduše Michal Horáček KARIM 2. LF UK v FNM Praha ph, resp. a[h + ] rovnice 4. řádu: 3 nezávisle proměnné, 5 rychlostních konstant po zjednodušení: Acidobazická rovnováha
NÁVOD K POUŽITÍ HOŘČÍK 600 A KATALOGOVÉ ČÍSLO 104
 NÁVOD K POUŽITÍ HOŘČÍK 600 A KATALOGOVÉ ČÍSLO 104 POUŽITÍ Souprava Mg 600 A se používá ke kvantitativnímu stanovení koncentrace hořečnatých iontů v séru, v moči a v dalších biologických materiálech. SOUHRN
NÁVOD K POUŽITÍ HOŘČÍK 600 A KATALOGOVÉ ČÍSLO 104 POUŽITÍ Souprava Mg 600 A se používá ke kvantitativnímu stanovení koncentrace hořečnatých iontů v séru, v moči a v dalších biologických materiálech. SOUHRN
2. PROTOLYTICKÉ REAKCE
 2. PROTOLYTICKÉ REAKCE Protolytické reakce představují všechny reakce spojené s výměnou protonů a jsou označovány jako reakce acidobazické. Teorie Arrheniova (1884): kyseliny disociují ve vodě na vodíkový
2. PROTOLYTICKÉ REAKCE Protolytické reakce představují všechny reakce spojené s výměnou protonů a jsou označovány jako reakce acidobazické. Teorie Arrheniova (1884): kyseliny disociují ve vodě na vodíkový
Název: Vypracovala: Datum: 7. 2. 2014. Zuzana Lacková
 Název: Vypracovala: Zuzana Lacková Datum: 7. 2. 2014 Reg.č.projektu: CZ.1.07/2.4.00/31.0023 Název projektu: Partnerská síť centra excelentního bionanotechnologického výzkumu MĚLI BYCHOM ZNÁT: informace,
Název: Vypracovala: Zuzana Lacková Datum: 7. 2. 2014 Reg.č.projektu: CZ.1.07/2.4.00/31.0023 Název projektu: Partnerská síť centra excelentního bionanotechnologického výzkumu MĚLI BYCHOM ZNÁT: informace,
3. HYDROLOGICKÉ POMĚRY
 Tunel Umiray Macua, Filipíny hydrogeologický monitoring Jitka Novotná1, Pavel Blaha2, Roman Duras3 1 GEOtest, a.s., Brno, Šmahova 112 novotna@geotest.cz 2 GEOtest, a.s., Brno, Šmahova 112 blaha@geotest.cz
Tunel Umiray Macua, Filipíny hydrogeologický monitoring Jitka Novotná1, Pavel Blaha2, Roman Duras3 1 GEOtest, a.s., Brno, Šmahova 112 novotna@geotest.cz 2 GEOtest, a.s., Brno, Šmahova 112 blaha@geotest.cz
10 Acidobazické reakce
 10 cidobazické reakce cidobazické reakce probíhají v roztocích mezi kyselinami a zásadami a dochází při nich k výměně protonu. Pojem kyseliny a zásady Podle teorie Brønsteda a Lowryho jsou kyseliny látky,
10 cidobazické reakce cidobazické reakce probíhají v roztocích mezi kyselinami a zásadami a dochází při nich k výměně protonu. Pojem kyseliny a zásady Podle teorie Brønsteda a Lowryho jsou kyseliny látky,
Vzdělávací oblast: Člověk a příroda. Vyučovací předmět: Chemie. Třída: tercie. Očekávané výstupy. Poznámky. Přesahy. Žák: Průřezová témata
 Vzdělávací oblast: Člověk a příroda Vyučovací předmět: Chemie Třída: tercie Očekávané výstupy Uvede příklady chemického děje a čím se zabývá chemie Rozliší tělesa a látky Rozpozná na příkladech fyzikální
Vzdělávací oblast: Člověk a příroda Vyučovací předmět: Chemie Třída: tercie Očekávané výstupy Uvede příklady chemického děje a čím se zabývá chemie Rozliší tělesa a látky Rozpozná na příkladech fyzikální
ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA
 Ústřední komise Chemické olympiády 49. ročník 2012/2013 ŠKOLNÍ KOLO kategorie B ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA KONTROLNÍ TEST ŠKOLNÍHO KOLA (60 BODŮ) ANORGANICKÁ CHEMIE 30 BODŮ Úloha 1 Titrační
Ústřední komise Chemické olympiády 49. ročník 2012/2013 ŠKOLNÍ KOLO kategorie B ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA KONTROLNÍ TEST ŠKOLNÍHO KOLA (60 BODŮ) ANORGANICKÁ CHEMIE 30 BODŮ Úloha 1 Titrační
Teorie kyselin a zásad poznámky 5.A GVN
 Teorie kyselin a zásad poznámky 5A GVN 13 června 2007 Arrheniova teorie platná pouze pro vodní roztoky kyseliny jsou látky schopné ve vodném roztoku odštěpit vodíkový kation H + HCl H + + Cl - CH 3 COOH
Teorie kyselin a zásad poznámky 5A GVN 13 června 2007 Arrheniova teorie platná pouze pro vodní roztoky kyseliny jsou látky schopné ve vodném roztoku odštěpit vodíkový kation H + HCl H + + Cl - CH 3 COOH
Gymnázium Vysoké Mýto nám. Vaňorného 163, Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Teorie kyselin a zásad Arheniova teorie Kyseliny jsou látky schopné ve vodném prostředí odštěpovat iont H +I. Zásady jsou látky schopné ve
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Teorie kyselin a zásad Arheniova teorie Kyseliny jsou látky schopné ve vodném prostředí odštěpovat iont H +I. Zásady jsou látky schopné ve
CHEMICKÉ VÝPOČTY I. ČÁST LÁTKOVÉ MNOŽSTVÍ. HMOTNOSTI ATOMŮ A MOLEKUL.
 CHEMICKÉ VÝPOČTY I. ČÁST LÁTKOVÉ MNOŽSTVÍ. HMOTNOSTI ATOMŮ A MOLEKUL. Látkové množství Značka: n Jednotka: mol Definice: Jeden mol je množina, která má stejný počet prvků, jako je atomů ve 12 g nuklidu
CHEMICKÉ VÝPOČTY I. ČÁST LÁTKOVÉ MNOŽSTVÍ. HMOTNOSTI ATOMŮ A MOLEKUL. Látkové množství Značka: n Jednotka: mol Definice: Jeden mol je množina, která má stejný počet prvků, jako je atomů ve 12 g nuklidu
Anorganické látky v buňkách - seminář. Petr Tůma některé slidy převzaty od V. Kvasnicové
 Anorganické látky v buňkách - seminář Petr Tůma některé slidy převzaty od V. Kvasnicové Zastoupení prvků v přírodě anorganická hmota kyslík (O) 50% křemík (Si) 25% hliník (Al) 7% železo (Fe) 5% vápník
Anorganické látky v buňkách - seminář Petr Tůma některé slidy převzaty od V. Kvasnicové Zastoupení prvků v přírodě anorganická hmota kyslík (O) 50% křemík (Si) 25% hliník (Al) 7% železo (Fe) 5% vápník
