Acidobazická rovnováha a její vztahy k iontovému hospodářství. Klinické aplikace.
|
|
|
- Dagmar Valentová
- před 9 lety
- Počet zobrazení:
Transkript
1 Text použit s laskavým svolením autora. Acidobazická rovnováha a její vztahy k iontovému hospodářství. Klinické aplikace. Antonín Jabor Oddělení klinické biochemie Nemocnice Kladno Část 1. Relevantní parametry pro posouzení acidobazického stavu. Historický vývoj, obsolentní a racionální ukazatele Rozvoj měření a klinického využívání základních acidobazických parametrů je v Evropě spojen s epidemií poliomyelitidy v letech , úsilím profesora Poula Astrupa o klinickou aplikaci stanovení ph (a pco 2 ekvilibrací, poprvé prezentováno 1958) v krvi, vývojem elektrody pro přímé měření pco2 (Stow a Severinghaus, rovněž prezentováno 1958) a teoretickými pracemi Ole Siggaard-Andersena týkajících se base excess (poprvé 1960) jako deskriptoru metabolické komponenty acidobazického nálezu. Známý spojnicový nomogram Siggaard-Andersena pochází z roku 1963 a interpretační graf oblastí z roku Je nutné zmínit technický přínos kodaňské firmy Radiometer, zakladatelé firmy a jejich sourozenci se přímo podíleli na vývoji prvních aparátů. Evropa se rychle seznamovala s přístupy běžnými ve Spojených státech, kde byl koncept base excessu podroben kritice (velká transatlantická debata) a později zájem o acidobazickou problematiku probíhal ve vlnách většího a menšího zájmu, indukovanými hlavně technickými novinkami. V posledním desetiletí dvacátého století je technicky vyřešeno a prakticky využíváno společné stanovení acidobazických ukazatelů, parametrů oxygenace, iontového složení plazmy a vybraných metabolitů. Řada ukazatelů se díky historickým souvislostem definičně i interpretačně multiplikovala. Pokusíme se proto množinu používaných ukazatelů redukovat na parametry s nejvyšší klinickou vypovídací hodnotou. a. ph nebo aktivita (koncentrace) vodíkových iontů? Tradiční ukazatel ph představuje sumární parametr acidobazického stavu, výslednici všech acidifikujících a alkalizujících dějů, ať již jsou respiračního nebo metabolického původu. Hooper (Hooper, 1998?) však obhajuje používání aktivity (resp. koncentrace) H + jako vhodnějšího parametru.
2 Tabulka 1 Vztah mezi koncentrací H + a ph Koncentrace H + ph (nmol/l) 20 7, , , , , , ,10 Rovnoměrná dekadická stupnice u koncentrace H+ pravděpodobně lépe ukazuje tíži děje, na druhé straně je interpretace ph tak zakořeněna, že Hooperovo doporučení nelze aplikovat. Otázku tedy řešíme ve prospěch ph. b. HCO 3 - aktuální nebo HCO 3 - standardní? HCO 3 - aktuální je funkcí ph a p a CO 2 a získává se výpočtem z Hendersonovy Hasselbalchovy rovnice. Je součástí sloupce anionů, je nutný pro výpočet korigovaného anion gap (korekce na albumin), je nutný pro výpočet efektivního SID: SID effective = [HCO 3 - ] + [Alb x- ] + [P y- ]. Na druhé straně je pro samostatné posuzování metabolické komponenty nevhodný a pro terapeutické zásahy nepoužitelný. HCO 3 - standardní představuje teoretickou koncentraci hydrogenuhličitanu při normálním parciálním tlaku CO2. Je vysoce korelován s hodnotou base excess a proto jej lze považovat za obsolentní parametr. Otázku řešíme ve prospěch aktuálního HCO 3 -. c. Base excess krve, base excess plazmy nebo base excess extracelulární tekutiny? Teoretické podklady shrnuje Siggaard-Andersen, stručně jsou uvedeny ve vlastní monografii (Jabor, 1999). Stručně lze uvést, že base excess (BE, mmol/l) krve se vypočte pro aktuální hodnotu koncentrace hemoglobinu v plné krvi, BE plazmy pro nulovou koncentraci hemoglobinu a BE extracelulární tekutiny pro modelovou extracelulární tekutinu zahrnující krev i intersticium. Kvantitativní rozdíl mezi base excess krve a extracelulární tekutiny můžeme demonstrovat na příkladu akutní hyperkapnie, údaje jsou v tabulce 2.
3 Tabulka 2. Efekt výpočtu BE(ECT) při akutní hyperkapnii (aspirace u novorozence, porod 14:00 hodin). 14:45 17:30 22:00 ph 7,18 7,33 7,37 pco 2 9,3 6,3 5,7 (kpa) BE(krev) -6,6-2,0-0,9 (mmol/l) BE(ECT) -2,0-1,0 0,0 (mmol/l) Hemoglobin (g/l) Zatímco BE(krve) signalizuje v prvním nálezu kombinaci respirační a metabolické acidózy, BE(ECT) je v mezích. Důvodem pro rozdíl v hodnotě BE je redistribuce HCO 3 - mezi krví a slabě pufrovanou intersticiální tekutinou, způsobená hyperkapnií. Modelovou extracelulární tekutinou se míní hypotetická tekutina, jež vznikne zředěním jednoho objemu krve dvěma objemy její vlastní plazmy. Base excess extracelulární tekutiny představuje ideální ukazatel sumární metabolické komponenty. Vypočte se podle rovnice BE(ECT) = HCO ,2 + ß ecf * (ph 7,40) kde ß ecf = 16,2 mmol/l, pufrová hodnota nebikarbonátových pufrů v extracelulární tekutině. Ty jsou určeny zejména proteiny (albuminem) a proto použití konstanty nevyhovuje se stavech, kdy se vyskytuje hypoalbuminémi. Referenční meze jsou pro všechny typy base excess stejné, tj. 2,5 až +2,5 mmol/l (uvádí se též norma 2 až +2 mmol/l). Otázku řešíme ve prospěch base excess extracelulární tekutiny, ve shodě s doporučením expertního panelu IFCC. d. Anion gap nebo korigovaný anion gap? Anion gap (anionové okno) je jedním z tradičních ukazatelů metabolické acidobazické komponenty. Nejprve ale rozřešíme další problém: jaký anion gap? Jsou totiž dva postupy pro výpočet. První výpočet anion gap (AG, mmol/l), používaný více v Evropě AG = [Na + ] + [K + ] - ([Cl - ] + [HCO 3 - ]), druhý, bez (relativně konstantní) koncentrace kaliového kationu AG = [Na + ] - ([Cl - ] + [HCO 3 - ], používaný více v USA.
4 Anion gap je ukazatelem metabolické acidobazické poruchy, v uvedeném provedení však selhává u hypoproteinemie (resp. hypoalbuminemie). U hypoalbuminemie klesá koncentrace albuminátu (z hlediska elektroneutrality je albumin slabou kyselinou) a tento prostor je obsazen zvýšenou koncentrací HCO 3 -, takže bez přítomnosti zvýšených neměřených anionů se anion gap snižuje! Vyskytuje-li se ale současně acidifikující anion (laktát, ketolátky apod.), anion gap tuto poruchu neodhalí. Proto se doporučuje korekce AG na hypoalbuminemii (Figge, 1998): AG corrected = AG + 0,25 * ([Alb] normal - [Alb] measured ) kde [Alb] normal a [Alb] measured představují normální, resp. měřenou koncentraci albuminu v plazmě v g/l. Otázku řešíme ve prospěch korigovaného anion gap, pokud je z tradičních důvodů vyžadován. Při využívání modelu elektroneutrality plazmy je však tento ukazatel nadbytečný. e. Reziduální aniony nebo neměřené aniony? Dalším tradičním ukazatelem metabolické acidobazické komponenty jsou tzv. reziduální aniony (RA, mmol/l) (Kazda, 1984). Počítají se podle rovnice RA = [Na + ] + [K + ] + [Ca ++ ] + [Mg ++ ] ([Cl - ] + [HCO 3 - ] + [Prot x- ]), kde [Prot x- ] představuje náboj na proteinech vypočtený z ph krve a koncentrace celkových proteinů v séru [Prot] podle vztahu [Prot x- ] = (ph 5,08) * 0,104 * [Prot], zatímco neměřené aniony (UA, unmeasured anions, mmol/l) se počítají podle vzorce [UA - ] = [Na + ] + [K + ] + [Ca ++ ] + [Mg ++ ] ([Cl - ] + [HCO 3 - ] + [Alb x- ] + [Pi y- ]) kde [Alb x- ] a [Pi y- ] představují náboje albuminu, resp. fosfátů (viz dále). Jak však ukážeme dále, jsou neměřené aniony součástí modelu elektroneutrality plazmy. Do podobného kontextu reziduální aniony nezapadají, jsou separovaným pokusem lépe řešit metabolickou komponentu acidobazického obrazu, než je schopen provést anion gap. Reziduální aniony byly opodstatněné v době před korigováním anion gap. Z tohoto hlediska je samozřejmě jednodušší a spolehlivější korekce AG než výpočet RA. Otázku proto jednoznačně řešíme ve prospěch neměřených anionů. f. Buffer base séra nebo diference silných iontů? Buffer base séra (BBS, pufrové báze séra, mmol/l) jsou klasickým ukazatelem metabolické acidobazické komponenty: BBS = [Na + ] + [K + ] [Cl - ]
5 a prakticky (při zanedbání koncentrace kalcia a magnezia, které lze případně nahradit konstantou) odpovídají parametru, který Fencl (Fencl, 1993) označuje jako SID apparent (SID je Strong Ion Difference, diference silných iontů, mmol/l): SID apparent = [Na + ] + [K + ] + [Ca ++ ] + [Mg ++ ] - [Cl - ] Mnohem významnější je však efektivní diference silných iontů, SID effective SID effective = [HCO 3 - ]+[Alb x- ]+[Pi y- ] kde [Alb x- ] a [Pi y- ] představují náboje albuminu, resp. fosfátů (viz dále). Na rozdíl od BBS a SID apparent nezahrnuje SID effective neměřené aniony (UA) a není tedy zkreslen přítomností žádného silného anionu. Z uvedeného je zřejmé, že kladení rovnítka mezi BBS a SID je přinejmenším nepřesné, neuvede-li se, o jaký typ SID se jedná. Dále, význam BBS a SID apparent je malý. Otázku řešíme ve prospěch efektivního SID. g. Chlorid nebo korigovaný chlorid? Multifunkční acidobazické analyzátory nabízejí možnost přímého měření koncentrace sodného a chloridového iontu. Při poruchách hydratace je však nutné posoudit, zda je odchylka koncentrace chloridů proti normě způsobena změnou hydratace (tedy paralelně se změnou sodného kationu) nebo metabolickou acidobazickou poruchou (primární změna chloridového anionu, kterou může maskovat změna hydratace). Fencl (Fencl, 1993) proto doporučuje korigovat koncentraci chloridového anionu ([Cl - ] corrected, mmol/l) takto: [Cl - ] corrected = [Cl - ] measured * [Na + ] normal / [Na + ] measured kde jsou všechny hodnoty v mmol/l. Otázku řešíme ve prospěch korigovaných chloridů. h. pco 2 nebo total CO 2 Není nejmenších pochyb, že parametr total CO 2 je redundatní. Jedná se o sumární ukazatel respirační (pco 2 ) i metabolické (HCO 3 - ) složky. Z tohoto hlediska total CO 2 nemůže přispět k identifikaci jednotlivých acidobazických poruch. Otázku nelze řešit jinak než ve prospěch pco 2.
6 Část 2. Model elektroneutrality plazmy jako základ moderní interpretace acidobazických poruch Elektroneutralitu plazmy lze za ideálních okolností popsat rovnicí [Na + ] + [K + ] + [Ca ++ ] + [Mg ++ ] + [H + ] = [OH - ] + [Cl - ] + [HCO 3 - ] + [CO 2 -- ] + [Alb x- ] + [Pi y- ] Koncentrace [H + ], [OH - ] a [CO 2 -- ] jsou v plazmě zanedbatelné (nanomolární), rovnice navíc předpokládá neexistenci dalších anionů. Ty se však i za fyziologických situací vyskytují, v zájmu zachování elektroneutrality obvykle na úkor hydrogenuhličitanového anionu. Tyto aniony označujeme jako neměřené (UA, unmeasured anions) a rovnice elektroneutrality je potom následující: [Na + ] + [K + ] + [Ca ++ ] + [Mg ++ ] = [Cl - ] + [HCO 3 - ] + [Alb x- ] + [Pi y- ] + [UA - ] Symboly elektrolytů jsou jasné, [Alb x- ] popisuje stav, kdy na molekule albuminu převládá určitý počet negativních nábojů, podobně [Pi y- ] reprezentuje počet fosfátových negativních nábojů (obě hodnoty závisejí na ph, viz dále). Diference silných iontů (SID apparent, mmol/l) je rozdíl mezi silnými kationy (levá strana výše uvedené rovnice) a chloridovým anionem, výpočet jsme uvedli výše. Protože se však i za fyziologických okolností vyskytuje určitá koncentrace dalších silných iontů (sumárně jako [UA - ]), má praktický význam efektivní diference silných iontů (SID ef ). Efektivní diferenci silných iontů (v mmol/l) získáme zmenšením SID o hodnotu [UA - ]: SID effective = [Na + ] + [K + ] + [Ca ++ ] + [Mg ++ ] - [Cl - ] - [UA - ] Pokud si představíme sloupce kationů a anionů, které musejí být v rámci elektroneutrality stejně vysoké, jedná se o prostor tvořený hydrogenuhličitanem (HCO 3 - ), aniony albuminu a anorganického fosfátu. Neměřené aniony (unidentified, unmeasured anions, mmol/l) jsme definovali výše. Slabé netěkavé kyseliny (jako třetího reprezentanta nezávislých acidobazických proměnných) představuje parametr A tot, tedy suma látkových koncentrací negativních nábojů albuminu a anorganického fosforu. Počet negativních nábojů na molekule albuminu v mmol/l ([Alb x- ], Alb je koncentrace albuminu v plazmě v g/l, ph je ph krve) se vypočte podle rovnice: [Alb x- ] = (ph - 5,17) * 0,125 * Alb Počet negativních nábojů anorganického fosfátu v mmol/l ([Pi y- ] v mmol/l, P je plazmatický fosfor v mmol/l) se vypočte podle rovnice: [Pi y- ] = P * (ph * 0,309 0,469) Uvedené závislosti platí, pokud nejsou přítomny neměřené kationy (lithium, paraproteiny) nebo aniony (např. halogenové prvky).
7 Část 3. Klinické aplikace Základní klasifikace acidobazických poruch Z modelu elektroneutrality vychází klasifikace acidobazických poruch, jak ji uvádí Fencl (Fencl, 1993) na základě práce Stewarta (Stewart, 1983). Vychází se ze změn tzv. nezávislých acidobazických proměnných, kterými jsou pco 2, SID a A tot (A tot představuje sumu slabých netěkavých kyselin, jak byla uvedena výše). Podle tohoto přístupu se příčiny primárních poruch dělí na tři skupiny: 1. Změny poměru ventilace a perfúze s následnými změnami pco 2 vedou respirační acidóze (hyperkapnii), respirační alkalóze (hypokapnii). 2. Změny SID mohou vést k acidifikaci i alkalizaci organismu. Snížení SID Acidóza se snížením SID je způsobena zvýšením chloridů, zvýšením organických i anorganických kyselin, dilucí plazmy čistou vodou (vzniká hyponatrémie). Zvýšení SID Alkalózu se zvýšením SID způsobuje zejména snížení chloridů (a. renálního původu, b. extrarenálního původu, c. při pozitivní zevní bilanci Na + ), ztráta čisté vody (vzniká hypernatrémie). 3. Změny slabých netěkavých kyselin představují nejčastěji hypoproteinemická (hypoalbuminemická) metabolická alkalóza a acidóza ze zvýšení fosfátů (např. při oligurickém renálním selhání). Příklady využití uvedeného přístupu při hodnocení kombinovaných poruch ukazují následující kazuistiky. V jednotlivých tabulkách jsou podbarveny nálezy výrazněji překračující referenční meze (se vztahem k acidobazické rovnováze).
8 Chronická obstruktivní choroba bronchopulmolání, bronchopneumonie, srdeční městnání Měřené hodnoty Vypočtené hodnoty Na mmol/l - HCO 3 33 mmol/l K + 4,8 mmol/l AG measured 7 mmol/l Ca 1,7 mmol/l AG corrected 15 mmol/l Mg 0,8 mmol/l BE pl +9 mmol/l Cl mmol/l BE ecf +10 mmol/l Pi 0,9 mmol/l SID 39 mmol/l Albumin 15 g/l Cl - corrected 105 mmol/l ph 7,45 UA - corrected 9 mmol/l pco 2 6,6 kpa acidifikující poruchy: alkalizující poruchy: hyperkapnie při základním onemocnění hypoalbumiemie Jediným zdrojem závažné MALK (BE +9 mmol/l) je hypoalbuminemie. Není jiná metabolická porucha (normální SID, Cl -, Na +, UA, AG corrected ). Běžně se vyskytující hypochlorémie v rámci renální kompenzace respirační acidózy se nevyvinula vzhledem k alkalizující hypoalbuminémii.
9 Srdeční zástava, kardiopulmonální resuscitace, hypoxická encefalopatie MĚŘENÉ HODNOTY VYPOČTENÉ HODNOTY Na mmol/l - HCO 3 25,5 mmol/l K + 3,6 mmol/l AG measured 16 mmol/l Ca 2,1 mmol/l AG corrected 25 mmol/l Mg 1,1 mmol/l BE pl +2 mmol/l Cl mmol/l BE ecf +3,5 mmol/l Pi 0,5 mmol/l SID 29 mmol/l Albumin 9 g/l CL - corrected 108 mmol/l ph 7,55 UA - corrected 17 mmol/l pco 2 3,7 kpa acidifikující poruchy: alkalizující poruchy: zvýšené UA deficit vody, hypoalbuminemie, hypokapnie Nejedná se o respirační alkalózu s minimální metabolickou poruchou. Není nadbytek chloridů, jak by se dalo soudit z koncentrace Cl (po korekci na dehydrataci je Cl normální). Na závažnou metabolickou acidózu neukazuje žádný z tradičních dopočítaných ukazatelů (AG, HCO 3 -, base excess), od normy jsou ve smyslu acidózy odchýleny pouze neměřené aniony, korigovaný anion gap a efektivní SID.
10 Diabetická ketoacidóza MĚŘENÉ HODNOTY VYPOČTENÉ HODNOTY Na mmol/l - HCO 3 23,5 mmol/l K + 3,5 mmol/l AG measured 20 mmol/l Ca 2,0 mmol/l AG corrected 26 mmol/l Mg 0,8 mmol/l BE pl 0 mmol/l Cl - 90 mmol/l BE ecf +1 mmol/l Pi 0,9 mmol/l SID 31 mmol/l Albumin 20 g/l CL - corrected 98 mmol/l ph 7,50 UA - corrected 20 mmol/l pco 2 4 kpa acidifikující poruchy: alkalizující poruchy: zvýšené UA, nadbytek vody deficit Cl, hypoalbuminemie Nejedná se o jednoduchou respirační alkalózu. Na podíl výrazné metabolické acidózy neukazuje žádný z tradičních dopočítaných ukazatelů (AG, HCO 3 -, base excess), od normy jsou ve smyslu acidózy odchýleny naopak neměřené aniony, korigovaný anion gap a efektivní SID. Tato složka metabolické acidobazické poruchy je ale vyvážena podíle metabolické alkalózy s hypoalbuminemie a deficitu chloridů.
11 Kraniocerebrální trauma, bezvědomí, akutní renální selhání Měřené hodnoty Vypočtené hodnoty Na mmol/l - HCO 3 25,5 mmol/l K + 3,9 mmol/l AG measured 15 mmol/l Ca 2,1 mmol/l AG corrected 24 mmol/l Mg 0,8 mmol/l BE pl +1 mmol/l Cl - 96 mmol/l BE ecf +1 mmol/l Pi 0,4 mmol/l SID 29 mmol/l Albumin 10 g/l CL - corrected 103 mmol/l ph 7,36 UA - corrected 19 mmol/l pco 2 6 kpa acidifikující poruchy: alkalizující poruchy: zvýšené UA, nadbytek vody, hyperkapnie hypoalbuminemie, hypofosforemie Vzhledem k normálnímu BE by se hodnotilo jako jednoduchá respirační acidóza! Není deficit chloridů, jak by se mohlo zdát z koncentrace Cl! Hyperfosforemie typická pro chronické renální selhání se v tomto případě nerozvinula.
12 Cirhóza jater, krvácení z jícnových varixů Měřené hodnoty Vypočtené hodnoty Na mmol/l - HCO 3 24 mmol/l K + 5,2 mmol/l AG measured 8 mmol/l Ca 1,6 mmol/l AG corrected 16 mmol/l Mg 0,5 mmol/l BE pl 0 mmol/l Cl - 98 mmol/l BE ecf 0 mmol/l Pi 0,9 mmol/l SID 29 mmol/l Albumin 13 g/l CL - corrected 111 mmol/l ph 7,40 UA - corrected 8 mmol/l pco 2 5,2 kpa acidifikující poruchy: alkalizující poruchy: nadbytek vody, nadbytek chloridů hypoalbuminemie Nadbytek chloridů ukazují pouze korigované chloridy! Tradiční parametry (BE) metabolickou poruchu neukazují!
13 Závěry Předložené sdělení hodnotí běžně využívané acidobazické ukazatele a navrhuje množinu relevantních parametrů. Ty jsou uvedeny v závěrečné tabulce spolu s referenčními mezemi pro jejich hodnocení. Určitou výjimku v tabulce tvoří korigovaný anion gap, jehož používání mezi ostatními parametry je zbytečné a pro detekci patologicky zvýšených silných anionů je vhodnější výpočet neměřených anionů. V práci se nezabýváme parametry oxygenace. Proto v tabulce není žádný z potřebných ukazatelů uveden. Možné parametry pro hodnocení acidobazických poruch a skupina navržených relevantních ukazatelů. MOŽNÉ PARAMETRY ph aktivita (koncentrace) vodíkových iontů pco 2 total CO 2 HCO - 3 aktuální HCO - 3 standardní Base excess krve base excess plazmy base excess extracelulární tekutiny Anion gap korigovaný anion gap Reziduální aniony neměřené aniony Buffer base séra diference silných iontů Chlorid korigovaný chlorid RELEVANTNÍ PARAMETRY (referenční rozmezí) ph (7,36 7,44) pco 2 (4,9 5,7 kpa) HCO 3 - aktuální (22 26 mmol/l) Base excess extracelulární tekutiny (-2,5 +2,5 mmol/l) (Korigovaný anion gap) (13 17 mmol/l) Neměřené aniony (6 10 mmol/l) Efektivní diference silných iontů (38 40 mmol/l) Korigovaný chlorid ( mmol/l)
14 Literatura Fencl, V., Leith, D.E.: Stewart s quantitative acid-base chemistry: Applications in biology and medicine. Respir. Physiol., 91, 1993, s Figge, J., Mydosh, T., Fencl, V.: Serum proteins and acid-base equilibria: a follow up. J. Lab. Clin. Med., 120, 1992, s Figge, J., Jabor, A., Kazda, A., Fencl, V.: Anion gap and hypoalbuminemia. Crit. Care Med., 26, 1998, č. 11, s Hooper, J., Marshall, W.J., Miller, A.L.: Long-jam in acid-base education and investigation: why make it so difficult? Ann. Clin. Biochem., 35, 1998, s Jabor, A.: Voda, ionty a modelování poruch vnitřního prostředí. STAPRO, s.r.o., Pardubice, 1999, ISBN , 162 stran. Kazda, A.: Monitorování vnitřního prostředí v intenzívní a resuscitační péči. Avicenum, Praha, 1984.
3.8. Acidobazická regulace
 3.8. Acidobazická regulace Tabulka 3.8. 1: Referenční intervaly Parametr Muži Ženy ph 7,37 7,43 7,37 7,43 pco 2 (kpa) 4,7 6,0 4,3 5,7 - aktuální HCO 3 (mmol/l) 23,6 27,6 21,8 27,2 - standardní HCO 3 (mmol/l)
3.8. Acidobazická regulace Tabulka 3.8. 1: Referenční intervaly Parametr Muži Ženy ph 7,37 7,43 7,37 7,43 pco 2 (kpa) 4,7 6,0 4,3 5,7 - aktuální HCO 3 (mmol/l) 23,6 27,6 21,8 27,2 - standardní HCO 3 (mmol/l)
Acidobazická rovnováha
 Acidobazická rovnováha Klepnutím lze upravit styl předlohy podnadpisů. MUDr. Jiří Dvorský, NMB Vnitřní prostředí Pod pojmem vnitřní prostředí chápeme extracelulární tekutinu (včetně jejího složení) omývající
Acidobazická rovnováha Klepnutím lze upravit styl předlohy podnadpisů. MUDr. Jiří Dvorský, NMB Vnitřní prostředí Pod pojmem vnitřní prostředí chápeme extracelulární tekutinu (včetně jejího složení) omývající
Acidobazická rovnováha vývoj interpretace nálezn. lezů. A. Kazda
 Acidobazická rovnováha vývoj interpretace nálezn lezů A. Kazda Vyšet etřování acidobazické rovnováhy před p r. 1956 Bylo měřm ěřeno ph krve a vyšet etřen en celkový CO 2 (Total CO 2 ) např. van Slykeovým
Acidobazická rovnováha vývoj interpretace nálezn lezů A. Kazda Vyšet etřování acidobazické rovnováhy před p r. 1956 Bylo měřm ěřeno ph krve a vyšet etřen en celkový CO 2 (Total CO 2 ) např. van Slykeovým
Stewart Fenclův koncept hodnocení poruch ABR
 Stewart Fenclův koncept hodnocení poruch ABR František Duška Klinika anesteziologie a resuscitace a Ústav lék. chemie a biochemie 3. LF UK Motto: Republika nepotřebuje chemiky! Roberspierre při vynášení
Stewart Fenclův koncept hodnocení poruch ABR František Duška Klinika anesteziologie a resuscitace a Ústav lék. chemie a biochemie 3. LF UK Motto: Republika nepotřebuje chemiky! Roberspierre při vynášení
Acidobazické regulace
 ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE 2004 Acidobazické regulace Antonín Kazda kapitola ve skriptech 3.8 Klasifikace acidobazických ch poruch Porucha ACIDOSA ALKALOSA I. Respirační PCO2 II. Nerespirační
ZÁKLADY OBECNÉ A KLINICKÉ BIOCHEMIE 2004 Acidobazické regulace Antonín Kazda kapitola ve skriptech 3.8 Klasifikace acidobazických ch poruch Porucha ACIDOSA ALKALOSA I. Respirační PCO2 II. Nerespirační
Zpět k základům: poruchy acidobazické rovnováhy a vnitřního prostředí u komplikovaného pacienta Antonín Jabor, Janka Franeková
 Zpět k základům: poruchy acidobazické rovnováhy a vnitřního prostředí u komplikovaného pacienta Antonín Jabor, Janka Franeková PLM IKEM a 3. LF, UK Praha 7.10. 08:50 7.10 12:17 7.10. 16:44 8.10. 02:00
Zpět k základům: poruchy acidobazické rovnováhy a vnitřního prostředí u komplikovaného pacienta Antonín Jabor, Janka Franeková PLM IKEM a 3. LF, UK Praha 7.10. 08:50 7.10 12:17 7.10. 16:44 8.10. 02:00
ABR a iontového hospodářství
 Poruchy acidobazické rovnováhy Patobiochemie a diagnostika poruch ABR a iontového hospodářství Regulace kyselosti vnitřního prostředí CO 2 NH 3 tvorba močoviny glutaminu H + HCO - 3 Martin Vejražka, 2007
Poruchy acidobazické rovnováhy Patobiochemie a diagnostika poruch ABR a iontového hospodářství Regulace kyselosti vnitřního prostředí CO 2 NH 3 tvorba močoviny glutaminu H + HCO - 3 Martin Vejražka, 2007
Plasma a většina extracelulární
 Acidobazická rovnováha Tato prezentace je přístupná online Fyziologické ph Plasma a většina extracelulární tekutiny ph = 7,40 ± 0,02 Význam stálého ph Na ph závisí vlastnosti bílkovin aktivita enzymů struktura
Acidobazická rovnováha Tato prezentace je přístupná online Fyziologické ph Plasma a většina extracelulární tekutiny ph = 7,40 ± 0,02 Význam stálého ph Na ph závisí vlastnosti bílkovin aktivita enzymů struktura
ABR a iontového hospodářství
 Poruchy acidobazické rovnováhy Patobiochemie a diagnostika poruch ABR a iontového hospodářství Připojte se! Room name: ABR http://b.socrative.com Regulace kyselosti vnitřního prostředí CO 2 NH 3 tvorba
Poruchy acidobazické rovnováhy Patobiochemie a diagnostika poruch ABR a iontového hospodářství Připojte se! Room name: ABR http://b.socrative.com Regulace kyselosti vnitřního prostředí CO 2 NH 3 tvorba
Klinická fyziologie ABR sekce Základy oboru edukační lekce. Michal Horáček KARIM 2. LF UK a FN v Motole Praha
 Klinická fyziologie ABR sekce Základy oboru edukační lekce Michal Horáček KARIM 2. LF UK a FN v Motole Praha Hlavní ukazatel ABR: ph (resp. a[h + ]) ph = pondus hydrogenii, potential of hydrogen = vodíkový
Klinická fyziologie ABR sekce Základy oboru edukační lekce Michal Horáček KARIM 2. LF UK a FN v Motole Praha Hlavní ukazatel ABR: ph (resp. a[h + ]) ph = pondus hydrogenii, potential of hydrogen = vodíkový
Acidobazická rovnováha 11
 Acidobazická rovnováha 11 Iontogram krevní plazmy, AG, SID, BB s, pufrační systémy, hydrogenuhličitanový pufr. Poruchy acidobazické rovnováhy. 1. Jaký je princip měření a? 2. Které kyslíkové parametry
Acidobazická rovnováha 11 Iontogram krevní plazmy, AG, SID, BB s, pufrační systémy, hydrogenuhličitanový pufr. Poruchy acidobazické rovnováhy. 1. Jaký je princip měření a? 2. Které kyslíkové parametry
P. Schneiderka, Ústav patologické fyziologie LFUP a OKB FN Olomouc
 P. Schneiderka, Ústav patologické fyziologie LFUP a OKB FN Olomouc Acidobazický stav organismu Verze 27.9. 2012 Úvod Za průkopníka znalostí o acidobazickém stavu organismu (ABS) lze považovat amerického
P. Schneiderka, Ústav patologické fyziologie LFUP a OKB FN Olomouc Acidobazický stav organismu Verze 27.9. 2012 Úvod Za průkopníka znalostí o acidobazickém stavu organismu (ABS) lze považovat amerického
Acidobazický stav organismu
 Acidobazický stav organismu Doc. MUDr. Petr Schneiderka CSc. Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických a klinických předmětů na LF UP a FZV UP Reg. č.: CZ.1.07/2.2.00/15.0313
Acidobazický stav organismu Doc. MUDr. Petr Schneiderka CSc. Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických a klinických předmětů na LF UP a FZV UP Reg. č.: CZ.1.07/2.2.00/15.0313
BILANČNÍ PŘÍSTUP K MODELOVÁNÍ ACIDOBAZICKÉ ROVNOVÁHY A PŘENOSU KREVNÍCH PLYNŮ
 BILANČNÍ PŘÍSTUP K MODELOVÁNÍ ACIDOBAZICKÉ ROVNOVÁHY A PŘENOSU KREVNÍCH PLYNŮ Jiří Kofránek, Michal Andrlík, Stanislav Matoušek Anotace Navazujeme na popis našeho přístupu k modelování acidobazické rovnováhy
BILANČNÍ PŘÍSTUP K MODELOVÁNÍ ACIDOBAZICKÉ ROVNOVÁHY A PŘENOSU KREVNÍCH PLYNŮ Jiří Kofránek, Michal Andrlík, Stanislav Matoušek Anotace Navazujeme na popis našeho přístupu k modelování acidobazické rovnováhy
Vybrané klinicko-biochemické hodnoty
 Vybrané klinicko-biochemické hodnoty Obecným výsledkem laboratorního vyšetření je naměřená hodnota, která může být fyziologická, zvýšená či snížená. Abychom zjištěnou hodnotu mohli takto zařadit, je třeba
Vybrané klinicko-biochemické hodnoty Obecným výsledkem laboratorního vyšetření je naměřená hodnota, která může být fyziologická, zvýšená či snížená. Abychom zjištěnou hodnotu mohli takto zařadit, je třeba
Vliv infuzních roztoků na acidobazickou rovnováhu. Antonín Jabor IKEM Praha
 Vliv infuzních roztoků na acidobazickou rovnováhu Antonín Jabor IKEM Praha Fyziologický roztok Fyziologický roztok Incidence hyperchloridemie na konci operace je častá, je spojena s metabolickou acidózou,
Vliv infuzních roztoků na acidobazickou rovnováhu Antonín Jabor IKEM Praha Fyziologický roztok Fyziologický roztok Incidence hyperchloridemie na konci operace je častá, je spojena s metabolickou acidózou,
Produkce kyselin v metabolismu Těkavé: 15,000 mmol/den kyseliny uhličité, vyloučena plícemi jako CO 2 Netěkavé kyseliny (1 mmol/kg/den) jsou vyloučeny
 Vnitřní prostředí a acidobazická rovnováha 13.12.2004 Vnitřní prostředí Sestává z posuzování složení extracelulární tekutiny z hlediska izohydrie (= optimální koncentrace ph) izoionie (= optimální koncentrace
Vnitřní prostředí a acidobazická rovnováha 13.12.2004 Vnitřní prostředí Sestává z posuzování složení extracelulární tekutiny z hlediska izohydrie (= optimální koncentrace ph) izoionie (= optimální koncentrace
NÁVOD K POUŽITÍ VÁPNÍK 600 KATALOGOVÉ ČÍSLO 207
 NÁVOD K POUŽITÍ VÁPNÍK 600 KATALOGOVÉ ČÍSLO 207 POUŽITÍ Souprava Vápník 600 se používá ke kvantitativnímu stanovení koncentrace vápenatých iontů v séru a moči. SOUHRN V lidském organismu je vázána převážná
NÁVOD K POUŽITÍ VÁPNÍK 600 KATALOGOVÉ ČÍSLO 207 POUŽITÍ Souprava Vápník 600 se používá ke kvantitativnímu stanovení koncentrace vápenatých iontů v séru a moči. SOUHRN V lidském organismu je vázána převážná
Analyzátory OPTI firmy ROCHE
 Analyzátory OPTI firmy ROCHE - øešení kritických situací Prof. MUDr. Jaroslav Racek, DrSc., MUDr. Vlasta Petøíková, Zuzana Pešková Ústav klinické biochemie a laboratorní diagnostiky Lékaøské fakulty UK
Analyzátory OPTI firmy ROCHE - øešení kritických situací Prof. MUDr. Jaroslav Racek, DrSc., MUDr. Vlasta Petøíková, Zuzana Pešková Ústav klinické biochemie a laboratorní diagnostiky Lékaøské fakulty UK
Acidobazická rovnováha
 Acidobazická rovnováha... přístupy Motol, 2019-04-16 Jak to vypadá v realitě? pouze arteriální odběry 15 000 nálezů ABL 800 Radiometer BEECT ABIC APH ACO2 7,8 18 7,6 7,4 7,2 16 14 12 10 7,0 8 6,8 6,6 6,4
Acidobazická rovnováha... přístupy Motol, 2019-04-16 Jak to vypadá v realitě? pouze arteriální odběry 15 000 nálezů ABL 800 Radiometer BEECT ABIC APH ACO2 7,8 18 7,6 7,4 7,2 16 14 12 10 7,0 8 6,8 6,6 6,4
Acidobazická rovnováha H+ a ph Vodíkový iont se skládá z protonu, kolem něhož neobíhá žádný elektron. Proto je vodíkový iont velmi malý a je
 Acidobazická rovnováha 14.4.2004 H+ a ph Vodíkový iont se skládá z protonu, kolem něhož neobíhá žádný elektron. Proto je vodíkový iont velmi malý a je extrémně reaktivní. Má proto velmi hluboký vliv na
Acidobazická rovnováha 14.4.2004 H+ a ph Vodíkový iont se skládá z protonu, kolem něhož neobíhá žádný elektron. Proto je vodíkový iont velmi malý a je extrémně reaktivní. Má proto velmi hluboký vliv na
Poruchy vnitřního prostředí. v intenzivní medicíně
 Poruchy vnitřního prostředí v intenzivní medicíně Vnitřní prostředí = extracelulární tekutina (plazma, intersticiální tekutina) Poruchy objemu a osmolality Poruchy iontů (Na, K, Ca, Mg, Cl) Poruchy acidobazické
Poruchy vnitřního prostředí v intenzivní medicíně Vnitřní prostředí = extracelulární tekutina (plazma, intersticiální tekutina) Poruchy objemu a osmolality Poruchy iontů (Na, K, Ca, Mg, Cl) Poruchy acidobazické
Jana Fauknerová Matějčková
 Jana Fauknerová Matějčková kyselina (HA) acidóza (acidémie) báze (B ) alkalóza (alkalémie) pufr ph = pk + log cs / ca koncentrace [H + ] v krvi udržována pomocí plic, ledvin a jater okolo 40 nm ph = log
Jana Fauknerová Matějčková kyselina (HA) acidóza (acidémie) báze (B ) alkalóza (alkalémie) pufr ph = pk + log cs / ca koncentrace [H + ] v krvi udržována pomocí plic, ledvin a jater okolo 40 nm ph = log
Existují ideální iontové roztoky pro pacienty se SBS? Michal Žourek DPV Praha
 Existují ideální iontové roztoky pro pacienty se SBS? Michal Žourek DPV Praha 16.11.2007 Osnova Vstřebávání základních látek z GIT Hodnocení ABR Hodnocení změn: Na, K, Cl, Ca, P, Mg SBS a funkční změny
Existují ideální iontové roztoky pro pacienty se SBS? Michal Žourek DPV Praha 16.11.2007 Osnova Vstřebávání základních látek z GIT Hodnocení ABR Hodnocení změn: Na, K, Cl, Ca, P, Mg SBS a funkční změny
Mendelova zemědělská a lesnická univerzita v Brně Agronomická fakulta Ústav morfologie, fyziologie a genetiky zvířat
 Mendelova zemědělská a lesnická univerzita v Brně Agronomická fakulta Ústav morfologie, fyziologie a genetiky zvířat Ukazatele acidobazické rovnováhy krve jalovic v průběhu výkrmu Bakalářská práce Vedoucí
Mendelova zemědělská a lesnická univerzita v Brně Agronomická fakulta Ústav morfologie, fyziologie a genetiky zvířat Ukazatele acidobazické rovnováhy krve jalovic v průběhu výkrmu Bakalářská práce Vedoucí
Vyšetřování a léčba poruch acidobazické rovnováhy
 Vyšetřování a léčba poruch acidobazické rovnováhy Vladimír Soška Oddělení klinické biochemie Fyziologické hodnoty ABR Parametr Jednotka Normální meze Kritické hodnoty ph 7.35-7.45 < 7.1; > 7.6 pco 2 kpa
Vyšetřování a léčba poruch acidobazické rovnováhy Vladimír Soška Oddělení klinické biochemie Fyziologické hodnoty ABR Parametr Jednotka Normální meze Kritické hodnoty ph 7.35-7.45 < 7.1; > 7.6 pco 2 kpa
Acidobazická rovnováha pro pokročilé. František Duška KAR FNKV
 Acidobazická rovnováha pro pokročilé František Duška KAR FNKV Republika nepotřebuje chemiky! Roberspierre při vynášení rozsudku trestu smrti nad Lavoisierem 8. května 1794 28 letý muž, alkoholik. Přichází
Acidobazická rovnováha pro pokročilé František Duška KAR FNKV Republika nepotřebuje chemiky! Roberspierre při vynášení rozsudku trestu smrti nad Lavoisierem 8. května 1794 28 letý muž, alkoholik. Přichází
2 Roztoky elektrolytů. Osmotický tlak
 Roztoky elektrolytů. Osmotický tlak 1. Doplněním uvedených schémat vyjádřete rozdílné chování různých typů látek po jejich rozpuštění ve vodě. Použijte symboly AB(aq), A + (aq), B - (aq). [s pevná fáze,
Roztoky elektrolytů. Osmotický tlak 1. Doplněním uvedených schémat vyjádřete rozdílné chování různých typů látek po jejich rozpuštění ve vodě. Použijte symboly AB(aq), A + (aq), B - (aq). [s pevná fáze,
Acidobazická rovnováha (ABR)
 Acidobazická rovnováha (ABR) Definice ph ph = log c(h + ) ph = 7,4 c(h + ) = 40 nm (H + ) = ph kyselina látka odštěpující H + (Arrhenius) nebo donor H + (Brönsted) zásada látka odštěpující OH (Arrhenius)
Acidobazická rovnováha (ABR) Definice ph ph = log c(h + ) ph = 7,4 c(h + ) = 40 nm (H + ) = ph kyselina látka odštěpující H + (Arrhenius) nebo donor H + (Brönsted) zásada látka odštěpující OH (Arrhenius)
Acido-bázická rovnováha (ABR)
 1 Acido-bázická rovnováha (ABR) Vladimír Kollárik II. klinika anestéziológie a intenzívnej medicíny Fakultná nemocnica s poliklinikou F. D. Roosevelta Banská Bystrica CEEA 2017 Košice, 2 3 Prečo je dôležitý
1 Acido-bázická rovnováha (ABR) Vladimír Kollárik II. klinika anestéziológie a intenzívnej medicíny Fakultná nemocnica s poliklinikou F. D. Roosevelta Banská Bystrica CEEA 2017 Košice, 2 3 Prečo je dôležitý
Hlavní ukazatele acidobazické rovnováhy
 Hlavní ukazatele acidobazické rovnováhy Pro vyšetření parametrů acidobazické rovnováhy (ABR) se odebírá krev arteriální nebo arterilizovaná. Arteriální krev se odebírá z artérií do heparinizovaných zkumavek
Hlavní ukazatele acidobazické rovnováhy Pro vyšetření parametrů acidobazické rovnováhy (ABR) se odebírá krev arteriální nebo arterilizovaná. Arteriální krev se odebírá z artérií do heparinizovaných zkumavek
3 Acidobazické reakce
 3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
Monitoring vnitřního prostředí pacienta
 Monitoring vnitřního prostředí pacienta MVDr. Leona Raušerová -Lexmaulová, Ph.D. Klinika chorob psů a koček VFU Brno Vnitřní prostředí Voda Ionty Bílkoviny Cukry Tuky Důležité faktory Obsah vody Obsah
Monitoring vnitřního prostředí pacienta MVDr. Leona Raušerová -Lexmaulová, Ph.D. Klinika chorob psů a koček VFU Brno Vnitřní prostředí Voda Ionty Bílkoviny Cukry Tuky Důležité faktory Obsah vody Obsah
Klasické nebo Stewartovo hodnocení poruch ABR?
 Klasické nebo Stewartovo hodnocení poruch ABR? Neboli naše mezery v acidobazi M. Kratochvíl, KARIM FN Brno Definice ph: záporný dekadický logaritmus koncentrace oxoniových iontů (40 nmol/l) Kyselina: donor
Klasické nebo Stewartovo hodnocení poruch ABR? Neboli naše mezery v acidobazi M. Kratochvíl, KARIM FN Brno Definice ph: záporný dekadický logaritmus koncentrace oxoniových iontů (40 nmol/l) Kyselina: donor
tělní buňky tělní tekutiny krev erythrocyty 7.28 thrombocyty 7.0 žaludeční šťáva buňky kosterního svalstva duodenální šťáva
 Acidobazická rovnováha homeostasa H + iontů Regulace vnitřního prostředí Udržování osmotické koncetrace solí, minerálů, eáů, Vztahy acidobazické rovnováhy Stálost = acidobazická rovnováha (stav) Regulace
Acidobazická rovnováha homeostasa H + iontů Regulace vnitřního prostředí Udržování osmotické koncetrace solí, minerálů, eáů, Vztahy acidobazické rovnováhy Stálost = acidobazická rovnováha (stav) Regulace
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls43951/2010
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls43951/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hydrogenuhličitan sodný 4,2% (w/v) - BRAUN infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls43951/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hydrogenuhličitan sodný 4,2% (w/v) - BRAUN infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ
Jiří Kofránek, Stanislav Matoušek, Marek Mateják
 Modelování acidobazické rovnováhy Jiří Kofránek, Stanislav Matoušek, Marek Mateják Abstrakt Náš bilanční přístup k modelování a hodnocení poruch acidobazické rovnováhy vychází z modelování bilancí dvou
Modelování acidobazické rovnováhy Jiří Kofránek, Stanislav Matoušek, Marek Mateják Abstrakt Náš bilanční přístup k modelování a hodnocení poruch acidobazické rovnováhy vychází z modelování bilancí dvou
ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY
 ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY Klíčová slova: relativní atomová hmotnost (A r ), relativní molekulová hmotnost (M r ), Avogadrova konstanta (N A ), látkové množství (n, mol), molární hmotnost (M, g/mol),
ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY Klíčová slova: relativní atomová hmotnost (A r ), relativní molekulová hmotnost (M r ), Avogadrova konstanta (N A ), látkové množství (n, mol), molární hmotnost (M, g/mol),
ZÁSADY SPRÁVNÉ LABORATORNÍ PRAXE VYBRANÁ USTANOVENÍ PRAKTICKÉ APLIKACE
 ZÁSADY SPRÁVNÉ LABORATORNÍ PRAXE VYBRANÁ USTANOVENÍ PRAKTICKÉ APLIKACE Zabezpečování jakosti v laboratorní praxi je významnou součástí práce každé laboratoře. Problematiku jakosti řeší řada předpisů, z
ZÁSADY SPRÁVNÉ LABORATORNÍ PRAXE VYBRANÁ USTANOVENÍ PRAKTICKÉ APLIKACE Zabezpečování jakosti v laboratorní praxi je významnou součástí práce každé laboratoře. Problematiku jakosti řeší řada předpisů, z
Výpočty koncentrací. objemová % (objemový zlomek) krvi m. Vsložky. celku. Objemy nejsou aditivní!!!
 Výpočty koncentrací objemová % (objemový zlomek) Vsložky % obj. = 100 V celku Objemy nejsou aditivní!!! Příklad: Kolik ethanolu je v 700 ml vodky (40 % obj.)? Kolik promile ethanolu v krvi bude mít muž
Výpočty koncentrací objemová % (objemový zlomek) Vsložky % obj. = 100 V celku Objemy nejsou aditivní!!! Příklad: Kolik ethanolu je v 700 ml vodky (40 % obj.)? Kolik promile ethanolu v krvi bude mít muž
Diagnostika a léčba poruch acidobazické rovnováhy. J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická
 Diagnostika a léčba poruch acidobazické rovnováhy J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická ph alkalita/acidita vnitřního prostředí 7,4 ± 0,04 mmol/l pco 2 respirační
Diagnostika a léčba poruch acidobazické rovnováhy J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická ph alkalita/acidita vnitřního prostředí 7,4 ± 0,04 mmol/l pco 2 respirační
DIAGNÓZA JEDNODUCHÝCH A SMÍŠ ÍŠENÝCH PORUCH ACIDOBAZICKÉ ROVNOVÁHY. A. Kazda. Katedra klinické biochemie, IPVZ Praha UKBLD 1.
 DIAGNÓZA JEDNODUCHÝCH A SMÍŠ ÍŠENÝCH PORUCH ACIDOBAZICKÉ ROVNOVÁHY A. Kazda Katedra klinické biochemie, IPVZ Praha UKBLD 1. LF UK a VFN Záznamový list acidobazické regulace Graf acidobazické regulace (M.
DIAGNÓZA JEDNODUCHÝCH A SMÍŠ ÍŠENÝCH PORUCH ACIDOBAZICKÉ ROVNOVÁHY A. Kazda Katedra klinické biochemie, IPVZ Praha UKBLD 1. LF UK a VFN Záznamový list acidobazické regulace Graf acidobazické regulace (M.
Chemické výpočty II. Vladimíra Kvasnicová
 Chemické výpočty II Vladimíra Kvasnicová Převod jednotek pmol/l nmol/l µmol/l mmol/l mol/l 10-12 10-9 10-6 10-3 mol/l µg mg g 10-6 10-3 g µl ml dl L 10-6 10-3 10-1 L Cvičení 12) cholesterol (MW=386,7g/mol):
Chemické výpočty II Vladimíra Kvasnicová Převod jednotek pmol/l nmol/l µmol/l mmol/l mol/l 10-12 10-9 10-6 10-3 mol/l µg mg g 10-6 10-3 g µl ml dl L 10-6 10-3 10-1 L Cvičení 12) cholesterol (MW=386,7g/mol):
Pavel Suk ARK, FN u svatéanny v Brně
 Pavel Suk ARK, FN u svatéanny v Brně anamnéza, klinika jaká porucha ABR je nejpravděpodobnější? vyvolávající porucha? jiné příčiny? smíšené poruchy ABR kompenzace? je adekvátní? klinická významnost? dynamika?
Pavel Suk ARK, FN u svatéanny v Brně anamnéza, klinika jaká porucha ABR je nejpravděpodobnější? vyvolávající porucha? jiné příčiny? smíšené poruchy ABR kompenzace? je adekvátní? klinická významnost? dynamika?
3 Acidobazické reakce
 3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
Diagnostika poruch acidobazické rovnováhy
 Návod do cvičení Diagnostika poruch acidobazické rovnováhy Úvod Stálost tzv. vnitřního prostředí je nezbytnou podmínkou života vyšších organismů. Důležitá je zejména hodnota ph. Na hodnotě ph závisí mimo
Návod do cvičení Diagnostika poruch acidobazické rovnováhy Úvod Stálost tzv. vnitřního prostředí je nezbytnou podmínkou života vyšších organismů. Důležitá je zejména hodnota ph. Na hodnotě ph závisí mimo
VNITŘNÍ PROSTŘEDÍ. Biochemický ústav LF MU (V.P.) 2007
 1 VNITŘNÍ PROSTŘEDÍ Biochemický ústav LF MU (V.P.) 2007 2 Vnitřní prostředí: Claude Bernard, 1878: Co je vnitřní prostředí? Je to krev, ve skutečnosti však nikoliv celá, nýbrž tekutá část krve, krevní
1 VNITŘNÍ PROSTŘEDÍ Biochemický ústav LF MU (V.P.) 2007 2 Vnitřní prostředí: Claude Bernard, 1878: Co je vnitřní prostředí? Je to krev, ve skutečnosti však nikoliv celá, nýbrž tekutá část krve, krevní
Biologický materiál je tvořen vzorky tělních tekutin, tělesných sekretů, exkretů a tkání.
 Otázka: Druhy biologického materiálu Předmět: Biologie Přidal(a): moni.ka Druhy biologického materiálu Biologický materiál je tvořen vzorky tělních tekutin, tělesných sekretů, exkretů a tkání. Tělní tekutiny
Otázka: Druhy biologického materiálu Předmět: Biologie Přidal(a): moni.ka Druhy biologického materiálu Biologický materiál je tvořen vzorky tělních tekutin, tělesných sekretů, exkretů a tkání. Tělní tekutiny
Akutní stavy Ztráty vody a iont byly hrazeny infúzemi glukózy nebo pitím vody. Vznikající hypoosmolalita ECT vedla k p esunu ásti vody z ECT do ICT.
 Strana 1 (celkem 6 Strana 1 (celkem 6) Odd lení laboratorní medicíny nemocnice Šternberk Jívavská 20, 78516, eská Republika Tel 585087308 fax 585087306 E-mail olm@nemstbk.cz info:www.nemstbk.cz/olm ----------------------------------------------
Strana 1 (celkem 6 Strana 1 (celkem 6) Odd lení laboratorní medicíny nemocnice Šternberk Jívavská 20, 78516, eská Republika Tel 585087308 fax 585087306 E-mail olm@nemstbk.cz info:www.nemstbk.cz/olm ----------------------------------------------
3. HYDROLOGICKÉ POMĚRY
 Tunel Umiray Macua, Filipíny hydrogeologický monitoring Jitka Novotná1, Pavel Blaha2, Roman Duras3 1 GEOtest, a.s., Brno, Šmahova 112 novotna@geotest.cz 2 GEOtest, a.s., Brno, Šmahova 112 blaha@geotest.cz
Tunel Umiray Macua, Filipíny hydrogeologický monitoring Jitka Novotná1, Pavel Blaha2, Roman Duras3 1 GEOtest, a.s., Brno, Šmahova 112 novotna@geotest.cz 2 GEOtest, a.s., Brno, Šmahova 112 blaha@geotest.cz
rovnováha mezi acidifikujícími a alkalizujícími vlivy
 AB balance; úvod do patofy- siologických aspektů AB balance; introduction into pathophysiological aspects Prof. Dr. V. Pelouch, CSc. Co je acidobazická rovnováha? rovnováha mezi acidifikujícími a alkalizujícími
AB balance; úvod do patofy- siologických aspektů AB balance; introduction into pathophysiological aspects Prof. Dr. V. Pelouch, CSc. Co je acidobazická rovnováha? rovnováha mezi acidifikujícími a alkalizujícími
Faktory ovlivňující úspěšnost embryologické laboratoře
 Faktory ovlivňující úspěšnost embryologické laboratoře P. Trávník Sanatorium REPROMEDA s.r.o. 1 Úspěšnost AR ovlivňuje řada faktorů, něco jsme věděli, některé jsme poznali v průběhu let 1990 Sanatorium
Faktory ovlivňující úspěšnost embryologické laboratoře P. Trávník Sanatorium REPROMEDA s.r.o. 1 Úspěšnost AR ovlivňuje řada faktorů, něco jsme věděli, některé jsme poznali v průběhu let 1990 Sanatorium
Diagnostika a léčba poruch acidobazické rovnováhy. J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická
 Diagnostika a léčba poruch acidobazické rovnováhy J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická ph alkalita/acidita vnitřního prostředí 7,4 ± 0,04 mmol/l pco 2 respirační
Diagnostika a léčba poruch acidobazické rovnováhy J. Vymětal 3. interní klinika nefrologická, revmatologická a endokrinologická ph alkalita/acidita vnitřního prostředí 7,4 ± 0,04 mmol/l pco 2 respirační
Acidobazická rovnováha - jasně a jednoduše
 Acidobazická rovnováha - jasně a jednoduše Michal Horáček KARIM 2. LF UK v FNM Praha ph, resp. a[h + ] rovnice 4. řádu: 3 nezávisle proměnné, 5 rychlostních konstant po zjednodušení: Acidobazická rovnováha
Acidobazická rovnováha - jasně a jednoduše Michal Horáček KARIM 2. LF UK v FNM Praha ph, resp. a[h + ] rovnice 4. řádu: 3 nezávisle proměnné, 5 rychlostních konstant po zjednodušení: Acidobazická rovnováha
Jana Fauknerová Matějčková
 Jana Fauknerová Matějčková převody jednotek výpočet ph ph vodných roztoků ph silných kyselin a zásad ph slabých kyselin a zásad, disociační konstanta, pk ph pufrů koncentace 1000mg př. g/dl mg/l = = *10000
Jana Fauknerová Matějčková převody jednotek výpočet ph ph vodných roztoků ph silných kyselin a zásad ph slabých kyselin a zásad, disociační konstanta, pk ph pufrů koncentace 1000mg př. g/dl mg/l = = *10000
KREVNÍ ELEMENTY, PLAZMA. Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje
 KREVNÍ ELEMENTY, PLAZMA Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Leden 2010 Mgr. Jitka Fuchsová KREV Červená, neprůhledná, vazká tekutina Skládá
KREVNÍ ELEMENTY, PLAZMA Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Leden 2010 Mgr. Jitka Fuchsová KREV Červená, neprůhledná, vazká tekutina Skládá
Toxické metabolity glykolaldehyd, kys. glykolová, kys. glyoxylová, kys. štavelová
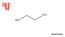 Marek Protuš C 2 H 6 O 2 Alkohol 1,2-ethandiol bezbarvá viskózní tekutina nasládlé chuti netoxický Molární hmotnost 62,068 g/mol Teplota tání 12,9 C Teplota varu 197,3 C Hustota 1,113 g/cm 3 Rozpustnost
Marek Protuš C 2 H 6 O 2 Alkohol 1,2-ethandiol bezbarvá viskózní tekutina nasládlé chuti netoxický Molární hmotnost 62,068 g/mol Teplota tání 12,9 C Teplota varu 197,3 C Hustota 1,113 g/cm 3 Rozpustnost
TEORETICKÁ ČÁST (70 BODŮ)
 Řešení okresního kola ChO kat. D 0/03 TEORETICKÁ ČÁST (70 BODŮ) Úloha 3 bodů. Ca + H O Ca(OH) + H. Ca(OH) + CO CaCO 3 + H O 3. CaCO 3 + H O + CO Ca(HCO 3 ) 4. C + O CO 5. CO + O CO 6. CO + H O HCO 3 +
Řešení okresního kola ChO kat. D 0/03 TEORETICKÁ ČÁST (70 BODŮ) Úloha 3 bodů. Ca + H O Ca(OH) + H. Ca(OH) + CO CaCO 3 + H O 3. CaCO 3 + H O + CO Ca(HCO 3 ) 4. C + O CO 5. CO + O CO 6. CO + H O HCO 3 +
1. Jeden elementární záporný náboj 1,602.10-19 C nese částice: a) neutron b) elektron c) proton d) foton
 varianta A řešení (správné odpovědi jsou podtrženy) 1. Jeden elementární záporný náboj 1,602.10-19 C nese částice: a) neutron b) elektron c) proton d) foton 2. Sodný kation Na + vznikne, jestliže atom
varianta A řešení (správné odpovědi jsou podtrženy) 1. Jeden elementární záporný náboj 1,602.10-19 C nese částice: a) neutron b) elektron c) proton d) foton 2. Sodný kation Na + vznikne, jestliže atom
 OBECNÁ CHEMIE František Zachoval CHEMICKÉ ROVNOVÁHY 1. Rovnovážný stav, rovnovážná konstanta a její odvození Dlouhou dobu se chemici domnívali, že jakákoliv chem.
OBECNÁ CHEMIE František Zachoval CHEMICKÉ ROVNOVÁHY 1. Rovnovážný stav, rovnovážná konstanta a její odvození Dlouhou dobu se chemici domnívali, že jakákoliv chem.
EFFECT OF DIFFERENT HOUSING SYSTEMS ON INTERNAL ENVIRONMENT PARAMETERS IN LAYING HENS
 EFFECT OF DIFFERENT HOUSING SYSTEMS ON INTERNAL ENVIRONMENT PARAMETERS IN LAYING HENS VLIV RŮZNÝCH TECHNOLOGICKÝCH SYSTÉMŮ CHOVU NA VYBRANÉ UKAZATELE VNITŘNÍHO PROSTŘEDÍ NOSNIC Pavlík A. Ústav morfologie,
EFFECT OF DIFFERENT HOUSING SYSTEMS ON INTERNAL ENVIRONMENT PARAMETERS IN LAYING HENS VLIV RŮZNÝCH TECHNOLOGICKÝCH SYSTÉMŮ CHOVU NA VYBRANÉ UKAZATELE VNITŘNÍHO PROSTŘEDÍ NOSNIC Pavlík A. Ústav morfologie,
Soli. ph roztoků solí - hydrolýza
 Soli Soli jsou iontové sloučeniny vzniklé neutralizační reakcí. Např. NaCl je sůl vzniklá reakcí kyseliny HCl a zásady NaOH. Př.: Napište neutralizační reakce jejichž produktem jsou CH 3 COONa, NaCN, NH
Soli Soli jsou iontové sloučeniny vzniklé neutralizační reakcí. Např. NaCl je sůl vzniklá reakcí kyseliny HCl a zásady NaOH. Př.: Napište neutralizační reakce jejichž produktem jsou CH 3 COONa, NaCN, NH
3 Acidobazické reakce
 3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
3 Acidobazické reakce Brønstedova teorie 1. Uveďte explicitní definice podle Brønstedovy teorie. Kyselina je... Báze je... Konjugovaný pár je... 2. Doplňte tabulku a pojmenujte všechny sloučeniny. Kyselina
PARENTERÁLNÍ VÝŽIVA 1
 PARENTERÁLNÍ VÝŽIVA 1 2 3 4 5 6 7 8 9 10 Cukr a tuk: 1/ glukosa je (aerobně) metabolizována na acetyl-coa. Jeho nadbytek, neodbouraný v Krebsově cyklu, může být přeměněn na mastné kyseliny (ev. na cholesterol)
PARENTERÁLNÍ VÝŽIVA 1 2 3 4 5 6 7 8 9 10 Cukr a tuk: 1/ glukosa je (aerobně) metabolizována na acetyl-coa. Jeho nadbytek, neodbouraný v Krebsově cyklu, může být přeměněn na mastné kyseliny (ev. na cholesterol)
HYDROSFÉRA 0,6% 2,14% 97,2%
 HYDROSFÉRA 0,6% 2,14% 97,2% PODZEMNÍ VODA Fosilní voda Proudící voda evapotranspirace Celkový odtok Přímý odtok infitrace Základní odtok VODA OBNOVITELNÝ PŘÍRODNÍ ZDROJ Hydrologický cyklus Zdrojem energie
HYDROSFÉRA 0,6% 2,14% 97,2% PODZEMNÍ VODA Fosilní voda Proudící voda evapotranspirace Celkový odtok Přímý odtok infitrace Základní odtok VODA OBNOVITELNÝ PŘÍRODNÍ ZDROJ Hydrologický cyklus Zdrojem energie
NÁVOD K POUŽITÍ HOŘČÍK 600 A KATALOGOVÉ ČÍSLO 104
 NÁVOD K POUŽITÍ HOŘČÍK 600 A KATALOGOVÉ ČÍSLO 104 POUŽITÍ Souprava Mg 600 A se používá ke kvantitativnímu stanovení koncentrace hořečnatých iontů v séru, v moči a v dalších biologických materiálech. SOUHRN
NÁVOD K POUŽITÍ HOŘČÍK 600 A KATALOGOVÉ ČÍSLO 104 POUŽITÍ Souprava Mg 600 A se používá ke kvantitativnímu stanovení koncentrace hořečnatých iontů v séru, v moči a v dalších biologických materiálech. SOUHRN
VYBRANÉ BIOCHEMICKÉ A FYZIOLOGICKÉ HODNOTY JEDNOTLIVÝCH DRUHŮ ZVÍŘAT MVDr. Vladimír Kopřiva,Ph.D DOPLŇKOVÝ STUDIJNÍ MATERIÁL KÓD AKTIVITY 2110/4-4 up.
 VYBRANÉ BIOCHEMICKÉ A FYZIOLOGICKÉ HODNOTY JEDNOTLIVÝCH DRUHŮ ZVÍŘAT MVDr. Vladimír Kopřiva,Ph.D DOPLŇKOVÝ STUDIJNÍ MATERIÁL KÓD AKTIVITY 2110/4-4 up. BIOCHEMICKÉ HODNOTY U VYBRANÝCH DRUHŮ ZVÍŘAT (SKOT,PRASE,
VYBRANÉ BIOCHEMICKÉ A FYZIOLOGICKÉ HODNOTY JEDNOTLIVÝCH DRUHŮ ZVÍŘAT MVDr. Vladimír Kopřiva,Ph.D DOPLŇKOVÝ STUDIJNÍ MATERIÁL KÓD AKTIVITY 2110/4-4 up. BIOCHEMICKÉ HODNOTY U VYBRANÝCH DRUHŮ ZVÍŘAT (SKOT,PRASE,
Monitorování hladiny metalothioneinu a thiolových sloučenin u biologických organismů vystavených působení kovových prvků a sloučenin
 Laboratoř Metalomiky a Nanotechnologií Monitorování hladiny metalothioneinu a thiolových sloučenin u biologických organismů vystavených působení kovových prvků a sloučenin Ing. Kateřina Tmejová, Ph. D.,
Laboratoř Metalomiky a Nanotechnologií Monitorování hladiny metalothioneinu a thiolových sloučenin u biologických organismů vystavených působení kovových prvků a sloučenin Ing. Kateřina Tmejová, Ph. D.,
Těžká laktátová acidosa. Daniel Nalos, Věra Vondráková, Pavel Neumann. KAPIM Ústí nad Labem
 Těžká laktátová acidosa Daniel Nalos, Věra Vondráková, Pavel Neumann. KAPIM Ústí nad Labem Anamnesa 74 letá paní, žijící ve společné domácnosti s manželem, v chronické medikaci Letrox 1 tbl. Cilkanol 1tbl,
Těžká laktátová acidosa Daniel Nalos, Věra Vondráková, Pavel Neumann. KAPIM Ústí nad Labem Anamnesa 74 letá paní, žijící ve společné domácnosti s manželem, v chronické medikaci Letrox 1 tbl. Cilkanol 1tbl,
KOMPLEXNÍ MODEL ACIDOBAZICKÉ ROVNOVÁHY KRVE. Jiří Kofránek
 KOMPLEXNÍ MODEL ACIDOBAZICKÉ ROVNOVÁHY KRVE KOMPLEXNÍ MODEL ACIDOBAZICKÉ ROVNOVÁHY KRVE Jiří Kofránek Anotace Klasický Siggaard-Andersenův nomogram, široce využívaný v klinické praxi pro vyhodnocování
KOMPLEXNÍ MODEL ACIDOBAZICKÉ ROVNOVÁHY KRVE KOMPLEXNÍ MODEL ACIDOBAZICKÉ ROVNOVÁHY KRVE Jiří Kofránek Anotace Klasický Siggaard-Andersenův nomogram, široce využívaný v klinické praxi pro vyhodnocování
POPISY LABORATORNÍCH VYŠETŘENÍ (Laboratorní příručka - příloha č. 1) Veškeré podrobné údaje o laboratorních metodách, jejich
 POPISY LABORATORNÍCH VYŠETŘENÍ (Laboratorní příručka - příloha č. 1) Veškeré podrobné údaje o laboratorních metodách, jejich indikacích a interpretaci, získáte na stránkách Encyklopedie laboratorní medicíny
POPISY LABORATORNÍCH VYŠETŘENÍ (Laboratorní příručka - příloha č. 1) Veškeré podrobné údaje o laboratorních metodách, jejich indikacích a interpretaci, získáte na stránkách Encyklopedie laboratorní medicíny
LCH/PAK01. 5 hodin cvičení
 Studijní program : Porodní asistence bakalářské studium - kombinovaná forma Název předmětu : Klinická biochemie Rozvrhová zkratka : LCH/PAK01 Rozvrh výuky : 5 hodin přednášek 5 hodin cvičení Zařazení výuky
Studijní program : Porodní asistence bakalářské studium - kombinovaná forma Název předmětu : Klinická biochemie Rozvrhová zkratka : LCH/PAK01 Rozvrh výuky : 5 hodin přednášek 5 hodin cvičení Zařazení výuky
Pitný režim. PaedDr. & Mgr. Hana Čechová
 Pitný režim PaedDr. & Mgr. Hana Čechová OSNOVA 1. Pitný režim 2. Vodní bilance 3. Kolik tekutin přijmout 4. Jak na pitný režim 5. Co pít 6. Voda 7. Perlivá či neperlivá 8. Minerální vody 9. Obsah zdravotně
Pitný režim PaedDr. & Mgr. Hana Čechová OSNOVA 1. Pitný režim 2. Vodní bilance 3. Kolik tekutin přijmout 4. Jak na pitný režim 5. Co pít 6. Voda 7. Perlivá či neperlivá 8. Minerální vody 9. Obsah zdravotně
Úprava podzemních vod
 Úprava podzemních vod 1 Způsoby úpravy podzemních vod Neutralizace = odkyselování = stabilizace vody odstranění CO 2 a úprava vody do vápenato-uhličitanové rovnováhy Odstranění plynných složek z vody (Rn,
Úprava podzemních vod 1 Způsoby úpravy podzemních vod Neutralizace = odkyselování = stabilizace vody odstranění CO 2 a úprava vody do vápenato-uhličitanové rovnováhy Odstranění plynných složek z vody (Rn,
Acidobazická rovnováha pro pokročilé. František Duška KAR FNKV
 Acidobazická rovnováha pro pokročilé František Duška KAR FNKV 28 letý muž, alkoholik. Přichází pro 3 dny trvající zvracení. Zmatený, tachykardie 134/min, jinak ale hemodynamicky stabilní, fyzikální nález
Acidobazická rovnováha pro pokročilé František Duška KAR FNKV 28 letý muž, alkoholik. Přichází pro 3 dny trvající zvracení. Zmatený, tachykardie 134/min, jinak ale hemodynamicky stabilní, fyzikální nález
Pro zředěné roztoky za konstantní teploty T je osmotický tlak úměrný molární koncentraci
 TRANSPORTNÍ MECHANISMY Transport látek z vnějšího prostředí do buňky a naopak se může uskutečňovat dvěma cestami - aktivním a pasivním transportem. Pasivním transportem rozumíme přenos látek ve směru energetického
TRANSPORTNÍ MECHANISMY Transport látek z vnějšího prostředí do buňky a naopak se může uskutečňovat dvěma cestami - aktivním a pasivním transportem. Pasivním transportem rozumíme přenos látek ve směru energetického
Seznam laboratorních vyšetření
 Seznam laboratorních vyšetření Albumin - odpad v moči (mikroalbuminurie) (81675) Odběrový systém: sklo nebo plast bez úpravy Materiál: moč, maximální doba pro doručení do laboratoře: 4 hodiny při 15-25
Seznam laboratorních vyšetření Albumin - odpad v moči (mikroalbuminurie) (81675) Odběrový systém: sklo nebo plast bez úpravy Materiál: moč, maximální doba pro doručení do laboratoře: 4 hodiny při 15-25
Seznam vyšetření biochemie a hematologie
 Seznam vyšetření biochemie a hematologie BIOCHEMIE NÁZEV: Glukosa POUŽITÍ: Stanovení koncentrace glukosy v séru (plazmě) a v moči JEDNOTKY KONCENTRACE: mmol/l (sérum, plazma) g% (sbíraná moč) g (odpad
Seznam vyšetření biochemie a hematologie BIOCHEMIE NÁZEV: Glukosa POUŽITÍ: Stanovení koncentrace glukosy v séru (plazmě) a v moči JEDNOTKY KONCENTRACE: mmol/l (sérum, plazma) g% (sbíraná moč) g (odpad
Krevní plazma organické a anorganické součásti, význam minerálů a bílkovin krevní plazmy. Somatologie Mgr. Naděžda Procházková
 Krevní plazma organické a anorganické součásti, význam minerálů a bílkovin krevní plazmy. Somatologie Mgr. Naděžda Procházková Krevní plazma definice: Tekutá složka krve Nažloutlá, vazká tekutina Složení
Krevní plazma organické a anorganické součásti, význam minerálů a bílkovin krevní plazmy. Somatologie Mgr. Naděžda Procházková Krevní plazma definice: Tekutá složka krve Nažloutlá, vazká tekutina Složení
Kyselé deště, rozpouštění CO 2 ve vodě
 Kyselé deště, rozpouštění CO 2 ve vodě vzorová úloha (ZŠ) Jméno Třída.. Datum.. 1 Teoretický úvod Cílem úlohy je zjistit hodnotu ph teplé a studené vody vlivem rozpouštění CO 2 ve vodě. Podobný děj probíhá
Kyselé deště, rozpouštění CO 2 ve vodě vzorová úloha (ZŠ) Jméno Třída.. Datum.. 1 Teoretický úvod Cílem úlohy je zjistit hodnotu ph teplé a studené vody vlivem rozpouštění CO 2 ve vodě. Podobný děj probíhá
Obecná a anorganická chemie. Halogenovodíky a halogenovodíkové kyseliny
 Šablona č. I, sada č. 2 Vzdělávací oblast Vzdělávací obor Tematický okruh Téma Člověk a příroda Chemie Obecná a anorganická chemie Halogenovodíky a halogenovodíkové kyseliny Ročník 9. Anotace Očekávaný
Šablona č. I, sada č. 2 Vzdělávací oblast Vzdělávací obor Tematický okruh Téma Člověk a příroda Chemie Obecná a anorganická chemie Halogenovodíky a halogenovodíkové kyseliny Ročník 9. Anotace Očekávaný
) se ve vodě ihned rozpouští za tvorby amonných solí (iontová, disociovaná forma NH 4+ ). Vzájemný poměr obou forem závisí na ph a teplotě.
 Amoniakální dusík Amoniakální dusík se vyskytuje téměř ve všech typech vod. Je primárním produktem rozkladu organických dusíkatých látek živočišného i rostlinného původu. Organického původu je rovněž ve
Amoniakální dusík Amoniakální dusík se vyskytuje téměř ve všech typech vod. Je primárním produktem rozkladu organických dusíkatých látek živočišného i rostlinného původu. Organického původu je rovněž ve
Metalografie ocelí a litin
 Metalografie ocelí a litin Metalografie se zabývá pozorováním a zkoumáním vnitřní stavby neboli struktury kovů a slitin. Dále také stanoví, jak tato struktura souvisí s chemickým složením, teplotou a tepelným
Metalografie ocelí a litin Metalografie se zabývá pozorováním a zkoumáním vnitřní stavby neboli struktury kovů a slitin. Dále také stanoví, jak tato struktura souvisí s chemickým složením, teplotou a tepelným
Aplikace elektromigračních technik
 Aplikace elektromigračních technik Capillary electrophoresis D.L.Barker High Performance Capillary electrophoresis M.G. Khaledi Analysis and detection by capillary electrophoresis M.L.Marina (ed.) Electrophoresis
Aplikace elektromigračních technik Capillary electrophoresis D.L.Barker High Performance Capillary electrophoresis M.G. Khaledi Analysis and detection by capillary electrophoresis M.L.Marina (ed.) Electrophoresis
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115
 Číslo projektu: Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo šablony: 26 Název materiálu: Ročník: Identifikace materiálu: Jméno autora: Předmět: Tematický celek: Anotace: CZ.1.07/1.5.00/3.010
Číslo projektu: Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo šablony: 26 Název materiálu: Ročník: Identifikace materiálu: Jméno autora: Předmět: Tematický celek: Anotace: CZ.1.07/1.5.00/3.010
MMN, a.s. Oddělení laboratoře Metyšova 465, Jilemnice
 Vyšetření: 1. Kvantitativní stanovení albuminu v lidském séru a Albumin 2. Kvantitativní stanovení katalytické aktivity ALT ALT 3. Kvantitativní stanovení katalytické aktivity AST AST 4. Kvantitativní
Vyšetření: 1. Kvantitativní stanovení albuminu v lidském séru a Albumin 2. Kvantitativní stanovení katalytické aktivity ALT ALT 3. Kvantitativní stanovení katalytické aktivity AST AST 4. Kvantitativní
 Renální tubulární acidózy Akutní selhání ledvin Prerenální syndrom je dán schopností ledvin udržet v organismu sůl a vodu tváří v tvář zaznamenané hypoperfúzi ledvin. Při obnovení renální hemodynamiky
Renální tubulární acidózy Akutní selhání ledvin Prerenální syndrom je dán schopností ledvin udržet v organismu sůl a vodu tváří v tvář zaznamenané hypoperfúzi ledvin. Při obnovení renální hemodynamiky
Název: Vypracovala: Datum: 7. 2. 2014. Zuzana Lacková
 Název: Vypracovala: Zuzana Lacková Datum: 7. 2. 2014 Reg.č.projektu: CZ.1.07/2.4.00/31.0023 Název projektu: Partnerská síť centra excelentního bionanotechnologického výzkumu MĚLI BYCHOM ZNÁT: informace,
Název: Vypracovala: Zuzana Lacková Datum: 7. 2. 2014 Reg.č.projektu: CZ.1.07/2.4.00/31.0023 Název projektu: Partnerská síť centra excelentního bionanotechnologického výzkumu MĚLI BYCHOM ZNÁT: informace,
TVRDOST, VODIVOST A ph MINERÁLNÍ VODY
 TRDOST, ODIOST A ph MINERÁLNÍ ODY A) STANOENÍ TRDOSTI MINERÁLNÍCH OD Prinip: Tvrdost, resp. elková tvrdost vody, je způsobena obsahem solí alkalikýh zemin vápník, hořčík, stronium a barium. Stronium a
TRDOST, ODIOST A ph MINERÁLNÍ ODY A) STANOENÍ TRDOSTI MINERÁLNÍCH OD Prinip: Tvrdost, resp. elková tvrdost vody, je způsobena obsahem solí alkalikýh zemin vápník, hořčík, stronium a barium. Stronium a
NaLékařskou.cz Přijímačky nanečisto
 alékařskou.cz Chemie 2016 1) Vyberte vzorec dichromanu sodného: a) a(cr 2 7) 2 b) a 2Cr 2 7 c) a(cr 2 9) 2 d) a 2Cr 2 9 2) Vypočítejte hmotnostní zlomek dusíku v indolu. a) 0,109 b) 0,112 c) 0,237 d) 0,120
alékařskou.cz Chemie 2016 1) Vyberte vzorec dichromanu sodného: a) a(cr 2 7) 2 b) a 2Cr 2 7 c) a(cr 2 9) 2 d) a 2Cr 2 9 2) Vypočítejte hmotnostní zlomek dusíku v indolu. a) 0,109 b) 0,112 c) 0,237 d) 0,120
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CHLORID SODNÝ 0,9% BAXTER 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii chloridum: 9,0 g/l Jeden ml roztoku obsahuje 9 mg natrii chloridum mmol/l: Na + : 154
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CHLORID SODNÝ 0,9% BAXTER 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii chloridum: 9,0 g/l Jeden ml roztoku obsahuje 9 mg natrii chloridum mmol/l: Na + : 154
ŠKOLA (SIMULAČNÍ) HROU VYUŽITÍ SIMULAČNÍCH MODELŮ ACIDOBAZICKÉ ROVNOVÁHY V E-LEARNIGNOVÉ APLIKACI
 Škola (simulační) hrou využití simulačních modelů acidobazické rovnováhy v e-learningových aplikacích 83 ŠKOLA (SIMULAČNÍ) HROU VYUŽITÍ SIMULAČNÍCH MODELŮ ACIDOBAZICKÉ ROVNOVÁHY V E-LEARNIGNOVÉ APLIKACI
Škola (simulační) hrou využití simulačních modelů acidobazické rovnováhy v e-learningových aplikacích 83 ŠKOLA (SIMULAČNÍ) HROU VYUŽITÍ SIMULAČNÍCH MODELŮ ACIDOBAZICKÉ ROVNOVÁHY V E-LEARNIGNOVÉ APLIKACI
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls176277/2011 a sp.zn. sukls129930/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 10% Braun koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu
sp.zn. sukls176277/2011 a sp.zn. sukls129930/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 10% Braun koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu
ZÁKLADNÍ ANALYTICKÉ METODY Vážková analýza, gravimetrie. Jana Sobotníková VÁŽKOVÁ ANALÝZA, GRAVIMETRIE
 Jana Sobotníková ZÁKLADÍ AALYTIKÉ METODY Vážková analýza, gravimetrie ke stažení v SIS nebo Moodle www.natur.cuni.cz/~suchan suchan@natur.cuni.cz jana.sobotnikova@natur.cuni.cz telefon: 221 951 230 katedra
Jana Sobotníková ZÁKLADÍ AALYTIKÉ METODY Vážková analýza, gravimetrie ke stažení v SIS nebo Moodle www.natur.cuni.cz/~suchan suchan@natur.cuni.cz jana.sobotnikova@natur.cuni.cz telefon: 221 951 230 katedra
3. STRUKTURA EKOSYSTÉMU
 3. STRUKTURA EKOSYSTÉMU 3.4 VODA 3.4.1. VLASTNOSTI VODY VODA Voda dva významy: - chemická sloučenina 2 O - přírodní roztok plynné kapalné pevné Skupenství Voda jako chemická sloučenina 1 δ+ Základní fyzikální
3. STRUKTURA EKOSYSTÉMU 3.4 VODA 3.4.1. VLASTNOSTI VODY VODA Voda dva významy: - chemická sloučenina 2 O - přírodní roztok plynné kapalné pevné Skupenství Voda jako chemická sloučenina 1 δ+ Základní fyzikální
Souhrn údajů o přípravku PHOXILIUM 1,2 MMOL/L FOSFÁT
 Příloha č. 2a k rozhodnutí o změně registrace sp. zn. sukls58787/2011 Souhrn údajů o přípravku PHOXILIUM 1,2 MMOL/L FOSFÁT 1. Název přípravku PHOXILIUM 1,2 mmol/l fosfát Roztok pro hemodialýzu/hemofiltraci
Příloha č. 2a k rozhodnutí o změně registrace sp. zn. sukls58787/2011 Souhrn údajů o přípravku PHOXILIUM 1,2 MMOL/L FOSFÁT 1. Název přípravku PHOXILIUM 1,2 mmol/l fosfát Roztok pro hemodialýzu/hemofiltraci
Technologie pro úpravu bazénové vody
 Technologie pro úpravu GHC Invest, s.r.o. Korunovační 6 170 00 Praha 7 info@ghcinvest.cz Příměsi významné pro úpravu Anorganické látky přírodního původu - kationty kovů (Cu +/2+, Fe 2+/3+, Mn 2+, Ca 2+,
Technologie pro úpravu GHC Invest, s.r.o. Korunovační 6 170 00 Praha 7 info@ghcinvest.cz Příměsi významné pro úpravu Anorganické látky přírodního původu - kationty kovů (Cu +/2+, Fe 2+/3+, Mn 2+, Ca 2+,
