Fázové změny. Manuál k programu
|
|
|
- Bohumil Kovář
- před 8 lety
- Počet zobrazení:
Transkript
1 Fázové změny Manuál k programu Jiří Mazurek 2009
2 OBSAH Úvod O programu Kapitoly programu Jak pracovat s programem Úvodní kapitola Tání Tuhnutí Změny objemu těles při tání a tuhnutí, závislost teploty tání na tlaku Sublimace a desublimace Vypařování a var Kapalnění (kondenzace) Fázový diagram Vodní pára v atmosféře Změny skupenství v praxi Výstupní test Pojmová mapa změn skupenství Laboratorní práce Dotazník k programu
3 Úvod Manuál k programu Fázové změny obsahuje údaje o samotném programu, jeho lokalizaci, účelu a určení, a také kompletní obsah programu včetně odkazů na internetové zdroje (obrázky, videa apod.). Manuál je určen především učitelům, kteří zvaţují uţití programu ve výuce fyziky. 1 O programu Program Fázové změny byl vytvořen v rámci disertační práce Počítačem podporovaná výuka fyziky v tématu fázové změny v průběhu studia oboru Teorie vzdělávání fyzice na Přírodovědecké fakultě Ostravské univerzity Mgr. Jiřím Mazurkem. Práce na programu začaly na začátku roku 2008, první první verze programu byla vyzkoušena během dvou fází předvýzkumu na jaře a na podzim roku Program byl dokončen v prosinci 2008, poté byla provedena jeho validace a nový software byl úspěšně vyzkoušen během pedagogického experimentu na vzorku cca 150 ţáků gymnázií. Program je vytvořen v jazyce HTML a je umístěn na adrese Funguje pod operačními systémy Windows XP a vyšších verzích, a je optimalizován pro prohlíţeče Mozilla Firefox 1.5 a vyšší, a Internet Explorer 6. S programem je spojena databáze MySQL, v níţ se ukládají výsledky výstupního testu ţáků a odpovědi na dotazník. Program je určen ţákům druhého ročníku čtyřletých gymnázií a odpovídajícím ročníkům víceletých gymnázií. Obsahuje změny skupenství s přesahem na změny klimatu (tání ledovců vlivem globálního oteplování). Rozsah jím dodané výuky je 6 aţ 8 vyučovacích hodin. Obsah programu byl zpracován na základě učebnice Molekulová fyzika a termika autorů Bartušky a Svobody. Program je určen k samostatné práci ţáků, ale můţe být pouţit i jako opora pro výklad učitele. Text k jednotlivým kapitolám je namluven ve formátu MP 3, je moţné jej z programu stáhnout do přehrávače MP 3 (nebo jiného) a učit se například cestou autobusem do školy. Program můţe slouţit k učení i nevidomým. Součástí programu je registrace, login a následující kapitoly: Úvod aneb Jak pracovat s programem, Úvodní kapitola, Tání, Tuhnutí, Změny objemu těles při tání a tuhnutí, závislost teploty tání na tlaku, Sublimace a desublimace, Vypařování a var, Kapalnění, Fázový diagram, Vodní pára v atmosféře, Změny skupenství v praxi, Laboratorní práce na určení měrného skupenského tepla tání ledu, 3
4 Pojmová mapa Fázových změn (ţáci mohou být pobídnuti k tomu, aby se pokusili vytvořit svou vlastní pojmovou mapu změn skupenství), Interaktivní výstupní test, Elektronický dotazník. Kaţdou kapitolu tvoří čtyři základní bloky: Úvod obsahuje vstup do dané problematiky, otázky a fotografie, které by měly podnítit zvědavost ţáků a motivovat je k dalšímu učení. Učivo obsahuje výukový text, fotografie, animace, videa a také odkazy na některé internetové adresy, například v elektronické encyklopedii Wikipedia. V programu je zařazeno celkem 22 statických obrázků, 2 vytvořené animace tuhnutí vody a vypařování, 3 vlastními silami natočená videa kondenzace, varu vody za sníţeného tlaku a regelace ledu, a dalších 8 videí z jiných webových stránek, například na tání ledovců nebo tuhnutí vody. Úkoly jsou formulovány v podobě otázek a úloh. Jejich součástí je i nápověda a výsledky. Při tvorbě a výběru úloh byly zohledněny jednak kurikulární poţadavky (RVP, ŠVP, poţadavky ke státní maturitě), a také bylo přihlédnuto k podobě a mnoţství úloh ve stávající učebnici Bartušky a Svobody Molekulová fyziky a termika. Soubor úloh v programu byl zpracován tak, aby obsahoval i problémy vyšších kategorií podle Bloomovy taxonomie kognitivních cílů, resp. taxonomie učebních úloh podle Tollingerové, převládají zde úlohy na porozumění a aplikaci. Program obsahuje 25 úloh, z toho 8 výpočtových, 16 problémových a 1 experimentální (ve formě laboratorní práce na určení měrného skupenského tepla tání ledu). Ke všem úlohám je ţákovi poskytnuta nápověda a řešení. Shrnutí poskytuje přehled toho nejdůleţitějšího z kaţdé kapitoly, slouţí ţákům jako opora pro samostatný zápis do sešitu a také k opakování učiva. Uvedné bloky jsou pro přehlednost uvozeny ikonami a je moţné jimi procházet v libovolném pořadí (je aplikován konstruktivistický přístup). Ţáci jsou vedeni instrukcemi uvedenými v oddíle Jak pracovat s programem. Učitel nemusí do procesu učení zasahovat. Z didaktického hlediska je funkcí Úvodu motivace ţáka, funkcí Učiva a Úkolů expozice, a funkcí Shrnutí fixace učební látky. Formativní hodnocení ţáka poskytují odpovědi uvedené u kaţdé otázky a úlohy v Úkolech, sumativní hodnocení ţáka je realizováno výstupním testem na stránkách programu. 2 Kapitoly programu V následujících kapitolách je uvedeno přesné znění textu a rozloţení obrázků, animací a videí v jednotlivých kapitolách programu. Modře vybarvené pojmy obsahují odkaz na jiné webové stránky. 2.1 Jak pracovat s programem Kaţdá kapitola obsahuje: - Co se v hodině naučíš - Otázky a Úkoly - Učivo - Shrnutí na konci kapitoly - Ikony, které pomáhají v orientaci. 4
5 - Úvod. - Otázky. - Učivo. - Úkoly. - Problémová úloha. - Shrnutí kapitoly. Při práci s programem postupuj následovně: 1. Přečti si Úvod kapitoly, Otázky a Úkoly, ať víš, co budeš během hodiny řešit. 2. Prostuduj si celou kapitolu a najdi v ní odpovědi na zadané otázky. 3. Udělej si do sešitu stručný zápis (můţeš pouţít shrnutí na konci kapitoly, ale vlastní zápis je mnohem lepší) 4. Vyřeš do sešitu zadané úkoly. 2.2 Úvodní kapitola Látky se v přírodě mohou vyskytovat v různých skupenstvích. Například látka voda (H 2 O) se vyskytuje ve formě ledu, vody nebo páry. Jaká skupenství látek znáš? Jaká je jejich vnitřní struktura? Jak se nazývají děje, při kterých se mění skupenství? Dokáţeš uvést nějaké příklady? Pevné látky Většina pevných látek je sloţena z částic atomů nebo molekul, které jsou pravidelně uspořádány v takzvané krystalové mříţce. Částice v krystalové mříţce chaoticky kmitají kolem rovnováţné polohy. S rostoucí teplotou se amlitudy výchylky kmitů zvětšují. Střední vzdálenosti mezi částicemi jsou malé, potenciální energie částic je větší neţ jejich kinetická energie. Některé pevné látky, jako např. vosk nebo sklo, nemají pravidelně uspořádáné částice. Takovým látkám se říká amorfní (beztvaré). Pevné látky mají stálý tvar i objem. Kapalné Molekuly kapalin jsou k sobě přitahovány slaběji neţ částice pevných látek. Mohou se tedy volněji pohybovat a měnit si svá místa kapaliny jsou tekuté. Potenciální energie molekul kapalin je přibliţně rovna jejich kinetické energii. Kapaliny mají stálý objem, 5
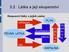
6 ale nemají stálý tvar. Volný povrch kapaliny je v klidu vodorovný a nazývá se hladina. Kapalné skupenství kovů, např.ţeleza, se označuje pojmem tavenina. Plynné Molekuly plynů jsou od sebe vzdáleny více neţ u pevných látek nebo kapalin a působí na sebe jen při vzájemných sráţkách. Pohybují se náhodně všemi směry a jejich rychlost roste s teplotou. Kinetická energie molekul je mnohem vyšší neţ jejich potenciální energie. Plyny nemají stálý ani tvar ani objem. Plazma Bývá často uváděno jako čtvrté skupenství látek. Je to ionizovaný plyn o vysoké teplotě. Plazma můţe mít formu blesku nebo polární záře, také Slunce a jiné hvězdy je tvořeno plazmou. Děje, při kterých se mění skupenství látek, se nazývají změny skupenství. Jednotlivé děje znázorňuje tento diagram: Červené šipky znázorňují děje, při kterých se musí energie látce dodávat. Modré šipky znamenají, ţe látka teplo odevzdává svému okolí. 1. Do sešitu si obkresli diagram se změnami skupenství. 2. Ke kaţdé změně skupenství si uveď jeden příklad z běţného ţivota, (pokud tě ţádný nenapadá, zkus nějaký najít zde). Pro zvídavé: Změny skupenství se řadí mezi fázové změny. Fází se ve fyzice rozumí část termodynamického systému, která má všude stejné vlastnosti. Změna fáze se nazývá fázový přechod. Mezi fázové přechody patří všechny změny skupenství, ale také například změna vodiče v supravodič nebo paramagnetického materiálu na feromagnetický. 6
7 Látky se v přírodě vyskytují ve třech skupenstvích: pevném, kapalném a plynném (za 4. skupenství je povaţována plazma). Děje, při kterých se mění skupenství látek, se nazývají změny skupenství. Známe 6 změn skupenství: tání, tuhnutí, vypařování, kondenzace, sublimace a desublimace. V dalších kapitolách postupně probereme všech šest změn skupenství a povíme si o jejich uţití v kaţdodenním ţivotě. 2.3 Tání 7
8 Tání je jev, s nímţ se setkáváme v přírodě především na jaře. Sníh v údolích taje, řeky se plní vodou a na některých místech dochází k povodním. Koncem dubna uţ bývá sněhu málo i na našich nejvyšších horách a lyţařská sezóna končí. Tání pozorujeme i u horských ledovců, například v Alpách (viz fotografie výše). Tyto ledovce se během posledních 150 let značně zkrátily. V posledních letech se zmenšuje i rozloha ledu v Arktidě. Příčinou je globální oteplování zemského povrchu a atmosféry. Můţe nás tání ledovců v budoucnosti nějak ohrozit? Co je to vlastně tání? A za jakých podmínek probíhá? V této kapitole se dozvíš, co se děje, kdyţ látka taje. Naučíš se spočítat teplo potřebné k roztání ledu. Zjistíš, co by se stalo s hladinou moří, kdyby najednou roztál veškerý led v Grónsku. Je moţné nějak změnit teplotu tání ledu? Co se děje uvnitř krystalické látky, kdyţ taje? Co vyjadřuje veličina měrné skupenské teplo tání? Je měrné skupenské teplo tání ledu vysoké, nebo nízké? Co by se dělo na jaře, kdyby tato hodnota byla menší? Proč na světě v současnosti taje většina horských ledovců? Zvýšila by se hladina moří, kdyby roztál všechen mořský led (= led na moři) v Arktidě? tání ledovců (video), tání ledovců (wikipedia) Kdyţ zahříváme led, při teplotě 0 C začne tát. Tato teplota se nazývá teplota tání ledu a značí se t t. Jiné krystalické látky mají jiné teploty tání (viz tabulka). Amorfní látky, jako je sklo nebo vosk, nemají určitou teplotu tání. Při zahřívání měknou, aţ se přemění v kapalinu. Teplota tání závisí na tlaku, u většiny látek se s rostoucím tlakem teplota tání zvyšuje. Teplotu tání ledu je moţné sníţit tím, ţe se posype solí. Směs ledu a soli taje při niţší teplotě neţ 0 C. Led taje, i kdyţ je mráz, a dá se snadno odhrabat a uklidit. Těleso o teplotě tání potřebuje k přeměně na kapalinu určité mnoţství tepla. Toto teplo se nazývá skupenské teplo tání L t. Je tím větší, čím větší je hmotnost tělesa (eskymácké iglů určitě spotřebuje při tání více tepla neţ kostka ledu v dlani). Jeho jednotkou je joule (J) 8
9 Teplo, které potřebuje ke změně skupenství jeden kilogram dané látky, se nazývá měrné skupenské teplo tání l t (l t pro jednotlivé látky viz tabulka). Jednotkou je J/kg. Tabulka tání látka teplota tání ( C) měrné skup. teplo tání (kj/kg) led olovo cín ţelezo měď Skupenské teplo a měrné skupenské teplo spolu souvisí podle vztahu: kde m je hmotnost látky, která roztála. Co se děje v krystalické látce, kdyţ taje? Nejprve ji musíme zahřát na teplotu tání. Částice v krystalové mříţce při tomto zahřívání získávají kinetickou energii a kmitají kolem rovnováţných poloh se stále větší amlitudou výchylky. Při teplotě tání uţ mají částice takovou energii, ţe se začínají uvolňovat z mříţky. Ta se hroutí a látka taje. Během tání se teplota látky nezvyšuje, i kdyţ se látce dodává skupenské teplo tání. Toto teplo se přemění na vnitřní energii látky. To znamená, ţe voda o teplotě 0 C má vyšší vnitřní energii neţ stejné mnoţství ledu o teplotě 0 C., Pokud by roztál veškerý led v Grónsku, o kolik by se zvýšila hladina moří? Stalo by se totéţ, pokud by roztál mořský led v Arktidě? Největší obavy vzbuzuje tání ledovců kvůli zvýšení hladiny moří. Pak by hrozilo zaplavení nízko poloţených oblastí souše a některých ostrovů. Údaje o růstu hladiny moří lze zjistit například z Wikipedie. - O kolik se zvýšila hladina moří za 20. století? (odpověď najdi na obrázku Recent sea level rise v anglické wikipedii. - Kdy začalo zvyšování hladiny moří? (prohlédni si obrázek Post-Glacial sea level rise na 9
10 téţe stránce). Z obrázku navíc zjisti, jestli se hladina moří v průběhu tisíciletí zrychluje nebo zpomaluje. - Jak se bude zvyšovat hladina moří ve 21. století? (vyhledej tento údaj v odstavci Future sea level rise na téţe stránce) - Co si myslíš ty sám? Jsou zjištěné údaje důvodem k obavám? 1. Vypočti, kolik tepla je zapotřebí k roztání 4 kg ledu o teplotě 0 C. 2. Vypočti teplo nutné k přeměně 2 kg ledu o teplotě 10 C na vodu o teplotě 50 C, c ledu = 2100 J/kgK, c vody = 4200 J/kgK. 3. Ledu o hmotnosti 1 kg bylo dodáváno teplo. Situaci zachycuje tento graf. Popiš, co se dělo v jednotlivých částech grafu. 4. Do sklenice s vodou o teplotě 0 C nasypeme sníh o teplotě 0 C. Co se bude dít? Zmrzne voda? Nebo naopak sníh roztaje? Vysvětli. 5. Ve sklenici naplněné po okraj vodou plave kousek ledu. Sklenici začneme zahřívat, led bude tát. Přeteče voda sklenici, nebo ne? [Voda nepřeteče. Při tání se led mění na vodu, která má menší objem. Objem takto vzniklé vody přesně vyplní objem ponořené části ledu.] Při tání se mění pevná látka v kapalnou. Tání krystalických látek probíhá při určité teplotě teplotě tání. Teplota tání ledu je 0 C. Při tání je látce nutné dodávat teplo skupenské teplo tání. 10
11 2.4 Tuhnutí Jak probíhá tuhnutí? Za jaké teploty látky tuhnou? Kdy vzniká tuhnutím polykrystal a kdy monokrystal? Jak se nazývá kapalné skupenství kovů? Je skupenské teplo tuhnutí pro danou látku stejné jako skupenské teplo tání? Je moţné ochladit vodu pod 0 C? Opakem tání je tuhnutí. Kdyţ ochlazujeme kapalinu o teplotě tuhnutí, mění se v pevnou látku. Teplota tuhnutí je shodná s teplotou tání, pro vodu je to 0 C. Při tuhnutí vznikají v kapalině nejprve zárodky krystalické struktury, tzv. krystalizační jádra (krystalizačními jádra vznikají kolem drobných zrnek a jiných nečistot v kapalině). Tato jádra rostou a spojují se, aţ se objem celé kapaliny promění v polykrystal. Pokud v kapalině vznikne jen jedno krystalizační jádro, promění se kapalina v monokrystal. Toho se vyuţívá v technické praxi. Do taveniny kovu se vloţí malé krystalizační jádro, kolem kterého tavenina ztuhne v mnohem větší monokrystal. Pokud je kapalina velmi čistá a neobsahuje krystalizační jádra, je moţné ji přechladit pod teplotu tuhnutí. Vodu je moţné přechladit aţ na -15 C. (Pak do ní stačit vhodit zrnko a téměř okamţitě zmrzne...) Při tuhnutí látka odevzdává teplo do okolí. Toto Skupenské teplo tuhnutí L t je stejné jako skupenské teplo tání. Zde můţete najít videa z tn.cz ukazující tuhnutí v praxi. Animace tuhnutí 1. Vypočti, kolik tepla se uvolní do okolí, jestliţe při teplotě 0 C zmrzne kaluţ vody o ploše 2 m 2 a hloubce 1 cm. 2. Proč musí být skupenské teplo tání stejné jako skupenské teplo tuhnutí? (uvaţuj zákon zachování energie) 11
12 Tuhnutí je opakem tání, v látce se tvoří krystalická struktura. Teplota tání je rovna teplotě tuhnutí (0 C pro vodu). Při tuhnutí látka odevzdává svému okolí skupenské teplo tuhnutí, které je rovno skupenskému teplu tání. 2.5 Změny objemu těles při tání a tuhnutí, závislost teploty tání na tlaku Láhev naplníme vodou, uzavřeme zátkou a dáme ji do mrazničky (nebo na balkón, pokud venku mrzne). Voda v láhvi zmrzne a led láhev roztrhne. Podobný jev můţeme pozorovat i v přírodě: mrznutí vody způsobuje rozrušování skal, ale také praskání vozovky nebo zdí domů. Co je příčinou výše zmíněných jevů? Jak se mění objem většiny látek při tání? Má větší hustotu voda nebo led? Čím je to způsobeno? Proč led zabraňuje promrzání jezer a rybníků? Jak souvisí tání ledu s bruslením? Většina látek zvětšuje při tání svůj objem, např. olovo o 3,4 %. Led patří mezi látky, které naopak při tání svůj objem zmenšují. Kdyţ do mezer mezi skalami pronikne voda a poté zmrzne na led, ten při zvětšování objemu skálu trhá a rozrušuje. Podobně působí led na silnice. Proto bývají silnice po zimě ve špatném stavu a musí se v nich lepit díry. Z většího objemu ledu v porovnání s vodou vyplývá jeho niţší hustota (led 918 kg/m 3, voda 1000 kg/m 3 ). Ta je způsobena zvláštní krystalovou strukturou ledu: jsou v ní prázdné dutiny, částice jsou tak od sebe vzdáleny více neţ ve vodě. Díky niţší hustotě led na vodě plave. Led je dobrým tepelným izolantem (viz iglů), a proto zabraňuje promrzání vody do větších hloubek. Tím umoţňuje vodním ţivočichům přečkat zimu. Teplota tání krystalické látky závisí na okolním tlaku. U látek, které při tání zvětšují svůj objem, vede zvýšení tlaku ke zvýšení teploty tání. U ledu je to naopak: zvýšením tlaku se teplota tání sniţuje. 12
13 Kluzkost ledu při bruslení se dříve vysvětlovala tak, ţe led pod bruslemi taje díky většímu tlaku. Toto vysvětlení ale není správné. Ve skutečnosti led pod bruslemi taje kvůli teplu vznikajícímu třením bruslí o led. 1. Hmotnost bruslaře je 70 kg, plocha noţů bruslí, na kterých stojí, je 2 cm 2. Vypočti, o kolik se sníţí teplota tání ledu pod bruslemi vlivem zvýšeného tlaku na led. (U ledu způsobuje zvýšení tlaku o 10 5 Pa pokles teploty tání o 0,0075 C). 2. Následující graf zachycuje závislost teploty tání na tlaku jisté látky křivku tání. Jedná se o látku, u které se s rostoucím tlakem teplota tání sniţuje, nebo zvyšuje? Při tání látky mění svůj objem: led svůj objem zmenšuje, většina látek naopak zvětšuje. Teplota tání látek závisí na vnějším tlaku. Při zvyšování tlaku se teplota tání ledu sniţuje, u většiny látek je to naopak. 2.6 Sublimace a desublimace 13
14 Jak vzniká jinovatka? Proč schne prádlo i při teplotě pod bodem mrazu? Proč ubývá na polích sněhu i při teplotách pod bodem mrazu? Přeměna pevné látky přímo na plynnou se nazývá sublimace. Můţeme ji pozorovat především u látek vonných nebo zapáchajících, ale také u sněhu nebo jódu. K sublimaci je látce nutné dodat skupenské teplo sublimační L s. Platí: kde l s je měrné skupenské teplo sublimační. Pro led při teplotě 0 C je l s = 2,8 MJ/kg. Příkladem sublimace je mizení sněhu za teplot niţších neţ 0 C nebo schnutí prádla při teplotách pod bodem mrazu. Sublimují také vonné nebo zapáchající pevné látky. Přeměna látky ze skupenství plynného přímo na pevné se nazývá desublimace. Měrné skupenské teplo desublimační je pro danou látku stejné jako měrné skupenské teplo sublimační. Při desublimaci se teplo uvolňuje. Příkladem desublimace je tvorba jinovatky vodní pára se za teplot niţších neţ 0 C proměňuje na povrchu pevných látek v jemné ledové krystalky, viz obrázek níţe., 14
15 1. Vypočti, kolik tepla je zapotřebí k sublimaci 10 kg sněhu o teplotě 0 C. Shrnutí kapitoly Přeměna pevné látky přímo na plynnou se nazývá sublimace. Opačný děj se nazývá desublimace. Při sublimaci se spotřebovává skupenské teplo sublimační, při desublimaci se naopak totéţ skupenské teplo uvolňuje do okolí. Díky sublimaci cítíme vůně a zápach pevných látek, příkladem desublimace jinovatka. 2.7 Vypařování a var Co je to vypařování? Kde se s ním v ţivotě setkáváme? Proč nás voda osvěţuje během horkých letních dní? Proč horolezcům v Himalájích vře voda na čaj uţ při 70 C? Vypařování je přeměna kapalného skupenství v plynné (například vody v páru, viz obrázek na následující straně). Vypařování probíhá z povrchu kapaliny a probíhá při kaţdé teplotě, při níţ existuje kapalina. Rychlost vypařování závisí na: -teplotě kapaliny: s rostoucí teplotou kapaliny se výpar zvětšuje. -druhu kapaliny: těkavé kapaliny jako ether se vypařují rychleji, voda pomaleji -na povrchu kapaliny: větší plocha hladiny znamená větší výpar -na odsávání par: pokud páry odsáváme nebo odfoukáme, výpar se zvětšuje Při vypařování je nutné kapalině dodat skupenské teplo vypařování L v (skupenské teplo výparné). Platí vztah: kde l v je měrné skupenské teplo vypařování. Měrné skupenské teplo vody závisí na teplotě. Při teplotě 0 C je l v = 2,51 MJ/kg, při teplotě 100 C je l v = 2,26 MJ/kg., 15
16 Vypařování pomáhá lidem regulovat tělesnou teplotu. Kdyţ je příliš horko, člověk se potí, pot se vypařuje a přitom se tělu odnímá skupenské teplo vypařování kůţe i tělo se ochlazují. Podobně je moţné se ochladit tím, ţe se postříkáme vodou, která se v horku začne vypařovat (a nemusí jít o vodu přímo studenou). Molekuly kapaliny vykonávají neustálý neuspořádaný pohyb. Při vypařování se z kapaliny uvolňují nejrychlejší molekuly, dostávají se nad hladinu a vytvářejí páru. Tím klesá střední rychlost molekul kapaliny a kapalina se ochlazuje. Vypařování má tedy ochlazující efekt. Probíhá-li vypařování z celého objemu kapaliny, nazývá se tento děj var. V kapalině vznikají bubliny páry, které vystupují k hladině. Teplota, při níţ nastává var, se nazývá teplota varu (nebo také bod varu). Za normálního atmosferického tlaku je teplota varu vody 100 C. Teplota varu však závisí i na vnějším tlaku. K varu dochází tehdy, kdyţ se vyrovná tlak páry v kapalině s vnějším tlakem. Proto ve vysokých horách, kde je niţší tlak, vře voda při méně neţ 100 C (ve výšce m.n.m. je teplota varu asi 95 C). Var využíváme například: -K vaření. Speciálním případem je vaření v tlakovém (Papinově) hrnci, ve kterém vře voda aţ při 130 C. Tlakový hrnec umoţňuje vaření při vyšší teplotě, coţ zkracuje dobu vaření. -Ke sterilizace obvazů a chirurgických nástrojů. Jestliţe necháme kapalinu vypařovat v uzavřené nádobě, po čase se nad hladinou vytvoří pára, jejíţ hustota se uţ nebude měnit. Kapalina a její pára budou v rovnováze. Páru, která je v rovnováze s kapalinou, nazýváme Sytá pára. Při dané teplotě a tlaku je to maxmální moţné mnoţství páry nad kapalinou (proto se nazývá sytá nebo také nasycená pára). S rostoucí teplotou roste i tlak syté páry. Závislost tlaku syté páry na teplotě se nazývá křivka syté páry, značí se k p. Křivka syté páry je součástí fázového diagramu (viz 7. kapitola). Pára, která není sytá, se označuje jako přehřátá (přehřátou páru je moţné změnit na sytou páru ochlazením). 16
17 Animace: vypařování a kondenzace Video: var vody při sníţeném tlaku 1. Urči, kolik tepla je zapotřebí k vypaření čaje o teplotě 100 C, jestliţe šálek obsahuje 4 dl vody. 2. Proč se obrací a rozhazuje posekaná tráva, kdyţ se suší? 3. Proč na horký čaj nebo kávu foukáme, kdyţ je chceme ochladit? 4. V létě se lidé ochlazují tím, ţe se stříkají vodou. Voda nemusí být studená, a přesto má osvěţující efekt. Proč?(odpověď) Vypařování je přeměna kapalného skupenství v plynné (například vody v páru). K vypaření je nutné kapalině dodat skupenské teplo vypařování L v.vypařování probíhá z povrchu kapaliny a probíhá při kaţdé teplotě. Vypařování z celého objemu kapaliny se nazývá var. Teplota, při které kapalina vře, se nazývá teplota (bod) varu. Vypařováním vzniká pára. Pokud se kapalina vypařuje v uzavřené nádobě, ustálí se po čase rovnováha mezi vypařováním a kapalněním. Nad kapalinou vznikne sytá pára pára o maximální moţné hustotě pro danou teplotu. 2.8 Kapalnění (kondenzace) Kapalnění je přeměna plynné látky v kapalnou. Při kapalnění dochází k uvolnění skupenského tepla kondenzačního L k, které je rovno skupenskému teplu vypařování téţe látky při stejné teplotě. Platí: 17
18 Páru je moţné zkapalnit buď jejím ochlazením nebo stlačením. Ke kapalnění dochází na povrchu pevných látek, které se pokrývají kapičkami vody nebo ve volném prostoru takto vznikají oblaka nebo mlha. Video: kondenzace vodní páry kolem křídel proudového letadla Kapalnění a vypařování se vyuţívá také k získávání pitné vody z mořské vody. Tento proces se nazývá odsolování. Vyuţívá se ve státech s nedostatkem pitné vody: např. v Izraeli, Kuvajtu nebo Saudské Arábii. Video: kondenzace vodní páry na sklenici 1. Vypočti teplo, které se uvolní do okolí, jestliţe na zrcadle zkondenzuje 50 g vodní páry o teplotě 50 C (l t 50 = 2,4 MJ/kg). 2. Vodní pára o hmotnosti 2 kg a teplotě 100 C se nejprve kapalněním přemění ve vodu stejné teploty a potom ochladí na teplotu 60 C. Urči teplo, které se při tomto ději uvolní do okolí. Kapalnění (kondenzace) je přeměna plynné látky v kapalnou. Při kapalnění dochází k uvolnění skupenského tepla kondenzačního, které je rovno skupenskému teplu vypařování téţe látky při stejné teplotě. Kapalněním vznikají mlhy nebo oblaka. 18
19 2.9 Fázový diagram Jak se dají přehledně znázornit všechny stavy dané látky? Kde ve fázovém diagramu najdeme jednotlivá skupenství? Které křivky rozdělují fázový diagram na tři části? Jak se ve fázovém diagramu znázorní jednotlivé změny skupenství? Fázový diagram znázorňuje rovnováţné stavy různých skupenství (fází) jedné a téţe látky. Je rozdělen na tři části: Křivky oddělující jednotlivé části jsou: k t - křivka tání, k s křivka sublimační, k p křivka syté páry. Na křivce tání mohou vedle sebe existovat pevné a kapalné skupenství dané látky. Na křivce sublimační plyn a pevná látka a na křivce syté páry kapalina a plyn. Všechny tři křivky se protínají v bodě A, který se nazývá trojný bod. V tomoto bodě mohou vedle sebe existovat všechna tři skupenství. (Trojný bod vody má hodnotu T k = 273,16 K a p k = 610 Pa). Křivka syté páry končí v bodě K, který se nazývá kritický bod. V tomto bodě mizí rozhraní mezi kapalinou a párou, obě skupenství od sebe nelze rozeznat. Z fázového diagramu je vidět, ţe je moţné (i kdyţ v praxi obtíţné) přeměnit páru na kapalinu (nebo obráceně) bez změny skupenství tak, ţe se obejde kritický bod K! V obrázku níţe je tento děj znázorněn zelenou křivkou. 19
20 Ve fázovém diagramu můţeme znázornit děje, při kterých dochází ke změnám skupenství. Tři takové příklady (modré křivky) jsou i v obrázku výše: - Pevná látka ve stavu S 1 se zahříváním při stálém tlaku (izobarickém ději) přivede do stavu S 2, kdy dochází k jejímu tání. Po dalším zahřátí látka skončí ve stavu S 3 jako kapalina. -Bod S 7 označuje látku v kapalném skupenství. Sniţováním tlaku při stálé teplotě (izotermický děj) látka přejde do bodu S 8 na křivce syté páry, kdy proběhne změna skupenství všechna kapalina se postupně promění v sytou páru. Dalším sníţením tlaku se pára změní v páru přehřátou a přejde do stavu označeném bodem S Která skupenství mohou existovat vedle sebe v rovnováze na křivce syté páry? 2. Popiš, k jakému ději dochází na křivce S 4 aţ S Do fázového diagramu zakresli děj, při kterém dochází k sublimaci pevné látky při stálé teplotě. Fázový diagram slouţí ke znázornění rovnováţných stavů dané látky. Je rozdělen na tři části podle skupenství na pevnou látku, kapalinu a páru. Jednotlivé oblasti jsou od sebe odděleny křivkou tání, křivkou sublimační a křivkou syté páry Vodní pára v atmosféře 20
21 Jak popisujeme mnoţství vodní páry v atmosféře? Jaká relativní vlhkost je pro člověka ideální? Jak vznikají mraky? V dolních vrstvách atmosféry je vţdy přítomna vodní pára. Vodní pára se dostává do atmosféry vypařováním moří, jezer a dalších vodních ploch. Mnoţství vodní páry závisí na denní i roční době a na poloze na Zemi. Největší je odpoledne a nejniţší k ránu, v létě je větší neţ v zimě, a v přímořských oblastech větší neţ ve vnitrozemských. Existence vodní páry se nejviditelněji projevuje tvorbou oblačnosti (viz obrázek níţe, různé druhy oblaků lze najít zde: cs.wikipedia.org/wiki/oblak) nebo mlhy (viz obrázek na následující straně vpravo) K vyjádření mnoţství vodní páry ve vzduchu se pouţívají veličiny absolutní a relativní vlhkost vzduchu. Absolutní vlhkost vzduchu (kg/m 3 ) udává hmotnost vodních par v jednotce objemu (v 1 m 3 ). Je to tedy zároveň hustota vodních par. Vypočte se ze vztahu: Maximální absolutní vlhkost za daných podmínek (teploty a tlaku) se značí dalším zvyšování mnoţství vodní páry by uţ docházelo k její kondenzaci.. Při Relativní vlhkost vzduchu se vypočte ze vztahu nasycení vzduchu vodní párou.. Udává v procentech Př.: Je-li relativní vlhkost vzduchu 50 %, znamená to, ţe je ve vzduchu obsaţeno poloviční mnoţství vodní páry v porovnání s maximální moţnou hodnotou. 21
22 Vlhkost vzduchu se měří vlhkoměrem (na obrázku vlevo). Nejlepší relativní vlhkost pro práci nebo sport je %. 1. Zkus odhadnout mnoţství vodní páry v oblaku, který má tvar válce o obsahu podstavy 12 km 2 a výšce 6 km. Uvaţuj absolutní vlhkost. 2. Vypočti relativní vlhkost vzduchu, je-li hustota vodní páry 12 g/m 3. Podle MFCH tabulek je za stejných podmínek. Mnoţství vodní páry v atmosféře popisují veličiny absolutní a relativní vlhkost. Relativní vlhkost měříme vlhkoměrem. K práci nebo sportu je nejvhodnější relativní vlhkost %. Při 100 % vlhkosti se člověk nemůţe ochladit pocením, coţ působí nepříznivě na organismus. Při 100 % vlhkosti začíná vodní pára v atmosféře kondenzovat a vznikají mraky nebo mlhy Změny skupenství v praxi Změny skupenství jsou děje, s nimiţ se lidé běţně střetávají v nejrůznějších situacích a podobách. Asi nenajdeme člověka, který by se dosud nesetkal s táním sněhu na jaře, vypařováním vody při vaření nebo zamlţeným oknem či zrcadlem. Změny skupenství však hrají důleţitou roli i v celosvětovém měřítku. Vodní pára se podílí zhruba šedesáti procenty na skleníkovém efektu, který umoţňuje ţivot na naší planetě. Bez vodní páry by průměrná teplota Země byla niţší asi o 30 C, a nemohl by na ní vzniknout ani existovat ţivot takový, jaký jej známe. 22
23 Změny skupenství vody v atmosféře jsou klíčové pro formování oblačnosti, vznik a vypadávání sráţek, a tím jsou předmětem studia meteorologie. Oblaka se vytvářejí v místech, kde vlivem vyšší teploty vznikají výstupné proudy vzduchu. Vzduch obsahující vodní páru se výstupem ochlazuje a v určité výšce (kondenzační hladině) se mění v kapičky vody. Ke vzniku sráţek je však v mírném a arktickém podnebném pásu ještě zapotřebí přeměna kapiček vody v ledové krystalky. Ty pak narůstají na úkor kapalné fáze a vypadávají v podobě sráţek na zadní straně oblaků typu nimbostratus nebo cumulonimbus. Při zamrzání vody v přírodě hraje významnou roli anomálie vody - objemová roztaţnost vody není lineární, voda má největší hustotu při 4 C. Ochlazování vody pod bod mrazu se na hladině tvoří vrstva ledu, zatímco u dna má voda zmíněné 4 C. Led je dobrým teplotním izolantem a tím brání dalšímu zamrzání vodní masy do hloubky. Výsledkem tohoto mechanismu je udrţení příznivých podmínek pro vodní ţivočichy i během zimy. V průmyslu (např. metalurgii) je změn skupenství vyuţíváno především při výrobě slitin (nejen) kovů a výrobě oceli. Ve sklářství se vyuţívá kapalné fáze skla k jeho formování do ţádoucích tvarů a velikostí. Tuhnutí vody a následné rozpínání ledu v puklinách a prasklinách je příčinou eroze skal a rozrušování povrchu silnic. Aplikací vypařování v běţném ţivotě je sušení prádla. Varu mořské vody za sníţeného tlaku a následné kondenzace vodní páry se vyuţívá k získávání pitné vody odsolováním mořské vody v nejsušších regionech světa (např. na Arabském poloostrově). Částicová fyzika vyuţívá změn skupenství k detekci elementárních částic pomocí Wilsonovy mlţné komory. V ní se nachází podchlazená pára, která při interakci s částicí kondenzuje v podobě kapiček vody, které lze následně vyfotografovat a zkoumat. Opačně funguje dokonalejší bublinková komora, v níţ je přehřátá kapalina a stopa částice je vytvořena bublinkami páry. Kalení oceli a zapisování dat na CD a DVD disků patří mezi příklady fázových změn, při nichţ dochází ke změnám v uspořádání částic látek. Jako poslední vyuţití změn skupenství v praxi je moţné uvést umělé zasněžování lyţařských svahů pomocí sněhových děl. 23
24 2.12 Výstupní test 1. Jak se nazývá děj opačný k vypařování? a) var b) kapalnění c) desublimace d) tuhnutí 2. Jaká je teplota tuhnutí vody za normálních podmínek? a) 0 C b) 0 K c) 1 C d) 1 C 3. Jakou jednotku má měrné skupenské teplo tání? a) J/K b) J kg -1 K -1 c) J kg d) J kg Co se děje s objemem většiny látek při tání? a) objem se zvětšuje b) objem se zmnšuje c) objem zůstává stejný 5. Led se mění táním ve vodu. Jaká je hustota vznikající vody? a) menší neţ hustota ledu b) stejná jako hustota ledu c) větší neţ hustota ledu 6. Kolik tepla se uvolní při zmrznutí 2 kg vody o teplotě 0 C? (měrné skupenské teplo tání ledu l t = 334 kj/kg) a) 167 kj b) 334 kj c) 668 kj d) 522 kj 7. Závisí teplota tání látek na vnějším tlaku? a) ano b) ne 8. Má skupenské teplo tání dané látky stejnou velikost jako skupenské teplo tuhnutí? a) ano b) ne c) jak kdy, záleţí na podmínkách tání/tuhnutí 9. Je moţné zchladit vodu na teplotu niţší neţ 0 C? a) ano b) ne 10. Do sklenice teplé vody přidáme kousek ledu. Tím se hladina ve sklenici zvedne aţ po okraj. Přeteče voda, aţ všechen led roztaje? a) ano b) ne 11. Do nádoby s kapalnou vodou o teplotě 0 C vloţíme led o teplotě 0 C. Co se bude dít? a) voda v nádobě zmrzne b) led roztaje c) nebude se dít nic, voda a led jsou v rovnováze 12. Ve fázovém diagramu na obrázku 1 jsou písmeny (a), (b), (c) a (d) znázorněny 4 děje. Který z nich představuje izobarické ohřátí kapaliny a její přeměnu v páru? a) (a) b) (b) c) (c) d) (d) Obr. 1 24
25 13. Ve fázovém diagramu na obrázku 2 označují římské číslice I, II a III oblasti, v nichţ se nacházejí různá skupenství. Jaké je správné označení jednotlivých skupenství? a) I pevné, II plynné, III - kapalné b) I pevné, II kapalné, III - plynné c) I kapalné, II pevné, III - plynné d) I kapalné, II plynné, III pevné Obr Co představují bod X, bod Y a symbol? ve fázovém diagramu na obrázku 3? a) bod X: kritický bod, bod Y: trojný bod,? : křivka tání b) bod X: trojný bod, bod Y: kritický bod,? : křivka tání c) bod X: trojný bod, bod Y: bod varu vody,? : křivka tání d) bod X: kritický bod, bod Y: trojný bod,? : křivka sublimační Obr Na čem nezávisí rychlost vypařování kapaliny? a) na teplotě kapaliny b) na odsávání par c) na objemu kapaliny d) na ploše hladiny 16. Který jev je typickým příkladem desublimace? a) schnutí prádla při teplotě niţší neţ 0 C b) zamlţování oken v autobuse c) tvorba námrazy (jíní a jinovatky) na povrchu těles d) mizení sněhu při teplotách niţších neţ 0 C 17. Co platí pro bod varu kapaliny? a) nezávisí na vnějším tlaku b) závisí na vnějším tlaku, s rostoucím tlakem se zvyšuje c) závisí na vnějším tlaku, s rostoucím tlakem se sniţuje d) nezávisí na vnějším tlaku, ale na vnější teplotě 25
26 18. Při kterých změnách skupenství se teplo uvolňuje do okolí? a) tuhnutí, vypařování, desublimace b) kondenzace, var, tuhnutí a sublimace c) tání, kondenzace, desublimace d) kondenzace, tuhnutí, desublimace 19. Jestliţe se sníţí teplota vzduchu a vodní páry v něm obsaţené, vodní pára zkapalní. Který jev nesouvisí s popsaným dějem? a) vznik rosy b) vznik mlhy c) vznik námrazy d) zamlţení skel aut 20. Jaké teplo se uvolní do okolí, jestliţe 200 g páry o teplotě 100 C zkondenzuje na kapalinu o stejné teplotě? (Měrné skupenské teplo vypařování vody při 100 C: l V = 2,26 MJ/kg). a) 4,52 MJ b) 452 kj c) 452 MJ d) 45,2 MJ 21. Vodu o teplotě 50 C a objemu 0,5 l cheme přivést k bodu varu a proměnit v páru. Kolik tepla je k tomu zapotřebí? (l V 100 C = 2,26 MJ/kg, c = J kg -1 K -1 ) a) 1,4 MJ b) 14 MJ c) 2,7 MJ d) 2,3 MJ 22. Kolik tepla je zapotřebí k přeměně 2 kg ledu o teplotě 10 C na vodu o teplotě 0 C? a) 42 kj b) 374 kj c) 670 kj d) 710 kj 23. Jakým dějem lze přehřátou páru proměnit v páru sytou? a) zvýšením teploty b) sníţením tlaku c) sníţením teploty nebo zvýšením tlaku d) přehřátou páru nelze ţádným dějem změnit v sytou páru 24. Která skupenství spolu mohou existovat v rovnováze na křivce syté páry? a) plynné a pevné skupenství b) pevné a kapalné skupenství c) plynné a kapalné skupenství d) všechna tři skupenství Pojmová mapa změn skupenství 26
27 2.14 Laboratorní práce Určení měrného skupenského tepla tání ledu Úkol Určete měrné skupenské teplo tání ledu pomocí kalorimetrické rovnice Pomůcky Směšovací kalorimetr, váhy, teploměr, led, miska, voda, piják nebo filtrační papír Postup 1. Neprve určete tepelnou kapacitu C k kalorimetru: zjistěte hmotnost kalorimetru m k a kov, z něhoţ je vyroben (většinou hliník). Pro tento kov najděte v tabulkách hodnotu měrné tepelné kapacity c k. Pak ze vztahu C k = c k m k vypočtěte C k. 2. Připravte si led, nejlépe ve formě kostek v miskách, které se pouţívají v mrazničkách. Jednu kostku ledu vloţte do nádobky s chladnou vodou a počkejte, aţ se led ohřeje na teplotu tání t 2 = 0 C. 3. Mezitím do kalorimetru nalijte přiměřené mnoţství vody o měrné tepelné kapacitě c 1, hmotnosti m 1 a teplotě t Vyjměte kostku ledu z nádobky, osušte ji pijákem nebo filtračním papírem a změřte její hmotnost m Kostku ledu vloţte do kalorimetru a počkejte, aţ všechen led roztaje a ustaví se rovnováţný 27
Digitální učební materiál
 Evidenční číslo materiálu: 516 Digitální učební materiál Autor: Mgr. Pavel Kleibl Datum: 22. 1. 2013 Ročník: 8. Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Fyzika Tematický okruh: Energie Téma:
Evidenční číslo materiálu: 516 Digitální učební materiál Autor: Mgr. Pavel Kleibl Datum: 22. 1. 2013 Ročník: 8. Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Fyzika Tematický okruh: Energie Téma:
SKUPENSKÉ PŘEMĚNY POJMY K ZOPAKOVÁNÍ. Testové úlohy varianta A
 Škola: Autor: DUM: Vzdělávací obor: Tematický okruh: Téma: Masarykovo gymnázium Vsetín Mgr. Jitka Novosadová MGV_F_SS_3S3_D11_Z_OPAK_T_Skupenske_premeny_T Člověk a příroda Fyzika Skupenské přeměny Opakování
Škola: Autor: DUM: Vzdělávací obor: Tematický okruh: Téma: Masarykovo gymnázium Vsetín Mgr. Jitka Novosadová MGV_F_SS_3S3_D11_Z_OPAK_T_Skupenske_premeny_T Člověk a příroda Fyzika Skupenské přeměny Opakování
LOGO. Změny skupenství
 Změny skupenství Látka existuje ve třech skupenstvích Pevném Kapalném Plynném Látka může přecházet z jednoho skupenství do druhého. Existují tedy tyto změny skupenství: Změny skupenství plyn sublimace
Změny skupenství Látka existuje ve třech skupenstvích Pevném Kapalném Plynném Látka může přecházet z jednoho skupenství do druhého. Existují tedy tyto změny skupenství: Změny skupenství plyn sublimace
ZMĚNY SKUPENSTVÍ LÁTEK
 ZMĚNY SKUPENSTVÍ LÁTEK TÁNÍ A TUHNUTÍ - OSNOVA Kapilární jevy příklad Skupenské přeměny látek Tání a tuhnutí Teorie s video experimentem Příklad KAPILÁRNÍ JEVY - OPAKOVÁNÍ KAPILÁRNÍ JEVY - PŘÍKLAD Jak
ZMĚNY SKUPENSTVÍ LÁTEK TÁNÍ A TUHNUTÍ - OSNOVA Kapilární jevy příklad Skupenské přeměny látek Tání a tuhnutí Teorie s video experimentem Příklad KAPILÁRNÍ JEVY - OPAKOVÁNÍ KAPILÁRNÍ JEVY - PŘÍKLAD Jak
TEPELNÉ JEVY. Mgr. Jan Ptáčník - GJVJ - Fyzika - Tercie
 TEPELNÉ JEVY Mgr. Jan Ptáčník - GJVJ - Fyzika - Tercie Vnitřní energie tělesa Každé těleso se skládá z látek. Látky se skládají z částic. neustálý neuspořádaný pohyb kinetická energie vzájemné působení
TEPELNÉ JEVY Mgr. Jan Ptáčník - GJVJ - Fyzika - Tercie Vnitřní energie tělesa Každé těleso se skládá z látek. Látky se skládají z částic. neustálý neuspořádaný pohyb kinetická energie vzájemné působení
F - Změny skupenství látek
 F - Změny skupenství látek Určeno jako učební text pro studenty dálkového studia a jako shrnující text pro studenty denního studia. VARIACE 1 Tento dokument byl kompletně vytvořen, sestaven a vytištěn
F - Změny skupenství látek Určeno jako učební text pro studenty dálkového studia a jako shrnující text pro studenty denního studia. VARIACE 1 Tento dokument byl kompletně vytvořen, sestaven a vytištěn
Vnitřní energie pevné látky < Vnitřní energie kapaliny < Vnitřní energie plynu (nejmenší energie)
 Změny skupenství Při změně tělesa z pevné látky na kapalinu nebo z kapaliny na plyn se jeho vnitřní energie zvyšuje musíme dodávat teplo (zahřívat). Při změně tělesa z plynu na kapalinu, nebo z kapaliny
Změny skupenství Při změně tělesa z pevné látky na kapalinu nebo z kapaliny na plyn se jeho vnitřní energie zvyšuje musíme dodávat teplo (zahřívat). Při změně tělesa z plynu na kapalinu, nebo z kapaliny
Řešení: Fázový diagram vody
 Řešení: 1) Menší hustota ledu v souladu s Archimédovým zákonem zapříčiňuje plování jedu ve vodě. Vodní nádrže a toky tudíž zamrzají shora (od hladiny). Kdyby hustota ledu byla větší než hustota vody, docházelo
Řešení: 1) Menší hustota ledu v souladu s Archimédovým zákonem zapříčiňuje plování jedu ve vodě. Vodní nádrže a toky tudíž zamrzají shora (od hladiny). Kdyby hustota ledu byla větší než hustota vody, docházelo
(test version, not revised) 24. listopadu 2010
 Změny skupenství (test version, not revised) Petr Pošta pposta@karlin.mff.cuni.cz 24. listopadu 2010 Obsah Tání Tuhnutí Sublimace a desublimace Vypařování a var. Kondenzace Sytá pára Fázový diagram Vodní
Změny skupenství (test version, not revised) Petr Pošta pposta@karlin.mff.cuni.cz 24. listopadu 2010 Obsah Tání Tuhnutí Sublimace a desublimace Vypařování a var. Kondenzace Sytá pára Fázový diagram Vodní
SKUPENSTVÍ LÁTEK Prima - Fyzika
 SKUPENSTVÍ LÁTEK Prima - Fyzika Skupenství látek Pevné skupenství Skupenství látek Skupenství látek Pevné skupenství Kapalné skupenství Skupenství látek Pevné skupenství Kapalné skupenství Plynné skupenství
SKUPENSTVÍ LÁTEK Prima - Fyzika Skupenství látek Pevné skupenství Skupenství látek Skupenství látek Pevné skupenství Kapalné skupenství Skupenství látek Pevné skupenství Kapalné skupenství Plynné skupenství
Zavádění inovativních metod a výukových materiálů do přírodovědných předmětů na Gymnáziu v Krnově
 Zavádění inovativních metod a výukových materiálů do přírodovědných předmětů na Gymnáziu v Krnově 06_6_ Změny skupenství látek Ing. Jakub Ulmann 6 Změny skupenství látek 6.1 Tání 6.2 Tuhnutí 6.3 Změna
Zavádění inovativních metod a výukových materiálů do přírodovědných předmětů na Gymnáziu v Krnově 06_6_ Změny skupenství látek Ing. Jakub Ulmann 6 Změny skupenství látek 6.1 Tání 6.2 Tuhnutí 6.3 Změna
Název DUM: Změny skupenství v příkladech
 Základní škola národního umělce Petra Bezruče, Frýdek-Místek, tř. T. G. Masaryka 454 Zpracováno v rámci OP VK - EU peníze školám Jednička ve vzdělávání CZ.1.07/1.4.00/21.2759 Název DUM: Změny skupenství
Základní škola národního umělce Petra Bezruče, Frýdek-Místek, tř. T. G. Masaryka 454 Zpracováno v rámci OP VK - EU peníze školám Jednička ve vzdělávání CZ.1.07/1.4.00/21.2759 Název DUM: Změny skupenství
3.2 Látka a její skupenství
 3.2 Látka a její skupenství Skupenství látky a jejich změny sublimace PEVNÁ LÁTKA tání desublimace tuhnutí PLYN vy pa řo vá ní KAPALINA zka pal ňo vá ní Látka a změna vnitřní energie Změna vnitřní energie
3.2 Látka a její skupenství Skupenství látky a jejich změny sublimace PEVNÁ LÁTKA tání desublimace tuhnutí PLYN vy pa řo vá ní KAPALINA zka pal ňo vá ní Látka a změna vnitřní energie Změna vnitřní energie
23_ 2 24_ 2 25_ 2 26_ 4 27_ 5 28_ 5 29_ 5 30_ 7 31_
 Obsah 23_ Změny skupenství... 2 24_ Tání... 2 25_ Skupenské teplo tání... 2 26_ Anomálie vody... 4 27_ Vypařování... 5 28_ Var... 5 29_ Kapalnění... 5 30_ Jak určíš skupenství látky?... 7 31_ Tepelné motory:...
Obsah 23_ Změny skupenství... 2 24_ Tání... 2 25_ Skupenské teplo tání... 2 26_ Anomálie vody... 4 27_ Vypařování... 5 28_ Var... 5 29_ Kapalnění... 5 30_ Jak určíš skupenství látky?... 7 31_ Tepelné motory:...
F8 - Změny skupenství Číslo variace: 1
 F8 - Změny skupenství Číslo variace: 1 1. K vypařování kapaliny dochází: při každé teplotě v celém jejím objemu pouze při teplotě 100 C v celém objemu kapaliny pouze při normální teplotě a normálním tlaku
F8 - Změny skupenství Číslo variace: 1 1. K vypařování kapaliny dochází: při každé teplotě v celém jejím objemu pouze při teplotě 100 C v celém objemu kapaliny pouze při normální teplotě a normálním tlaku
Kalorimetrická rovnice, skupenské přeměny
 Základní škola Nový Bor, náměstí Míru 128, okres Česká Lípa, příspěvková organizace e mail: info@zsnamesti.cz; www.zsnamesti.cz; telefon: 487 722 010; fax: 487 722 378 Registrační číslo: CZ.1.07/1.4.00/21.3267
Základní škola Nový Bor, náměstí Míru 128, okres Česká Lípa, příspěvková organizace e mail: info@zsnamesti.cz; www.zsnamesti.cz; telefon: 487 722 010; fax: 487 722 378 Registrační číslo: CZ.1.07/1.4.00/21.3267
1) Skupenství fáze, forma, stav. 2) 3 druhy skupenství (1 látky): pevné (led) kapalné (voda) plynné (vodní pára)
 SKUPENSTVÍ 1) Skupenství fáze, forma, stav 2) 3 druhy skupenství (1 látky): pevné (led) kapalné (voda) plynné (vodní pára) 3) Pevné látky nemění tvar, objem částice blízko sebe, pohybují se kolem urč.
SKUPENSTVÍ 1) Skupenství fáze, forma, stav 2) 3 druhy skupenství (1 látky): pevné (led) kapalné (voda) plynné (vodní pára) 3) Pevné látky nemění tvar, objem částice blízko sebe, pohybují se kolem urč.
Termika. Nauka o teple se zabývá měřením teploty, tepla a tepelnými ději.
 Termika Nauka o teple se zabývá měřením teploty, tepla a tepelnými ději. 1. Vnitřní energie Brownův pohyb a difúze látek prokazují, že částice látek jsou v neustálém neuspořádaném pohybu. Proto mají kinetickou
Termika Nauka o teple se zabývá měřením teploty, tepla a tepelnými ději. 1. Vnitřní energie Brownův pohyb a difúze látek prokazují, že částice látek jsou v neustálém neuspořádaném pohybu. Proto mají kinetickou
ABSOLVENTSKÁ PRÁCE ZÁKLADNÍ ŠKOLA, ŠKOLNÍ 24, BYSTRÉ 9. ROČNÍK. Změny skupenství. Filip Skalský, David Řehůřek
 ABSOLVENTSKÁ PRÁCE ZÁKLADNÍ ŠKOLA, ŠKOLNÍ 24, 569 92 BYSTRÉ 9. ROČNÍK Změny skupenství Filip Skalský, David Řehůřek ŠKOLNÍ ROK 2011/2012 Prohlašujeme, že jsme absolventskou práci vypracovali samostatně
ABSOLVENTSKÁ PRÁCE ZÁKLADNÍ ŠKOLA, ŠKOLNÍ 24, 569 92 BYSTRÉ 9. ROČNÍK Změny skupenství Filip Skalský, David Řehůřek ŠKOLNÍ ROK 2011/2012 Prohlašujeme, že jsme absolventskou práci vypracovali samostatně
VÝUKOVÝ MATERIÁL. 0301 Ing. Yvona Bečičková Tematická oblast. Termika Číslo a název materiálu VY_32_INOVACE_0301_0215 Anotace
 VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
DUM č. 12 v sadě. 10. Fy-1 Učební materiály do fyziky pro 2. ročník gymnázia
 projekt GML Brno Docens DUM č. 12 v sadě 10. Fy-1 Učební materiály do fyziky pro 2. ročník gymnázia Autor: Vojtěch Beneš Datum: 03.05.2014 Ročník: 1. ročník Anotace DUMu: Kapaliny, změny skupenství Materiály
projekt GML Brno Docens DUM č. 12 v sadě 10. Fy-1 Učební materiály do fyziky pro 2. ročník gymnázia Autor: Vojtěch Beneš Datum: 03.05.2014 Ročník: 1. ročník Anotace DUMu: Kapaliny, změny skupenství Materiály
STRUKTURA PEVNÝCH LÁTEK A KAPALIN
 STRUKTURA PEVNÝCH LÁTEK A KAPALIN 19. ZMĚNY SKUPENSTVÍ, FÁZOVÝ DIAGRAM Autor: Ing. Eva Jančová DESS SOŠ a SOU spol. s r. o. SKUPENSTVÍ - Skupenství neboli stav je konkrétní forma látky, charakterizovaná
STRUKTURA PEVNÝCH LÁTEK A KAPALIN 19. ZMĚNY SKUPENSTVÍ, FÁZOVÝ DIAGRAM Autor: Ing. Eva Jančová DESS SOŠ a SOU spol. s r. o. SKUPENSTVÍ - Skupenství neboli stav je konkrétní forma látky, charakterizovaná
Měření měrného skupenského tepla tání ledu
 KATEDRA EXPERIMENTÁLNÍ FYZIKY PŘÍRODOVĚDECKÁ FAKULTA UNIVERZITY PALACKÉHO V OLOMOUCI FYZIKÁLNÍ PRAKTIKUM Z MOLEKULOVÉ FYZIKY A TERMODYNAMIKY Měření měrného skupenského tepla tání ledu Úvod Tání, měrné
KATEDRA EXPERIMENTÁLNÍ FYZIKY PŘÍRODOVĚDECKÁ FAKULTA UNIVERZITY PALACKÉHO V OLOMOUCI FYZIKÁLNÍ PRAKTIKUM Z MOLEKULOVÉ FYZIKY A TERMODYNAMIKY Měření měrného skupenského tepla tání ledu Úvod Tání, měrné
Základem molekulové fyziky je kinetická teorie látek. Vychází ze tří pouček:
 Molekulová fyzika zkoumá vlastnosti látek na základě jejich vnitřní struktury, pohybu a vzájemného působení částic, ze kterých se látky skládají. Termodynamika se zabývá zákony přeměny různých forem energie
Molekulová fyzika zkoumá vlastnosti látek na základě jejich vnitřní struktury, pohybu a vzájemného působení částic, ze kterých se látky skládají. Termodynamika se zabývá zákony přeměny různých forem energie
CELKOVÉ OPAKOVÁNÍ UČIVA + ZÁPIS DO ŠKOLNÍHO SEŠITU část 03 VNITŘNÍ ENERGIE, TEPLO.
 CELKOVÉ OPAKOVÁNÍ UČIVA + ZÁPIS DO ŠKOLNÍHO SEŠITU část 03 VNITŘNÍ ENERGIE, TEPLO. 01) Složení látek opakování učiva 6. ročníku: Všechny látky jsou složeny z částic nepatrných rozměrů (tj. atomy, molekuly,
CELKOVÉ OPAKOVÁNÍ UČIVA + ZÁPIS DO ŠKOLNÍHO SEŠITU část 03 VNITŘNÍ ENERGIE, TEPLO. 01) Složení látek opakování učiva 6. ročníku: Všechny látky jsou složeny z částic nepatrných rozměrů (tj. atomy, molekuly,
Molekulová fyzika a termika
 Molekulová fyzika a termika Fyzika 1. ročník Vzdělávání pro konkurenceschopnost Inovace výuky oboru Informační technologie MěSOŠ Klobouky u Brna Mgr. Petr Kučera 1 Obsah témat v kapitole Molekulová fyzika
Molekulová fyzika a termika Fyzika 1. ročník Vzdělávání pro konkurenceschopnost Inovace výuky oboru Informační technologie MěSOŠ Klobouky u Brna Mgr. Petr Kučera 1 Obsah témat v kapitole Molekulová fyzika
4IS09F8 změna skupenství.notebook. Registrační číslo projektu: CZ.1.07/1.4.00/21.3075. Šablona: III/2. Sada: VY_32_INOVACE_4IS Pořadové číslo: 09
 Registrační číslo projektu: CZ.1.07/1.4.00/21.3075 Šablona: III/2 Sada: VY_32_INOVACE_4IS Pořadové číslo: 09 Ověření ve výuce Třída: 8.A Datum: 20.2.2013 1 Změna skupenství Předmět: Fyzika Ročník: 8. ročník
Registrační číslo projektu: CZ.1.07/1.4.00/21.3075 Šablona: III/2 Sada: VY_32_INOVACE_4IS Pořadové číslo: 09 Ověření ve výuce Třída: 8.A Datum: 20.2.2013 1 Změna skupenství Předmět: Fyzika Ročník: 8. ročník
Mol. fyz. a termodynamika
 Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Vnitřní energie, práce a teplo
 Vnitřní energie, práce a teplo Míček upustíme z výšky na podlahu o Míček padá zvětšuje se, zmenšuje se. Celková mechanická energie se - o Míček se od země odrazí a stoupá vzhůru zvětšuje se, zmenšuje se.
Vnitřní energie, práce a teplo Míček upustíme z výšky na podlahu o Míček padá zvětšuje se, zmenšuje se. Celková mechanická energie se - o Míček se od země odrazí a stoupá vzhůru zvětšuje se, zmenšuje se.
Základní poznatky. Teplota Vnitřní energie soustavy Teplo
 Molekulová fyzika a termika Základní poznatky Základní poznatky Teplota Vnitřní energie soustavy Teplo Termika = část fyziky zabývající se studiem vlastností látek a jejich změn souvisejících s teplotou
Molekulová fyzika a termika Základní poznatky Základní poznatky Teplota Vnitřní energie soustavy Teplo Termika = část fyziky zabývající se studiem vlastností látek a jejich změn souvisejících s teplotou
Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny
 Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny Hustota toku Zatím jsme studovali pouze soustavy, které byly v rovnovážném stavu není-li soustava v silovém poli, je hustota částic stejná
Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny Hustota toku Zatím jsme studovali pouze soustavy, které byly v rovnovážném stavu není-li soustava v silovém poli, je hustota částic stejná
5.7 Vlhkost vzduchu 5.7.5 Absolutní vlhkost 5.7.6 Poměrná vlhkost 5.7.7 Rosný bod 5.7.8 Složení vzduchu 5.7.9 Měření vlhkosti vzduchu
 Fázové přechody 5.6.5 Fáze Fázové rozhraní 5.6.6 Gibbsovo pravidlo fází 5.6.7 Fázový přechod Fázový přechod prvního druhu Fázový přechod druhého druhu 5.6.7.1 Clausiova-Clapeyronova rovnice 5.6.8 Skupenství
Fázové přechody 5.6.5 Fáze Fázové rozhraní 5.6.6 Gibbsovo pravidlo fází 5.6.7 Fázový přechod Fázový přechod prvního druhu Fázový přechod druhého druhu 5.6.7.1 Clausiova-Clapeyronova rovnice 5.6.8 Skupenství
STRUKTURA KAPALIN STRUKTURA KAPALIN
 Předmět: Ročník: Vytvořil: Datum: FYZIKA PRVNÍ MGR. JÜTTNEROVÁ 18. 5. 2013 Název zpracovaného celku: STRUKTURA KAPALIN STRUKTURA KAPALIN Struktura kapalin, povrchová vrstva kapaliny: Každá molekula kapaliny
Předmět: Ročník: Vytvořil: Datum: FYZIKA PRVNÍ MGR. JÜTTNEROVÁ 18. 5. 2013 Název zpracovaného celku: STRUKTURA KAPALIN STRUKTURA KAPALIN Struktura kapalin, povrchová vrstva kapaliny: Každá molekula kapaliny
Fyzikální učebna vybavená audiovizuální technikou, interaktivní tabule, fyzikální pomůcky
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Fyzika (FYZ) Molekulová fyzika, termika 2. ročník, sexta 2 hodiny týdně Fyzikální učebna vybavená audiovizuální technikou, interaktivní tabule, fyzikální pomůcky
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Fyzika (FYZ) Molekulová fyzika, termika 2. ročník, sexta 2 hodiny týdně Fyzikální učebna vybavená audiovizuální technikou, interaktivní tabule, fyzikální pomůcky
VÝUKOVÝ MATERIÁL Ing. Yvona Bečičková Tematická oblast. Termika Číslo a název materiálu VY_32_INOVACE_0301_0220 Anotace
 VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
VNITŘNÍ ENERGIE. Mgr. Jan Ptáčník - GJVJ - Fyzika - 2. ročník - Termika
 VNITŘNÍ ENERGIE Mgr. Jan Ptáčník - GJVJ - Fyzika - 2. ročník - Termika Zákon zachování energie Ze zákona zachování mechanické energie platí: Ek + Ep = konst. Ale: Vnitřní energie tělesa Každé těleso má
VNITŘNÍ ENERGIE Mgr. Jan Ptáčník - GJVJ - Fyzika - 2. ročník - Termika Zákon zachování energie Ze zákona zachování mechanické energie platí: Ek + Ep = konst. Ale: Vnitřní energie tělesa Každé těleso má
Fyzika - Sexta, 2. ročník
 - Sexta, 2. ročník Fyzika Výchovné a vzdělávací strategie Kompetence komunikativní Kompetence k řešení problémů Kompetence sociální a personální Kompetence občanská Kompetence k podnikavosti Kompetence
- Sexta, 2. ročník Fyzika Výchovné a vzdělávací strategie Kompetence komunikativní Kompetence k řešení problémů Kompetence sociální a personální Kompetence občanská Kompetence k podnikavosti Kompetence
Fyzikální vzdělávání. 1. ročník. Učební obor: Kuchař číšník Kadeřník. Implementace ICT do výuky č. CZ.1.07/1.1.02/02.0012 GG OP VK
 Fyzikální vzdělávání 1. ročník Učební obor: Kuchař číšník Kadeřník 1 2 Termika 2.1Teplota, teplotní roztažnost látek 2.2 Teplo a práce, přeměny vnitřní energie tělesa 2.3 Tepelné motory 2.4 Struktura pevných
Fyzikální vzdělávání 1. ročník Učební obor: Kuchař číšník Kadeřník 1 2 Termika 2.1Teplota, teplotní roztažnost látek 2.2 Teplo a práce, přeměny vnitřní energie tělesa 2.3 Tepelné motory 2.4 Struktura pevných
III/2 Inovace a zkvalitnění výuky prostřednictvím ICT. Pracovní list č.3 k prezentaci Křivky chladnutí a ohřevu kovů
 Číslo projektu CZ.1.07/1.5.00/34.0514 Číslo a název šablony klíčové aktivity III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Tematická oblast Strojírenská technologie, vy_32_inovace_ma_22_06 Autor
Číslo projektu CZ.1.07/1.5.00/34.0514 Číslo a název šablony klíčové aktivity III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Tematická oblast Strojírenská technologie, vy_32_inovace_ma_22_06 Autor
UČIVO. Termodynamická teplota. První termodynamický zákon Přenos vnitřní energie
 PŘEDMĚT: FYZIKA ROČNÍK: SEXTA VÝSTUP UČIVO MEZIPŘEDM. VZTAHY, PRŮŘEZOVÁ TÉMATA, PROJEKTY, KURZY POZNÁMKY Zná 3 základní poznatky kinetické teorie látek a vysvětlí jejich praktický význam Vysvětlí pojmy
PŘEDMĚT: FYZIKA ROČNÍK: SEXTA VÝSTUP UČIVO MEZIPŘEDM. VZTAHY, PRŮŘEZOVÁ TÉMATA, PROJEKTY, KURZY POZNÁMKY Zná 3 základní poznatky kinetické teorie látek a vysvětlí jejich praktický význam Vysvětlí pojmy
EU PENÍZE ŠKOLÁM Operační program Vzdělávání pro konkurenceschopnost
 ZÁKLADNÍ ŠKOLA OLOMOUC příspěvková organizace MOZARTOVA 48, 779 00 OLOMOUC tel.: 585 427 142, 775 116 442; fax: 585 422 713 e-mail: kundrum@centrum.cz; www.zs-mozartova.cz Projekt: ŠKOLA RADOSTI, ŠKOLA
ZÁKLADNÍ ŠKOLA OLOMOUC příspěvková organizace MOZARTOVA 48, 779 00 OLOMOUC tel.: 585 427 142, 775 116 442; fax: 585 422 713 e-mail: kundrum@centrum.cz; www.zs-mozartova.cz Projekt: ŠKOLA RADOSTI, ŠKOLA
Laboratorní práce č. 2: Určení měrného skupenského tepla tání ledu
 Přírodní vědy moderně a interaktivně FYZIKA 1. ročník šestiletého studia Laboratorní práce č. 2: Určení měrného skupenského tepla tání ledu ymnázium Přírodní vědy moderně a interaktivně FYZIKA 1. ročník
Přírodní vědy moderně a interaktivně FYZIKA 1. ročník šestiletého studia Laboratorní práce č. 2: Určení měrného skupenského tepla tání ledu ymnázium Přírodní vědy moderně a interaktivně FYZIKA 1. ročník
V izolované soustavě nedochází k výměně tepla s okolím. Dokonalá izolovaná soustava neexistuje, nejvíce se jí blíží kalorimetr nebo termoska.
 Teplo a vnitřní energie pracovní list Vnitřní energie Všechny tělesa se skládají z částic, které vykonávají neustálý a neuspořádaný pohyb a které na sebe navzájem silově působí. Částice uvnitř všech těles
Teplo a vnitřní energie pracovní list Vnitřní energie Všechny tělesa se skládají z částic, které vykonávají neustálý a neuspořádaný pohyb a které na sebe navzájem silově působí. Částice uvnitř všech těles
Molekulová fyzika a termika:
 Molekulová fyzika a termika: 1. Měření teploty: 2. Délková roztažnost a Objemová roztažnost látek 3. Bimetal 4. Anomálie vody 5. Částicová stavba látek, vlastnosti látek 6. Atomová hmotnostní konstanta
Molekulová fyzika a termika: 1. Měření teploty: 2. Délková roztažnost a Objemová roztažnost látek 3. Bimetal 4. Anomálie vody 5. Částicová stavba látek, vlastnosti látek 6. Atomová hmotnostní konstanta
Pomůcky, které poskytuje sbírka fyziky, a audiovizuální technika v učebně fyziky, interaktivní tabule a i-učebnice
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Fyzika (FYZ) Práce a energie, tepelné jevy, elektrický proud, zvukové jevy Tercie 1+1 hodina týdně Pomůcky, které poskytuje sbírka fyziky, a audiovizuální technika
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Fyzika (FYZ) Práce a energie, tepelné jevy, elektrický proud, zvukové jevy Tercie 1+1 hodina týdně Pomůcky, které poskytuje sbírka fyziky, a audiovizuální technika
Půdní voda. *vyplňuje póry v půdách. *nevytváří souvislou hladinu. *je důležitá pro růst rostlin.
 PODPOVRCHOVÁ VODA Půdní voda *vyplňuje póry v půdách. *nevytváří souvislou hladinu. *je důležitá pro růst rostlin. Podzemní voda hromadí se na horninách, které jsou málo propustné pro vodu vytváří souvislou
PODPOVRCHOVÁ VODA Půdní voda *vyplňuje póry v půdách. *nevytváří souvislou hladinu. *je důležitá pro růst rostlin. Podzemní voda hromadí se na horninách, které jsou málo propustné pro vodu vytváří souvislou
Doprovodné otázky pro studenty, kvízy, úkoly aj.
 Doprovodné otázky pro studenty, kvízy, úkoly aj. Otázky: 1. Jak se projeví menší hustota ledu v porovnání s vodou při zamrzání vodních nádrží a toků? 2. Jaký jev se nazývá anomálie vody? 3. Vysvětlete
Doprovodné otázky pro studenty, kvízy, úkoly aj. Otázky: 1. Jak se projeví menší hustota ledu v porovnání s vodou při zamrzání vodních nádrží a toků? 2. Jaký jev se nazývá anomálie vody? 3. Vysvětlete
V izolované soustavě nedochází k výměně tepla s okolím. Dokonalá izolovaná soustava neexistuje, nejvíce se jí blíží kalorimetr nebo termoska.
 Teplo a vnitřní energie pracovní list Vnitřní energie Všechny tělesa se skládají z částic, které vykonávají neustálý a neuspořádaný pohyb a které na sebe navzájem silově působí. Částice uvnitř všech těles
Teplo a vnitřní energie pracovní list Vnitřní energie Všechny tělesa se skládají z částic, které vykonávají neustálý a neuspořádaný pohyb a které na sebe navzájem silově působí. Částice uvnitř všech těles
Změna skupenství, Tání a tuhnutí, Sublimace a desublimace Vypařování a kapalnění Sytá pára, Fázový diagram, Vodní pára
 Zěny skupenství átek Zěna skupenství, Tání a tuhnutí, Subiace a desubiace Vypařování a kapanění Sytá pára, Fázový diagra, Vodní pára Zěna skupenství = fyzikání děj, při které se ění skupenství átky Skupenství
Zěny skupenství átek Zěna skupenství, Tání a tuhnutí, Subiace a desubiace Vypařování a kapanění Sytá pára, Fázový diagra, Vodní pára Zěna skupenství = fyzikání děj, při které se ění skupenství átky Skupenství
Ch - Rozlišování látek
 Ch - Rozlišování látek Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně
Ch - Rozlišování látek Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně
Vnitřní energie, práce a teplo
 Vnitřní energie, práce a teplo Zákon zachování mechanické energie V izolované soustavě těles je v každém okamžiku úhrnná mechanická energie stálá. Mění se navzájem jen potenciální energie E p a kinetická
Vnitřní energie, práce a teplo Zákon zachování mechanické energie V izolované soustavě těles je v každém okamžiku úhrnná mechanická energie stálá. Mění se navzájem jen potenciální energie E p a kinetická
ZÁKLADNÍ ŠKOLA KOLÍN II., KMOCHOVA 943 škola s rozšířenou výukou matematiky a přírodovědných předmětů
 ZÁKLADNÍ ŠKOLA KOLÍN II., KMOCHOVA 943 škola s rozšířenou výukou matematiky a přírodovědných předmětů Autor Číslo materiálu Mgr. Vladimír Hradecký 8_F_1_13 Datum vytvoření 2. 11. 2011 Druh učebního materiálu
ZÁKLADNÍ ŠKOLA KOLÍN II., KMOCHOVA 943 škola s rozšířenou výukou matematiky a přírodovědných předmětů Autor Číslo materiálu Mgr. Vladimír Hradecký 8_F_1_13 Datum vytvoření 2. 11. 2011 Druh učebního materiálu
Pomůcky, které poskytuje sbírka fyziky, a audiovizuální technika v učebně fyziky, interaktivní tabule
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Fyzika (FYZ) Práce a energie, tepelné jevy, elektrický proud, zvukové jevy Tercie 1+1 hodina týdně Pomůcky, které poskytuje sbírka fyziky, a audiovizuální technika
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Fyzika (FYZ) Práce a energie, tepelné jevy, elektrický proud, zvukové jevy Tercie 1+1 hodina týdně Pomůcky, které poskytuje sbírka fyziky, a audiovizuální technika
Termodynamika 2. UJOP Hostivař 2014
 Termodynamika 2 UJOP Hostivař 2014 Skupenské teplo tání/tuhnutí je (celkové) teplo, které přijme pevná látka při přechodu na kapalinu během tání nebo naopak Značka Veličina Lt J Nedochází při něm ke změně
Termodynamika 2 UJOP Hostivař 2014 Skupenské teplo tání/tuhnutí je (celkové) teplo, které přijme pevná látka při přechodu na kapalinu během tání nebo naopak Značka Veličina Lt J Nedochází při něm ke změně
Teplotní roztažnost. Teorie. Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti
 Teplotní roztažnost Teorie Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti Teplotní roztažnost souvisí se změnou rozměru zahřívaného těles Při zahřívání se tělesa zvětšují, při ochlazování
Teplotní roztažnost Teorie Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti Teplotní roztažnost souvisí se změnou rozměru zahřívaného těles Při zahřívání se tělesa zvětšují, při ochlazování
Laboratorní práce č. 2: Určení měrné tepelné kapacity látky
 Přírodní vědy moderně a interaktivně FYZIKA 4. ročník šestiletého a 2. ročník čtyřletého studia Laboratorní práce č. 2: Určení měrné tepelné kapacity látky Přírodní vědy moderně a interaktivně FYZIKA
Přírodní vědy moderně a interaktivně FYZIKA 4. ročník šestiletého a 2. ročník čtyřletého studia Laboratorní práce č. 2: Určení měrné tepelné kapacity látky Přírodní vědy moderně a interaktivně FYZIKA
6. Jaký je výkon vařiče, který ohřeje 1 l vody o 40 C během 5 minut? Měrná tepelná kapacita vody je W)
 TEPLO 1. Na udržení stále teploty v místnosti se za hodinu spotřebuje 4,2 10 6 J tepla. olik vody proteče radiátorem ústředního topení za hodinu, jestliže má voda při vstupu do radiátoru teplotu 80 ºC
TEPLO 1. Na udržení stále teploty v místnosti se za hodinu spotřebuje 4,2 10 6 J tepla. olik vody proteče radiátorem ústředního topení za hodinu, jestliže má voda při vstupu do radiátoru teplotu 80 ºC
ÚVODNÍ POJMY, VNITŘNÍ ENERGIE, PRÁCE A TEPLO POJMY K ZOPAKOVÁNÍ. Testové úlohy varianta A
 Škola: Autor: DUM: Vzdělávací obor: Tematický okruh: Téma: Masarykovo gymnázium Vsetín Mgr. Jitka Novosadová MGV_F_SS_3S3_D08_Z_OPAK_T_Uvodni_pojmy_vnitrni_energie _prace_teplo_t Člověk a příroda Fyzika
Škola: Autor: DUM: Vzdělávací obor: Tematický okruh: Téma: Masarykovo gymnázium Vsetín Mgr. Jitka Novosadová MGV_F_SS_3S3_D08_Z_OPAK_T_Uvodni_pojmy_vnitrni_energie _prace_teplo_t Člověk a příroda Fyzika
Molekulová fyzika a termika. Přehled základních pojmů
 Molekulová fyzika a termika Přehled základních pojmů Kinetická teorie látek Vychází ze tří experimentálně ověřených poznatků: 1) Látky se skládají z částic - molekul, atomů nebo iontů, mezi nimiž jsou
Molekulová fyzika a termika Přehled základních pojmů Kinetická teorie látek Vychází ze tří experimentálně ověřených poznatků: 1) Látky se skládají z částic - molekul, atomů nebo iontů, mezi nimiž jsou
Pracovní list číslo 01
 Pracovní list číslo 01 Měření délky Jak se nazývá základní jednotka délky? Jaká délková měřidla používáme k měření rozměrů a) knihy b) okenní tabule c) třídy.. d) obvodu svého pasu.. Jaké díly a násobky
Pracovní list číslo 01 Měření délky Jak se nazývá základní jednotka délky? Jaká délková měřidla používáme k měření rozměrů a) knihy b) okenní tabule c) třídy.. d) obvodu svého pasu.. Jaké díly a násobky
ZMĚNY SKUPENSTVÍ LÁTEK ČÁST 01
 ZMĚNY SKUPENSTVÍ LÁTEK ČÁST 01 A) Výklad: Změny skupenství látky Látka se může vyskytovat ve třech různých skupenstvích PEVNÉM, KAPALNÉM nebo PLYNNÉM. Např. voda (H 2 O)- může se vyskytovat jako krystalický
ZMĚNY SKUPENSTVÍ LÁTEK ČÁST 01 A) Výklad: Změny skupenství látky Látka se může vyskytovat ve třech různých skupenstvích PEVNÉM, KAPALNÉM nebo PLYNNÉM. Např. voda (H 2 O)- může se vyskytovat jako krystalický
Energie. Název sady DUM. Člověk a příroda. Vzdělávací oblast. Fyzika. Autor, datum vytvoření Mgr. Zbyněk Šostý, 2012. interaktivní tabule
 Název DUM: Skupenství látek Název sady DUM Číslo DUM Vzdělávací oblast Vzdělávací obor Energie VY_32_INOVACE_14_S1 12 Člověk a příroda Fyzika Ročník 8. Autor, datum vytvoření Mgr. Zbyněk Šostý, 2012 Doporučená
Název DUM: Skupenství látek Název sady DUM Číslo DUM Vzdělávací oblast Vzdělávací obor Energie VY_32_INOVACE_14_S1 12 Člověk a příroda Fyzika Ročník 8. Autor, datum vytvoření Mgr. Zbyněk Šostý, 2012 Doporučená
VÝUKOVÝ MATERIÁL. 0301 Ing. Yvona Bečičková Tematická oblast
 VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
Vnitřní energie, teplo, změny skupenství Pracovní listy pro samostatnou práci
 Vnitřní energie, teplo, změny skupenství Pracovní listy pro samostatnou práci Oblast: Člověk a příroda Předmět: Fyzika Tematický okruh: Tělesa, látky a síla Ročník: 8. Klíčová slova: změny skupenství,
Vnitřní energie, teplo, změny skupenství Pracovní listy pro samostatnou práci Oblast: Člověk a příroda Předmět: Fyzika Tematický okruh: Tělesa, látky a síla Ročník: 8. Klíčová slova: změny skupenství,
měření teploty Molekulová fyzika a termika Teplotní délková roztažnost V praxi úlohy
 měření teploty Molekulová fyzika a termika rozdíl mezi stupnicí celsiovskou a termodynamickou př. str. 173 (nové vydání s. 172) teplo(to)měry roztažnost látek rtuťový, lihový, bimetalový vodivost polovodičů
měření teploty Molekulová fyzika a termika rozdíl mezi stupnicí celsiovskou a termodynamickou př. str. 173 (nové vydání s. 172) teplo(to)měry roztažnost látek rtuťový, lihový, bimetalový vodivost polovodičů
Fyzika je přírodní věda, která zkoumá a popisuje zákonitosti přírodních jevů.
 Fyzika je přírodní věda, která zkoumá a popisuje zákonitosti přírodních jevů. Násobky jednotek název značka hodnota kilo k 1000 mega M 1000000 giga G 1000000000 tera T 1000000000000 Tělesa a látky Tělesa
Fyzika je přírodní věda, která zkoumá a popisuje zákonitosti přírodních jevů. Násobky jednotek název značka hodnota kilo k 1000 mega M 1000000 giga G 1000000000 tera T 1000000000000 Tělesa a látky Tělesa
KAPALINY. Mgr. Jan Ptáčník - GJVJ - Fyzika - Sekunda
 KAPALINY Mgr. Jan Ptáčník - GJVJ - Fyzika - Sekunda Vlastnosti molekul kapalin V neustálém pohybu Ve stejných vzdálenostech, nejsou ale vázány Působí na sebe silami: odpudivé x přitažlivé Vlastnosti kapalin
KAPALINY Mgr. Jan Ptáčník - GJVJ - Fyzika - Sekunda Vlastnosti molekul kapalin V neustálém pohybu Ve stejných vzdálenostech, nejsou ale vázány Působí na sebe silami: odpudivé x přitažlivé Vlastnosti kapalin
POZNÁMKA: V USA se používá ještě Fahrenheitova teplotní stupnice. Převodní vztahy jsou vzhledem k volbě základních bodů složitější: 9 5
 TEPLO, TEPLOTA Tepelný stav látek je charakterizován veličinou termodynamická teplota T Jednotkou je kelvin T K Mezi Celsiovou a Kelvinovou teplotní stupnicí existuje převodní vztah T 73,5C t POZNÁMKA:
TEPLO, TEPLOTA Tepelný stav látek je charakterizován veličinou termodynamická teplota T Jednotkou je kelvin T K Mezi Celsiovou a Kelvinovou teplotní stupnicí existuje převodní vztah T 73,5C t POZNÁMKA:
PROCESY V TECHNICE BUDOV 8
 UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY PROCESY V TECHNICE BUDOV 8 Dagmar Janáčová, Hana Charvátová Zlín 2013 Tento studijní materiál vznikl za finanční podpory Evropského sociálního
UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY PROCESY V TECHNICE BUDOV 8 Dagmar Janáčová, Hana Charvátová Zlín 2013 Tento studijní materiál vznikl za finanční podpory Evropského sociálního
Skupenské stavy látek. Mezimolekulární síly
 Skupenské stavy látek Mezimolekulární síly 1 Interakce iont-dipól Např. hydratační (solvatační) interakce mezi Na + (iont) a molekulou vody (dipól). Jde o nejsilnější mezimolekulární (nevazebnou) interakci.
Skupenské stavy látek Mezimolekulární síly 1 Interakce iont-dipól Např. hydratační (solvatační) interakce mezi Na + (iont) a molekulou vody (dipól). Jde o nejsilnější mezimolekulární (nevazebnou) interakci.
FYZIKA 2. ROČNÍK. Změny skupenství látek. Tání a tuhnutí. Pevná látka. soustava velkého počtu částic. Plyn
 Zěny skuenství látek Pevná látka Kaalina Plyn soustava velkého očtu částic Má-li soustava v rovnovážné stavu ve všech částech stejné fyzikální a cheické vlastnosti (stejnou hustotu, stejnou strukturu a
Zěny skuenství látek Pevná látka Kaalina Plyn soustava velkého očtu částic Má-li soustava v rovnovážné stavu ve všech částech stejné fyzikální a cheické vlastnosti (stejnou hustotu, stejnou strukturu a
MOLEKULOVÁ FYZIKA A TERMODYNAMIKA
 MOLEKULOVÁ FYZIKA A TERMODYNAMIKA 2 metody zkoumání látek na základě vnějších projevů: I. KINETICKÁ TEORIE LÁTEK -studium vlastností látek na základě vnitřní struktury, pohybu a vzájemného působení jednotlivých
MOLEKULOVÁ FYZIKA A TERMODYNAMIKA 2 metody zkoumání látek na základě vnějších projevů: I. KINETICKÁ TEORIE LÁTEK -studium vlastností látek na základě vnitřní struktury, pohybu a vzájemného působení jednotlivých
12. Termomechanika par, Clausiova-Clapeyronova rovnice, parní tabulky, základni termodynamické děje v oblasti par
 1/18 12. Termomechanika par, Clausiova-Clapeyronova rovnice, parní tabulky, základni termodynamické děje v oblasti par Příklad: 12.1, 12.2, 12.3, 12.4, 12.5, 12.6, 12.7, 12.8, 12.9, 12.10, 12.11, 12.12,
1/18 12. Termomechanika par, Clausiova-Clapeyronova rovnice, parní tabulky, základni termodynamické děje v oblasti par Příklad: 12.1, 12.2, 12.3, 12.4, 12.5, 12.6, 12.7, 12.8, 12.9, 12.10, 12.11, 12.12,
Vnitřní energie, teplo a práce
 Přednáška 3 Vnitřní energie, teplo a práce 3.1 Vnitřní energie Pro popis stavu termodynamických soustav je výhodné zavést stavovou funkci, tzv. vnitřní energii soustavy U, která vyjadřuje charakter pohybu
Přednáška 3 Vnitřní energie, teplo a práce 3.1 Vnitřní energie Pro popis stavu termodynamických soustav je výhodné zavést stavovou funkci, tzv. vnitřní energii soustavy U, která vyjadřuje charakter pohybu
Termodynamika. T [K ]=t [ 0 C] 273,15 T [ K ]= t [ 0 C] termodynamická teplota: Stavy hmoty. jednotka: 1 K (kelvin) = 1/273,16 část termodynamické
![Termodynamika. T [K ]=t [ 0 C] 273,15 T [ K ]= t [ 0 C] termodynamická teplota: Stavy hmoty. jednotka: 1 K (kelvin) = 1/273,16 část termodynamické Termodynamika. T [K ]=t [ 0 C] 273,15 T [ K ]= t [ 0 C] termodynamická teplota: Stavy hmoty. jednotka: 1 K (kelvin) = 1/273,16 část termodynamické](/thumbs/24/2778201.jpg) Termodynamika termodynamická teplota: Stavy hmoty jednotka: 1 K (kelvin) = 1/273,16 část termodynamické teploty trojného bodu vody (273,16 K = 0,01 o C). 0 o C = 273,15 K T [K ]=t [ 0 C] 273,15 T [ K ]=
Termodynamika termodynamická teplota: Stavy hmoty jednotka: 1 K (kelvin) = 1/273,16 část termodynamické teploty trojného bodu vody (273,16 K = 0,01 o C). 0 o C = 273,15 K T [K ]=t [ 0 C] 273,15 T [ K ]=
Základy molekulové fyziky a termodynamiky
 Základy molekulové fyziky a termodynamiky Molekulová fyzika je částí fyziky, která zkoumá vlastnosti látek na základě jejich vnitřní struktury, pohybu a vzájemného silového působení částic, z nichž jsou
Základy molekulové fyziky a termodynamiky Molekulová fyzika je částí fyziky, která zkoumá vlastnosti látek na základě jejich vnitřní struktury, pohybu a vzájemného silového působení částic, z nichž jsou
Názvosloví Kvalita Výroba Kondenzace Teplosměnná plocha
 Názvosloví Kvalita Výroba Kondenzace Teplosměnná plocha Názvosloví páry Pro správné pochopení funkce parních systémů musíme znát základní pojmy spojené s párou. Entalpie Celková energie, příslušná danému
Názvosloví Kvalita Výroba Kondenzace Teplosměnná plocha Názvosloví páry Pro správné pochopení funkce parních systémů musíme znát základní pojmy spojené s párou. Entalpie Celková energie, příslušná danému
Vnitřní energie, práce, teplo.
 Vnitřní energie, práce, teplo. Vnitřní energie tělesa Částice uvnitř látek mají kinetickou a potenciální energii. Je to energie uvnitř tělesa, proto ji nazýváme vnitřní energie. Značíme ji písmenkem U
Vnitřní energie, práce, teplo. Vnitřní energie tělesa Částice uvnitř látek mají kinetickou a potenciální energii. Je to energie uvnitř tělesa, proto ji nazýváme vnitřní energie. Značíme ji písmenkem U
II. VNITŘNÍ ENERGIE, PRÁCE A TEPLO
 II. VNITŘNÍ ENERGIE, PRÁCE A TEPLO 2.1 Vnitřní energie tělesa a) celková energie (termodynamické) soustavy E tvořena kinetickou energií E k jejího makroskopického pohybu jako celku potenciální energií
II. VNITŘNÍ ENERGIE, PRÁCE A TEPLO 2.1 Vnitřní energie tělesa a) celková energie (termodynamické) soustavy E tvořena kinetickou energií E k jejího makroskopického pohybu jako celku potenciální energií
Termodynamika 1. UJOP Hostivař 2014
 Termodynamika 1 UJOP Hostivař 2014 Termodynamika Zabývá se tepelnými ději obecně. Existují 3 termodynamické zákony: 1. Celkové množství energie (všech druhů) izolované soustavy zůstává zachováno. 2. Teplo
Termodynamika 1 UJOP Hostivař 2014 Termodynamika Zabývá se tepelnými ději obecně. Existují 3 termodynamické zákony: 1. Celkové množství energie (všech druhů) izolované soustavy zůstává zachováno. 2. Teplo
Kapaliny Molekulové vdw síly, vodíkové můstky
 Kapaliny Molekulové vdw síly, vodíkové můstky Metalické roztavené kovy, ionty + elektrony, elektrostatické síly Iontové roztavené soli, FLINAK (LiF + NaF + KF), volně pohyblivé anionty a kationty, iontová
Kapaliny Molekulové vdw síly, vodíkové můstky Metalické roztavené kovy, ionty + elektrony, elektrostatické síly Iontové roztavené soli, FLINAK (LiF + NaF + KF), volně pohyblivé anionty a kationty, iontová
Voda. Pevné: sníh, led, kroupy, jinovatka, námraza Kapalné Plynné: vodní pára
 Voda Voda je jednou z podmínek pro život. je tekutina bez barvy, chuti a zápachu. na Zemi stále koluje, mění skupenství. vznikla v prehistorickém období a už nevzniká. má chemický vzorec H2O. je obsažena
Voda Voda je jednou z podmínek pro život. je tekutina bez barvy, chuti a zápachu. na Zemi stále koluje, mění skupenství. vznikla v prehistorickém období a už nevzniká. má chemický vzorec H2O. je obsažena
Název: Ověření kalorimetrické rovnice, tepelná výměna
 Název: Ověření kalorimetrické rovnice, tepelná výměna Autor: Mgr. Petr Majer Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět (mezipředmětové vztahy) : Fyzika (Matematika) Tematický celek:
Název: Ověření kalorimetrické rovnice, tepelná výměna Autor: Mgr. Petr Majer Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět (mezipředmětové vztahy) : Fyzika (Matematika) Tematický celek:
VÝUKOVÝ MATERIÁL. 0301 Ing. Yvona Bečičková Termika VY_32_INOVACE_0301_0212 Teplotní roztažnost látek. Fyzika 2. ročník, učební obory Bez příloh
 VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
T0 Teplo a jeho měření
 Teplo a jeho měření 1 Teplo 2 Kalorimetrie Kalorimetr 3 Tepelná kapacita 3.1 Měrná tepelná kapacita Měrná tepelná kapacita při stálém objemu a stálém tlaku Poměr měrných tepelných kapacit 3.2 Molární tepelná
Teplo a jeho měření 1 Teplo 2 Kalorimetrie Kalorimetr 3 Tepelná kapacita 3.1 Měrná tepelná kapacita Měrná tepelná kapacita při stálém objemu a stálém tlaku Poměr měrných tepelných kapacit 3.2 Molární tepelná
2.6.7 Fázový diagram. Předpoklady: Popiš děje zakreslené v diagramu křivky syté páry. Za jakých podmínek mohou proběhnout?
 2.6.7 Fázový diagram Předoklady: 2606 Př. 1: Poiš děje zakreslené v diagramu křivky syté áry. Za jakých odmínek mohou roběhnout? 4 2 1 3 1) Sytá ára je za stálého tlaku zahřívána. Zvětšuje svůj objem a
2.6.7 Fázový diagram Předoklady: 2606 Př. 1: Poiš děje zakreslené v diagramu křivky syté áry. Za jakých odmínek mohou roběhnout? 4 2 1 3 1) Sytá ára je za stálého tlaku zahřívána. Zvětšuje svůj objem a
Přehled otázek z fyziky pro 2.ročník
 Přehled otázek z fyziky pro 2.ročník 1. Z jakých základních poznatků vychází teorie látek + důkazy. a) Látka kteréhokoli skupenství se skládá z částic molekul, atomů, iontů. b) Částice se v látce pohybují,
Přehled otázek z fyziky pro 2.ročník 1. Z jakých základních poznatků vychází teorie látek + důkazy. a) Látka kteréhokoli skupenství se skládá z částic molekul, atomů, iontů. b) Částice se v látce pohybují,
007. Chladicí směs jednoduchá chladnička
 007. Chladicí směs jednoduchá chladnička Oblast dle RVP: Člov?k a p?íroda Obor: fyzika, chemie Mezipředmětový vztah: přírodopis Klíčová slova: mrznoucí směs, teplota tuhnutí, posyp vozovky Pomůcky: 2x
007. Chladicí směs jednoduchá chladnička Oblast dle RVP: Člov?k a p?íroda Obor: fyzika, chemie Mezipředmětový vztah: přírodopis Klíčová slova: mrznoucí směs, teplota tuhnutí, posyp vozovky Pomůcky: 2x
PŘÍRODA - VLASTNOSTI LÁTEK. Anotace: Materiál je určen k výuce věd ve 3. ročníku ZŠ. Seznamuje žáky s vlastnostmi látek a jejich měřením.
 PŘÍRODA - VLASTNOSTI LÁTEK Anotace: Materiál je určen k výuce věd ve 3. ročníku ZŠ. Seznamuje žáky s vlastnostmi látek a jejich měřením. Vlastnosti látek všechny věci kolem nás jsou složeny z látek tyto
PŘÍRODA - VLASTNOSTI LÁTEK Anotace: Materiál je určen k výuce věd ve 3. ročníku ZŠ. Seznamuje žáky s vlastnostmi látek a jejich měřením. Vlastnosti látek všechny věci kolem nás jsou složeny z látek tyto
34_Mechanické vlastnosti kapalin... 2 Pascalův zákon _Tlak - příklady _Hydraulické stroje _PL: Hydraulické stroje - řešení...
 34_Mechanické vlastnosti kapalin... 2 Pascalův zákon... 2 35_Tlak - příklady... 2 36_Hydraulické stroje... 3 37_PL: Hydraulické stroje - řešení... 4 38_Účinky gravitační síly Země na kapalinu... 6 Hydrostatická
34_Mechanické vlastnosti kapalin... 2 Pascalův zákon... 2 35_Tlak - příklady... 2 36_Hydraulické stroje... 3 37_PL: Hydraulické stroje - řešení... 4 38_Účinky gravitační síly Země na kapalinu... 6 Hydrostatická
VYBRANÉ STATĚ Z PROCESNÍHO INŢENÝRSTVÍ cvičení 12
 UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY VYBRANÉ STATĚ Z PROCESNÍHO INŢENÝRSTVÍ cvičení 2 Termodynamika reálných plynů část 2 Hana Charvátová, Dagmar Janáčová Zlín 203 Tento studijní
UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY VYBRANÉ STATĚ Z PROCESNÍHO INŢENÝRSTVÍ cvičení 2 Termodynamika reálných plynů část 2 Hana Charvátová, Dagmar Janáčová Zlín 203 Tento studijní
13. Skupenské změny látek
 13. Skuenské změny látek Skuenství je konkrétní forma látky, charakterizovaná ředevším usořádáním částic v látce a rojevující se tyickými fyzikálními a chemickými vlastnostmi. Pro označení skuenství se
13. Skuenské změny látek Skuenství je konkrétní forma látky, charakterizovaná ředevším usořádáním částic v látce a rojevující se tyickými fyzikálními a chemickými vlastnostmi. Pro označení skuenství se
[381 m/s] 12. Ocelovou součást o hmotnosti m z = 4 kg, měrném teple c z = 420 J/kgK, zahřátou na teplotu t z = 900 C ponoříme do olejové lázně o
![[381 m/s] 12. Ocelovou součást o hmotnosti m z = 4 kg, měrném teple c z = 420 J/kgK, zahřátou na teplotu t z = 900 C ponoříme do olejové lázně o [381 m/s] 12. Ocelovou součást o hmotnosti m z = 4 kg, měrném teple c z = 420 J/kgK, zahřátou na teplotu t z = 900 C ponoříme do olejové lázně o](/thumbs/27/11706382.jpg) 3 - Termomechanika 1. Hustota vzduchu při tlaku p l = 0,2 MPa a teplotě t 1 = 27 C je ρ l = 2,354 kg/m 3. Jaká je jeho hustota ρ 0 při tlaku p 0 = 0,1MPa a teplotě t 0 = 0 C [1,29 kg/m 3 ] 2. Určete objem
3 - Termomechanika 1. Hustota vzduchu při tlaku p l = 0,2 MPa a teplotě t 1 = 27 C je ρ l = 2,354 kg/m 3. Jaká je jeho hustota ρ 0 při tlaku p 0 = 0,1MPa a teplotě t 0 = 0 C [1,29 kg/m 3 ] 2. Určete objem
IV. Fázové rovnováhy. 4. Fázové rovnováhy Ústav procesní a zpracovatelské techniky FS ČVUT v Praze
 IV. Fázové rovnováhy 1 4. Fázové rovnováhy 4.1 Základní pojmy 4.2 Fázové rovnováhy jednosložkové soustavy 4.3 Fázové rovnováhy dvousložkových soustav 4.3.1 Soustava tuhá složka tuhá složka 4.3.2 Soustava
IV. Fázové rovnováhy 1 4. Fázové rovnováhy 4.1 Základní pojmy 4.2 Fázové rovnováhy jednosložkové soustavy 4.3 Fázové rovnováhy dvousložkových soustav 4.3.1 Soustava tuhá složka tuhá složka 4.3.2 Soustava
Pracovní list č. 3 téma: Povětrnostní a klimatičtí činitelé část 2
 Pracovní list č. 3 téma: Povětrnostní a klimatičtí činitelé část 2 Obsah tématu: 1) Vzdušný obal země 2) Složení vzduchu 3) Tlak vzduchu 4) Vítr 5) Voda 1) VZDUŠNÝ OBAL ZEMĚ Vzdušný obal Země.. je směs
Pracovní list č. 3 téma: Povětrnostní a klimatičtí činitelé část 2 Obsah tématu: 1) Vzdušný obal země 2) Složení vzduchu 3) Tlak vzduchu 4) Vítr 5) Voda 1) VZDUŠNÝ OBAL ZEMĚ Vzdušný obal Země.. je směs
Objasnění důvodu solení vozovek v zimě (laboratorní práce)
 Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Objasnění důvodu solení vozovek v zimě (laboratorní práce) Označení: EU-Inovace-BFCh-F-05 Předmět: Biologická, fyzikální
Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Objasnění důvodu solení vozovek v zimě (laboratorní práce) Označení: EU-Inovace-BFCh-F-05 Předmět: Biologická, fyzikální
*Základní škola praktická Halenkov * * *VY_32_INOVACE_03_01_03 * *Voda
 Základní škola praktická Halenkov VY_32_INOVACE_03_01_03 Voda Číslo projektu CZ.1.07/1.4.00/21.3185 Klíčová aktivita III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Zařazení učiva v rámci ŠVP Chemie
Základní škola praktická Halenkov VY_32_INOVACE_03_01_03 Voda Číslo projektu CZ.1.07/1.4.00/21.3185 Klíčová aktivita III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Zařazení učiva v rámci ŠVP Chemie
b) Máte dvě stejná tělesa, jak se pozná, že částice jednoho se pohybují rychleji než částice druhého?
 TEPLO OPAKOVÁNÍ a) Co jsou částice a jak se pohybují? b) Máte dvě stejná tělesa, jak se pozná, že částice jednoho se pohybují rychleji než částice druhého? c) Co je vnitřní energie? d) Proč se těleso při
TEPLO OPAKOVÁNÍ a) Co jsou částice a jak se pohybují? b) Máte dvě stejná tělesa, jak se pozná, že částice jednoho se pohybují rychleji než částice druhého? c) Co je vnitřní energie? d) Proč se těleso při
Termodynamika materiálů. Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn
 Termodynamika materiálů Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn Důležité konstanty Standartní podmínky Avogadrovo číslo N A = 6,023.10
Termodynamika materiálů Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn Důležité konstanty Standartní podmínky Avogadrovo číslo N A = 6,023.10
3.5 Tepelné děje s ideálním plynem stálé hmotnosti, izotermický děj
 3.5 Tepelné děje s ideálním plynem stálé hmotnosti, izotermický děj a) tepelný děj přechod plynu ze stavu 1 do stavu tepelnou výměnou nebo konáním práce dále uvaž., že hmotnost plynu m = konst. a navíc
3.5 Tepelné děje s ideálním plynem stálé hmotnosti, izotermický děj a) tepelný děj přechod plynu ze stavu 1 do stavu tepelnou výměnou nebo konáním práce dále uvaž., že hmotnost plynu m = konst. a navíc
