XGEVA (denosumab): nov! standard lé"by pacient# s kostními metastázami?
|
|
|
- Matyáš Blažek
- před 8 lety
- Počet zobrazení:
Transkript
1 XGEVA (denosumab): nov! standard lé"by pacient# s kostními metastázami? prof. MUDr. Jitka Abrahámová, Dr.Sc. Onkologická klinika 1. LF UK a TN
2 DMO-CZE-AMG November-P
3 Integrovaná anal!za: shodn! design studií N = 5723 Karcinom prsu N = 2046 Karcinom prostaty N = 1901 Solidní nádory + mnoho%etn" myelom N = 1776 Vstupní kritéria:!" Pacienti s # 1 kostní metastázou/lézí R A N D O M I S A T I O N denosumab 120 mg SC Q4W + Placebo IV Q4W* (n = 2861) denní suplementace kalciem (# 500 mg) a vitaminem D (# 400 IU) Zoledronová kyselina 4 mg IV Q4W* + Placebo SC Q4W (n = 2862) *Dle protokolu a SPC Zometa byl iv. p$ípravek upraven dle vstupní clearance kreatininu a následné dávkové intervaly stanoveny dle sérového kreatininu Lipton A et al. Poster presented at ESMO 35; Milan, Italy; 8 12 October, 2010 [Abstract 1249P]. IV, intravenózní; Q4W, ka!dé 4 t"dny; SC, subkutánní
4 Kostní metastázy mohou vyústit v záva$né SRE!" SRE jsou definovány jako: 1 K hodnocení ú%innosti látek ovliv'ujících kostní metabolizmus v lé%b( kostních metastáz je pou!íván kompozitní cíl SRE 1 Ozá%ení kosti Patologická zlomenina Mí&ní komprese Operace kosti!" Prevalentní SRE zvy&uje riziko následn"ch SRE (Accessed 2 March 2011); 2. Saad F et al. Clin Genitourin Cancer 2007;5:390 6.
5 Signifikantn' del&í "as (8.2 m'síce) bez SRE na denosumabu vs zoledronová kyselina Integrovaná anal!za 3 studií Studie fáze 3 Integrovaná anal"za Pacienti bez SRE (%) po%et subjekt) v riziku 19.4 m(síce Doba do první SRE (n = 5723) 27.6 m(síce zoledronová kys. denosumab M(síc ve studii Zoledronová kys denosumab HR = 0.83 (95% CI: ) P < (superiorita) 17% redukce rizika Lipton A et al. Poster presented at ESMO 35; Milan, Italy; 8 12 October, 2010 [Abstract 1249P]. HR, hazard ratio
6 Signifikantn' del&í "as bez SRE na denosumabu vs zoledronová kyselina bez ohledu na p%edchozí SRE P%edchozí SRE Bez p%edchozí SRE Podíl pacient) bez SRE v pr)b(hu studie HR 0.84 (95% CI: ) P = M(síc ve studii HR 0.82 (95% CI: ) P = M(síc ve studii Denosumab Zoledronová kyselina Lipton A et al. Poster presented at ESMO 35; Milan, Italy; 8 12 October, 2010 [Abstract 1249P].
7 Redukce rizika (doba do první SRE) je u denosumabu konzistentn' lep&í nap%í" r#zn!mi typy nádor# Doba do první SRE Studie u karcinomu prsu 1 (n = 2046) 18% redukce rizika Studie u karcinomu prostaty 2 (n = 1901) 18% redukce rizika Studie u ostatních solidních nádor#/ mnoho"etného myelomu 3 (n = 1776) 16% redukce rizika Pacienti bez SRE (%) HR = 0,82 (95% CI: 0,71 0,95) P = 0,01 (superiorita) Medián dosud nedosa$en 40 26,4 m'síce HR = 0,82 (95% CI: 0,71 0,95) P = 0,008 (superiorita) 20,7 m'síce 17,1 m'síce 16,3 m'síce M(síc ve studii HR = 0,84 (95% CI: 0,71 0,98) P = 0,0007 (non-inferiorita) P = 0,06 (NS for superiorita) 20,6 m'síce Zoledronová kyselina Denosumab 1. Stopeck AT et al. J Clin Oncol 2010;28:5132 9; 2. Fizazi K et al. Lancet 2011;377:813 22; 3. Henry DH et al. J Clin Oncol 2011;29: s v"jimkou prsu a prostaty. V&echna data z primární anal"zy
8 % patcent# bez SRE Subanal!za studie 244 s ostatními solidními nádory: signifikantn' del&í doba bez SRE na denosumabu vs zoledronová kyselina Doba do první SRE: pacienti s ostatními solidními nádory/ mnoho"etn!m myelomem 1,2 (N = 1776) 16,3 m'síce 20,5 m'síce [HR = 0,84] (95% CI, 0,71 0,98) (P < 0,001, noninferiorita) (P = 0,060, NS pro superioritu) Doba do první SRE: subanal!za bez pacient# s mnoho"etn!m myelomem 3 (N = 1677) 15,4 months [HR 0,81] (95% CI, 0,68 0,96) (P = 0,034, superiorita) Subanal!za ostatních solidních nádor# vylou"ila pacienty s mnoho"etn!m myelomem (10% pacient# celé kohorty ve studii). XGEVA (denosumab) Souhrn informací o p%ípravku, Amgen. Henry DH, et al. J Clin Oncol 2011; 29: Henry D, et al. Presentation at: ASCO Annual Meeting. June 4-8, 2010; Chicago, ILL. 21,4 months M'síc ve studii 19% redukce rizika Denosumab Zoledronová kyselina
9 Doba do první SRE ve studii podle v'ku fáze 3 Integrovaná anal"za Podíl subjekt) bez SRE ve studii 1,0 0,8 0,6 0,4 0,2 0,0 < 65 let 18% HR 0,82 (95% CI 0,73, 0,93) P=0,0015 odhad mediánu dle KM (m'síce) denosumab: 28,8 kys. zoledronová: : 19, m(síc redukce rizika ,0 0,8 0,6 0,4 0,2 0,0 0 6! 65 let 18% m(síc redukce rizika HR 0,82 (95% CI 0,72, 0,94) P=0,0039 odhad mediánu dle KM (m'síce) denosumab: 24,9 kys. zoledronová: 19, pacienti v riziku denosumab: kys. zoledronová: Lipton A, Fizazi K, Stopeck A, et al. EMCC 2011: abstrakt 3061 a poster. 9
10 Studie fáze 3 Integrovaná anal"za Doba do první SRE ve studii dle typu SRE Typ SRE: jakákoli SRE patologická fraktura ozá$ení kosti mí&ní komprese operace kosti Hazard Ratio (95% CI) 0,83 (0,76, 0,90), P < 0,001 0,86 (0,76, 0,96), P = 0,009 0,77 (0,69, 0,87), P < 0,001 0,89 (0,65, 1,21), P = 0,46 0,86 (0,61, 1,21), P = 0,38 0,5 1,0 1,5 Hazard Ratio lep&í denosumab lep&í ZA Lipton A, Fizazi K, Stopeck A, et al. EMCC 2011: abstract 3061 a poster ZA zoledronová kyselina 10
11 Signifikantn' mén' SRE na denosumabu vs zoledronová kyselina Kumulativní pr)m(rn" po%et SRE na pacienta 1,6 1,4 1,2 1,0 0,8 0,6 0,4 0,2 0,0 Doba do první a dal&í SRE (n = 5723) SRE celkem: Denosumab: 1360 Zoledronová kyselina: RR = 0,82 (95% CI, 0,75 0,89) P < 0,001 (superiorita) 18% redukce rizika M(síce ve studii Lipton A et al. Poster presented at ESMO 35; Milan, Italy; 8 12 October, 2010 [Abstract 1249P]. P$íhody v odstupu minimáln( 21 dní (anal"za mnoho%etn"ch událostí) RR, pom(r %etnosti
12 V!sledky Prevence bolesti Doba do mírné nebo silné bolesti (> 4 body) u pacient! bez bolesti nebo s mírnou bolestí (0 4) p"i vstupu do studie Podíl subjekt# bez zhor!ení bolesti o > 4-Body po vstupu do studie 1,0 0,8 0,6 0,4 0,2 0,0 Subjekty v riziku Zoledronová kys. Denosumab HR 0,83 (95% CI: 0,76-0,92) P = 0,0002 Denosumab Zoledronová kyselina Denosumab byl spojen s lep!í prevencí bolesti ne" kyselina zoledronová BL T$den ve studii Medián dn# dle KM Denosumab 198 Zoledronová kyselina 143 Cleeland CS, et al. Ann Oncol 2010;21:8s (abstract 1248P) Do not copy or distribute Amgen Inc. All rights reserved.
13 Bolest: p%echod od $ádn!ch nebo slab!ch analgetik k siln!m opiát#m Studie fáze 3 karcinom prsu Podíl pacient) (%) ! denosumab (n=863)! zoledronová kyselina (n=848) * * * * m(síc *p<0,05, neupraveno pro multiplicitu Cleeland CS, Patrick DL, Fallowfield L, et al. SABCS 2010: abstract P a poster 13
14 Kvalita $ivota byla vy&&í p%i lé"b' denosumabem ve srovnání s lé"bou kyselinou zoledronovou po celou dobu studie Studie fáze 3 karcinom prsu 1 Pr)m(rná zm(na skóre FACT-G proti v"cho!í hodnot( denosumab (n = 913) Zoledronová kyselina (n = 890) M(síce Fallowfield L, et al. Poster presented at SABCS,
15 Ne$ádoucí p%íhody byly dle o"ekávání u této pacientské populace Studie fáze 3 Integrovaná anal"za Incidence, n (%) zoledronová kys. (n = 2836) denosumab (n = 2841) Ne!ádoucí p$íhoda (AE), v&echny stupn( 2745 (96,8) 2734 (96,2) Nej%ast(j&í AE Nauzea 895 (31,6) 876 (30,8) Anémie 859 (30,3) 771 (27,1) Únava 766 (27,0) 769 (27,1) Bolest zad 747 (26,3) 718 (25,3) Nechutenství 694 (24,5) 656 (23,1) CTCAE st, 3, 4 nebo (70,8) 2000 (70,4) AE vedoucí k p$eru&ení lé%by 280 (9,9) 270 (9,5) Lipton A et al. Poster presented at ESMO 35; Milan, Italy; 8 12 October, 2010 [Abstract 1249P]. 15 CTCAE, common terminology criteria for adverse events
16 Vybrané v!sledky bezpe"nosti: p%ehled z velkého vzorku pacient# Studie fáze 3 Integrovaná anal"za Incidence, n (%) zoledronová kys. (n = 2836) denosumab (n = 2841) Infek%ní AE 1218 (42,9) 1233 (43,4) Vá!né infek%ní AE 309 (10,9) 329 (11,6) Reakce akutní fáze (první 3 dny) 572 (20,2) 246 (8,7) Kumulativní %etnost ONJ 37 (1,3) 52 (1,8) Rok 1 15 (0,5) 22 (0,8) Rok 2 28 (1,0) 51 (1,8) Hypokalcémie 141 (5,0) 273 (9,6) (9.6) Nová primární malignita 18 (0,6) 28 (1,0) Lipton A et al. Poster presented at ESMO 35; Milan, Italy; 8 12 October, 2010 [Abstract 1249P]. 16
17 Souhrn: integrovaná anal!za doplnila v!sledky t%í pivotních studií fáze III Studie fáze 3 Integrovaná anal"za " denosumab prokázal superioritu v prevenci SRE vs. zoledronová kyselina: 1 " Signifikantn( del&í doba bez SRE (o 8,2 m(síce) " Signifikantn( mén( SRE celkem (18% redukce rizika) " Bezpe%nostní profil denosumabu byl stanoven u více ne! 5900 pacient) s pokro%il"m nádorov"m onemocn(ním " ONJ se vyskytovala vzácn( a s podobnou %etností jako u kyseliny zoledronové 2 " o 57% mén( reakcí akutní fáze vs. kyselina zoledronová 1 " Hypokalcémie se vyskytovala %ast(ji u denosumabu (9.6%) vs. zoledronová kys. (5.0%) 1 " nebyla spojena se symptomy nebo klinick"mi d)sledky " denosumab nem(l vliv na renální funkce a nebyla u n(j po!adována úprava dávky 1 1. Lipton A et al. Ann Oncol 2010;21(Suppl 8):viii379 [Abstract 1249P]; 2. Brown J et al. Presented at CIBD, 2010 [Abstract OC-15]. 17
18 Riziko hypokalcemie " * u nemocn"ch kte$í neu!ívají doporu%enou suplementaci kalcia a vit. D " * u nemocn"ch se záva!nou renální insuficiencí a u dialyzovan"ch Nej%ast(j&í v prvních 6 m(sících lé%by V dlouhodobém (postmarketingovém) sledování hlá&eny i symptomatické hypokalcemie (i fatální) 18
19 Doporu"ení v SPC - XGEVA " V&ichni nemocní bez hypokalcemie u!ívají alespo' 500 mg kalcia a 400 IU vit. D " P$ed zahájením lé%by nutno upravit preexistující hypokalcemii " U nemocn"ch s renální insuficiencí (+ clearance kreat. 30 mg/ml) a u dialyzovan"ch nutno monitorovat hodnoty kalcia " Suplementace kalciem kdykoliv p$i vzniku hypokalcemie 19
20 Prevence osteonekrózy "elisti - XGEVA " Zv"&ená pé%e o hygienu dutiny ústní. " P$ed zahájením lé%by odeslat preventivn( ke stomatologovi. " Stomatologická kontrola b(hem lé%by. 20
21 XGEVA: indikace a dávkování " Prevence kostních p$íhod (skeletal related events, SRE) (patologické fraktury, mí&ní komprese, stavy vy!adující radia%ní lé%bu kostí %i kostní operaci) u dosp(l"ch s metastázami solidních nádor) do kostí. " Doporu%ená dávka p$ípravku XGEVA je 120 mg, podávaná jednou za 4 t"dny ve form( jednorázové subkutánní injekce do stehna, b$icha nebo horní %ásti pa!e. 1. Lipton A et al. Ann Oncol 2010;21(Suppl 8):viii379 [Abstract 1249P]; 2. Brown J et al. Presented at CIBD, 2010 [Abstract OC-15]. 21
22 XGEVA " Od hrazena z ve$ejného zdravotního poji&t(ní. " Cenov( srovnatelná se Zometou. " Lze podávat i po selhání bisfosfonát). 22
23 V!znamn! p%ínos pro pacienty denosumab 27,6 SRE m(síce " denosumab má v"znamn" klinick" benefit ve srovnání s existující lé%bou v prodlou!ení doby do první SRE, men&í nefrotoxicit( a jednodu&&ím zp)sobu podání (aplikace) (EMA XGEVA EPAR, srpen 2011) XGEVA EPAR. EMA
24 Sou"asná doporu"ení zahrnují denosumab 120!mg Q4W v prevenci kostních p%íhod u!kostních metastáz NCCN ESMO ASCO EAU Modrá kniha Prs , 2012 Prostata , NSCLC , 2011, 2012 Ledviny ,, Mo%ov" m(ch"$, 2012, 2011, Zahrnut: denosumab bisfosfonáty, doporu%ení neexistují nebo není zmín(na lé%ba kostních p$íhod 24
25 DMO-CZE-AMG November-P
26 Zkrácené informace o lé"ivém p%ípravku!" Název lé"ivého p%ípravku: XGEVA 120 mg injek%ní roztok. Ú"inná látka a léková forma: denosumabum 120 mg v 1,7 ml (70 mg/ml) injek%ního roztoku. Denosumab je lidská monoklonální protilátka IgG2, která se vyrábí r-dna technologií. Terapeutické indikace: Prevence kostních p$íhod (patologické fraktury, mí&ní komprese, stavy vy!adující radia%ní lé%bu kostí %i kostní operaci) u dosp(l"ch s metastázami solidních nádor) do kostí. Dávkování a zp#sob podání: doporu%ená dávka p$ípravku XGEVA je 120 mg podávaná jednou za 4 t"dny ve form( jednorázové subkutánní injekce do stehna, b$icha nebo horní %ásti pa!e. Injek%ní lahvi%ku nechte p$ed podáním oh$át na pokojovou teplotu a roztok aplikujte pomalu. V&ichni pacienti, kte$í nemají hyperkalcémii, by m(li u!ívat alespo' 500 mg kalcia a 400 IU vitaminu D. Pediatrická populace: p$ípravek XGEVA se nedoporu%uje podávat d(tsk"m pacient)m (do 18 let v(ku). Kontraindikace: Hypersenzitivita na lé%ivou látku nebo kteroukoliv pomocnou látku. T(!ká, nelé%ená hypokalcémie. Zvlá&tní upozorn'ní a opat%ení pro pou$ití: V&ichni pacienti, kte$í nemají hyperkalcémii, by m(li u!ívat kalcium a vitamin D. Hypokalcémie: p$ed zahájením lé%by p$ípravkem XGEVA je t$eba upravit preexistující hypokalcémii. Hypokalcémií jsou více ohro!eni pacienti s t(!kou poruchou funkce ledvin (clearance kreatininu < 30 ml/min) nebo pacienti dialyzovaní. Osteonekróza %elisti: v"skyt osteonekrózy %elisti (osteonecrosis of the jaw, ONJ) byl hlá&en v rámci klinického hodnocení u pacient) s pokro%il"m maligním nádorov"m onemocn(ním postihujícím kosti. U t(chto pacient) se obvykle vyskytoval n(kter" z rizikov"ch faktor) ONJ: invazivní stomatologick" zákrok, &patná hygiena dutiny ústní nebo jiné preexistující onemocn(ní chrupu, pokro%ilé maligní onemocn(ní, infekce nebo konkomitantní protinádorová lé%ba. P$ed lé%bou p$ípravkem XGEVA by tito rizikoví pacienti m(li podstoupit preventivní zubní prohlídku a stomatologické o&et$ení. Po dobu lé%by by tito pacienti, pokud to bude mo!né, nem(li podstupovat invazivní stomatologické zákroky. Ko!ní infekce vy!adující hospitalizaci (zejména flegmóna-celulitida): v klinick"ch hodnoceních byly hlá&eny ko!ní infekce (zejména flegmóna-celulitida) vy!adující hospitalizaci. Pacienti by m(li b"t pou%ení, aby neodkladn( vyhledali léka$skou pomoc, pokud se u nich objeví známky %i p$íznaky flegmóny-celulitidy. Jiné: pacienti lé%ení p$ípravkem XGEVA by nem(li b"t sou%asn( lé%eni jin"mi lé%iv"mi p$ípravky obsahujícími denosumab (k lé%b( osteoporózy). Pacienti lé%ení p$ípravkem XGEVA by nem(li b"t sou%asn( lé%eni bisfosfonáty. Upozorn(ní na pomocné látky: pacient)m se vzácnou hereditární intolerancí fruktózy by nem(l b"t p$ípravek XGEVA podáván.!" Interakce s jin!mi lé"iv!mi p%ípravky a jiné formy interakce:!ádné studie interakcí nebyly provedeny. V klinick"ch hodnoceních byl p$ípravek XGEVA podáván konkomitantn( s chemoterapií a/nebo hormonální lé%bou nebo po p$edchozím nitro!ilním podávání bisfosfonát). Nebyly zji&t(ny!ádné klinicky signifikantní zm(ny sérové koncentrace nebo farmakodynamiky denosumabu. Fertilita, t'hotenství a kojení: XGEVA se nedoporu%uje podávat v t(hotenství a!enám ve fertilním v(ku nepou!ívajícím antikoncep%ní prost$edky. Není známo, zda se denosumab vylu%uje do lidského mate$ského mléka. Je t$eba se rozhodnout, zda ustoupit od kojení nebo zda nepodávat p$ípravek XGEVA, p$i%em! je nutno brát v úvahu p$ínos kojení pro novorozence/kojence a p$ínos lé%by p$ípravkem XGEVA pro pacientku. Ne$ádoucí ú"inky (NÚ): bezpe%nost p$ípravku XGEVA byla hodnocena v rámci klinick"ch hodnocení u pacient) s pokro%il"m maligním onemocn(ním postihujícím kosti. Velmi %ast"mi NÚ byly: du&nost a pr)jem; %asté NÚ p$edstavovaly hypokalcémie, hypofosfatémie, extrakce zubu, hyperhidróza a osteonekróza %elisti. Hypokalcémie t$etího a %tvrtého stupn( byla zji&t(no u 2,5 %, resp. 0,6 % pacient) lé%en"ch p$ípravkem XGEVA. Po uvedení p$ípravku na trh byla hlá&ena záva!ná symptomatická hypokalcémie (v%etn( fatálních p$ípad)).osteonekróza %elisti (ONJ) byla ve 3 kontrolovan"ch klinick"ch hodnoceních fáze III potvrzena u 1,8 % pacient) lé%en"ch p$ípravkem XGEVA. V(t&ina (81 %) pacient) m(la v anamnéze extrakci zubu, &patnou hygienu dutiny ústní, a/nebo pou!ívání zubních náhrad a byla navíc aktuáln( nebo p$edtím lé%ena chemoterapií.!" Zvlá&tní opat%ení pro uchovávání: uchovávejte p$i 2 8 C (v chladni%ce). Chra'te p$ed mrazem. Chra'te p$ed sv(tlem. DR(ITEL ROZHODNUTÍ O REGISTRACI Amgen Europe B.V., Minervum 7061, 4817 ZK Breda, Nizozemsko REGISTRA)NÍ )ÍSLO: EU/1/11/703/ DATUM REVIZE TEXTU: 23. srpen P$ed p$edepsáním p$ípravku se, prosím, seznamte s úpln"m zn(ním Souhrnu údaj) o p$ípravku. P$ípravek je od hrazen z prost$edk) zdravotního poji&t(ní.
27 Podpo%eno z prost%edk# projektu Eduka%ní a informa%ní platforma onkologick"ch center pro podporu a modernizaci vzd(lávání a léka$sk"ch a p$íbuzn"ch medicínsk"ch oborech. CZ 2.07/2.4.00/ D'kuji za pozornost 27
28 Back up slides 28
29 Sekven"ní testování cíl# pou$ité p%i pr#kazu superiority Primární Sekundární Doba do první SRE ve studii (noninferiorita) " Doba do první SRE ve studii (superiorita) " Doba do první a dal&í(ch) SRE (superiorita) " Bezpe%nost a tolerabilita!" Pokud byl dosa!en primární cíl noninferiority, byl proveden test na superioritu sekundárních cíl)!" SRE byly definovány jako n(která z následujících situací: " Patologická zlomenina Operace kosti " Ozá$ení kosti Mí&ní komprese Fizazi K et al. Lancet 2011;377:
30 Pain Evaluated with BPI-SF!" The BPI-SF is a validated instrument that uses an 11-point numerical rating scale.!" Patients rated pain severity at its worst from no pain (0) to pain as bad as can be imagined (10).!" Levels of pain severity are categorized by no/mild, moderate, and severe pain. Brief-Pain Inventory Short Form (Worst pain) 2 Please rate your pain by circling the one number that best describes your pain at it s worst in the last week. No pain Pain as bad as you can imagine No pain Mild pain Moderate pain Severe pain 1. Fallowfield L, von Moos R, Patrick D, et al. EMCC 2011: abstract 7004 and oral presentation; 2. Cleeland CS. Clin Cancer Res 2006;12:6236s-6242s. 30
31 BPI Short Form 1. Throughout our lives, most of us have had pain from time to time (such as minor headaches, sprains and toothaches). Have you had pain other than these everyday kinds of pain today? 1. Yes 0. No Front Back 2." On the diagram, shade the areas where you feel pain. Put an X on the area that hurts the most. Left Right Left Right 3." Please rate your pain by circling the one number that best describes your pain at its worst in the last week " Please rate your pain by circling the one number that best describes your pain at its least in the last week " Please rate your pain by circling the one number that best describes your pain on the average " Please rate your pain by circling the one number that tells how much pain you have right now No Pain Pain as bad as you can imagine 1. Cleeland CS. Brief Pain Inventory User Guide. Houston, TX. 2009; 2. Cleeland CS, Patrick DL, Fallowfield L, et al. ESMO 2010: abstract 1248P and poster presentation. 31
32 BPI-SF Pain Interference Items Cleeland CS, Patrick DL, Fallowfield L, et al. SABCS 2010: abstract P and poster presentation. 32
Kostní metastázy solidních tumorů. L. Ostřížková, D. Brančíková
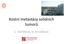 Kostní metastázy solidních tumorů L. Ostřížková, D. Brančíková Metastatické kostní postižení je časté 5-letá světová Prevalence V tisicích 1 Proporce vzniklých metastáz Incidence kostních metastáz u pokročilých
Kostní metastázy solidních tumorů L. Ostřížková, D. Brančíková Metastatické kostní postižení je časté 5-letá světová Prevalence V tisicích 1 Proporce vzniklých metastáz Incidence kostních metastáz u pokročilých
Celostátní spondyloonkologické sympozium NÁDORY A METASTATICKÉ ONEMOCNĚNÍ PÁTEŘE. 11. června 2015 Brno, hotel International PR O G R A M S Y M P OZIA
 Celostátní spondyloonkologické sympozium NÁDORY A METASTATICKÉ ONEMOCNĚNÍ PÁTEŘE 11. června 2015 Brno, hotel International PR O G R A M S Y M P OZIA ve spolupráci s Masarykovým onkologickým ústavem pořádá
Celostátní spondyloonkologické sympozium NÁDORY A METASTATICKÉ ONEMOCNĚNÍ PÁTEŘE 11. června 2015 Brno, hotel International PR O G R A M S Y M P OZIA ve spolupráci s Masarykovým onkologickým ústavem pořádá
27. FARMAKOTERAPIE KOSTNÍ NÁDOROVÉ NEMOCI
 27. FARMAKOTERAPIE KOSTNÍ NÁDOROVÉ NEMOCI 27.1 Kostní nádorová nemoc Kostěný skelet je jedním z nejčastějších míst nádorové diseminace. Kostní metastázy jsou zdrojem závažné morbidity: působí bolest, omezují
27. FARMAKOTERAPIE KOSTNÍ NÁDOROVÉ NEMOCI 27.1 Kostní nádorová nemoc Kostěný skelet je jedním z nejčastějších míst nádorové diseminace. Kostní metastázy jsou zdrojem závažné morbidity: působí bolest, omezují
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele XGEVA 120 mg injekční roztok denosumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele XGEVA 120 mg injekční roztok denosumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Jedna lahvička se 100 ml roztoku obsahuje acidum zoledronicum 4 mg (jako acidum zoledronicum monohydricum).
 1. NÁZEV PŘÍPRAVKU Zoledronic acid medac 4 mg/100 ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička se 100 ml roztoku obsahuje acidum zoledronicum 4 mg (jako acidum zoledronicum
1. NÁZEV PŘÍPRAVKU Zoledronic acid medac 4 mg/100 ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička se 100 ml roztoku obsahuje acidum zoledronicum 4 mg (jako acidum zoledronicum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls238740/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zerlinda /100 ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden vak se 100 ml infuzního roztoku obsahuje acidum zoledronicum
sp. zn. sukls238740/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zerlinda /100 ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden vak se 100 ml infuzního roztoku obsahuje acidum zoledronicum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Zometa 4 mg prášek a rozpouštědlo pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje acidum zoledronicum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Zometa 4 mg prášek a rozpouštědlo pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje acidum zoledronicum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU XGEVA 120 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje denosumabum 120 mg v 1,7 ml roztoku (70 mg/ml).
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU XGEVA 120 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje denosumabum 120 mg v 1,7 ml roztoku (70 mg/ml).
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok Ibandronic Acid Accord 6 mg koncentrát pro infuzní roztok acidum ibandronicum
 Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok acidum ibandronicum Máte- Pokud se kterýkoli z než V 1. Ibandronic Acid Accord a k 2. Ibandronic Acid Accord používat 3. Ibandronic Acid Accord
Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok acidum ibandronicum Máte- Pokud se kterýkoli z než V 1. Ibandronic Acid Accord a k 2. Ibandronic Acid Accord používat 3. Ibandronic Acid Accord
29. FARMAKOTERAPIE KOSTNÍ NÁDOROVÉ NEMOCI
 29. FARMAKOTERAPIE KOSTNÍ NÁDOROVÉ NEMOCI 29.1 Kostní nádorová nemoc Skelet je jedním z nejčastějších míst nádorové diseminace. Kostní metastázy jsou zdrojem závažné morbidity: působí bolest, omezují hybnost,
29. FARMAKOTERAPIE KOSTNÍ NÁDOROVÉ NEMOCI 29.1 Kostní nádorová nemoc Skelet je jedním z nejčastějších míst nádorové diseminace. Kostní metastázy jsou zdrojem závažné morbidity: působí bolest, omezují hybnost,
Smrnice správné klinické praxe vydané 1.5.1996 Mezinárodní konferencí pro harmonizaci
 ICH E6 Smrnice správné klinické praxe vydané 1.5.1996 Mezinárodní konferencí pro harmonizaci ICH International conference on harmonization = Mezinárodní konference pro harmonizaci (EU, USA, Japonsko) CRO
ICH E6 Smrnice správné klinické praxe vydané 1.5.1996 Mezinárodní konferencí pro harmonizaci ICH International conference on harmonization = Mezinárodní konference pro harmonizaci (EU, USA, Japonsko) CRO
Možnosti léčby CRPC s časem přibývají
 Možnosti léčby CRPC s časem přibývají Jana Katolická Onkologicko-chirurgické oddělení Fakultní nemocnice u Sv. Anny Mnoho studií - jen čtyři nové léky Enzalutamid Abirateron + prednison Cabazitaxel Radium-223
Možnosti léčby CRPC s časem přibývají Jana Katolická Onkologicko-chirurgické oddělení Fakultní nemocnice u Sv. Anny Mnoho studií - jen čtyři nové léky Enzalutamid Abirateron + prednison Cabazitaxel Radium-223
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Zoledronic acid Richter 4 mg/5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum
1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Zoledronic acid Richter 4 mg/5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum
Oficiální v!sledky Národního programu mamografického screeningu v roce 2012
 Oficiální v!sledky Národního programu mamografického screeningu v roce 2012 Jan Dane!, Helena Barto"ková, Miroslava Skovajsová Anal!za dat: Ond#ej Májek, Daniel Klime!, Ladislav Du!ek Úvod!! V!eské republice
Oficiální v!sledky Národního programu mamografického screeningu v roce 2012 Jan Dane!, Helena Barto"ková, Miroslava Skovajsová Anal!za dat: Ond#ej Májek, Daniel Klime!, Ladislav Du!ek Úvod!! V!eské republice
Patofyziologie kostní nádorové nemoci a možnosti farmakoterapie
 Patofyziologie kostní nádorové nemoci a možnosti farmakoterapie Peter Grell Klinika komplexní onkologické péče Masarykův onkologický ústav Brno Kongres traumatologie a muskuloskeletální radiologie 14.
Patofyziologie kostní nádorové nemoci a možnosti farmakoterapie Peter Grell Klinika komplexní onkologické péče Masarykův onkologický ústav Brno Kongres traumatologie a muskuloskeletální radiologie 14.
Studie FREEDOM a extenze na 10 let design
 Studie FREEDOM a extenze na 10 let design 3letá mezinárodní studie kontrolovaná placebem FREEDOM 7letá mezinárodní otevřená studie s 1 větví EXTENZE R A N D O M I Z A C E roky 0 1 2 3 4 5 6 7 8 9 10 A
Studie FREEDOM a extenze na 10 let design 3letá mezinárodní studie kontrolovaná placebem FREEDOM 7letá mezinárodní otevřená studie s 1 větví EXTENZE R A N D O M I Z A C E roky 0 1 2 3 4 5 6 7 8 9 10 A
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Prolia 60 mg injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Prolia 60 mg injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka obsahuje
29. FARMAKOTERAPIE KOSTNÍ NÁDOROVÉ NEMOCI
 29. FARMAKOTERAPIE KOSTNÍ NÁDOROVÉ NEMOCI 29.1 Kostní nádorová nemoc Skelet je jedním z nejčastějších míst nádorové diseminace. Kostní metastázy jsou zdrojem závažné morbidity: způsobují bolest, omezují
29. FARMAKOTERAPIE KOSTNÍ NÁDOROVÉ NEMOCI 29.1 Kostní nádorová nemoc Skelet je jedním z nejčastějších míst nádorové diseminace. Kostní metastázy jsou zdrojem závažné morbidity: způsobují bolest, omezují
Možnosti ovlivnění kostní patologie. MUDr. Jana Katolická, PhD
 Možnosti ovlivnění kostní patologie MUDr. Jana Katolická, PhD Kostní metastázy skelet častou cílovou tkání pro metastázy v bohatě vaskularizované tkáni mechanizmy chemoatrakce seed and soil, mechanizmy
Možnosti ovlivnění kostní patologie MUDr. Jana Katolická, PhD Kostní metastázy skelet častou cílovou tkání pro metastázy v bohatě vaskularizované tkáni mechanizmy chemoatrakce seed and soil, mechanizmy
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Příloha I Vědecké zdůvodnění a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha I Vědecké zdůvodnění a zdůvodnění změny podmínek rozhodnutí o registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké zdůvodnění a zdůvodnění změny podmínek rozhodnutí o registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR)
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Souhrn údajů o přípravku
 sp.zn. sukls219612/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU BONEFOS koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu obsahuje: dinatrii clodronas tetrahydricus
sp.zn. sukls219612/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU BONEFOS koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu obsahuje: dinatrii clodronas tetrahydricus
Novinky v léčbě. Úvod: Srdeční selhání epidemie 21. století. Prof. MUDr. Jindřich Špinar, CSc., FESC Interní kardiologická klinika FN Brno
 Novinky v léčbě Úvod: Srdeční selhání epidemie 21. století Prof. MUDr. Jindřich Špinar, CSc., FESC Interní kardiologická klinika FN Brno PARADIGM-HF: Design studie Randomizace n=8442 Dvojitě slepá Léčebná
Novinky v léčbě Úvod: Srdeční selhání epidemie 21. století Prof. MUDr. Jindřich Špinar, CSc., FESC Interní kardiologická klinika FN Brno PARADIGM-HF: Design studie Randomizace n=8442 Dvojitě slepá Léčebná
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Biologická léčba karcinomu prsu. Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN)
 Biologická léčba karcinomu prsu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN) Cílená léčba Ca prsu Trastuzumab (HercepNn) AnN HER2 neu pronlátka LapaNnib (Tyverb)
Biologická léčba karcinomu prsu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN) Cílená léčba Ca prsu Trastuzumab (HercepNn) AnN HER2 neu pronlátka LapaNnib (Tyverb)
BONEFOS (Dinatrii clodronas) koncentrát pro přípravu infúzního roztoku
 Příloha č. 2 ke sdělení sp. zn. sukls18805/2011 a příloha ke sp. zn. sukls18806/2011 Příbalová informace:informace pro uživatele BONEFOS (Dinatrii clodronas) koncentrát pro přípravu infúzního roztoku Držitel
Příloha č. 2 ke sdělení sp. zn. sukls18805/2011 a příloha ke sp. zn. sukls18806/2011 Příbalová informace:informace pro uživatele BONEFOS (Dinatrii clodronas) koncentrát pro přípravu infúzního roztoku Držitel
Design studie. KH fáze 3- DEFEND - preventivní studie. Multicentrická, dvojitě zaslepená, placebem kontrolovaná studie. Měsíce 24.
 Design studie KH fáze 3- DEFEND - preventivní studie Den 1 Návštěva 1 6 Měsíce 12 18 24 Studijní populace 332 postmenopauzálních žen T-skóre bederní páteře mezi 1. a 2.5 S C R E E N I N G R A N D O M I
Design studie KH fáze 3- DEFEND - preventivní studie Den 1 Návštěva 1 6 Měsíce 12 18 24 Studijní populace 332 postmenopauzálních žen T-skóre bederní páteře mezi 1. a 2.5 S C R E E N I N G R A N D O M I
Karcinom prsu a radioterapie
 Karcinom prsu a radioterapie Mezioborov! multidisciplinární seminá" Zhoubné nádory prsu projekt OPVK Eduka#ní a informa#ní platforma onkologick!ch center pro podporu a modernizaci vzd$lávání v léka"sk!ch
Karcinom prsu a radioterapie Mezioborov! multidisciplinární seminá" Zhoubné nádory prsu projekt OPVK Eduka#ní a informa#ní platforma onkologick!ch center pro podporu a modernizaci vzd$lávání v léka"sk!ch
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele XGEVA 120 mg injekční roztok denosumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele XGEVA 120 mg injekční roztok denosumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Bevacizumab u starších pacientů s kolorektálním karcinomem
 Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT IKARUS. Neintervenční epidemiologická studie
 CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT Neintervenční epidemiologická studie PROTOKOL PROJEKTU Verze: 4.0 Datum: 26.09.2006 Strana 2 PROTOKOL PROJEKTU
CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT Neintervenční epidemiologická studie PROTOKOL PROJEKTU Verze: 4.0 Datum: 26.09.2006 Strana 2 PROTOKOL PROJEKTU
Novinky ve screeningu vybrané kapitoly. Jan Dane!
 Novinky ve screeningu vybrané kapitoly Jan Dane! Projekt EU ke zv!"ení ú#asti Systém podpory prevence vybran!ch nádorov!ch onemocn$ní %R screeningové programy (nádory prsu, d$lo&ního hrdla a tlustého st'eva)!!
Novinky ve screeningu vybrané kapitoly Jan Dane! Projekt EU ke zv!"ení ú#asti Systém podpory prevence vybran!ch nádorov!ch onemocn$ní %R screeningové programy (nádory prsu, d$lo&ního hrdla a tlustého st'eva)!!
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Kyselina zoledronová +pharma 4 mg/5 ml, koncentrát pro infuzní roztok
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Kyselina zoledronová +pharma 4 mg/5 ml, koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Kyselina zoledronová +pharma 4 mg/5 ml, koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. sukls179374/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ZENDRACTIN 4mg/100 ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje acidum zoledronicum 4
Sp. zn. sukls179374/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ZENDRACTIN 4mg/100 ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje acidum zoledronicum 4
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Prolia 60 mg injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Prolia 60 mg injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o změně registrace sp. zn. sukls159867/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rismyl 35 mg potahované tablety natrii risedronas 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o změně registrace sp. zn. sukls159867/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rismyl 35 mg potahované tablety natrii risedronas 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
RCD s.r.o. Americká Dob!ichovice DI": CZ !!!!!!!!!!!!!! VLIV PREPARÁTU BIOCOL NA R!ST LIDSKÉHO KARCINOMU COLON (LINIE HCT 116) U
 RCD s.r.o. Americká 632 252 29 Dobichovice DI": CZ47052511 VLIV PREPARÁTU BIOCOL NA RST LIDSKÉHO KARCINOMU COLON (LINIE HCT 116) U NU/NU MY"Í Zadavatel: ASCOLOR-BIOTEC s.r.o. #ídící pracovník studie: Doc.
RCD s.r.o. Americká 632 252 29 Dobichovice DI": CZ47052511 VLIV PREPARÁTU BIOCOL NA RST LIDSKÉHO KARCINOMU COLON (LINIE HCT 116) U NU/NU MY"Í Zadavatel: ASCOLOR-BIOTEC s.r.o. #ídící pracovník studie: Doc.
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jeden vak o objemu 100 ml obsahuje acidum zoledronicum 4 mg (ve formě acidum zoledronicum monohydricum).
 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Zoledronic Acid Hospira /100 ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden vak o objemu 100 ml obsahuje acidum zoledronicum (ve formě acidum
1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Zoledronic Acid Hospira /100 ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden vak o objemu 100 ml obsahuje acidum zoledronicum (ve formě acidum
satelitní sympozium společnosti Amgen Když ODPOVĚĎ je výjimečná
 satelitní sympozium společnosti Amgen Když ODPOVĚĎ je výjimečná Vážená paní doktorko, vážený pane doktore, rádi bychom Vás pozvali na satelitní sympozium společnosti Amgen, které proběhne u příležitosti
satelitní sympozium společnosti Amgen Když ODPOVĚĎ je výjimečná Vážená paní doktorko, vážený pane doktore, rádi bychom Vás pozvali na satelitní sympozium společnosti Amgen, které proběhne u příležitosti
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum zoledronicum 4 mg (ve formě acidum zoledronicum monohydricum).
 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Zoledronic Acid Hospira /5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum
1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Zoledronic Acid Hospira /5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
Udržovací léčba: zamířeno na anti-vegf léčbu Alan Sandler
 Udržovací léčba: zamířeno na anti-vegf léčbu Alan Sandler Department of Hematology/Oncology Oregon Health and Science University Knight Cancer Institute Portland, OR, USA Medián OS (měsíce) Studie v 1.linii
Udržovací léčba: zamířeno na anti-vegf léčbu Alan Sandler Department of Hematology/Oncology Oregon Health and Science University Knight Cancer Institute Portland, OR, USA Medián OS (měsíce) Studie v 1.linii
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aranesp 10 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp 15 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aranesp 10 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp 15 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp
Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky
 Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky Prof. MUDr. Jitka Abrahámová, DrSc Onkologická klinika TN a 1. LF UK KOC (NNB + VFN + TN) St Gallén 2011 Rozsah onemocnění T, N, M ER, PgR
Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky Prof. MUDr. Jitka Abrahámová, DrSc Onkologická klinika TN a 1. LF UK KOC (NNB + VFN + TN) St Gallén 2011 Rozsah onemocnění T, N, M ER, PgR
v eské republice Du$ek L., Mu%ík J. Institut biostatistiky a anal!z, Masarykova univerzita, Brno
 Institut biostatistiky a anal!z Léka"ská a P"írodov#decká fakulta Masarykova univerzita Epidemiologie gynekologick!ch nádor v eské republice Du$ek L., Mu%ík J. Institut biostatistiky a anal!z, Masarykova
Institut biostatistiky a anal!z Léka"ská a P"írodov#decká fakulta Masarykova univerzita Epidemiologie gynekologick!ch nádor v eské republice Du$ek L., Mu%ík J. Institut biostatistiky a anal!z, Masarykova
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Zoledronic Acid Hospira 4 mg/5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Zoledronic Acid Hospira 4 mg/5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls170515/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Risedronat Mylan 35 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls170515/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Risedronat Mylan 35 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zoledronic Acid Hospira 4 mg/5 ml, koncentrát pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zoledronic Acid Hospira 4 mg/5 ml, koncentrát pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum zoledronicum 4 mg (ve formě acidum zoledronicum monohydricum).
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zoledronic Acid Hospira 4 mg/5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zoledronic Acid Hospira 4 mg/5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum zoledronicum 4 mg (ve formě acidum zoledronicum monohydricum).
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zoledronic Acid Hospira 4 mg/5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zoledronic Acid Hospira 4 mg/5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Prolia 60 mg injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Prolia 60 mg injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna injekční lahvička obsahuje acidum zoledronicum 4 mg, což odpovídá 4,264 mg acidum zoledronicum monohydricum.
 Sp.zn.sukls216868/2015 a sp.zn.sukls178453/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zoledronic acid Zentiva 4 mg/100 ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička
Sp.zn.sukls216868/2015 a sp.zn.sukls178453/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zoledronic acid Zentiva 4 mg/100 ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Prolia 60 mg injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Prolia 60 mg injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zoledronic Acid Pfizer /5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zoledronic Acid Pfizer /5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum
Celkové závěry vědeckého hodnocení přípravku Femara a souvisejících názvů (viz příloha I)
 Příloha II Vědecké závěry a zdůvodnění potřebných úprav v souhrnu údajů o přípravku, označení na obalu a příbalové informaci předkládané Evropskou agenturou pro léčivé přípravky 7 Vědecké závěry Celkové
Příloha II Vědecké závěry a zdůvodnění potřebných úprav v souhrnu údajů o přípravku, označení na obalu a příbalové informaci předkládané Evropskou agenturou pro léčivé přípravky 7 Vědecké závěry Celkové
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Zoledronic acid medac 4 mg/5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Zoledronic acid medac 4 mg/5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zoledronic Acid Hospira 4 mg/100 ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden vak o objemu 100 ml obsahuje acidum zoledronicum 4 mg (ve formě
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zoledronic Acid Hospira 4 mg/100 ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden vak o objemu 100 ml obsahuje acidum zoledronicum 4 mg (ve formě
Přehled změn vybraných kapitol
 Přehled změn vybraných kapitol (aneb najdi 10 rozdílů.) změny guidelines 2012 Nové léčebné odpovědi Bendamustin Profylaxe infekčních komplikací Profylaxe TEN Léčba pacientů s renální insuficiencí Léčba
Přehled změn vybraných kapitol (aneb najdi 10 rozdílů.) změny guidelines 2012 Nové léčebné odpovědi Bendamustin Profylaxe infekčních komplikací Profylaxe TEN Léčba pacientů s renální insuficiencí Léčba
Možnosti léčby CRPC. Michaela Matoušková
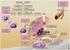 Možnosti léčby CRPC Michaela Matoušková Pokročilý karcinom prostaty prevalence CaP 65215 pokročilý CaP st. III 8492 st. IV 5884 14376 CRPC cca 900-1000 Zdroj dat www.uroweb.cz CRPC Kastrační hladina testosteronu
Možnosti léčby CRPC Michaela Matoušková Pokročilý karcinom prostaty prevalence CaP 65215 pokročilý CaP st. III 8492 st. IV 5884 14376 CRPC cca 900-1000 Zdroj dat www.uroweb.cz CRPC Kastrační hladina testosteronu
Revlimid v léčbě myelomu u nemocných s renální insuficiencí MUDr. Jan Straub
 Revlimid v léčbě myelomu u nemocných s renální insuficiencí MUDr. Jan Straub Updated December 2009. 1 Závěry s ASH 2009 Len-Dex u rr MM s úpravou dávkování v závislosti na stupni renální insuficience Soubor
Revlimid v léčbě myelomu u nemocných s renální insuficiencí MUDr. Jan Straub Updated December 2009. 1 Závěry s ASH 2009 Len-Dex u rr MM s úpravou dávkování v závislosti na stupni renální insuficience Soubor
Sp.zn.sukls113275/2013, sukls113277/2013, sukls113278/2013, sukls113279/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls113275/2013, sukls113277/2013, sukls113278/2013, sukls113279/2013 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Vitamin D 3 Radaydrug 800 IU potahované tablety Vitamin D 3 Radaydrug 1 000 IU potahované
Sp.zn.sukls113275/2013, sukls113277/2013, sukls113278/2013, sukls113279/2013 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Vitamin D 3 Radaydrug 800 IU potahované tablety Vitamin D 3 Radaydrug 1 000 IU potahované
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls104507/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alendronat-ratiopharm 70 mg tablety 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls104507/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alendronat-ratiopharm 70 mg tablety 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Prolia 60 mg injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Prolia 60 mg injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka obsahuje
Příbalová informace: informace pro uživatele. Zoledronic acid medac 4 mg/100 ml infuzní roztok. Acidum zoledronicum
 Příbalová informace: informace pro uživatele Zoledronic acid medac 4 mg/100 ml infuzní roztok Acidum zoledronicum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek podáván,
Příbalová informace: informace pro uživatele Zoledronic acid medac 4 mg/100 ml infuzní roztok Acidum zoledronicum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek podáván,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls254000/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TAIRA /5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu obsahuje
Sp.zn.sukls254000/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TAIRA /5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu obsahuje
Oficiální v!sledky Národního programu mamografického screeningu v roce 2013
 Oficiální v!sledky Národního programu mamografického screeningu v roce 2013 Jan Dane!, Helena Barto"ková, Miroslava Skovajsová Anal!za dat: Ond#ej Májek, Ond#ej Ngo, Daniel Klime!, Ladislav Du!ek Úvod!!
Oficiální v!sledky Národního programu mamografického screeningu v roce 2013 Jan Dane!, Helena Barto"ková, Miroslava Skovajsová Anal!za dat: Ond#ej Májek, Ond#ej Ngo, Daniel Klime!, Ladislav Du!ek Úvod!!
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zoledronic Acid Hospira 4 mg/5 ml, koncentrát pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zoledronic Acid Hospira 4 mg/5 ml, koncentrát pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu
Novinky z informa!ní podpory screeningového programu
 Novinky z informa!ní podpory screeningového programu Ond!ej Májek, Ladislav Du"ek, Jan Mu#ík, Tomá" Pavlík, Daniel Klime" Odborná garance programu: Jan Dane!, Helena Barto"ková, Miroslava Skovajsová Princip
Novinky z informa!ní podpory screeningového programu Ond!ej Májek, Ladislav Du"ek, Jan Mu#ík, Tomá" Pavlík, Daniel Klime" Odborná garance programu: Jan Dane!, Helena Barto"ková, Miroslava Skovajsová Princip
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum zoledronicum 4 mg (ve formě acidum zoledronicum monohydricum).
 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Zoledronic Acid Hospira 4 mg/5 ml, koncentrát pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu
1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Zoledronic Acid Hospira 4 mg/5 ml, koncentrát pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu
Osteonekŕóza čelisti v průběhu léčby bisfosfonáty přehled literární údajů
 Osteonekŕóza čelisti v průběhu léčby bisfosfonáty přehled literární údajů Zdeněk Adam FN Brno a LF MU Brno Definice ostenokrózy čelisti (ONČ) Nehojící se ložisko v čelisti s nebo bez bolesti po dobu nejméně
Osteonekŕóza čelisti v průběhu léčby bisfosfonáty přehled literární údajů Zdeněk Adam FN Brno a LF MU Brno Definice ostenokrózy čelisti (ONČ) Nehojící se ložisko v čelisti s nebo bez bolesti po dobu nejméně
XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY
 NÁDORY PROSTATY 63 XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY Kolektiv autorů Úvod Léčivý přípravek (radium-223 dichlorid) byl 13. listopadu 2013 schválen
NÁDORY PROSTATY 63 XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY Kolektiv autorů Úvod Léčivý přípravek (radium-223 dichlorid) byl 13. listopadu 2013 schválen
Injekční roztok. Tmavě hnědý, neprůhledný roztok s ph 5,0 7,0 a s přibližnou osmolaritou 400 mosm/l.
 sp.zn. sukls57833/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
sp.zn. sukls57833/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
Terapie kastračně refrakterního(kr) karcinomu prostaty. Onkologická klinika 2. LF UK, FN Motol, Praha
 Terapie kastračně refrakterního(kr) karcinomu prostaty Onkologická klinika 2. LF UK, FN Motol, Praha Kritéria pro kastračně rezistentní karcinom prostaty ( EAU 2013 ) Kastrační hodnota testosteronu v séru
Terapie kastračně refrakterního(kr) karcinomu prostaty Onkologická klinika 2. LF UK, FN Motol, Praha Kritéria pro kastračně rezistentní karcinom prostaty ( EAU 2013 ) Kastrační hodnota testosteronu v séru
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Zoledronic acid Actavis 4 mg/5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Zoledronic acid Actavis 4 mg/5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu
Rozbor léčebné zátěže Thomayerovy nemocnice onkologickými pacienty a pilotní prezentace výsledků péče
 Rozbor léčebné zátěže Thomayerovy nemocnice onkologickými pacienty a pilotní prezentace výsledků péče Výstupy analýzy dat zdravotnického zařízení a Národního onkologického registru ČR Prof. MUDr. Jitka
Rozbor léčebné zátěže Thomayerovy nemocnice onkologickými pacienty a pilotní prezentace výsledků péče Výstupy analýzy dat zdravotnického zařízení a Národního onkologického registru ČR Prof. MUDr. Jitka
P ÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Singulair 4 MINI, žvýkací tablety montelukastum
 PÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Singulair 4 MINI, žvýkací tablety montelukastum Pette si pozorn celou píbalovou informaci díve, než zanete tento pípravek užívat. Ponechte si píbalovou informaci
PÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Singulair 4 MINI, žvýkací tablety montelukastum Pette si pozorn celou píbalovou informaci díve, než zanete tento pípravek užívat. Ponechte si píbalovou informaci
Doporučený postup při řešení krvácivých komplikací u nemocných léčených přímými inhibitory FIIa a FXa (NOAC)
 Doporučený postup při řešení krvácivých komplikací u nemocných léčených přímými inhibitory FIIa a FXa (NOAC) Preambule: Dabigatran, rivaroxaban, apixaban jsou nová perorální antikoagulancia (NOAC), jejichž
Doporučený postup při řešení krvácivých komplikací u nemocných léčených přímými inhibitory FIIa a FXa (NOAC) Preambule: Dabigatran, rivaroxaban, apixaban jsou nová perorální antikoagulancia (NOAC), jejichž
Atestační otázky z oboru klinická stomatologie
 Publikováno z 2. léka?ská fakulta Univerzity Karlovy (https://www.lf2.cuni.cz) LF2 > Atesta?ní otázky z oboru klinická stomatologie Atestační otázky z oboru klinická stomatologie A. Ústní biologie a fyziologie
Publikováno z 2. léka?ská fakulta Univerzity Karlovy (https://www.lf2.cuni.cz) LF2 > Atesta?ní otázky z oboru klinická stomatologie Atestační otázky z oboru klinická stomatologie A. Ústní biologie a fyziologie
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna injekční lahvička obsahuje acidum zoledronicum 4 mg, což odpovídá acidum zoledronicum monohydricum 4,26 mg.
 Sp.zn.sukls46060/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zoledronic acid Stada /100 ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje acidum zoledronicum,
Sp.zn.sukls46060/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zoledronic acid Stada /100 ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje acidum zoledronicum,
Norifaz 35 mg potahované tablety
 Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls18991/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Norifaz 35 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta
Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls18991/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Norifaz 35 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls137371/2011 sp. zn. sukls59100/2012 a sukls137336/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Calcium/Vitamin D3 Acis 500 mg/400 IU Žvýkací tableta 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls137371/2011 sp. zn. sukls59100/2012 a sukls137336/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Calcium/Vitamin D3 Acis 500 mg/400 IU Žvýkací tableta 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Pioneer in Rare Diseases. Pozvánka na satelitní sympozium společnosti SOBI. Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B?
 Pioneer in Rare Diseases Pozvánka na satelitní sympozium společnosti SOBI Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom
Pioneer in Rare Diseases Pozvánka na satelitní sympozium společnosti SOBI Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls179451/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zomikos /5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička s obsahem 5 ml koncentrátu obsahuje
Sp.zn.sukls179451/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zomikos /5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička s obsahem 5 ml koncentrátu obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Zoledronic Acid Accord 4 mg / 5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Zoledronic Acid Accord 4 mg / 5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls185574/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zomikos 4 mg/5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička s obsahem 5 ml koncentrátu obsahuje
Sp.zn.sukls185574/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zomikos 4 mg/5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička s obsahem 5 ml koncentrátu obsahuje
Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls128523/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls128523/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ibandronic Acid Sandoz 2 mg/2 ml koncentrát pro přípravu infuzního roztoku acidum ibandronicum
Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls128523/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ibandronic Acid Sandoz 2 mg/2 ml koncentrát pro přípravu infuzního roztoku acidum ibandronicum
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum zoledronicum 4 mg (jako monohydrát).
 1. NÁZEV PŘÍPRAVKU Zoledronic acid medac 4 mg/5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum zoledronicum 4 mg (jako
1. NÁZEV PŘÍPRAVKU Zoledronic acid medac 4 mg/5 ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 5 ml koncentrátu obsahuje acidum zoledronicum 4 mg (jako
Karbapenemy v intenzivní péči K. Urbánek
 Karbapenemy v intenzivní péči K. Urbánek Ústav farmakologie Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc Rozdělení Skupina I Skupina II ertapenem, panipenem, tebipenem omezený účinek
Karbapenemy v intenzivní péči K. Urbánek Ústav farmakologie Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc Rozdělení Skupina I Skupina II ertapenem, panipenem, tebipenem omezený účinek
Bisfosfonáty v léčbě generalizovaného karcinomu prostaty. MUDr. Martin FoldynA
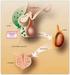 Bisfosfonáty v léčbě generalizovaného karcinomu prostaty MUDr. Martin FoldynA Výskyt kostních mts u různých maligních onemocnění 5letá světová prevalence /tisíce/ Incidence kostních mts (%) Medián přežití
Bisfosfonáty v léčbě generalizovaného karcinomu prostaty MUDr. Martin FoldynA Výskyt kostních mts u různých maligních onemocnění 5letá světová prevalence /tisíce/ Incidence kostních mts (%) Medián přežití
Pomocné látky se známým účinkem : Jedna potahovaná tableta obsahuje částečně hydrogenovaný sojový olej 0,3 mg a sacharózu 1,52 mg.
 Sp.zn.sukls21356/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Calcium Cholecalciferol Béres 600 mg/400 IU potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje
Sp.zn.sukls21356/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Calcium Cholecalciferol Béres 600 mg/400 IU potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje
Od opia k melatoninu aneb Práce s nespavým pacientem
 Soubor pøednášek ze semináøe Od opia k melatoninu aneb Práce s nespavým pacientem Semináøe se konají na 14 místech ÈR v období únor duben 2009 1. Péèe o pacienta s nespavostí Diagnostika a nefarmakologická
Soubor pøednášek ze semináøe Od opia k melatoninu aneb Práce s nespavým pacientem Semináøe se konají na 14 místech ÈR v období únor duben 2009 1. Péèe o pacienta s nespavostí Diagnostika a nefarmakologická
Jak dlouho podávat adjuvantní LHRH analoga? Stanislav Batko Radioterap.-onkol. Odd FNM
 Jak dlouho podávat adjuvantní LHRH analoga? Stanislav Batko Radioterap.-onkol. Odd FNM Krátce na úvod hypothalamus hypofýza ovarium X X X Pokles tvorby estradiolu Goserelin Blokáda tvorby LH mamma LHRH
Jak dlouho podávat adjuvantní LHRH analoga? Stanislav Batko Radioterap.-onkol. Odd FNM Krátce na úvod hypothalamus hypofýza ovarium X X X Pokles tvorby estradiolu Goserelin Blokáda tvorby LH mamma LHRH
M. Babjuk Urologická klinika 2.LF UK a FN Motol
 Operační léčba jako součást multimodálního přístupu k léčbě vysocerizikového karcinomu prostaty M. Babjuk Urologická klinika 2.LF UK a FN Motol Synopse Definice Výsledky a místo operační léčby Kombinace
Operační léčba jako součást multimodálního přístupu k léčbě vysocerizikového karcinomu prostaty M. Babjuk Urologická klinika 2.LF UK a FN Motol Synopse Definice Výsledky a místo operační léčby Kombinace
