CARILLON Mitral Contour System (XE2)
|
|
|
- Jiřina Kadlecová
- před 6 lety
- Počet zobrazení:
Transkript
1 CARILLON Mitral Contour System (XE2) Návod k použití Výrobce: Cardiac Dimensions, Inc Lake Washington Blvd. NE Kirkland, WA Spojené státy americké Zástupce pro ES: MedPass International, Ltd. Windsor House Bretforton Evesham Worcestershire WR11 7 JJ Velká Británie Copyright 2017 Cardiac Dimensions, Inc. Všechna práva vyhrazena Strana 1 z 45
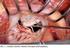
2 NÁVOD K POUŽITÍ CARILLON Mitral Contour System (XE2) společnosti Cardiac Dimensions, Inc. I. Popis systému Systém CARILLON Mitral Contour System (CMCS ) společnosti Cardiac Dimensions, Inc. je zdravotnické zařízení sestávající z níže uvedených součástí: 1) chráněný implantát určený k trvalému umístění v koronárním sinu (CS)/velké žíle srdeční (GCV) 2) aplikační systém založený na katetru, který sestává ze zahnutého aplikačního katetru CMCS (vnější průměr 3,2 mm) a sestavy rukojeti 3) Měřicí katetr umožňující lékaři odhadnout celkové rozměry CS/GCV, aby bylo možné zvolit implantát vhodné velikosti Implantát je připojen k sestavě rukojeti a aplikuje se skrz aplikační katetr CMCS do koronární žíly podél posterolaterální strany mitrálního anulu. Implantát je určený k novému vytvarování mitrálního anulu s cílem redukce dilatace anulu a mitrální regurgitace. Níže je uveden popis konkrétních součástí systému CARILLON Mitral Contour System. Implantát Implantát XE2 je vyroben z nitinolu a titanu a vyrábí se v různých délkách a s různými velikostmi kotvy pro použití s různými žilními anatomiemi. Implantát sestává z distální kotvy (umístěné v GCV), proximální kotvy (umístěné v CS), páskového konektoru (spojujícího kotvy), proximální krimpovací hadičky a distální krimpovací hadičky. Pojistný drát a hrot ve tvaru šipky pomáhají zajistit příslušná očka v zajištěné poloze (Obrázek 1.1). Implantát je určen k rozvinutí, vypnutí a zajištění v koronární žíle. Strana 2 z 45
3 Distální kotva (GCV) Očko distální kotvy Zajišťovací drát Proximální kotva (CS) Distální krimpovací hadička Páskový konektor Očko proximální kotvy Proximální krimpovací hadička Hrot ve tvaru šipky Obrázek 1.1: Nákres implantátu CARILLON XE2 (ve skutečnosti je zařízení celé stříbrné) Aplikační systém Aplikační katetr CMCS: Aplikační katetr usnadňuje perkutánní vstup měřícího katetru, připojení kazety, rozvinutí implantátu, aktivaci zajišťovacího mechanismu distální kotvy a znovuzachycení implantátu (v případě potřeby). Aplikační katetr sestává z polymerového sheathu vyztuženého kovovým opletením s konektorem luer ve tvaru Y. Odolá vstřikovacímu stlaku max KPa (246 psi). Hrot katetru je rentgenokontrastní. Aplikační katetr je na distálním konci zahnutý, jeho vnější průměr je 3,2 mm a účinná délka 70 cm. Vnitřní průměr je 2,5 mm a vyhovuje vodicímu drátu s průměrem 0,89 mm (0,035 palce) nebo diagnostickému či ohebnému katetru s vnějším průměrem 7 F (2,3 mm) (obrázek 1.2). Rovný port se používá pro posun vpřed a vytažení měřicího zařízení a k zavedení implantátu. Postranní port se může použít pro vstřikování rentgenokontrastního média. Strana 3 z 45
4 Víčko luer Rentgenokontrastní hrot Konektor ve tvaru Y Uvolňovač tahu Vnější plášť Výplet Vnitřní vložka Obrázek 1.2: Aplikační katetr CMCS Sestava rukojeti: Sestava rukojeti sestává z kazety, sestavy sheathu/tlačného zařízení a sestavy rukojeti s okénkem kazety, otočných tlačítek a uvolňovací pojistky (obrázek 1.3). Distální konec kazety (mužská spojka luer) se připojuje k armatuře luer na rovném portu na proximálním konci aplikačního katetru. o Kazeta obsahuje implantát, který je složený v nezajištěné poloze v lumenu kazety. Dále obsahuje distální část sestavy sheathu/tlačného zařízení, která je připojena k implantátu. Při aplikaci se implantát ručně vytlačí z kazety do aplikačního katetru. o Sestava sheathu/tlačného zařízení sestává z pojistného drátu, šňůrky, tlačného zařízení a polymerového sheatu pro zajištění proximální kotvy. Kombinace tlačného zařízení a drátů pomáhá při umístění, rozvinutí a odpojení implantátu od sestavy rukojeti. Poskytují mechanismus zajišťující, že implantát je připojený k sestavě rukojeti až do doby vhodné pro odpojení (pomocí uvolňovací pojistky a uvolňovacího tlačítka). Strana 4 z 45
5 Rukojeť usnadňuje rozvinutí, zajištění, odpojení a znovuzachycení implantátu. To se provádí pomocí otočných tlačítek, která umožňují kontrolované pohyby aplikačního katetru, implantátu, sheathu/tlačného zařízení a odpojovacího mechanismu. Před odpojením implantátu od sestavy rukojeti je nutné odstranit uvolňovací pojistku. o Mužská spojka luer Kazeta (implantát složený uvnitř) Sheath/tlačné zařízení Ovládací tlačítko Okénko kazety Rukojeť Tlačítko sheathu Uvolňovací tlačítko Uvolňovací pojistka Obrázek 1.3: Sestava rukojeti CARILLON Měřící katetr Měříci katetr se používá k odhadu celkových rozměrů CS/GCV, aby bylo možné zvolit implantát vhodné velikosti. Měřící katetr se vkládá do aplikačního katetru a posunuje, dokud nedojde k zarovnání nejdistálnější pásky markeru s kontrastním markerem u hrotu aplikačního katetru. Lékař poté s použitím flebogramů zachycených pomocí skiaskopie určí velikost žíly. Měřící katetr je složen z polymerového vřetene, hlavy s luerovou koncovkou na proximálním konci, polymer snižující napětí, kontrastní pásky markeru a čiré distální objímky pokrývající pásky markeru (Obrázek 1.4). Proximální hlavice Snížení napětí Vřeteno 18 kontrastní ch pásek markeru Čirá dist. objímka Obrázek 1.4: Měřicí katetr CARILLON Strana 5 z 45
6 II. Indikace pro použití Systém CARILLON Mitral Contour System je indikován pro použití u pacientů s funkční mitrální regurgitací. III. Kontraindikace Systém CARILLON Mitral Contour System je kontraindikován pro použití: u pacientů se stávajícími prostředky v CS/GCV u pacientů, kteří prodělali náhradu mitrální chlopně nebo mitrální anuloplastiku s implantovaným prstencem IV. Požadavky na uživatele Systém CARILLON Mitral Contour System smějí používat pouze lékaři se zkušeností v technikách cévní katetrizace, kteří byli vyškolení ve správném používání systému CARILLON. Implantát by měl být zaváděn pouze v institucích, kde je možné okamžitě zařídit urgentní operaci srdce (ať už v rámci instituce provádějící implantaci nebo prostřednictvím převozu pacienta do jiné instituce, která urgentní operaci srdce umožňuje). V. Varování Pokud u pacienta v průběhu zákroku dojde k prodloužené A-V blokádě třetího stupně nebo k asystole, zákrok ukončete. Pokud dojde k neúmyslnému složení rozporky distální kotvy přílišným posunem aplikačního katetru vpřed k přetočení distální kotvy, znovu zachyťte a odstraňte celý implantát. Viz krok 5 znovuzachycení implantátu. Jakmile je implantát odpojen od sestavy rukojeti, již ho není možné pomocí sestavy rukojeti znovu zachytit. Pokud kdykoli v průběhu zákroku koronární flebogram prokáže klinicky významnou disekci cévy v cílové zóně implantátu, ukončete implantační zákrok a pacienta monitorujte. Pokud kdykoli v průběhu zákroku koronární flebogram nebo echokardiogram prokáže klinicky významnou perforaci cévy, implantační zákrok ukončete. Pacienta sledujte z hlediska perikardiálního výpotku a vyhodnoťte potřebu perikardiální drenáže. Pokud po znovuzachycení implantátu pozorujete na součásti systému CARILLON Mitral Contour System klinicky významnou obnaženou žilní tkáň, implantační zákrok ukončete. Pacienta sledujte z hlediska perikardiálního výpotku. Pokud umístění implantátu způsobí významnou změnu v elektrokardiogramu (EKG), implantát znovu zachyťte a odstraňte. Pokud umístění implantátu způsobí významné zmenšení rozměru koronární tepny u klinicky významné tepny, která nereaguje na intrakoronární nitroglycerin, implantát znovu zachyťte a odstraňte. Potvrďte návrat ke vstupním rozměrům tepny. Strana 6 z 45
7 VI. Rizika Zákrok se systémem CARILLON Mitral Contour System vyžaduje koronární angiografii a z toho důvodu rizika spojená s tímto zákrokem zahrnují jak rizika spojená s diagnostickou koronární angiografií, tak i rizika spojená se zavedením, permanentním umístěním a znovuzachycením implantátu CARILLON v koronárním žilním systému. Potenciální rizika spojená se zákrokem se systémem CARILLON Mitral Contour System zahrnují kromě jiného: alergickou reakci anginu pectoris stenózu (ucpání) aorty krvácení srdeční arytmii srdeční tamponádu poranění krční tepny chronické poškození nervů smrt obnažení žilní tkáně disekci, perforaci nebo rupturu koronární cévy embolii (vzduchem, tkání, zařízením nebo trombem) hematom zhoršení hemodynamických parametrů frakturu implantátu nemožnost trvalého umístění implantátu infekci zánět nedosažení redukce mitrální regurgitace ztrátu redukce mitrální regurgitace mitrální stenózu infarkt myokardu ischemii myokardu okluzi koronární cévy perikardiální výpotek pneumotorax delší expozici skiaskopickému ozáření selhání ledvin Copyright 2017 Cardiac Dimensions, Inc. Všechna práva vyhrazena Strana 7 z 45
8 cévní mozkovou příhodu chirurgické odstranění implantátu nekrózu tkáně penetraci tkáně transientní ischemickou ataku vasovagální reakci erozi cév spasmus cév VII. Upozornění Všeobecná upozornění Všechny součásti systému CARILLON Mitral Contour System uchovávejte v kartónech, ve kterých jsou dodávány, na chladném a suchém místě. Před použitím zkontrolujte obal. Součást nepoužívejte, pokud je sáček s odtrhovacím uzávěrem poškozený nebo otevřený. Nepoužívejte, pokud se jakákoli součást zdá být poškozená. POUZE PRO JEDNORÁZOVÉ POUŽITÍ. Implantát, aplikační katetr, měřící katetr a sestavu rukojeti neresterilizujte ani nepoužívejte opakovaně. Opětovné použití implantátu může snížit výkon implantátu a aplikačního katetru. Opakované použití může vést ke zlomení nebo deformaci implantátu. Opakované použití vést k nemožnosti katetr umístit, znovu jej zachytit, dále může narušit funkci kateru či vést k prasknutí implantátu. Výrobek použijte před datem použitelnosti uvedeným na štítku obalu. Při zacházení se systémem CARILLON Mitral Contour System používejte sterilní techniky. Upozornění specifická pro výběr pacienta Pacienti s anamnézou atriální fibrilace musí před zákrokem podstoupit vyšetření TEE (transezofageální echokardiografie), aby se vyloučila sraženina v oušku levé síně, za účelem minimalizace rizika tromboembolie způsobené plikací tkáně. Pacienti citliví na nikl, titan nebo nikl titanové slitiny (nitinol) mohou mít reakci na implantát. Permanentní umístění implantátu může ovlivnit budoucí kardiologické zákroky, např. perkutánní koronární intervenci nebo umístění stimulačního vodiče skrz koronární sinus při resynchronizační terapii. Před provedením budoucích intervenčních zákroků by měla být zvážena možnost zapouzdření implantátu. U pacientů se známým onemocněním převodního systému, obzvláště blokádou levého raménka Tawarova, je třeba před kanylací koronárního sinu zvážit dočasnou transvenózní stimulaci pravé komory. U pacientů s dominantní (nebo kodominantní) levou koronární artérií je vyšší pravděpodobnost, že u nich při zákroku dojde k akutní přechodné kompresi koronární artérie. U pacientů, kteří mají významnou kalcifikaci mitrálního anulu, může být menší pravděpodobnost redukce mitrální regurgitace. Strana 8 z 45
9 Pacienti s nekompaktní kardiomypatií. Pacienti s hyperdynamickou žilní kompresí; v případě, kdy se kterákoli část koronárního sinu lumenu žíly v průběhu srdečního cyklu zcela smrští. Upozornění specifická pro implantační zákrok Implantát by měl být zaváděn pouze v institucích, kde je možné okamžitě zařídit urgentní operaci srdce (ať už v rámci instituce provádějící implantaci nebo prostřednictvím převozu pacienta do jiné instituce, která urgentní operaci srdce umožňuje). Pro zavedení systému CARILLON Mitral Contour System kanylujte pouze pravou vnitřní jugulární žílu. Distální konec distální kotvy musí být umístěn minimálně 9 cm od ostia koronárního sinu. Dbejte na přesné změření velikosti koronární žíly a výběr vhodného implantátu. Systém CARILLON Mitral Contour System neposunujte vpřed, ani nestahujte zpět, pokud se setkáte s odporem. Určete příčinu odporu pomocí skiaskopického vyšetření nebo jiným způsobem. Aplikační katetr CMCS vždy posunujte vpřed po katetru s vnějším průměrem o velikosti 6F nebo 7F, jako je např. víceúčelový angiografický (MPA) diagnostický katetr nebo ohebný katetr. POZNÁMKA: Vnější průměr katetru o velikost 7F je preferován před velikostí 6F, jelikož minimalizuje luminální přechod mezi diagnostickým katetrem a aplikačním katetrem CMCS. Při používání systému CARILLON Mitral Contour System dodržujte standardní intervenční kardiologické antikoagulační protokoly. Při posunování vpřed, umisťování, rozvinutí a znovuzachycení implantátu na minimum omezte ohýbání sestavy rukojeti a aplikačního katetru. Implantát neumisťujte v místě, které by mohlo ohrozit neporušenost koronárního arteriálního stentu. Při implantaci pomocí koronární angiografie zkontrolujte ucpání koronárních tepen. Před odpojením implantátu od sestavy rukojeti potvrďte, že jsou obě kotvy zajištěné. Pokud konečné umístění implantátu není v zamýšlené anatomické oblasti koronárního sinu, pokud se kotvy nezafixují, nebo pokud se tvar drátěných součástí kotvy jeví jako závažně deformovaný, zvažte znovuzachycení a odstranění implantátu. Aplikační katetr, sestavu rukojeti a implantát nepoužívejte opakovaně pro další pokus o implantaci. Upozornění specifická pro pooperační péči Používejte vhodná opatření při ošetřování místa vstupu po zákroku a po propuštění z nemocnice, aby se předešlo infekci. VIII. Postup implantace VAROVÁNÍ: Pokud u pacienta v průběhu zákroku dojde k prodloužené A-V blokádě třetího stupně nebo k asystole, zákrok ukončete.. 1. Příprava zákroku a. Proveďte vstupní EKG před zákrokem. Strana 9 z 45
10 b. Kanylujte periferní artérii cévním zaváděcím sheathem pro injekce do koronárních tepen. c. Kanylujte pravou vnitřní jugulární žílu cévním zaváděcím sheathem velikosti 10F. Pro přístup nepoužívejte jinou žílu. d. Pacientovi podejte heparin a udržujte dostatečnou heparinizaci po celou dobu zákroku podle standardních intervenčních kardiologických antikoagulačních protokolů pro diagnostické katetrizační procedury. e. Proveďte vstupní levý a pravý koronární arteriogram s cílem: i. zhodnotit onemocnění relevantních artérií ii. zaznamenat vstupní rozměry artérií a způsoby krevního proudění iii. zaznamenat umístění ostia koronárního sinu při žilní fázi injekce 2. Koronární cévní přístup a. Připojte otočný hemostatický ventil na tvarovaný diagnostický katetr s vnějším průměrem 6F (2,0 mm) nebo 7F (2,3 mm) (např. MPA-1 nebo MPA-2) a propláchněte katetr heparinizovaným fyziologickým roztokem. b. Skrz otočný hemostatický ventil a do diagnostického katetru zaveďte vodicí drát s měkkým hrotem o velikosti 0,89 mm (0,035 palce). c. Rotační hemostatický ventil připojte k rovnému portu aplikačního katetru CMCS s vnějším průměrem (3,2 mm) a propláchněte katetr heparinizovaným fyziologickým roztokem. d. Sestavu diagnostického katetru/drátu zaveďte skrz otočný hemostatický ventil do aplikačního katetru CMCS a posunujte vpřed. e. Celou sestavu pro přístup zaveďte skrz žilní zaváděcí sheath velikosti 10F. f. Kanylujte koronární sinus pomocí teleskopického systému aplikačního katetru CMCS, tvarovaného diagnostického katetru velikosti 6F nebo 7F a vodicího drátu s měkkým hrotem. Jako aniografické vodítko pro kanulaci ostia koronárního sinu použijte žilní fázi předcházejícího angiogramu. g. Vodicí drát posunujte vpřed skrz koronární sinus (CS) a velkou srdeční žílu (GCV) do přední interventrikulární žíly (AIV). h. Posunujte diagnostický katetr velikosti vpřed po vodicím drátu do spojení GCV/AIV. i. Posunujte aplikační katetr CMCS vpřed po diagnostickém katetru do spojení GCV/AIV. j. Vyjměte diagnostický katetr a vodicí drát z aplikačního katetru CMCS. k. Potvrďte zpětný tok krve skrz aplikační katetr CMCS označující luminální polohu hrotu katetru. V případě potřeby vytáhněte aplikační katetr, až nastane zpětný tok krve. l. Alternativní přístupovou metodou ke koronárnímu sinu je založení ohebného katetru 7F (vnější průměr 2,3 mm) (s lumenem vodicího drátu nebo bez něho) skrz otočný hemostatický ventil do aplikačního katetru CMCS. Kanylujte koronární sinus ohebným katetrem velikosti 7F. Posunujte ohebný katetr velikosti 7 F (po vodicím drátu, je-li přítomen) vpřed do spojení GCV/AIV. Posunujte aplikační katetr CMCS vpřed po ohebném katetru velikosti 7F do spojení GCV/AIV. Vyjměte ohebný katetr velikosti 7F z aplikačního katetru CMCS. Potvrďte zpětný tok krve skrz aplikační katetr CMCS, označující luminální polohu hrotu katetru. V případě potřeby aplikační katetr vytáhněte, až nastane zpětný tok krve. Strana 10 z 45
11 3. Výběr cílového umístění a implantátu a. Opatrně vyjměte měřící katetr z balení, aby nedošlo k jeho zauzlení. Posunujte měřící katetr skrz otočný hemostatický ventil a srovnejte jeho distální kontrastní pásek s aplikačním katetrem. b. Proveďte venogram s malým objemem a nízkým tlakem kontrastní látky skrz aplikační katetr CMCS, abyste ověřili, že hrot katetru není umístěn v postranní větvi žíly, nebo že neucpává lumen žíly. V případě potřeby stáhněte aplikační katetr CMCS zpět. Pokud je katetr umístěn ve vhodné poloze, proveďte a zaznamenejte venogram s kontrastní látkou skrz aplikační katet, aby se zakalila žilní anatomie, zaznamenala se poloha spojení GCV/AIV a ostia CS a určila kombinovaná délka CS/GCV. Venogramy je třeba zaznamenat na projekcích dostatečných k vizualizaci geometrie žíly. Zvažte LAO (levá přední šikmá)/kaudální, RAO (pravá přední šikmá)/kaudální a AP (předozadní)/ kaudální projekci. Finální arteriogram a následující venogram by měly být v LAO/kaudální (nebo AP (kaudální) pozici tak, aby skiaskopickou obrazovku bylo možné označit pro umístění kotvy, aniž by se pohlo stolem nebo zesilovačem obrazu, dokud nedojde ke kompletnímu odsheatování a zapadnutí systému Carillon Mitral Contour System. Pokud ostium CS není dostatečně vizualizováno venogramem provedeným z GCV, zvažte opakování venogramu s aplikačním katetrem CMCS v CS. Alternativně proveďte venogram CS s LAO/kaudální projekcí před kanylací GCV. Po venogramu CS pokračujte s kanylací GCV, jak je popsáno v části 2. c. Pokud aplikační katetr CMCS musí být posunut vpřed, aby byl blíže ke spojení GCV/AIV, nejprve odstraňte měřící katetr a znovu vložte diagnostický katetr a vodicí drát (nebo ohebný katetr (a vodicí drát, je-li přítomen)) do aplikačního katetru CMCS. UPOZORNĚNÍ: Aplikační katetr CMCS vždy posunujte vpřed po diagnostickém nebo ohebném katetru 6F nebo 7F. d. Angiogramy proveďte měřícím katetrem v kaudálních pohledech RAO a LAO umístěným v aplikačním katetru CMCS, abyste určili vztah koronárních artérií k CS/GCV. Uvolněte RHV a odstraňte měřící katetr. e. Cílové zóny implantátu se stanoví podle dostupné délky a geometrie žíly, umístění postranních žilních větví, žilních chlopní, žilních zakřivení, dynamické žilní komprese umístění koronárních artérií a umístění koronárních arteriálních stentů. f. Pro měření průměrů žil v cílových zónách implantátu použijte skiaskopickou projekci a venogram nebo venogramy udávající největší průměry žíly. Vypočítejte průměr 3 rovnoměrně od sebe vzdálených měření průměru pro stanovení průměrného průměru GCV v 1,5cm - 2cm cílové zóně distální kotvy. Pokud venogramy z doprovodných projekcí indikují oválnou žílu, zvažte zprůměrování průměrů žíly z těchto doprovodných projekcí, aby byla vzata v úvahu asymetrická žilní anatomie. Stanovte průměr CS ve třech polohách přes 2cm proximální cílovou zónu kotvy. Označte obrazovku monitoru (obrázek 3.2) pro označení cílových umístění distální a proximální kotvy. POZNÁMKA: Nepohybujte stolem ani zesilovačem obrazu, dokud nedojde k označení obrazovky monitoru, popř. zajistěte, aby bylo při označení monitoru možné stůl či zesilovač obrazu navrátit do naprosto stejné polohy, ve které se nachází. Zvažte použití anatomických referenčních bodů, které vám pomohou stůl a zesilovač obrazu vrátit do původní polohy, je-li to nutné. i. Distální kotvu neumisťujte do žilního segmentu s průměrným průměrem nižším než 3,5 mm. ii. Apex proximální kotvy neumisťujte v místě žíly s průměrem větším než 13,5 mm. Strana 11 z 45
12 iii. Distální konec distální kotvy musí být umístěn minimálně 9 cm od ostia koronárního sinu. UPOZORNĚNÍ: Pokud aplikační katetr způsobí lokalizovanou distenzi žíly, neměřte průměr žíly v rozšířeném místě. Distální Střední 2cm cílová oblast distální kotvy Proximální 1 cm Ostium CS a 2cm proximální cílové umístění Distální Proximální Střední Obrázek 3.1: Venogram GCV/CS měření velikosti žíly Strana 12 z 45
13 Obrázek 3.2: Příklad obrazovky monitoru se značením pro umístění kotvy g. Podle průměrů žíly a dostupné délky žíly vyberte vhodný implantát. Dostupná délka žíly se určí podle celkové délky žíly (ostium CS až po spojení GCV/AIV), průměrů žíly, geometrie žíly a anatomie relevantních artérií. Dostupná délka žíly může být kratší než celková délka žíly. Tabulka 3.1 obsahuje doporučení pro určení velikosti kotvy. Doporučení pro výběr délky implantátu jsou následující: Pokud je dostupná délka žíly 12 cm, pro první pokus použijte implantát o délce 60 nebo 70 mm Pokud je dostupná délka žíly 13 cm, pro první pokus použijte implantát o délce 80 mm, pokud se umístění distální kotvy nachází ve vzdálenosti menší než 12 cm od CS ostia (např. abyste se vyhli koronární tepně) Pro opakované pokusy o implantaci můžete vybrat jakoukoli délku Vezměte prosím na vědomí, že implantáty s distálními kotvami 13 nebo 14 mm jsou dostupné pouze v délkách 70 nebo 80 mm. Tabulka 3.1: Doporučení pro výběr velikosti kotev CARILLON XE2 Průměrný průměr GCV v cílové oblasti distální kotvy (mm) Výška distální kotvy (GCV) (mm) Průměrný průměr CS v cílové oblasti proximální kotvy (mm) Výška proximální kotvy (CS) (mm) 3,5 3,9 7 6,0 6,9 12 4,0 4,4 8 7,0 7,9 14 4,5 4,9 9 8,0 8,9 16 Strana 13 z 45
14 Průměrný průměr GCV v cílové oblasti distální kotvy (mm) Výška distální kotvy (GCV) (mm) Průměrný průměr CS v cílové oblasti proximální kotvy (mm) Výška proximální kotvy (CS) (mm) 5,0 5,6 10 9,0 10,9 18 5,7 6, ,0 13,5 20 6,4 7,2 12 7,3 7,8 13 7,9 8, Implantace zařízení a. Opatrně vyjměte sestavu rukojeti a kazetu z balení, aniž by se kazeta vůči sestavě rukojeti pohnula. Dbejte na to, aby implantát zůstal krytý v kazetě a že z kazety není předčasně vysunut. V případě neúmyslného částečného odkrytí implantátu v průběhu procesu je nutné zařízení vyměnit za nové. b. Po vyjmutí sestavy rukojeti a kazety z balení otočte, otočte zajišťovacím tlačítkem sheathu ve směru hodinových ručiček proti černé zajišťovací šipce (obrázek 4.1) a ubezpečte se, zda je proximální zajišťovací sheath zcela zatáhnut. Otočte proti směru černé zajišťovací šipky Obrázek 4.1: Protiotočení zajišťovacího tlačítka sheathu c. Vyjměte otočný hemostatický ventil z rovného portu aplikačního katetru CMCS a připojte mužskou spojku luer na distálním konci kazety k aplikačnímu katetru (obrázek 4.2). Strana 14 z 45
15 Obrázek 4.2: Připojení kazety k rovnému portu aplikačního katetru d. Implantát posunujte vpřed a ven z kazety do aplikačního katetru ručním posunováním sestavy sheathu/tlačného zařízení vpřed na proximálním konci kazety. Tlačte v malých krocích (o velikosti 1 cm - 2 cm), aby se sestava sheathu/tlačného zařízení nezauzlila (obrázek 4.3). Pokračujte v posunování sestavy sheathu/tlačného zařízení vpřed, až se sestava rukojeti a kazeta setkají. Obrázek 4.3: Posunování implantátu vpřed do aplikačního katetru e. Vložte proximální konec kazety do distální objímky rukojeti a otočte ovládacím tlačítkem ve směru černé šipky, aby se kazeta zachytila. Při otáčení ovládacího tlačítka a zachycování kazety se ubezpečte, aby aplikační katetr u zaváděcího sheathu zůstal pevně umístěn. Přestaňte otáčet ovládacím tlačítkem, jakmile je proximální konec kazety viditelný v okénku kazety (obrázek 4.4). Strana 15 z 45
16 Kazeta viditelná v okénku kazety rukojeti Ukazatel směru šipky Obrázek 4.4: Kazeta je viditelná v okénku kazety v rukojeti POZOR: f. Zbývající kroky implantace prostředku (f-p) je nutné provádět pod skiaskopickým naváděním. V cílovém umístění v GCV rozviňte distální kotvu otáčením ovládacího tlačítka ve směru černé šipky, až bude distální kotva obnažena. Obvykle je nutné při otáčení ovládacího tlačítka jemně zatáhnout rukojeť a aplikační katetr zpět, aby se distální kotva dostala do cílového umístění. Pokračujte v otáčení ovládacího tlačítka stejným směrem, až bude očko distální kotvy zcela mimo aplikační katetr (obrázek 4.5). Otočte ve směru černé šipky Obrázek 4.5: Otáčení ovládacím tlačítkem při umisťování distální kotvy g. Zajistěte distální kotvu v cílovém umístění otáčením ovládacího tlačítka ve směru bílé šipky, až aplikační katetr zatlačí očko tak, aby bylo vyrovnané proti distální krimpovací hadičce. Stáhněte zpět aplikační katetr otáčením ovládacího tlačítka ve směru černé šipky pro ověření, že očko distální kotvy zůstane vyrovnané proti distální krimpovací hadičce v zajištěné poloze. V případě potřeby otáčejte ovládacím tlačítkem ve směru bílé šipky a znovu posuňte aplikační katetr vpřed pro další pokus o zajištění. Strana 16 z 45
17 UPOZORNĚNÍ: Další otáčení ovládacím tlačítkem ve směru bílé šipky po zajištění distální kotvy způsobí znovuzachycení kotvy aplikačním katetrem. VAROVÁNÍ: Pokud dojde k neúmyslnému složení rozporky distální kotvy přílišným posunem aplikačního katetru vpřed k přetočení distálni kotvy, znovu zachyťte a odstraňte celý implantát. Viz krok 5 Znovuzachycení implantátu h. Podle potřeby proveďte angiogramy pro zhodnocení rozměrů artérie a průtoku v oblasti kolem implantátu. Pokud byly významně ovlivněny rozměry artérie nebo průtok a nelze to řešit napnutím systému, implantát znovu zachyťte a odstraňte (viz krok 5 Znovuzachycení implantátu). POZNÁMKA: Zvažte podání intrakoronárního nitroglycerinu pro vyloučení spasmu cévy, kdykoli máte podezření na implantátem způsobené narušení koronárních cév. i. Stáhněte aplikační katetr zpět k distálnímu konci krimpovací hadičky proximální kotvy otáčením ovládacího tlačítka ve směru černé šipky. Abyste se ubezpečili, že proximální kotva zůstane v aplikačním katetru zasheathována, ovládací tlačítko otočte pouze o cca. 2 cm, je-li na kazetě viditelná délka závitu. j. Implantát postupně napínejte jemným tahem za sestavu rukojeti a/nebo aplikační katetr velikosti CMCS při současné stabilizaci žilního zaváděcího sheathu. Pomalu pokračujte v napání, dokud krimpovací hadička proximální kotvy nedosáhne cílového umístění (vymezené na obrazovce skiaskopie) proximální kotvy v CS pod skiaskopickým naváděním. k. Netahejte krimpovací hadičku proximální kotvy do pravé síně. Použijte žilní fázi angiogramu, abyste potvrdili, že proximální kotva zůstává v koronárním sinu. Alternativně vstříkněte kontrastní látku skrz postranní port aplikačního katetru pro zhodnocení polohy krimpovací hadičky proximální kotvy v poměru k anatomii CS. Dbejte zvýšené opatrnosti, aby se těmito manévry nezměnilo napětí v systému. POZNÁMKA: Před odsheatováním a zavedením proximální kotvy podle potřeby proveďte angiogramy ke zhodnocení relevantních rozměrů artérií a průtoku. Pokud byly významně ovlivněny rozměry artérie nebo průtok a nelze to řešit částečným uvolněním napětí, uvolněte tlak na implantát, aby se obnovily rozměry artérie. Implantát znovu zachyťte a odstraňte. Jsou-li koronární cévy pokryty jakoukoli částí zařízení CARILLON, zvažte provedení angiogramů v alternativní projekci, např. RAO kaudální, pro adekvátní vizualizaci koronárních cév a průtoku. Aby mohla být proximální kotva umístěna na plánované místo, je tento manévr potřeba pečlivě zvážit, stůl a zesilovač obrazu totiž musí být po návratu z RAO kaudální do LAO kaudální pozice navráceny na stejné misto. POZNÁMKA: Pokud při napínání distální kotva sklouzne, znovu zachyťte a odstraňte implantát (viz krok 5 - Znovuzachycení implantátu). l. Udržujte napětí na sestavě rukojeti a/nebo aplikačním katetru CMCS ve směru černé šipky. Podle potřeby upravte napětí, aby se proximální kotva udržela v cílové poloze. Pokračujte v otáčení ovládacího tlačítka, až otáčení nebude možné (obrázek 4.6). Strana 17 z 45
18 Otočte ve směru černé šipky Obrázek 4.6: Otáčení ovládacím tlačítkem při umisťování proximální kotvy m. Zajistěte proximální kotvu v cílovém umístění v CS otáčením tlačítka sheathu ve směru zajišťovací šipky, až sheath zatlačí očko proximální kotvy tak, aby bylo vyrovnané proti proximální krimpovací hadičce. Stáhněte sheath zpět otáčením tlačítka sheatu opačným směrem vůči směru zajišťovací šipky. Ověřte, že očko proximální kotvy zůstává proti proximální krimpovací hadičce v zajištěné poloze. Pro lepší vizualizaci a potvrzení zajištění proximální kotvy, zvažte možnost nahlížet proximální kotvu v LAO kraniální projekci. V případě potřeby otáčejte tlačítkem sheathu ve směru zajišťovací šipky, a znovu posuňte sheath vpřed pro další pokus o zajištění (obrázek 4.7). Otočte ve směru černé šipky Obrázek 4.7: Otáčení tlačítkem sheathu při zajišťování proximální kotvy n. Zrušte veškerý vnější tlak na systém jemným posunutím aplikačního katetru vpřed k zaváděcímu sheathu. Ujistěte se, že po uvolnění vnějšího systémového tlaku se implantát nepohnul nebo nezměnil polohu v CS/GCV. o. Před odpojením implantátu od sestavy rukojeti proveďte všechny níže uvedené kroky: i. Zhodnoťte hemodynamické parametry a stabilitu pacienta. ii. Proveďte angiogramy pro potvrzení, že nedošlo k žádnému významnému ovlivnění levé a pravé koronární artérie. VAROVÁNÍ: Pokud umístění implantátu způsobí významnou změnu v elektrokardiogramu (EKG), implantát znovu zachyťte a odstraňte. VAROVÁNÍ: Pokud umístění implantátu způsobí významné zemenšení rozměru koronární tepny u klinicky významné tepny, implantát znovu zachyťte a odstraňte. Potvrďte návrat ke vstupním rozměrům tepen. Strana 18 z 45
19 iii. Pomocí několika skiaskopických pohledů potvrďte, že obě kotvy jsou zajištěné. Na obrázcích 4.8 až 4.11 jsou příklady zajištěných a odjištěných kotev. Obr. 4.8: Odjištěná distální kotva Obr. 4.9: Zajištěná distální kotva Obr. 4.10: Odjištěná proximální kotva Obr. 4.11: Zajištěná proximální kotva iv. Ke kvantifikaci redukce mitrální regurgitace použijte echokardiogram. VAROVÁNÍ: Po odpojení implantátu od sestavy rukojeti již ho není možné pomocí sestavy rukojeti znovu zachytit. Pokud konečné umístění implantátu není v zamýšlené anatomické oblasti koronárního sinu, nebo pokud se tvar drátů kotvy jeví jako závažně deformovaný, zvažte znovuzachycení a odstranění implantátu (viz krok 5 Znovuzachycení implantátu). p. Pro odpojení implantátu od aplikačního systému otočte červenou uvolňovací pojistku ve směru šipky a vyjměte ji z rukojeti (obrázek 4.12). Poté otáčejte uvolňovacím tlačítkem ve směru šipky pro odpojení, až se implantát zcela oddělí od sestavy rukojeti (obrázek 4.13). Strana 19 z 45
20 Obrázek 4.12: Otáčení a vyjmutí uvolňovací pojistky Otočte ve směru černé šipky Obrázek 4.13: Otáčení uvolňovacím tlačítkem pro odpojení implantátu od sestavy rukojeti q. Vytáhněte sestavu rukojeti a připojený aplikační katetr CMCS ven z žilního zaváděcího sheathu. Po odpojení implantátu systém již neposunujte vpřed. r. Vyjměte zaváděcí systém. 5. Znovuzachycení implantátu Pokud to vyžadují klinické okolnosti, implantát může být znovu zachycen a odstraněn z koronární žíly před odpojením od sestavy rukojeti. Znovu zachyťte a odstraňte implantát, pokud výkon, vzhled nebo konečné umístění implantátu jsou neuspokojivé. a. Pokud byla rozvinuta proximální kotva, otáčejte tlačítkem sheathu ve směru zajišťovací šipky, až bude sheath pevně proti krimpovací hadičce proximální kotvy. Neutahujte nadměrně. Poté pokračujte krokem (b). Pokud proximální kotva ještě nebyla rozvinuta, přejděte přímo ke kroku (d). b. Otáčejte ovládacím tlačítkem ve směru bílé šipky a posunujte aplikační katetr velikosti 9 F vpřed po drátech proximální kotvy (obrázek 5.1). c. Poté stáhněte katetr asi 1 cm zpět otáčením ovládacího tlačítka ve směru černé šipky,čímž se hrot drátů proximální kotvy dostane za hrot aplikačního katetru. Tento postup je prováděn za účelem normalizace nebo odstranění jakéhokoli převrácení hrotu aplikačního katetru před zachycením distální kotvy. d. Pro znovuzachycení distální kotvy otáčejte ovládacím tlačítkem ve směru bílé šipky, aby se aplikační katetr CMCS posunul vpřed nad zbytek implantátu. Při zpětném Strana 20 z 45
21 zachycování zabraňte nadměrnému pnutí systému tak, že ručně posunete aplikační katetr a zaváděcí sheath vpřed při současném otáčení ovládacím tlačítkem. Pnutí systému můžete sledovat podle umístění krimpovací hadičky proximální kotvy ve vztahu k anatomii srdce. Otočte ve směru černé šipky Obrázek 5.1: Otáčení kontrolního tlačítka při znovuzachycení implantátu POZNÁMKA: Pokud během pokusu o znovuzachycení kotvy narazíte na významný odpor, stáhněte katetr přibližně 2 cm zpět od kotvy otáčením ovládacího tlačítka ve směru černé šipky. Zatlačte na sestavu rukojeti nebo aplikační katetr CMCS, aby se vyrovnal úhel mezi aplikačním katetrem a kotvou. Poté otáčejte ovládacím tlačítkem ve směru bílé šipky, abyste aplikační katetr posunuli vpřed a zahájili znovuzachycení kotvy. Jakmile se kotva začne skládat, uvolněte extra tlak na systém ručním posunem aplikačního katetru vpřed u zaváděcího sheathu. Poté pokračujte v otáčení ovládacího tlačítka, abyste znovuzachycení dokončili. e. Jakmile bude celý implantát v aplikačním katetru CMCS, odpojte kazetu od aplikačního katetru a stabilizujte aplikační katetr. Zatáhněte za sestavu rukojeti, abyste zcela vytáhli implantát ven z aplikačního katetru, použitý aplikační katetr ponechejte v koronární žíle a udržujte koronární žilní přístup. Pro zhodnocení žilní disekce lze provést venogram. Alternativně, jakmile bude celý implantát uvnitř aplikačního katetru, vytáhněte sestavu rukojeti a aplikační katetr společně skrz žilní zaváděcí sheath. VAROVÁNÍ: Pokud flebogram po znovuzachycení prokáže klinicky významnou žilní disekci nebo perforaci, nepokoušejte se o umístění dalšího implantátu. VAROVÁNÍ: Pokud po znovuzachycení implantátu pozorujete na součásti systému CARILLON Mitral Contour System klinicky významnou obnaženou žilní tkáň, implantační zákrok ukončete. Pacienta sledujte z hlediska perikardiálního výpotku. f. Pokud je plánován další implantační zákrok, opakujte implantační zákrok s novým aplikačním katetrem, sestavou rukojeti a implantátem. Součásti systému CARILLON Mitral Contour System jsou pouze k jednorázovému použití. Pokud byl aplikační katetr ponechán v koronární žíle po znovuzachycení, použijte vodicí drát s měkkým hrotem vhodné délky (např. 0,89 mm (0,035 palce)) k odstranění použitého katetru a po diagnostickém katetru zaveďte nový aplikační katetr CMCS pro další pokus. Opakujte proces implantace počínaje částí VIII. 3. Strana 21 z 45
22 IX. Následné kontrolní procedury Po implantaci se doporučují níže uvedená hodnocení pacientů: Rentgen hrudníku nebo filmová skiaskopie pro zhodnocení správné polohy a neporušeno sti implantátu Echokardiogram pro zhodnocení funkce levé komory (LV) a mitrální regurgitace Elektrokardiogram (EKG) pro zhodnocení potenciálního infarktu myokardu Anamnéza pacienta pro zhodnocení příznaků ischemie X. Kompatibilita s vyšetřením magnetickou rezonancí (MRI): Podmíněně bezpečný při MRI Neklinické testy prokázaly, že implantát CARILLON XE2 je podmíněně bezpečný při MRI podle terminologie specifikované v mezinárodní normě ASTM International Standard F2503. Může být bezpečně snímán za následujících podmínek: Statické magnetické pole 3,0 tesla Pole s prostorovým gradientem 720 gaussů/cm Maximální specifická míra absorpce přepočtená na celé tělo (SAR) o hodnotě 2,9 W/kg za 15 minut snímkování V neklinických testech došlo u implantátu CARILLON XE2 ke zvýšení teploty o maximálně 2,3 C při maximálním absorbovaném výkonu přepočteném na celé tělo (SAR) 2,9 W/kg, jak bylo stanoveno kalorimetrií při 15minutovém skenování MRI při 3,0 tesla na systému MRI 3,0 tesla/128 MHz, Excite, HDX, software 14x.M5, General Electric Healthcare, Milwaukee, WI. Kvalita MRI snímku může být negativně ovlivněna, pokud je oblast zájmu totožná s polohou implantátu CARILLON XE2 nebo v její blízkosti. Proto může být nutné vzhledem k přítomnosti tohoto zařízení optimalizovat parametry MRI snímkování. Artefakty ve formě mezer signálu byly: pulsová sekvence T1-SE T1-SE GRE GRE Rozsah výpadku signálu mm2 384 mm mm2 644 mm2 Orientace roviny Paralelní Kolmá Paralelní Kolmá XI. Sterilizace Implantát, sestava rukojeti, aplikační katetr a měřící katetr se dodávají sterilní a nepyrogenní. Implantát je založen v kazetě a připojen k sestavě rukojeti. Aplikační katetr a měřící katetr jsou baleny samostatně. Všechny součásti systému jsou sterilizovány ethylenoxidem a jsou POUZE PRO JEDNORÁZOVÉ POUŽITÍ NERESTERILIZUJTE. Nepoužívejte, je-li obal otevřený nebo poškozený. XII. Podmínky skladování Všechny součásti systému CARILLON Mitral Contour System uchovávejte v kartónech, ve kterých jsou dodávány, na chladném a suchém místě. Nepoužívejte po uplynutí doby použitelnosti. Strana 22 z 45
23 XIII. Informace o klinických studiích 6. Přehled klinických studií Součástí klinického zhodnocení je souhrn výsledků klinického testování systému CARILLON Mitral Contour. Výsledky studie AMADEUS, ve které byla použita dřívější iterace systému CARILLON Mitral Contour, byly vydány v publikaci s názvem Circulation. 1 Klinická data této části zahrnují informace získané z klinických testů proveditelnosti s názvem TITAN a TITAN II. Tabulka 6.1: Shrnutí klinických testů TITAN a TITAN II Název studie a data zápisu TITAN Typ studie Název zařízení Proveditelnost. Výhledová, nerandomizovaná, dvouramenná Následné sledování: výchozí bod, 1, 6, 12 měsíců a ročně po dobu 5 let CARILLON XE2 Hlavní kritéria pro přijetí a vyloučení Přijetí: dilatovaná ischemická/neischemická kardiomyopatie střední až vážná funkční mitrální regurgitace (2+ 4+) LVEF < 4 NYHA třída II - IV věk stabilní lék proti zástavě srdce Vyloučení: hospitalizace v průběhu poslední tří měsíců z důvodu: o infarktu myokardu, operace koronárního bypassu, nestabilní anginy pectoris hospitalizace v průběhu posledních 30 dnů z důvodu koronární angioplastiky pacienti, u kterých se očekává, že v průběhu jednoho roku podstoupí operaci srdce Počet lokalit a pacientů Cílové ukazatele 7 lokalit Primární: Hlavní nežádoucí účinky (MAE) v průběhu 30 dnů. MAE značí: smrt infarkt myokardu srdeční perforaci vyžadující zákrok katetrem nebo chirurgický zákrok 53 pacientů se záměrem léčby 36 pacientů s implantátem (pozorováni 5 let) embolizace zařízení výskyt operace nebo perkutánní koronární intervence spojené se zařízením 17 pacientů bez implantátu (pozorováni pouze 1 rok) Hlavní sekundární: úmrtnost v průběhu 5 let kvantitativní MR měření funkce levé komory funkční třída NYHA 6 minutová chůze pěšky kvalita života (KCCQ) 1 Schofer J, Siminiak T, Haude M, a kol. Percutaneous mitral annuloplasty for functional mitral regurgitation: Results of the CARILLON mitral annuloplasty device European Union study. Circulation. 2009;120: Siminiak, T, Wu JC, Haude M, Hoppe UC, Sadowski J, Lipiecki J, Fajadet J, Shah AM, Feldman T, Kaye DM, Goldberg SL, Levy WC, Solomon SD, Reuter DG. Léčba funkční mitrální regurgitace perkutánní anuloplastikou: výsledky testu TITAN, Eur J Heart Fail Srpen; 14(8): Strana 23 z 45
24 Název studie a data zápisu TITAN II Typ studie Název zařízení Proveditelnost. Prospektivní, jednoramenná potvrzující CARILLON mxe2 Následné sledování: Výchozí bod, 1, 6 a 12 měsíců Hlavní kritéria pro přijetí a vyloučení Stejné jako v případě studie TITAN Počet lokalit a pacientů Cílové ukazatele 5 lokalit Primární: Míra výskytu hlavních nežádoucích účinků v průběhu 30 dnů. MAE značí: smrt infarkt myokardu srdeční perforaci vyžadující zákrok katetrem nebo chirurgický zákrok 36 pacientů se záměrem léčby 30 pacientů s implantátem (pozorováni pouze 1 rok) embolizaci zařízení výskyt operace nebo perkutánní koronární intervence spojené se zařízením 6 pacientů bez implantátu (pozorování pouze 30 dnů) Hlavní sekundární: úmrtnost v průběhu 5 let kvantitativní MR měření funkce levé komory funkční třída NYHA 6 minutová chůze pěšky 7. Klinický test TITAN Výsledky klinického testu TITAN byly zveřejněny v časopise European Journal of Heart Failure.2 Vývoj klinického testu TITAN Hlavním cíle klinického testu TITAN bylo vyhodnotit bezpečnost rozvinutí a implantace systému CARILLON Mitra Contour u pacientů s funkční mitrální regurgitací (FMR). Mezi druhotné cíle patřilo vyhodnocení bezpečnosti z dlouhodobého hlediska a zhodnocení hemodynamických a klinických změn. Hemodynamické změny byly charakterizovány echokardiografií. Klinická účinnost byla zhodnocena dle změn v klasifikaci NYHA, tolerancí cvičení a dle kvality života. Nezávislý dohled Protokol, informovaný souhlas a ostatní dokumentace studie byly schváleny příslušným úřadem EU a etickými komisemi. Do studie byl rovněž zapojen Výbor pro sledování údajů o bezpečnosti (DSMB). Výbor DSMB ověřil údaje o bezpečnosti ve vztahu ke stanoveným kritériím, v kontextu shromážděných údajů o bezpečnosti a ve vztahu k trvání platnosti studie. Výbor DSMB rovněž přezkoumal míru výskytu hlavních nežádoucích účinků a zhodnotil pokrok studie v Strana 24 z 45
25 případě výskytu neočekávaného nežádoucího účinku. Kdyby z údajů o bezpečnosti vyplynulo, že studie způsobuje účastníkům jakoukoli újmu, výbor DSMB měl právo a zodpovědnost studii přerušit. Statistická analýza Údaje shromážděné v této studii byly zdokumentovány s použitím souhrnných tabulek a výčtů údajů jednotlivých pacientů. Testování statistické významnosti je ohlášeno na příslušných místech a poskytuje srovnání mezi kohorty s implantátem a bez. Výpočty byly provedeny s použitím softwaru SAS, verze 9.1. Konkrétní použité statistické testování je u příslušných tabulek a grafů uvedeno ve formě poznámek pod čarou. Veškeré statistické testování bylo založeno na dvoustranné hladině významnosti alfa = 0,05. Chybějící údaje nebyly nahrazovány. Výsledky klinické studie TITAN Dispozice pacientů Vývojový diagram dispozic všech pacientů, kteří splnili konečná kritéria pro účast na testu, jsou uvedena níže. Definice: Populace se záměrem léčby (ITT): Plně kvalifikované osoby, u kterých došlo k pokusu o implantaci zařízení CARILLON. Úspěšná populace s implantáty: Osoby s trvalou implantací, pozorováni pět let. Populace bez implantátu: Osoby zařazené do studie, u kterých došlo k pokusu o implantaci, ale které trvalý implantát neobdržely. LTFU: Nelze nadále sledovat Implantát CARILLON měl být zaveden celkem 53 plně kvalifikovaným pacientům, mezi něž se počítá také populace se záměrem léčby. Systém CARILLON Mitral Contour byl implantován celkem třiceti šesti (36) pacientům ( pacienti s implantátem ) s úspěšností 68 %. Z těchto 36 pacientů s implantátem: bylo u dvaceti šesti (26) pacientů k dosažení dostatečné redukce mitrální regurgitace, která vyústila v trvalé umístění zařízení CARILLON, bez jakéhokoli narušení koronární tepny zapotřebí pouze jednoho pokusu. u deseti (10) pacientů bylo pro splnění požadavků trvalého umístění zapotřebí více než jednoho pokusu. Sedmnáct (17) pacientů nesplnilo kritéria pro úspěšnou implantaci (nebyla prokázána redukce MR a/nebo narušení koronární tepny) a trvalý implantát neobdrželo ( pacienti bez implantátu ). Ze 17 pacientů bez implantátu: devět (9) neobdrželo trvalý implantát z důvodu uvedeného v protokolu - nedostatečná periprocedurální MR redukce - vymezeného jako jedno nebo více stupňová redukce v MR alespoň u jednoho MR parametru vyplývajícího z echokardiografie (vena contracta, množství natrávené potravy (regurgitantu), účinná plocha regurgitačního ústí nebo plocha jetu MR/levá síňová plocha) v době procedury. sedmi (7) pacientům zařízení nebylo implantováno z důvodu narušení koronární tepny. Strana 25 z 45
26 jeden (1) pacient nevyhověl z důvodu nedostatečné MR redukce a narušení koronární tepny. Obrázek 7.1: Dispozice pacientů klinického testu TITAN Strana 26 z 45
27 Demografie pacientů Klíčové demografie pacientů jak s implantáty, tak bez implantátů jsou shrnuty v tabulce 7.1. Tabulka 7.1: Klíčové demografické charakteristiky Charakteristika pacienta Pacienti s implantáty (počet = 36) 62 (13) Pacienti bez implantátu (počet = 17) 63 (13) hodnota P* Věk, průměr (SD), rok 0,95 Pohlaví, počet (%), muž Muž 27 (75) 14 (82) 0,73 Klasifikace NYHA, % (n) 0,55 Třída I 0 % (0/35) 0 % Třída II 0,0 % 5,9 % (1/17) Třída III 94,4 % (34/36) 94,1 % (16/17) Třída IV 5,6 % (2/36) 0,0 % 6ti minutová chůze, průměr 302,5 (74) 337,9 (83) 0,12 (SD), m Anamnéza, počet (%) Cukrovka 6 (16,7 %) 5 (29,4 %) 0,30 Angína pectoris 16 (44,4 %) 9 (52,9 %) 0,77 Ischemická choroba srdeční 22 (61,1 %) 12 (70,6 %) 0,56 Koronární bypass 12/22 (54,5 %) 4/12 (33,3 %) 0,30 Počet selhání srdce v posledních 12 měsících, průměr 0,8 (0,8) 3,0 (6,2) 0,13 (SD) Echo parametr, průměr (SD) LVEDD, cm 6,63 (0,85) 6,72 (0,77) 0,70 Průměr mitrálního anulu, cm 3,74 (0,56) 3,74 (0,48) 0,95 LVEF, průměr (SD) % 28,7 (7,5) 27,0 (7,8) 0,46 * Pořadové měření průměrného skóre Cochran-Mantel-Haenszelova (CMH) testu, dichotomní měření bylo zhodnoceno s použitím Fisherova testu a kontinuální měření s použitím t-testu nebo Wilcoxonova dvouvýběrového testu. Většina pacientů byla mužského pohlaví, III. NYHA třídy, u nichž šestiminutová chůze odpovídala středně závaznému selhání srdce. Mezi zmíněnými dvěma kohortami neexistovaly žádné statistické rozdíly v komorbiditě. U pacientů s implantáty a bez implantátů nebyly zjištěny žádné statisticky významné rozdíly v parametrech echokardiografie. Charakteristiky zařízení CARILLON a procedury Celková úspěšnost zařízení, implantátu a procedury jsou uvedeny v tabulce 7.2. Úspěšnost implantátu byla definována jako: - úspěšná trvalá implantace vyšetřovacího zařízení CARILLON. Úspěšnost implantátu byla dále kategorizována do případů vyžadujících pouze jeden pokus a případů vyžadujících více než jeden pokus. Celková úspěšnost implantace byla 68 %, přičemž 36 z 53 pacientů obdrželo trvalý implantát. Je nutné podotknout, že v 9 ze 17 případů, kdy zařízení CARILLON nebylo implantováno a muselo být odstraněno, se jednalo o důvod uvedený v protokolu, konkrétně o situaci, kdy v MR nebylo dosaženo jednostupňové redukce. V pouhých 8 případech nebyl implantát implantován z důvodu narušení koronární tepny. Strana 27 z 45
28 U 72 % případů (26/36) zavedených implantátu bylo dosaženo redukce MR a implantování na první pokus. Ve zbývajících 10 případech se zařízení podařilo úspěšně získat zpět (buďto z důvodu nedostatku redukce MR nebo narušení koronární tepny) a následný pokus(y) měl za následek uspokojivé MR výsledky umožňující trvalou implantaci. Tabulka 7.2: Úspěšnost zařízení a procedury Populace se záměrem léčby (počet = 53) Charakteristiky pacienta Úspěšnost implantace 67,9 % (36/53) Na první pokus 72,2 % (26/36) Vyžadující >1 pokus 27,8 % (10/36) Bezpečnost Hlavní nežádoucí účinky Mezi hlavní nežádoucí účinky se řadí především bezpečnost systému CARILLON Mitral Contour. Tyto nežádoucí účinky byly označeny jako hlavní nežádoucí účinky (MAE). Bezpečnost byla hodnocena jako 30denní míra (nebo den propuštění z nemocnice, cokoli z těchto dvou možností bylo delší) hlavních nežádoucích účinků s následujícími smíšenými koncovými ukazateli: Smrt Infarkt myokardu Srdeční perforace vyžadující zákrok katetrem nebo chirurgický zákrok Embolizace zařízení Výskyt chirurgického nebo perkutánního koronárního zákroku souvisejícího se zařízením (např. infekce/septikemie související se zařízením) 30denní míra hlavních nežádoucích účinků populace se záměrem léčby je uvedena v tabulce 7.3. Tabulka 7.3: Hlavní výsledky bezpečnosti po 30 dnech - populace se záměrem léčby Primární koncový ukazatel bezpečnosti po dobu 30 dnů sledování (popř. propuštění z nemocnice) Hlavní nežádoucí účinky Smrt Populace se záměrem léčby (počet = 53) Kaplan Meierův výskyt účinků Kaplan Meier 95 % CI 1,9% (1/53) 98,1 % [87,4 %, 99,7 %] 1,9 % (1/53) Infarkt myokardu 0 % (0/53) Srdeční perforace vyžadující zákrok katetrem nebo chirurgický zákrok 0 % (0/53) Embolizace zařízení 0 % (0/53) Výskyt chirurgického nebo perkutánního koronárního zákroku souvisejícího se zařízením 0 % (0/53) * Mezi pacienty se záměrem léčby se řadí všichni pacienti, kteří se zúčastnili studie a u nichž došlo k pokusu o implantaci zařízení CARILLON. Strana 28 z 45
29 Za 30 dnů činila míra výskytu hlavních nežádoucích účinků u populace se záměrem léčby 1,9 % (1/53). Zmíněná míra odpovídá jednomu úmrtí pacienta s ejekční frakcí levé srdeční komory (LVEF) 32,5 % a stupněm MR 4+, který před neúspěšnou implantací zařízení CARILLON ze dne 24. dubna 2008 prožil tranzientní asystolii v průběhu vstupu do koronárního sinu. Pacientovi selhaly ledviny a zemřel v důsledku selhání několika orgánů 2. května Tento hlavní nežádoucí účinek byl prošetřen výborem DSMB a vyhodnocen jako ne-srdeční operační úmrtí související s procedurou. V tabulce 7.4 jsou zobrazeny hlavní bezpečnostní výsledky (30denní míra hlavních nežádoucích účinků) rozdělené mezi skupinami s implantátem a bez implantátu. Z výsledků vyplývá, že po 30 dnech se míra hlavních nežádoucích účinků u populace s implantátem rovnala 0 %. Tabulka 7.4: Hlavní bezpečnostní výsledky po 30 dnech srovnání pacientů s implantátem a bez implantátu Pacienti s úspěšně zavedeným implantátem (počet = 36) Podíl Populace bez implantátu (počet = 17) Podíl Souvis ející se zařízení m Souvisejíc ís proceduro u Celke m 95 % CI** Souvis ející se zařízení m Souvisejíc ís proceduro u Celke m 95 % CI** [0,0 %, 9,7 %] 5,9 % (1/17) 5,9 % (1/17) [0,1 %, 28,7 %] [0,0 %, 9,7 %] [0,0 %, 9,7 %] 5,9 % (1/17) 5,9 % (1/17) [0,1 %, 28,7 %] [0,0 %, 19,5 %] Srdeční perforace vyžadující zákrok katetrem nebo chirurgický zákrok [0,0 %, 9,7 %] [0,0 %, 19,5 %] Embolizace zařízení [0,0 %, 9,7%] [0,0 %, 19,5%] Výskyt chirurgického nebo perkutánního koronárního zákroku souvisejícího se zařízením [0,0 %, 9,7 %] [0,0 %, 19,5 %] Primární koncový ukazatel bezpečnosti po dobu 30 dnů sledování (popř. propuštění z nemocnice)* Hlavní nežádoucí účinky Smrt Infarkt myokardu hodnota P*** 0,3208 0,3208 * Údaje uvedené v tabulce se týkají všech pacientů s úspěšně zavedeným implantátem a 30denním pozorováním (definováno jako pacienti s alespoň 24denním pozorováním) nebo pacientů s úspěšně zavedeným implantátem, u kterých se v průběhu 30 dnů po proceduře nebo před propuštěním z nemocnice dostavil hlavní nežádoucí účinek. ** Pro celkový počet pacientů s úspěšně zavedeným implantátem i u pacientů s neúspěšně zavedeným implantátem bylo spočítáno 95% CI. *** Srovnání pacientů s implantátem a bez implantátu. Pro porovnání celkového podílu pacientů, u nichž se v průběhu 30 dnů dostavil hlavní nežádoucí účinek, byla spočtena P hodnota Fisherova testu. U pacientů s implantátem činila 12měsíční ( dnů) míra hlavních nežádoucích účinků 27,8 % (10/36), z toho osm (8) úmrtí a dva (2) infarkty myokardu bez ST elevace (tabulka 7.5). U pacientů bez implantátu činila 12měsíční míra hlavních nežádoucích účinků 23,5 % (4/17) a zahrnovala 4 úmrtí. Mezi zmíněnými dvěma populacemi pacientů neexistoval žádný statisticky významný rozdíl ani v celkové míře hlavních nežádoucích účinků, ani v míře úmrtnosti. Strana 29 z 45
30 Tabulka 7.5: Dlouhodobé výsledky bezpečnosti srovnání pacientů s implantátem a bez implantátu po 1 roce Pacienti s úspěšně zavedeným implantátem (počet = 36) Podíl Hlavní nežádoucí účinky v průběhu 365 dnů sledování (nebo po propuštění z nemocnice)* Hlavní nežádoucí účinky Smrt Infarkt myokardu Srdeční perforace vyžadující zákrok katetrem nebo chirurgický zákrok Embolizace zařízení Výskyt chirurgického nebo perkutánního koronárního zákroku souvisejícího se zařízením Souvis ející se zařízení m Souvisejíc ís proceduro u Populace bez implantátu (počet = 17) Podíl Celke m 95 % CI** Souvisej ící se zařízení m Souvisejíc ís proceduro u Celke m 2,8 % (1/36) 27,8 % (10/36 ) [14,2 %, 45,2 %] 5,9 % (1/17) 23,5 % (4/17) 2,8 % (1/36) 22,2 % (8/36) [10,1 %, 39,2 %] 5,9 % (1/17) 23,5 % (4/17) 5,6 % (2/36) [0,7 %, 18,7 %] [0,0 %, 9,7 %] [0,0 %, 9,7 %] [0,0 %, 9,7 %] 95 % CI** [6,8 %, 49,9 %] [6,8 %, 49,9 %] [0,0 %, 19,5 %] [0,0 %, 19,5 %] [0,0 %, 19,5 %] [0,0 %, 19,5 %] hodnota P*** 1,0000 1,0000 * Údaje obsažené v tabulce se týkají všech pacientů, kteří byli sledováni po dobu 365 dnů od procedury, nebo pacientů, u kterých se v průběhu 365±30 dnů od procedury dostavil hlavní nežádoucí účinek. ** Pro celkový počet pacientů s úspěšně zavedeným implantátem i u pacientů s neúspěšně zavedeným implantátem bylo spočítáno 95% CI. *** Srovnání pacientů s implantátem a bez implantátu. Pro porovnání celkového podílu pacientů, kteří v průběhu 365±30 dnů utrpěli hlavní nežádoucí účinek, byla vypočtena p hodnota Fisherova testu. U pacientů s implantátem došlo po roce pouze k 5 dalším úmrtím. Dvě (2) z těchto úmrtí byly zjištěny po provedení 2ročního prošetření a tři (3) po provedení 3ročního prošetření. Příčina smrti tří (3) z těchto úmrtí nesouvisela s implantovaným zařízením. Příčina smrti zbývajících dvou (2) úmrtí nebyla rodinnými členy pacienta i přes několik žádostí sdělena. Strana 30 z 45
31 Obrázek 7.2: Křivka přežití klinického testu TITAN Kromě úmrtnosti nedošlo k žádným dalším dlouhodobým hlavním nežádoucím účinkům. S ukončením studie nebyl zjištěn výskyt žádných pozdních infarktů myokardu. Na konci 5letého prošetření studie bylo z 36 pacientů s implantátem: 15 pacientů živých 13 pacientů zemřelo 8 pacientů nebylo možné dále vysledovat a Integrita zařízení Klinický test TITAN začal s náborem pacientů v únoru 2009 a k poslednímu prošetření došlo v únoru Problémy s integritou zařízení (zlomené drátky) CARILLON XE2 zaznamenala společnosti Cardiac Dimensions v klinickém testu TITAN jen u malé míry pacientů. Přerušené drátky jsou možným rizikem, které je jasně popsané v protokolu testu TITAN, v návodu k požití a v informovaném souhlasu pacienta. Ztráta integrity zařízení nebyla spojena s žádným nežádoucím účinkem a zařízení CARILLON jsou nadále implantovány u 5 z 9 pacientů, jejichž zařízení se průběhu 5letého sledování zlomilo, přičemž v souvislosti se porušením zařízení nebyly zaznamenány žádné nežádoucí účinky. Údaje o účinnosti Tato zpráva o výsledku rozboru uvádí údaje o účinnosti u všech pacientů (pacienti s implantátem i bez implantátu) zaznamenané v době 12 měsíců od procedury. Účinky zařízení CARILLON na hodnocení MR U skupiny pacientů s implantátem došlo v průběhu 1 měsíce k výraznému zmenšení anulárního průměru (měřeno v anteroseptálně-posterolaterální rovině), a to o 13,5 % od Strana 31 z 45
32 výchozího bodu. Dané zmenšení anulárního průměru přetrvalo i v průběhu prošetření po 6 a 12 měsících. U skupiny pacientů bez implantátu naopak v průběhu prošetření po 12 měsících nebyla zjištěna žádná změna nebo mírný nárůst anulárního průměru. Rozdíl ve změně anulárních průměru mezi skupinami byl v průběhu všech následných vyšetření pacientů výrazně statisticky odlišný (P < 0,001). Obrázek 7.3: Mitrální anulární průměr pacienti s implantátem vs. pacienti bez implantátu Ze všech čtyř klíčových echokardiografických indexů MR - plochy regurgitačního ústí (EROA), vena contracta, regurgitačního objemu (RV) a regurgitační frakce (RF) - za 1 měsíc od procedury vyplynulo zmenšení od výchozího bodu pohybující se v rozmezí od -17 % až 28 %. Hodnota těchto změn všech parametrů klesala i nadále po 12 měsících (zmenšení o 34 % až -46 %). U skupiny pacientů bez implantátu naopak došlo k nárůstu všech parametrů MR. Strana 32 z 45
33 Obrázek 7.4: Parametry mitrální regurgitace - pacienti s implantátem vs. pacienti bez implantátu Celkový stupeň MR se u 81 % pacientů s implantátem, jejichž výchozí stupeň MR byl 3+ nebo 4+, od výchozího bodu snížil za 1 měsíc na pouhých 45 % a za 12 měsíců na pouhých 20 %. Po 12 měsících se většina pacientů (80 %) nacházela na stupni MR 2+ nebo lepším. Důležité je zmínit, že 12 % (3/25) z pacientů s implantátem po 12 měsících nevykazovalo žádné nebo pouze stopové množství MR (stupeň MR 0). U žádného z pacientů s implantátem nebyla v průběhu následných vyšetření zjištěna jakákoli známka systolického anteriorního pohybu nebo mitrální stenózy. Účinky zařízení CARILLON na hemodynamické vyšetření U skupiny pacientů s implantátem došlo v porovnání s výchozím bodem ke snížení průměrného ventrikulárního enddiastolického a endsystolického objemu. K největšímu poklesu došlo po 12 měsících, a to o -9,5 % a -12,1 % v uvedeném pořadí. To se odrazilo v nárůstech ejekční frakce levé komory o 18,7 % za 12 měsíců. Tyto změny naznačují reverzní remodelaci levé komory jako odpověď na redukci mitrální regurgitace. U skupiny pacientů bez implantátu bylo v ostrém kontrastu po 12 měsících prokázáno další zvetšení jak levého ventrikulárního enddiastolického, tak endsystolického objemu o 12,2 % a 9,6 % příznačného pro selhání srdce. Strana 33 z 45
34 Obrázek 7.5: Rozměry levé komory pacienti s implantátem vs. pacienti bez implantátu Účinky zařízení CARILLON na funkční hodnocení Účinky systému CARRILON Mitral Countour na zlepšení funkčnosti jsou popsány změnami třídy NYHA, tolerancí cvičení, měřeným testem šestiminutové chůze (6MWT) a kvalitou života (QOL) změřenou hodnocením KCCQ. 6MWT Výsledky testu šestiminutové chůze u pacientů s implantátem prokázaly zlepšení ve všech časových ohledech. Střední absolutní nárůst ušlé vzdálenosti byl v porovnání s výchozím bodem po jednom měsíci o 34,5 % větší (93,7 metrů), po 6 měsících o 40,1 % (114,6 metrů) a po 12 měsících o 36,7 % (102,5 metrů). Obrázek 7.6: Vzdálenost 6 minutové chůze pacienti s implantátem vs. pacienti bez implantátu U pacientů bez implantátu byla v porovnání s výchozím bodem po jednom měsíci střední absolutní změna po jednom měsíci pouhých 3,2 % (1,8 metrů), po 6 měsících došlo ke zkrácení Strana 34 z 45
35 ušlé vzdálenosti o 5,4 % (11,5 metrů) a po 12 měsících k nárůstu o 1,4 % (13,9 metrů), z čehož u skupiny pacientů bez implantátu nevyplynulo žádné zlepšení schopnosti cvičení. NYHA U třídy NYHA u pacientů s implantátem došlo oproti výchozímu bodu ke zlepšení, 84,4 % pacientů po 1 měsíci vykázalo pozitivní posun alespoň a jednu třídu NYHA; daný posun alespoň a jednu třídu NYHA byl zachován rovněž po 6 a 12 měsících, a to u 75,9 % a 76 % pacientů v uvedeném pořadí. Skupina pacientů bez implantátu naopak vykázala zlepšení o jednu třídu NYHA u pouhých 15,4 % pacientů po 1 měsíci, u pouhých 40 % pacientů po 6 měsících a 62,5 % pacientů po 12 měsících. Zlepšení po 12 měsících je pravděpodobně způsobeno malým počtem hodnotitelných údajů. KCCQ Údaje o kvalitě života těchto pacientů vykázaly průměrné 20bodové zlepšení 109 % po 1 měsíci, které se udrželo i po 6 (21,5 bodů, 73% zlepšení) a 12 měsících (17,3 bodů, 62% zlepšení). U skupiny pacientů bez implantátu byla zjištěna pouhá 5bodová změna po 1 měsíci a žádné další změny po 6 (4bodová změna) ani 12 měsících (6bodová změna). Obrázek 7.7: Výsledek hodnocení kvality života pacienti s implantátem vs. pacienti bez implantátu 8. Klinický test TITAN II Klinický test TITAN II byl zahájen jako podpůrná studie ke zhodnocení upraveného zařízení CARILLON. Konkrétně měl stanovit, zda upravené zařízení vyřešilo nebo minimalizovalo míru integrity zařízení, zatímco by si i nadále zachovalo zlepšení v oblasti regurgitace mitrální chlopně, kde by vedlo k dalším zlepšením funkčnosti, a v oblasti levé ventrikulární hemodynamiky, které byly pozorovány v testu TITAN. Strana 35 z 45
36 Vývoj klinického testu TITAN II Stejně jako tomu bylo u klinického testu TITAN, hlavním cílem testu TITAN II bylo zhodnotit bezpečnost rozvinutí a implantace zařízení CARILLON do koronárního sinu/velké žíly srdeční u pacientů s funkční mitrální regurgitací (FMR). Mezi druhotné cíle patřilo vyhodnocení bezpečnosti zařízení z dlouhodobého hlediska a zhodnocení účinku zařízení na hemodynamické funkce a pacienta celkově. Dohled na bezpečnost studie Do studie byl zapojen Výbor pro sledování údajů o bezpečnosti (DSMB). Výbor DSMB ověřil údaje o bezpečnosti ve vztahu ke stanoveným kritériím v kontextu jiných doposud shromážděných údajů o bezpečnosti a ve vztahu k trvání platnosti studie. Výbor DSMB rovněž zhodnotil míru nežádoucích účinků a pokrok studie při výskytu neočekávaných nežádoucích účinků. Statistická analýza Údaje shromážděné v této studii byly zdokumentovány s použitím souhrnných tabulek a výčtů údajů jednotlivých pacientů. V příslušných případech je zaznamenáno testování statistické významnosti. Chybějící údaje nebyly nahrazovány. Výsledky klinické studie TITAN II Dispozice pacientů Vývojový diagram dispozic všech pacientů, kteří byli do klinického testu TITAN II přijati, jsou uvedeny na obrázku 8.1 níže. Obrázek 8.1: Dispozice pacientů testu TITAN II Strana 36 z 45
37 Populaci pacientů se záměrem léčby tvořilo celkem 36 pacientů. Z tohoto počtu byl systém CARILLON Mitral Contour úspěšně implantován 30 pacientům ( pacienti s implantátem ) s 83% úspěšností implantace. Z celkového počtu neobdrželo trvalý implantát 6 pacientů ( pacienti bez implantátu ). Pacienti bez implantátu byli i po propuštění nadále sledováni a před vyřazením ze studie u nich byly hodnoceny nežádoucí účinky po dobu 30 dnů. Pacienti s implantátem byli i proceduře sledování po dobu 12 měsíců, což je doba vymezená protokolem. Z těchto 30 pacientů s implantátem: bylo u dvaceti dvou (22) pacientů k dosažení dostatečné redukce mitrální regurgitace, která vyústila v trvalé umístění zařízení CARILLON, bez jakéhokoli narušení koronární tepny zapotřebí pouze jednoho pokusu. u sedmi (7) pacientů bylo pro splnění požadavků trvalého umístění implantátu zapotřebí dvou pokusů. u jednoho (1) z pacientů bylo pro splnění požadavků trvalého umístění implantátu zapotřebí třech pokusů. Ze 6 pacientů bez implantátu: u třech (3) pacientů proběhl pokus o zavedení implantátu, zařízení jim však nebylo implantováno z důvodu narušení koronární tepny. ze zbývajících tří (3) pacientů proběhly u dvou (2) dva pokusy a zavedení implantátu a u jednoho pacienta tři pokusy o zavedení implantátu. Všem zmíněným pacientům nebylo zařízení implantováno z důvodu narušení koronární tepny. Demografie pacientů Klíčové demografie pacientů jak s implantáty, tak bez implantátů jsou shrnuty v tabulce 8.1. Tabulka 8.1: Klíčové demografické charakteristiky Charakteristika pacienta Věk, průměr a SD, roky Pohlaví, počet (%), muž Muž Klasifikace NYHA, % (n) Třída I Třída II Třída III Třída IV 6ti minutová chůze, průměr a SD, m Anamnéza, počet (%) Cukrovka Vysoký tlak Ischemická choroba srdeční Koronární bypass Ischemická kardiomyopatie Počet selhání srdce v posledních 12 měsících, průměr (SD) Pacienti s implantáty (počet = 30) 70,3 ±8,7 Pacienti bez implantátu (počet = 6) 72,0 ±7,6 70,0 % (21/30) 50,0 % (3/6) 3,3 % (1/30) 90,0 % (27/30) 6,7 % (2/30) 294,07 ±82,59 (29) 0 % (0/6) 16,7 % (1/6) 83,3 % (5/6) 0,0 % (0/6) 258,33 ±108,38 (6) 30,0 % (9/30) 70,0 % (21/30) 60,0 % (18/30) 38,9 % (7/18) 60,0 % (18/30) 33,3 % (2/6) 66,7 % (4/6) 33,3 % (2/6) 0,0 % (0/2) 50,0 % (3/6) 1,48 ±1,19 (27) 1,75 ±1,7 (4) Strana 37 z 45
38 Většina pacientů byla mužského pohlaví, III. NYHA třídy, u nichž šestiminutová chůze odpovídala středně závaznému selhání srdce. Charakteristiky zařízení CARILLON a procedury Celková úspěšnost zařízení, implantátu a procedury jsou uvedeny v tabulce 8.2. Úspěšnost implantátu byla definována jako: - úspěšná trvalá implantace vyšetřovacího zařízení CARILLON. Úspěšnost implantátu byla dále byla kategorizována do případů vyžadujících pouze jeden pokus a případů vyžadujících více než jeden pokus. Celková úspěšnost implantace byla 83%, přičemž 30 z 36 pacientů obdrželo trvalý implantát. U 73 % případů (22/30) zavedených implantátu bylo dosaženo redukce MR a implantování na první pokus. Ve zbývajících 8 případech se zařízení podařilo úspěšně získat zpět (z důvodu narušení koronární tepny) a následný pokus(y) měl za následek uspokojivé MR výsledky umožňující trvalou implantaci. Tabulka 8.2: Úspěšnost zařízení a procedury Charakteristiky pacienta Úspěšnost implantace Populace se záměrem léčby (počet = 36) 83,3 % (30/36) Na první pokus 73,3 % (22/30) Vyžadující >1 pokus 26,7 % (8/30) Na zmíněných 36 pacientech, kteří implantační proceduru podstoupili, bylo provedeno celkem 47 pokusů o implantaci. U osmi (8) pacientů (27 %) z celkové populace 30 pacientů byl zapotřebí více než jeden pokus. Co se týče populace pacientů bez implantátu, více než jeden pokus o zavedení implantátu byl zapotřebí u dvou (2) z 6 pacientů (33 %). Bezpečnost Hlavní nežádoucí účinky Mezi hlavní nežádoucí účinky se řadí především bezpečnost systému CARILLON Mitral Contour. Tyto nežádoucí účinky byly označeny jako hlavní nežádoucí účinky (MAE). Bezpečnost byla hodnocena jako 30denní míra (nebo den propuštění z nemocnice, cokoli z těchto dvou možností bylo delší) hlavních nežádoucích účinků s následujícími smíšenými koncovými ukazateli: Smrt Infarkt myokardu Srdeční perforace vyžadující zákrok katetrem nebo chirurgický zákrok Embolizace zařízení Výskyt chirurgického nebo perkutánního koronárního zákroku souvisejícího se zařízením (např. infekce/septikemie související se zařízením). 30 denní míra hlavních nežádoucích účinků populace se záměrem léčby je uvedena v tabulce 8.3. Strana 38 z 45
39 Tabulka 8.3: Hlavní výsledky bezpečnosti po 30 dnech populace se záměrem léčby Populace se záměrem léčby (počet = 36) Primární koncový ukazatel bezpečnosti: < 30 dnů po proceduře (nebo po propuštění z nemocnice) Hlavní nežádoucí účinky 2,8 % (1/36) Smrt 2,8 % (1/36) Infarkt myokardu 0 % (0/26) Srdeční perforace vyžadující zákrok katetrem nebo chirurgický zákrok 0 % Embolizace zařízení 0 % Výskyt chirurgického nebo perkutánního koronárního zákroku 0 % souvisejícího se zařízením * Mezi pacienty se záměrem léčby se řadí všichni pacienti, kteří se zúčastnili studie a u nichž došlo k pokusu a implantaci zařízení CARILLON (jak pacienti s implantátem, tak bez implantátu). Za 30 dnů činila míra výskytu hlavních nežádoucích účinků u populace se záměrem léčby 2,8 % (1/36). Zmíněná míra odpovídá jednomu úmrtí pacienta (pacient ), přičemž anamnéza daného pacienta zahrnovala kardiomyopatii, II. třídu NYHA, atriální fibrilaci, implantabilní kardioverter-defiblirátor, koronární bypass, infarkt myokardu, kouření a hyperlimidémii. K úspěšnému zavedení zařízení CARILLON došlo 28. března Pacient zemřel 14. dubna 2012 na následek začínající infekce/zánětu GIT, který v kombinaci se stávajícím vážným selháním srdce pacienta, dřívějším narušením funkce ledvin a slabou srdeční rezervou způsobil multisystémovou srdeční dekompenzaci vedoucí ke smrti pacienta. Tento nežádoucí účinek nebyl vyhodnocen jako související s procedurou ani se zařízením. V tabulce 8.4 jsou zobrazeny hlavní výsledky bezpečnosti (30denní míra hlavních nežádoucích účinků) rozdělené mezi skupinami s implantátem a bez implantátu. Z výsledků vyplývá, že po 30 dnech se míra hlavních nežádoucích účinků u populace s implantátem rovnala 3,3 % (1/30). U populace bez implantátu nebyly v průběhu 30 dnů zjištěny žádné hlavní nežádoucí účinky. Procedura CARILLON se tudíž může pochlubit velmi dobrým profilem bezpečnosti. Tabulka 8.4: Hlavní výsledky bezpečnosti po 30 dnech srovnání pacientů s implantátem a bez implantátu Primární koncový ukazatel bezpečnosti: < 30 dnů po proceduře (nebo po propuštění z nemocnice) Populace bez implantátu* (N = 6) Související se zařízením Související s procedurou Celkem Souvisejíc í se zařízením Související s procedurou Celkem 5,9 % (1/30) 0 % (0/6) 0 % (0/6) 0 % (0/6) Smrt 5,9 % (1/30) 0 % (0/6) 0 % (0/6) 0 % (0/6) MI 0 % (0/6) 0 % (0/6) 0 % (0/6) Srdeční perforace vyžadující zákrok katetrem nebo chirurgický zákrok 0 % (0/6) 0 % (0/6) 0 % (0/6) Embolizace zařízení 0 % (0/6) 0 % (0/6) 0 % (0/6) Výskyt chirurgického nebo perkutánního koronárního 0 % (0/6) 0 % (0/6) 0 % (0/6) Hlavní nežádoucí účinky Pacienti s úspěšně zavedeným implantátem (počet = 30) Strana 39 z 45
40 Primární koncový ukazatel bezpečnosti: < 30 dnů po proceduře (nebo po propuštění z nemocnice) zákroku souvisejícího se zařízením Pacienti s úspěšně zavedeným implantátem (počet = 30) Populace bez implantátu* (N = 6) Celková míra hlavních nežádoucích účinků (veškeré hlavní nežádoucí účinky této zprávy) u pacientů s implantátem je uvedena v tabulce 8.5. Míra hlavních dlouhodobých nežádoucích účinků činila u pacientů s implantátem 23,3 % (7/30 pacientů). Všechny tyto nežádoucí účinky vyústily ve smrt pacienta, nicméně ani jeden z účinků dle rozhodnutí nesouvisel s procedurou ani zařízením. Tabulka 8.5: Dlouhodobé bezpečnostní výsledky pacienti s implantátem Celkem hlavních nežádoucích účinků* Hlavní nežádoucí účinky Smrt Populace s implantátem (počet = 30) Podíl Související se zařízením Související s procedurou Celkem 23,3 % (7/30) 23,3 % (7/30) MI (0/30) (0/30) (0/30) Srdeční perforace vyžadující zákrok katetrem nebo chirurgický zákrok Embolizace zařízení Výskyt chirurgického nebo perkutánního koronárního zákroku souvisejícího se zařízením * Zahrnuje všechny pacienty s implantátem, které v průběhu konečné uzávěrky údajů pro tuto studii 23. září 2014 postihl hlavní nežádoucí účinek. Obrázek 8.2: Křivka přežití klinického testu TITAN II Integrita zařízení U dvaceti devíti (29) ze 30 pacientů studie Titan II s úspěšně zavedeným systémem CARILLON Mitral Contour nedošlo v průběhu období sledování po proceduře k prasknutí kotvy drátku. V průběhu 3měsíčního sledování po proceduře došlo k jednomu prasknutí kotvy implantátu, k němuž s největší pravděpodobností došlo v důsledku opětovného rozvinutí po vyjmutí implantátu, což je v rozporu s návodem k použití a lékařskou průpravou. Strana 40 z 45
41 Účinky zařízení CARILLON na hodnocení MR Účinky systému CARILLON Mitra Contour na parametry MR odvozené z echokardiografie (hodnoceny ve výchozím bodě, po 1, 6 a 12 měsících od procedury) pacientů s implantátem jsou uvedeny níže. Mitrální anulární průměr Mitrální anulární průměr (měřený v anterospetálně-posterolaterální rovině) se v průběhu jednoho měsíce zmenšil o 15,3 % od výchozího bodu. Zmenšení anulárního průměru přetrvalo také po 6 a 12 měsících. Tato změna mitrálního anulárního průměru je obdobná změně zjištěné v předchozí studii TITAN. Obrázek 8.3: Mitrální anulární průměr - změna od výchozího bodu Parametry MR Celkový stupeň MR u skupiny pacientů s implantátem se od výchozího bodu zlepšil natolik, že celkový počet 64 % pacientů, kteří byli ve výchozím bodě na stupni +3 nebo +4, se za jeden měsíc snížil na 42 % a po 12 měsících na pouhých 25 %. Po dvanácti měsících se většina pacientů (75 %) nachází na stupni MR 2+ nebo lepším (nižším). Důležité je zmínit rovněž, že 13 % z pacientů po 12 měsících nevykazovalo žádné nebo pouze stopové množství MR (stupeň MR 0). Ze čtyř klíčových echokardiografických indexů MR - vena contracta, plochy regurgitačního ústí (EROA), regurgitačního objemu (RV) a plochy jetu MR/levé síňové plochy (MRJA/LAA) za 1 měsíc vyplynulo zmenšení od výchozího bodu pohybující se v rozmezí od -17 % až -25 %. Tyto změny u všech parametrů klesaly i nadále po 12 měsících (zmenšení o -24 % až -37 %). Strana 41 z 45
42 Obrázek 8.4: Kvantitativní parametry mitrální regurgitace změna od výchozího bodu U žádného z pacientů s implantátem nebyla v průběhu následných vyšetření zjištěna žádná známka systolického anteriorního pohybu nebo mitrální stenózy. Účinky zařízení CARILLON na hemodynamické vyšetření V porovnání s výchozím bodem došlo ke snížení průměrného levého ventrikulárního enddiastolického (LVEDV) a endsystolického objemu. K největšímu poklesu o -5,2 % a -9,4 % došlo po 12 měsících. To se odrazilo v nárůstech ejekční frakce levé komory o 18,7 % za 12 měsíců. I když tyto změny nejsou statisticky významné, naznačují reverzní remodelaci levé komory jako odpověď na redukci mitrální regurgitace. Obrázek 8.5: Objemové parametry levé komory změna od výchozího bodu Strana 42 z 45
43 Účinky zařízení CARILLON na funkční hodnocení Účinky systému CARILLON Mitral Contour na zlepšení třídy NYHA a toleranci cvičení měřené testem šestiminutové chůze jsou uvedeny níže. NYHA U třídy NYHA došlo oproti výchozímu bodu k následujícímu zlepšení, 79,3 % pacientů po 1 měsíci vykázalo pozitivní posun alespoň o jednu třídu NYHA; posun alespoň a jednu třídu NYHA byl zachován rovněž po 6 a 12 měsících, a to u 83,3 % a 77,3 % pacientů v uvedeném pořadí. 6MWT Test šestiminutové chůze prokázal po 1 měsíci od procedury okamžité zlepšení, které trvalo i po 12 měsících od výchozího bodu. Střední absolutní nárůst ušlé vzdálenosti byl v porovnání s výchozím bodem po jednom měsíci o 28,4% větší (77,3 metrů), po 6 měsících o 27,2% (84,3 metrů) a po 12 měsících o 26,4% (77,6 metrů). Obrázek 8.6: Vzdálenost ušlá po 6 minutách chůze změna od výchozího bodu Strana 43 z 45
44 XIV. Definice Symboly použité na sestavě rukojeti a jejich definice jsou uvedeny níže: Symbol Definice Pozor, viz návod k použití Symbol ovládání Symbol zajištění Symbol uvolnění Copyright 2017 Cardiac Dimensions, Inc. Všechna práva vyhrazena Strana 44 z 45
45 Symboly použité na štítku výrobku a jejich definice jsou uvedeny níže: Symbol Definice Nepoužívejte opakovaně pouze pro jednorázové použití Nepoužívejte, je-li obal poškozený Datum použitelnosti Metoda sterilizace - ethylenoxid Číslo šarže Číslo v katalogu (číslo modelu) PhysicianResources/IFU Přečtěte si pokyny pro používání tohoto webu Výrobce Podmíněně bezpečný při MRI Udržujte v suchu Chraňte před slunečním zářením XV. Výrobce Cardiac Dimensions, Inc Lake Washington Blvd. N.E. Kirkland, Washington, 98033, U.S.A. Telefon: Fax: Patent- Copyright 2017 Cardiac Dimensions, Inc. Všechna práva vyhrazena Strana 45 z 45
CARILLON Mitral Contour System (XE2)
 CARILLON Mitral Contour System (XE2) Návod k použití 0 3 4 4 Výrobce: Cardiac Dimensions, Inc. 5540 Lake Washington Blvd. NE Kirkland, WA 98033 Spojené státy americké Zástupce pro ES: MedPass International,
CARILLON Mitral Contour System (XE2) Návod k použití 0 3 4 4 Výrobce: Cardiac Dimensions, Inc. 5540 Lake Washington Blvd. NE Kirkland, WA 98033 Spojené státy americké Zástupce pro ES: MedPass International,
CARILLON Mitral Contour System (XE2)
 CARILLON Mitral Contour System (XE2) Návod k použití 0 3 4 4 Výrobce: Cardiac Dimensions, Inc. 5540 Lake Washington Blvd. NE Kirkland, WA 98033 Spojené státy americké Zástupce pro ES: MedPass International,
CARILLON Mitral Contour System (XE2) Návod k použití 0 3 4 4 Výrobce: Cardiac Dimensions, Inc. 5540 Lake Washington Blvd. NE Kirkland, WA 98033 Spojené státy americké Zástupce pro ES: MedPass International,
CARILLON Mitral Contour System (XE2)
 CARILLON Mitral Contour System (XE2) Návod k použití 0 3 4 4 Výrobce: Cardiac Dimensions, Inc. 5540 Lake Washington Blvd. NE Kirkland, WA 98033 Spojené státy americké Zástupce pro ES: MedPass International,
CARILLON Mitral Contour System (XE2) Návod k použití 0 3 4 4 Výrobce: Cardiac Dimensions, Inc. 5540 Lake Washington Blvd. NE Kirkland, WA 98033 Spojené státy americké Zástupce pro ES: MedPass International,
RF CONDUCTR MC Ovladatelný elektrodový katétr pro intrakardiální ablaci
 RF CONDUCTR MC Ovladatelný elektrodový katétr pro intrakardiální ablaci Technická příručka Upozornění: Podle federálních / zákonů USA je výdej tohoto zařízení vázán na lékařský předpis. c VYSVĚTLENÍ SYMBOLŮ
RF CONDUCTR MC Ovladatelný elektrodový katétr pro intrakardiální ablaci Technická příručka Upozornění: Podle federálních / zákonů USA je výdej tohoto zařízení vázán na lékařský předpis. c VYSVĚTLENÍ SYMBOLŮ
ROZDÍLOVÁ TABULKA NÁVRHU PRÁVNÍHO PŘEDPISU S PŘEDPISY EU
 V. ROZDÍLOVÁ TABULKA NÁVRHU PRÁVNÍHO PŘEDPISU S PŘEDPISY EU Rozdílová tabulka návrhu vyhlášky, kterou se mění vyhláška č. 277/2004 Sb., o stanovení zdravotní způsobilosti k řízení motorových vozidel, zdravotní
V. ROZDÍLOVÁ TABULKA NÁVRHU PRÁVNÍHO PŘEDPISU S PŘEDPISY EU Rozdílová tabulka návrhu vyhlášky, kterou se mění vyhláška č. 277/2004 Sb., o stanovení zdravotní způsobilosti k řízení motorových vozidel, zdravotní
Invazivní vyšetření srdce a srdečních cév (srdeční katetrizace, koronarografie) Invazivní léčba srdečních cév (perkutánní koronární angioplastika)
 Invazivní vyšetření srdce a srdečních cév (srdeční katetrizace, koronarografie) Invazivní léčba srdečních cév (perkutánní koronární angioplastika) INFORMOVANÝ SOUHLAS PACIENTA (ZÁKONNÉHO ZÁSTUPCE) S POSKYTNUTÍM
Invazivní vyšetření srdce a srdečních cév (srdeční katetrizace, koronarografie) Invazivní léčba srdečních cév (perkutánní koronární angioplastika) INFORMOVANÝ SOUHLAS PACIENTA (ZÁKONNÉHO ZÁSTUPCE) S POSKYTNUTÍM
VASKULÁRNÍ STENT ZILVER FLEX 35
 VASKULÁRNÍ STENT ZILVER FLEX 35 POZOR: Federální zákony USA dovolují prodej tohoto zdravotnického zarízení pouze lékahjm nebo na predpis lékare (nebo kvalifikovaného klinického pracovníka). Nesterilizujte.
VASKULÁRNÍ STENT ZILVER FLEX 35 POZOR: Federální zákony USA dovolují prodej tohoto zdravotnického zarízení pouze lékahjm nebo na predpis lékare (nebo kvalifikovaného klinického pracovníka). Nesterilizujte.
6996T. Tunelovací nástroj. Technická příručka
 6996T Tunelovací nástroj Technická příručka Následující seznam obsahuje ochranné známky nebo registrované ochranné známky společnosti Medtronic v USA a případně v jiných zemích. Všechny ostatní ochranné
6996T Tunelovací nástroj Technická příručka Následující seznam obsahuje ochranné známky nebo registrované ochranné známky společnosti Medtronic v USA a případně v jiných zemích. Všechny ostatní ochranné
Katetrizační léčba mitrální regurgitace u pacientů s chronickou srdeční nedostatečností pomocí MitraClipu
 Katetrizační léčba mitrální regurgitace u pacientů s chronickou srdeční nedostatečností pomocí MitraClipu V. Pořízka, M. Želízko, R. Kočková, Klinika kardiologie IKEM XXIV. výroční sjezd ČKS, Brno 6.5.06
Katetrizační léčba mitrální regurgitace u pacientů s chronickou srdeční nedostatečností pomocí MitraClipu V. Pořízka, M. Želízko, R. Kočková, Klinika kardiologie IKEM XXIV. výroční sjezd ČKS, Brno 6.5.06
Příloha III Dodatky, které je třeba přidat do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Dodatky, které je třeba přidat do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku
Příloha III Dodatky, které je třeba přidat do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku
Po použití prostředek a obal zlikvidujte v souladu se zásadami nemocnice, správními a/nebo místními státními předpisy.
 NÁVOD K POUŽITÍ Accura Positsoon Balonkový katetr pro perkutánní transluminální angioplastiku (PTA, PC) STERILNÍ: Sterilizováno ethylenoxidem. Nepoužívejte, je li sterilní obal otevřen nebo poškozen. Před
NÁVOD K POUŽITÍ Accura Positsoon Balonkový katetr pro perkutánní transluminální angioplastiku (PTA, PC) STERILNÍ: Sterilizováno ethylenoxidem. Nepoužívejte, je li sterilní obal otevřen nebo poškozen. Před
Akutní koronární syndromy. Formy algické Forma arytmická Forma kongestivní Formy smíšené. Definice pojmů
 Akutní koronární syndromy Formy algické Forma arytmická Forma kongestivní Formy smíšené Definice pojmů Akutní koronární syndromy nestabilní angina pectoris (NAP) minimální léze myokardu - mikroinfarkt
Akutní koronární syndromy Formy algické Forma arytmická Forma kongestivní Formy smíšené Definice pojmů Akutní koronární syndromy nestabilní angina pectoris (NAP) minimální léze myokardu - mikroinfarkt
Punkce perikardiálního výpotku Pořízka V. KK IKEM
 Punkce perikardiálního výpotku Pořízka V. KK IKEM 11. 4. 2014 Perikardiální výpotek příčiny Mechanické: komplikace katetrizačních výkonů, trauma, poststernotomický sy Závažná celková onemocnění: celkové
Punkce perikardiálního výpotku Pořízka V. KK IKEM 11. 4. 2014 Perikardiální výpotek příčiny Mechanické: komplikace katetrizačních výkonů, trauma, poststernotomický sy Závažná celková onemocnění: celkové
Návod k použití S Sada stříkačky Vertecem V+
 Návod k použití 03.702.215S Sada stříkačky Vertecem V+ Nástroje a implantáty schválené nadací AO Foundation Návod k použití Před použitím si prosím pečlivě přečtěte tyto pokyny, jakékoli přiložené informace
Návod k použití 03.702.215S Sada stříkačky Vertecem V+ Nástroje a implantáty schválené nadací AO Foundation Návod k použití Před použitím si prosím pečlivě přečtěte tyto pokyny, jakékoli přiložené informace
Hemodynamický efekt komorové tachykardie
 Hemodynamický efekt komorové tachykardie Autor: Kristýna Michalčíková Výskyt Lidé s vadami srdce, kteří během svého života prodělali srdeční infarkt, trpí zúženými věnčitými tepnami zásobujícími srdce
Hemodynamický efekt komorové tachykardie Autor: Kristýna Michalčíková Výskyt Lidé s vadami srdce, kteří během svého života prodělali srdeční infarkt, trpí zúženými věnčitými tepnami zásobujícími srdce
TORQR Intrakardiální elektrodový katétr
 TORQR Intrakardiální elektrodový katétr Technická příručka 0123 Následující názvy jsou ochranné známky nebo registrované ochranné známky společnosti Medtronic v USA a případně v jiných zemích: Medtronic,
TORQR Intrakardiální elektrodový katétr Technická příručka 0123 Následující názvy jsou ochranné známky nebo registrované ochranné známky společnosti Medtronic v USA a případně v jiných zemích: Medtronic,
ATTAIN BIPOLAR OTW 4194
 ATTAIN BIPOLAR OTW 4194 Transvenózní, bipolární, stimulační, levokomorová elektroda uvolňující steroid, zaváděná do srdeční žíly přes vodicí drát Technická příručka 0123 2003 Následující seznam uvádí ochranné
ATTAIN BIPOLAR OTW 4194 Transvenózní, bipolární, stimulační, levokomorová elektroda uvolňující steroid, zaváděná do srdeční žíly přes vodicí drát Technická příručka 0123 2003 Následující seznam uvádí ochranné
Návod k použití. Endovaskulární katétr MicroSonic SV
 Autorizovaný zástupce: KRAUTH medical KG (GmbH & Co.) Wandsbeker Königstrasse 27-29 22041 Hamburg, Germany Endovaskulární katétr MicroSonic SV 2009 EKOS Corporation. Všechna práva vyhrazena. Návod k použití
Autorizovaný zástupce: KRAUTH medical KG (GmbH & Co.) Wandsbeker Königstrasse 27-29 22041 Hamburg, Germany Endovaskulární katétr MicroSonic SV 2009 EKOS Corporation. Všechna práva vyhrazena. Návod k použití
Mechanické srdeční podpory při katetrizačních ablacích. Mgr. Kamila Holdová
 Mechanické srdeční podpory při katetrizačních ablacích Mgr. Kamila Holdová Mechanické srdeční podpory systémy, které umožňují částečně nebo i kompletně podpořit práci srdce jako pumpy zavádí se mini-invazivní
Mechanické srdeční podpory při katetrizačních ablacích Mgr. Kamila Holdová Mechanické srdeční podpory systémy, které umožňují částečně nebo i kompletně podpořit práci srdce jako pumpy zavádí se mini-invazivní
Zenith Alpha HRUDNÍ STENTGRAFT
 Zenith Alpha HRUDNÍ STENTGRAFT Zenith Alpha hrudní nízkoprofilový stentgraft Trvanlivá reparace Speciálně navržen pro utěsnění ve zdravé tkáni Nový intuitivní zaváděcí systém se třemi jednoduchými kroky
Zenith Alpha HRUDNÍ STENTGRAFT Zenith Alpha hrudní nízkoprofilový stentgraft Trvanlivá reparace Speciálně navržen pro utěsnění ve zdravé tkáni Nový intuitivní zaváděcí systém se třemi jednoduchými kroky
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím
 Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referralové
Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referralové
Systém WaveOne Gold. Pilník WaveOne Gold Glider: Pilník WaveOne Gold Glider č
 Systém WaveOne Gold CS POUZE PRO DENTÁLNÍ POUŽITÍ NÁVOD K POUŽITÍ ENDODONTICKÝ STERILNÍ KANÁLKOVÝ PILNÍK S VRATNÝM POHYBEM REF. B ST W1GG & ENDODONTICKÉ STERILNÍ TVAROVACÍ PILNÍKY S VRATNÝM POHYBEM REF.
Systém WaveOne Gold CS POUZE PRO DENTÁLNÍ POUŽITÍ NÁVOD K POUŽITÍ ENDODONTICKÝ STERILNÍ KANÁLKOVÝ PILNÍK S VRATNÝM POHYBEM REF. B ST W1GG & ENDODONTICKÉ STERILNÍ TVAROVACÍ PILNÍKY S VRATNÝM POHYBEM REF.
Edukační materiál. Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera
 Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
Racionalizace indikace echokardiografických vyšetření
 základní principy doporučené postupy u vybraných diagnóz Oddělení neinvazivní kardiologie - Klinika kardiologie IKEM Únor 2009 Jednoznačné indikace : nový pacient Kliniky kardiologie ( Kardiocentra ) (akutní
základní principy doporučené postupy u vybraných diagnóz Oddělení neinvazivní kardiologie - Klinika kardiologie IKEM Únor 2009 Jednoznačné indikace : nový pacient Kliniky kardiologie ( Kardiocentra ) (akutní
Po použití prostředek a obal zlikvidujte v souladu se zásadami nemocnice, správními a/nebo místními státními předpisy.
 NÁVOD K POUŽITÍ Accura Unblocker Deblokační aspirační katétr STERILNÍ: Sterilizováno ethylenoxidem. Nepoužívejte, je li sterilní obal otevřen nebo poškozen. Před použitím si pečlivě prostudujte všechny
NÁVOD K POUŽITÍ Accura Unblocker Deblokační aspirační katétr STERILNÍ: Sterilizováno ethylenoxidem. Nepoužívejte, je li sterilní obal otevřen nebo poškozen. Před použitím si pečlivě prostudujte všechny
3-1. Přesná kontrola příslušenství (pouze pro EG-3870UTK)
 3-1. Přesná kontrola (pouze pro EG-3870UTK) Kombinace endoskopické dopředně-šikmé optiky, ultrazvukového zobrazení lineárního pole a mechanismu distálního elevátoru poskytuje uživatelům maximální kontrolu
3-1. Přesná kontrola (pouze pro EG-3870UTK) Kombinace endoskopické dopředně-šikmé optiky, ultrazvukového zobrazení lineárního pole a mechanismu distálního elevátoru poskytuje uživatelům maximální kontrolu
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
KIPS BAY MEDICAL, INC.
 ...advancing, refining and improving cardiac surgery. KIPS BAY MEDICAL, INC. Implantát pro vnější oporu safenózní žíly esvs Mesh Návod k použití KIPS BAY MEDICAL, INC. Implantát pro vnější oporu safenózní
...advancing, refining and improving cardiac surgery. KIPS BAY MEDICAL, INC. Implantát pro vnější oporu safenózní žíly esvs Mesh Návod k použití KIPS BAY MEDICAL, INC. Implantát pro vnější oporu safenózní
Zvažte oddálení podání regadenosonu u pacientů s nekontrolovanou hypertenzí.
 CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
provoz byl zahájen v r.1997
 MODERNÍ POSTUPY V INTERVENČNÍ KARDIOLOGII Weislamplová Marcela Pracoviště invazivní a intervenční kardiologie provoz byl zahájen v r.1997 Diagnostické výkony Terapeutické výkony ROZDĚLENÍ PACIENTŮ ELEKTIVNÍ
MODERNÍ POSTUPY V INTERVENČNÍ KARDIOLOGII Weislamplová Marcela Pracoviště invazivní a intervenční kardiologie provoz byl zahájen v r.1997 Diagnostické výkony Terapeutické výkony ROZDĚLENÍ PACIENTŮ ELEKTIVNÍ
Balónkový dilatační katetr s aplikací přes vodicí drát (OTW) pro perkutánní transluminální angioplastiku (PTA) (dále jen Persoon )
 NÁVOD K POUŽITÍ Accura Persoon Balónkový katetr pro perkutánní transluminární angioplastiku (PTA) Balónkový dilatační katetr s aplikací přes vodicí drát (OTW) pro perkutánní transluminální angioplastiku
NÁVOD K POUŽITÍ Accura Persoon Balónkový katetr pro perkutánní transluminární angioplastiku (PTA) Balónkový dilatační katetr s aplikací přes vodicí drát (OTW) pro perkutánní transluminální angioplastiku
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Akutní vaskulární příhody jsou nadále nejčastějšími příčinami úmrtí v ČR
 Akutní vaskulární příhody jsou nadále nejčastějšími příčinami úmrtí v ČR 2015 62 111 osob hospitalizovaných pro ICHS Ošetřovací doba 6,4 dne Mortalita 4,1% (3122 nemocných) 16 888 osob hospitalizovaných
Akutní vaskulární příhody jsou nadále nejčastějšími příčinami úmrtí v ČR 2015 62 111 osob hospitalizovaných pro ICHS Ošetřovací doba 6,4 dne Mortalita 4,1% (3122 nemocných) 16 888 osob hospitalizovaných
Metodika kódování diagnóz pro využití v IR-DRG
 Metodika kódování diagnóz pro využití v IR-DRG 009.2012 Platná verze MKN-10 Pro rok 2012 je platnou verzí Mezinárodní statistické klasifikace nemocí a přidružených zdravotních problémů 2. aktualizované
Metodika kódování diagnóz pro využití v IR-DRG 009.2012 Platná verze MKN-10 Pro rok 2012 je platnou verzí Mezinárodní statistické klasifikace nemocí a přidružených zdravotních problémů 2. aktualizované
Kontraindikace Neimplantujte do infikovaných míst.
 Indikace Identifikátor místa biopsie MammoMARK je určen pro použití k označení místa biopsie po provedení otevřené chirurgické nebo perkutánní biopsie prsu. Kontraindikace Neimplantujte do infikovaných
Indikace Identifikátor místa biopsie MammoMARK je určen pro použití k označení místa biopsie po provedení otevřené chirurgické nebo perkutánní biopsie prsu. Kontraindikace Neimplantujte do infikovaných
Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH)
 Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH) Se souhlasem Evropské lékové agentury (EMA) a její
Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH) Se souhlasem Evropské lékové agentury (EMA) a její
Příloha III. Změny v příslušných bodech informací o přípravku
 Příloha III Změny v příslušných bodech informací o přípravku Poznámka: Tyto změny v příslušných bodech informací o přípravku jsou výsledkem postupu přezkoumání. Informace o přípravku může být následně
Příloha III Změny v příslušných bodech informací o přípravku Poznámka: Tyto změny v příslušných bodech informací o přípravku jsou výsledkem postupu přezkoumání. Informace o přípravku může být následně
Užití DRG markerů v systému IR-DRG Verze 010
 Užití DRG markerů v systému IR-DRG Verze 010 1 / 5 NÁRODNÍ REFERENČNÍ CENTRUM Pokyny ke kódování markerů umělé plicní ventilace Definice Umělá plicní ventilace je postup, při němž přísun plynů do plic
Užití DRG markerů v systému IR-DRG Verze 010 1 / 5 NÁRODNÍ REFERENČNÍ CENTRUM Pokyny ke kódování markerů umělé plicní ventilace Definice Umělá plicní ventilace je postup, při němž přísun plynů do plic
SBĚR DAT STUDIE DUQUE - ZLOMENINA HORNÍHO KONCE STEHENNÍ KOSTI
 Inclusion Definice Zlomenina krčku SBĚR DAT STUDIE DUQUE - ZLOMENINA HORNÍHO KONCE STEHENNÍ KOSTI Diagnostická kritéria Pacient ve věku 65 let a více + splňující následující tři diagnostická kritéria:
Inclusion Definice Zlomenina krčku SBĚR DAT STUDIE DUQUE - ZLOMENINA HORNÍHO KONCE STEHENNÍ KOSTI Diagnostická kritéria Pacient ve věku 65 let a více + splňující následující tři diagnostická kritéria:
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Akutní formy ischemické choroby srdeční. Křivánková M. Oddělení urgentního příjmu FN Olomouc
 Akutní formy ischemické choroby srdeční Křivánková M. Oddělení urgentního příjmu FN Olomouc Ischemická choroba srdeční Akutní (nestabilní) formy nestabilní angina pectoris akutní infarkt myokardu s vývojem
Akutní formy ischemické choroby srdeční Křivánková M. Oddělení urgentního příjmu FN Olomouc Ischemická choroba srdeční Akutní (nestabilní) formy nestabilní angina pectoris akutní infarkt myokardu s vývojem
RePneu systém spirálky pro plicní volumredukci Návod k použití
 RePneu systém spirálky pro plicní volumredukci Návod k použití 1 MPS Medical Product Service GmbH Borngasse 20 35619 Braunfels Německo Tel.: (+49) 6442 962073 Fax: (+49) 6442 962074 PneumRx, společnost
RePneu systém spirálky pro plicní volumredukci Návod k použití 1 MPS Medical Product Service GmbH Borngasse 20 35619 Braunfels Německo Tel.: (+49) 6442 962073 Fax: (+49) 6442 962074 PneumRx, společnost
1 sterilní intrauterinní inzert obsahuje levonorgestrelum 52 mg. Pomocné látky: polyethylen, síran barnatý, hnědý oxid železitý, dimetikon.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Mirena Levonorgestrelum 20 mikrogramů /24 hodin 2. OBSAH LÉČIVÝCH LÁTEK 1 sterilní intrauterinní inzert obsahuje levonorgestrelum 52 mg 3. SEZNAM
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Mirena Levonorgestrelum 20 mikrogramů /24 hodin 2. OBSAH LÉČIVÝCH LÁTEK 1 sterilní intrauterinní inzert obsahuje levonorgestrelum 52 mg 3. SEZNAM
Průměr šroubu Barevné provedení Rozsah délek Vodicí drát Vrták. 2,5 mm žlutá mm Ø 1,0 100 mm Ø 2,0 mm
 OPERAČNÍ NÁSTROJE TECHNIKA PRO ARTROSKOPII ŠROUBY INSTRUMENTS BEZHLAVIČKOVÉ FOR ARTHROSCOPY KANYLOVANÉ Šrouby bezhlavičkové kanylované Ø ; Ø 3 mm; Ø 4 mm Určený účel použití Šrouby jsou určeny pro dočasnou
OPERAČNÍ NÁSTROJE TECHNIKA PRO ARTROSKOPII ŠROUBY INSTRUMENTS BEZHLAVIČKOVÉ FOR ARTHROSCOPY KANYLOVANÉ Šrouby bezhlavičkové kanylované Ø ; Ø 3 mm; Ø 4 mm Určený účel použití Šrouby jsou určeny pro dočasnou
DIGITÁLNÍ UČEBNÍ MATERIÁL 325-18
 DIGITÁLNÍ UČEBNÍ MATERIÁL 325-18 Název projektu: Číslo projektu: Název školy: Číslo materiálu: Autor: Předmět: Název materiálu: Cílová skupina: Zkvalitnění vzdělávání na SZŠ Děčín CZ.1.07/1.5.00/34.0829
DIGITÁLNÍ UČEBNÍ MATERIÁL 325-18 Název projektu: Číslo projektu: Název školy: Číslo materiálu: Autor: Předmět: Název materiálu: Cílová skupina: Zkvalitnění vzdělávání na SZŠ Děčín CZ.1.07/1.5.00/34.0829
VZTAH MEZI ISCHEMICKÝMI CÉVNÍMI PŘÍHODAMI A ONEMOCNĚNÍM SRDCE Z POHLEDU DIAGNOSTIKY A PREVENCE. MUDr. Michal Král
 VZTAH MEZI ISCHEMICKÝMI CÉVNÍMI PŘÍHODAMI A ONEMOCNĚNÍM SRDCE Z POHLEDU DIAGNOSTIKY A PREVENCE MUDr. Michal Král 2. Výskyt kardioselektivního troponinu T u pacientů v akutní fázi ischemické cévní mozkové
VZTAH MEZI ISCHEMICKÝMI CÉVNÍMI PŘÍHODAMI A ONEMOCNĚNÍM SRDCE Z POHLEDU DIAGNOSTIKY A PREVENCE MUDr. Michal Král 2. Výskyt kardioselektivního troponinu T u pacientů v akutní fázi ischemické cévní mozkové
Pokud se chcete dozvědět o statinech a problematice léčby více, přejděte na. Partnerem je Diagnóza FH, z.s.
 BRÁT! SAMOZŘEJMĚ! Pokud se chcete dozvědět o statinech a problematice léčby více, přejděte na www.athero.cz Připravila Česká společnost pro aterosklerózu www.athero.cz Česká společnost pro aterosklerózu
BRÁT! SAMOZŘEJMĚ! Pokud se chcete dozvědět o statinech a problematice léčby více, přejděte na www.athero.cz Připravila Česká společnost pro aterosklerózu www.athero.cz Česká společnost pro aterosklerózu
Dr. George Haidukewych Traumatolog, chirurg se zaměřením na rekonstrukční operace u dospělých pacientů, Florida Orhopaedic Institute
 Obsah Úvod a indikace....................................................................................... 4 Hlavní vlastnosti systému.................................................................................
Obsah Úvod a indikace....................................................................................... 4 Hlavní vlastnosti systému.................................................................................
Systém spirálky RePneu Návod k použití
 Systém spirálky RePneu Návod k použití 0086 MPS Medical Product Service GmbH Borngasse 20 35619 Braunfels Německo Tel.: (+49) 6442.962073 Fax: (+49) 6442.962074 PneumRx, Inc. 530 Logue Avenue Mountain
Systém spirálky RePneu Návod k použití 0086 MPS Medical Product Service GmbH Borngasse 20 35619 Braunfels Německo Tel.: (+49) 6442.962073 Fax: (+49) 6442.962074 PneumRx, Inc. 530 Logue Avenue Mountain
Ambulantní program koronárních katetrizací a následná péče o pacienta po propuštění. Bronislav Janek Klinika kardiologie IKEM
 Ambulantní program koronárních katetrizací a následná péče o pacienta po propuštění Bronislav Janek Klinika kardiologie IKEM Co je to ambulantní katetrizace? Jednodenní vyšetření a ošetření bez hospitalizace
Ambulantní program koronárních katetrizací a následná péče o pacienta po propuštění Bronislav Janek Klinika kardiologie IKEM Co je to ambulantní katetrizace? Jednodenní vyšetření a ošetření bez hospitalizace
ZDRAVOTNICTVÍ ČR: Stručný přehled údajů z Národního kardiochirurgického registru NZIS REPORT č. R/1 (10/2018)
 NÁRODNÍ ZDRAVOTNICKÝ INFORMAČNÍ SYSTÉM NKR ZDRAVOTNICTVÍ ČR: Stručný přehled údajů z Národního kardiochirurgického registru 2007 2017 NZIS REPORT č. R/1 (10/2018) Stručný přehled údajů z Národního kardiochirurgického
NÁRODNÍ ZDRAVOTNICKÝ INFORMAČNÍ SYSTÉM NKR ZDRAVOTNICTVÍ ČR: Stručný přehled údajů z Národního kardiochirurgického registru 2007 2017 NZIS REPORT č. R/1 (10/2018) Stručný přehled údajů z Národního kardiochirurgického
Tisková konference k realizaci projektu. vybavení komplexního. Olomouc, 9. listopadu 2012
 Tisková konference k realizaci projektu Modernizace a obnova přístrojového vybavení komplexního kardiovaskulárního k centra FN Olomouc Olomouc, 9. listopadu 2012 Fakultní nemocnice Olomouc je součástí
Tisková konference k realizaci projektu Modernizace a obnova přístrojového vybavení komplexního kardiovaskulárního k centra FN Olomouc Olomouc, 9. listopadu 2012 Fakultní nemocnice Olomouc je součástí
ČESKÝ JAZYK Návod k použití. Vysvětlivky k symbolům. Katalogové číslo. Číslo šarže. Sériové číslo. Množství. Jen pro jedno použití
 ČESKÝ JAZYK Návod k použití Vysvětlivky k symbolům Symbol Definice Katalogové číslo Číslo šarže Sériové číslo Množství Jen pro jedno použití Pozor, viz Návod k použití Vnitřní průměr Nepoužívejte, je-li
ČESKÝ JAZYK Návod k použití Vysvětlivky k symbolům Symbol Definice Katalogové číslo Číslo šarže Sériové číslo Množství Jen pro jedno použití Pozor, viz Návod k použití Vnitřní průměr Nepoužívejte, je-li
REZISTENTNÍ ARTERIÁLNÍ HYPERTENZE
 REZISTENTNÍ ARTERIÁLNÍ HYPERTENZE Autor: Jakub Flašík Výskyt Hypertenze je definována jako obtížně léčitelná (rezistentni) tehdy když se nedaří dosáhnou cílových hodnot krevního tlaku (
REZISTENTNÍ ARTERIÁLNÍ HYPERTENZE Autor: Jakub Flašík Výskyt Hypertenze je definována jako obtížně léčitelná (rezistentni) tehdy když se nedaří dosáhnou cílových hodnot krevního tlaku (
MORTALITA SRDEČNÍCH CHOROB PŘI FARMAKOTERAPII VS. PŘI INTERVENCÍCH ČI OPERACÍCH. Petr Widimský Kardiocentrum FNKV a 3.LF UK Praha
 MORTALITA SRDEČNÍCH CHOROB PŘI FARMAKOTERAPII VS. PŘI INTERVENCÍCH ČI OPERACÍCH Petr Widimský Kardiocentrum FNKV a 3.LF UK Praha Proč tato samostatná otázka k atestaci? Hrubé neznalosti faktů (někdy až
MORTALITA SRDEČNÍCH CHOROB PŘI FARMAKOTERAPII VS. PŘI INTERVENCÍCH ČI OPERACÍCH Petr Widimský Kardiocentrum FNKV a 3.LF UK Praha Proč tato samostatná otázka k atestaci? Hrubé neznalosti faktů (někdy až
Návod k použití pro endovaskulární prostředek EkoSonic MACH4
 Návod k použití pro endovaskulární prostředek EkoSonic MACH4 INDIKACE K POUŽITÍ Endovaskulární systém EkoSonic tvořený jedním infuzním katétrem a jedním ultrazvukovým jádrem je indikován pro následující
Návod k použití pro endovaskulární prostředek EkoSonic MACH4 INDIKACE K POUŽITÍ Endovaskulární systém EkoSonic tvořený jedním infuzním katétrem a jedním ultrazvukovým jádrem je indikován pro následující
LÉČBA STENÓZY VNITŘNÍ KAROTICKÉ TEPNY
 LÉČBA STENÓZY VNITŘNÍ KAROTICKÉ TEPNY Autor: Martin Baláž Školitel: MUDr. Petr Dráč, Ph.D. Charakteristika, výskyt Stenóza vnitřní krkavice je zúžení hlavní tepny zásobující mozek okysličenou krví. Nedostatečný
LÉČBA STENÓZY VNITŘNÍ KAROTICKÉ TEPNY Autor: Martin Baláž Školitel: MUDr. Petr Dráč, Ph.D. Charakteristika, výskyt Stenóza vnitřní krkavice je zúžení hlavní tepny zásobující mozek okysličenou krví. Nedostatečný
Antiagregační zajištění pacienta s koronárním stentem. Petr Toušek III.Interní-kardiologická klinika FNKV a 3.LF UK
 Antiagregační zajištění pacienta s koronárním stentem Petr Toušek III.Interní-kardiologická klinika FNKV a 3.LF UK Antiagregační zajištění pacienta s koronárním stentem Typ stentu Důvod revaskularizace
Antiagregační zajištění pacienta s koronárním stentem Petr Toušek III.Interní-kardiologická klinika FNKV a 3.LF UK Antiagregační zajištění pacienta s koronárním stentem Typ stentu Důvod revaskularizace
ATTAIN 6215 Balónkový katétr pro venografii
 ATTAIN 6215 Balónkový katétr pro venografii Technická příručka Upozornění: Podle federálních c zákonů USA je výdej tohoto přístroje vázán na lékařský předpis. 0123 Následující názvy jsou ochrannými známkami
ATTAIN 6215 Balónkový katétr pro venografii Technická příručka Upozornění: Podle federálních c zákonů USA je výdej tohoto přístroje vázán na lékařský předpis. 0123 Následující názvy jsou ochrannými známkami
Historie. Lokalizace. Úvod. Patogeneze. Ateroskleróza
 Historie Ateroskleróza Václav Pavliňák II. interní klinika VFN a 1.LF UK 1820 prof. Lobstein - arterioskleróza: rigidní arterie se ztluštělou stěnou 1904 ateroskleróza Marchand 1974-76 - Ross, moderní
Historie Ateroskleróza Václav Pavliňák II. interní klinika VFN a 1.LF UK 1820 prof. Lobstein - arterioskleróza: rigidní arterie se ztluštělou stěnou 1904 ateroskleróza Marchand 1974-76 - Ross, moderní
Účinný boj s LDL-cholesterolem? STATINY?!
 Účinný boj s LDL-cholesterolem? STATINY?! BRÁT! SAMOZŘEJMĚ! Pověry o statinech aneb Nevěřte všemu, co se povídá a píše O statinech, tedy lécích na snížení množství cholesterolu v krvi, koluje mezi laiky,
Účinný boj s LDL-cholesterolem? STATINY?! BRÁT! SAMOZŘEJMĚ! Pověry o statinech aneb Nevěřte všemu, co se povídá a píše O statinech, tedy lécích na snížení množství cholesterolu v krvi, koluje mezi laiky,
Úskalí diagnostiky akutního infarktu myokardu
 Úskalí diagnostiky akutního infarktu myokardu po srdeční zástavě Miroslav Solař I. Interní klinika FN Hradec Králov lové Úvod do problematiky Diagnostika akutního infarktu myokardu kardiomarkery koronarografie
Úskalí diagnostiky akutního infarktu myokardu po srdeční zástavě Miroslav Solař I. Interní klinika FN Hradec Králov lové Úvod do problematiky Diagnostika akutního infarktu myokardu kardiomarkery koronarografie
Úvod do trombofilie. MUDr. Dagmar Riegrová, CSc.
 Úvod do trombofilie MUDr. Dagmar Riegrová, CSc. Název projektu: Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických a klinických předmětů na Lékařské fakultě a Fakultě zdravotnických
Úvod do trombofilie MUDr. Dagmar Riegrová, CSc. Název projektu: Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických a klinických předmětů na Lékařské fakultě a Fakultě zdravotnických
Elektronické srdce a plíce CZ.2.17/3.1.00/33276
 Kasuistika č. 7, bolest mezi lopatkami a v zádech (vertebrogenní syndrom, infarkt myokardu, aneurysma aorty) J.K,muž, 55 let Popis případu a základní anamnesa 55 letý pacient hypertonik přivezen RZP po
Kasuistika č. 7, bolest mezi lopatkami a v zádech (vertebrogenní syndrom, infarkt myokardu, aneurysma aorty) J.K,muž, 55 let Popis případu a základní anamnesa 55 letý pacient hypertonik přivezen RZP po
SV615 Pojistný ventil - náhradní díly
 IM-P316-04 CH Vydání 3 SV615 Pojistný ventil - náhradní díly Návod k montáži a údržbě Upozornění Přestavení otevíracího tlaku nebo údržbu pojistných ventilů může provádět pouze výrobce nebo jím autorizovaná
IM-P316-04 CH Vydání 3 SV615 Pojistný ventil - náhradní díly Návod k montáži a údržbě Upozornění Přestavení otevíracího tlaku nebo údržbu pojistných ventilů může provádět pouze výrobce nebo jím autorizovaná
Intraoperační snímač ve tvaru T
 Návod k použití Typ 8816 Intraoperační snímač ve tvaru T Česky BB1779-B Červen 2012 Pouze pro profesionální uživatele BK MEDICAL Mileparken 34 2730 Herlev Dánsko Tel.: +45 4452 8100 / Fax: +45 4452 8199
Návod k použití Typ 8816 Intraoperační snímač ve tvaru T Česky BB1779-B Červen 2012 Pouze pro profesionální uživatele BK MEDICAL Mileparken 34 2730 Herlev Dánsko Tel.: +45 4452 8100 / Fax: +45 4452 8199
Aortální stenóza. Kazuistika pacientky od narození po transplantaci
 Aortální stenóza Kazuistika pacientky od narození po transplantaci Bc. Lucie Laciaková Dětské kardiocentrum 2. lékařské fakulty Univerzity Karlovy v Praze FN Motol Praha 2017 Kazustika pojednává o komplikacích
Aortální stenóza Kazuistika pacientky od narození po transplantaci Bc. Lucie Laciaková Dětské kardiocentrum 2. lékařské fakulty Univerzity Karlovy v Praze FN Motol Praha 2017 Kazustika pojednává o komplikacích
Technická specifikace
 Technická specifikace Srdeční chlopně a prstence 1. Biologické srdeční chlopně stentované, perikardiální, aortální do malých anulů 19-21mm (kovový stent) 2. Biologické srdeční chlopně stentované, perikardiální,
Technická specifikace Srdeční chlopně a prstence 1. Biologické srdeční chlopně stentované, perikardiální, aortální do malých anulů 19-21mm (kovový stent) 2. Biologické srdeční chlopně stentované, perikardiální,
MUDr. Jiří Malý, Ph. D. KC IKEM
 CHIRURGICKÁ LÉČBA ONEMOCNĚNÍ SRDCE MUDr. Jiří Malý, Ph. D. KC IKEM ANATOMIE SRDCE CHIRURGICKÁ LÉČBA CHOROB SRDCE Ischemická choroba srdeční aortokoronární bypass Chirurgie srdečních chlopní Chirurgie srdečního
CHIRURGICKÁ LÉČBA ONEMOCNĚNÍ SRDCE MUDr. Jiří Malý, Ph. D. KC IKEM ANATOMIE SRDCE CHIRURGICKÁ LÉČBA CHOROB SRDCE Ischemická choroba srdeční aortokoronární bypass Chirurgie srdečních chlopní Chirurgie srdečního
Elektromagnetický ventil Řady EZ-FLO 1 EZ - FLO. Příručka pro uživatele. Děkujeme Vám, že jste si vybrali řídící elektromagnetický ventil řady EZ FLO.
 Elektromagnetický ventil Řady EZ-FLO 1 EZ - FLO Příručka pro uživatele Děkujeme Vám, že jste si vybrali řídící elektromagnetický ventil řady EZ FLO. Obsah Specifikace. 1 Čísla modelů...1 Instalace.. 2
Elektromagnetický ventil Řady EZ-FLO 1 EZ - FLO Příručka pro uživatele Děkujeme Vám, že jste si vybrali řídící elektromagnetický ventil řady EZ FLO. Obsah Specifikace. 1 Čísla modelů...1 Instalace.. 2
AKUTNÍ INFARKT MYOCARDU. Charakteristika onemocnění AIM 18.12.2012 ETIOLOGIE, PŘÍZNAKY TERAPIE, OŠETŘOVATELSKÉ PRIORITY - CÍLE A INTERVENCE
 AKUTNÍ INFARKT MYOCARDU ETIOLOGIE, PŘÍZNAKY TERAPIE, OŠETŘOVATELSKÉ PRIORITY - CÍLE A INTERVENCE Charakteristika onemocnění AIM Akutní infarkt myokardu patří mezi akutní formy ischemické choroby srdeční.
AKUTNÍ INFARKT MYOCARDU ETIOLOGIE, PŘÍZNAKY TERAPIE, OŠETŘOVATELSKÉ PRIORITY - CÍLE A INTERVENCE Charakteristika onemocnění AIM Akutní infarkt myokardu patří mezi akutní formy ischemické choroby srdeční.
Atestační otázky z oboru kardiologie
 Publikováno z 2. lékařská fakulta Univerzity Karlovy v Praze ( https://www.lf2.cuni.cz) Atestační otázky z oboru kardiologie 1. Aortální stenóza CT a magnetická rezonance v kardiologii Antikoagulační léčba
Publikováno z 2. lékařská fakulta Univerzity Karlovy v Praze ( https://www.lf2.cuni.cz) Atestační otázky z oboru kardiologie 1. Aortální stenóza CT a magnetická rezonance v kardiologii Antikoagulační léčba
NÁRODNÍ REGISTR CMP. Cévní mozkové příhody epidemiologie, registr IKTA Kalita Z.
 NÁRODNÍ REGISTR CMP Cévní mozkové příhody epidemiologie, registr IKTA Kalita Z.. X.Cerebrovaskulární seminář, 23.9.2011 Kunětická Hora Sympozium firmy ZENTIVA Význam registru Odkud máme informace : ÚZIS
NÁRODNÍ REGISTR CMP Cévní mozkové příhody epidemiologie, registr IKTA Kalita Z.. X.Cerebrovaskulární seminář, 23.9.2011 Kunětická Hora Sympozium firmy ZENTIVA Význam registru Odkud máme informace : ÚZIS
Ischemická choroba srdeční a její detekce
 Ischemická choroba srdeční a její detekce Autor: Petřková Z. Ischemická choroba srdeční (dále ICHS) je nejčastější příčinou smrti nejen v české republice, ale v celém rozvinutém světě. Stres, kouření,
Ischemická choroba srdeční a její detekce Autor: Petřková Z. Ischemická choroba srdeční (dále ICHS) je nejčastější příčinou smrti nejen v české republice, ale v celém rozvinutém světě. Stres, kouření,
Řídicí moduly elektromotoru NLX pro systémy A-dec 300 a A-dec 500 I n s t a l a č n í p ř í r u č k a
 Řídicí moduly elektromotoru NLX pro systémy A-dec 300 a A-dec 500 I n s t a l a č n í p ř í r u č k a NEBEZPEČÍ: Pokud před zahájením tohoto postupu nevypnete napájení, může dojít k zasažení elektrickým
Řídicí moduly elektromotoru NLX pro systémy A-dec 300 a A-dec 500 I n s t a l a č n í p ř í r u č k a NEBEZPEČÍ: Pokud před zahájením tohoto postupu nevypnete napájení, může dojít k zasažení elektrickým
Lokální analýza dat Národního registru CMP. Komplexní cerebrovaskulární centrum Fakultní nemocnice Ostrava
 NÁRODNÍ REGISTR CMP Lokální analýza dat Národního registru CMP za rok 2010 Komplexní cerebrovaskulární centrum Fakultní nemocnice Ostrava MUDr. Martin Roubec Garant centra: MUDr. Michal Bar, Ph.D. Garant
NÁRODNÍ REGISTR CMP Lokální analýza dat Národního registru CMP za rok 2010 Komplexní cerebrovaskulární centrum Fakultní nemocnice Ostrava MUDr. Martin Roubec Garant centra: MUDr. Michal Bar, Ph.D. Garant
Práce anesteziologické sestry u implantace aortální chlopně katetrizační metodou
 Práce anesteziologické sestry u implantace aortální chlopně katetrizační metodou Lenka Rychetníková, Lenka Pleskotová Klinika anesteziologie, resuscitace a intenzívní medicíny Fakultní nemocnice Hradec
Práce anesteziologické sestry u implantace aortální chlopně katetrizační metodou Lenka Rychetníková, Lenka Pleskotová Klinika anesteziologie, resuscitace a intenzívní medicíny Fakultní nemocnice Hradec
Stent Decent je předinstalovaný balonkový rozšiřitelný stent uvolňující lék s následujícími vlastnostmi:
 NÁVOD K POUŽITÍ Accura Decent Koronární stent uvolňující lék paclitaxel STERILNÍ: Sterilizováno ethylenoxidem. Nepoužívejte, je li sterilní obal otevřen nebo poškozen. Před použitím si pečlivě prostudujte
NÁVOD K POUŽITÍ Accura Decent Koronární stent uvolňující lék paclitaxel STERILNÍ: Sterilizováno ethylenoxidem. Nepoužívejte, je li sterilní obal otevřen nebo poškozen. Před použitím si pečlivě prostudujte
SV60 Pojistné ventily - náhradní díly Montážní návod
 IM-S13-35 CTLS Vydání 6 SV60 Pojistné ventily - náhradní díly Montážní návod Upozornění Opravy a nastavování pojistného mohou být prováděny pouze výrobcem nebo jím autorizovanou firmou. Bezpečnostní upozornění
IM-S13-35 CTLS Vydání 6 SV60 Pojistné ventily - náhradní díly Montážní návod Upozornění Opravy a nastavování pojistného mohou být prováděny pouze výrobcem nebo jím autorizovanou firmou. Bezpečnostní upozornění
SBĚR DAT STUDIE DUQUE - AKUTNÍ INFRAKT MYOKARDU (AIM)
 Inclusion Definice Akutní infarkt myokardu (AIM) Telemedicína SBĚR DAT STUDIE DUQUE - AKUTNÍ INFRAKT MYOKARDU (AIM) Akutní infarkt myokardu (AIM) lze definovat z několika různých perspektiv dle charakteristik
Inclusion Definice Akutní infarkt myokardu (AIM) Telemedicína SBĚR DAT STUDIE DUQUE - AKUTNÍ INFRAKT MYOKARDU (AIM) Akutní infarkt myokardu (AIM) lze definovat z několika různých perspektiv dle charakteristik
Týká se i mě srdeční selhání?
 Týká se i mě srdeční selhání? Tato brožura vám může pomoci si uvědomit některé časné příznaky srdečního selhání. Co je to srdeční selhání? Srdeční selhání sice může znít hrozivě, ale vlastně to znamená,
Týká se i mě srdeční selhání? Tato brožura vám může pomoci si uvědomit některé časné příznaky srdečního selhání. Co je to srdeční selhání? Srdeční selhání sice může znít hrozivě, ale vlastně to znamená,
Souprava vylepšeného snímače excentru Směrový vrtací stroj 4045 DŮLEŽITÉ UPOZORNĚNÍ
 Form No. Souprava vylepšeného snímače excentru Směrový vrtací stroj 4045 Číslo modelu 132-4165 3395-935 Rev A Návod k instalaci DŮLEŽITÉ UPOZORNĚNÍ CALIFORNIA Důležité upozornění, poučka 65 Tento výrobek
Form No. Souprava vylepšeného snímače excentru Směrový vrtací stroj 4045 Číslo modelu 132-4165 3395-935 Rev A Návod k instalaci DŮLEŽITÉ UPOZORNĚNÍ CALIFORNIA Důležité upozornění, poučka 65 Tento výrobek
Instructions for use Ventrain DE Bedienungsanleitung für Ventrain. Instructions for use Ventrain
 ES Instrucciones de uso de Ventrain FR Mode d emploi de Ventrain Instructions for use Ventrain DE Bedienungsanleitung für Ventrain T Istruzioni per l uso di Ventrain NL Gebruiksinstructie Ventrain EN S
ES Instrucciones de uso de Ventrain FR Mode d emploi de Ventrain Instructions for use Ventrain DE Bedienungsanleitung für Ventrain T Istruzioni per l uso di Ventrain NL Gebruiksinstructie Ventrain EN S
Hemodynamika srdečních vad. Hana Maxová Ústav patologické fyziologie 2. LF UK
 Hemodynamika srdečních vad Hana Maxová Ústav patologické fyziologie 2. LF UK Srdeční vady Získané - vada v dospělosti - v celé populaci 0,2 % - nad 70 let 12% Chlopenní vady - aortální st. - mitrální reg.
Hemodynamika srdečních vad Hana Maxová Ústav patologické fyziologie 2. LF UK Srdeční vady Získané - vada v dospělosti - v celé populaci 0,2 % - nad 70 let 12% Chlopenní vady - aortální st. - mitrální reg.
Cévní mozková příhoda. Petr Včelák
 Cévní mozková příhoda Petr Včelák 12. 2. 2015 Obsah 1 Cévní mozková příhoda... 1 1.1 Příčiny mrtvice... 1 1.2 Projevy CMP... 1 1.3 Případy mrtvice... 1 1.3.1 Česko... 1 1.4 Diagnóza a léčba... 2 1.5 Test
Cévní mozková příhoda Petr Včelák 12. 2. 2015 Obsah 1 Cévní mozková příhoda... 1 1.1 Příčiny mrtvice... 1 1.2 Projevy CMP... 1 1.3 Případy mrtvice... 1 1.3.1 Česko... 1 1.4 Diagnóza a léčba... 2 1.5 Test
Aktualizováno 17.03.2015. Čistící sada INTEX Deluxe
 Aktualizováno 17.03.2015 Čistící sada INTEX Deluxe 1 NEŽ ZAČNETE SE SAMOTNÝM POUŽÍVÁNÍM, POZORNĚ SI PŘEČTĚTE NÁVOD K POUŽITÍ TÝKAJÍCÍ SE VŠECH SOUČÁSTÍ. TATO DŮLEŽITÁ DOPORUČENÍ SI PROSÍM USCHOVEJTE PRO
Aktualizováno 17.03.2015 Čistící sada INTEX Deluxe 1 NEŽ ZAČNETE SE SAMOTNÝM POUŽÍVÁNÍM, POZORNĚ SI PŘEČTĚTE NÁVOD K POUŽITÍ TÝKAJÍCÍ SE VŠECH SOUČÁSTÍ. TATO DŮLEŽITÁ DOPORUČENÍ SI PROSÍM USCHOVEJTE PRO
Důležité Přečtěte tuto uživatelskou příručku dříve, než budete používat a uschovejte jej pro budoucí použití.
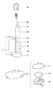 Důležité Přečtěte tuto uživatelskou příručku dříve, než budete používat a uschovejte jej pro budoucí použití. Nebezpečí Udržujte nabíječku a dezinfekční stanici mimo dosahu vody či jiných čisticích prostředků.
Důležité Přečtěte tuto uživatelskou příručku dříve, než budete používat a uschovejte jej pro budoucí použití. Nebezpečí Udržujte nabíječku a dezinfekční stanici mimo dosahu vody či jiných čisticích prostředků.
Ortopedické nástroje pro nohu. Speciální nástroje pro rekonstrukční chirurgii nohy.
 Ortopedické nástroje pro nohu. Speciální nástroje pro rekonstrukční chirurgii nohy. Technický návod Nástroje a implantáty schválené nadací AO Foundation Obsah Úvod Ortopedické nástroje pro nohu 2 Indikace
Ortopedické nástroje pro nohu. Speciální nástroje pro rekonstrukční chirurgii nohy. Technický návod Nástroje a implantáty schválené nadací AO Foundation Obsah Úvod Ortopedické nástroje pro nohu 2 Indikace
Symboly používané na obalu Ne všechny uvedené symboly se nutně vztahují na tento výrobek. Použité symboly naleznete na obalu.
 Symboly používané na obalu Ne všechny uvedené symboly se nutně vztahují na tento výrobek. Použité symboly naleznete na obalu. Katalogové číslo Výrobce Číslo šarže Elektronický odpad Sériové číslo K jednorázovému
Symboly používané na obalu Ne všechny uvedené symboly se nutně vztahují na tento výrobek. Použité symboly naleznete na obalu. Katalogové číslo Výrobce Číslo šarže Elektronický odpad Sériové číslo K jednorázovému
INTERNÍ ODDĚLENÍ SPEKTRUM POSKYTOVANÉ ZDRAVOTNÍ PÉČE
 Zdravotnická péče, diagnostika a léčba je na interním oddělení poskytována ve třech úrovních, tzv. diferencovaná péče: na lůžkách jednotky intenzívní péče pro interní a neurologické pacienty na lůžkách
Zdravotnická péče, diagnostika a léčba je na interním oddělení poskytována ve třech úrovních, tzv. diferencovaná péče: na lůžkách jednotky intenzívní péče pro interní a neurologické pacienty na lůžkách
ZÁZNAM POHOVORU S LÉKAŘEM
 Strana 1 / 5 Vážená pacientko, vážený paciente, vážení rodiče, vzhledem k Vašemu zdravotnímu stavu (zdravotnímu stavu Vašeho dítěte) je Vám doporučeno provedení výše uvedeného zákroku (výkonu). Před vlastním
Strana 1 / 5 Vážená pacientko, vážený paciente, vážení rodiče, vzhledem k Vašemu zdravotnímu stavu (zdravotnímu stavu Vašeho dítěte) je Vám doporučeno provedení výše uvedeného zákroku (výkonu). Před vlastním
Souhrn údajů o přípravku PHOXILIUM 1,2 MMOL/L FOSFÁT
 Příloha č. 2a k rozhodnutí o změně registrace sp. zn. sukls58787/2011 Souhrn údajů o přípravku PHOXILIUM 1,2 MMOL/L FOSFÁT 1. Název přípravku PHOXILIUM 1,2 mmol/l fosfát Roztok pro hemodialýzu/hemofiltraci
Příloha č. 2a k rozhodnutí o změně registrace sp. zn. sukls58787/2011 Souhrn údajů o přípravku PHOXILIUM 1,2 MMOL/L FOSFÁT 1. Název přípravku PHOXILIUM 1,2 mmol/l fosfát Roztok pro hemodialýzu/hemofiltraci
1. Co je mozková příhoda (iktus, mrtvice, stroke)?
 1. Co je mozková příhoda (iktus, mrtvice, stroke)? 2. Epidemiologie 3. Jak se mozková příhoda projevuje? 4. Co dělat při podezření na mozkovou mrtvici? 5. Jak CMP diagnostikujeme? 6. Léčba 7. Následky
1. Co je mozková příhoda (iktus, mrtvice, stroke)? 2. Epidemiologie 3. Jak se mozková příhoda projevuje? 4. Co dělat při podezření na mozkovou mrtvici? 5. Jak CMP diagnostikujeme? 6. Léčba 7. Následky
Antitrombotická léčba u strukturálních intervencí. Michael Želízko
 Antitrombotická léčba u strukturálních intervencí Michael Želízko 1. TAVI Antitrombotická léčba během a po TAVI: balancování mezi krvácením a trombózou Krvácivé komplikace (major 12%) z místa tepenného
Antitrombotická léčba u strukturálních intervencí Michael Želízko 1. TAVI Antitrombotická léčba během a po TAVI: balancování mezi krvácením a trombózou Krvácivé komplikace (major 12%) z místa tepenného
MUDr. Ondřej Rennét Oddělení urgentní medicíny. 18. Brněnské dny urgentní medicíny.
 MUDr. Ondřej Rennét Oddělení urgentní medicíny 18. Brněnské dny urgentní medicíny www.fnhk.cz Guidelines Česká kardiologická společnost 2007 European Society of Cardiology 2018 Definice SYNKOPA: Přechodná
MUDr. Ondřej Rennét Oddělení urgentní medicíny 18. Brněnské dny urgentní medicíny www.fnhk.cz Guidelines Česká kardiologická společnost 2007 European Society of Cardiology 2018 Definice SYNKOPA: Přechodná
- Kolaps,mdloba - ICHS angina pectoris - ICHS infarkt myokardu - Arytmie - Arytmie bradyarytmie,tachyarytmie
 NÁHLÁ POSTIŽENÍ OBĚHOVÉHO SYSTÉMU NEODKLADNÁ ZDRAVOTNICKÁ POMOC 27.2.--9.3.2012 BRNO 27.2. POSTIŽENÍ TEPEN - Onemocnění věnčitých tepen věnčité tepny zásobují srdeční sval krví a tedy i kyslíkem - Onemocnění
NÁHLÁ POSTIŽENÍ OBĚHOVÉHO SYSTÉMU NEODKLADNÁ ZDRAVOTNICKÁ POMOC 27.2.--9.3.2012 BRNO 27.2. POSTIŽENÍ TEPEN - Onemocnění věnčitých tepen věnčité tepny zásobují srdeční sval krví a tedy i kyslíkem - Onemocnění
Systém monitorování zdravotního stavu obyvatelstva ve vztahu k životnímu prostředí
 Systém monitorování zdravotního stavu obyvatelstva ve vztahu k životnímu prostředí Subsystém 6 Zdravotní stav Výsledky studie Zdraví dětí 2016 Rizikové faktory kardiovaskulárních onemocnění Úvod Prevalenční
Systém monitorování zdravotního stavu obyvatelstva ve vztahu k životnímu prostředí Subsystém 6 Zdravotní stav Výsledky studie Zdraví dětí 2016 Rizikové faktory kardiovaskulárních onemocnění Úvod Prevalenční
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
Snímač 14L CS-00 Srpen Pouze pro profesionální uživatele
 Snímač 14L3 16-01269-CS-00 Srpen 2014 Pouze pro profesionální uživatele OPRÁVNĚNÝ VÝROBCE BK Medical ApS Mileparken 34 2730 Herlev Dánsko Tel.:+45 4452 8100/Fax:+45 4452 8199 www.analogicultrasound.com
Snímač 14L3 16-01269-CS-00 Srpen 2014 Pouze pro profesionální uživatele OPRÁVNĚNÝ VÝROBCE BK Medical ApS Mileparken 34 2730 Herlev Dánsko Tel.:+45 4452 8100/Fax:+45 4452 8199 www.analogicultrasound.com
