Hartreeho-Fockova metoda (HF)
|
|
|
- Dana Ivana Soukupová
- před 8 lety
- Počet zobrazení:
Transkript
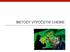
1 Stacionární Schrödingerova rovnice H Ψ = EΨ Metoda konfigurační interakce Metoda vázaných klastrů Poruchová teorie Zahrnutí el. korelace Bornova-Oppenheimerova aproximace Model nezávislých elektronů Vlnová funkce ve tvaru Slaterova determinantu MO LCAO + variační princip Hartreeho-Fockova metoda (HF) Separace σ-π Neempirické π-elektronové metody Zanedbání některých integrálů Empirické parametry Semiempirické π-elektronové metody Zanedbání elektronové repulse Hückelova metoda MO Zanedbání některých integrálů Empirické parametry Semiempirické metody (NDO, AM, PM3) Metoda EHT Zanedbání elektronové repulse Separace σ-π
2 E Korelační energie Korelační energie HF limita Nerelativistická exp. Experimentální energie Korelční energii má smysl počítat pouze s dostatečně velkou bází je potřeba mít řadu neobsazených MO -MO z AO s vyšším vedlejším kvantovým číslem (polarizační funkce) - pro zahrnutí korelační energie musí elektrony mít kam uniknout Relativistický příspěvek Pro většinu procesů je malý a je identický na obou stranách rovnice (kompenzace). Důležitost korelační energie závisí na povaze studovaného procesu (reakce). V některých případech je korelační energie na obou stranách rovnice stejná v případě, že počet i prostorové uspořádání elektronových párů je na obou stranách rovnice stejné. HOMODESMICKÉ REAKCE zachovává se počet vazeb daného typu i jejich uspořádání: CH 3 CH 2 CH 2 CH 3 + CH 3 CH 3 2 CH 3 CH 2 CH 3 IZODESMICKÉ REAKCE zachovává se pouze počet vazeb CH 3 CHO + CH 4 CH 3 CH 3 + CH 2 O ANIZODESMICKÉ REAKCE nezachovává se ani počet vazeb Zánik elektronového páru bez korelační energie nemá smysl popisovat.
3 n n n HF n ϕi ϕi ϕi ϕj ϕi ϕj i k i< j i, j k E = () h() () + () (2) v'(, 2) () (2) = n n n = ϕ () h() ϕ () + ϕ () ϕ (2) v'(, 2) ϕ () ϕ (2) i i i j i j i= i< j n ϕk() h() ϕk() ϕk() ϕj(2) v'(, 2) ϕk( ) ϕ j (2) j HF HF E n E = n ε k Koopmansův teorém Ionizační potenciál pro elektron v orbitalu i je dán zápornou hodnotou energie tohoto orbitalu: IP i (Koopmans) = -ε i Podobně pro elektronovou afinitu (EA).
4 Koopmansův teorém Ionizační potenciál pro elektron v orbitalu i je dán zápornou hodnotou energie tohoto orbitalu: IP i (Koopmans) = -ε i Podobně pro elektronovou afinitu (EA). KT je založen na kompenzaci chyb: rozdíl v zanedbané korelační energii vs. zanedbaná relaxační energie. E Ε corr (i) Ε corr (m) HF energie Orbitální relaxační en. E relax (i) Nerelativistická exp. Experimentální energie HF energie Nerelativistická exp. Experimentální energie ε corr corr ( m) > ε () i corr corr relax ε ( m) ε () i + ε () i Princip KT: Zadenbání korelační energie Částečně se kompenzuje Zanedbání orbitalové relaxace Zanedbání relativistických efektů - zanedbatelné pro valenční elektrony - nelze zanedbat pro core elektrony těžších atomů
5 KT for p-benzoquinone, anthracenequinone and pentacenequinone Journal of Electron Spectroscopy and Related Phenomena (200) 6 79 KT HF/cc-pvdz Exp. 4b 3g (n) b 2u (n) b 3u (π).9.06 b g (π) b 3g (π) b 2g (π) Δ(E M E M+ )
6 Spolehlivost Koopmansova theorému [ev] KT ΔSCF CI Experimen t H 2 O b a a CH 4 t a
7 Relativistický příspěvek k energiím elektronů vnitřních slupek (v ev): CH 4 (s) 0. Ne(s) 0.8 Ar(s) 4 U(7s).0 U(6d) 2. U(5f) 8.3
8 4. Hartree-Fock description Hartree-Fock description BASIS No. No. of HF Orbital SET of bf prim. G Energy En. sto-3g G G G G(d,p) tzvp cc-pvdz cc-pvtz cc-pvqz cc-pv5z Koopmansův teorém Přesná hodnota ionizačního potenciálu je He atom Přesná hodnota: E He+ + IP(He) = a. u.
9 E Korelační energie Korelační energie HF limita Nerelativistická exp. Experimentální energie Korelční energii má smysl počítat pouze s dostatečně velkou bází je potřeba mít řadu neobsazených MO -MO z AO s vyšším vedlejším kvantovým číslem (polarizační funkce) - pro zahrnutí korelační energie musí elektrony mít kam uniknout Elektronová korelace je důsledkem toho, že elektrony se vyskytují příliš blízko sebe. Pro zahrnutí korelační energie musí elektrony mít možnost se vyhnout jeden druhému uniknout do jiného (neobsazeného) molekulového orbitalu. Zahrnutí dalších molekulových orbitalů nám umožní větší počet Slaterových orbitalů vzniklých z HF orbitalů. Virtualní orbitaly Valenční - neobsazené Mono-, di-, tri,- excitované determinanty z referenčního Slaterova determinantu Example: molekula vody Valenční - obsazené Core orbitaly
10 Řešením HF rovnic získáme molekulové orbitaly. MO získáme jako lineární kombinaci atomových orbitalů získáme rozvojové c μi j i L m c m i c m Příklad: molekula H 2 O v minimální bázi (každý vnitřní a valenční orbital atomů H a O je reprezentován právě jednou funkci gaussiánem. H... x (s) jednda funkce typu s na každém z vodíků O... x (s) reprezentuje vnitřní orbital x (2s) 3 x (2p) 2p x, 2p y, 2p z Celkem 7 AO získáme 7 MO φ 7 = 2s + 2p z s(h A ) s(h B ) φ 6 = 2p y s(h A ) + s(h B ) φ 5 = 2p x φ 4 = 2s 2p z φ 3 = 2p y + s(h A ) s(h B ) φ 2 = 2s + 2pz + s(h A ) + s(h B ) φ = s(o) Celkem máme 0 elektronů -Umístíme je do pěti energeticky nejnižších orbitalů. Získáme referenční, HF, Slaterův determinant: Ψ = ! ϕϕϕϕϕ
11 Molekulové orbitaly H 2 O
12 φ 7 = 2s + 2p z s(h A ) s(h B ) φ 6 = 2p y s(h A ) + s(h B ) φ 5 = 2p x φ 4 = 2s 2p z φ 3 = 2p y + s(h A ) s(h B ) φ 2 = 2s + 2pz + s(h A ) + s(h B ) φ = s(o) Celkem máme 0 elektronů -Umístíme je do pěti energeticky nejnižších orbitalů. Získáme referenční, HF, Slaterův determinant: Ψ = ! ϕϕϕϕϕ Ze sady MO plynoucích z řešení Fockových rovnic a daného počtu elektronů v molekule můžeme sestavit řadu Slaterových determinantů. Například: Ψ = ! ϕϕϕϕϕϕ Ψ = ! ϕϕϕϕϕϕ Dolní index označuje uprázdněné MO a horní index označuje zaplněné MO vzhledem k referenčnímu HF Slaterovu determinantu
13 Monoexcitované determinanty: Ψ = 0 ϕ () ϕ ()... ϕ () ϕ(2) ϕi(2)... ϕn(2) n! ϕ ( n) ϕ ( n)... ϕ ( n) i i n n occ unocc S a a ci i i a Ψ = Ψ Ψ = a i ϕ () ϕ ()... ϕ () ϕ(2) ϕa(2)... ϕn(2) n! ϕ ( n) ϕ ( n)... ϕ ( n) a a n n Biexcitované determinanty: occ unocc D ab ab cij ij i a j i b a Ψ = Ψ Analogicky tri-, tetra-,... excitovanéné determinanty
14 => single Slater determinant is replaced by linear combination of many determinants Φ= C Ψ I I I Various methods differ in the specification of Slater determinants in linear expansion and in the criteria used in search for optimal coefficients C I If all Slater determinant that can be created with the given basis set are considered full CI (configuration interaction) Full CI provides an exact solution of the many-electron problem for a given basis set. N number of electrons B number of basis functions N electrons in 2B spin-orbitals 2 N-electron Slater determinants B N Water in minimum basis set: 4 4! = = !4! Water in VDZ basis set: 26 26! = = ! 6! Water in VTZP basis set: 60 = Freezing O(s): x x 0 9
15 CI final notes A + B C QCH description: Cannot be described exactly (full CI) in general. Approximate methods REQUIREMENTS consistent, balanced description for L and R side of chemical eq. Quality/accuracy should not depend on the size of the system E(A) + E(B) = E(A B) inf size consistent description HF size consistent for closed-shell monomers Full CI always size consistent CI-SD not!
16 => single Slater determinant is replaced by linear combination of many determinants Φ= C Ψ I I I Various methods differ in the specification of Slater determinants in linear expansion and in the criteria used in search for optimal coefficients C I Not exact solution. Variational principle upper limit Many of integrals are zero! Slater determinants mush have the same spin Brillouin s theorem: ˆ a Ψ H Ψ = 0 0 i Slater-Condon s rules: majority of integrals formed by different Slater determinant vanishes
17 Example: H 2 in a minimum basis set Show all possible Slater determinants how many are there How man of them can really contribute to the wavefuntion?
18 Slaterova-Condonova pravidla K L M = mn = pn = pq N Oˆ ˆ = hi () i= KOˆ K = mhi ˆ() m = mhi ˆ() m N m KOˆ ˆ ˆ L = mhi () p = mhi () p KOˆ M = 0 N m Oˆ 2 N N = i= j> i r ij K Oˆ K 2 N m N = n mn mn N ˆ K O L = mn pn 2 n [ ] [ ] K O M = mn pq = mn pq mn qp = mp nq mq np
19 Mono-, di-, tri-, tetra-, etc. determinants: occ unocc S a a ci i i a Ψ = Ψ occ unocc D ab ab cij ij i a j i b a Ψ = Ψ CI wavefunction 0 c r r rs rs rst rst 0 0 ca a cab ab cabc abc... ar a< b a< b< c r< s r< s< t Φ = Ψ + Ψ + Ψ + Ψ + Φ = Ψ c0 0 cs S cd D ct T... CI matrix Ψ0 Hˆ Ψ ˆ 0 0 Ψ0 H D SHS ˆ SHD ˆ SHT ˆ 0... ˆ ˆ ˆ DHD DHT DHQ... T Hˆ T T Hˆ Q... QHQ ˆ Brillouin s theorem Slater-Condon rules Effect of singles Effect of doubles DHQ ˆ Ψ rs ab Hˆ Ψ tuvw cdef a,b must be in c,d,e,f r,s must be in t,u,v,w
20 CI expression for correlation energy Φ = c Ψ + c Ψ + c Ψ + c Ψ + r r rs rs rst rst a a ab ab abc abc... ar a< b a< b< c r< s r< s< t Intermediate normalization: Ψ0 Φ 0 = Linear variational method: Ĥ Φ 0 = E0 Φ0 ( ˆ ) ( ˆ ) ( E ) H E Φ = E Φ = E corr Φ = Ψ Hˆ Ψ rs Ψ0 H E0 Φ 0 = Ecorr Ψ0 Φ 0 = Ecorr cab 0 a< b r< s Expression for correlation energy is simple! We have to know expansion coefficients Expansion coefficients for S, D, etc. are coupled! Coupling equations from Eq. () multiplied by S, D, etc. Cannot be managed except for small systems rs ab
21 Configuration interaction (CI) Wavefunction in the form: Variation theorem applied Wavefunction expansion must be truncated: SD N 2B N N = n n Search only for C coefficients of CI expansion MO are kept fixed (coefficients c does not change) CI S D T Q Φ = c0ψ 0 +Ψ +Ψ +Ψ +Ψ +... For n-tuple excitations considered in a system of N electrons in 2B spinorbitals Various implementations (CID, CISD, CISDTQ,..) Not size consistent! Davidson correction for size consistency: (-c 0 ) 2.E correl Applications Modern variant of CI method: AQCC, ACPF CISD - 2el ~ 00% E(corr) - 00el ~ 60% E(corr) Example: He He
METODY VÝPOČETNÍ CHEMIE
 METODY VÝPOČETNÍ CHEMIE Metody výpočetní chemie Ab initio metody Semiempirické metody Molekulová mechanika Molekulová simulace Ab initio metody Ab initio - od počátku Metody kvantově-mechanické vycházejí
METODY VÝPOČETNÍ CHEMIE Metody výpočetní chemie Ab initio metody Semiempirické metody Molekulová mechanika Molekulová simulace Ab initio metody Ab initio - od počátku Metody kvantově-mechanické vycházejí
Ab initio výpočty v chemii a biochemii
 Ab initio výpočty v chemii a biochemii Doc. RNDr. Ing. Jaroslav Burda, CSc., jaroslav.burda@mff.cuni.cz Dr. Vladimír Sychrovský vladimir.sychrovsky@uochb.cas.cz Studijní literatura Szabo A., Ostlund N.S.
Ab initio výpočty v chemii a biochemii Doc. RNDr. Ing. Jaroslav Burda, CSc., jaroslav.burda@mff.cuni.cz Dr. Vladimír Sychrovský vladimir.sychrovsky@uochb.cas.cz Studijní literatura Szabo A., Ostlund N.S.
Operátory a maticové elementy
 Operátory a matice Operátory a maticové elementy operátory je výhodné reprezentovat maticemi maticové elementy operátorů jsou dány vztahy mezi Slaterovými determinanty obsahujícími ortonormální orbitaly
Operátory a matice Operátory a maticové elementy operátory je výhodné reprezentovat maticemi maticové elementy operátorů jsou dány vztahy mezi Slaterovými determinanty obsahujícími ortonormální orbitaly
Atom vodíku. Nejjednodušší soustava: p + e Řešitelná exaktně. Kulová symetrie. Potenciální energie mezi p + e. e =
 Atom vodíku Nejjednodušší soustava: p + e Řešitelná exaktně Kulová symetrie Potenciální energie mezi p + e V 2 e = 4πε r 0 1 Polární souřadnice využití kulové symetrie atomu Ψ(x,y,z) Ψ(r,θ, φ) x =? y=?
Atom vodíku Nejjednodušší soustava: p + e Řešitelná exaktně Kulová symetrie Potenciální energie mezi p + e V 2 e = 4πε r 0 1 Polární souřadnice využití kulové symetrie atomu Ψ(x,y,z) Ψ(r,θ, φ) x =? y=?
Mul$determinantální metody: CASSCF
 Mul$determinantální metody: CASSCF Mul%konfiguračni (mnohadeterninantálni MC SCF) metody použivají narozdíl od metody Hartreeho- Focka pro popis N- elektronového systému větší počet Slaterových determinantů.
Mul$determinantální metody: CASSCF Mul%konfiguračni (mnohadeterninantálni MC SCF) metody použivají narozdíl od metody Hartreeho- Focka pro popis N- elektronového systému větší počet Slaterových determinantů.
Modelové výpočty na H 2 a HeH +
 Modelové výpočty na H 2 a HeH + Minimální báze Všechny teoretické poznatky je užitečné ilustrovat modelovým výpočtem. Budeme aplikovat Hartree-Fockovy výpočty na uzavřených slupkách systémů H 2 a HeH +.
Modelové výpočty na H 2 a HeH + Minimální báze Všechny teoretické poznatky je užitečné ilustrovat modelovým výpočtem. Budeme aplikovat Hartree-Fockovy výpočty na uzavřených slupkách systémů H 2 a HeH +.
Atomové a molekulové orbitaly Ion molekuly vodíku. Molekula vodíku Heitler-Londonovou metodou. Metoda LCAO. Báze atomových orbitalů.
 Atomové a molekulové orbitaly Ion molekuly vodíku. Molekula vodíku Heitler-Londonovou metodou. Metoda LCAO. Báze atomových orbitalů. Ion molekuly vodíku H + 2 První použití metody je demonstrováno při
Atomové a molekulové orbitaly Ion molekuly vodíku. Molekula vodíku Heitler-Londonovou metodou. Metoda LCAO. Báze atomových orbitalů. Ion molekuly vodíku H + 2 První použití metody je demonstrováno při
Teorie chemické vazby a molekulární geometrie Molekulární geometrie VSEPR
 Geometrie molekul Lewisovy vzorce poskytují informaci o tom které atomy jsou spojeny vazbou a o jakou vazbu se jedná (topologie molekuly). Geometrické uspořádání molekuly je charakterizováno: Délkou vazeb
Geometrie molekul Lewisovy vzorce poskytují informaci o tom které atomy jsou spojeny vazbou a o jakou vazbu se jedná (topologie molekuly). Geometrické uspořádání molekuly je charakterizováno: Délkou vazeb
Přehled Ab Initio a semiempirických metod
 Přehled Ab Initio a semiempirických metod Pokud se vám bude zdát, že je v tom nějaký blud, tak tam asi je. Budu rád, když mě na něj upozorníte. Ab initio metody - od počátku, z prvotních principů, tzn.
Přehled Ab Initio a semiempirických metod Pokud se vám bude zdát, že je v tom nějaký blud, tak tam asi je. Budu rád, když mě na něj upozorníte. Ab initio metody - od počátku, z prvotních principů, tzn.
Od kvantové mechaniky k chemii
 Od kvantové mechaniky k chemii Jan Řezáč UOCHB AV ČR 19. září 2017 Jan Řezáč (UOCHB AV ČR) Od kvantové mechaniky k chemii 19. září 2017 1 / 33 Úvod Vztah mezi molekulovou strukturou a makroskopickými vlastnostmi
Od kvantové mechaniky k chemii Jan Řezáč UOCHB AV ČR 19. září 2017 Jan Řezáč (UOCHB AV ČR) Od kvantové mechaniky k chemii 19. září 2017 1 / 33 Úvod Vztah mezi molekulovou strukturou a makroskopickými vlastnostmi
Fyzika atomového jádra
 Fyzika atomového jádra (NJSF064) František Knapp http://www-ucjf.troja.mff.cuni.cz/~knapp/jf/ frantisek.knapp@mff.cuni.cz Slupkový model jádra evidence magických čísel: hmoty, separační energie, vazbové
Fyzika atomového jádra (NJSF064) František Knapp http://www-ucjf.troja.mff.cuni.cz/~knapp/jf/ frantisek.knapp@mff.cuni.cz Slupkový model jádra evidence magických čísel: hmoty, separační energie, vazbové
ATOM VODÍKU MODEL : STOJÍCÍ BODOVÉ JÁDRO A ELEKTRON VZÁJEMNĚ ELEKTROSTATICKY INTERAGUJÍCÍ SCHRÖDINGEROVA ROVNICE PRO PŘÍPAD POTENCIÁLNÍ ENERGIE.
 ATOMY + MOLEKULY ATOM VODÍKU MODEL : STOJÍCÍ BODOVÉ JÁDRO A ELEKTRON VZÁJEMNĚ ELEKTROSTATICKY INTERAGUJÍCÍ SCHRÖDINGEROVA ROVNICE H ˆψ = Eψ PRO PŘÍPAD POTENCIÁLNÍ ENERGIE Vˆ = Ze 2 4πε o r ŘEŠENÍ HLEDÁME
ATOMY + MOLEKULY ATOM VODÍKU MODEL : STOJÍCÍ BODOVÉ JÁDRO A ELEKTRON VZÁJEMNĚ ELEKTROSTATICKY INTERAGUJÍCÍ SCHRÖDINGEROVA ROVNICE H ˆψ = Eψ PRO PŘÍPAD POTENCIÁLNÍ ENERGIE Vˆ = Ze 2 4πε o r ŘEŠENÍ HLEDÁME
Orbitaly, VSEPR 1 / 18
 rbitaly, VSEPR Rezonanční struktury, atomové a molekulové orbitaly, hybridizace, určování tvaru molekuly pomocí teorie VSEPR, úvod do symetrie molekul, dipólový moment 1 / 18 Formální náboj Rozdíl mezi
rbitaly, VSEPR Rezonanční struktury, atomové a molekulové orbitaly, hybridizace, určování tvaru molekuly pomocí teorie VSEPR, úvod do symetrie molekul, dipólový moment 1 / 18 Formální náboj Rozdíl mezi
16 Semiempirické přístupy
 16 Semiempirické přístupy V této kapitole se podíváme na skupinu semiempirických metod. Ačkoli semiempirické metody také vycházejí z řešení elektronové Schrödingerovy rovnice, jejich rovnice obsahují dodatečné
16 Semiempirické přístupy V této kapitole se podíváme na skupinu semiempirických metod. Ačkoli semiempirické metody také vycházejí z řešení elektronové Schrödingerovy rovnice, jejich rovnice obsahují dodatečné
Orbitaly, VSEPR. Zdeněk Moravec, 16. listopadu / 21
 rbitaly, VSEPR Rezonanční struktury, atomové a molekulové orbitaly, hybridizace, určování tvaru molekuly pomocí teorie VSEPR, úvod do symetrie molekul, dipólový moment Zdeněk Moravec, http://z-moravec.net
rbitaly, VSEPR Rezonanční struktury, atomové a molekulové orbitaly, hybridizace, určování tvaru molekuly pomocí teorie VSEPR, úvod do symetrie molekul, dipólový moment Zdeněk Moravec, http://z-moravec.net
John Dalton Amadeo Avogadro
 Spojením atomů vznikají molekuly... John Dalton 1766 1844 Amadeo Avogadro 1776 1856 Výpočet molekuly 2, metoda valenční vazby Walter eitler 1904 1981 Fritz W. London 1900 1954 Teorie molekulových orbitalů
Spojením atomů vznikají molekuly... John Dalton 1766 1844 Amadeo Avogadro 1776 1856 Výpočet molekuly 2, metoda valenční vazby Walter eitler 1904 1981 Fritz W. London 1900 1954 Teorie molekulových orbitalů
Hartre-Fock method (HF)
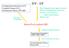 Cofgurato Iteracto (CI) Coupled Clusters (CC) Perturbato Theory (PT, MP) Electro correlato H Ψ = EΨ Bor-Oppehemer approxmato Model of depedet electros Product wave fucto (Slater determat) MO LCAO Hartre-Fock
Cofgurato Iteracto (CI) Coupled Clusters (CC) Perturbato Theory (PT, MP) Electro correlato H Ψ = EΨ Bor-Oppehemer approxmato Model of depedet electros Product wave fucto (Slater determat) MO LCAO Hartre-Fock
13 Elektronová struktura molekul
 13 Elektronová struktura molekul Ústředním úkolem kvantové chemie po zavedení Bornovy-Oppenheimerovy aproximace je výpočet elektronové energie molekul Ĥ e ψ e ( r, R) = E e ( R)ψ e ( r, R), (13.1) kde
13 Elektronová struktura molekul Ústředním úkolem kvantové chemie po zavedení Bornovy-Oppenheimerovy aproximace je výpočet elektronové energie molekul Ĥ e ψ e ( r, R) = E e ( R)ψ e ( r, R), (13.1) kde
Teoretická chemie 1. cvičení
 Teoretická chemie 1. cvičení Teoretická část Základní úlohou kvantové chemie je nalézt elektronovou vlnovou funkci zkoumané molekuly Ψ a z ní poté odvodit všechny zajímavé vlastnosti této molekuly, např.
Teoretická chemie 1. cvičení Teoretická část Základní úlohou kvantové chemie je nalézt elektronovou vlnovou funkci zkoumané molekuly Ψ a z ní poté odvodit všechny zajímavé vlastnosti této molekuly, např.
Hartreeho-Fockova metoda (HF)
 Staonární Shrödngerova rovne H Ψ = EΨ Metoda konfgurační nterake Metoda vázanýh klastrů Poruhová teore Zahrnutí el. korelae Bornova-Oppenhemerova aproxmae Model nezávslýh elektronů Vlnová funke ve tvaru
Staonární Shrödngerova rovne H Ψ = EΨ Metoda konfgurační nterake Metoda vázanýh klastrů Poruhová teore Zahrnutí el. korelae Bornova-Oppenhemerova aproxmae Model nezávslýh elektronů Vlnová funke ve tvaru
Molekuly. Všeobecně známý fakt: atomy se slučujou do molekul, pokud to zrovna nejsou atomy inertních plynů v posledním sloupci periodické tabulky
 Molekuly Všeobecně známý fakt: atomy se slučujou do molekul, pokud to zrovna nejsou atomy inertních plynů v posledním sloupci periodické tabulky Nejjednodušší případ: molekulární iont H +, tj. dva protony
Molekuly Všeobecně známý fakt: atomy se slučujou do molekul, pokud to zrovna nejsou atomy inertních plynů v posledním sloupci periodické tabulky Nejjednodušší případ: molekulární iont H +, tj. dva protony
Hamiltonián popisující atom vodíku ve vnějším magnetickém poli:
 Orbitální a spinový magnetický moment a jejich interakce s vnějším polem Vše na příkladu atomu H: Elektron (e - ) a jádro (u atomu H pouze p + ) mají vlastní magnetický moment (= spin). Tyto dva dipóly
Orbitální a spinový magnetický moment a jejich interakce s vnějším polem Vše na příkladu atomu H: Elektron (e - ) a jádro (u atomu H pouze p + ) mají vlastní magnetický moment (= spin). Tyto dva dipóly
Chemická vazba. John Dalton Amadeo Avogadro
 Chemická vazba John Dalton 1766-1844 Amadeo Avogadro 1776-1856 Výpočet molekuly 2, metoda valenční vazby Walter eitler 1904-1981 Fritz W. London 1900-1954 Teorie molekulových orbitalů Friedrich und 1896-1997
Chemická vazba John Dalton 1766-1844 Amadeo Avogadro 1776-1856 Výpočet molekuly 2, metoda valenční vazby Walter eitler 1904-1981 Fritz W. London 1900-1954 Teorie molekulových orbitalů Friedrich und 1896-1997
Born-Oppenheimerova aproximace
 Born-Oppenheimerova aproximace Oddělení elektronického a jaderného pohybu Jádra 2000 x těžší než elektrony elektrony kvantová chemie, popis systému (do 100 atomů) na základě vlastností elektronů (jádra
Born-Oppenheimerova aproximace Oddělení elektronického a jaderného pohybu Jádra 2000 x těžší než elektrony elektrony kvantová chemie, popis systému (do 100 atomů) na základě vlastností elektronů (jádra
Teorie Molekulových Orbitalů (MO)
 Teorie Molekulových Orbitalů (MO) Kombinace atomových orbitalů na všech atomech v molekule Vhodná symetrie Vhodná (podobná) energie Z n AO vytvoříme n MO Pro začátek dvouatomové molekuly: H 2, F 2, CO,...
Teorie Molekulových Orbitalů (MO) Kombinace atomových orbitalů na všech atomech v molekule Vhodná symetrie Vhodná (podobná) energie Z n AO vytvoříme n MO Pro začátek dvouatomové molekuly: H 2, F 2, CO,...
10 Více-elektronové atomy
 1 Více-elektronové atomy Atom vodíku je asi nejsložitější soustava, kterou jsme schopni analyticky přesně vyřešit. Tato situace je pro chemika pochopitelně málo uspokojivá. Pomocí kvantové teorie bychom
1 Více-elektronové atomy Atom vodíku je asi nejsložitější soustava, kterou jsme schopni analyticky přesně vyřešit. Tato situace je pro chemika pochopitelně málo uspokojivá. Pomocí kvantové teorie bychom
Fyzika IV. -ezv -e(z-zv) kov: valenční elektrony vodivostní elektrony. Elektronová struktura pevných látek model volných elektronů
 Elektronová struktura pevných látek model volných elektronů 1897: J.J. Thomson - elektron jako částice 1900: P. Drude: kinetická teorie plynů - kov jako plyn elektronů Drudeho model elektrony se mezi srážkami
Elektronová struktura pevných látek model volných elektronů 1897: J.J. Thomson - elektron jako částice 1900: P. Drude: kinetická teorie plynů - kov jako plyn elektronů Drudeho model elektrony se mezi srážkami
Využití hybridní metody vícekriteriálního rozhodování za nejistoty. Michal Koláček, Markéta Matulová
 Využití hybridní metody vícekriteriálního rozhodování za nejistoty Michal Koláček, Markéta Matulová Outline Multiple criteria decision making Classification of MCDM methods TOPSIS method Fuzzy extension
Využití hybridní metody vícekriteriálního rozhodování za nejistoty Michal Koláček, Markéta Matulová Outline Multiple criteria decision making Classification of MCDM methods TOPSIS method Fuzzy extension
Teorie hybridizace. Vysvětluje vznik energeticky rovnocenných kovalentních vazeb a umožňuje předpovědět prostorový tvar molekul.
 Chemická vazba co je chemická vazba charakteristiky chemické vazby jak vzniká vazba znázornění chemické vazby kovalentní a koordinační vazba vazba σ a π jednoduchá, dvojná a trojná vazba polarita vazby
Chemická vazba co je chemická vazba charakteristiky chemické vazby jak vzniká vazba znázornění chemické vazby kovalentní a koordinační vazba vazba σ a π jednoduchá, dvojná a trojná vazba polarita vazby
VÝPOČETNÍ CHEMIE V ANALÝZE STRUKTURY
 VÝPOČETNÍ CHEMIE V ANALÝZE STRUKTURY A VLASTNOSTÍ MOLEKUL Michal Čajan Katedra anorganické chemie PřF UP v Olomouci MOLEKULOVÉ MODELOVÁNÍ V CHEMII MOLEKULOVÉ MODELOVÁNÍ aplikace zobrazení a analýza strukturních
VÝPOČETNÍ CHEMIE V ANALÝZE STRUKTURY A VLASTNOSTÍ MOLEKUL Michal Čajan Katedra anorganické chemie PřF UP v Olomouci MOLEKULOVÉ MODELOVÁNÍ V CHEMII MOLEKULOVÉ MODELOVÁNÍ aplikace zobrazení a analýza strukturních
VÍTEJTE V MIKROSVĚTĚ
 VÍTEJTE V MIKROSVĚTĚ Klasická vs. Moderní fyzika Klasická fyzika fyzika obyčejných věcí viditelných pouhým okem Moderní fyzika Relativita zabývá se tím co se pohybuje rychle nebo v silovém gravitačním
VÍTEJTE V MIKROSVĚTĚ Klasická vs. Moderní fyzika Klasická fyzika fyzika obyčejných věcí viditelných pouhým okem Moderní fyzika Relativita zabývá se tím co se pohybuje rychle nebo v silovém gravitačním
17 Vlastnosti molekul
 17 Vlastnosti molekul Experimentálně molekuly charakterizujeme pomocí nejrůznějších vlastností: můžeme změřit třeba NMR posuny, elektrické či magnetické parametry či třeba jejich optickou otáčivost. Tyto
17 Vlastnosti molekul Experimentálně molekuly charakterizujeme pomocí nejrůznějších vlastností: můžeme změřit třeba NMR posuny, elektrické či magnetické parametry či třeba jejich optickou otáčivost. Tyto
ĤΨ=EΨ. aproximace pro vlnovou funkci Ψ atomové orbitaly molekulové orbitaly mnoho-elektronové molekuly
 Chemická struktura Hartreeho-Fockova metoda základní metoda kvantové chemie, řešení Schrödingerovy rovnice Atomové a molekulové orbitaly, báze AO Hückelova metoda ĤΨ=EΨ aproximace pro Hamiltonián Ĥ repulze
Chemická struktura Hartreeho-Fockova metoda základní metoda kvantové chemie, řešení Schrödingerovy rovnice Atomové a molekulové orbitaly, báze AO Hückelova metoda ĤΨ=EΨ aproximace pro Hamiltonián Ĥ repulze
Nekovalentní interakce
 Nekovalentní interakce Jan Řezáč UOCHB AV ČR 3. listopadu 2016 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 3. listopadu 2016 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii
Nekovalentní interakce Jan Řezáč UOCHB AV ČR 3. listopadu 2016 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 3. listopadu 2016 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii
Nekovalentní interakce
 Nekovalentní interakce Jan Řezáč UOCHB AV ČR 31. října 2017 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 31. října 2017 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii 4 Výpočty
Nekovalentní interakce Jan Řezáč UOCHB AV ČR 31. října 2017 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 31. října 2017 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii 4 Výpočty
Fyzika atomového jádra (FAJ) Petr Veselý Ústav Jaderné fyziky, Česká Akademie Věd www-ucjf.troja.mff.cuni.cz/~vesely/faj/faj.pdf
 Fyzika atomového jádra (FAJ) Petr Veselý Ústav Jaderné fyziky, Česká Akademie Věd www-ucjf.troja.mff.cuni.cz/~vesely/faj/faj.pdf Letní semestr 2017 Motivace Studium jaderné struktury: - široká škála systémů
Fyzika atomového jádra (FAJ) Petr Veselý Ústav Jaderné fyziky, Česká Akademie Věd www-ucjf.troja.mff.cuni.cz/~vesely/faj/faj.pdf Letní semestr 2017 Motivace Studium jaderné struktury: - široká škála systémů
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/
 Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Předmět: LRR/CHPB1/Chemie pro biology 1 Elektronový obal Mgr. Karel Doležal Dr. Cíl přednášky: seznámit posluchače se stavbou
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Předmět: LRR/CHPB1/Chemie pro biology 1 Elektronový obal Mgr. Karel Doležal Dr. Cíl přednášky: seznámit posluchače se stavbou
Inovace studia molekulární a buněčné biologie
 Investice do rozvoje vzdělávání Inovace studia molekulární a buněčné biologie Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Investice do rozvoje vzdělávání
Investice do rozvoje vzdělávání Inovace studia molekulární a buněčné biologie Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Investice do rozvoje vzdělávání
Teoretická chemie 3. cvičení
 Teoretická chemie 3. cvičení Teoretická část K popisu částic nepoužívá kvantová mechanika klasické veličiny fázového prostoru (tj. polohu a hybnost), ale pracuje s tzv. vlnovou funkcí, která může být podle
Teoretická chemie 3. cvičení Teoretická část K popisu částic nepoužívá kvantová mechanika klasické veličiny fázového prostoru (tj. polohu a hybnost), ale pracuje s tzv. vlnovou funkcí, která může být podle
Electron Density. One-el. Functions. Traditional Ab initio. Model of independent electrons. Electron correlation neglected
 CCSD(T) Stationary Schrödingr quation H Ψ = EΨ MP Elctron corrlation Expansion ovr Slatr dt. Φ= C0Ψ 0 + CSΨ S + CDΨ D + Non-rlativistic Hamiltonian Born-Oppnhimr approximaion occ Elctron Dnsity ρ( r) ϕ
CCSD(T) Stationary Schrödingr quation H Ψ = EΨ MP Elctron corrlation Expansion ovr Slatr dt. Φ= C0Ψ 0 + CSΨ S + CDΨ D + Non-rlativistic Hamiltonian Born-Oppnhimr approximaion occ Elctron Dnsity ρ( r) ϕ
jádro a elektronový obal jádro nukleony obal elektrony, pro chemii významné valenční elektrony
 atom jádro a elektronový obal jádro nukleony obal elektrony, pro chemii významné valenční elektrony molekula Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti seskupení alespoň dvou atomů
atom jádro a elektronový obal jádro nukleony obal elektrony, pro chemii významné valenční elektrony molekula Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti seskupení alespoň dvou atomů
Kvantová teorie atomů
 Kvantová teorie atomů Kdo otevřel Pandořinu skříňku? l při studiu záření abs. černého tělesa (hvězda) použil Max von Planck (1900, NP 1918) předpoklad, že oscilátor má diskrétní spektrum, s velikostí kvanta
Kvantová teorie atomů Kdo otevřel Pandořinu skříňku? l při studiu záření abs. černého tělesa (hvězda) použil Max von Planck (1900, NP 1918) předpoklad, že oscilátor má diskrétní spektrum, s velikostí kvanta
Přednáška IX: Elektronová spektroskopie II.
 Přednáška IX: Elektronová spektroskopie II. 1 Försterův resonanční přenos energie Pravděpodobnost (rychlost) přenosu je určená jako: k ret 1 = τ 0 D R r 0 6 0 τ D R 0 r Doba života donoru v excitovaném
Přednáška IX: Elektronová spektroskopie II. 1 Försterův resonanční přenos energie Pravděpodobnost (rychlost) přenosu je určená jako: k ret 1 = τ 0 D R r 0 6 0 τ D R 0 r Doba života donoru v excitovaném
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/
 Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Předmět: LRR/CHPB1/Chemie pro biology 1 Chemická vazba II Mgr. Karel Doležal Dr. Cíl přednášky: seznámit posluchače s principem
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Předmět: LRR/CHPB1/Chemie pro biology 1 Chemická vazba II Mgr. Karel Doležal Dr. Cíl přednášky: seznámit posluchače s principem
Molekuly 1 12/4/2011. Molekula definice IUPAC. Molekuly. Proč existují molekuly? Kosselův model. Představy o molekulách
 1/4/011 Molekuly 1 Molekula definice IUPC elektricky neutrální entita sestávající z více nežli jednoho atomu. Přesně, molekula, v níž je počet atomů větší nežli jedna, musí odpovídat snížení na ploše potenciální
1/4/011 Molekuly 1 Molekula definice IUPC elektricky neutrální entita sestávající z více nežli jednoho atomu. Přesně, molekula, v níž je počet atomů větší nežli jedna, musí odpovídat snížení na ploše potenciální
Elektronový obal atomu
 Elektronový obal atomu Vlnění o frekvenci v se může chovat jako proud částic (kvant - fotonů) o energii E = h.v Částice pohybující se s hybností p se může chovat jako vlna o vlnové délce λ = h/p Kde h
Elektronový obal atomu Vlnění o frekvenci v se může chovat jako proud částic (kvant - fotonů) o energii E = h.v Částice pohybující se s hybností p se může chovat jako vlna o vlnové délce λ = h/p Kde h
Transportation Problem
 Transportation Problem ١ C H A P T E R 7 Transportation Problem The transportation problem seeks to minimize the total shipping costs of transporting goods from m origins (each with a supply s i ) to n
Transportation Problem ١ C H A P T E R 7 Transportation Problem The transportation problem seeks to minimize the total shipping costs of transporting goods from m origins (each with a supply s i ) to n
Aplikace matematiky. Dana Lauerová A note to the theory of periodic solutions of a parabolic equation
 Aplikace matematiky Dana Lauerová A note to the theory of periodic solutions of a parabolic equation Aplikace matematiky, Vol. 25 (1980), No. 6, 457--460 Persistent URL: http://dml.cz/dmlcz/103885 Terms
Aplikace matematiky Dana Lauerová A note to the theory of periodic solutions of a parabolic equation Aplikace matematiky, Vol. 25 (1980), No. 6, 457--460 Persistent URL: http://dml.cz/dmlcz/103885 Terms
Laserová technika prosince Katedra fyzikální elektroniky.
 Laserová technika 1 Aktivní prostředí Šíření rezonančního záření dvouhladinovým prostředím Jan Šulc Katedra fyzikální elektroniky České vysoké učení technické jan.sulc@fjfi.cvut.cz 22. prosince 2016 Program
Laserová technika 1 Aktivní prostředí Šíření rezonančního záření dvouhladinovým prostředím Jan Šulc Katedra fyzikální elektroniky České vysoké učení technické jan.sulc@fjfi.cvut.cz 22. prosince 2016 Program
Látkové množství. 6,022 10 23 atomů C. Přípravný kurz Chemie 07. n = N. Doporučená literatura. Látkové množství n. Avogadrova konstanta N A
 Doporučená literatura Přípravný kurz Chemie 2006/07 07 RNDr. Josef Tomandl, Ph.D. Mailto: tomandl@med.muni.cz Předmět: Přípravný kurz chemie J. Vacík a kol.: Přehled středoškolské chemie. SPN, Praha 1990,
Doporučená literatura Přípravný kurz Chemie 2006/07 07 RNDr. Josef Tomandl, Ph.D. Mailto: tomandl@med.muni.cz Předmět: Přípravný kurz chemie J. Vacík a kol.: Přehled středoškolské chemie. SPN, Praha 1990,
Fyzika IV. g( ) Vibrace jader atomů v krystalové mříži
 Vibrace jader atomů v krystalové mříži v krystalu máme N základních buněk, v každé buňce s atomů, které kmitají kolem rovnovážných poloh výchylky kmitů jsou malé (Taylorův rozvoj): harmonická aproximace
Vibrace jader atomů v krystalové mříži v krystalu máme N základních buněk, v každé buňce s atomů, které kmitají kolem rovnovážných poloh výchylky kmitů jsou malé (Taylorův rozvoj): harmonická aproximace
Emise vyvolaná působením fotonů nebo částic
 Emise vyvolaná působením fotonů nebo částic PES (fotoelektronová spektroskopie) XPS (rentgenová fotoelektronová spektroskopie), ESCA (elektronová spektroskopie pro chemickou analýzu) UPS (ultrafialová
Emise vyvolaná působením fotonů nebo částic PES (fotoelektronová spektroskopie) XPS (rentgenová fotoelektronová spektroskopie), ESCA (elektronová spektroskopie pro chemickou analýzu) UPS (ultrafialová
Univerzita Karlova v Praze Matematicko-fyzikální fakulta
 Univerzita Karlova v Praze Matematicko-fyzikální fakulta Diplomová práce Ladislav Benda Výpočetní studium struktury a vlastností klastrů ethanolu Katedra fyziky nízkých teplot Vedoucí diplomové práce:
Univerzita Karlova v Praze Matematicko-fyzikální fakulta Diplomová práce Ladislav Benda Výpočetní studium struktury a vlastností klastrů ethanolu Katedra fyziky nízkých teplot Vedoucí diplomové práce:
ATOMOVÉ JÁDRO. Nucleus Složení: Proton. Neutron 1 0 n částice bez náboje Proton + neutron = NUKLEON PROTONOVÉ číslo: celkový počet nukleonů v jádře
 ATOM 1 ATOM Hmotná částice Dělit lze: Fyzikálně ANO Chemicky Je z nich složena každá látka Složení: Atomové jádro (protony, neutrony) Elektronový obal (elektrony) NE Elektroneutrální částice: počet protonů
ATOM 1 ATOM Hmotná částice Dělit lze: Fyzikálně ANO Chemicky Je z nich složena každá látka Složení: Atomové jádro (protony, neutrony) Elektronový obal (elektrony) NE Elektroneutrální částice: počet protonů
Execrices. Mathematics FRDIS
 Eecrices Mathematics FRDIS Vytvořeno s podporou projektu Průřezová inovace studijních programů Lesnické a dřevařské fakulty MENDELU v Brně (LDF) s ohledem na disciplíny společného základu http://akademie.
Eecrices Mathematics FRDIS Vytvořeno s podporou projektu Průřezová inovace studijních programů Lesnické a dřevařské fakulty MENDELU v Brně (LDF) s ohledem na disciplíny společného základu http://akademie.
Configuration vs. Conformation. Configuration: Covalent bonds must be broken. Two kinds of isomers to consider
 Stereochemistry onfiguration vs. onformation onfiguration: ovalent bonds must be broken onformation: hanges do NT require breaking of covalent bonds onfiguration Two kinds of isomers to consider is/trans:
Stereochemistry onfiguration vs. onformation onfiguration: ovalent bonds must be broken onformation: hanges do NT require breaking of covalent bonds onfiguration Two kinds of isomers to consider is/trans:
Periodická soustava prvků
 Periodická soustava prvků 1829 Döbereiner Triády: Li, Na, K; Ca, Sr, Ba; S, Se, Te; Cl, Br, I; 1870 Meyer - atomové objemy 1869, 1871 Mendelejev předpověď vlastností chybějících prvků (Sc, Ga, Ge, Tc,
Periodická soustava prvků 1829 Döbereiner Triády: Li, Na, K; Ca, Sr, Ba; S, Se, Te; Cl, Br, I; 1870 Meyer - atomové objemy 1869, 1871 Mendelejev předpověď vlastností chybějících prvků (Sc, Ga, Ge, Tc,
Atomové jádro, elektronový obal
 Atomové jádro, elektronový obal 1 / 9 Atomové jádro Atomové jádro je tvořeno protony a neutrony Prvek je látka skládající se z atomů se stejným počtem protonů Nuklid je systém tvořený prvky se stejným
Atomové jádro, elektronový obal 1 / 9 Atomové jádro Atomové jádro je tvořeno protony a neutrony Prvek je látka skládající se z atomů se stejným počtem protonů Nuklid je systém tvořený prvky se stejným
Orbitaly ve víceelektronových atomech
 Orbitaly ve víceelektronových atomech Elektrony jsou přitahovány k jádru ale také se navzájem odpuzují. Repulzní síly způsobené dalšími elektrony stíní přitažlivý účinek atomového jádra. Efektivní náboj
Orbitaly ve víceelektronových atomech Elektrony jsou přitahovány k jádru ale také se navzájem odpuzují. Repulzní síly způsobené dalšími elektrony stíní přitažlivý účinek atomového jádra. Efektivní náboj
ATOMOVÁ SPEKTROMETRIE
 ATOMOVÁ SPEKTROMETRIE Atomová spektrometrie valenčních e - 1. OES (AES). AAS 3. AFS 1 Atomová spektra čárová spektra Tok záření P - množství zářivé energie (Q E ) přenesené od zdroje za jednotku času.
ATOMOVÁ SPEKTROMETRIE Atomová spektrometrie valenčních e - 1. OES (AES). AAS 3. AFS 1 Atomová spektra čárová spektra Tok záření P - množství zářivé energie (Q E ) přenesené od zdroje za jednotku času.
Elektronový obal atomu
 Elektronový obal atomu Chemické vlastnosti atomů (a molekul) jsou určeny vlastnostmi elektronového obalu. Chceme znát energii a prostorové rozložení elektronů Znalosti o elektronovém obalu byly získány
Elektronový obal atomu Chemické vlastnosti atomů (a molekul) jsou určeny vlastnostmi elektronového obalu. Chceme znát energii a prostorové rozložení elektronů Znalosti o elektronovém obalu byly získány
Kvantové provázání. Pavel Cejnar ÚČJF MFF UK Praha
 Kvantové provázání Pavel Cejnar ÚČJF MFF UK Praha Seminář PřF UK Praha, listopad 2018 Kvantové provázání monopartitní tripartitní multipartitní Kanazawa, Japonsko bipartitní Zápasníci, Uffizi muzeum, Florencie
Kvantové provázání Pavel Cejnar ÚČJF MFF UK Praha Seminář PřF UK Praha, listopad 2018 Kvantové provázání monopartitní tripartitní multipartitní Kanazawa, Japonsko bipartitní Zápasníci, Uffizi muzeum, Florencie
WORKSHEET 1: LINEAR EQUATION 1
 WORKSHEET 1: LINEAR EQUATION 1 1. Write down the arithmetical problem according the dictation: 2. Translate the English words, you can use a dictionary: equations to solve solve inverse operation variable
WORKSHEET 1: LINEAR EQUATION 1 1. Write down the arithmetical problem according the dictation: 2. Translate the English words, you can use a dictionary: equations to solve solve inverse operation variable
1 1 3 ; = [ 1;2]
![1 1 3 ; = [ 1;2] 1 1 3 ; = [ 1;2]](/thumbs/96/127559812.jpg) Soustavy lineárních rovnic - Příklady k procvičení ) + y= y= [ ; ] ) + y= = ) y= y 0 y ; + = [ ;] ) y= + y= [ ;] ) + y= = ; ) y= = y ) y = y= 8) y= + y= 9) = 8 y 0) y=, y= ) a+ = a b ) = y 9 ) u ( ) v
Soustavy lineárních rovnic - Příklady k procvičení ) + y= y= [ ; ] ) + y= = ) y= y 0 y ; + = [ ;] ) y= + y= [ ;] ) + y= = ; ) y= = y ) y = y= 8) y= + y= 9) = 8 y 0) y=, y= ) a+ = a b ) = y 9 ) u ( ) v
Gymnázium, Brno, Slovanské nám. 7 WORKBOOK. Mathematics. Teacher: Student:
 WORKBOOK Subject: Teacher: Student: Mathematics.... School year:../ Conic section The conic sections are the nondegenerate curves generated by the intersections of a plane with one or two nappes of a cone.
WORKBOOK Subject: Teacher: Student: Mathematics.... School year:../ Conic section The conic sections are the nondegenerate curves generated by the intersections of a plane with one or two nappes of a cone.
Studium enzymatické reakce metodami výpočetní chemie
 Studium enzymatické reakce metodami výpočetní chemie 2. kolo Petr Kulhánek, Zora Střelcová kulhanek@chemi.muni.cz CEITEC - Středoevropský technologický institut Masarykova univerzita, Kamenice 5, 625 00
Studium enzymatické reakce metodami výpočetní chemie 2. kolo Petr Kulhánek, Zora Střelcová kulhanek@chemi.muni.cz CEITEC - Středoevropský technologický institut Masarykova univerzita, Kamenice 5, 625 00
Fyzika IV. Pojem prvku. alchymie. Paracelsus (16.st) Elektronová struktura atomů
 Elektronová struktura atomů Pojem prvku alchymie Paracelsus (16.st) Elektronová struktura atomů alchymie 17.-18.století - při hoření látky ztrácí těkavou součást - flogiston. látka = flogiston + popel
Elektronová struktura atomů Pojem prvku alchymie Paracelsus (16.st) Elektronová struktura atomů alchymie 17.-18.století - při hoření látky ztrácí těkavou součást - flogiston. látka = flogiston + popel
4 Přenos energie ve FS
 4 Přenos energie ve FS Petr Ilík KF a CH, PřF UP Přenos energie (excitace) do C - 1-1 molekula chl je i při vysoké ozářenosti excitována max. 10x za sekundu neefektivní pro C - nténní systém s mnoha pigmenty
4 Přenos energie ve FS Petr Ilík KF a CH, PřF UP Přenos energie (excitace) do C - 1-1 molekula chl je i při vysoké ozářenosti excitována max. 10x za sekundu neefektivní pro C - nténní systém s mnoha pigmenty
Oddělení pohybu elektronů a jader
 Oddělení pohybu elektronů a ader Adiabatická aproximace Born-Oppenheimerova aproximace Důležité vztahy sou 4, 5, 7, 0,,, udělal sem to zbytečně podrobně, e to samostatný okruh Separace translačního pohybu:
Oddělení pohybu elektronů a ader Adiabatická aproximace Born-Oppenheimerova aproximace Důležité vztahy sou 4, 5, 7, 0,,, udělal sem to zbytečně podrobně, e to samostatný okruh Separace translačního pohybu:
Korelační energie. Celkovou elektronovou energii molekuly lze experimentálně určit ze vztahu. E vib. = E at. = 39,856, E d
 Korelační energe Referenční stavy Energ molekul a atomů lze vyjádřt vzhledem k různým referenčním stavům. V kvantové mechance za referenční stav s nulovou energí bereme stav odpovídající nenteragujícím
Korelační energe Referenční stavy Energ molekul a atomů lze vyjádřt vzhledem k různým referenčním stavům. V kvantové mechance za referenční stav s nulovou energí bereme stav odpovídající nenteragujícím
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Periodická soustava prvků Chemické prvky V současné době známe 104 chemických prvků. Většina z nich se vyskytuje v přírodě. Jen malá část byla
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Periodická soustava prvků Chemické prvky V současné době známe 104 chemických prvků. Většina z nich se vyskytuje v přírodě. Jen malá část byla
2. Elektrotechnické materiály
 . Elektrotechnické materiály Předpokladem vhodného využití elektrotechnických materiálů v konstrukci elektrotechnických součástek a zařízení je znalost jejich vlastností. Elektrické vlastnosti materiálů
. Elektrotechnické materiály Předpokladem vhodného využití elektrotechnických materiálů v konstrukci elektrotechnických součástek a zařízení je znalost jejich vlastností. Elektrické vlastnosti materiálů
2. Atomové jádro a jeho stabilita
 2. Atomové jádro a jeho stabilita Atom je nejmenší hmotnou a chemicky nedělitelnou částicí. Je tvořen jádrem, které obsahuje protony a neutrony, a elektronovým obalem. Elementární částice proton neutron
2. Atomové jádro a jeho stabilita Atom je nejmenší hmotnou a chemicky nedělitelnou částicí. Je tvořen jádrem, které obsahuje protony a neutrony, a elektronovým obalem. Elementární částice proton neutron
LOGBOOK. Blahopřejeme, našli jste to! Nezapomeňte. Prosím vyvarujte se downtrade
 název cache GC kód Blahopřejeme, našli jste to! LOGBOOK Prosím vyvarujte se downtrade Downtrade (z GeoWiki) Je to jednání, kterého byste se při výměnách předmětů v keších měli vyvarovat! Jedná se o snížení
název cache GC kód Blahopřejeme, našli jste to! LOGBOOK Prosím vyvarujte se downtrade Downtrade (z GeoWiki) Je to jednání, kterého byste se při výměnách předmětů v keších měli vyvarovat! Jedná se o snížení
Kvantová mechanika - model téměř volných elektronů. model těsné vazby
 Kvantová mechanika - model téměř volných elektronů model těsné vazby Částice (elektron) v periodickém potenciálu- Blochův teorém Dále už nebudeme považovat elektron za zcela volný (Sommerfeld), ale připustíme
Kvantová mechanika - model téměř volných elektronů model těsné vazby Částice (elektron) v periodickém potenciálu- Blochův teorém Dále už nebudeme považovat elektron za zcela volný (Sommerfeld), ale připustíme
Inovace studia molekulární a buněčné biologie
 Investice do rozvoje vzdělávání Inovace studia molekulární a buněčné biologie Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Investice do rozvoje vzdělávání
Investice do rozvoje vzdělávání Inovace studia molekulární a buněčné biologie Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Investice do rozvoje vzdělávání
Diskutujte, jak široký bude pás spojený s fosforescencí versus fluorescencí. Udělejte odhad v cm -1.
 S použitím modelu volného elektronu (=částice v krabici) spočtěte vlnovou délku a vlnočet nejdlouhovlnějšího elektronového přechodu u molekuly dekapentaenu a oktatetraenu. Diskutujte polohu absorpčního
S použitím modelu volného elektronu (=částice v krabici) spočtěte vlnovou délku a vlnočet nejdlouhovlnějšího elektronového přechodu u molekuly dekapentaenu a oktatetraenu. Diskutujte polohu absorpčního
Opakování: shrnutí základních poznatků o struktuře atomu
 11. Polovodiče Polovodiče jsou krystalické nebo amorfní látky, jejichž elektrická vodivost leží mezi elektrickou vodivostí kovů a izolantů a závisí na teplotě nebo dopadajícím optickém záření. Elektrické
11. Polovodiče Polovodiče jsou krystalické nebo amorfní látky, jejichž elektrická vodivost leží mezi elektrickou vodivostí kovů a izolantů a závisí na teplotě nebo dopadajícím optickém záření. Elektrické
#(, #- #(!!$!#$%!! [2], studiu difraktivních. #!$$&$.( &$/#$$ oblasti holografie a difraktivní!# '!% #!!$#!'0!!*#!(#!! #!!! $ % *! $! (!
![#(, #- #(!!$!#$%!! [2], studiu difraktivních. #!$$&$.( &$/#$$ oblasti holografie a difraktivní!# '!% #!!$#!'0!!*#!(#!! #!!! $ % *! $! (! #(, #- #(!!$!#$%!! [2], studiu difraktivních. #!$$&$.( &$/#$$ oblasti holografie a difraktivní!# '!% #!!$#!'0!!*#!(#!! #!!! $ % *! $! (!](/thumbs/103/158526342.jpg) . Úvod!"!!!#$%!!!&'!!#$%!!!& # vlnovým!!*!!#$*$! #!!&!!!$%!# #!!$ % '!!&!&!!#$!!!$!!!$ s #!!!*! '! $ #, #- #!!$!#$%!! [], studiu difraktivních #!$$&$. &$/#$$ oblasti holografie a difraktivní!# '!% #!!$#!'0!!*#!#!!
. Úvod!"!!!#$%!!!&'!!#$%!!!& # vlnovým!!*!!#$*$! #!!&!!!$%!# #!!$ % '!!&!&!!#$!!!$!!!$ s #!!!*! '! $ #, #- #!!$!#$%!! [], studiu difraktivních #!$$&$. &$/#$$ oblasti holografie a difraktivní!# '!% #!!$#!'0!!*#!#!!
Database systems. Normal forms
 Database systems Normal forms An example of a bad model SSN Surnam OfficeNo City Street No ZIP Region President_of_ Region 1001 Novák 238 Liteň Hlavní 10 26727 Středočeský Rath 1001 Novák 238 Bystřice
Database systems Normal forms An example of a bad model SSN Surnam OfficeNo City Street No ZIP Region President_of_ Region 1001 Novák 238 Liteň Hlavní 10 26727 Středočeský Rath 1001 Novák 238 Bystřice
ATOMOVÁ SPEKTROMETRIE
 ATOMOVÁ SPEKTROMETRIE doc. Ing. David MILDE, Ph.D. tel.: 585634443 E-mail: david.milde@upol.cz (c) -017 Doporučená literatura Černohorský T., Jandera P.: Atomová spektrometrie. Univerzita Pardubice 1997.
ATOMOVÁ SPEKTROMETRIE doc. Ing. David MILDE, Ph.D. tel.: 585634443 E-mail: david.milde@upol.cz (c) -017 Doporučená literatura Černohorský T., Jandera P.: Atomová spektrometrie. Univerzita Pardubice 1997.
Lehký úvod do kvantové teorie II
 1 Lehký úvod do kvantové teorie II 5 Harmonický oscilátor Na příkladu harmonického oscilátoru, jehož klasické řešení známe z Fyziky 1, si ukážeme typické postupy při hledání vlastních hodnot operátoru
1 Lehký úvod do kvantové teorie II 5 Harmonický oscilátor Na příkladu harmonického oscilátoru, jehož klasické řešení známe z Fyziky 1, si ukážeme typické postupy při hledání vlastních hodnot operátoru
Víceatomové molekuly s jedním centrálním atomem
 Molekuly 2 Víceatomové molekuly s jedním centrálním atomem l u tříatomových molekul se uplatňuje směr vazby l dvě atomové spojnice (vazby) svírají vazebný úhel O H H Hybridizace l MO-LCAO se v empirických
Molekuly 2 Víceatomové molekuly s jedním centrálním atomem l u tříatomových molekul se uplatňuje směr vazby l dvě atomové spojnice (vazby) svírají vazebný úhel O H H Hybridizace l MO-LCAO se v empirických
Vazby v pevných látkách
 Vazby v pevných látkách Hlavní body 1. Tvorba pevných látek 2. Van der Waalsova vazba elektrostatická interakce indukovaných dipólů 3. Iontová vazba elektrostatická interakce iontů 4. Kovalentní vazba
Vazby v pevných látkách Hlavní body 1. Tvorba pevných látek 2. Van der Waalsova vazba elektrostatická interakce indukovaných dipólů 3. Iontová vazba elektrostatická interakce iontů 4. Kovalentní vazba
elektrony v pevné látce verze 1. prosince 2016
 F6122 Základy fyziky pevných látek seminář elektrony v pevné látce verze 1. prosince 2016 1 Drudeho model volných elektronů 1 1.1 Mathiessenovo pravidlo............................................... 1
F6122 Základy fyziky pevných látek seminář elektrony v pevné látce verze 1. prosince 2016 1 Drudeho model volných elektronů 1 1.1 Mathiessenovo pravidlo............................................... 1
Elektronový obal atomu
 Elektronový obal atomu Ondřej Havlíček.ročník F-Vt/SŠ Jsoucno je vždy něco, co jsme si sami zkonstruovali ve své mysli. Podstata takovýchto konstrukcí nespočívá v tom, že by byly odvozeny ze smyslových
Elektronový obal atomu Ondřej Havlíček.ročník F-Vt/SŠ Jsoucno je vždy něco, co jsme si sami zkonstruovali ve své mysli. Podstata takovýchto konstrukcí nespočívá v tom, že by byly odvozeny ze smyslových
Struktura elektronového obalu
 Projekt: Inovace oboru Mechatronik pro Zlínský kraj Registrační číslo: CZ.1.07/1.1.08/03.0009 Struktura elektronového obalu Představy o modelu atomu se vyvíjely tak, jak se zdokonalovaly možnosti vědy
Projekt: Inovace oboru Mechatronik pro Zlínský kraj Registrační číslo: CZ.1.07/1.1.08/03.0009 Struktura elektronového obalu Představy o modelu atomu se vyvíjely tak, jak se zdokonalovaly možnosti vědy
Angličtina v matematických softwarech 2 Vypracovala: Mgr. Bronislava Kreuzingerová
 Angličtina v matematických softwarech 2 Vypracovala: Mgr. Bronislava Kreuzingerová Název školy Název a číslo projektu Název modulu Obchodní akademie a Střední odborné učiliště, Veselí nad Moravou Motivace
Angličtina v matematických softwarech 2 Vypracovala: Mgr. Bronislava Kreuzingerová Název školy Název a číslo projektu Název modulu Obchodní akademie a Střední odborné učiliště, Veselí nad Moravou Motivace
Protonové číslo Z - udává počet protonů v jádře atomu, píše se jako index vlevo dole ke značce prvku
 Stavba jádra atomu Protonové Z - udává protonů v jádře atomu, píše se jako index vlevo dole ke značce prvku Neutronové N - udává neutronů v jádře atomu Nukleonové A = Z + N, udává nukleonů (protony + neutrony)
Stavba jádra atomu Protonové Z - udává protonů v jádře atomu, píše se jako index vlevo dole ke značce prvku Neutronové N - udává neutronů v jádře atomu Nukleonové A = Z + N, udává nukleonů (protony + neutrony)
Střední průmyslová škola strojnická Olomouc, tř.17. listopadu 49
 Střední průmyslová škola strojnická Olomouc, tř.17. listopadu 49 Výukový materiál zpracovaný v rámci projektu Výuka moderně Registrační číslo projektu: CZ.1.07/1.5.00/34.0205 Šablona: III/2 Anglický jazyk
Střední průmyslová škola strojnická Olomouc, tř.17. listopadu 49 Výukový materiál zpracovaný v rámci projektu Výuka moderně Registrační číslo projektu: CZ.1.07/1.5.00/34.0205 Šablona: III/2 Anglický jazyk
Nerovnovážné systémy Onsagerova hypotéza, fluktuačně disipační teorém
 Nerovnovážné systémy Onsagerova hypotéza, fluktuačně disipační teorém Omezení se na nerovnážné systémy v blízkosti rovnováhy Chování systému lze popsat v rámci linear response theory (teorie lineární odezvy)
Nerovnovážné systémy Onsagerova hypotéza, fluktuačně disipační teorém Omezení se na nerovnážné systémy v blízkosti rovnováhy Chování systému lze popsat v rámci linear response theory (teorie lineární odezvy)
Symetrie Platonovská tělesa
 Symetrie Platonovská tělesa 1 Symetrie Virus rýmy Virus obrny Virus slintavky a kulhavky 2 Symetrie molekul Jak jsou atomy v molekule uspořádány = ekvivalentní atomy 3 Prvky a operace symetrie Značk a
Symetrie Platonovská tělesa 1 Symetrie Virus rýmy Virus obrny Virus slintavky a kulhavky 2 Symetrie molekul Jak jsou atomy v molekule uspořádány = ekvivalentní atomy 3 Prvky a operace symetrie Značk a
Dynamic programming. Optimal binary search tree
 The complexity of different algorithms varies: O(n), Ω(n ), Θ(n log (n)), Dynamic programming Optimal binary search tree Různé algoritmy mají různou složitost: O(n), Ω(n ), Θ(n log (n)), The complexity
The complexity of different algorithms varies: O(n), Ω(n ), Θ(n log (n)), Dynamic programming Optimal binary search tree Různé algoritmy mají různou složitost: O(n), Ω(n ), Θ(n log (n)), The complexity
Mezimolekulové interakce
 Mezimolekulové interakce, od teorie po interakce biomolekul s grafenem Pavel Banáš Mezimolekulové interakce slabé mezimolekulové interakce fyzikální původ mezimolekulárních interakcí poruchová teorie mezimolekulárních
Mezimolekulové interakce, od teorie po interakce biomolekul s grafenem Pavel Banáš Mezimolekulové interakce slabé mezimolekulové interakce fyzikální původ mezimolekulárních interakcí poruchová teorie mezimolekulárních
Interakce fluoroforu se solventem
 18. Vliv solventu Interakce fluoroforu se solventem Fluorescenční charakteristiky fluoroforu se mohou měnit podle toho, jaké je jeho okolí změna kvantového výtěžku posun excitačního či emisního spektra
18. Vliv solventu Interakce fluoroforu se solventem Fluorescenční charakteristiky fluoroforu se mohou měnit podle toho, jaké je jeho okolí změna kvantového výtěžku posun excitačního či emisního spektra
Introduction to MS Dynamics NAV
 Introduction to MS Dynamics NAV (Item Charges) Ing.J.Skorkovský,CSc. MASARYK UNIVERSITY BRNO, Czech Republic Faculty of economics and business administration Department of corporate economy Item Charges
Introduction to MS Dynamics NAV (Item Charges) Ing.J.Skorkovský,CSc. MASARYK UNIVERSITY BRNO, Czech Republic Faculty of economics and business administration Department of corporate economy Item Charges
Lekce 4 Statistická termodynamika
 Lekce 4 Statistická termodynamika Osnova 1. Co je statistická termodynamika 2. Mikrostav, makrostav a Gibbsův soubor 3. Příklady Gibbsových souborů 4. Souborové střední hodnoty 5. Časové střední hodnoty
Lekce 4 Statistická termodynamika Osnova 1. Co je statistická termodynamika 2. Mikrostav, makrostav a Gibbsův soubor 3. Příklady Gibbsových souborů 4. Souborové střední hodnoty 5. Časové střední hodnoty
