Pokusy z organické chemie. Oxidace ethanolu. OCH pokus číslo 1. Forma provedení: ŽP, DP Časová náročnost: 5 minut
|
|
|
- Pavel Němec
- před 7 lety
- Počet zobrazení:
Transkript
1 4.2 Pokusy z organické chemie OCH pokus číslo 1 Oxidace ethanolu Forma provedení: ŽP, DP Časová náročnost: 5 minut Vysvětlivky: ŽP žákovský pokus DP demonstrační pokus Princip: KMnO4 je oxidační činidlo a ethanol je redukční činidlo. Alkoholy se díky oxidačním činidlům oxidují na kyseliny. Pomůcky: zkumavka, pipeta (5 cm3 ), držák na zkumavky, bílé pozadí Chemikálie: 1% manganistan draselný, ethanol Pracovní postup: 1) Ke 3 cm3 ethanolu ve zkumavce přikapáváme z pipety roztok manganistanu draselného (0,5 1 cm3). 2) Původně fialový roztok manganistanu draselného se odbarvuje a současně vzniká hnědočervená sraženina hydratovaného oxidu manganičitého MnO2. Obrázek: 49
2 Rovnice: H 3 C-CH 2 -OH H 3 C-CHO oxidace KMnO 4 MnO 2 redukce Otázky pro žáky: 1. Do které skupiny derivátů uhlovodíků patří ethanol? 2. Jaké má ethanol vlastnosti? 3. Na co jiného se ethanol používá? 4. Napiš mi rovnici kvašení ovoce, při němž ethanol vzniká? Bezpečnost práce: Ethanol: Požití: Je-li postižený při vědomí: Vypít asi 1/2 litru vlažné vody, slané vody nebo sodovky a drážděním hrdla vyvolat zvracení. Po zvracení podat černou kávu. Je-li vědomí výrazně porušeno: nepokoušet se o vyvolání zvracení, pečovat o průchodnost dýchacích cest (poloha s hlavou na stranu, vyjmout předměty z úst, zaklonit hlavu a tlačit dolní čelist vpřed). zasažení očí: Rychlý a důkladný výplach vodou. KMnO 4 : Požití: Vypít asi 1/2 litru vlažné vody nebo mléka i vody s rozmíchanými bílky (2 4 bílky do 1/2 litru) a snažit se o vyvolání zvracení. Nadýchání: Úplný klid na lůžku, přivolat lékaře. Zařazení do RVP: Deriváty uhlovodíků - příklady v praxi významných halogenderivátů, alkoholů. 50
3 OCH Pokus číslo 2 Důkaz jednoduchého sacharidu - glukózy Forma provedení: ŽP, DP Časová náročnost: 2 minuty Vysvětlivky: ZP žákovský pokus DP demonstrační pokus Princip: Směs ovocné šťávy, hydroxidu sodného a síranu měďnatého se zahřívá. Směs postupně mění barvu a vylučuje se oranžovo-červený oxid měďný. Pomůcky: zkumavka, odměrný válec (10 cm 3 ), držák na zkumavky, kahan Chemikálie: roztok medu nebo ovocné šťávy, 10% síran měďnatý, 20% hydroxid sodný Pracovní postup: 1) Do zkumavky ke 3 cm 3 roztoku medové nebo ovocné šťávy přidáme 1 cm 3 10% síranu měďnatého a 2 cm 3 20% hydroxidu sodného. 2) Směs protřepeme a zahříváme k varu. Při zahřívání se směs kalí a vylučuje se žlutý, oranžový, popřípadě až červený oxid měďný. 51
4 Obrázek: Otázky pro žáky: 1. Do které skupiny organických látek řadíme glukózu? 2. Jak se jmenuje chemická reakce, při které vzniká glukóza? 3. V organismu mají sacharidy nejrůznější funkce, o jaké funkce se jedná? Bezpečnost práce: CuSO 4 : Požití: Vypít asi 1/2 litru vody nebo (lépe) mléka nebo roztok K 4 [Fe(CN) 6 ] (1 kávová lžička žluté krevní soli do 1/2 litru vody). O vyvolání zvracení se pokoušet jen do 10 minut po požití. Zasažení očí: Rychlý a důkladný výplach vodou. NaOH: Požití: Ihned ústa vyplachovat vodou či mlékem, vyvolat zvracení. Poté nedávat velké množství tekutin. Zasažení očí: Rychle opláchovat vodou, alespoň 10 minut a k dalšímu výplachu použít borovou vodu. Zařazení do RVP: Přírodní látky - zdroje, vlastnosti a příklady funkcí bílkovin, tuků, sacharidů a vitaminů v lidském těle. 52
5 OCH Pokus číslo 3 Pozorování hoření hexanu, naftelenu, cyklohexanu Forma provedení: DP Časová náročnost:2 minuty Vysvětlivky: DP- demonstrační Princip: Naftalen hoří malým, skoro červeným a čadivým plamenem, zato hexan hoří velkým sytě žlutým plamenem. Cyklohexan hoří tenkým světle žlutým plamenem. Pomůcky: 3 kusy hodinových skel, 3 kusy krycích skel, špejle, zápalky, černé pozadí, nehořlavá podložka, 2 kapátka, chemická lžička Chemikálie: hexan, naftalen (šupinkový), cyklohexan Pracovní postup: PRACUJEME V DIGESTOŘI!!! 1) Na nehořlavou podložku umístíme hodinová skla, za která umístíme černé pozadí. 2) Na jedno sklo kápneme 3 5 kapek hexanu, druhé položíme asi 10 šupinek naftalenu a na třetí sklo kápneme 3 5 kapek benzenu. 3) Látky zapálíme hořící špejlí. Po chvilce pozorování zakryjeme krycím sklem. 53
6 Obrázek: Otázky pro žáky: 1. Jaký je rozdíl mezi hexanem a naftalenem z hlediska skupenských stavů? 2. Do které skupiny uhlovodíků patří hexan, benzen a naftalen? 3. Na co se používá benzen a naftalen Bezpečnost práce: Naftalen: Je zdraví škodlivá látka, karcinogenní. Musíme pracovat v digestoři Zařazení do RVP: Uhlovodíky - příklady v praxi významných alkanů, uhlovodíků s vícenásobnými vazbami a aromatických uhlovodíků. 54
7 OCH pokus číslo 4 Důkaz a vlastnosti bílkovin Forma provedení: ŽP, DP Časová náročnost: 2 minuty Vysvětlivky: DP demonstrační pokus ŽP žákovský pokus Princip: V alkalickém (zásaditém) prostředí reagují bílkovinné sloučeniny, obsahující peptidové skupiny (-CO-NH-) s měďnatými solemi za vzniku fialově, modře až červeně zbarvených sloučenin. Rovněž reagují za vzniku žlutě zbarvených sloučenin. Pomůcky : gáza, filtrační papír, filtrační nálevka, 2 kádinky (75 cm 3 ), 5 zkumavek, odměrný válec (10 cm 3 ), držák na zkumavky, kahan Chemikálie: bílek z jednoho drůbežího vejce, 0,75% roztok chloridu sodného, koncentrovaná kyselina dusičná, 40% roztok hydroxidu sodného, 10% roztok síranu měďnatého, 40% roztok formaldehydu Pracovní postup: 1) Bílek z jednoho drůbežího vejce protřepeme s desetinásobným objemem 0,75% vodného roztoku chloridu sodného a směs zfiltrujeme přes dvakrát přeloženou gázu. 2) Do série pěti zkumavek odlijeme po 5 cm 3 roztoku vaječného bílku. 3) Do první zkumavky přidáme 2 cm 3 koncentrované kyseliny dusičné. 4) Roztok ve druhé zkumavce zahřejeme k varu. 5) Do třetí zkumavky přidáme roztok síranu měďnatého a 2 cm 3 40% roztoku hydroxidu sodného. 6) Do čtvrté zkumavky přidáme ke vzorku bílku pouze 10% roztoku síranu měďnatého. 7) Do páté zkumavky přidáme 40% roztoku formaldehydu. 55
8 Obrázek: Otázky pro žáky: 1. Jak jinak se nazývají bílkoviny? 2. Jaká je funkce bílkovin v lidském těle? Bezpečnost práce: NaOH: Požití: Ihned ústa vyplachovat vodou či mlékem, vyvolat zvracení. Poté nedávat velké množství tekutin. Zasažení očí: Rychle opláchnout vodou alespoň 10 minut a k dalšímu výplachu použít borovou vodu. CuSO4: Požití: Vypít asi 1/2 litru vody nebo (lépe) mléka nebo roztok K4[Fe(CN)6] (1 kávová lžička žluté krevní soli do 1/2 litru vody). O vyvolání zvracení se pokoušet jen do 10 minut po požití. Zasažení očí: Rychlý a důkladný výplach vodou. NaCl: Požití: Při požití velkého množství vypít asi 1 litr vlažné vody, drážděním hrdla se snažit vyvolat zvracení. HNO3: Požití: Vypláchnout ústa vodou či mlékem, poté vyvolat zvracení.později dávat pít malé množství mléka či suspenze MgO. Zasažení očí: Vypláchnout co nejrychleji a důkladně vodou. Vyplachovat alespoň 10 minut. Potřísnění kůže: Zasažená místa omýt vodou, odstranit oděv, dát obklad s roztokem NaHCO3 a vyměňovat každých 10 minut po dobu 1 2 hodin. Zařazení do RVP: Přírodní látky - zdroje, vlastnosti a příklady funkcí bílkovin, tuků, sacharidů a vitaminů, enzymů a hormonů v lidském těle. 56
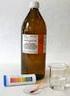
9 OCH pokus číslo 5 Důkaz ethanolu v alkoholickém nápoji Forma provedení: ŽP, DP, LP Časová náročnost: 8 minut Vysvětlivky: ŽP žákovský pokus DP demonstrační pokus LP laboratorní práce Princip: Ethanol (alkohol, který se nachází v alkoholických nápojích) má nízký bod varu a začne se proto vypařovat již při 78 C a z vroucí kapalné směsi v baňce tak uniká plynná a hořlavá látka, kterou lze zapálit. Touto hořlavou látkou je ethanol. Pomůcky: varná baňka (250cm 3 ), zátka s otvorem, 40 až 50 cm dlouhá skleněná trubice, stojan, keramická síťka, kahan, špejle, zápalky, nádoba pro vodní lázeň, varné kuličky Chemikálie: alkoholický nápoj Pracovní postup: 1) Do varné baňky nalijeme 100 cm 3 alkoholického nápoje (aby reakce lépe probíhala, můžeme přidat trochu čistého ethanolu), přidáme několik varných kuliček. Baňku uzavřeme zátkou, kterou prochází skleněná trubice. 2) Baňku s kapalinou upevníme ke stojanu a ponoříme do vodní lázně. 3) Alkoholický nápoj ve vodní lázni zahříváme k varu a u horního konce trubice přidržujeme hořící špejli. 57
10 Obrázek: Otázky pro žáky: 1. Jaký jiný název je pro ethanol v běžném životě? 2. Jakou charakteristickou skupinu obsahuje ethanol? 3. Na co se ethanol používá? Bezpečnost práce: Ethanol: Požití: Je-li postižený při vědomí: vypít asi 1/2 litru vlažné vody, slané vody nebo sodovky a drážděním hrdla vyvolat zvracení. Po zvracení podat černou kávu. Je-li vědomí výrazně porušeno: nepokoušet se o vyvolání zvracení, pečovat o průchodnost dýchacích cest (poloha s hlavou na stranu, vyjmout předměty z úst, zaklonit hlavu a tlačit dolní čelist vpřed). Zasažení očí: Rychlý a důkladný výplach vodou. Zařazení do RVP: Deriváty uhlovodíků - příklady v praxi významných halogenderivátů, alkoholů, 58
11 OCH pokus číslo 6 Důkaz halogenu vázaného v organické látce Forma provedení: ŽP, DP Časová náročnost: 2 minuty Vysvětlivky: DP demonstrační pokus ŽP žákovský pokus Princip: Organická látka se teplem rozkládá a v ní vázaný halogen reaguje s mědí. Vzniká halogenid mědi, např. chlorid měďnatý. Halogenidy mědi barví plamen zeleně. Pomůcky : spirála z měděného drátu, kahan Chemikálie: chloroform CHCl 3, popřípadě jiné organické rozpouštědlo obsahující halogen Pracovní postup: 1) Spirálu z měděného drátu vložíme do organického rozpouštědla obsahujícím vázaný halogen a vsuneme do nesvítivého plamene kahanu (viz obrázek). 2) Zelené zbarvení plamene dokazuje, že zkoumaná látka obsahuje vázaný halogen. 59
12 Obrázek: Otázky pro žáky: 1. Které prvky patří mezi halogeny? 2. K čemu se dříve používal chloroform? Bezpečnost práce: Chloroform: zdraví škodlivá látka, karcinogenní Zařazení do RVP: Deriváty uhlovodíků - příklady v praxi významných halogenderivátů. 60
13 OCH pokus číslo 7 Důkaz škrobu Forma provedení: ŽP, DP Časová náročnost: 2 minuty Vysvětlivky: ŽP žákovský pokus DP demonstrační pokus Princip: Pokud vzorek obsahuje škrob, zbarví se roztokem jodu do modra až do černa. Jestliže vzorek škrob neobsahuje, pak roztok jodu zůstane hnědý. Pomůcky: nůž, tyčinka, kapátko, 2 ks kádinky (50 cm 3 ) Chemikálie: 1% roztok škrobu, bramborová hlíza, 1% roztok jodu, voda Pracovní postup: 1) Do 1% roztoku škrobu a na překrojenou bramborovou hlízu přidáme několik kapek 1% roztoku jodu. 2) Reakcí roztoku škrobu a jodu vzniká modrý (popřípadě tmavomodrý) roztok. Náhradní varianta: viz. obrázek 1) Do první kádinky nalijeme 25 cm 3 škrobu, zamícháme. Poté do roztoku přidáme 3 kapky roztoku jodu. 2) Do druhé kádinky nalijeme 25 cm 3 vody a přidáme 2 lžičky škrobu. 3) Pozorujeme, co se stalo. - viz. obrázek 61
14 Obrázek: Otázky pro žáky: 1. Ve kterých dalších rostlinách, mimo brambor, se vyskytuje škrob? 2. Do které skupiny organických látek řadíme škrob? Bezpečnost práce: Jod: Požití: Vypít asi 1/2l litru mléka nebo vody s rozmíchaným škrobem (moukou) nebo s rozšlehanými bílky. Nesnažit se o vyvolání zvracení. Zasažení očí: Rychlý a důkladný výplach vodou. Nadýchání: Úplný tělesný klid, zákaz kouření a přivolat lékaře. Zařazení do RVP: Přírodní látky - zdroje, vlastnosti a příklady funkcí bílkovin, tuků, sacharidů a vitaminů v lidském těle. 62
15 OCH pokus číslo 8 Esterifikace reakce kyseliny octové s ethanolem Forma provedení: ŽP, DP, LP Časová náročnost: 13 min. Vysvětlivky : ŽP žákovský pokus DP demonstrační pokus LP laboratorní práce Princip: Za přítomnosti koncentrované kyseliny sírové reaguje kyselina octová s ethanolem, vzniká ethylester kyseliny octové a voda. Ethylester se používá jako rozpouštědlo. Pomůcky: varná baňka, vzdušný chladič, 3 kádinky (150 cm 3 ), dělící nálevka, tyčinka, lžička Chemikálie: kyselina octová, ethanol, koncentrovaná kyselina sírová, uhličitan sodný (práškový) Pracovní postup: 1) Ve varné baňce s připojeným vzdušným chladičem zahříváme směs 6 cm 3 kyseliny octové, 5 cm 3 ethanolu a 7 cm 3 koncentrované kyseliny sírové. Ze směsi oddestilujeme 5 cm 3 kapaliny. 2) Destilát protřepeme v dělící nálevce s asi 10 cm 3 nasyceného roztoku uhličitanu sodného a po usazení spodní vodnou vrstvu oddělíme. 3) Čichem opatrně porovnáme vůni výchozí kyseliny octové, ethanolu a získaného produktu. Získali jsme příjemně vonící produkt, který je na rozdíl od reaktantu ve vodě nerozpustný. 63
16 Obrázek: Rovnice: CH 3 COOH + CH 3 CH 2 OH CH 3 COOCH 2 CH 3 + H 2 O Otázky pro žáky: 1. Co je to esterifikace? 2. Jaké chemické sklo potřebujeme pro provedení esterifikace? 3. Co se získává esterifikací? Bezpečnost práce: Ethanol: Požití: Je li postižený při vědomí vypít asi ½ l vody, slané vody či sodovky a vyvolat zvracení, poté dát černou kávu. Je li vědomí porušeno kontrolovat průchodnost dýchacích cest Zasažení očí: Rychle a důkladně vypláchnout vodou. Potřísnění kůže: Kůži omýt vodou a mýdlem. Nadýchání: Přenést na čerstvý vzduch a pečovat o průchodnost dýchacích cest. Zařazení do RVP: Deriváty uhlovodíků - příklady v praxi významných halogenderivátů, alkoholů, aldehydů, karboxylových kyselin a esterů. 64
17 OCH pokus číslo 9 Oheň, který nespálí Forma provedení: ŽP, DP Časová náročnost: 3 minuty Vysvětlivky: ŽP žákovský pokus DP demonstrační pokus Princip: Namočený kousek látky ve směsi ethanolu s vodou jsme zapálili. Poté jsme ho uhasili a látka byla nepoškozená. Proč? Protože voda obsažená ve směsi ochlazovala kus látky. Hořeli jen páry ethanolu. Pomůcky: plynový kahan, kleště, látka (čtvereček 10x10 cm), kádinka (50 cm 3 ) Chemikálie: směs ethanolu a vody (1:1) Pracovní postup: 1) Čtvereček látky důkladně namočíme ve směsi ethanolu a vody tak, aby nezůstal ani kousek suchý. 2) Potom tento kousek látky uchopíme do kleští a vložíme do plamene kahanu. Po vyjmutí látky z ohně, bude nepoškozená. 65
18 Obrázek: Otázky pro žáky: 1. Proč si myslíte že hadřík neshořel? 2. K čemu všemu se ethanol v chemii používá? 3. Jakou charakteristickou skupinu obsahuje ethanol? Bezpečnost práce: Ethanol: Požití: Je li postižený při vědomí vypít asi ½ l vody, slané vody či sodovky a vyvolat zvracení, poté dát černou kávu. Je li vědomí porušeno kontrolovat průchodnost dýchacích cest. Zasažení očí: Rychle a důkladně vypláchnout vodou. Potřísnění kůže: Kůži omýt vodou a mýdlem. Nadýchání: Přenést na čerstvý vzduch a pečovat o průchodnost dýchacích cest. Zařazení do RVP: Deriváty uhlovodíků - příklady v praxi významných halogenderivátů, alkoholů, aldehydů, karboxylových kyselin a esterů. 66
19 OCH pokus číslo 10 Příprava ethenu (ethylenu) depolymerací polyethylenu Forma provedení: ŽP, DP Časová náročnost: 7 minut Vysvětlivky: ŽP žákovský pokus DP demonstrační pokus Princip: Zahříváním nastříhaných kousků hadičky (z polyethylenu), vzniká plyn ethen, který začne odbarvovat žlutou bromovou vodu. Což je důkazem dvojné vazby v najímaném plynu. Pomůcky: zkumavky, polyethylenová hadička, kahan, stojan, držáky na zkumavky Chemikálie: bromová voda Pracovní postup: 1) Ve zkumavce zahříváme kousky polyethylenu (např.hadičky) a vznikající plyn zavádíme do zkumavky s 5 cm 3 bromové vody. 2) Pozorujeme odbarvení bromové vody 67
20 Obrázek: Rovnice: [CH2 =CH-CH3]n + n Br2- n Br CH2-CH-CH3 Otázky pro žáky: 1. Na co všechno se používá polyethylen? 2. Co je to polymerace? Bezpečnost práce: Bromová voda: Požití : Vypít asi 1 litr slané vody obsahující 5 lžic NaCl na 1 litr a vyvolat zvracení. Potřísnění kůže: Omýt místo vodou a poté namazat glycerolem. Zařazení do RVP: Uhlovodíky - příklady v praxi významných alkanů, uhlovodíků s vícenásobnými vazbami a aromatických uhlovodíků. 68
21 OCH pokus číslo 11 Příprava ethinu (acetylenu) Forma provedení: DP Časová náročnost: 8 minut Vysvětlivky: DP demonstrační pokus Princip: Reakcí karbidu vápenatého a vody vzniká ethin a oxid vápenatý. Trojná vazby v ethinu se dokazuje tak, že tento plyn odvádíme do zkumavky s bromovou vodou. Důkaz se projeví tím, že se žlutá bromová voda odbarví. Pomůcky : erlenmayerova kuželová baňka (250 cm 3 ), zátka s hořákovou trubičkou, porcelánový střep, zátka s odvodnou trubičkou, zkumavka, promývací zkumavka (s bočním odvodem). Chemikálie: karbid vápenatý (acetylid vápenatý), destilovaná voda, bromová voda Pracovní postup: 1) Navážíme si 4g acetylidu vápenatého a odměříme 60 cm 3 vody. S ohledem na bouřlivou reakci je nutno tato množství dodržet. 2) Navážený acetylid vápenatý nasypeme do suché frakční baňky a uzavřeme zátkou s dělící nálevkou. 3) Do dělící nálevky nalijeme vodu. Frakční baňku připojíme k promývací baňce s bromovou vodou. K promývací baňce připojíme odvodnou trubičku. 4) Vyvíjející se ethin odvádíme přes promývací baňku asi 1 minutu. Poté zavřeme kohout dělící nálevky a konec odvodné trubičky zapálíme. 5) Do plamene vložíme porcelánový střep na němž se zachycují vznikající saze. 69
22 Obrázek: Otázky pro žáky: 1. Na co se používá acetylen (ethin)? 2. Kolikanásobná vazba je obsažena mezi atomy uhlíku v molekule ethinu? 3. Do které skupiny uhlovodíků ethin řadíme? Bezpečnost práce: Bromová voda: Požití: Vypít asi 1 litr slané vody obsahující 5 lžic NaCl na 1 litr a vyvolat zvracení. Potřísnění kůže: Omýt místo vodou a poté namazat glycerolem. Zařazení do RVP: Uhlovodíky - příklady v praxi významných alkanů, uhlovodíků s vícenásobnými vazbami a aromatických uhlovodíků. 70
23 OCH pokus číslo 12 Příprava mýdla povrchové napětí Forma provedení: DP, LP Časová náročnost: 60 minut Vysvětlivky: LP laboratorní práce DP demonstrační pokus Princip: Při výrobě mýdla se vaří živočišné nebo rostlinné oleje s hydroxidem sodným. Nejprve vzniká tekuté mýdlo,které se musí usušit. Mýdla snižují povrchové napětí vody, a tím usnadňují smáčení částeček špíny a jejich rozpouštění ve vodě Pomůcky: 2 ks kádinky(250 cm 3 ), skleněná tyčinka, sklíčko, plynový kahan, síťka Chemikálie: tuk, 40% roztok NaOH, ethanol, nasycený roztok chloridu sodného, roztok fenolftaleinu, Pracovní postup: 1) V malé kádince smícháme asi 3g tuku se 3 cm 3 40% NaOH a 3 cm 3 ethanolu. 2) Po promíchání skleněnou tyčinkou směs zahřejeme na vodní lázni k varu. Zmýdelnění je skončeno, když kapka roztoku vyjmutá skleněnou tyčinkou na sklíčku ztuhne (žlutá kapka mezi prsty nemaže, ale drobí se). 3) K získanému roztoku mýdla pak přidáme 5 cm 3 horkého nasyceného roztoku NaCl. Po zamíchání nalijeme do kádinky ještě asi 10 cm 3 nasyceného roztoku NaCl. 4) Směs pak necháme ještě několik minut v horké vodní lázni. Poté ji ochladíme. Tuhou horní vrstvu mýdla vyškrabeme tyčinkou. Obrázek: 71
24 Otázky pro žáky: 1. Do které skupiny organických látek řadíme tuky? 2. Jakou chemickou reakcí vznikají tuky? Bezpečnost práce: Ethanol: Požití: Je-li postižený při vědomí: Vypít asi 1/2 litru vlažné vody, slané vody nebo sodovky a drážděním hrdla vyvolat zvracení. Po zvracení podat černou kávu. Je-li vědomí výrazně porušeno: nepokoušet se o vyvolání zvracení, pečovat o průchodnost dýchacích cest (poloha s hlavou na stranu, vyjmout předměty z úst, zaklonit hlavu a tlačit dolní čelist vpřed). Zasažení očí: Rychlý důkladný výplach vodou Nadýchání: Přenést na čistý vzduch, pečovat o průchodnost dýchacích cest NaCl: Požití: Při požití velkého množství vypít asi 1 litr vlažné vody, drážděním hrdla se snažit vyvolat zvracení. Fenoftalein: Požití: V případě nutnosti masáž srdce a umělé dýchání. V bezvědomí dbát o průchodnost dýchacích cest. Při poruše vědomí, náběhu ke křečím nebo při náznacích poruchy krevního oběhu (bledost, promodrání, slabý či nepravidelný tep, obtížné dýchání) klid na lůžku, nepokoušet se o vyvolání zvracení, udržet tělesnou teplotu. Při dobrém celkovém stavu (nejde-li o požití petroleje, benzínu, terpentýnu ani většího množství silné žíraviny) vypláchnout ústa vodou, vykloktat, vypít asi ½ litru vlažné vody a drážděním hrdla vyvolat zvracení. Zasažení očí: Odstranit např. kapesníkem pevně nelpící tuhé částečky (zaseknuté střepy necháme na místě!). Poté odsát nastříkanou tekutinu. I násilím otevřít oko a po dobu min proplachovat vlažnou vodou. Nepokoušet se o neutralizaci. Zavolat očního lékaře. NaOH: Požití: Ihned ústa vyplachovat vodou či mlékem, vyvolat zvracení. Poté nedávat velké množství tekutin. Zasažení očí: Rychle opláchnout vodou alespoň 10 minut a k dalšímu výplachu použít borovou vodu Zařazení do RVP: Přírodní látky - zdroje, vlastnosti a příklady funkcí bílkovin, tuků, sacharidů a vitaminů, enzymů a hormonů v lidském těle. 72
25 73
KARBOXYLOVÉ KYSELINY
 LABORATORNÍ PRÁCE Č. 28 KARBOXYLOVÉ KYSELINY PRINCIP Karboxylové kyseliny jsou látky, které ve své molekule obsahují jednu nebo více karboxylových skupin. Odvozují se od nich dva typy derivátů, substituční
LABORATORNÍ PRÁCE Č. 28 KARBOXYLOVÉ KYSELINY PRINCIP Karboxylové kyseliny jsou látky, které ve své molekule obsahují jednu nebo více karboxylových skupin. Odvozují se od nich dva typy derivátů, substituční
Návod k laboratornímu cvičení. Alkoholy
 Úkol č. 1: Ověřování fyzikálních vlastností alkoholů Návod k laboratornímu cvičení Alkoholy Pomůcky: 3 velké zkumavky - A,B,C, hodinové sklíčko, kapátko nebo skleněná tyčinka Chemikálie: etanol (F), etan-1,2-
Úkol č. 1: Ověřování fyzikálních vlastností alkoholů Návod k laboratornímu cvičení Alkoholy Pomůcky: 3 velké zkumavky - A,B,C, hodinové sklíčko, kapátko nebo skleněná tyčinka Chemikálie: etanol (F), etan-1,2-
Sacharidy - důkaz organických látek v přírodních materiálech pomocí žákovské soupravy pro chemii
 Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.1.28/02.0055 Sacharidy - důkaz organických látek v přírodních materiálech pomocí žákovské soupravy pro chemii (laboratorní práce)
Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.1.28/02.0055 Sacharidy - důkaz organických látek v přírodních materiálech pomocí žákovské soupravy pro chemii (laboratorní práce)
OKRUH 7 Karboxylové kyseliny
 OKRUH 7 Karboxylové kyseliny Pro karboxylové kyseliny je charakteristická přítomnost jedné nebo více karboxylových skupin Monokarboxylové kyseliny Příprava kyseliny mravenčí z chloroformu a její důkaz
OKRUH 7 Karboxylové kyseliny Pro karboxylové kyseliny je charakteristická přítomnost jedné nebo více karboxylových skupin Monokarboxylové kyseliny Příprava kyseliny mravenčí z chloroformu a její důkaz
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY
 LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY Mezi nejrozšířenější práce s plyny v laboratoři patří příprava a důkazy oxidu uhličitého CO 2, kyslíku O 2, vodíku H 2, oxidu siřičitého SO 2 a amoniaku NH 3. Reakcí
LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY Mezi nejrozšířenější práce s plyny v laboratoři patří příprava a důkazy oxidu uhličitého CO 2, kyslíku O 2, vodíku H 2, oxidu siřičitého SO 2 a amoniaku NH 3. Reakcí
Návod k laboratornímu cvičení. Bílkoviny
 Úkol č. 1: Důkazy bílkovin ve vaječném bílku a) natvrdo uvařené vejce s kyselinou dusičnou Pomůcky: Petriho miska, pipeta, nůž. Návod k laboratornímu cvičení Bílkoviny Chemikálie: koncentrovaná kyselina
Úkol č. 1: Důkazy bílkovin ve vaječném bílku a) natvrdo uvařené vejce s kyselinou dusičnou Pomůcky: Petriho miska, pipeta, nůž. Návod k laboratornímu cvičení Bílkoviny Chemikálie: koncentrovaná kyselina
UHLOVODÍKY A HALOGENDERIVÁTY
 LABORATORNÍ PRÁCE Č. 25 UHLOVODÍKY A HALOGENDERIVÁTY PRINCIP Uhlovodíky jsou nejjednodušší organické sloučeniny, jejichž molekuly jsou tvořeny pouze uhlíkem a vodíkem. Uhlovodíky klasifikujeme z několika
LABORATORNÍ PRÁCE Č. 25 UHLOVODÍKY A HALOGENDERIVÁTY PRINCIP Uhlovodíky jsou nejjednodušší organické sloučeniny, jejichž molekuly jsou tvořeny pouze uhlíkem a vodíkem. Uhlovodíky klasifikujeme z několika
Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii
 Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Laboratorní cvičení č. Tlak vzduchu: Teplota vzduchu: Bílkoviny(proteiny) Vlhkost
Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Laboratorní cvičení č. Tlak vzduchu: Teplota vzduchu: Bílkoviny(proteiny) Vlhkost
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 10 Bílkoviny Pro potřeby projektu
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 10 Bílkoviny Pro potřeby projektu
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 9 Lipidy Pro potřeby projektu
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 9 Lipidy Pro potřeby projektu
Teoretický protokol ze cvičení 6. 12. 2010 Josef Bušta, skupina: 1, obor: fytotechnika
 Úloha: Karboxylové kyseliny, č. 3 Úkoly: Příprava kys. mravenčí z chloroformu Rozklad kys. mravenčí Esterifikace Rozklad kys. šťavelové Příprava kys. benzoové oxidací toluenu Reakce kys. benzoové a salicylové
Úloha: Karboxylové kyseliny, č. 3 Úkoly: Příprava kys. mravenčí z chloroformu Rozklad kys. mravenčí Esterifikace Rozklad kys. šťavelové Příprava kys. benzoové oxidací toluenu Reakce kys. benzoové a salicylové
LP č. 6 - BÍLKOVINY. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 28. 2. 2013. Ročník: devátý
 LP č. 6 - BÍLKOVINY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 28. 2. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci prakticky ověří
LP č. 6 - BÍLKOVINY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 28. 2. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci prakticky ověří
ORGANICKÁ CHEMIE Laboratorní práce č. 4 Téma: Karbonylové sloučeniny, karboxylové kyseliny
 ORGANICKÁ CHEMIE Laboratorní práce č. 4 Téma: Karbonylové sloučeniny, karboxylové kyseliny Úkol 1: Připravte acetaldehyd. Karbonylová skupina aldehydů podléhá velmi snadno oxidaci až na skupinu karboxylovou.
ORGANICKÁ CHEMIE Laboratorní práce č. 4 Téma: Karbonylové sloučeniny, karboxylové kyseliny Úkol 1: Připravte acetaldehyd. Karbonylová skupina aldehydů podléhá velmi snadno oxidaci až na skupinu karboxylovou.
ORGANICKÁ CHEMIE Laboratorní práce č. 3
 Téma: Hydroxyderiváty uhlovodíků ORGANICKÁ CHEMIE Laboratorní práce č. 3 Úkol 1: Dokažte přítomnost ethanolu ve víně. Ethanol bezbarvá kapalina, která je základní součástí alkoholických nápojů. Ethanol
Téma: Hydroxyderiváty uhlovodíků ORGANICKÁ CHEMIE Laboratorní práce č. 3 Úkol 1: Dokažte přítomnost ethanolu ve víně. Ethanol bezbarvá kapalina, která je základní součástí alkoholických nápojů. Ethanol
téma: Halogeny-úvod autor: Ing. František Krejčí, CSc. cíl praktika: žáci si osvojí znalosti z chemie halogenů doba trvání: 2 h
 téma: Halogeny-úvod cíl praktika: žáci si osvojí znalosti z chemie halogenů pomůcky: psací potřeby popis aktivit: Žáci si osvojí problematiku halogenů, popíší jejich elektronovou konfiguraci a z ní vyvodí
téma: Halogeny-úvod cíl praktika: žáci si osvojí znalosti z chemie halogenů pomůcky: psací potřeby popis aktivit: Žáci si osvojí problematiku halogenů, popíší jejich elektronovou konfiguraci a z ní vyvodí
Laboratorní cvičení z kinetiky chemických reakcí
 Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
RCOOR + H 2 O. Inovace bakalářského studijního oboru Aplikovaná chemie CZ.1.07/2.2.00/ Esterifikace
 Esterifikace Estery jsou funkční deriváty karboxylových kyselin. Připravují se reakcí karboxylových kyselin s alkoholy nebo s fenoly. RCOOH+ HOR RCOOR + H 2 O K přípravě esterů je vhodné použít vyšší alifatické
Esterifikace Estery jsou funkční deriváty karboxylových kyselin. Připravují se reakcí karboxylových kyselin s alkoholy nebo s fenoly. RCOOH+ HOR RCOOR + H 2 O K přípravě esterů je vhodné použít vyšší alifatické
Návod k laboratornímu cvičení. Fenoly
 Návod k laboratornímu cvičení Fenoly Úkol č. 1: Příprava fenolátu sodného Pomůcky: váhy, kádinka, zkumavky Chemikálie: 10% roztok hydroxidu sodného NaOH (C), 5%roztok kyseliny chlorovodíkové HCl (C, X
Návod k laboratornímu cvičení Fenoly Úkol č. 1: Příprava fenolátu sodného Pomůcky: váhy, kádinka, zkumavky Chemikálie: 10% roztok hydroxidu sodného NaOH (C), 5%roztok kyseliny chlorovodíkové HCl (C, X
HYDROXYDERIVÁTY - ALKOHOLY
 LABORATORNÍ PRÁCE Č. 26 HYDROXYDERIVÁTY - ALKOHOLY PRINCIP Hydroxyderiváty jsou kyslíkaté deriváty uhlovodíků, které vznikají náhradou jednoho nebo více atomů vodíku v molekule uhlovodíku hydroxylovou
LABORATORNÍ PRÁCE Č. 26 HYDROXYDERIVÁTY - ALKOHOLY PRINCIP Hydroxyderiváty jsou kyslíkaté deriváty uhlovodíků, které vznikají náhradou jednoho nebo více atomů vodíku v molekule uhlovodíku hydroxylovou
ORGANICKÁ CHEMIE Laboratorní práce č. 9
 Téma: Bílkoviny, enzymy ORGANICKÁ CHEMIE Laboratorní práce č. 9 Úkol 1: Dokažte, že mléko obsahuje bílkovinu kasein. Kasein je hlavní bílkovinou obsaženou v savčím mléce. Výroba řady mléčných výrobků je
Téma: Bílkoviny, enzymy ORGANICKÁ CHEMIE Laboratorní práce č. 9 Úkol 1: Dokažte, že mléko obsahuje bílkovinu kasein. Kasein je hlavní bílkovinou obsaženou v savčím mléce. Výroba řady mléčných výrobků je
Návod k laboratornímu cvičení. Efektní pokusy
 Návod k laboratornímu cvičení Efektní pokusy Úkol č. 1: Chemikova zahrádka Pomůcky: skleněná vana, lžička na chemikálie. Chemikálie: vodní sklo, síran zinečnatý ZnSO 4 (X i ), síran železnatý FeSO 4, chlorid
Návod k laboratornímu cvičení Efektní pokusy Úkol č. 1: Chemikova zahrádka Pomůcky: skleněná vana, lžička na chemikálie. Chemikálie: vodní sklo, síran zinečnatý ZnSO 4 (X i ), síran železnatý FeSO 4, chlorid
Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády. 46. ročník 2009/2010. KRAJSKÉ KOLO kategorie D
 Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 46. ročník 2009/2010 KRAJSKÉ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH TEORETICKÁ ČÁST (60 bodů) Úloha 1 Vlastnosti prvků 26
Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 46. ročník 2009/2010 KRAJSKÉ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH TEORETICKÁ ČÁST (60 bodů) Úloha 1 Vlastnosti prvků 26
Téma : Uhlovodíky Areny Toluen a naftalen Název : Vlastnosti toluenu a naftalenu
 Téma : Uhlovodíky Areny Toluen a naftalen Název : Vlastnosti toluenu a naftalenu Typ pokusu : demonstrační Princip : Areny starším názvem aromatické uhlovodíky, vzaly tento svůj název podle své typické
Téma : Uhlovodíky Areny Toluen a naftalen Název : Vlastnosti toluenu a naftalenu Typ pokusu : demonstrační Princip : Areny starším názvem aromatické uhlovodíky, vzaly tento svůj název podle své typické
!STUDENTI DONESOU! PET
 Důkaz prvků v organických sloučeninách (C, H, N, S, halogeny), vlastnosti organických sloučenin, pokusy se svíčkou sacharosa oxid měďnatý, pentahydrát síranu měďnatého oxid vápenatý hydroxid sodný, hydrogenuhličitan
Důkaz prvků v organických sloučeninách (C, H, N, S, halogeny), vlastnosti organických sloučenin, pokusy se svíčkou sacharosa oxid měďnatý, pentahydrát síranu měďnatého oxid vápenatý hydroxid sodný, hydrogenuhličitan
Vodík, kyslík a jejich sloučeniny
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Vodík, kyslík a jejich sloučeniny
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Vodík, kyslík a jejich sloučeniny
Návod k laboratornímu cvičení. Oddělování složek směsí I
 Návod k laboratornímu cvičení Oddělování složek směsí I Úkol č. 1: Usazování Pomůcky: dělící nálevka, držák, svorka, stojan, kádinka Chemikálie: voda, potravinářské barvivo, olej 1. Dělící nálevku upevníme
Návod k laboratornímu cvičení Oddělování složek směsí I Úkol č. 1: Usazování Pomůcky: dělící nálevka, držák, svorka, stojan, kádinka Chemikálie: voda, potravinářské barvivo, olej 1. Dělící nálevku upevníme
Návod k laboratornímu cvičení. Cukry(sacharidy)
 Návod k laboratornímu cvičení Cukry(sacharidy) Úkol č. 1: Odlišení glukosy a fruktosy Pomůcky: zkumavky, lžička na chemikálie, kádinka, stojan, držák, kruh, síťka, plynový kahan, zápalky Chemikálie: fruktosa,
Návod k laboratornímu cvičení Cukry(sacharidy) Úkol č. 1: Odlišení glukosy a fruktosy Pomůcky: zkumavky, lžička na chemikálie, kádinka, stojan, držák, kruh, síťka, plynový kahan, zápalky Chemikálie: fruktosa,
Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii
 Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Laboratorní cvičení č. Tlak vzduchu: Teplota vzduchu: Vodík a kyslík Vlhkost
Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Laboratorní cvičení č. Tlak vzduchu: Teplota vzduchu: Vodík a kyslík Vlhkost
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Sacharidy Pro potřeby projektu
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Sacharidy Pro potřeby projektu
Návod k laboratornímu cvičení. Alkaloidy a steroidy
 Návod k laboratornímu cvičení Úkol č. 1: Sublimace kofeinu Alkaloidy a steroidy Pomůcky: 2 hodinová sklíčka, elektrický vařič, siťka, stojan s kruhem, filtrační papír Chemikálie: suché čajové lístky (černý,
Návod k laboratornímu cvičení Úkol č. 1: Sublimace kofeinu Alkaloidy a steroidy Pomůcky: 2 hodinová sklíčka, elektrický vařič, siťka, stojan s kruhem, filtrační papír Chemikálie: suché čajové lístky (černý,
LP č. 5 - SACHARIDY. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 28. 2. 2013. Ročník: devátý
 LP č. 5 - SACHARIDY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 28. 2. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci si prakticky vyzkouší
LP č. 5 - SACHARIDY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 28. 2. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci si prakticky vyzkouší
Oxidace benzaldehydu vzdušným kyslíkem a roztokem
 Úloha: Karbonylové sloučeniny a sacharidy, č. 2 Úkoly: Oxidace benzaldehydu Důkaz aldehydu Schiffovým činidlem Redukční vlastnosti karbonylových sloučenin a sacharidů (Reakce s Tollensovým a Fehlingovým
Úloha: Karbonylové sloučeniny a sacharidy, č. 2 Úkoly: Oxidace benzaldehydu Důkaz aldehydu Schiffovým činidlem Redukční vlastnosti karbonylových sloučenin a sacharidů (Reakce s Tollensovým a Fehlingovým
Reakce kyselin a zásad
 seminář 6. 1. 2011 Chemie Reakce kyselin a zásad Známe několik teorií, které charakterizují definují kyseliny a zásady. Nejstarší je Arrheniova teorie, která je platná pro vodné prostředí, podle které
seminář 6. 1. 2011 Chemie Reakce kyselin a zásad Známe několik teorií, které charakterizují definují kyseliny a zásady. Nejstarší je Arrheniova teorie, která je platná pro vodné prostředí, podle které
Odborná práce přírodovědného kroužku Gymnázia Jana Opletala Litovel, Opletalova 189. Sacharidy
 Odborná práce přírodovědného kroužku Gymnázia Jana Opletala Litovel, Opletalova 189 Sacharidy Vypracovali: Jana Andrýsková, Aneta Čulíková, Jan Dvořáček, David Hrachovina, Petra Hrachovinová, Eva Podivínská,
Odborná práce přírodovědného kroužku Gymnázia Jana Opletala Litovel, Opletalova 189 Sacharidy Vypracovali: Jana Andrýsková, Aneta Čulíková, Jan Dvořáček, David Hrachovina, Petra Hrachovinová, Eva Podivínská,
Ústřední komise Chemické olympiády. 42. ročník. KRAJSKÉ KOLO Kategorie D. SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut
 Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
Reakce organických látek
 Pavel Lauko 5.2.2002 DI I. roč. 3.sk. Reakce organických látek 1. Příprava methanu dekarboxylací octanu sodného Roztoky a materiál: octan sodný, natronové vápno, manganistan draselný, cyklohexan. Postup:
Pavel Lauko 5.2.2002 DI I. roč. 3.sk. Reakce organických látek 1. Příprava methanu dekarboxylací octanu sodného Roztoky a materiál: octan sodný, natronové vápno, manganistan draselný, cyklohexan. Postup:
Školní výstupy Učivo (pojmy) Poznámka
 Vyučovací předmět: Chemie (Ch) Ročník Předmět Průřezová témata Mezipředmět. vazby Školní výstupy Učivo (pojmy) Poznámka Období splnění Metodická poznámka Rozsah vyžadovaného učiva OSV 1 (praktické pokusy)
Vyučovací předmět: Chemie (Ch) Ročník Předmět Průřezová témata Mezipředmět. vazby Školní výstupy Učivo (pojmy) Poznámka Období splnění Metodická poznámka Rozsah vyžadovaného učiva OSV 1 (praktické pokusy)
téma: Úvodní praktikum - Práce v laboratoři autor: Ing. Dagmar Kučerová
 téma: Úvodní praktikum - Práce v laboratoři cíl praktika: Žáci budou seznámeni s laboratorním řádem a poučeni o bezpečnosti práce. pomůcky: laboratorní řád popis aktivit: Žáci se seznámí se všemi body
téma: Úvodní praktikum - Práce v laboratoři cíl praktika: Žáci budou seznámeni s laboratorním řádem a poučeni o bezpečnosti práce. pomůcky: laboratorní řád popis aktivit: Žáci se seznámí se všemi body
ORGANICKÁ CHEMIE Laboratorní práce č. 1 Téma: Důkaz biogenních prvků v organických sloučeninách
 ORGANICKÁ CHEMIE Laboratorní práce č. 1 Téma: Důkaz biogenních prvků v organických sloučeninách Úkol 1: Dokažte přítomnost uhlíku a vodíku v organických sloučeninách. Uhlík spolu s vodíkem jsou základními
ORGANICKÁ CHEMIE Laboratorní práce č. 1 Téma: Důkaz biogenních prvků v organických sloučeninách Úkol 1: Dokažte přítomnost uhlíku a vodíku v organických sloučeninách. Uhlík spolu s vodíkem jsou základními
ORGANICKÁ CHEMIE Laboratorní práce č. 2
 Téma: Uhlovodíky ORGANICKÁ CHEMIE Laboratorní práce č. 2 Pozn: Organické látky, jako jsou petrolej, hexan nebo naftalen, nepatří do umyvadla, ale do speciální nádoby na organický odpad!! Úkol 1: Zkoumejte
Téma: Uhlovodíky ORGANICKÁ CHEMIE Laboratorní práce č. 2 Pozn: Organické látky, jako jsou petrolej, hexan nebo naftalen, nepatří do umyvadla, ale do speciální nádoby na organický odpad!! Úkol 1: Zkoumejte
Rozezná a vysvětlí význam označení různých nebezpečných látek. Vybrané dostupné látky pojmenuje a vysvětlí jejich nebezpečnost.
 Vyučovací předmět: Ročník Předmět Průřezová témata Mezipředmět. vazby F emie () Školní výstupy Učivo (pojmy) Poznámka OSV 1 (praktické pokusy) Na konkrétních příkladech rozliší látky a tělesa, pokusným
Vyučovací předmět: Ročník Předmět Průřezová témata Mezipředmět. vazby F emie () Školní výstupy Učivo (pojmy) Poznámka OSV 1 (praktické pokusy) Na konkrétních příkladech rozliší látky a tělesa, pokusným
Bílkoviny (laboratorní práce)
 Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Bílkoviny (laboratorní práce) Označení: EU-Inovace-Ch-9-08 Předmět: chemie Cílová skupina: 9. třída Autor: Mgr. Simona
Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Bílkoviny (laboratorní práce) Označení: EU-Inovace-Ch-9-08 Předmět: chemie Cílová skupina: 9. třída Autor: Mgr. Simona
KVALITATIVNÍ ELEMENTÁRNÍ ANALÝZA ORGANICKÝCH LÁTEK
 LABORATORNÍ PRÁCE Č. 24 KVALITATIVNÍ ELEMENTÁRNÍ ANALÝZA ORGANICKÝCH LÁTEK PRINCIP Organická kvalitativní elementární analýza zkoumá chemické složení organických látek, zabývá se identifikací jednotlivých
LABORATORNÍ PRÁCE Č. 24 KVALITATIVNÍ ELEMENTÁRNÍ ANALÝZA ORGANICKÝCH LÁTEK PRINCIP Organická kvalitativní elementární analýza zkoumá chemické složení organických látek, zabývá se identifikací jednotlivých
Název: Deriváty uhlovodíků karbonylové sloučeniny
 Název: Deriváty uhlovodíků karbonylové sloučeniny Autor: Mgr. Štěpán Mička Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, fyzika Ročník: 4. Tématický
Název: Deriváty uhlovodíků karbonylové sloučeniny Autor: Mgr. Štěpán Mička Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, fyzika Ročník: 4. Tématický
7) Uveď příklad chemické reakce, při níž se sloučí dva prvky za vzniku sloučeniny. (3) hoření vodíku s kyslíkem a vzniká voda
 Chemické reakce a děje Chemické reakce 1) Jak se chemické reakce odlišují od fyzikálních dějů? (2) změna vlastností látek, změna vazeb mezi atomy 2) Co označujeme v chemických reakcích jako reaktanty a
Chemické reakce a děje Chemické reakce 1) Jak se chemické reakce odlišují od fyzikálních dějů? (2) změna vlastností látek, změna vazeb mezi atomy 2) Co označujeme v chemických reakcích jako reaktanty a
Oborový workshop pro ZŠ CHEMIE
 PRAKTICKÁ VÝUKA PŘÍRODOVĚDNÝCH PŘEDMĚTŮ NA ZŠ A SŠ CZ.1.07/1.1.30/02.0024 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Oborový workshop pro ZŠ CHEMIE
PRAKTICKÁ VÝUKA PŘÍRODOVĚDNÝCH PŘEDMĚTŮ NA ZŠ A SŠ CZ.1.07/1.1.30/02.0024 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Oborový workshop pro ZŠ CHEMIE
Pomůcky: láhev s víčkem (např. zavařovací láhev), nůž případně struhadlo, dřevěná destička, červené zelí, voda
 4.3 Domácí pokusy Domácí pokus číslo 1 Příprava přírodního indikátoru Forma provedení: DP, ŽP Časová náročnost: 1-2 dní Vysvětlivky: DP demonstrační pokus ŽP žákovský pokus Princip: Červené zelí obsahuje
4.3 Domácí pokusy Domácí pokus číslo 1 Příprava přírodního indikátoru Forma provedení: DP, ŽP Časová náročnost: 1-2 dní Vysvětlivky: DP demonstrační pokus ŽP žákovský pokus Princip: Červené zelí obsahuje
Termochemie. Úkol: A. Určete změnu teploty při rozpouštění hydroxidu sodného B. Určete reakční teplo reakce zinku s roztokem měďnaté soli
 1. Termochemie Úkol: Určete změnu teploty při rozpouštění hydroxidu sodného B. Určete reakční teplo reakce zinku s roztokem měďnaté soli Pomůcky : a) kádinky, teploměr, odměrný válec, váženka, váhy, kalorimetr,
1. Termochemie Úkol: Určete změnu teploty při rozpouštění hydroxidu sodného B. Určete reakční teplo reakce zinku s roztokem měďnaté soli Pomůcky : a) kádinky, teploměr, odměrný válec, váženka, váhy, kalorimetr,
Sešit pro laboratorní práci z chemie
 Sešit pro laboratorní práci z chemie téma: Důkaz C, H, N a halogenů v organických sloučeninách autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie
Sešit pro laboratorní práci z chemie téma: Důkaz C, H, N a halogenů v organických sloučeninách autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie
Ústřední komise Chemické olympiády. 52. ročník 2015/2016. ŠKOLNÍ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH
 Ústřední komise Chemické olympiády 52. ročník 2015/2016 ŠKOLNÍ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH 21 Řešení školního kola ChO kat. B 2015/2016 TEORETICKÁ ČÁST (70 BODŮ) Úloha 1 Měď v minerálech 12
Ústřední komise Chemické olympiády 52. ročník 2015/2016 ŠKOLNÍ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH 21 Řešení školního kola ChO kat. B 2015/2016 TEORETICKÁ ČÁST (70 BODŮ) Úloha 1 Měď v minerálech 12
REAKCE V ORGANICKÉ CHEMII A BIOCHEMII
 REAKCE V ORGANICKÉ CHEMII A BIOCHEMII PaedDr. Ivana Töpferová Střední průmyslová škola, Mladá Boleslav, Havlíčkova 456 CZ.1.07/1.5.00/34.0861 MODERNIZACE VÝUKY Anotace: laboratorní práce z organické chemie
REAKCE V ORGANICKÉ CHEMII A BIOCHEMII PaedDr. Ivana Töpferová Střední průmyslová škola, Mladá Boleslav, Havlíčkova 456 CZ.1.07/1.5.00/34.0861 MODERNIZACE VÝUKY Anotace: laboratorní práce z organické chemie
Hydroxidy a indikátory demonstrační
 název typ: zařazení: Pomůcky: Chemikálie: Postup: pozorování rovnice, vysvětlení Hydroxidy a indikátory demonstrační Hydroxidy. Indikátory. 3 zkumavky, kapátko NaOH(C), fenolftalein, lakmus, ph papírek
název typ: zařazení: Pomůcky: Chemikálie: Postup: pozorování rovnice, vysvětlení Hydroxidy a indikátory demonstrační Hydroxidy. Indikátory. 3 zkumavky, kapátko NaOH(C), fenolftalein, lakmus, ph papírek
VÝŽIVA LIDSTVA Mléko a zdraví
 GYMNÁZIUM JANA OPLETALA LITOVEL Odborná práce přírodovědného kroužku VÝŽIVA LIDSTVA Mléko a zdraví Vypracovali: Martina Hubáčková, Petra Vašíčková, Pavla Kubíčková, Michaela Pavlovská, Jitka Tichá, Petra
GYMNÁZIUM JANA OPLETALA LITOVEL Odborná práce přírodovědného kroužku VÝŽIVA LIDSTVA Mléko a zdraví Vypracovali: Martina Hubáčková, Petra Vašíčková, Pavla Kubíčková, Michaela Pavlovská, Jitka Tichá, Petra
LABORATORNÍ PRÁCE č.2
 LABORATORNÍ PRÁCE č.2 Téma: Dělení směsí II Úkol č.1: Destilace směsi manganistan draselný voda Teorie: Jedná se o jeden z nejdůležitějších způsobů oddělování složek kapalných směsí a jejich čištění. Složky
LABORATORNÍ PRÁCE č.2 Téma: Dělení směsí II Úkol č.1: Destilace směsi manganistan draselný voda Teorie: Jedná se o jeden z nejdůležitějších způsobů oddělování složek kapalných směsí a jejich čištění. Složky
Neutralizace kyseliny zásadou
 Neutralizace kyseliny zásadou Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 15 minut Pomůcky a) chemikálie - kyselina chlorovodíková - hydroxid sodný
Neutralizace kyseliny zásadou Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 15 minut Pomůcky a) chemikálie - kyselina chlorovodíková - hydroxid sodný
LP č. 3 - ESTERY. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 27. 12. 2012. Ročník: devátý
 LP č. 3 - ESTERY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 27. 12. 2012 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci prakticky vyzkouší
LP č. 3 - ESTERY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 27. 12. 2012 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci prakticky vyzkouší
HYDROXYDERIVÁTY. Alkoholy Fenoly Bc. Miroslava Wilczková
 HYDROXYDERIVÁTY Alkoholy Fenoly Bc. Miroslava Wilczková HYDROXYDERIVÁTY Alkoholy -OH skupina vázána na uhlíkový atom alifatického řetězce Fenoly -OH skupina vázána na uhlíku, který je součástí aromatického
HYDROXYDERIVÁTY Alkoholy Fenoly Bc. Miroslava Wilczková HYDROXYDERIVÁTY Alkoholy -OH skupina vázána na uhlíkový atom alifatického řetězce Fenoly -OH skupina vázána na uhlíku, který je součástí aromatického
A 1 DŮKAZ ORGANICKÉ LÁTKY 5
 A 1 DŮKAZ ORGANICKÉ LÁTKY 5 Na rozdíl od anorganických sloučenin, jsou organické sloučeniny v naprosté většině méně odolné proti chemickým a fyzikálním zásahům. Působením teploty vyšší než 350 C nebo i
A 1 DŮKAZ ORGANICKÉ LÁTKY 5 Na rozdíl od anorganických sloučenin, jsou organické sloučeniny v naprosté většině méně odolné proti chemickým a fyzikálním zásahům. Působením teploty vyšší než 350 C nebo i
Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii
 Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Tlak vzduchu: Teplota vzduchu: Laboratorní cvičení č. Oddělování složek směsí
Datum: Jazykové gymnázium Pavla Tigrida, Ostrava-Poruba Název projektu: Podpora rozvoje praktické výchovy ve fyzice a chemii Tlak vzduchu: Teplota vzduchu: Laboratorní cvičení č. Oddělování složek směsí
Význam ovoce jako zdroje cenných látek ve stravě
 Metodické listy OPVK Význam ovoce jako zdroje cenných látek ve stravě Druhý stupeň ZŠ 9. VÝZNAM OVOCE JAKO ZDROJE CENNÝCH LÁTEK VE STRAVĚ Praktické cvičení pokus kategorie a vyžadující běžné vybavení Co
Metodické listy OPVK Význam ovoce jako zdroje cenných látek ve stravě Druhý stupeň ZŠ 9. VÝZNAM OVOCE JAKO ZDROJE CENNÝCH LÁTEK VE STRAVĚ Praktické cvičení pokus kategorie a vyžadující běžné vybavení Co
Sešit pro laboratorní práci z chemie
 Sešit pro laboratorní práci z chemie téma: Důkazové reakce sacharidů autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační číslo
Sešit pro laboratorní práci z chemie téma: Důkazové reakce sacharidů autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační číslo
Název: Barvy chromu. Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy
 Název: Barvy chromu Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, biologie Ročník: 3. Tématický celek: Systematická anorganická
Název: Barvy chromu Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, biologie Ročník: 3. Tématický celek: Systematická anorganická
Návod k laboratornímu cvičení. Kovy a elektrochemická(beketovova) řada napětí kovů
 Návod k laboratornímu cvičení Kovy a elektrochemická(beketovova) řada napětí kovů Úkol č. 1: Barvení plamene Pomůcky: kahan, zápalky, tuha upevněná ve verzatilce nebo platinový drátek Chemikálie: nasycené
Návod k laboratornímu cvičení Kovy a elektrochemická(beketovova) řada napětí kovů Úkol č. 1: Barvení plamene Pomůcky: kahan, zápalky, tuha upevněná ve verzatilce nebo platinový drátek Chemikálie: nasycené
Návody na pokusy SEG Chemie pro začátečníky 103.7250
 Návody na pokusy SEG Chemie pro začátečníky 103.720 OBSAH 1 2 3 4 6 7 8 9 10 11 12 13 14 1 16 17 18 Obsah sady... Látky potřebné pro některé pokusy... Příprava indikačních roztoků... Příprava a použití
Návody na pokusy SEG Chemie pro začátečníky 103.720 OBSAH 1 2 3 4 6 7 8 9 10 11 12 13 14 1 16 17 18 Obsah sady... Látky potřebné pro některé pokusy... Příprava indikačních roztoků... Příprava a použití
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
2.12 Vyvíjení CO 2 bublinky kolem nás. Projekt Trojlístek
 2. Vlastnosti látek a chemické reakce 2.12 Vyvíjení CO 2 bublinky kolem nás. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová
2. Vlastnosti látek a chemické reakce 2.12 Vyvíjení CO 2 bublinky kolem nás. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, organická chemie, biochemie, chemické výpočty Kvarta 2 hodiny týdně + 1x za 14 dní 1 hod laboratorní práce Školní tabule, interaktivní
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, organická chemie, biochemie, chemické výpočty Kvarta 2 hodiny týdně + 1x za 14 dní 1 hod laboratorní práce Školní tabule, interaktivní
Pracovní list číslo 01
 Téma Teplota plamene plynového kahanu Pracovní list číslo 01 Notebook NB, EdLab, termočlánek, plynový kahan 1. Proveď pokus a doplň tabulku: Oblast Teplota ( o C) 1 2 3 4 Postup práce: 1. Spustíme EdLab
Téma Teplota plamene plynového kahanu Pracovní list číslo 01 Notebook NB, EdLab, termočlánek, plynový kahan 1. Proveď pokus a doplň tabulku: Oblast Teplota ( o C) 1 2 3 4 Postup práce: 1. Spustíme EdLab
Sešit pro laboratorní práci z chemie
 Sešit pro laboratorní práci z chemie téma: Příprava oxidu měďnatého autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační číslo
Sešit pro laboratorní práci z chemie téma: Příprava oxidu měďnatého autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie a chemie registrační číslo
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, organická chemie, biochemie, chemické výpočty Kvarta 2 hodiny týdně + 1x za 14 dní 1 hod laboratorní práce Školní tabule, interaktivní
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, organická chemie, biochemie, chemické výpočty Kvarta 2 hodiny týdně + 1x za 14 dní 1 hod laboratorní práce Školní tabule, interaktivní
Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády. 46. ročník 2009/2010. OKRESNÍ KOLO kategorie D
 Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 46. ročník 2009/2010 OKRESNÍ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH TEORETICKÁ ČÁST (55 bodů) Úloha 1 Závislost rozpustnosti
Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 46. ročník 2009/2010 OKRESNÍ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH TEORETICKÁ ČÁST (55 bodů) Úloha 1 Závislost rozpustnosti
RUŠENÁ KRYSTALIZACE A SUBLIMACE
 LABORATORNÍ PRÁCE Č. 5 RUŠENÁ KRYSTALIZACE A SUBLIMACE KRYSTALIZACE PRINCIP Krystalizace je důležitý postup při získávání čistých tuhých látek z jejich roztoků. Tuhá látka se rozpustí ve vhodném rozpouštědle.
LABORATORNÍ PRÁCE Č. 5 RUŠENÁ KRYSTALIZACE A SUBLIMACE KRYSTALIZACE PRINCIP Krystalizace je důležitý postup při získávání čistých tuhých látek z jejich roztoků. Tuhá látka se rozpustí ve vhodném rozpouštědle.
VÝROBA UHLIČITANU SODNÉHO TEXT PRO UČITELE
 VÝROBA UHLIČITANU SODNÉHO TEXT PRO UČITELE Mgr. Jana Prášilová prof. RNDr. Jiří Kameníček, CSc. Olomouc, 2013 Obsah 1. Téma v učebnicích používaných na gymnáziích 2. Teoretické poznatky k problematice
VÝROBA UHLIČITANU SODNÉHO TEXT PRO UČITELE Mgr. Jana Prášilová prof. RNDr. Jiří Kameníček, CSc. Olomouc, 2013 Obsah 1. Téma v učebnicích používaných na gymnáziích 2. Teoretické poznatky k problematice
Návody na praktika z Cytologie verze 2015
 Návody na praktika z Cytologie verze 2015 Témata cvičení: 1. Úvodní cvičení, výpočty a příprava roztoků 2. Prvkové složení rostlinné buňky 3. Bílkoviny 4. Sacharidy 5. Lipidy, cholesterol, důkaz mýdla
Návody na praktika z Cytologie verze 2015 Témata cvičení: 1. Úvodní cvičení, výpočty a příprava roztoků 2. Prvkové složení rostlinné buňky 3. Bílkoviny 4. Sacharidy 5. Lipidy, cholesterol, důkaz mýdla
Ústřední komise Chemické olympiády. 55. ročník 2018/2019 ŠKOLNÍ KOLO. Kategorie C ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ)
 Ústřední komise Chemické olympiády 55. ročník 2018/2019 ŠKOLNÍ KOLO Kategorie C ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) PRAKTICKÁ ČÁST 40 BODŮ Autor RNDr. Jan Břížďala Gymnázium Třebíč RNDr. Jan Havlík, Ph.D.
Ústřední komise Chemické olympiády 55. ročník 2018/2019 ŠKOLNÍ KOLO Kategorie C ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) PRAKTICKÁ ČÁST 40 BODŮ Autor RNDr. Jan Břížďala Gymnázium Třebíč RNDr. Jan Havlík, Ph.D.
NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY. Ondřej Maca, Tereza Kudrnová
 NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY Ondřej Maca, Tereza Kudrnová HUSTÝ DÝM 1) pro koho: 1. ročník čtyřletého gymnázia 2) zařazení do učiva: vlastnosti látek; halogeny; pentely 3) pomůcky: zkumavka se zátkou,
NOVÉ NÁMĚTY PRO DEMONSTRAČNÍ POKUSY Ondřej Maca, Tereza Kudrnová HUSTÝ DÝM 1) pro koho: 1. ročník čtyřletého gymnázia 2) zařazení do učiva: vlastnosti látek; halogeny; pentely 3) pomůcky: zkumavka se zátkou,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
LP č. 2 - ALKOHOLY. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 26. 10. 2012. Ročník: devátý
 LP č. 2 - ALKOHOLY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 26. 10. 2012 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci si prakticky vyzkouší
LP č. 2 - ALKOHOLY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 26. 10. 2012 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci si prakticky vyzkouší
Vlastnosti kyseliny sírové
 Vlastnosti kyseliny sírové Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 10 minut Pomůcky a) chemikálie - kyselina sírová - voda - kostka cukru b)
Vlastnosti kyseliny sírové Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 10 minut Pomůcky a) chemikálie - kyselina sírová - voda - kostka cukru b)
Laboratorní cvičení manuál pro vyučujícího. Oxidace benzaldehydu, redukční účinky kyseliny mravenčí a příprava kyseliny acetylsalicylové
 Laboratorní cvičení manuál pro vyučujícího Oxidace benzaldehydu, redukční účinky kyseliny mravenčí a příprava kyseliny acetylsalicylové Před příchodem žáků do laboratoře je třeba připravit tyto chemikálie
Laboratorní cvičení manuál pro vyučujícího Oxidace benzaldehydu, redukční účinky kyseliny mravenčí a příprava kyseliny acetylsalicylové Před příchodem žáků do laboratoře je třeba připravit tyto chemikálie
Praktické ukázky analytických metod ve vinařství
 Praktické ukázky analytických metod ve vinařství Ing. Mojmír Baroň Stanovení v moštu Stanovení ph a veškerých titrovatelných kyselin Stanovení ph Princip: Hodnota ph je záporný dekadický logaritmus aktivity
Praktické ukázky analytických metod ve vinařství Ing. Mojmír Baroň Stanovení v moštu Stanovení ph a veškerých titrovatelných kyselin Stanovení ph Princip: Hodnota ph je záporný dekadický logaritmus aktivity
Opakování učiva organické chemie Smart Board
 Opakování učiva organické chemie Smart Board VY_52_INOVACE_200 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie ročník: 9 Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Opakování učiva organické chemie Smart Board VY_52_INOVACE_200 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie ročník: 9 Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Ústřední komise Chemické olympiády. 53. ročník 2016/2017. KRAJSKÉ KOLO kategorie C. ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) časová náročnost: 120 minut
 Ústřední komise Chemické olympiády 53. ročník 2016/2017 KRAJSKÉ KOLO kategorie C ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) časová náročnost: 120 minut Zadání praktické části krajského kola ChO kat. C 2016/2017
Ústřední komise Chemické olympiády 53. ročník 2016/2017 KRAJSKÉ KOLO kategorie C ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) časová náročnost: 120 minut Zadání praktické části krajského kola ChO kat. C 2016/2017
CHEMIE. Pracovní list č. 10 - žákovská verze Téma: Bílkoviny. Mgr. Lenka Horutová
 www.projektsako.cz CHEMIE Pracovní list č. 10 - žákovská verze Téma: Bílkoviny Lektor: Mgr. Lenka Horutová Projekt: Student a konkurenceschopnost Reg. číslo: CZ.1.07/1.1.07/03.0075 Teorie: Název proteiny
www.projektsako.cz CHEMIE Pracovní list č. 10 - žákovská verze Téma: Bílkoviny Lektor: Mgr. Lenka Horutová Projekt: Student a konkurenceschopnost Reg. číslo: CZ.1.07/1.1.07/03.0075 Teorie: Název proteiny
4.02 Důkaz bílkovin biuretovou reakcí. Projekt Trojlístek
 4. Přírodní látky: zdroje, vlastnosti a důkazy 4.02 Důkaz bílkovin biuretovou reakcí. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie
4. Přírodní látky: zdroje, vlastnosti a důkazy 4.02 Důkaz bílkovin biuretovou reakcí. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie
-ičelý -natý -ičitý - ečný (-ičný) -istý -ný -itý -ový
 1 Halogenidy dvouprvkové sloučeniny halogenů s jinými prvky atomy halogenů mají v halogenidech oxidační číslo -I 1) Halogenidy - názvosloví Podstatné jméno názvu je zakončeno koncovkou.. Zakončení přídavného
1 Halogenidy dvouprvkové sloučeniny halogenů s jinými prvky atomy halogenů mají v halogenidech oxidační číslo -I 1) Halogenidy - názvosloví Podstatné jméno názvu je zakončeno koncovkou.. Zakončení přídavného
P + D PRVKY Laboratorní práce
 Téma: Reakce sloučenin zinku P + D PRVKY Laboratorní práce Pozn: Výsledky úkolu 1 zapisujte až po 14 dnech. Úkol 4 provádějte pouze pod dohledem učitele. Úkol 1: Připravte 5 gramů bílé skalice. Bílá skalice
Téma: Reakce sloučenin zinku P + D PRVKY Laboratorní práce Pozn: Výsledky úkolu 1 zapisujte až po 14 dnech. Úkol 4 provádějte pouze pod dohledem učitele. Úkol 1: Připravte 5 gramů bílé skalice. Bílá skalice
2.11 Vlastnosti látek. (Skupenství, rozpustnost, hoření, rozklad) Projekt Trojlístek
 2. Vlastnosti látek a chemické reakce 2.11 Vlastnosti látek. (Skupenství, rozpustnost, hoření, rozklad) Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu
2. Vlastnosti látek a chemické reakce 2.11 Vlastnosti látek. (Skupenství, rozpustnost, hoření, rozklad) Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í LABORATORNÍ PRÁCE Č. 14 SRÁŽECÍ REAKCE
 LABORATORNÍ PRÁCE Č. 14 SRÁŽECÍ REAKCE PRINCIP Srážecí reakce je reakce, při níž se alespoň jeden z produktů vylučuje z reakční směsi ve formě tuhé fáze (sraženiny). A + (aq) + B - (aq) AB (s) (Reakce
LABORATORNÍ PRÁCE Č. 14 SRÁŽECÍ REAKCE PRINCIP Srážecí reakce je reakce, při níž se alespoň jeden z produktů vylučuje z reakční směsi ve formě tuhé fáze (sraženiny). A + (aq) + B - (aq) AB (s) (Reakce
Laboratorní cvičení manuál pro vyučujícího. Sublimace naftalenu, reakce aldehydů a ketonů
 Laboratorní cvičení manuál pro vyučujícího Sublimace naftalenu, reakce aldehydů a ketonů Před příchodem žáků do laboratoře je třeba připravit tyto chemikálie v odpovídající koncentraci: Naftalen, H 2O,
Laboratorní cvičení manuál pro vyučujícího Sublimace naftalenu, reakce aldehydů a ketonů Před příchodem žáků do laboratoře je třeba připravit tyto chemikálie v odpovídající koncentraci: Naftalen, H 2O,
Laboratorní práce z chemie č. Téma: S-prvky
 Autor: Mgr. Lenka Fišerová Škola: Gymnázium, Kadaň, 5. května 620, po. Vytvořeno: listopad 2012 Kód: VY_32_INOVACE_13_05Fis_ChLPVG Předmět: CHEMIE Ročník:2. ročník VG Téma: S prvky Cíl: Prakticky ověřit
Autor: Mgr. Lenka Fišerová Škola: Gymnázium, Kadaň, 5. května 620, po. Vytvořeno: listopad 2012 Kód: VY_32_INOVACE_13_05Fis_ChLPVG Předmět: CHEMIE Ročník:2. ročník VG Téma: S prvky Cíl: Prakticky ověřit
Vzdělávací oblast: Člověk a příroda. Vyučovací předmět: Chemie. Třída: kvarta. Očekávané výstupy. Poznámky. Přesahy. Průřezová témata.
 Vzdělávací oblast: Člověk a příroda Vyučovací předmět: Chemie Třída: kvarta Očekávané výstupy Vysvětlí pojmy oxidace, redukce, oxidační činidlo, redukční činidlo Rozliší redoxní rovnice od neredoxních
Vzdělávací oblast: Člověk a příroda Vyučovací předmět: Chemie Třída: kvarta Očekávané výstupy Vysvětlí pojmy oxidace, redukce, oxidační činidlo, redukční činidlo Rozliší redoxní rovnice od neredoxních
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
LABORATOŘ ANALÝZY POTRAVIN A PŘÍRODNÍCH PRODUKTŮ
 LABORATOŘ ANALÝZY POTRAVIN A PŘÍRODNÍCH PRODUKTŮ Stanovení monosacharidů a oligosacharidů (metoda titrace po inverzi) Garant úlohy: Ing. Lucie Drábová, Ph.D. OBSAH Základní požadované znalosti pro vstupní
LABORATOŘ ANALÝZY POTRAVIN A PŘÍRODNÍCH PRODUKTŮ Stanovení monosacharidů a oligosacharidů (metoda titrace po inverzi) Garant úlohy: Ing. Lucie Drábová, Ph.D. OBSAH Základní požadované znalosti pro vstupní
Úloha 1: Kovy v osmisměrce
 Úloha 1: Kovy v osmisměrce Zadání: V osmisměrce je ukryto ve všech směrech 12 kovů, z nichž pouze jeden (umístěný vodorovně ve středu osmisměrky) je.. Po vyškrtání názvů kovů (v legendě zapsány pouze jejich
Úloha 1: Kovy v osmisměrce Zadání: V osmisměrce je ukryto ve všech směrech 12 kovů, z nichž pouze jeden (umístěný vodorovně ve středu osmisměrky) je.. Po vyškrtání názvů kovů (v legendě zapsány pouze jejich
Laboratorní cvičení manuál pro vyučujícího. Barevné reakce fenolů, reakce glycerolu
 Laboratorní cvičení manuál pro vyučujícího Barevné reakce fenolů, reakce glycerolu Před příchodem žáků do laboratoře je třeba připravit tyto chemikálie v odpovídající koncentraci: Roztok fenolu 1%, roztok
Laboratorní cvičení manuál pro vyučujícího Barevné reakce fenolů, reakce glycerolu Před příchodem žáků do laboratoře je třeba připravit tyto chemikálie v odpovídající koncentraci: Roztok fenolu 1%, roztok
Reálné gymnázium a základní škola města Prostějova Školní vzdělávací program pro ZV Ruku v ruce
 6 ČLOVĚK A PŘÍRODA UČEBNÍ OSNOVY 6. 2 Chemie Časová dotace 8. ročník 2 hodiny 9. ročník 2 hodiny Celková dotace na 2. stupni je 4 hodiny. Charakteristika: Vyučovací předmět chemie vede k poznávání chemických
6 ČLOVĚK A PŘÍRODA UČEBNÍ OSNOVY 6. 2 Chemie Časová dotace 8. ročník 2 hodiny 9. ročník 2 hodiny Celková dotace na 2. stupni je 4 hodiny. Charakteristika: Vyučovací předmět chemie vede k poznávání chemických
4.01 Barevné reakce manganistanu draselného. Projekt Trojlístek
 4. Přírodní látky: zdroje, vlastnosti a důkazy 4.01 Barevné reakce manganistanu draselného. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie
4. Přírodní látky: zdroje, vlastnosti a důkazy 4.01 Barevné reakce manganistanu draselného. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie
CHEMIE Pracovní list č.3 žákovská verze Téma: Acidobazická titrace Mgr. Lenka Horutová Student a konkurenceschopnost
 www.projektsako.cz CHEMIE Pracovní list č.3 žákovská verze Téma: Acidobazická titrace Lektor: Projekt: Reg. číslo: Mgr. Lenka Horutová Student a konkurenceschopnost CZ.1.07/1.1.07/03.0075 Teorie: Základem
www.projektsako.cz CHEMIE Pracovní list č.3 žákovská verze Téma: Acidobazická titrace Lektor: Projekt: Reg. číslo: Mgr. Lenka Horutová Student a konkurenceschopnost CZ.1.07/1.1.07/03.0075 Teorie: Základem
2. Chemický turnaj. kategorie starší žáci Teoretická část. Řešení úloh
 2. Chemický turnaj kategorie starší žáci 31. 5. 2013 Teoretická část Řešení úloh Téma: Oxidy celkem 29 bodů 1. Příprava oxidů Rovnice:...S + O 2 SO 2... Název oxidu:...siřičitý... rovnice 2 b. Rovnice:
2. Chemický turnaj kategorie starší žáci 31. 5. 2013 Teoretická část Řešení úloh Téma: Oxidy celkem 29 bodů 1. Příprava oxidů Rovnice:...S + O 2 SO 2... Název oxidu:...siřičitý... rovnice 2 b. Rovnice:
