AFINITOR V LÉČBĚ METASTATICKÉHO RENÁLNÍHO KARCINOMU
|
|
|
- Lukáš Zeman
- před 9 lety
- Počet zobrazení:
Transkript
1 NÁDORY LEDVIN A MOČOVÉHO MĚCHÝŘE 11 AFINITOR V LÉČBĚ METASTATICKÉHO RENÁLNÍHO KARCINOMU Voženílková K. Úvod V srpnu 2009 byl na základě výsledků randomizované placebem kontrolované studie fáze III registrován Evropskou lékovou agenturou (a krátce předtím i americkou FDA) přípravek AFINITOR obsahující léčivou látku everolimus. AFINITOR je indikován k léčbě pacientů s pokročilým renálním karcinomem, u kterých došlo k progresi onemocnění během VEGF- cílené terapie nebo po ní. Afinitor je prvním a dosud jediným léčivým přípravkem, u kterého byla na základě výsledků studie fáze III prokázána účinnost v 2. a dalších liniích léčby pacientů s metastatickým renálním karcinomem, jejichž onemocnění progredovalo po předchozí VEGF- cílené léčbě. Cílem tohoto sdělení je podat základní informace o mechanizmu účinku everolimu, jeho farmakokinetických vlastnostech, shrnout klinické zkušenosti s přípravkem a zároveň podat stručný přehled o možných nežádoucích účincích a vhodných způsobech jejich řešení. Mechanizmus účinku Everolimus je selektivním inhibitorem mtor (mammalian target of rapamycin). mtor je klíčová serin/ threonin kináza, jejíž aktivita je u mnoha lidských nádorů zvýšená. Dráha mtor reaguje citlivě na signály, jako jsou růstové faktory (VEGF, PDGF, EGF, IGF), hormony, nutrienty (ATP, glukóza, aminokyseliny) a reaguje též na stres. K signální trans dukci dochází zejména prostřednictvím dráhy PI3K- Akt. Po aktivaci mtor dochází kaskádovitě k aktivaci dvou klíčových proteinů: S6K1 (ribozomální protein-s6- kinázy) a 4EBP- 1 (vazebný protein pro eukaryotický iniciační faktor) s následným zvýšením translace specifických mrna. Tím dochází ke zvýšené syntéze proteinů zapojených do procesů buněčného růstu a proliferace, angio geneze a buněčného metabolizmu. Everolimus se váže na intracelulární protein FKBP- 12 a tvoří komplex, který inhibuje aktivitu mtor komplexu- 1 (mtorc1). Tento komplex blokuje další procesy v signalizační kaskádě, jako jsou fosforylace S6K1 a 4E- BP1 zprostředkované mtor. Tím zabrání aktivaci těchto proteinů. Everolimus svou interferencí s proteiny snižuje tvorbu VEGF, který potencuje nádorové angiogenetické procesy, inhibuje růst a proliferaci nádorových buněk, endoteliálních buněk, fibroblastů a buněk hladkého svalstva krevních cév a navozuje apoptózu nádorových buněk. Farmakokinetické vlastnosti Afinitor se užívá perorálně v dávce 10 mg jednou denně, pro případ potřeby snížení dávky je k dispozici i síla 5 mg. Maximální koncentrace (C max ) je dosaženo přibližně za 1 hodinu po užití. Vazba na plazmatické proteiny je zhruba 74%. Everolimus je z velké míry metabolizován, a to zejména cytochromovým enzymem P450 3A4 za vzniku hydroxylovaných a demetylovaných metabolitů. Průměrný eliminační poločas činí 30 hodin. U pacientů se středně těžkou poruchou funkce jater dochází ke zdvojnásobení AUC, doporučuje se tedy podávání nižší dávky (5 mg). Vliv těžkého poškození funkce jater nebyl hodnocen. U pacientů s poruchou funkce ledvin a u starších pacientů nebylo pozorováno významné ovlivnění farmakokinetických parametrů everolimu. Údaje o interakcích Vzhledem k tomu, že je everolimus substrátem CYP3A4 a PgP, může dojít k interferenci s jejich inhibitory nebo induktory. Látky, které jsou inhibitory CYP3A4 a PgP (např. ketokonazol, itrakonazol, klarithromycin, nefazodon, ritonavir, indinavir), mohou zvyšovat koncentraci everolimu v krvi, naopak induktory CYP3A4 a PgP (např. rifampicin, karbamazepin, fenobarbital, fenytoin, třezalka tečkovaná) mohou koncentraci everolimu snižovat. Užívání everolimu může ovlivnit imunitní odpověď na očkování a očkování může být méně účinné. K očkování by neměly být používány živé vakcíny [1]. Klinické zkušenosti Design pivotní klinické studie Registrace přípravku v dané indikaci byla schválena na základě výsledků multicentrické randomizované dvo-
2 12 NÁDORY LEDVIN A MOČOVÉHO MĚCHÝŘE jitě slepé studie fáze III porovnávající everolimus v dávce 10 mg za den a placebo u pacientů s metastazujícím renálním karcinomem (mrcc), u kterých došlo k progresi onemocnění při antiangiogenní léčbě tyrozinkinázovými inhibitory nebo po ní (STUDIE RECORD- 1). Do studie byli zařazeni dospělí pacienti s mrcc se světlebuněčnou složkou, u kterých došlo k progresi onemocnění po předchozí léčbě tyrozinkinázovými inhibitory (VEGFR- TKI) sunitinibem, sorafenibem nebo oběma těmito léky podávanými postupně, přičemž byla povolena také předchozí léčba bevacizumabem a cytokiny. Jednalo se o tzv. cross- over design, to znamená, že pacienti v placebové větvi, u kterých došlo k progresi onemocnění, byli převáděni na léčbu everolimem. Klíčovými vstupními kritérii byly přítomnost měřitelné léze dle RECIST kritérií a Karnofského výkonostní skóre 70 %. Pacienti byli stratifikováni do prognostických skupin dle MSKCC kritérií (nízké vs střední vs vysoké riziko) a podle předchozí protinádorové léčby (léčba jedním vs dvěma VEGFR- TKI). Celkově bylo randomizováno 416 pacientů v poměru 2 : 1 buď do skupiny léčené everolimem (n = 272), nebo do skupiny užívající placebo (n = 138). Všichni pacienti dostávali nejlepší podpůrnou léčbu. Obě ramena byla dobře vyvážená s ohledem na vstupní charakteristiky: průměrný věk, výkonostní stav, riziko dle MSKCC kritérií a předchozí léčbu. Primárním cílem bylo přežití bez progrese onemocnění (PFS) dokumentované radiologicky pomocí RECIST kritérií. Sekundární cíle studie zahrnovaly míru objektivní odpovědi, celkové přežívání, bezpečnost léčby, kvalitu života a symptomy související s onemocněním. Design studie je znázorněn na obrázku (obr. 1) [1,3]. Výsledky studie PFS podle kritérií RECIST hodnocený nezávislou centrální komisí byl statisticky významně delší u pacientů léčených everolimem oproti pacientům užíva- n = 416 STRATIFIKACE 2 : 1 Afinitor + BSC (n = 277) (ASCO 2008) Obr. 1. Design pivotní studie RECORD- 1 porovnávající účinnost everolimu oproti placebu u pacientů, jejichž onemocnění progredovalo po předchozí léčbě VEGFR- TKI.
3 NÁDORY LEDVIN A MOČOVÉHO MĚCHÝŘE 13 Tab. 1. Prospěch z léčby zaznamenán při hodnocení centrální nezávislou komisí i při lokálním hodnocení zkoušejícími a napříč všemi rizikovými skupinami [1]. Populace n Afinitor n = 277 Placebo n = 139 Poměr rizik (95% CI) p-hodnota medián přežití bez progrese onemocnění (měsíce) (95% CI) Primární analýza všichni (zaslepená, nezávislá centrální hodnotící komise) 416 4,9 (4,0 5,5) 1,9 (1,8 1,9) 0,33 (0,25 0,43) < 0,0001 Podpůrná analýza všichni (lokální hodnocení zkoušejícím) 416 5,5 (4,6 5,8) 1,9 (1,8 2,2) 0,32 (0,25 0,41) < 0,0001 MSKCC prognostické skóre (zaslepená nezávislá centrální hodnotící komise) příznivé riziko 120 5,8 (4,0 7,4) 1,9 (1,9 2,8) 0,31 (0,19 0,50) < 0,0001 střední riziko 235 4,5 (3,8 5,5) 1,8 (1,8 1,9) 0,32 (0,22 0,44) < 0,0001 vysoké riziko 61 3,6 (1,9 4,6) 1,8 (1,8 3,6) 0,44 (0,22 0,85) 0,007 jícím placebo: 4,9 měsíce vs 1,9 měsíce, se statisticky významným 67% snížením rizika progrese nebo úmrtí (HR = 0,33; 95% CI [0,25; 0,43]; p < 0,0001). Šestiměsíční míra přežití bez progrese onemocnění byla 36 % ve větvi léčené přípravkem Afinitor a 9 % v placebové větvi (viz obr. 2) [1,2]. Na základě Kaplan- Meierovy analýzy byla u pacientů užívajících everolimus pravděpodobnost přežití bez progrese onemocnění v 10. měsíci léčby 25 % [4]. Prospěch z léčby everolimem byl zaznamenán ve všech podskupinách pacientů (předem definovaných podle MSKCC kritérií, předchozí léčby, věku a pohlaví) (viz tab. 1). Potvrzené objektivní odpovědi nádoru (tj. úplná odpověď (CR) + částečná odpověď (PR)) byly pozorovány u 2 % pacientů léčených přípravkem Afinitor, zatímco u pacientů užívajících placebo nebyla zaznamenána žádná odpověď. Prospěch z přežití bez progrese onemocnění tedy odráží primárně populaci pacientů se stabilizací onemocnění (SD), což odpovídá 67 % pacientů léčených přípravkem Afinitor. Vzhledem ke cross- over designu nebyl zaznamenán statisticky významný rozdíl v celkovém přežití (Afinitor: 14,8 měsíců vs placebo: 14,4 měsíce; HR = 0,87; 95% CI: [0,65; 1,17]; p = 0,177) (celkem 80 % pacientů progredujících na placebu bylo převedeno na léčbu everolimem) [1,3,4]. Prediktivní a prognostické faktory Nejsou známy. Bezpečnost a snášenlivost přípravku Nejčastějšími nežádoucími účinky zaznamenanými v klinické studii fáze III byly stomatitida, kožní vyrážky, průjem, nauzea, zvracení, únava, astenie, infekce, změny krevního obrazu (anémie, leukopenie, neutropenie, trombocytopenie), hypertenze, kašel, pneumonitida a metabolické změny (hyperglykemie, hypercholesterolemie, hypertriglyceridemie). Toxicita stupně se vyskytovala vzácně. Jednalo se zejména o případy stomatitidy, hyperglykemie, hypercholesterolemie, infekcí a pneumonitidy. V klinické studii RECORD- 1 byla léčba ukončena pro nežádoucí účinky u 7 % pacientů [1]. Kontraindikace Kontraindikací podávání přípravku Afinitor je přecitlivělost na everolimus, na jiné deriváty rapamycinu nebo na kteroukoli pomocnou látku [1]. Doporučení u vybraných nežádoucích účinků Níže jsou uvedena doporučení pro zvládání ně kterých vybraných nežádoucích účinků.
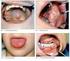
4 14 NÁDORY LEDVIN A MOČOVÉHO MĚCHÝŘE % Afinitor (n = 277) Obr. 2. Výsledky studie RECORD- 1: statisticky významné prodloužení PFS v rameni s everolimem (4,9 měsíce) oproti placebu (1,9 měsíce). Šestiměsíční míra přežití bez progrese onemocnění byla 36 % ve větvi s everolimem a 9 % v placebové větvi. Neinfekční pneumonitida Jedná se o nežádoucí účinek, který je skupinovým účinkem derivátů rapamycinu včetně everolimu. O diagnóze je třeba uvažovat při nespecifických příznacích, jako jsou hypoxie, pleurální výpotek, kašel a dušnost při současném vyloučení jiných příčin. U pacientů s radiologickými změnami indikujícími neinfekční pneumonitidu a zároveň s minimálními nebo žádnými příznaky je možno pokračovat v léčbě bez úpravy dávkování a není nezbytná žádná specifická léčba. Při výskytu středně závažných příznaků je třeba zvážit přerušení léčby, dokud se příznaky neupraví, a může být též indikováno podání kortikosteroidů. Podávání přípravku Afinitor lze znovu zahájit nižší dávkou (5 mg). U pacientů se závažnými projevy je třeba přerušit léčbu a může být indikováno podání kortikosteroidů až do vymizení klinických příznaků. V závislosti na klinickém stavu pacienta může být léčba znovu zahájena dávkou 5 mg [1]. Infekce Everolimus má imunosupresivní vlastnosti, a pacienti tak mohou být náchylnější k infekcím, především oportunními patogeny. Preexistující infekce by měly být vyléčeny ještě před zahájením léčby. Při podezření na infekci je třeba zahájit vhodnou antiinfekční léčbu. Při diagnóze systémové invazivní plísňové infekce musí být léčba trvale zastavena a je nezbytné zahájit vhodnou antimykotickou terapii. Při mírných příznacích (1. stupně) není nutná úprava dávky, při středně závažných příznacích (2. a 3. stupně) se doporučuje vysazení everolimu a jeho opětovné nasazení v nižší dávce (5 mg) po úpravě příznaků. Při závažných příznacích (4. stupně) se doporučuje ukončení léčby [1,5]. Stomatitida Doporučuje se lokální léčba. K výplachům by se měly užívat ústní vody bez obsahu alkoholu nebo 0,9% roztok NaCl, popř. lokální analgetika nebo lo-
5 NÁDORY LEDVIN A MOČOVÉHO MĚCHÝŘE 15 kální kortikosteroidy. Neměly by se provádět výplachy úst roztoky obsahujícími alkohol nebo peroxid. Antimykotika by neměla být použita dříve, než je diagnostikována plísňová infekce. Při mírných příznacích je možno pokračovat v léčbě přípravkem Afinitor bez úpravy dávkování. Při středně těžkých nebo těžkých příznacích se doporučuje snížení dávky na 5 mg, popř. dočasné vysazení. Po vymizení příznaků je možno zahájit léčbu v dávce 5 mg [1,5]. Popis léčiva Afinitor obsahuje léčivou látku everolimus. Přípravek je dodáván ve formě tablet o síle 5 mg a 10 mg. Pomocnými látkami jsou: butylhydroxytoluen, magnesium- stearát, laktóza, hypromelóza a krospovidon typ A. Dávkování Doporučená dávka Afinitoru je 10 mg jednou denně, per os. Léčba by měla pokračovat tak dlouho, dokud je pozorován klinický přínos nebo dokud se neobjeví nepřijatelné příznaky toxicity. K úpravě dávkování se doporučuje přistoupit z důvodu nežádoucích účinků. Při závažných nežádoucích účincích se doporučuje snížit dávkování nebo může být léčba dočasně přerušena (např. na jeden týden) s následným znovuzahájením dávkou 5 mg denně. U starších pacientů ( 65 let) a u pacientů s poruchou funkce ledvin není třeba snižovat dávkování. U pacientů se středně těžkým poškozením jater by měla být dávka snížena na 5 mg denně a u pacientů s těžkým poškozením jater se podávání nedoporučuje, protože everolimus nebyl u těchto pacientů hodnocen. Způsob podání Afinitor se užívá perorálně, jedenkrát denně, vždy ve stejnou denní dobu, důsledně vždy s jídlem nebo bez jídla [1]. Závěr Afinitor je zatím jediným lékem, u kterého byla prokázána účinnost ve druhé a dalších liniích léčby metastatického karcinomu ledviny po selhání předchozí léčby tyrozinkinázovými inhibitory. Pacienty je dobře snášen a nežádoucí účinky jsou ve většině případů mírné, přechodné a dobře zvládnutelné. Přípravek Afinitor je jako lék volby v sekvenční léčbě metastatického karcinomu ledviny po předchozím selhání VEGFR- TKI shodně doporučován mezinárodními odbornými společnostmi i Českou onkologickou společností ČLS JEP. Odkazy na internetové zdroje a informační linka držitele rozhodnutí o registraci / modules/ medication/ search.php / / odbornici/ info_praxe/ standardy.php?t=1 / index.asp / # Informační linka výrobce léčiva, Novartis: Literatura 1. Afinitor 5 mg a 10 mg, tablety. Souhrn údajů o přípravku (schváleno 4/ 2010). 2. Oudard S, Medioni J, Ayllon J et al. Everolimus (RAD001): an mtor inhibitor for the treatment of metastatic renal cell carcinoma. Expert Rev Anticancer Ther 2009; 9(6): Motzer RJ, Escudier B, Oudard S et al. RECORD- 1 Study Group. Efficacy of everolimus in advanced renal cell carcinoma: a double-blind, randomised, placebo- controlled phase III trial. Lancet 2008; 372(9637): Motzer RJ, Escudier B, Oudard S et al. RECORD- 1 Study Group. Phase 3 Trial of Everoliomus for Metastatic Renal Cell Carcinoma Final Results and Analysis of Prognostic Factors. Cancer 2010; 116 (18): Chan HY, Grossman AB, Bukowski RM. Everolimus in the Treatment of Renal Cell Carcinoma and Neuroendocrine Tumors. Adv Ther 2010; 27(8): MU Dr. Kateřina Voženílková Medicínské oddělení společnosti Novartis s. r. o. Praha
Analýza dat z klinického registru RenIS České onkologické společnosti ČLS JEP shrnutí výsledků pro elektronický report
 Účinnost a bezpečnost přípravku Afinitor (everolimus) v léčbě pacientů s pokročilým karcinomem ledviny v podmínkách reálné klinické praxe v České republice Analýza dat z klinického registru RenIS České
Účinnost a bezpečnost přípravku Afinitor (everolimus) v léčbě pacientů s pokročilým karcinomem ledviny v podmínkách reálné klinické praxe v České republice Analýza dat z klinického registru RenIS České
TORISEL. Kocák I. NÁDORY LEDVIN A MOČOVÉHO MĚCHÝŘE 43 O O
 NÁDRY LEDVIN A MČVÉH MĚCHÝŘE 43 TRISEL Kocák I. Úvod Torisel (temsirolimus, CCI- 779) patří do skupiny látek, tzv. m- TR inhibitorů. Temsirolimus má dva základní mechanizmy účinku: kontroluje buněčné dělení
NÁDRY LEDVIN A MČVÉH MĚCHÝŘE 43 TRISEL Kocák I. Úvod Torisel (temsirolimus, CCI- 779) patří do skupiny látek, tzv. m- TR inhibitorů. Temsirolimus má dva základní mechanizmy účinku: kontroluje buněčné dělení
Léčba mrcc. Jindřich Fínek Alena Dvořáková FN a LF UK v Plzni
 Léčba mrcc Jindřich Fínek Alena Dvořáková FN a LF UK v Plzni Možnosti systémové léčby Látka Název Registrace EU Účinek Indikace sunitinib Sutent 01/2007 VEGFR-TKI 1.Linie (dobrá a středně d.p.) sorafenib
Léčba mrcc Jindřich Fínek Alena Dvořáková FN a LF UK v Plzni Možnosti systémové léčby Látka Název Registrace EU Účinek Indikace sunitinib Sutent 01/2007 VEGFR-TKI 1.Linie (dobrá a středně d.p.) sorafenib
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Afinitor 5 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 5 mg everolimusum. Pomocné látky Jedna tableta obsahuje 149
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Afinitor 5 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 5 mg everolimusum. Pomocné látky Jedna tableta obsahuje 149
TYVERB: BIOHORMONÁLNÍ LÉČBA V 1. LINII POKROČILÉHO HER2 POZITIVNÍHO KARCINOMU PRSU
 NÁDORY PRSU 49 TYVERB: BIOHORMONÁLNÍ LÉČBA V 1. LINII POKROČILÉHO HER2 POZITIVNÍHO KARCINOMU PRSU Nosek M. Úvod Přípravek Tyverb se již více než rok používá v léčbě pokročilého HER2 (ErbB2) pozitivního
NÁDORY PRSU 49 TYVERB: BIOHORMONÁLNÍ LÉČBA V 1. LINII POKROČILÉHO HER2 POZITIVNÍHO KARCINOMU PRSU Nosek M. Úvod Přípravek Tyverb se již více než rok používá v léčbě pokročilého HER2 (ErbB2) pozitivního
RENIS - Afinitor. Klinický registr pacientů s renálním karcinomem. Stav registru k datu
 RENIS - Afinitor Klinický registr pacientů s renálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr. Zbyněk
RENIS - Afinitor Klinický registr pacientů s renálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr. Zbyněk
AFINITOR (EVEROLIMUS) V LÉČBĚ POKROČILÉHO HR+/HER2 KARCINOMU PRSU
 NÁDORY RSU 11 AFINITOR (EVOLIMUS) V LÉČBĚ OKROČILÉHO HR+/H2 KARCINOMU RSU Voženílková K. Úvod V červenci 2012 byla na základě výsledků randomizované studie fáze III (Bolero-2) schválena nová indikace přípravku
NÁDORY RSU 11 AFINITOR (EVOLIMUS) V LÉČBĚ OKROČILÉHO HR+/H2 KARCINOMU RSU Voženílková K. Úvod V červenci 2012 byla na základě výsledků randomizované studie fáze III (Bolero-2) schválena nová indikace přípravku
Možnosti léčby CRPC s časem přibývají
 Možnosti léčby CRPC s časem přibývají Jana Katolická Onkologicko-chirurgické oddělení Fakultní nemocnice u Sv. Anny Mnoho studií - jen čtyři nové léky Enzalutamid Abirateron + prednison Cabazitaxel Radium-223
Možnosti léčby CRPC s časem přibývají Jana Katolická Onkologicko-chirurgické oddělení Fakultní nemocnice u Sv. Anny Mnoho studií - jen čtyři nové léky Enzalutamid Abirateron + prednison Cabazitaxel Radium-223
Sekvenční bioterapie pokročilého karcinomu ledviny
 Sekvenční bioterapie pokročilého karcinomu ledviny MUDr. Milada Zemanová, Ph.D. Onkologická klinika 1. LF UK a VFN, Praha Úvod V incidenci karcinomu ledviny zaujímá Česká republika 1. místo na světě vysvětlení
Sekvenční bioterapie pokročilého karcinomu ledviny MUDr. Milada Zemanová, Ph.D. Onkologická klinika 1. LF UK a VFN, Praha Úvod V incidenci karcinomu ledviny zaujímá Česká republika 1. místo na světě vysvětlení
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Afinitor 2,5 mg tablety Afinitor 5 mg tablety Afinitor 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Afinitor 2,5 mg tablety Jedna tableta
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Afinitor 2,5 mg tablety Afinitor 5 mg tablety Afinitor 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Afinitor 2,5 mg tablety Jedna tableta
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Afinitor 2,5 mg tablety Afinitor 5 mg tablety Afinitor 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Afinitor 2,5 mg tablety Jedna tableta
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Afinitor 2,5 mg tablety Afinitor 5 mg tablety Afinitor 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Afinitor 2,5 mg tablety Jedna tableta
Kasuistika onkologický pacient
 Kasuistika onkologický pacient U pana P.P., 68 letého muže, byl diagnostikován metastazující nádor ledviny. Dle provedených vyšetření byly kromě primárního nádoru pravé ledviny diagnostikovány i mnohočetné
Kasuistika onkologický pacient U pana P.P., 68 letého muže, byl diagnostikován metastazující nádor ledviny. Dle provedených vyšetření byly kromě primárního nádoru pravé ledviny diagnostikovány i mnohočetné
R.A. Burger, 1 M.F. Brady, 2 J. Rhee, 3 M.A. Sovak, 3 H. Nguyen, 3 M.A. Bookman 4
 NEZÁVISLÉ RADIOLOOGICKÉ HODNOCENÍ STUDIE FÁZE III GOG218 S BEVACIZUMABEM (BEV) V PRIMÁRNÍ LÉČBĚ POKROČILÉHO EPITELOVÉHO NÁDORU VAJEČNÍKŮ, PRIMÁRNÍHO NÁDORU PERITONEA NEBO VEJCOVODŮ. R.A. Burger, 1 M.F.
NEZÁVISLÉ RADIOLOOGICKÉ HODNOCENÍ STUDIE FÁZE III GOG218 S BEVACIZUMABEM (BEV) V PRIMÁRNÍ LÉČBĚ POKROČILÉHO EPITELOVÉHO NÁDORU VAJEČNÍKŮ, PRIMÁRNÍHO NÁDORU PERITONEA NEBO VEJCOVODŮ. R.A. Burger, 1 M.F.
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 tel. 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz
 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 tel. 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním pojištění,
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 tel. 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním pojištění,
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Afinitor 2,5 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 2,5 mg everolimusum. Pomocná látka se známým účinkem: Jedna
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Afinitor 2,5 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 2,5 mg everolimusum. Pomocná látka se známým účinkem: Jedna
Celkové shrnutí vědeckého hodnocení přípravku Atacand Plus a související názvy (viz Příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 14 Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 14 Vědecké závěry Celkové
Pomocná látka se známým účinkem: Jedna tableta obsahuje 75 mg monohydrátu laktosy. Úplný seznam pomocných látek viz bod 6.1.
 sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
Lékový registr ALIMTA
 Lékový registr Pravidelný report Maligní pleurální mezoteliom (MPM) Stav registru k datu 19. 10. 2015 Pneumoonkologická centra zapojená v projektu Alimta 1. FN Brno Jihlavská 20, 625 00 Brno - Bohunice
Lékový registr Pravidelný report Maligní pleurální mezoteliom (MPM) Stav registru k datu 19. 10. 2015 Pneumoonkologická centra zapojená v projektu Alimta 1. FN Brno Jihlavská 20, 625 00 Brno - Bohunice
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Cílená léčba metastatického renálního karcinomu, možnosti sekvenční léčby: současný pohled
 115 Cílená léčba metastatického renálního karcinomu, možnosti sekvenční léčby: současný pohled MUDr. Alexandr Poprach, Ph.D. 1, doc. MUDr. Tomáš Büchler, Ph.D. 2, MUDr. Radek Lakomý, Ph.D. 1, MUDr. Jiří
115 Cílená léčba metastatického renálního karcinomu, možnosti sekvenční léčby: současný pohled MUDr. Alexandr Poprach, Ph.D. 1, doc. MUDr. Tomáš Büchler, Ph.D. 2, MUDr. Radek Lakomý, Ph.D. 1, MUDr. Jiří
RENIS - Votrient. Klinický registr pacientů s renálním karcinomem. Stav registru k datu 26. 3. 2012
 RENIS - Votrient Klinický registr pacientů s renálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr. Zbyněk
RENIS - Votrient Klinický registr pacientů s renálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr. Zbyněk
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Bezpečnost a účinnost přípravku Neoclarityn 5 mg potahované tablety u dětí mladších 12 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
 1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Votubia 2,5 mg tablety Votubia 5 mg tablety Votubia 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Votubia 2,5 mg tablety Jedna tableta obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Votubia 2,5 mg tablety Votubia 5 mg tablety Votubia 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Votubia 2,5 mg tablety Jedna tableta obsahuje
Systémová léčba lokálně pokročilých a metastatických GEP-NET
 Systémová léčba lokálně pokročilých a metastatických GEP-NET Jiří Tomášek Masarykův onkologický ústav, Brno Vzácné nádory a raritní stavy v oblasti GITu Seminář pro onkology, gastroenterology,radiology
Systémová léčba lokálně pokročilých a metastatických GEP-NET Jiří Tomášek Masarykův onkologický ústav, Brno Vzácné nádory a raritní stavy v oblasti GITu Seminář pro onkology, gastroenterology,radiology
Desloratadin STADA 5 mg jsou modré, kulaté, bikonvexní potahované tablety o průměru přibližně 6,5 mm.
 Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Biologická léčba karcinomu ledviny
 111 Biologická léčba karcinomu ledviny MUDr. Milada Zemanová, Ph.D. Onkologická klinika 1. LF UK a VFN, Praha Základem léčby lokalizovaného karcinomu ledviny je operace. Léčba pokročilých a metastazujících
111 Biologická léčba karcinomu ledviny MUDr. Milada Zemanová, Ph.D. Onkologická klinika 1. LF UK a VFN, Praha Základem léčby lokalizovaného karcinomu ledviny je operace. Léčba pokročilých a metastazujících
Červené potahované tablety oválného tvaru s vyraženým nápisem Pfizer na jedné straně a 1 XNB na druhé straně.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
Nechirurgická léčba metastazujícího karcinomu ledviny
 Přehledové články 63 Nechirurgická léčba metastazujícího karcinomu ledviny MUDr. Milada Zemanová, Ph.D. Onkologická klinika 1. LF UK a VFN, Katedra klinické onkologie IPVZ Praha Léčba pokročilých a metastazujících
Přehledové články 63 Nechirurgická léčba metastazujícího karcinomu ledviny MUDr. Milada Zemanová, Ph.D. Onkologická klinika 1. LF UK a VFN, Katedra klinické onkologie IPVZ Praha Léčba pokročilých a metastazujících
STIVARGA (REGORAFENIB)
 NÁDORY TLUSTÉHO STŘEVA A REKTA 31 STIVARGA (REGORAFENIB) Kolektiv autorů Úvod Regorafenib (Stivarga ) je nový perorální multikinázový inhibitor, který byl v roce 2013 registrován pro léčbu dospělých pacientů
NÁDORY TLUSTÉHO STŘEVA A REKTA 31 STIVARGA (REGORAFENIB) Kolektiv autorů Úvod Regorafenib (Stivarga ) je nový perorální multikinázový inhibitor, který byl v roce 2013 registrován pro léčbu dospělých pacientů
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Celkové závěry vědeckého hodnocení přípravku Femara a souvisejících názvů (viz příloha I)
 Příloha II Vědecké závěry a zdůvodnění potřebných úprav v souhrnu údajů o přípravku, označení na obalu a příbalové informaci předkládané Evropskou agenturou pro léčivé přípravky 7 Vědecké závěry Celkové
Příloha II Vědecké závěry a zdůvodnění potřebných úprav v souhrnu údajů o přípravku, označení na obalu a příbalové informaci předkládané Evropskou agenturou pro léčivé přípravky 7 Vědecké závěry Celkové
Lékový registr ALIMTA
 Lékový registr Pravidelný report Maligní pleurální mezoteliom (MPM) Stav registru k datu 31. 3. 2014 Pneumoonkologická centra zapojená v projektu Alimta 1. FN Brno Jihlavská 20, 625 00 Brno - Bohunice
Lékový registr Pravidelný report Maligní pleurální mezoteliom (MPM) Stav registru k datu 31. 3. 2014 Pneumoonkologická centra zapojená v projektu Alimta 1. FN Brno Jihlavská 20, 625 00 Brno - Bohunice
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Indikace přípravku Zetamac v ordinaci praktického lékaře
 Indikace přípravku Zetamac v ordinaci praktického lékaře MUDr. Igor Karen 13.10. 2009 Zetamac léková forma azithromycinum 2g granule s prodlouženým uvolňováním pro přípravu perorální suspenze s příchutí
Indikace přípravku Zetamac v ordinaci praktického lékaře MUDr. Igor Karen 13.10. 2009 Zetamac léková forma azithromycinum 2g granule s prodlouženým uvolňováním pro přípravu perorální suspenze s příchutí
Světle červené, ploché, kulaté, skvrnité tablety, na jedné straně označené písmenem K.
 1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg.
 1 NÁZEV PŘÍPRAVKU Neoclarityn 2,5 mg tablety dispergovatelné v ústech 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5
1 NÁZEV PŘÍPRAVKU Neoclarityn 2,5 mg tablety dispergovatelné v ústech 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5
SYSTÉMOVÁ LÉČBA NÁDORŮ MOČOVÉHO MĚCHÝŘE
 SYSTÉMOVÁ LÉČBA NÁDORŮ MOČOVÉHO MĚCHÝŘE Jana Katolická FN u svaté Anny, Brno CZ/ONCO/617/0088 1 UROTELIÁLNÍ KARCINOM MOČOVÉHO MĚCHÝŘE CHEMOSENZITIVNÍ ONEMOCNĚNÍ. V době stanovení diagnózy je 15 % lokálně
SYSTÉMOVÁ LÉČBA NÁDORŮ MOČOVÉHO MĚCHÝŘE Jana Katolická FN u svaté Anny, Brno CZ/ONCO/617/0088 1 UROTELIÁLNÍ KARCINOM MOČOVÉHO MĚCHÝŘE CHEMOSENZITIVNÍ ONEMOCNĚNÍ. V době stanovení diagnózy je 15 % lokálně
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 1. NÁZEV PŘÍPRAVKU Nitresan 10 mg Nitresan 20 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 1. NÁZEV PŘÍPRAVKU Nitresan 10 mg Nitresan 20 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Bevacizumab u starších pacientů s kolorektálním karcinomem
 Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Poznámka: Tyto úpravy souhrnu údajů o přípravku a
 PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
INFLECTRA SCREENINGOVÝ LIST. a výběru pacientů pro všechny schválené indikace. Obsahuje pokyny ke správnému screeningu
 Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Doporučení pro dávkování a způsob podávání přípravku Tasigna
 Klinické studie a přípravek Tasigna Ukázalo se, že přípravek Tasigna u některých pacientů prodlužuje QT interval. V klinické studii fáze II u pacientů s CML s přítomností Ph chromozomu v chronické či akcelerované
Klinické studie a přípravek Tasigna Ukázalo se, že přípravek Tasigna u některých pacientů prodlužuje QT interval. V klinické studii fáze II u pacientů s CML s přítomností Ph chromozomu v chronické či akcelerované
Důležité bezpečnostní informace pro zdravotnické pracovníky
 Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE
 EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Keytruda (pembrolizumabum)
 EMA/235911/2019 EMEA/H/C/003820 Přehled pro přípravek Keytruda a proč byl přípravek registrován v EU Co je přípravek Keytruda a k čemu se používá? Keytruda je protinádorový léčivý přípravek používaný k
EMA/235911/2019 EMEA/H/C/003820 Přehled pro přípravek Keytruda a proč byl přípravek registrován v EU Co je přípravek Keytruda a k čemu se používá? Keytruda je protinádorový léčivý přípravek používaný k
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Certican 0,25 mg tablety Certican 0,5 mg tablety Certican 0,75 mg tablety Certican 1 mg tablety
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls1740-1/2008, sukls1743/2008, sukls1747/2008 Přílohy k sp.zn. sukls619/2008, sukls620/2008, sukls622-3/2008, sukls18318-21/2007 PŘÍBALOVÁ INFORMACE:
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls1740-1/2008, sukls1743/2008, sukls1747/2008 Přílohy k sp.zn. sukls619/2008, sukls620/2008, sukls622-3/2008, sukls18318-21/2007 PŘÍBALOVÁ INFORMACE:
Kelapril 5mg 7x14tbl.
 Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls118033/2010
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls118033/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cardioxane prášek pro přípravu infuzního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls118033/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cardioxane prášek pro přípravu infuzního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Renální karcinom přehled léčby pokročilého a metastatického onemocnění
 Renální karcinom přehled léčby pokročilého a metastatického onemocnění Doc. MUDr. Tomáš Büchler, Ph.D. Onkologická klinika 1. LF UK a Thomayerovy nemocnice, Praha Souhrn Büchler T.. Remedia 2013; 23 (Supl.
Renální karcinom přehled léčby pokročilého a metastatického onemocnění Doc. MUDr. Tomáš Büchler, Ph.D. Onkologická klinika 1. LF UK a Thomayerovy nemocnice, Praha Souhrn Büchler T.. Remedia 2013; 23 (Supl.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
Hodnocení segmentu centrové léčby z dat plátců zdravotní péče. Společné pracoviště ÚZIS ČR a IBA MU
 Hodnocení segmentu centrové léčby z dat plátců zdravotní péče Společné pracoviště ÚZIS ČR a IBA MU Realita současné české medicíny: úspěšné výsledky léčby = podstatné prodlužování doby života pacienta
Hodnocení segmentu centrové léčby z dat plátců zdravotní péče Společné pracoviště ÚZIS ČR a IBA MU Realita současné české medicíny: úspěšné výsledky léčby = podstatné prodlužování doby života pacienta
Biologická léčba karcinomu prsu. Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN)
 Biologická léčba karcinomu prsu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN) Cílená léčba Ca prsu Trastuzumab (HercepNn) AnN HER2 neu pronlátka LapaNnib (Tyverb)
Biologická léčba karcinomu prsu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN) Cílená léčba Ca prsu Trastuzumab (HercepNn) AnN HER2 neu pronlátka LapaNnib (Tyverb)
Východiska. Čtvrtá nejčastější příčina úmrtí na nádorová onemocní u žen, v celém světě je ročně nových onemocnění a úmrtí
 ICON7: studie fáze III Gynaecologic Cancer InterGroup (GCIG) s přidáním bevacizumabu ke standardní chemoterapii u žen s nově diagnostikovaným epitelovým nádorem vaječníků, primárním nádorem pobřišnice
ICON7: studie fáze III Gynaecologic Cancer InterGroup (GCIG) s přidáním bevacizumabu ke standardní chemoterapii u žen s nově diagnostikovaným epitelovým nádorem vaječníků, primárním nádorem pobřišnice
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aerius 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aerius 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT IKARUS. Neintervenční epidemiologická studie
 CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT Neintervenční epidemiologická studie PROTOKOL PROJEKTU Verze: 4.0 Datum: 26.09.2006 Strana 2 PROTOKOL PROJEKTU
CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT Neintervenční epidemiologická studie PROTOKOL PROJEKTU Verze: 4.0 Datum: 26.09.2006 Strana 2 PROTOKOL PROJEKTU
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Pomocné látky se známým účinkem: Jedna tableta obsahuje 28 mg laktosy a 5 mg glyceromakrogol-hydroxystearátu.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PLENDIL ER 5 mg PLENDIL ER 10 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje felodipinum 5,0 mg. Pomocné látky se známým účinkem: Jedna tableta
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PLENDIL ER 5 mg PLENDIL ER 10 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje felodipinum 5,0 mg. Pomocné látky se známým účinkem: Jedna tableta
STUDIE 2014 KLINIKA ONKOLOGIE A RADIOTERAPIE AKTIVNÍ NÁBOR PACIENTŮ
 STUDIE 2014 KLINIKA ONKOLOGIE A RADIOTERAPIE AKTIVNÍ NÁBOR PACIENTŮ KARCINOM PRSU Spoluzkoušející: MUDr.Iva Slánská, MUDr.Peter Priester,MUDr.Adam Paulík Název studie : PH3-01 Studie Present Prevence recidivy
STUDIE 2014 KLINIKA ONKOLOGIE A RADIOTERAPIE AKTIVNÍ NÁBOR PACIENTŮ KARCINOM PRSU Spoluzkoušející: MUDr.Iva Slánská, MUDr.Peter Priester,MUDr.Adam Paulík Název studie : PH3-01 Studie Present Prevence recidivy
Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH)
 Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH) Se souhlasem Evropské lékové agentury (EMA) a její
Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH) Se souhlasem Evropské lékové agentury (EMA) a její
VOTRIENT: NOVÝ MULTIKINÁZOVÝ INHIBITOR V LÉČBĚ RENÁLNÍHO KARCINOMU
 56 NÁDORY LEDVIN A MOČOVÉHO MĚCHÝŘE VOTRIENT: NOVÝ MULTIKINÁZOVÝ INHIBITOR V LÉČBĚ RENÁLNÍHO KARCINOMU Nosek M. Úvod Karcinom ledvin patří k chemorezistentním a radiorezistentním malignitám. Objev angiogeneze
56 NÁDORY LEDVIN A MOČOVÉHO MĚCHÝŘE VOTRIENT: NOVÝ MULTIKINÁZOVÝ INHIBITOR V LÉČBĚ RENÁLNÍHO KARCINOMU Nosek M. Úvod Karcinom ledvin patří k chemorezistentním a radiorezistentním malignitám. Objev angiogeneze
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna lahvička přípravku Torisel koncentrát obsahuje 30 mg temsirolimusum.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Torisel 30 mg, koncentrát a rozpouštědlo pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička přípravku Torisel koncentrát obsahuje 30 mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Torisel 30 mg, koncentrát a rozpouštědlo pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička přípravku Torisel koncentrát obsahuje 30 mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls2006/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL Rapide potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls2006/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL Rapide potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
Tableta s prodlouženým uvolňováním. Popis přípravku : bílé, kulaté, nepotahované tablety se zkosenými hranami.
 Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
Edukační materiály. KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře
 Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls211402/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje alfuzosini hydrochloridum10
sp. zn. sukls211402/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje alfuzosini hydrochloridum10
sp.zn.sukls103802/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ANDROCUR DEPOT 300 mg, injekční roztok
 sp.zn.sukls103802/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ANDROCUR DEPOT 300 mg, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule o obsahu 3 ml obsahuje cyproteroni acetas
sp.zn.sukls103802/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ANDROCUR DEPOT 300 mg, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule o obsahu 3 ml obsahuje cyproteroni acetas
EDUKAČNÍ MATERIÁLY. KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rapamune 1 mg, obalené tablety. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje sirolimusum 1 mg. Pomocné látky se známým účinkem Jedna
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rapamune 1 mg, obalené tablety. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje sirolimusum 1 mg. Pomocné látky se známým účinkem Jedna
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls49563/2016 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Kaloba Perorální kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 10 g (= 9,75 ml) roztoku obsahuje 8,0 g Pelargonii
sp.zn.sukls49563/2016 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Kaloba Perorální kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 10 g (= 9,75 ml) roztoku obsahuje 8,0 g Pelargonii
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
CZ PAR. QUETIAPINI FUMARAS Seroquel. NL/W/0004/pdWS/002
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
Přípravek Avastin se společně s jinými protinádorovými léčivými přípravky používá u dospělých k léčbě těchto typů rakoviny:
 EMA/175824/2015 EMEA/H/C/000582 Souhrn zprávy EPAR určený pro veřejnost bevacizumabum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro přípravek.
EMA/175824/2015 EMEA/H/C/000582 Souhrn zprávy EPAR určený pro veřejnost bevacizumabum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro přípravek.
PŘÍLOHA III ZMĚNY PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Poznámka:
 PŘÍLOHA III ZMĚNY PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Změny v souhrnu údajů o přípravku a příbalové informaci možná bude následně třeba nechat (v případě potřeby
PŘÍLOHA III ZMĚNY PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Změny v souhrnu údajů o přípravku a příbalové informaci možná bude následně třeba nechat (v případě potřeby
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje 71,3 mg monohydrátu laktosy.
 sp.zn. sukls138016/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje
sp.zn. sukls138016/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Celkové shrnutí vědeckého hodnocení přípravku Kytril a souvisejících názvů (viz příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACE PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 11 Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACE PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 11 Vědecké závěry Celkové
Nové léčebné možnosti v léčbě mnohočetného myelomu GROUP. Roman Hájek 3.9.2005. Lednice
 Nové léčebné možnosti v léčbě mnohočetného myelomu CZECH CMG M Y E L O M A GROUP ČESKÁ MYELOMOVÁ SKUPINA ČESKÁ MYELOMOVÁ SKUPINA CZECH CMG M Y E L O M A NADAČNÍ FOND GROUP Roman Hájek 3.9.2005 Lednice
Nové léčebné možnosti v léčbě mnohočetného myelomu CZECH CMG M Y E L O M A GROUP ČESKÁ MYELOMOVÁ SKUPINA ČESKÁ MYELOMOVÁ SKUPINA CZECH CMG M Y E L O M A NADAČNÍ FOND GROUP Roman Hájek 3.9.2005 Lednice
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Urorec 4 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje silodosinum 4 mg. Úplný seznam pomocných látek viz
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Urorec 4 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje silodosinum 4 mg. Úplný seznam pomocných látek viz
21. ZHOUBNÝ NOVOTVAR LEDVINY (C64)
 21. ZHOUBNÝ NOVOTVAR LEDVINY (C64) 21.1 Léčba lokalizovaného onemocnění (stádium I, II a operabilní III. stádium) Základem je léčba chirurgická. U pacientů s T1 nádorem preferujeme ledvinu šetřící výkony,
21. ZHOUBNÝ NOVOTVAR LEDVINY (C64) 21.1 Léčba lokalizovaného onemocnění (stádium I, II a operabilní III. stádium) Základem je léčba chirurgická. U pacientů s T1 nádorem preferujeme ledvinu šetřící výkony,
CZ PAR QUETIAPINUM. Seroquel. UK/W/0004/pdWS/001. NL/W/0004/pdWS/001
 CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY
 NÁDORY PROSTATY 63 XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY Kolektiv autorů Úvod Léčivý přípravek (radium-223 dichlorid) byl 13. listopadu 2013 schválen
NÁDORY PROSTATY 63 XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY Kolektiv autorů Úvod Léčivý přípravek (radium-223 dichlorid) byl 13. listopadu 2013 schválen
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1. NÁZEV PŘÍPRAVKU Ramonna 1500 mikrogramů, tableta
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ramonna 1500 mikrogramů, tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum1500 mikrogramů. Pomocné látky se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ramonna 1500 mikrogramů, tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum1500 mikrogramů. Pomocné látky se známým účinkem:
Důležité informace o užívání přípravku TASIGNA
 Důležité informace o užívání přípravku TASIGNA Důležité informace o užívání přípravku TASIGNA Co je důležité vědět o přípravku TASIGNA Přípravek TASIGNA je lék vydávaný pouze na lékařský předpis. TASIGNA
Důležité informace o užívání přípravku TASIGNA Důležité informace o užívání přípravku TASIGNA Co je důležité vědět o přípravku TASIGNA Přípravek TASIGNA je lék vydávaný pouze na lékařský předpis. TASIGNA
