Quiz Karboxylové kyseliny & jejich deriváty
|
|
|
- Vlasta Dušková
- před 9 lety
- Počet zobrazení:
Transkript
1 Quiz Karboxylové kyseliny & jejich deriváty 1. Určete produkt(y) reakce propionylchloridu s následujícími reaktanty: 2 i) C 3 C 2 C 2 2 (nadbytek) b) C 3 C 2 C 2 C 2 Li (nadbytek) j) m-toluidin (nadbytek) c) (C 3 ) 2 C pyridin k) (C 3 C 2 ) 2 (nadbytek) d) 3 (nadbytek) l) C 3 pyridin e) toluen Al 3 m) C 3 C 2 C - a f) [(C 3 ) 2 C] 3 AlLi n) C 3 C 2 C pyridin g) [(C 3 ) 3 C] 2 CuLi o) o-kresol pyridin h) K (nadbytek)/ 2 p) BS, a S 2 2. Doplňte reagenty ( (n) chybějící v zobrazené syntéze Cantharidinu z furanu (Cantharidin je silně zpuchýřující látka, která byla izolována z usušených brouků Cantharis vesicatori. (Ms = methansulfonyl ~ mesyl; Ph = fenyl; Me = methyl; Et = ethyl) I 4 ( C 2 Me C 2 Me C 2 SEt C 2 SEt (d) (g) C 2 Me C 2 Me C C (b) C 2 C 2 (e) C 2 SEt C 2 SEt (i) (h) C 2 Me C 2 Me C (c) C 2 Ms C 2 Ms (j) (f) C Ph (- C 3 C 2 ) (k) C Ph (m) C Ph (l) C 2 C 2 (n) CC 3 C Ph Catharidin 1
2 3. avrhněte, jaký produkt(y) získáte reakcí sukcinanhydridu s následujícími reaktanty: 3 (nadbytek) b) 2 c) butanol d) benzen Al 3 e) ethylamin (nadbytek) f) dipropylamin (nadbytek) 4. avrhněte a napište syntézu následujících sloučenin z uvedených výchozích látek. octová kyselina malonová kyselina b) pentanal pentanová kyselina c) 1-brombutan pentanová kyselina d) cyklohexanol adipová kyselina e) dec-5-en pentanová kyselina f) butan-1,4-diol jantarová kyselina 5. Připravte následující látky z o-bromtoluenu: o-brombenzoová kyselina b) o-bromfenyloctová kyselina c) o-bromfenylhydroxyoctová kyselina d) 3-(2-bromfenyl)akrylová kyselina 6. Určete produkt(y) následujících reakcí. 2,2-dimethylpropanoylchlorid isopropyl(methyl)amin / Pyridin b) p-nitrobenzoylchlorid 2-(,-dimethylamino)ethanol c) 2,-dimehylanilin fosgen d) salicylová kyselina acetanhydrid / Pyridin e) ethylamin ftalanhydrid f) decyl-palmitoát ethanol (nadbytek) /, g) methyl-acetát hydroxylamin / 7. avrhněte alespoň 2 různé syntézy následujících sloučenin: acetofenon b) 2,2-dimethylpropanová kyselina c) benzyl-acetát d),-dimehylbenzamid 2
3 8. Určete, které z následujících sloučenin budou reagovat s: ab 4 b) / 2, c) Jonesův reagent (a 2 Cr S 4 Cr 3 / aceton, 2 ) a napište produkty těchto reakcí. A B C D E F G 9. avrhněte a napište syntézu následujících sloučenin z uvedených výchozích látek. propylbromid butanová kyselina b) brombenzen benzoová kyselina c) cyklopentankarboxylová kyselina terc-butyl-cyklopentankarboxylát d) benzoová kyselina allyl-benzoát e) ethin vinyl-acetát f) pent-4-en-1-ová kyselina γ-valerolakton g) cyklohexan-1,2-dikarboxylová kyselina cyklohexen h) cyklopentankarboxylová kyselina cyklopentylbromid i) 4-chlorbenzoová kyselina p-bromchlorbenzen j) palmitová kyselina pentadekyljodid k) (2S)-2-methylbutanová kyselina 2-brombutan (racemát) 10. Doplňte chybějící reaktan(y), reagent(y) nebo produkt(y) a produkt(y) plně pojmenujte C
4 b) a 2 Cr c) 3. C 2 (kat.), 4. 3 C d) C 3 6 e) 1. ab 4 2. P 3 f) Et Et 1. Eta 2. C 3 -I 1. Eta 2. C2 C 3 3 C 4
5 g) 2 Eta h) 2 Et Et Eta 3 i) 1. Eta / Et 2. Bu- C 2 Et 3 j) 1. LDA / TF C 3 5
6 Řešení: 1. 2 b) Li 2. / 2 Li c) pyridin d) e) C 3 C 3 C 3 Al 3 f) [(C 3 ) 2 C] 3 AlLi g) [(C 3 ) 3 C] 2 CuLi h) 2 K 2 K K 6
7 i) 2 3 j) C 3 2 C 3 C 3 3 k) 2 l) pyridin m) - a a n) pyridin o) C 3 pyridin C 3 p) S 2 2. ( Diels-Alderova reakce: Me Me 7
8 (b) Katalytická hydrogenace: 2 / Pd Disubstituovaná dvojná vazba je méně stericky bráněná než tetrasubstituovaná dvojná vazba a tedy i více reaktivnější. (c) Diels-Alderova reakce: (d) Redukce esteru: LiAl 4 (e) Příprava esteru methansulfonové kyseliny: 3 C S (f) Substituce nukleofilní: C 3 C 2 S - (g) xidace dvojné vazby: s 4 a potom a 2 S 3 (h) Redukce sulfidu (odstranění jako chránící skupiny): Raney i (i) Aldolová kondenzace: 40 % a / 2 (nebo jiná báze) (j) Adice nukleofilní na karbonylu: PhMg (nebo PhLi) a potom / 2 (k) Kysele katalyzovaný přesmyk allylalkoholu: / 2 (l) Příprava esteru: 3 C (m) zonolýza s následující oxidací: 1. 3 ; , Ac (n) Termicky iniciovaná dehydratace: C C 2-4 b) 2 2 C C 2 c) 2 C C 2 C 2 C 2 C 2 C 3 8
9 d) Al 3 C 2 e) 2 3 C 2 CC C 2-3 C 2 C 3 f) ( 3 C 2 C 2 C) 2 C C 2-2 (C 2 C 2 C 3 ) a a ac C a / 2 b) 1. Ag( 3 ) c) 1. Mg / Et 2 Mg 2. C 2 / 2 d) 1. KMn4, -, 2. / 2 e) 1. KMn 4, -, 2. / 2 2 f) 1. KMn 4, -, 2. / 2 5. C 3 1. KMn 4, -, 2. / 2 C 9
10 b) C 3 2 / RR C 4 C 2 ac C C 2 / 2 2 C C c) C 3 1. KMn 4, -, 2. / 2 C S 2 C LiAl[C(C 3 ) 3 ] 3 Et 2, -78 C C KC / 2 C C / 2 C C d) C 3 2 / RR C 4 C 2 ac C C 2 / 2 2 C C S 2 2 C C LiAl[C(C 3 ) 3 ] 3 Et 2, -78 C 2 C C KC / 2 2 C C C / 2 C 2 C C C C C 6. Pyridin b) 2 2 c) Friedel-Craftsova acylace (terciární aminy nepodléhají acylaci na dusíku)
11 d) C 2 Pyridin C 2 e) 2 C 2 f) 3 C( 2 C) 14 (C2 ) 9 C 3 C 3 3 C( 2 C) 14 C 3 C 3 (C 2 ) 9 g) 2 C 3 7. Možností syntéz v těchto případech je více a v tomto řešení je snahou vyznačit nejschůdnější, nejméně náročný a pokud možno nejkratší způsob přípravy požadovaných látek. Al 3 C 3 3 C (C 3 ) 2 CuLi C 3 b) 1. Mg, Et 2 2. C KMn 4, -, 2. 3 c) 3 C pyridin C 3 3 C C 3 pyridin C 3 11
12 3 C 2 S 4 C 3 d) Et (C 3 ) 2 (C 3 ) 2 (C 3 ) 2 pyridin (C 3 ) 2 (C 3 ) 2 pyridin (C 3 ) 2 8. S uvedenými reagenty budou reagovat: ab 4 A, B, C, E, F b) / 2, D, G, c) Jonesův reagent (a 2 Cr S 4 Cr 3 / aceton, 2 ) A, E, F A ab 4 B ab 4 C ab 4 E ab 4 F ab 4 b) D 2, G 2, 2, C 3 12
13 c) B a 2 Cr S 4 aceton, 2 E a 2 Cr S 4 aceton, 2 F a 2 Cr S 4 aceton, 2 9. Možností syntéz v těchto případech je více a v tomto řešení je snahou vyznačit nejschůdnější, nejméně náročný a pokud možno nejkratší způsob přípravy s nejvyšším výtěžkem požadovaných látek. ac Et C / 2 C b) 2 Li pentan Li 1. C 2 2 / 2 c) 2 S 4 (kat.) d) Ag Ag - Ag e) C C 2 S 4 gs 4 (kat.) f) 2 S 4 (kat.) g) C 2 C 2 (Ac) 4 Pb 2 C 2 2 C 3 C 2 (Ac) 2 Pb 13
14 h) V příkladech g) až k) se jedná o oxidaci, při které dochází k dekarboxylaci (v důsledku již tak vysokého oxidačního stavu karboxylových kyselin). Reakce může být iniciována solemi g 2, Pb 4 nebo Ag, přičemž tato reakce se nazývá unsdieckerova reakce. Pro lepší pochopení této reakce je zobrazen mechanismus pro tento příklad. g 2 C 4, C2 Mechanismus (M = g 2, Pb 4 nebo Ag ): g nebo Ag 2 M nebo (Ac) 4 Pb 2 (nebo hν) - C 2 i) g 2 C 4,, hν j) 3 C (C 2 ) 14 C Ag 2 I 2 C 4,, hν 3 C (C 2 ) 14 I k) C 2 Ag2 2 C 4,, hν 10. Příprava sodné soli benzylalkoholu pomocí hybridu sodného a jeho reakce s oxiranem s následným vytěsněním alkoholu zředěnou kyselinou z jeho sodné soli. Reakce pokračuje oxidací pyridinium-chlorchromátem. 1. a 2. PCC 3. 3 (Cr 3 Py ) 2-benzyloxyacetaldehyd b) xidace propanolu Jonesovým reagentem na karboxylovou kyselinu. Příprava propanoylchloridu reakcí karboxylové kyseliny s thionylchloridem a následuje Friedel- Craftsova acylace benzenu. 14
15 a 2 Cr S 2 2. benzen Al 3 propiofenon c) alogenace alkoholu na cyklopentylhalogenid, následná příprava Grignardova činidla a jeho reakce s C 2 za vzniku hořečnaté soli cyklopentankarboxylové kyseliny a její vytěsnění zředěnou kyselinou. ásleduje kysele katalyzovaná esterifikace (Fisherova esterifikace) s propanolem. 1. P 3 2. Mg 3. C 2 (kat.), 4. 3 propyl-cyklopentankarboxylát d) xidace alkoholu na aldehyd, po které následuje aldolizace a redukce aldehydické skupiny na hydroxy skupinu za vzniku diolu. Poté je diol acetylován acetanhydridem. 1. a / 2 PCC 2. ab 4 (Cr 3 Py ) 3. (C 3 C) 2 2-methylpent-1,3-diyl-diacetát e) Redukce acetonu na isopropanol a jeho halogenace na isopropylbromid. Příprava Grignardova činidla a jeho reakce s 0.5 ekv. ethyl-acetátu s následnou kyselou hydrolýzou vzniklé soli terciárního alkoholu. 1. ab 4 2. P 3 1. Mg ,3,4-trimethylpentan-3-ol f) Et Et 1. Eta 2. C 3 -I 3 C Et Et 1. Eta 3 C Et 3 3 C 2. C2 C Et 3 3 C 2 C - C 2-2 Et - C 3 2-methylbutandiová kyselina g) 2 Eta 1,5-difenylpenta-1,4-dien-3-on 15
16 h) 2 Et Et Eta Et 2 C C 2 Et 3 2 C 2 2 Et cyklohexan-1,4-dion i) C 2 Et 1. Eta / Et C 2 Et 3 C C 2 Et 2. Bu- 2 Et 2-butylcyklopentanon j) 1. LDA / TF Eta C 3 C 2 Et 2,2-dimethylheptan-3-on 16
SEMINÁRNÍ PRÁCE. Jméno: Obor: 1. Pojmenujte následující sloučeniny:
 SEMIÁRÍ PRÁE Jméno: bor: 1. Pojmenujte následující sloučeniny: 1 3 4 5 6 S 3 7 8 9 S 3 10 11. akreslete strukturním vzorcem následující sloučeniny: a pentannitril b propyl-4-oxocyklohexankarboxylát c 5-amino-1,7-dimethylbicyklo[..1]hept--en-7-karbonitril
SEMIÁRÍ PRÁE Jméno: bor: 1. Pojmenujte následující sloučeniny: 1 3 4 5 6 S 3 7 8 9 S 3 10 11. akreslete strukturním vzorcem následující sloučeniny: a pentannitril b propyl-4-oxocyklohexankarboxylát c 5-amino-1,7-dimethylbicyklo[..1]hept--en-7-karbonitril
OCH/OC2. Karbonylové sloučeniny 2
 OCH/OC2 Karbonylové sloučeniny 2 1 Reaktivita karbonylových sloučenin Nukleofilní adice na karbonylovou skupinu A N vody vznik hydrátů A N alkoholů tvorba acetalů a ketalů A N HCN vznik kyanhydrinů A N
OCH/OC2 Karbonylové sloučeniny 2 1 Reaktivita karbonylových sloučenin Nukleofilní adice na karbonylovou skupinu A N vody vznik hydrátů A N alkoholů tvorba acetalů a ketalů A N HCN vznik kyanhydrinů A N
Inovace bakalářského studijního oboru Aplikovaná chemie
 Inovace bakalářského studijního oboru Aplikovaná chemie http://aplchem.upol.cz Z.1.07/2.2.00/15.0247 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Karbonylové
Inovace bakalářského studijního oboru Aplikovaná chemie http://aplchem.upol.cz Z.1.07/2.2.00/15.0247 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Karbonylové
Karboxylové kyseliny
 Karboxylové kyseliny Názvosloví pokud je karboxylováskupina součástířetězce, sloučenina mákoncovku -ovákyselina. Pokud je mimo řetězec má sloučenina koncovku karboxylová kyselina. butanová kyselina cyklohexankarboxylová
Karboxylové kyseliny Názvosloví pokud je karboxylováskupina součástířetězce, sloučenina mákoncovku -ovákyselina. Pokud je mimo řetězec má sloučenina koncovku karboxylová kyselina. butanová kyselina cyklohexankarboxylová
Organická chemie (KATA) rychlý souhrn a opakování
 Organická chemie (KATA) rychlý souhrn a opakování Molekulové orbitaly hybridizace N a O Polarita vazby, induktivní efekt U kovalentní vazby mezi rozdílnými atomy, nebude elektronový pár oběma atomy sdílen
Organická chemie (KATA) rychlý souhrn a opakování Molekulové orbitaly hybridizace N a O Polarita vazby, induktivní efekt U kovalentní vazby mezi rozdílnými atomy, nebude elektronový pár oběma atomy sdílen
Úvod Obecný vzorec alkoholů je R-OH.
 Alkoholy a fenoly Úvod becný vzorec alkoholů je R-. Názvosloví alkoholů a fenolů Běžná jména alkoholů se odvozují od alifatického zbytku připojeného k hydroxylové skupině, ke kterému se přidá slovo alkohol.
Alkoholy a fenoly Úvod becný vzorec alkoholů je R-. Názvosloví alkoholů a fenolů Běžná jména alkoholů se odvozují od alifatického zbytku připojeného k hydroxylové skupině, ke kterému se přidá slovo alkohol.
Karboxylové kyseliny a jejich funkční deriváty
 Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
Reakce aldehydů a ketonů s N-nukleofily
 Reakce aldehydů a ketonů s N-nukleofily bdobně jako aminy se adují na karbonyl i jiné dusíkaté nukleofily: 2,4-dinitrofenylhydrazin aceton 2,4dinitrofenylhydrazon 2,4-dinitrofenylhydrazon acetaldehydu
Reakce aldehydů a ketonů s N-nukleofily bdobně jako aminy se adují na karbonyl i jiné dusíkaté nukleofily: 2,4-dinitrofenylhydrazin aceton 2,4dinitrofenylhydrazon 2,4-dinitrofenylhydrazon acetaldehydu
2016 Organická chemie testové otázky
 Hodnocení (max. 20 bodů): Číslo kód: 2016 Organická chemie testové otázky 1. Která metoda vede ke tvorbě aminů 1 b. a Gabrielova syntéza b Claisenova kondenzace c Reakce ethyl acetátu s ethylaminem d Reakce
Hodnocení (max. 20 bodů): Číslo kód: 2016 Organická chemie testové otázky 1. Která metoda vede ke tvorbě aminů 1 b. a Gabrielova syntéza b Claisenova kondenzace c Reakce ethyl acetátu s ethylaminem d Reakce
Organická chemie pro biochemiky II část 14 14-1
 rganická chemie pro biochemiky II část 14 14-1 oxidace a redukce mají v organické chemii trochu jiný charakter než v chemii anorganické obvykle u jde o adici na systém s dvojnou vazbou či štěpení vazby
rganická chemie pro biochemiky II část 14 14-1 oxidace a redukce mají v organické chemii trochu jiný charakter než v chemii anorganické obvykle u jde o adici na systém s dvojnou vazbou či štěpení vazby
Karbonylové sloučeniny
 Karbonylové sloučeniny více než 120 o 120 o C O C C d + d - C O C sp 2 C sp 2 R C O H R 1 C O R 2 1.aldehydy, ketony Nu E R C O R C O 2. karboxylové kyseliny a funkční deriváty O H 3. deriváty kys. uhličité
Karbonylové sloučeniny více než 120 o 120 o C O C C d + d - C O C sp 2 C sp 2 R C O H R 1 C O R 2 1.aldehydy, ketony Nu E R C O R C O 2. karboxylové kyseliny a funkční deriváty O H 3. deriváty kys. uhličité
Organická chemie II. Acylderiváty I. Zdeněk Friedl. Kapitola 21. Solomons & Fryhle: Organic Chemistry 8th Ed., Wiley 2004
 rganická chemie II Zdeněk Friedl Kapitola 21 Acylderiváty I Solomons & Fryhle: rganic Chemistry 8th Ed., Wiley 2004 Karboxylové kyseliny, funkční deriváty karboxylových kyselin fyzikální vlastnosti karboxylových
rganická chemie II Zdeněk Friedl Kapitola 21 Acylderiváty I Solomons & Fryhle: rganic Chemistry 8th Ed., Wiley 2004 Karboxylové kyseliny, funkční deriváty karboxylových kyselin fyzikální vlastnosti karboxylových
OCH/OC2. Karbonylové sloučeniny 1
 OCH/OC2 Karbonylové sloučeniny 1 1 Rozdělení Aldehyd Keton Karboxylová kyselina Acylhalogenid Ester Anhydrid Amid Azid Hydrazid Hydroxamová kyselina Lakton Laktam 2 Rozdělení Deriváty kyseliny uhličité
OCH/OC2 Karbonylové sloučeniny 1 1 Rozdělení Aldehyd Keton Karboxylová kyselina Acylhalogenid Ester Anhydrid Amid Azid Hydrazid Hydroxamová kyselina Lakton Laktam 2 Rozdělení Deriváty kyseliny uhličité
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 KARBONYLOVÉ SLOUČENINY = látky, které obsahují karbonylovou skupinu Aldehydy mají skupinu C=O na konci řetězce, aldehydická skupina má potom tvar... Názvosloví aldehydů: V systematickém názvu je zakončení
KARBONYLOVÉ SLOUČENINY = látky, které obsahují karbonylovou skupinu Aldehydy mají skupinu C=O na konci řetězce, aldehydická skupina má potom tvar... Názvosloví aldehydů: V systematickém názvu je zakončení
Obsah. 2. Mechanismus a syntetické využití nejdůležitějších organických reakcí 31 2.1. Adiční reakce 31 2.1.1. Elektrofilní adice (A E
 Obsah 1. Typy reakcí, reakčních komponent a jejich roztřídění 6 1.1. Formální kritérium pro klasifikaci reakcí 6 1.2. Typy reakčních komponent a způsob jejich vzniku jako další kriterium pro klasifikaci
Obsah 1. Typy reakcí, reakčních komponent a jejich roztřídění 6 1.1. Formální kritérium pro klasifikaci reakcí 6 1.2. Typy reakčních komponent a způsob jejich vzniku jako další kriterium pro klasifikaci
Karbonylové sloučeniny
 Aldehydy a ketony Karbonylové sloučeniny ' edoxní reakce Nukleofilní adice Aldolová kondenzace aldehyd formaldehyd = keton Aldehydy a ketony edoxní reakce aldehydů/ketonů E + Aldehydy oxidace mírnými oxidačními
Aldehydy a ketony Karbonylové sloučeniny ' edoxní reakce Nukleofilní adice Aldolová kondenzace aldehyd formaldehyd = keton Aldehydy a ketony edoxní reakce aldehydů/ketonů E + Aldehydy oxidace mírnými oxidačními
DERIVÁTY - OPAKOVÁNÍ
 DERIVÁTY - OPAKOVÁNÍ Doplňte k názvu derivátu uhlovodíku charakteristickou skupinu: alkohol Název derivátu Charakteristická skupina nitroderivát karboxylová kyselina aldehyd halogenderivát keton Doplňte
DERIVÁTY - OPAKOVÁNÍ Doplňte k názvu derivátu uhlovodíku charakteristickou skupinu: alkohol Název derivátu Charakteristická skupina nitroderivát karboxylová kyselina aldehyd halogenderivát keton Doplňte
OCH/OC2. Hydroxyderiváty
 OCH/OC2 Hydroxyderiváty 1 Voda alkoholy - ethery voda methanol (monoalkyl derivát vody) dimethylehter (dialkyl derivát vody) 2 Rozdělení Alkoholy (alifatické) Fenoly (aromatické) primární sekundární terciární!
OCH/OC2 Hydroxyderiváty 1 Voda alkoholy - ethery voda methanol (monoalkyl derivát vody) dimethylehter (dialkyl derivát vody) 2 Rozdělení Alkoholy (alifatické) Fenoly (aromatické) primární sekundární terciární!
OCH/OC2. Deriváty karboxylových kyseliny
 OCH/OC2 Deriváty karboxylových kyseliny 1 Reaktivita karboxylových kyselin H O O - H H H OH deprotonace redukce R O OH H O OH H O Y α-substituce Nukleofilní acylová substituce Substituční deriváty Funkční
OCH/OC2 Deriváty karboxylových kyseliny 1 Reaktivita karboxylových kyselin H O O - H H H OH deprotonace redukce R O OH H O OH H O Y α-substituce Nukleofilní acylová substituce Substituční deriváty Funkční
Příklady k semináři z organické chemie OCH/SOCHA. Doc. RNDr. Jakub Stýskala, Ph.D.
 Příklady k semináři z organické chemie /SA Doc. RNDr. Jakub Stýskala, Ph.D. Příklady k procvičení 1. Které monochlorované deriváty vzniknou při radikálové chloraci následující sloučeniny. Který z nich
Příklady k semináři z organické chemie /SA Doc. RNDr. Jakub Stýskala, Ph.D. Příklady k procvičení 1. Které monochlorované deriváty vzniknou při radikálové chloraci následující sloučeniny. Který z nich
OCH/OC2. Karboxylové kyseliny
 OCH/OC2 Karboxylové kyseliny 1 Struktura a fyzikální vlastnosti karboxylová skupina je planární vazebné úhly přibližně 120 molekuly karboxylových kyselin jsou silně asociovány vodíkovými vazbami tvorba
OCH/OC2 Karboxylové kyseliny 1 Struktura a fyzikální vlastnosti karboxylová skupina je planární vazebné úhly přibližně 120 molekuly karboxylových kyselin jsou silně asociovány vodíkovými vazbami tvorba
Organická chemie II. Aldehydy a ketony II. Zdeněk Friedl. Kapitola 20. Solomons & Fryhle: Organic Chemistry 8th Ed., Wiley 2004
 Organická chemie II Zdeněk Friedl Kapitola 20 Aldehydy a ketony II Solomons & Fryhle: Organic Chemistry 8th Ed., Wiley 2004 Aldolové reakce karbonylových sloučenin RS aldehydů a ketonů kyselost α-vodíkových
Organická chemie II Zdeněk Friedl Kapitola 20 Aldehydy a ketony II Solomons & Fryhle: Organic Chemistry 8th Ed., Wiley 2004 Aldolové reakce karbonylových sloučenin RS aldehydů a ketonů kyselost α-vodíkových
reakci (tj. od nejvíce disponovaného k nejméně disponovanému).
 1. Napište libovolný příklad nukleofilní adice. 2. Uveďte příklad tautomerizace libovolné nitrososloučeniny. 3. Na libovolném cyklickém uhlovodíku uveďte příklad 1,4-adice. 4. Napište libovolnou reakci,
1. Napište libovolný příklad nukleofilní adice. 2. Uveďte příklad tautomerizace libovolné nitrososloučeniny. 3. Na libovolném cyklickém uhlovodíku uveďte příklad 1,4-adice. 4. Napište libovolnou reakci,
OCH/OC2. Heterocyklické sloučeniny
 CH/C2 Heterocyklické sloučeniny 1 ázvosloví 5-ti členné heterocykly 6-ti členné heterocykly 2 ázvosloví earomatické (nasycené) heterocykly. 3 Aromaticita heterocyklů 4 Aromaticita heterocyklů 5 Rezonanční
CH/C2 Heterocyklické sloučeniny 1 ázvosloví 5-ti členné heterocykly 6-ti členné heterocykly 2 ázvosloví earomatické (nasycené) heterocykly. 3 Aromaticita heterocyklů 4 Aromaticita heterocyklů 5 Rezonanční
OCH/OC2. Hydroxyderiváty
 OCH/OC2 Hydroxyderiváty 1 Voda alkoholy - ethery voda methanol (monoalkyl derivát vody) dimethylehter (dialkyl derivát vody) 2 Rozdělení Alkoholy (alifatické) Fenoly (aromatické) primární sekundární terciární!
OCH/OC2 Hydroxyderiváty 1 Voda alkoholy - ethery voda methanol (monoalkyl derivát vody) dimethylehter (dialkyl derivát vody) 2 Rozdělení Alkoholy (alifatické) Fenoly (aromatické) primární sekundární terciární!
Kyslíkaté deriváty. 1) Hydroxyderiváty: a) Alkoholy b) Fenoly. řešení. Dle OH = hydroxylová skupina
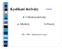 Kyslíkaté deriváty řešení 1) Hydroxyderiváty: a) Alkoholy b) Fenoly Dle = hydroxylová skupina 1 Hydroxyderiváty Alifatické alkoholy: náhrada 1 nebo více atomů H. hydroxylovou skupinou (na 1 atom C vázaná
Kyslíkaté deriváty řešení 1) Hydroxyderiváty: a) Alkoholy b) Fenoly Dle = hydroxylová skupina 1 Hydroxyderiváty Alifatické alkoholy: náhrada 1 nebo více atomů H. hydroxylovou skupinou (na 1 atom C vázaná
Projekt OCH. http://ich.vscht.cz/projects/och/ Tištěný výstup
 Projekt OCH http://ich.vscht.cz/projects/och/ Tištěný výstup 4 6 Nakreslete produkt bromace anilinu do třetího stupně. 7 http://ich.vscht.cz/projects/och/ Strana 2 8 Meziproduktem následující reakce je
Projekt OCH http://ich.vscht.cz/projects/och/ Tištěný výstup 4 6 Nakreslete produkt bromace anilinu do třetího stupně. 7 http://ich.vscht.cz/projects/och/ Strana 2 8 Meziproduktem následující reakce je
1. Hydroxysloučeniny 2. Thioly 3. Ethery
 Kyslíkaté deriváty uhlovodíků I 1. ydroxysloučeniny 2. Thioly 3. Ethery deriváty kyslíkaté hydroxysloučeniny R alkoholy fenoly ethery RR karbonylové sloučeniny aldehydy RC ketony RCR karboxylové sloučeniny
Kyslíkaté deriváty uhlovodíků I 1. ydroxysloučeniny 2. Thioly 3. Ethery deriváty kyslíkaté hydroxysloučeniny R alkoholy fenoly ethery RR karbonylové sloučeniny aldehydy RC ketony RCR karboxylové sloučeniny
Ethery. dimethylether tetrahydrofuran. O R O R O R ortoester R 1 O R R 2 O R. acetal
 OCH/OC2 Ethery 1 Ethery! R 1 R 2 O R O R acetal R 1 O R O R O R ortoester dimethylether tetrahydrofuran 2 Ethery Možno považovat za deriváty vody nebo alkoholů, tomu odpovídá valenční úhel C-O-C, který
OCH/OC2 Ethery 1 Ethery! R 1 R 2 O R O R acetal R 1 O R O R O R ortoester dimethylether tetrahydrofuran 2 Ethery Možno považovat za deriváty vody nebo alkoholů, tomu odpovídá valenční úhel C-O-C, který
Kyslíkaté deriváty uhlovodíků III
 Kyslíkaté deriváty uhlovodíků III 5. Karboxylové kyseliny 6. Funkční deriváty karboxylových kyselin 7. Substituční deriváty karboxylových kyselin 8. Deriváty kyseliny uhličité 1 5. Karboxylové kyseliny
Kyslíkaté deriváty uhlovodíků III 5. Karboxylové kyseliny 6. Funkční deriváty karboxylových kyselin 7. Substituční deriváty karboxylových kyselin 8. Deriváty kyseliny uhličité 1 5. Karboxylové kyseliny
TEST + ŘEŠENÍ. PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKOUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2010
 30 otázek maximum: 60 bodů TEST + ŘEŠEÍ PÍSEMÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CEMIE bakalářský studijní obor Bioorganická chemie 2010 1. apište názvy anorganických sloučenin: (4 body) 4 BaCr 4 kyselina peroxodusičná
30 otázek maximum: 60 bodů TEST + ŘEŠEÍ PÍSEMÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CEMIE bakalářský studijní obor Bioorganická chemie 2010 1. apište názvy anorganických sloučenin: (4 body) 4 BaCr 4 kyselina peroxodusičná
Vlastnosti. Pozor! H 3 C CH 3 H CH 3
 Alkeny Vlastnosti C n 2n obsahují dvojné vazby uhlíky v sp 2 hybridizaci násobná vazba vzniká překryvem 2p orbitalů obou atomů uhlíku nad a pod prostorem obsazeným vazbou aby k překryvu mohlo dojít, musí
Alkeny Vlastnosti C n 2n obsahují dvojné vazby uhlíky v sp 2 hybridizaci násobná vazba vzniká překryvem 2p orbitalů obou atomů uhlíku nad a pod prostorem obsazeným vazbou aby k překryvu mohlo dojít, musí
HALOGENDERIVÁTY - PART 1
 ALGENDERIVÁTY - PART 1 1. Nakreslete struktury, které odpovídají systematickým názvům: a) 2-chlor-3,3-dimethylhexan b) 4-sek-butyl-2-chlornonan c) 1,1-dibrom-4-isopropylcyklohexan 2. Nakreslete a pojmenujte
ALGENDERIVÁTY - PART 1 1. Nakreslete struktury, které odpovídají systematickým názvům: a) 2-chlor-3,3-dimethylhexan b) 4-sek-butyl-2-chlornonan c) 1,1-dibrom-4-isopropylcyklohexan 2. Nakreslete a pojmenujte
Karboxylové kyseliny
 Karboxylové kyseliny Učební text, Hb 2008 Obsahují jednu nebo více charakteristických karboxylových skupin COOH. Název vznikl kombinací karboxyl = karbonyl + hydroxyl Obecný vzorec např. R-COOH, HOOC-R-COOH,
Karboxylové kyseliny Učební text, Hb 2008 Obsahují jednu nebo více charakteristických karboxylových skupin COOH. Název vznikl kombinací karboxyl = karbonyl + hydroxyl Obecný vzorec např. R-COOH, HOOC-R-COOH,
Chemie 2018 CAUS strana 1 (celkem 5)
 Chemie 2018 CAUS strana 1 (celkem 5) 1. Vápník má atomové číslo 20, hmotnostní 40. Kolik elektronů obsahuje kationt Ca 2+? a) 18 b) 20 c) 40 d) 60 2. Kolik elektronů ve valenční sféře má atom Al? a) 1
Chemie 2018 CAUS strana 1 (celkem 5) 1. Vápník má atomové číslo 20, hmotnostní 40. Kolik elektronů obsahuje kationt Ca 2+? a) 18 b) 20 c) 40 d) 60 2. Kolik elektronů ve valenční sféře má atom Al? a) 1
4. ročník - seminář Vzdělávací obor - Člověk a příroda
 Gymnázium, Milevsko, Masarykova 183 Školní vzdělávací program (ŠVP) pro vyšší stupeň osmiletého studia a čtyřleté studium Vyučovací předmět - Chemie 4. ročník - seminář Vzdělávací obor - Člověk a příroda
Gymnázium, Milevsko, Masarykova 183 Školní vzdělávací program (ŠVP) pro vyšší stupeň osmiletého studia a čtyřleté studium Vyučovací předmět - Chemie 4. ročník - seminář Vzdělávací obor - Člověk a příroda
Inovace bakalářského studijního oboru Aplikovaná chemie http://aplchem.upol.cz
 Inovace bakalářského studijního oboru Aplikovaná chemie http://aplchem.upol.cz Z.1.07/2.2.00/15.0247 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Funkční
Inovace bakalářského studijního oboru Aplikovaná chemie http://aplchem.upol.cz Z.1.07/2.2.00/15.0247 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Funkční
ORGANICKÁ CHEMIE II pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Vyučující na semináři...
 RGANICKÁ CHEMIE II pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Vyučující na semináři... 1) [01752] Napište rovnice děje, ke kterému dochází při zahřívání
RGANICKÁ CHEMIE II pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Vyučující na semináři... 1) [01752] Napište rovnice děje, ke kterému dochází při zahřívání
Inovace bakalářského studijního oboru Aplikovaná chemie
 Inovace bakalářského studijního oboru Aplikovaná chemie http://aplchem.upol.cz Z.1.07/2.2.00/15.0247 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Funkční
Inovace bakalářského studijního oboru Aplikovaná chemie http://aplchem.upol.cz Z.1.07/2.2.00/15.0247 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Funkční
ORGANICKÁ CHEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Zápočet udělil(a)...
 RGANICKÁ CHEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Zápočet udělil(a)... Počet bodů v části A:... Počet bodů v části B:... Počet bodů celkem:...
RGANICKÁ CHEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Zápočet udělil(a)... Počet bodů v části A:... Počet bodů v části B:... Počet bodů celkem:...
KARBOXYLOVÉ KYSELINY C OH COOH. řešení. uhlovodíkový zbytek. KARBOXYLOVÝCH funkčních skupin. - obsahují 1 či více
 KARBXYLVÉ KYSELINY - obsahují 1 či více KARBXYLVÝCH funkčních skupin. - nejvyšší organické oxidační produkty uhlovodíků řešení R CH R C H R = uhlovodíkový zbytek 1 KARBXYLVÉ KYSELINY Dělení dle: a) typu
KARBXYLVÉ KYSELINY - obsahují 1 či více KARBXYLVÝCH funkčních skupin. - nejvyšší organické oxidační produkty uhlovodíků řešení R CH R C H R = uhlovodíkový zbytek 1 KARBXYLVÉ KYSELINY Dělení dle: a) typu
Reaktivita karboxylové funkce
 eaktivita karboxylové funkce - M efekt, - I efekt - I efekt < + M efekt - I efekt kyslíku eaktivita: 1) itlivost na působení bází - tvorba solí karboxylových kyselin (také většina nukleofilů zde působí
eaktivita karboxylové funkce - M efekt, - I efekt - I efekt < + M efekt - I efekt kyslíku eaktivita: 1) itlivost na působení bází - tvorba solí karboxylových kyselin (také většina nukleofilů zde působí
ORGANICKÁ CHEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Vyučující na semináři...
 ORGANICKÁ CEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Vyučující na semináři... Počet bodů v části A:... Počet bodů v části B:... Počet bodů celkem:...
ORGANICKÁ CEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Vyučující na semináři... Počet bodů v části A:... Počet bodů v části B:... Počet bodů celkem:...
ETHYLEN - PRŮMYSLOVÉ ZPRACOVÁNÍ
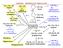 H ethanol CH= acetaldehyd CH octová kys. C CH= vinylacetát ETHYLE - PRŮMYSLVÉ ZPRACVÁÍ oxiran (ethylenoxid) ~ 10 % + 2 ~ 20 % -H 2 + KYS. KATAL. ETHE CH= styren (-CH- -) n Ph polystyren PS a jeho kopolymery
H ethanol CH= acetaldehyd CH octová kys. C CH= vinylacetát ETHYLE - PRŮMYSLVÉ ZPRACVÁÍ oxiran (ethylenoxid) ~ 10 % + 2 ~ 20 % -H 2 + KYS. KATAL. ETHE CH= styren (-CH- -) n Ph polystyren PS a jeho kopolymery
AMINOKYSELINY REAKCE
 CHEMIE POTRAVIN - cvičení AMINOKYSELINY REAKCE Milena Zachariášová (milena.zachariasova@vscht.cz) Ústav chemie a analýzy potravin, VŠCHT Praha REAKCE AMINOKYSELIN část 1 ELIMINAČNÍ REAKCE DEKARBOXYLACE
CHEMIE POTRAVIN - cvičení AMINOKYSELINY REAKCE Milena Zachariášová (milena.zachariasova@vscht.cz) Ústav chemie a analýzy potravin, VŠCHT Praha REAKCE AMINOKYSELIN část 1 ELIMINAČNÍ REAKCE DEKARBOXYLACE
Quiz Aromatické uhlovodíky
 Quiz Aromatické uhlovodíky 1. Určete, které z následujících molekul splňují podmínku aromaticity podle ückelova pravidla: C 2 C 2 A B C D E S 2 C C 2 2 C C 2 C 2 F G I J 2. Určete, které z následujících
Quiz Aromatické uhlovodíky 1. Určete, které z následujících molekul splňují podmínku aromaticity podle ückelova pravidla: C 2 C 2 A B C D E S 2 C C 2 2 C C 2 C 2 F G I J 2. Určete, které z následujících
Organická chemie. Lektor: Mgr. Miroslav Zabadal, Ph.D.
 Přípravný kurz k přijp ijímacím m zkouškám m z chemie rganická chemie (2. část) (kurz CŽV) C Lektor: Mgr. Miroslav Zabadal, Ph.D. (zabadal@fch fch.vutbr.cz) 1 Chemické vazby v organických molekulách charakteristiky
Přípravný kurz k přijp ijímacím m zkouškám m z chemie rganická chemie (2. část) (kurz CŽV) C Lektor: Mgr. Miroslav Zabadal, Ph.D. (zabadal@fch fch.vutbr.cz) 1 Chemické vazby v organických molekulách charakteristiky
Halogenderiváty. Halogenderiváty
 Názvosloví Halogeny jsou v názvu vždy v předponě. Trichlormethan mátriviálnínázev CHLOROFORM Podle připojení halogenu je dělíme na primární sekundární a terciární Br Vazba mezi uhlíkem a halogenem je polarizovaná
Názvosloví Halogeny jsou v názvu vždy v předponě. Trichlormethan mátriviálnínázev CHLOROFORM Podle připojení halogenu je dělíme na primární sekundární a terciární Br Vazba mezi uhlíkem a halogenem je polarizovaná
Kyslíkaté deriváty uhlovodíků I
 deriváty kyslíkaté hydrysloučeniny alkoholy Kyslíkaté deriváty uhlovodíků I ethery fenoly 1. ydrysloučeniny. Thioly. Ethery karbonylové sloučeniny karbylové sloučeniny aldehydy ketony 1. ydrysloučeniny
deriváty kyslíkaté hydrysloučeniny alkoholy Kyslíkaté deriváty uhlovodíků I ethery fenoly 1. ydrysloučeniny. Thioly. Ethery karbonylové sloučeniny karbylové sloučeniny aldehydy ketony 1. ydrysloučeniny
Inovace bakalářského studijního oboru Aplikovaná chemie
 Inovace bakalářského studijního oboru Aplikovaná chemie http://aplchem.upol.cz Z.1.07/2.2.00/15.0247 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. ALKYNY
Inovace bakalářského studijního oboru Aplikovaná chemie http://aplchem.upol.cz Z.1.07/2.2.00/15.0247 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. ALKYNY
Rozdělení organických sloučenin
 Rozdělení organických sloučenin nenasycené nasycené aromatické Uhlovodíky, halogenderiváty X = F, l, Br, I sloučeniny síry S alkoholy, fenoly Deriváty uhlovodíků,,x,,n,s aminy NR 3 aldehydy, ketony nitrosloučeniny
Rozdělení organických sloučenin nenasycené nasycené aromatické Uhlovodíky, halogenderiváty X = F, l, Br, I sloučeniny síry S alkoholy, fenoly Deriváty uhlovodíků,,x,,n,s aminy NR 3 aldehydy, ketony nitrosloučeniny
Téma : DERIVÁTY VYPRACOVAT NEJPOZDĚJI DO
 Máte před sebou pracovní list. Téma : DERIVÁTY Jestliže ho zpracujete, máte možnost získat známku, která má nejvyšší hodnotu v elektronické žákovské knížce. Ovšem je nezbytné splnit následující podmínky:
Máte před sebou pracovní list. Téma : DERIVÁTY Jestliže ho zpracujete, máte možnost získat známku, která má nejvyšší hodnotu v elektronické žákovské knížce. Ovšem je nezbytné splnit následující podmínky:
Školní vzdělávací program
 Školní vzdělávací program Vyučovací předmět - Chemie Vzdělávací obor - Člověk a příroda Očekávané a školní výstupy - popíše a vysvětlí důkaz přítomnosti halogenů v organických sloučeninách jako halogenidů
Školní vzdělávací program Vyučovací předmět - Chemie Vzdělávací obor - Člověk a příroda Očekávané a školní výstupy - popíše a vysvětlí důkaz přítomnosti halogenů v organických sloučeninách jako halogenidů
3.3.3 Karbonylové sloučeniny
 3.3.3 Karbonylové sloučeniny V molekulách karbonylových sloučenin se nachází charakteristická (funkční) karbonylová skupina >C=O (oxoskupina). Ta je tvořena atomem kyslíku O, který je pomocí dvojné vazby
3.3.3 Karbonylové sloučeniny V molekulách karbonylových sloučenin se nachází charakteristická (funkční) karbonylová skupina >C=O (oxoskupina). Ta je tvořena atomem kyslíku O, který je pomocí dvojné vazby
Biotransformace Vylučování
 Biotransformace Vylučování Toxikologie Ing. Lucie Kochánková, Ph.D. Biotransformace proces chemické přeměny látek v organismu zpravidla enzymaticky katalyzované reakce vedoucí k látkám tělu vlastním nebo
Biotransformace Vylučování Toxikologie Ing. Lucie Kochánková, Ph.D. Biotransformace proces chemické přeměny látek v organismu zpravidla enzymaticky katalyzované reakce vedoucí k látkám tělu vlastním nebo
Organická chemie 2 Anotace Cíle Osnova předmětu
 Organická chemie 2 Anotace Organická chemie je zaměřena na sloučeniny uhlíku, jejich klasifikaci, názvosloví, strukturu a vlastnosti, jejich použití v praxi. Obsahem druhé části je chemie kyslíkatých derivátů
Organická chemie 2 Anotace Organická chemie je zaměřena na sloučeniny uhlíku, jejich klasifikaci, názvosloví, strukturu a vlastnosti, jejich použití v praxi. Obsahem druhé části je chemie kyslíkatých derivátů
CH 2 = CH 2 ethen systematický název propen CH 2 = CH CH 3 but-1-en CH 2 = CH CH 2 CH 3 but-2-en CH 3 CH = CH CH 3 buta-1,3-dien CH 2 = CH CH = CH 2
 Základní názvy organických látek alifatické nasycené alkany (příklady s nerozvětvenými řetězci) methan CH 4 ethan CH 3 CH 3 propan CH 3 CH 2 CH 3 butan CH 3 CH 2 CH 2 CH 3 pentan CH 3 CH 2 CH 2 CH 2 CH
Základní názvy organických látek alifatické nasycené alkany (příklady s nerozvětvenými řetězci) methan CH 4 ethan CH 3 CH 3 propan CH 3 CH 2 CH 3 butan CH 3 CH 2 CH 2 CH 3 pentan CH 3 CH 2 CH 2 CH 2 CH
Alkoholy. Alkoholy. sekundární. a terciární
 Názvosloví pokud je alkohol jedinou funkční skupinou je uveden v koncovce, např. butan-2-ol pokud je v molekule jináfunkčnískupina, kterámápřed alkoholem přednost, je uveden v předponě, např. 2-hydroxybutanová
Názvosloví pokud je alkohol jedinou funkční skupinou je uveden v koncovce, např. butan-2-ol pokud je v molekule jináfunkčnískupina, kterámápřed alkoholem přednost, je uveden v předponě, např. 2-hydroxybutanová
DERIVÁTY UHLOVODÍKŮ Obsah
 DERIVÁTY UHLOVODÍKŮ Obsah 27_Deriváty uhlovodíků... 2 28_Halogenderiváty... 3 PL: Halogenderiváty uhlovodíků řešení... 4 29_Dusíkaté deriváty... 5 30_Alkoholy a fenoly... 6 31_Karbonylové sloučeniny...
DERIVÁTY UHLOVODÍKŮ Obsah 27_Deriváty uhlovodíků... 2 28_Halogenderiváty... 3 PL: Halogenderiváty uhlovodíků řešení... 4 29_Dusíkaté deriváty... 5 30_Alkoholy a fenoly... 6 31_Karbonylové sloučeniny...
Dusík (N) - 3 Dusík (N + ) - 4 Uhlík ( C) - 4
 Úvod do chemie organických sloučenin Vaznost počet kovalentních vazeb atomu ve sloučeninách + + Methan 4 alkylamin R 2 alkylamonium R + 3 Vodík () - 1 Dusík () - 3 Dusík ( + ) - 4 Uhlík ( ) - 4 1 Vaznost
Úvod do chemie organických sloučenin Vaznost počet kovalentních vazeb atomu ve sloučeninách + + Methan 4 alkylamin R 2 alkylamonium R + 3 Vodík () - 1 Dusík () - 3 Dusík ( + ) - 4 Uhlík ( ) - 4 1 Vaznost
DUM VY_52_INOVACE_12CH24
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH24 autor: Kristýna Anna olníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 9. vzdělávací oblast: vzdělávací obor: tematický
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH24 autor: Kristýna Anna olníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 9. vzdělávací oblast: vzdělávací obor: tematický
2.3.2012. Oxidace. Radikálová substituce alkanů. Elektrofilní adice. Dehydrogenace CH 3 CH 3 H 2 C=CH 2 + 2 H. Oxygenace (hoření)
 xidace alkanů Dehydrogenace Reaktivita alkanů xidace Radikálová substituce 3 3 2 = 2 2 xygenace (hoření) 4 2 2 2 2 2 2 4 3 2 2 4 2 Radikálová substituce alkanů Iniciace (vznik radikálu, homolytické štěpení
xidace alkanů Dehydrogenace Reaktivita alkanů xidace Radikálová substituce 3 3 2 = 2 2 xygenace (hoření) 4 2 2 2 2 2 2 4 3 2 2 4 2 Radikálová substituce alkanů Iniciace (vznik radikálu, homolytické štěpení
PROPEN - PŘEHLED VYUŽITÍ
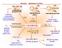 PRPEN - PŘEHLED VYUŽITÍ polymery propandioly propylenkarbonát isopropanolaminy C 4 aldehydy alkoholy kyseliny jejich estery CH methyloxiran (propylenoxid) hydroformylace hydrokarbonylace + 2 isopropylbenzen
PRPEN - PŘEHLED VYUŽITÍ polymery propandioly propylenkarbonát isopropanolaminy C 4 aldehydy alkoholy kyseliny jejich estery CH methyloxiran (propylenoxid) hydroformylace hydrokarbonylace + 2 isopropylbenzen
Fyzikální vlastnosti. Chemické vlastnosti
 ALKYNY (alkiny, acetylény) Trojná vazba, -sp Příprava alkynů 1. Eliminační metody R 1 B I R 2 R 1 2 B I B R 1 B I B R 2 R 1 R 2 R 2 3 2 Br Br K -KBr, 2 3 2. Syntetické metody Alkylace acetylidů (S N )
ALKYNY (alkiny, acetylény) Trojná vazba, -sp Příprava alkynů 1. Eliminační metody R 1 B I R 2 R 1 2 B I B R 1 B I B R 2 R 1 R 2 R 2 3 2 Br Br K -KBr, 2 3 2. Syntetické metody Alkylace acetylidů (S N )
Reaktivita oxosloučenin: Nukleofilní adice na karbonylovou skupinu Reakce vedle karbonylové skupiny Oxidace a redukce
 Názvosloví pokud je keton nebo aldehyd funkčnískupinou s nejvyššíprioritou (v praxi tedy obvykle jen kdyžv molekule neníobsažena karboxylováskupina) je uveden v koncovce, např. butan-2-on nebo butanal
Názvosloví pokud je keton nebo aldehyd funkčnískupinou s nejvyššíprioritou (v praxi tedy obvykle jen kdyžv molekule neníobsažena karboxylováskupina) je uveden v koncovce, např. butan-2-on nebo butanal
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í KARBOXYLOVÉ KYSELINY
 I N V E S T I E D R Z V J E V Z D Ě L Á V Á N Í KARBXYLVÉ KYSELINY = deriváty uhlovodíků, které obsahují alespoň jednu... skupinu... skupina H H... skupina Názvosloví Nasycené monokarboxylové kyseliny
I N V E S T I E D R Z V J E V Z D Ě L Á V Á N Í KARBXYLVÉ KYSELINY = deriváty uhlovodíků, které obsahují alespoň jednu... skupinu... skupina H H... skupina Názvosloví Nasycené monokarboxylové kyseliny
Ethery R-O-R. Příprava. 1) Williamsonova syntéza (alkylace alkoholátů, fenolátů) O R-O-R 1 -X S N R-X + R 1 -O-CH 3 CH 3 CH 2. -Br + CH 3.
 Ethery -- C 3 C 3 C3 alifatický ether dimethylether aromatický ether methoxybenzen (anisol) cyklický ether tetrahydrofuran trojčlenný ether - epoxid derivát ethylenoxidu (oxiranu) Příprava 1) Williamsonova
Ethery -- C 3 C 3 C3 alifatický ether dimethylether aromatický ether methoxybenzen (anisol) cyklický ether tetrahydrofuran trojčlenný ether - epoxid derivát ethylenoxidu (oxiranu) Příprava 1) Williamsonova
Charakteristika Teorie kyselin a zásad. Příprava kyselin Vlastnosti + typické reakce. Významné kyseliny. Arrheniova teorie Teorie Brönsted-Lowryho
 Petra Ustohalová 1 harakteristika Teorie kyselin a zásad Arrheniova teorie Teorie Brönsted-Lowryho Příprava kyselin Vlastnosti + typické reakce Fyzikální a chemické Významné kyseliny 2 Látky, které ve
Petra Ustohalová 1 harakteristika Teorie kyselin a zásad Arrheniova teorie Teorie Brönsted-Lowryho Příprava kyselin Vlastnosti + typické reakce Fyzikální a chemické Významné kyseliny 2 Látky, které ve
Halogenalkany H 3 CH 3. 2-brom-6-methylheptan. 6-brom-2,5-dimethylnonan
 alogenalkany Názvosloví Protože halogen je v pořadí charakteristických skupin na stejném místě jako alkylové skupiny, rozhoduje při tvorbě názvu nejnižsí sada lokantů, případně abecední pořadí. 6-brom-2,5-dimethylnonan
alogenalkany Názvosloví Protože halogen je v pořadí charakteristických skupin na stejném místě jako alkylové skupiny, rozhoduje při tvorbě názvu nejnižsí sada lokantů, případně abecední pořadí. 6-brom-2,5-dimethylnonan
Chemická odolnost neměkčeného polyvinylchloridu (PVC - U)
 Chemická odolnost neměkčeného polyvinylchloridu (PVC - U) Klasifikace materiálů v tabulce je zjednodušena do tří skupin: + Odolný - za běžných podmínek (tlak, ) materiál není nebo je jen zanedbatelně napadán
Chemická odolnost neměkčeného polyvinylchloridu (PVC - U) Klasifikace materiálů v tabulce je zjednodušena do tří skupin: + Odolný - za běžných podmínek (tlak, ) materiál není nebo je jen zanedbatelně napadán
NaLékařskou.cz Přijímačky nanečisto
 alékařskou.cz Chemie 2016 1) Vyberte vzorec dichromanu sodného: a) a(cr 2 7) 2 b) a 2Cr 2 7 c) a(cr 2 9) 2 d) a 2Cr 2 9 2) Vypočítejte hmotnostní zlomek dusíku v indolu. a) 0,109 b) 0,112 c) 0,237 d) 0,120
alékařskou.cz Chemie 2016 1) Vyberte vzorec dichromanu sodného: a) a(cr 2 7) 2 b) a 2Cr 2 7 c) a(cr 2 9) 2 d) a 2Cr 2 9 2) Vypočítejte hmotnostní zlomek dusíku v indolu. a) 0,109 b) 0,112 c) 0,237 d) 0,120
16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší?
 16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší? 4) Urči typy konstituční izomerie. 5) Co je tautomerie
16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší? 4) Urči typy konstituční izomerie. 5) Co je tautomerie
6. Vyberte látku, která má nepolární charakter: 1b. a) voda b) diethylether c) kyselina bromovodíková d) ethanol e) sulfan
 1. Ionizace je: 1b. a) vysrážení iontů z roztoku b) vznik iontových vazeb c) solvatace iontů d) vznik iontů z elektroneutrálních sloučenin e) elektrolýza sloučenin 2. Počet elektronů v orbitalech s,p,d,f
1. Ionizace je: 1b. a) vysrážení iontů z roztoku b) vznik iontových vazeb c) solvatace iontů d) vznik iontů z elektroneutrálních sloučenin e) elektrolýza sloučenin 2. Počet elektronů v orbitalech s,p,d,f
Teoretický protokol ze cvičení 6. 12. 2010 Josef Bušta, skupina: 1, obor: fytotechnika
 Úloha: Karboxylové kyseliny, č. 3 Úkoly: Příprava kys. mravenčí z chloroformu Rozklad kys. mravenčí Esterifikace Rozklad kys. šťavelové Příprava kys. benzoové oxidací toluenu Reakce kys. benzoové a salicylové
Úloha: Karboxylové kyseliny, č. 3 Úkoly: Příprava kys. mravenčí z chloroformu Rozklad kys. mravenčí Esterifikace Rozklad kys. šťavelové Příprava kys. benzoové oxidací toluenu Reakce kys. benzoové a salicylové
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Biochemicky významné sloučeniny a reakce - testík na procvičení
 Biochemicky významné sloučeniny a reakce - testík na procvičení Vladimíra Kvasnicová Vyberte pravdivé(á) tvrzení o heterocyklech: a) pyrrol je součástí struktury hemu b) indol je součástí struktury histidinu
Biochemicky významné sloučeniny a reakce - testík na procvičení Vladimíra Kvasnicová Vyberte pravdivé(á) tvrzení o heterocyklech: a) pyrrol je součástí struktury hemu b) indol je součástí struktury histidinu
Jednou z nejdůležitějších skupin derivátů uhlovodíků jsou sloučeniny obsahující jednovazné hydroxylové skupiny OH, proto hydroxyderiváty:
 ALKOHOLY, FENOLY A ANALOGICKÉ SIRNÉ SLOUČENINY Jednou z nejdůležitějších skupin derivátů uhlovodíků jsou sloučeniny obsahující jednovazné hydroxylové skupiny OH, proto hydroxyderiváty: Obecný vzorec hydroxysloučenin
ALKOHOLY, FENOLY A ANALOGICKÉ SIRNÉ SLOUČENINY Jednou z nejdůležitějších skupin derivátů uhlovodíků jsou sloučeniny obsahující jednovazné hydroxylové skupiny OH, proto hydroxyderiváty: Obecný vzorec hydroxysloučenin
Organická chemie 1 - sylabus
 Organická chemie 1 - sylabus Anotace Organická chemie je zaměřena na sloučeniny uhlíku, jejich klasifikaci, názvosloví, strukturu a vlastnosti, jejich použití v praxi. Obsahem první části jsou obecné principy
Organická chemie 1 - sylabus Anotace Organická chemie je zaměřena na sloučeniny uhlíku, jejich klasifikaci, názvosloví, strukturu a vlastnosti, jejich použití v praxi. Obsahem první části jsou obecné principy
SADA VY_32_INOVACE_CH1
 SADA VY_32_INOVACE_CH1 Přehled anotačních tabulek k dvaceti výukovým materiálům vytvořených Mgr. Danou Tkadlecovou. Kontakt na tvůrce těchto DUM: tkadlecova@szesro.cz Základy názvosloví anorganických sloučenin
SADA VY_32_INOVACE_CH1 Přehled anotačních tabulek k dvaceti výukovým materiálům vytvořených Mgr. Danou Tkadlecovou. Kontakt na tvůrce těchto DUM: tkadlecova@szesro.cz Základy názvosloví anorganických sloučenin
Ukázky z pracovních listů
 Ukázky z pracovních listů 2. V nádobách na obrázku č. 2 jsou látky, které můžeme mít doma. Některé z nich jsou anorganické a některé jsou organické. Dokážeš je roztřídit a zapsat do uvedeného schématu
Ukázky z pracovních listů 2. V nádobách na obrázku č. 2 jsou látky, které můžeme mít doma. Některé z nich jsou anorganické a některé jsou organické. Dokážeš je roztřídit a zapsat do uvedeného schématu
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 VY_32_INOVACE_C.3.01 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT
VY_32_INOVACE_C.3.01 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT
Inovace bakalářského studijního oboru Aplikovaná chemie
 Inovace bakalářského studijního oboru Aplikovaná chemie http://aplchem.upol.cz Z.1.07/2.2.00/15.0247 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Rozdělení
Inovace bakalářského studijního oboru Aplikovaná chemie http://aplchem.upol.cz Z.1.07/2.2.00/15.0247 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Rozdělení
KARBOXYLOVÉ KYSELINY
 KARBXYLVÉ KYSELINY kyslíkaté deriváty uhlovodíků v jejichž molekulách se vyskytuje jedna nebo více karboxylových skupin karboxylová skupina vzniká spojením karbonylové a hydroxylové skupiny rozlišujeme:
KARBXYLVÉ KYSELINY kyslíkaté deriváty uhlovodíků v jejichž molekulách se vyskytuje jedna nebo více karboxylových skupin karboxylová skupina vzniká spojením karbonylové a hydroxylové skupiny rozlišujeme:
P Ř ÍRODOVĚ DECKÁ FAKULTA
 OSTRAVSKÁ UNIVERZITA P Ř ÍRODOVĚ DECKÁ FAKULTA ORGANICKÁ CEMIE I ING. RUDOLF PETER, CSC. OSTRAVA 2003 Na této stránce mohou být základní tirážní údaje o publikaci. 1 OBSA PŘ EDMĚ TU Úvod... 3 1. Alkany...
OSTRAVSKÁ UNIVERZITA P Ř ÍRODOVĚ DECKÁ FAKULTA ORGANICKÁ CEMIE I ING. RUDOLF PETER, CSC. OSTRAVA 2003 Na této stránce mohou být základní tirážní údaje o publikaci. 1 OBSA PŘ EDMĚ TU Úvod... 3 1. Alkany...
DUM VY_52_INOVACE_12CH31
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH31 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 9. vzdělávací oblast: vzdělávací obor:
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH31 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 9. vzdělávací oblast: vzdělávací obor:
Testy k procvičení Základy organické chemie
 1. Které z uvedených vzorců představují organické sloučeniny? C 6 H 12 O 6 (A), Na 2 CO 3 (B), NH 2 CONH 2 (C), CuSO 4 (D), HCI 3 (E), CO (F), C 2 H 6 (G) a) ABCE b) ACDG c) ACEG d) ACFG 2. Typické vaznosti
1. Které z uvedených vzorců představují organické sloučeniny? C 6 H 12 O 6 (A), Na 2 CO 3 (B), NH 2 CONH 2 (C), CuSO 4 (D), HCI 3 (E), CO (F), C 2 H 6 (G) a) ABCE b) ACDG c) ACEG d) ACFG 2. Typické vaznosti
Struktura organických sloučenin
 Struktura organických sloučenin Vzorce: Empirický (stechiometrický) druh atomů a jejich poměrné zastoupení v molekule Sumární(molekulový) druh a počet atomů v molekule Strukturní které atomy jsou spojeny
Struktura organických sloučenin Vzorce: Empirický (stechiometrický) druh atomů a jejich poměrné zastoupení v molekule Sumární(molekulový) druh a počet atomů v molekule Strukturní které atomy jsou spojeny
1.2. ALICYKLICKÉ UHLOVODÍKY
 1.. ALIYKLIKÉ ULVDÍKY Lze je rozdělit podle skeletu. Monocyklické apř. Bicyklické spirocyklické, např. cyklopropan spiro[4.5]dekan můstkové, např. bicyklo[3..1]oktan Vícecyklické, které mohou být spirocyklické,
1.. ALIYKLIKÉ ULVDÍKY Lze je rozdělit podle skeletu. Monocyklické apř. Bicyklické spirocyklické, např. cyklopropan spiro[4.5]dekan můstkové, např. bicyklo[3..1]oktan Vícecyklické, které mohou být spirocyklické,
Řešené příklady k procvičení
 Řešené příklady k procvičení 1. Nakreslete strukturní vzorce všech následujících látek a označte, které jsou chirální nebo jsou mezosloučeninami. cischlorcyklohexanol transchlorcyklohexanol cischlorcyklohexanol
Řešené příklady k procvičení 1. Nakreslete strukturní vzorce všech následujících látek a označte, které jsou chirální nebo jsou mezosloučeninami. cischlorcyklohexanol transchlorcyklohexanol cischlorcyklohexanol
1.1.2. ALKENY C n H 2n
 1.1.. ALKEY n n 1.1..1. Příprava 1 3 4 I) Z látek se stejným počtem atomů především eliminační reakce 1) Transeliminace v tranzitním stavu jsou eliminující skupiny v antiperiplanární konformaci a) Dehydrohalogenace
1.1.. ALKEY n n 1.1..1. Příprava 1 3 4 I) Z látek se stejným počtem atomů především eliminační reakce 1) Transeliminace v tranzitním stavu jsou eliminující skupiny v antiperiplanární konformaci a) Dehydrohalogenace
Acetylen. Tlakové láhve s acetylenem. Toxicita acetylenu
 Acetylen Acetylen je triviální název pro nejjednodušší alkyn ethyn (dříve psáno ethin). Acetylen je za normálního tlaku a teploty bezbarvý plyn. Jeho teplota varu je -80,8 C. Čistý acetylen je bez zápachu,
Acetylen Acetylen je triviální název pro nejjednodušší alkyn ethyn (dříve psáno ethin). Acetylen je za normálního tlaku a teploty bezbarvý plyn. Jeho teplota varu je -80,8 C. Čistý acetylen je bez zápachu,
Sol gel metody. Si O Si + H 2 O (2)
 Sol gel metody Zdeněk Moravec (hugo@chemi.muni.cz) Sol gel metody jsou používány pro přípravu hlavně anorganických oxidických materiálů a dále pro syntézu organicko-anorganických kompozitních materiálů,
Sol gel metody Zdeněk Moravec (hugo@chemi.muni.cz) Sol gel metody jsou používány pro přípravu hlavně anorganických oxidických materiálů a dále pro syntézu organicko-anorganických kompozitních materiálů,
Chemie NÁRODNÍ SROVNÁVACÍ ZKOUŠKY DUBNA 2017
 NÁRODNÍ SROVNÁVACÍ ZKOUŠKY Chemie T DUBNA 2017 : 29. dubna 2017 D : 348 : 30 M. M. : 30,0 : 29,0 M. : 9,7 % S : -10,0 M. : -2,0 : 13,5 Zopakujte si základní informace ke zkoušce: n Test obsahuje 30 úloh.
NÁRODNÍ SROVNÁVACÍ ZKOUŠKY Chemie T DUBNA 2017 : 29. dubna 2017 D : 348 : 30 M. M. : 30,0 : 29,0 M. : 9,7 % S : -10,0 M. : -2,0 : 13,5 Zopakujte si základní informace ke zkoušce: n Test obsahuje 30 úloh.
Karboxylové kyseliny. Ing. Lubor Hajduch ZŠ Újezd Kyjov
 Karboxylové kyseliny Ing. Lubor Hajduch ZŠ Újezd Kyjov Karboxylové kyseliny Karboxylové kyseliny jsou deriváty uhlovodíků, které obsahují charakteristickou skupinu -COOH. Karboxylové sloučeniny Dělení:
Karboxylové kyseliny Ing. Lubor Hajduch ZŠ Újezd Kyjov Karboxylové kyseliny Karboxylové kyseliny jsou deriváty uhlovodíků, které obsahují charakteristickou skupinu -COOH. Karboxylové sloučeniny Dělení:
Chemie - Sexta, 2. ročník
 - Sexta, 2. ročník Chemie Výchovné a vzdělávací strategie Kompetence komunikativní Kompetence k řešení problémů Kompetence sociální a personální Kompetence občanská Kompetence k podnikavosti Kompetence
- Sexta, 2. ročník Chemie Výchovné a vzdělávací strategie Kompetence komunikativní Kompetence k řešení problémů Kompetence sociální a personální Kompetence občanská Kompetence k podnikavosti Kompetence
Brno e) Správná odpověď není uvedena. c) KHPO4. e) Správná odpověď není uvedena. c) 49 % e) Správná odpověď není uvedena.
 Brno 2019 1. Vyberte vzoreček hydrogenfosforečnanu draselného. a) K2HP4 d) K3P4 b) K(HP4)2 c) KHP4 2. Vyjádřete hmotnostní procenta síry v kyselině thiosírové. Ar(S) = 32, Ar() = 16, Ar(H) = 1 a) 28 %
Brno 2019 1. Vyberte vzoreček hydrogenfosforečnanu draselného. a) K2HP4 d) K3P4 b) K(HP4)2 c) KHP4 2. Vyjádřete hmotnostní procenta síry v kyselině thiosírové. Ar(S) = 32, Ar() = 16, Ar(H) = 1 a) 28 %
Chemie. 5. K uvedeným vzorcům (1 5) přiřaďte tvar struktury (A D) jejich molekuly. 1) CO 2 2) SO 2 3) SO 3 4) NH 3 5) BF 3.
 Chemie 1. Analýzou vzorku bylo zjištěno, že vzorek o hmotnosti 25 g obsahuje 15,385 g mědi, 3,845 g síry a zbytek připadá na kyslík. Který empirický vzorec uvedeným výsledkům analýzy odpovídá? A r (Cu)
Chemie 1. Analýzou vzorku bylo zjištěno, že vzorek o hmotnosti 25 g obsahuje 15,385 g mědi, 3,845 g síry a zbytek připadá na kyslík. Který empirický vzorec uvedeným výsledkům analýzy odpovídá? A r (Cu)
1. Jeden elementární záporný náboj 1,602.10-19 C nese částice: a) neutron b) elektron c) proton d) foton
 varianta A řešení (správné odpovědi jsou podtrženy) 1. Jeden elementární záporný náboj 1,602.10-19 C nese částice: a) neutron b) elektron c) proton d) foton 2. Sodný kation Na + vznikne, jestliže atom
varianta A řešení (správné odpovědi jsou podtrženy) 1. Jeden elementární záporný náboj 1,602.10-19 C nese částice: a) neutron b) elektron c) proton d) foton 2. Sodný kation Na + vznikne, jestliže atom
5. CHEMICKÉ REAKCE. KLASIFIKACE CHEMICKÝCH REAKCÍ a) Podle vnějších změn Reakce skládání = SYNTÉZY z jednodušších -> složitější 2H 2 + O 2 -> 2H 2 O
 Na www.studijni-svet.cz zaslal(a): Kikusska94 5. CHEMICKÉ REAKCE Je děj při kterém v molekulách reagujících látek dochází k zániku některých vazeb a ke vzniku vazeb nových. Produkty rekce mají jiné chemické
Na www.studijni-svet.cz zaslal(a): Kikusska94 5. CHEMICKÉ REAKCE Je děj při kterém v molekulách reagujících látek dochází k zániku některých vazeb a ke vzniku vazeb nových. Produkty rekce mají jiné chemické
1. ročník Počet hodin
 SOUSTAVY LÁTEK A JEJICH SLOŽENÍ rozdělení přírodních látek a vlastnosti chemických látek soustavy látek a jejich složení STAVBA ATOMU historie pohledu na atom složení a struktura atomu stavba atomu VELIČINY
SOUSTAVY LÁTEK A JEJICH SLOŽENÍ rozdělení přírodních látek a vlastnosti chemických látek soustavy látek a jejich složení STAVBA ATOMU historie pohledu na atom složení a struktura atomu stavba atomu VELIČINY
