CREDIT ČESKÝ REGISTR IBD PACIENTŮ NA BIOLOGICKÉ TERAPII
|
|
|
- Renata Benešová
- před 6 lety
- Počet zobrazení:
Transkript
1 CREDIT ČESKÝ REGISTR IBD PACIENTŮ NA BIOLOGICKÉ TERAPII Datum vydání: Číslo protokolu: IBA1062 Autor: Mgr. Martina Nováčková Tento dokument obsahuje informace důvěrného charakteru. Žádná část dokumentu nesmí být kopírována, uchovávána v dokumentovém systému, ani žádným způsobem přenášena, včetně elektronického, mechanického, fotografického či jiného záznamu, ani uveřejněna či poskytnuta třetí straně bez předchozí dohody a písemného souhlasu vlastníků. Registered e-document
2
3 Historie Verze Nahrazuje Změny Platné od revidoval Jelínková Upraven seznam sponzorů, doplněna informace o centrech, doplnění loga Jelínková Formální úprava Jelínková Změna formátu dokumentu Úprava kapitoly 8, zohlednění směrnice GDPR. Nově přiřazena kapitola 15. Řízení rizik Nováčková 2/16
4 Obsah 1. Základní informace o projektu Úvod Typ studie Cíle projektu Primární cíle Sekundární cíle Design projektu Počet a údaje o subjektech zapojených do projektu Inkluzní kritéria Exkluzní kritéria Zapojená centra/participující investigátoři Odměny investigátorům Expozice - Hodnocený léčivý přípravek Metodologie Iniciátor projektu Data management Statistické zpracování Statistický analytický plán Statistická metodika zpracování dat Plán analýz Regulatorní a legislativní požadavky Legislativní požadavky Ochrana osobních údajů Zpracování OÚ subjektů hodnocení Zpracování osobních údajů investigátorů Zajištění ochrany osobních údajů Popis archivace/likvidace dat po skončení projektu Subjekty, s nimiž budou data sdílena Regulatorní požadavky /16
5 9. Farmakovigilance Pojištění Zaškolení center a zahájení sběru dat Harmonogram Harmonogram sběru dat Harmonogram projektu Kontrola a jištění kvality Řízení rizik Reference Seznam příloh Příloha 1 Seznam zapojených center Příloha 2 Informovaný souhlas Příloha 3 Statut registru CREdIT Seznam použitých zkratek AE/SAE CRO ČGS ČLS JEP CN EDC EU GDPR IBA IBD ICF ID Nežádoucí příhoda / Vážná nežádoucí příhoda Contract research organization Česká gastroenterologická společnost Česká lékařská společnost Jana Evangelisty Purkyně Crohnova nemoc Elektronický systém pro sběr dat Evropská unie Obecné nařízení o ochraně osobních údajů Institut biostatistiky a analýz Idiopatické střevní záněty Informovaný souhlas Unikátní identifikační kód pacienta 4/16
6 IEC ISO LEK LP MEK NIS OÚ PhV SAP SÚKL UC Mezinárodní elektrotechnická komise Mezinárodní organizace pro standardizaci Lokální etická komise Léčivý přípravek Multicentrická etická komise Neintervenční studie Osobní údaj/e Farmakovigilance Statistický analytický plán Státní Ústav pro kontrolu léčiv Ulcerózní kolitida 5/16
7 1. Základní informace o projektu Tabulka 1: Základní informace o projektu Celý název projektu Zkrácený název projektu Očekávaná délka projektu (datum od-do) Číslo protokolu Český registr IBD pacientů na biologické terapii (Czech REgistry of IBD patients on biological Therapy) CREdIT neurčito IBA1062 Odborný garant Jméno a příjmení Klinika/oddělení Stát prof. MUDr. Milan Lukáš, CSc., MUDr. Martin Bortlík, Ph.D. ČGS ČLS JEP Česká republika Institut biostatistiky a analýz, s.r.o. Poštovská 68/ Brno CRO Jazyk IČ: Projektový manažer Data manažer Analytik český Mgr. Martina Nováčková Ing. David Pavlík Mgr. Kateřina Fröhlich, Mgr. Matyáš Kuhn Charakteristika populace pacientů Pacienti s diagnostikovaným IBD a léčení léčivými přípravky biologické léčby. Datum vydání verze Verze protokolu 4.0 6/16
8 2. Úvod Idiopatické střevní záněty (Crohnova choroba a ulcerózní kolitida) jsou chronická zánětlivá onemocnění trávicí trubice postihující především mladé osoby ve věku let. Jde o medikamentózně nevyléčitelné choroby významně ovlivňující kvalitu života a pracovní i sociální aktivity postižených jedinců. Jejich výskyt v populaci ČR narůstá, současné odhady předpokládají postižení 0,3-0,5% populace. Základem péče o nemocné je dlouhodobá medikamentózní terapie v indikovaných případech doplněná o léčbu chirurgickou. Pacienti s idiopatickými střevními záněty (dále IBD) jsou při vyčerpání možností konzervativní medikamentózní terapie (aminosalicyláty, kortikosteroidy, imunosupresiva) indikováni k podání biologické terapie. Jde o nejúčinnější formu léčby IBD, která je obvykle podávána dlouhodobě. Její aplikace v ČR probíhá ve specializovaných centrech. V současné době je v ČR léčeno biologicky přibližně 10% celkové populace IBD pacientů, odhady v zemích západní Evropy uvádějí 20-30%. Z tohoto důvodu a také v souvislosti s dalšími faktory (snižování ceny, zavádění nových biologik) lze předpokládat v budoucnu významný nárůst pacientů léčených biologickou terapií. Informace získané prostřednictvím registrů léčených pacientů mohou zásadním způsobem přispět ke zlepšení účinnosti a bezpečnosti biologické terapie IBD Typ studie Neintervenční multicentrická retrospektivně prospektivní longitudinální studie, v rámci níž budou sbírána prospektivní data o pacientech s idiopatickými střevními záněty léčených léčivými přípravky biologické léčby. 3. Cíle projektu 3.1. Primární cíle Hlavním cílem projektu je sledování celkového počtu pacientů léčených léčivými přípravky biologické léčby v České republice Sekundární cíle Další cíle studie jsou hodnocení efektivity biologické léčby, hodnocení bezpečnosti biologické léčby, hodnocení kvality života prostřednictvím dotazníků kvality života, hodnocení terapeutických režimů a sledování délky biologické léčby IBD pacientů 7/16
9 4. Design projektu 4.1. Počet a údaje o subjektech zapojených do projektu Do studie budou zapojena centra z České republiky se zaměřením na léčbu IBD biologickou léčbou. Seznam center je uveden v Příloze č Inkluzní kritéria pacient s diagnostikovanou IBD probíhající nebo nově zahájena biologická léčba Exkluzní kritéria nesouhlas pacienta se zařazením do studie 4.2. Zapojená centra/participující investigátoři Seznam zapojených center je připojen k dokumentu formou přílohy Odměny investigátorům Lékařům není poskytována žádná náhrada konkrétních nákladů (lékaři si své náklady s účastí na projektu nesou sami) nad rámec odměny za poskytnuté služby. 5. Expozice - Hodnocený léčivý přípravek V rámci studie se hodnotí léčivé přípravky biologické léčby. 8/16
10 6. Metodologie 6.1. Iniciátor projektu Česká gastroenterologická společnost České lékařské společnosti Jana Evangelisty Purkyně (ČGS ČLS JEP) Data management Data budou sbírána pomocí elektronických formulářů systému CLADE IS, elektronickým systémem vyvinutým na IBA pro sběr dat v rámci klinických studií (EDC systém). V systému budou nastavena validační pravidla pro zajištění kontrolovaného sběru dat: hraniční hodnoty, logické návaznosti a propojení souvisejících polí. 7. Statistické zpracování Data budou centrálně statisticky zpracována, analyzována a vyhodnocována Institutem biostatistiky a analýz, s.r.o., Poštovská, Brno Statistický analytický plán Statistický analytický plán není součástí analýzy dat. Obecné informace k analýze jsou specifikovány níže. Výstupy analýz budou poskytovány ve formě powerpointové prezentace. Počet pacientů v registru není omezen. Předpokládá se, že náběr pacientů bude probíhat rychlostí přibližně 1000 pacientů za 1 rok Statistická metodika zpracování dat S ohledem na charakter projektu budou použity metody deskriptivní statistiky běžně používané v epidemiologických studiích. Součástí závěrečné statistické zprávy bude deskriptivní vyhodnocení primárních a sekundárních cílů registru a všech sledovaných parametrů u jednotlivých pacientů. Statistická analýza bude respektovat typy dat (spojitá, ordinální, binární) a rozložení hodnot (normální log-normální aj.). Budou vypočteny základní statistické parametry (průměr, medián, relativní podíl) a ukazatele spolehlivosti odhadu parametrů ve skupinách pacientů (SD, interval spolehlivosti, percentily). 9/16
11 Pro testování proměnných odpovídajících cílům studie u sledovaných skupin pacientů budou použity standardní statistické metody, což znamená, že v případě spojitých proměnných budou použity podle normality dat buď parametrické (t-test, analýza rozptylu) nebo neparametrické testy (Mann-Whitney test, Kruskal-Wallis test). V případě hodnocení vztahu kategoriálních proměnných pak bude použit odpovídající test pro kontingenční tabulky, Fisherův exaktní test pro dvě kategorie binárního charakteru (ano/ne) a Pearsonův chi-kvadrát test pro hodnocení vztahu dvou proměnných s více než dvěma kategoriemi. Pro stanovení statistické významnosti bude použita standardní hladina α=0,05, která bude při mnohonásobném testování adekvátně korigována. Chybějící data nebudou nahrazována či imputována. Při statistickém zpracování budou použita data všech pacientů zařazených do registru splňující vstupní kritéria. Sekundární cíl, hodnocení efektivity biologické léčby, se bude vyhodnocovat na základě aktivity onemocnění při zahájení, v době průběžných záznamů a při ukončení biologické terapie dle: Harvey-Bradshaw index (CN) o Remission <5 o Mild disease 5-7 o Moderate disease 8-16 o Severe disease >16 Mayo skóre (UC) o remission ( 2) o mild (3-5) o moderate (6-8) o severe (9-12) Změna od vstupní hodnoty bude při vyhodnocování kompletní analýzy statisticky testována za explorativním účelem Plán analýz Kompletní analýza dat zaměřená na diagnostickou jednotku bude probíhat jedenkrát ročně, stejně tak bude probíhat i analýza dat zaměřená na léčbu konkrétním preparátem. Za publikaci dat je zodpovědný řídící výbor Registru. 10/16
12 Dílčí analytické výstupy budou poskytovány na žádost odborné společnosti nebo center, po schválení Řídícího výboru registru, z exportu dat. Dílčí analytické výstupy týkající se dat konkrétního centra budou poskytovány na žádost centra z exportu dat. 8. Regulatorní a legislativní požadavky 8.1. Legislativní požadavky Ochrana osobních údajů Zpracování osobních údajů fyzických osob zapojených do registru probíhá v souladu s požadavky a ustanoveními zákona č. 101/2000 Sb., o ochraně osobních údajů a o změně některých zákonů, ve znění pozdějších předpisů, případně s právním předpisem tento zákon nahrazující, a v souladu s Nařízením Evropského parlamentu a Rady EU 2016/679 o ochraně fyzických osob v souvislosti se zpracováním osobních údajů a o volném pohybu těchto údajů (dále jen GDPR ). Správce i zpracovatel OÚ jsou povinni dodržovat pravidla a povinnosti z GDPR vyplývající, především zajistit bezpečnost zpracování OÚ zavedením dostatečných organizačních a technických opatření, stejně jako nastavit procesy pro uplatnění práv subjektů údajů. Ať už v rámci registru dochází ke zpracování osobních, pseudonymních či anonymních údajů, vždy se jedná o zpracování chráněných informací. Společnost IBA má proto zavedený systém řízení bezpečnosti informací ISMS dle mezinárodní normy ISO/IEC Tímto jsou zavedeny taková technická a organizační opatření, jaké jsou normou, ale i evropskou legislativou GDPR při zpracování OÚ vyžadovány Zpracování OÚ subjektů hodnocení Správcem osobních údajů v rámci registru je Institut biostatistiky a analýz, s.r.o., IČ: , se sídlem Poštovská 68/3, Brno, zapsaná v obchodním rejstříku vedeném KS v Brně, sp. zn. C (dále jen IBA ), který zajišťuje vedení tohoto registru z pohledu projektového, technického a analytického. Zpracování OÚ pacienta probíhá výhradně na základě podepsaného výslovného informovaného souhlasu. Za získání informovaného souhlasu pacienta pro účely vědeckého a statistického hodnocení v rámci registru (přesná definice účelu/účelů zpracování je uvedena ve vzorovém ICF, který je přílohou tohoto protokolu) odpovídá IBA, respektive ošetřující lékař (investigátor)/ poskytovatel zdravotních služeb (centrum) v závislosti na podmínkách uzavřené smlouvy. Pacient bez podepsaného informovaného souhlasu nesmí být do daného projektu, registru či studie zařazen. Informaci o udělení informovaného 11/16
13 souhlasu subjektem hodnocení je taktéž nutno potvrdit v samotném registru (EDC systému), bez potvrzení pacienta do registru nelze zadat. Zpracovatelem údajů pacientů v registru je investigátor/poskytovatel zdravotnických služeb. Lékař zadává pacienta do registru pod unikátním číselným kódem (ID) a je tak jedinou osobou, která může pacienta na základě ID identifikovat. Pacient je informován o svých právech, která mu v souvislosti se zpracováním jeho údajů náleží, stejně jako o způsobu jejich uplatnění formou informovaného souhlasu. Lékař je seznámen s pravidly pro zpracování OÚ pacienta formou závazné směrnice, poskytnuté správcem OÚ tedy IBA. Pacienti jsou o předání svých OÚ IBA řádně informováni v rámci informovaného souhlasu Zpracování osobních údajů investigátorů V rámci registru dochází ke zpracovávání osobních údajů investigátorů, a to na základě plnění smlouvy o spolupráci pro účely zadávání dat do registru, vytvoření přístupových účtů a vyplácení odměn za provedenou práci. Na základě oprávněného zájmu správce jsou OÚ investigátora zpracovávány v rámci komunikace pro zajištění plynulého chodu registru a kvality dat. Správcem OÚ investigátorů v rámci registru je IBA. Investigátoři jsou o zpracování svých OÚ stejně jako o svých právech patřičně informováni Zajištění ochrany osobních údajů Pro zajištění maximální bezpečnosti sbíraných dat v registru, IBA jakožto správce zavedla následující opatření v souladu s etickými a právními požadavky. Technické zajištění elektronického sběrného systému dat Interní předpisy pro nakládání s osobními údajů, řízení incidentů a rizik, systém školení Řízený přístup k chráněným informacím na základě přidělených oprávnění pro zaměstnance IBA i další zainteresované strany přistupující do EDC systému Školení investigátorů Popis archivace/likvidace dat po skončení projektu Data nasbíraná během trvání projektu zůstávají uložená v DB elektronického sběrného systému po dobu minimálně 15 let. Fyzicky jsou data uložena na zabezpečených serverech IBA. Po uplynutí této doby jsou data bezpečně zlikvidována. 12/16
14 Subjekty, s nimiž budou data sdílena Např.: Primární data nebudou sdílena s nikým. Sekundární data budou k dispozici jiným centrům, mohou být publikována, nebo se souhlasem odborné rady projektu postoupeny třetím stranám Regulatorní požadavky V rámci studie je vyžadován informovaný souhlas pacienta se sběrem dat viz Příloha č. 2. Informovaný souhlas dle pravidel GDPR bude schválen multicentrickou etickou komisí. Dle nařízení PhV 3 verze 3 SÚKL, ( 3a odst. 2 ZoL), se jedná o neintervenční poregistrační studii a jako taková je nahlášena na SÚKL jako tzv. jiný typ studie. 9. Farmakovigilance V rámci registru je nastaveno hlášení nežádoucích příhod. Po vyplnění příslušného formuláře lékařem/datamanažerem, bude hlášení automaticky odesláno na farmakovigilanční oddělení IBA, kde proběhne revize hlášení kontrola údajů, případně další komunikace s lékařem. Hlášení AE/SAE může být odesíláno na PV oddělení držitele registrace dle PV smlouvy. Za ohlášení nežádoucích příhod spojených s léčbou jakéhokoliv léčivého přípravku na SÚKL je zodpovědný zdravotnický personál, a to podle platné legislativy a nařízení České republiky. 10. Pojištění Není vyžadováno. 11. Zaškolení center a zahájení sběru dat Centrům/investigátorům je poskytnut technický manuál k databázi. Proběhlo školení zapojených center prostřednictvím telekonferenčního zařízení ve dvou termínech. Školení investigátorů na problematiku ochrany osobních údajů v rámci studie bude probíhat proškolením Směrnice o zpracování osobních údajů dodané správcem, Publikační pravidla Vedoucí center budou schvalovat použití dat daného centra a jejich účel. Dílčí analytické výstupy budou vždy potvrzeny prostřednictvím hlasovací aplikace. Roční souhrnné výstupy budou automaticky prováděny 13/16
15 na datech všech center bez potřeby přímého souhlasu; tyto výstupy schvaluje před uveřejněním řídící výbor Registru. Prezentované výstupy (např. na stránkách projektu) mohou sloužit jako podklad pro publikaci, je nutné vždy uvést zdroj. 12. Harmonogram Harmonogram sběru dat Při nasazení léčby a při switchi z jiného preparátu se založí Vstupní formulář. Follow-up intervaly sběru dat jsou rozdílné dle typu preparátu a roku: rok léčby počet kontrol adalimumab á 12 týdnů 4 golimumab á 12 týdnů 4 infliximab cca cca 7 ustekinumab á 12 týdnů 4 vedolizumab cca cca 7 Při ukončení léčby nebo při switchi na jiný preparát se vyplní Ukončovací formulář Harmonogram projektu Proces Zodpovědná osoba Termín Vytvoření protokolu Jelínková, Hejduk, Bortlík, Frölich listopad - prosinec 2015 Schválení protokolu Bortlík, Lukáš prosinec 2015 Vytvoření a schválení inf. souhlasu Bortlík, Jelínková listopad 2015 Vytvoření CRF Bortlík, Baranová listopad-prosinec 2015 Schválení MEK Jelínková leden /16
16 Nahlášení projektu na SUKL Jelínková únor 2016 Vytvoření ecrf Jobánková, Pavlík prosinec únor 2015/2016 Schválení ecrf Bortlík, Lukáš leden 2016 Školení center Lukáš, Bortlík, Jelínková, Stáňa, Pavlík březen 2016 Zahájení sběru dat lékaři center leden-duben 2016 Smluvní zajištění Jelínková, Hejduk listopad březen 2016 Reporting Stáňa od měsíčně 13. Kontrola a jištění kvality V projektu neprobíhá monitoring zapojených center. Kontrola dat je nastavena pomocí EDC systému, není zajištěna kontrola se zdrojovou dokumentací. Bude sepsán data management a data validační plán. 14. Řízení rizik Proces řízení rizik v projektu probíhá dle standartních operačních postupů vedených v rámci systému řízení jakosti IBA. V rámci registru jsou zvažována následující rizika. Riziko Technická rizika. EDC systém nesplňuje všechny požadavky studie. Legislativní rámec. Změna legislativy, která ovlivní průběh projektu Rozpočet projektu. Průběh projektu a jeho délka závisí na financování projektu. Zhodnocení rizika a návrh na opatření ke zmírnění rizika Nízké riziko. EDC systém CLADE IS je flexibilní systém s možností vývoje nových funkcionalit. IBA splňuje zásady ISO 9001 a , týkající se zabezpečení systému a přenosu dat. Střední riziko. V případě nového nařízení či nové legislativní úpravy, nastavení projektu bude aktualizováno tak, aby projekt splňoval všechny nové legislativní podmínky. Střední riziko. Rozpočet na projekt je definovaný a odsouhlasený na roční bázi. Protože jde o projekt dlouhodobý, prakticky z nedefinovaných termínem ukončení, narůstá riziko zajištění financování projektu z roku na rok, a to zejména z důvodu 15/16
17 neočekávaného nárůstu variabilních nákladů na projekt nebo z důvodu výjimečných požadavků zadavatelů projektu v průběhu. Kvalita. Závisí na dostupnosti zdrojů a kvalifikaci týmu. Nízké riziko. Projekt běží od roku 2016 bez závažnějších změn. IBA má zavedený integrovaný systém managementu jakosti v souladu s normami ČSN ISO/IEC :2006 (o garanci kvality IT služeb), ČSN EN ISO 9001:2001/2009 (o managementu systému jakosti) a ČSN ISO/IEC 27001:2006 (o managementu bezpečnosti informací). Management systému jakosti i management poskytování IT služeb zůstávají i nadále implementovány a udržovány dle aktuálních verzí norem. Tým oddělení klinických projektů se zaměřuje též na řízení projektů klinického výzkumu a je proškolen ve správné klinické praxi (GCP). 15. Reference 1) Česká gastroenterologická společnost ČLS-JEP. 2) Pracovní skupina pro IBD. 16/16
CREdIT - ČESKÝ REGISTR IBD PACIENTŮ NA BIOLOGICKÉ TERAPII
 Kotlářská 267/2 602 00 Brno Česká republika www.biostatistika.cz CREdIT - ČESKÝ REGISTR IBD PACIENTŮ NA BIOLOGICKÉ PROTOKOL Datum: 29-FEB-2015 Číslo protokolu: IBA1062 Verze: v3.0 Autor: Mgr. Michaela
Kotlářská 267/2 602 00 Brno Česká republika www.biostatistika.cz CREdIT - ČESKÝ REGISTR IBD PACIENTŮ NA BIOLOGICKÉ PROTOKOL Datum: 29-FEB-2015 Číslo protokolu: IBA1062 Verze: v3.0 Autor: Mgr. Michaela
CREDIT. Výroční zpráva projektu v roce Datum vydání: Verze: 3.0. Registered e-document
 CREDIT projektu v roce 2018 Datum vydání: 26. 11. 2018 Projektový manažer: Analytik projektu: Odborný garant: Odborný garant: Mgr. Martina Nováčková Mgr. Matyáš Kuhn prof. MUDr. Milan Lukáš, Ph.D. MUDr.
CREDIT projektu v roce 2018 Datum vydání: 26. 11. 2018 Projektový manažer: Analytik projektu: Odborný garant: Odborný garant: Mgr. Martina Nováčková Mgr. Matyáš Kuhn prof. MUDr. Milan Lukáš, Ph.D. MUDr.
CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT IKARUS. Neintervenční epidemiologická studie
 CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT Neintervenční epidemiologická studie PROTOKOL PROJEKTU Verze: 4.0 Datum: 26.09.2006 Strana 2 PROTOKOL PROJEKTU
CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT Neintervenční epidemiologická studie PROTOKOL PROJEKTU Verze: 4.0 Datum: 26.09.2006 Strana 2 PROTOKOL PROJEKTU
CREDIT. Výroční zpráva projektu v roce Datum vydání: Verze: 2.0. Registered e-document
 CREDIT projektu v roce 2017 Datum vydání: 27.11.2017 Projektový manažer: Analytik projektu: Odborný garant: Odborný garant: Mgr. Martina Nováčková Mgr. Kateřina Fröhlich prof. MUDr. Milan Lukáš, Ph.D.
CREDIT projektu v roce 2017 Datum vydání: 27.11.2017 Projektový manažer: Analytik projektu: Odborný garant: Odborný garant: Mgr. Martina Nováčková Mgr. Kateřina Fröhlich prof. MUDr. Milan Lukáš, Ph.D.
2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 1 2 NEINTERVENČNÍ POREGISTRAČNÍ STUDIE MONITOROVÁNÍ, POSUZOVACÍ PRAXE Mgr. Natália Svršková Velký sál SÚKL 3 Obsah Neintervenční poregistrační studie definice, monitorování Neintervenční poregistrační
1 2 NEINTERVENČNÍ POREGISTRAČNÍ STUDIE MONITOROVÁNÍ, POSUZOVACÍ PRAXE Mgr. Natália Svršková Velký sál SÚKL 3 Obsah Neintervenční poregistrační studie definice, monitorování Neintervenční poregistrační
PRIVACY POLICY. Issued / vydáno dne: Written by / vypracoval: Mgr. Michaela Škrabalová. Revised by / revidoval: ---
 Issued / vydáno dne: 2018-05-29 Written by / vypracoval: Mgr. Michaela Škrabalová Revised by / revidoval: --- Approved by / schválil: Ing. Petr Brabec Supersedes/nahrazuje: --- Valid from / platné od:
Issued / vydáno dne: 2018-05-29 Written by / vypracoval: Mgr. Michaela Škrabalová Revised by / revidoval: --- Approved by / schválil: Ing. Petr Brabec Supersedes/nahrazuje: --- Valid from / platné od:
Česká multicentrická výzkumná databáze CHOPN registr ČPFS
 Česká multicentrická výzkumná databáze CHOPN registr ČPFS Hradec Králové, 1.2.2013 Karel Hejduk Institut biostatistiky a analýz, Brno Obsah: 1) Obecné informace o aktivitách IBA MU v rámci projektu CHOPN
Česká multicentrická výzkumná databáze CHOPN registr ČPFS Hradec Králové, 1.2.2013 Karel Hejduk Institut biostatistiky a analýz, Brno Obsah: 1) Obecné informace o aktivitách IBA MU v rámci projektu CHOPN
PROGRAMOVÉ PROHLÁŠENÍ
 PROGRAMOVÉ PROHLÁŠENÍ Verze: 1.0 Datum: 03.05.2006 PROGRAMOVÉ PROHLÁŠENÍ CO je to CEBO? KDO FINANCUJE CEBO? PROČ je CEBO? CO DĚLÁ CEBO? Co a komu přinese CEBO? PACIENTI LÉKAŘI ČESKÁ REPUBLIKA Kvalitnější
PROGRAMOVÉ PROHLÁŠENÍ Verze: 1.0 Datum: 03.05.2006 PROGRAMOVÉ PROHLÁŠENÍ CO je to CEBO? KDO FINANCUJE CEBO? PROČ je CEBO? CO DĚLÁ CEBO? Co a komu přinese CEBO? PACIENTI LÉKAŘI ČESKÁ REPUBLIKA Kvalitnější
Řešení multicentrických klinických registrů
 Řešení multicentrických klinických registrů Daniel Klimeš, Petr Brabec, Vít Kandrnal Institut biostatistiky a analýz Masarykova univerzita, Brno 1 Obsah přednášky Definice pojmů Cíle klinických registrů
Řešení multicentrických klinických registrů Daniel Klimeš, Petr Brabec, Vít Kandrnal Institut biostatistiky a analýz Masarykova univerzita, Brno 1 Obsah přednášky Definice pojmů Cíle klinických registrů
Životní cyklus programů časného záchytu onemocnění
 Národní koordinační centrum programů časného záchytu onemocnění CZ.03.2.63/0.0/0.0/15_039/0006904 Životní cyklus programů časného záchytu onemocnění Ondřej Májek, Karel Hejduk, Ondřej Ngo, Ladislav Dušek
Národní koordinační centrum programů časného záchytu onemocnění CZ.03.2.63/0.0/0.0/15_039/0006904 Životní cyklus programů časného záchytu onemocnění Ondřej Májek, Karel Hejduk, Ondřej Ngo, Ladislav Dušek
Nemocniční výjimka pokyn UST-37
 1 Nemocniční výjimka pokyn UST-37 2 Právní rámec Zákon č. 378/2007 Sb., o léčivech a změnách některých souvisejících zákonů (zákon o léčivech), ve znění pozdějších předpisů Vyhláška č. 228/2008 Sb., o
1 Nemocniční výjimka pokyn UST-37 2 Právní rámec Zákon č. 378/2007 Sb., o léčivech a změnách některých souvisejících zákonů (zákon o léčivech), ve znění pozdějších předpisů Vyhláška č. 228/2008 Sb., o
CEBO jako reakce na aktuální problémy v organizaci klinických studií. Jindřich Fínek 20.6.2006
 CEBO jako reakce na aktuální problémy v organizaci klinických studií Jindřich Fínek 20.6.2006 Centrum pro onkologii založenou na důkazech (Center for Evidence Based Oncology; CEBO) Institutu biostatistiky
CEBO jako reakce na aktuální problémy v organizaci klinických studií Jindřich Fínek 20.6.2006 Centrum pro onkologii založenou na důkazech (Center for Evidence Based Oncology; CEBO) Institutu biostatistiky
KLINICKÉ HODNOCENÍ LÉČIV REGULACE V ČR
 1 KLINICKÉ HODNOCENÍ LÉČIV REGULACE V ČR MUDr. Alice Němcová Oddělení klinického hodnocení KLINICKÁ HODNOCENÍ LÉČIV REGULACE V ČR 2 Obsah prezentace: Právní rámec KH Regulace KH LP v ČR Úloha SÚKL Úloha
1 KLINICKÉ HODNOCENÍ LÉČIV REGULACE V ČR MUDr. Alice Němcová Oddělení klinického hodnocení KLINICKÁ HODNOCENÍ LÉČIV REGULACE V ČR 2 Obsah prezentace: Právní rámec KH Regulace KH LP v ČR Úloha SÚKL Úloha
FV systémy a jejich QM Základní dokument FV systému
 Státní ústav pro kontrolu léčiv [ 1 ] FV systémy a jejich QM Základní dokument FV systému Oddělení farmakovigilance Státní ústav pro kontrolu léčiv [ 2 ] Co v dnešní prezentaci? Stručné představení modulů
Státní ústav pro kontrolu léčiv [ 1 ] FV systémy a jejich QM Základní dokument FV systému Oddělení farmakovigilance Státní ústav pro kontrolu léčiv [ 2 ] Co v dnešní prezentaci? Stručné představení modulů
Farmakovigilanční inspekce
 Státní ústav pro kontrolu léčiv [ 1 ] Oddělení farmakovigilance Státní ústav pro kontrolu léčiv [ 2 ] Co v dnešní prezentaci? právní základ novinky přehled proběhlých inspekcí v ČR [ 3 ] právní základ
Státní ústav pro kontrolu léčiv [ 1 ] Oddělení farmakovigilance Státní ústav pro kontrolu léčiv [ 2 ] Co v dnešní prezentaci? právní základ novinky přehled proběhlých inspekcí v ČR [ 3 ] právní základ
Časný záchyt chronické obstrukční plicní nemoci v rizikové populaci
 Časný záchyt diabetické retinopatie a makulárního edému u pacientů s diabetem 1. nebo 2. typu CZ.03.2.63/0.0/0.0/15_039/0008165 Časný záchyt chronické obstrukční plicní nemoci v rizikové populaci PreVon
Časný záchyt diabetické retinopatie a makulárního edému u pacientů s diabetem 1. nebo 2. typu CZ.03.2.63/0.0/0.0/15_039/0008165 Časný záchyt chronické obstrukční plicní nemoci v rizikové populaci PreVon
Vyhodnocení studie SPACE
 Kotlářská 267/2 602 00 Brno Česká republika www.biostatistika.cz Vyhodnocení studie SPACE Tato zpráva sumarizuje data shromážděná v rámci studie SPACE. Data byla poskytnuta Diabetickou asociací ČR. Autorský
Kotlářská 267/2 602 00 Brno Česká republika www.biostatistika.cz Vyhodnocení studie SPACE Tato zpráva sumarizuje data shromážděná v rámci studie SPACE. Data byla poskytnuta Diabetickou asociací ČR. Autorský
Prof. MUDr. Karel Pavelka, DrSc. Revmatologický ústav Praha Klinika revmatologie 1. LF UK
 Prof. MUDr. Karel Pavelka, DrSc. Revmatologický ústav Praha Klinika revmatologie 1. LF UK Historie centrové péče v revmatologii podnětem zavedení biologické léčby RA v roce 2000 diskuze DOHADOVACÍ ŘÍZENÍ
Prof. MUDr. Karel Pavelka, DrSc. Revmatologický ústav Praha Klinika revmatologie 1. LF UK Historie centrové péče v revmatologii podnětem zavedení biologické léčby RA v roce 2000 diskuze DOHADOVACÍ ŘÍZENÍ
Jednotný NIS Prezentace k zahájení projektu pro Radu kraje Vysočina. Projektový manažer - Ing. Ivan Sokolov, Ph.D.
 Prezentace k zahájení projektu pro Radu kraje Vysočina Projektový manažer - Ing. Ivan Sokolov, Ph.D. Obsah Úvod Cíle projektu Rozsah projektu Projektové řízení základní východiska Základní organizační
Prezentace k zahájení projektu pro Radu kraje Vysočina Projektový manažer - Ing. Ivan Sokolov, Ph.D. Obsah Úvod Cíle projektu Rozsah projektu Projektové řízení základní východiska Základní organizační
XIV. Intenzivní kurz IBD
 10. 11. prosince 2015 Kongresové centrum IKEM Praha Vídeňská 1958/9 P r a h a 4 XIV. Intenzivní kurz IBD Pořádají: Pracovní skupina pro idiopatické střevní záněty ČGS ČLS JEP Nadační fond IBD a Congress
10. 11. prosince 2015 Kongresové centrum IKEM Praha Vídeňská 1958/9 P r a h a 4 XIV. Intenzivní kurz IBD Pořádají: Pracovní skupina pro idiopatické střevní záněty ČGS ČLS JEP Nadační fond IBD a Congress
XXXXXXXXXXXXXX NADPIS. PODNADPIS Text text text. Bod KURZY A SEMINÁŘE. naše edukační aktivity
 XXXXXXXXXXXXXX NADPIS PODNADPIS Text text text. Bod KURZY A SEMINÁŘE naše edukační aktivity PŘEHLED KURZŮ Individuální kurzy a školení pro uzavřené skupiny ZÁKLADY APLIKOVANÉ ANALÝZY DAT DESIGN NEINTERVENČNÍCH
XXXXXXXXXXXXXX NADPIS PODNADPIS Text text text. Bod KURZY A SEMINÁŘE naše edukační aktivity PŘEHLED KURZŮ Individuální kurzy a školení pro uzavřené skupiny ZÁKLADY APLIKOVANÉ ANALÝZY DAT DESIGN NEINTERVENČNÍCH
INTERIM ANALÝZA. Klinické studie
 INTERIM ANALÝZA Strana 1 INTERIM ANALÝZA Klinické studie Sledování účinku Prostatus oils (speciální směs rostlinných olejů) u pacientů s benigním zvětšením prostaty a nadnormativním zvýšením hladiny PSA
INTERIM ANALÝZA Strana 1 INTERIM ANALÝZA Klinické studie Sledování účinku Prostatus oils (speciální směs rostlinných olejů) u pacientů s benigním zvětšením prostaty a nadnormativním zvýšením hladiny PSA
Přehled použitých výrazů a zkratek
 Orgány vývoje klinických standardů a proces plánování Příloha 4b Závěrečné zprávy projektu č. NS 10650-3/2009 podpořeného Interní grantovou agenturou MZ ČR, Výzkum metod standardizace zdravotní péče zaměřený
Orgány vývoje klinických standardů a proces plánování Příloha 4b Závěrečné zprávy projektu č. NS 10650-3/2009 podpořeného Interní grantovou agenturou MZ ČR, Výzkum metod standardizace zdravotní péče zaměřený
Správná klinická praxe GCP ICH E6 R(2)
 Správná klinická praxe GCP ICH E6 R(2) MUDr. Alice Němcová OKH SÚKL ICH E 6 (R2) - GCP - dodatky INTEGRATED ADDENDUM TO ICH E6(R1): GUIDELINE FOR GOOD CLINICAL PRACTICE E6(R2) dated 9 November 2016 Integrated
Správná klinická praxe GCP ICH E6 R(2) MUDr. Alice Němcová OKH SÚKL ICH E 6 (R2) - GCP - dodatky INTEGRATED ADDENDUM TO ICH E6(R1): GUIDELINE FOR GOOD CLINICAL PRACTICE E6(R2) dated 9 November 2016 Integrated
DOKUMENTACE K ŽÁDOSTI
 1 KAPITOLA IV + PŘÍLOHA I DOKUMENTACE K ŽÁDOSTI MUDr. Alena Trunečková Oddělení klinického hodnocení 2 Článek 25 Údaje předložené v dokumentaci k žádosti Článek 26 Jazykové požadavky Příloha I Dokumentace
1 KAPITOLA IV + PŘÍLOHA I DOKUMENTACE K ŽÁDOSTI MUDr. Alena Trunečková Oddělení klinického hodnocení 2 Článek 25 Údaje předložené v dokumentaci k žádosti Článek 26 Jazykové požadavky Příloha I Dokumentace
NEINTERVENČNÍ POREGISTRAČNÍ STUDIE BEZPEČNOSTI
 1 NEINTERVENČNÍ POREGISTRAČNÍ STUDIE BEZPEČNOSTI Radim Tobolka 2 Obsah prezentace Typy studií Registry studií Hlášení nežádoucích účinků Studijní a návazná dokumentace Etika neintervenčního výzkumu Seznam
1 NEINTERVENČNÍ POREGISTRAČNÍ STUDIE BEZPEČNOSTI Radim Tobolka 2 Obsah prezentace Typy studií Registry studií Hlášení nežádoucích účinků Studijní a návazná dokumentace Etika neintervenčního výzkumu Seznam
KLINICKÁ HODNOCENÍ - PRÁVNÍ RÁMEC
 KLINICKÁ HODNOCENÍ - PRÁVNÍ RÁMEC MUDr. Alena Trunečková Legislativa souhrnně na webu SÚKL: http://www.sukl.cz/sukl/legislativa-ceske-republiky Zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících
KLINICKÁ HODNOCENÍ - PRÁVNÍ RÁMEC MUDr. Alena Trunečková Legislativa souhrnně na webu SÚKL: http://www.sukl.cz/sukl/legislativa-ceske-republiky Zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících
Lokální analýza dat Národního registru CMP pro neurologické oddělení Fakultní nemocnice v Ostravě pacienti hospitalizovaní v letech 2010 a 2011
 NÁRODNÍ REGISTR CMP Lokální analýza dat Národního registru CMP pro neurologické oddělení Fakultní nemocnice v Ostravě pacienti hospitalizovaní v letech 2010 a 2011 MUDr. Eva Hurtíková Národní registr CMP
NÁRODNÍ REGISTR CMP Lokální analýza dat Národního registru CMP pro neurologické oddělení Fakultní nemocnice v Ostravě pacienti hospitalizovaní v letech 2010 a 2011 MUDr. Eva Hurtíková Národní registr CMP
Pilotní projekt Optimalizace programu screeningu kolorektálního karcinomu
 Národní koordinační centrum programů časného záchytu onemocnění CZ.03.2.63/0.0/0.0/15_039/0006904 Pilotní projekt Optimalizace programu screeningu kolorektálního karcinomu Ondřej Májek, Michaela Jelínková,
Národní koordinační centrum programů časného záchytu onemocnění CZ.03.2.63/0.0/0.0/15_039/0006904 Pilotní projekt Optimalizace programu screeningu kolorektálního karcinomu Ondřej Májek, Michaela Jelínková,
IKTA : analýza dat 2009-2012 IC Nemocnice Chomutov (1) MUDr. Jiří Neumann MUDr. Ján Macko
 IKTA : analýza dat 2009-2012 IC Nemocnice Chomutov (1) MUDr. Jiří Neumann MUDr. Ján Macko Iktové centrum - Neurologické oddělení Krajská zdravotní a.s. Nemocnice Chomutov o.z. NÁRODNÍ REGISTR CMP Lokální
IKTA : analýza dat 2009-2012 IC Nemocnice Chomutov (1) MUDr. Jiří Neumann MUDr. Ján Macko Iktové centrum - Neurologické oddělení Krajská zdravotní a.s. Nemocnice Chomutov o.z. NÁRODNÍ REGISTR CMP Lokální
Q & A a co ještě nebylo řečeno
 1 Q & A a co ještě nebylo řečeno MUDr. Alice Němcová OKH SÚKL 2 Lze použít v KH elektronické IP a IS? Zatím nelze Zákon o léčivech č. 378/2007 Sb., v aktuálním znění 51 odst. (2) písm. h) Informovaný souhlas
1 Q & A a co ještě nebylo řečeno MUDr. Alice Němcová OKH SÚKL 2 Lze použít v KH elektronické IP a IS? Zatím nelze Zákon o léčivech č. 378/2007 Sb., v aktuálním znění 51 odst. (2) písm. h) Informovaný souhlas
SM_0115 rev.01. Statut etické komise FNKV
 FAKULTNÍ NEMOCNICE KRÁLOVSKÉ VINOHRADY S M Ě R N I C E SM_0115 rev.01 Statut etické komise FNKV Datum vydání: 23.10.2017 Datum účinnosti: 01.11.2017 Doba platnosti: Bez omezení, revize 1 x ročně Vazba
FAKULTNÍ NEMOCNICE KRÁLOVSKÉ VINOHRADY S M Ě R N I C E SM_0115 rev.01 Statut etické komise FNKV Datum vydání: 23.10.2017 Datum účinnosti: 01.11.2017 Doba platnosti: Bez omezení, revize 1 x ročně Vazba
POVINNOSTI A ODPOVĚDNOST ZKOUŠEJÍCÍHO
 POVINNOSTI A ODPOVĚDNOST ZKOUŠEJÍCÍHO MUDr. Karolína Klieštiková Oddělení klinických hodnocení SÚKL Povinnosti a odpovědnost zkoušejícího Zkoušející Lékař nebo stomatolog Patřičná kvalifikace minim. atestace
POVINNOSTI A ODPOVĚDNOST ZKOUŠEJÍCÍHO MUDr. Karolína Klieštiková Oddělení klinických hodnocení SÚKL Povinnosti a odpovědnost zkoušejícího Zkoušející Lékař nebo stomatolog Patřičná kvalifikace minim. atestace
Projekt zaměřený na monitoring diagnostiky a léčby bolesti u onkologicky nemocných pacientů. Brno 23.4.2010 Brněnské onkologické dny
 Projekt zaměřený na monitoring diagnostiky a léčby bolesti u onkologicky nemocných pacientů Brno 23.4.2010 Brněnské onkologické dny Vlastník projektu PARMA Realizátor: OAKS Consulting s.r.o. Finanční zajištění:
Projekt zaměřený na monitoring diagnostiky a léčby bolesti u onkologicky nemocných pacientů Brno 23.4.2010 Brněnské onkologické dny Vlastník projektu PARMA Realizátor: OAKS Consulting s.r.o. Finanční zajištění:
Zásady ochrany osobních údajů pro jednotlivé subjekty
 Zásady ochrany osobních údajů pro jednotlivé subjekty Společnost Merck spol. s r. o., IČ 18626971, sídlem Na Hřebenech II 1718/10, Praha 4 Nusle, PSČ 140 00, zapsaná v obchodním rejstříku u Městského soudu
Zásady ochrany osobních údajů pro jednotlivé subjekty Společnost Merck spol. s r. o., IČ 18626971, sídlem Na Hřebenech II 1718/10, Praha 4 Nusle, PSČ 140 00, zapsaná v obchodním rejstříku u Městského soudu
Statistická predikce prevalence DM v ČR do roku 2030
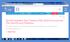 Statistická predikce prevalence DM v ČR do roku 2030 Zdroj dat: NRHZS 2015 2017, pacienti s DM; Český statistický úřad - Projekce obyvatelstva ČR Metodika: Poissonův zobecněný lineární model, predikční
Statistická predikce prevalence DM v ČR do roku 2030 Zdroj dat: NRHZS 2015 2017, pacienti s DM; Český statistický úřad - Projekce obyvatelstva ČR Metodika: Poissonův zobecněný lineární model, predikční
ZAHÁJENÍ, PRŮBĚH A UKONČENÍ KH
 Zahájení, průběh a ukončení KH 1 ZAHÁJENÍ, PRŮBĚH A UKONČENÍ KH MUDr. Tomáš Boráň Oddělení klinického hodnocení, SÚKL Obsah 2 Obsah Zahájení KH Průběh KH Zpráva o průběhu DSUR Další informace (USR, závady
Zahájení, průběh a ukončení KH 1 ZAHÁJENÍ, PRŮBĚH A UKONČENÍ KH MUDr. Tomáš Boráň Oddělení klinického hodnocení, SÚKL Obsah 2 Obsah Zahájení KH Průběh KH Zpráva o průběhu DSUR Další informace (USR, závady
Sledování bezpečnosti v registeru. MUDr. Tomáš Moravec
 Sledování bezpečnosti v registeru MUDr. Tomáš Moravec Jaký je náš cíl v sledování bezpečnosti? naší snahou a cílem je ověření bezpečnostního profilu daného léčivého přípravku a získání nových informací
Sledování bezpečnosti v registeru MUDr. Tomáš Moravec Jaký je náš cíl v sledování bezpečnosti? naší snahou a cílem je ověření bezpečnostního profilu daného léčivého přípravku a získání nových informací
MANAGEMENT KYBERNETICKÉ BEZPEČNOSTI
 MANAGEMENT KYBERNETICKÉ BEZPEČNOSTI TÉMA Č. 4 SOUBOR POSTUPŮ PRO MANAGEMENT BEZPEČNOSTI INFORMACÍ POLITIKA A ORGANIZACE BEZPEČNOSTI INFORMACÍ pplk. Ing. Petr HRŮZA, Ph.D. Univerzita obrany, Fakulta ekonomiky
MANAGEMENT KYBERNETICKÉ BEZPEČNOSTI TÉMA Č. 4 SOUBOR POSTUPŮ PRO MANAGEMENT BEZPEČNOSTI INFORMACÍ POLITIKA A ORGANIZACE BEZPEČNOSTI INFORMACÍ pplk. Ing. Petr HRŮZA, Ph.D. Univerzita obrany, Fakulta ekonomiky
Čl. I Úvodní ustanovení
 Organizační řád Centra pro onkologii založenou na důkazech (Center for Evidence Based Oncology; CEBO) Institutu biostatistiky a analýz Lékařské a Přírodovědecké fakulty Masarykovy univerzity Čl. I Úvodní
Organizační řád Centra pro onkologii založenou na důkazech (Center for Evidence Based Oncology; CEBO) Institutu biostatistiky a analýz Lékařské a Přírodovědecké fakulty Masarykovy univerzity Čl. I Úvodní
Připravil/revidoval: Datum: Podpis: Mgr. Petr Baum... Prof. MUDr. Vladimír Staněk, CSc., předseda EK... 1/5
 STANDARDNÍ OPERAČNÍ POSTUP č. 3 Jednání Etické komise (dále jen EK ) o nové žádosti o udělení souhlasu s provedením klinického hodnocení léčivého přípravku nebo klinickou zkouškou zdravotnického prostředku
STANDARDNÍ OPERAČNÍ POSTUP č. 3 Jednání Etické komise (dále jen EK ) o nové žádosti o udělení souhlasu s provedením klinického hodnocení léčivého přípravku nebo klinickou zkouškou zdravotnického prostředku
Vývoj nového léčiva. as. MUDr. Martin Votava, PhD.
 Vývoj nového léčiva as. MUDr. Martin Votava, PhD. Příprava na vývoj a registraci LP Náklady na vývoj: 800 mil USD Doba vývoje: 10 let Úspěšnost: 0,005% - 0,001% Vývoj nového léčivého přípravku IND NDA
Vývoj nového léčiva as. MUDr. Martin Votava, PhD. Příprava na vývoj a registraci LP Náklady na vývoj: 800 mil USD Doba vývoje: 10 let Úspěšnost: 0,005% - 0,001% Vývoj nového léčivého přípravku IND NDA
Elektronická preskripce a finanční udržitelnost zdravotnických systémů
 Parlament České republiky Poslanecká sněmovna Zdravotní výbor Elektronická preskripce a finanční udržitelnost zdravotnických systémů Farmakoekonomie, racionální předepisování a mezisektorová komunikace
Parlament České republiky Poslanecká sněmovna Zdravotní výbor Elektronická preskripce a finanční udržitelnost zdravotnických systémů Farmakoekonomie, racionální předepisování a mezisektorová komunikace
KLINICKÁ HODNOCENÍ & DATA INTEGRITY
 KLINICKÁ HODNOCENÍ & DATA INTEGRITY MUDr Beata Čečetková, Ph.D. TWMA Clinical Research & Pharmacovigilance Praha Doc. MUDr. Regina Demlová, Ph.D. Masarykův onkologický ústav Oddělení klinických studií
KLINICKÁ HODNOCENÍ & DATA INTEGRITY MUDr Beata Čečetková, Ph.D. TWMA Clinical Research & Pharmacovigilance Praha Doc. MUDr. Regina Demlová, Ph.D. Masarykův onkologický ústav Oddělení klinických studií
ÚVOD Představení Národního screeningového centra
 ÚVOD Představení Národního screeningového centra Ondřej Májek, Karel Hejduk, Ladislav Dušek Ústav zdravotnických informací a statistiky České republiky Institute of Health Information and Statistics of
ÚVOD Představení Národního screeningového centra Ondřej Májek, Karel Hejduk, Ladislav Dušek Ústav zdravotnických informací a statistiky České republiky Institute of Health Information and Statistics of
Lokální analýza dat Národního registru CMP. Komplexní cerebrovaskulární centrum Fakultní nemocnice Ostrava
 NÁRODNÍ REGISTR CMP Lokální analýza dat Národního registru CMP za rok 2010 Komplexní cerebrovaskulární centrum Fakultní nemocnice Ostrava MUDr. Martin Roubec Garant centra: MUDr. Michal Bar, Ph.D. Garant
NÁRODNÍ REGISTR CMP Lokální analýza dat Národního registru CMP za rok 2010 Komplexní cerebrovaskulární centrum Fakultní nemocnice Ostrava MUDr. Martin Roubec Garant centra: MUDr. Michal Bar, Ph.D. Garant
Jednání KR a VR ČNHP , Praha I. Český hematologický a transfuziologický sjezd Jan Blatný, Zlata Křístková, Petra Ovesná
 Jednání KR a VR ČNHP 17.9. 2018, Praha I. Český hematologický a transfuziologický sjezd Jan Blatný, Zlata Křístková, Petra Ovesná 17:00 Zahájení Úvod a přivítání (J.Blatný) Program Aktuální přehled hospodaření
Jednání KR a VR ČNHP 17.9. 2018, Praha I. Český hematologický a transfuziologický sjezd Jan Blatný, Zlata Křístková, Petra Ovesná 17:00 Zahájení Úvod a přivítání (J.Blatný) Program Aktuální přehled hospodaření
KLH-EK-01 ŽÁDOST O STANOVISKO ETICKÉ KOMISE K PROVEDENÍ KLINICKÉHO HODNOCENÍ V ČESKÉ REPUBLICE - požadavky na předkládanou dokumentaci
 KLH-EK-01 ŽÁDOST O STANOVISKO ETICKÉ KOMISE K PROVEDENÍ KLINICKÉHO HODNOCENÍ V ČESKÉ REPUBLICE - požadavky na předkládanou dokumentaci Tento pokyn se vydává za účelem harmonizace činnosti etických komisí
KLH-EK-01 ŽÁDOST O STANOVISKO ETICKÉ KOMISE K PROVEDENÍ KLINICKÉHO HODNOCENÍ V ČESKÉ REPUBLICE - požadavky na předkládanou dokumentaci Tento pokyn se vydává za účelem harmonizace činnosti etických komisí
[ 1 ] RNDr. Olga Hanzlíčková 2012 Státní ústav pro kontrolu léčiv
![[ 1 ] RNDr. Olga Hanzlíčková 2012 Státní ústav pro kontrolu léčiv [ 1 ] RNDr. Olga Hanzlíčková 2012 Státní ústav pro kontrolu léčiv](/thumbs/93/112264798.jpg) [ 1 ] Státní ústav pro kontrolu léčiv [ 2 ] Návrh novely zákona č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů vedoucí sekce DOZ [ 3 ] Směrnice Evropského parlamentu a Rady 2010/84/EU
[ 1 ] Státní ústav pro kontrolu léčiv [ 2 ] Návrh novely zákona č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů vedoucí sekce DOZ [ 3 ] Směrnice Evropského parlamentu a Rady 2010/84/EU
K VYDÁNÍ STANOVISKA EK
 Jednání Lokální etické komise (LEK) Nemocnice Mělník (jednací řád) o nové žádosti o udělení souhlasu s provedením klinického hodnocení léčivého přípravku nebo s klinickou zkouškou zdravotnického prostředku
Jednání Lokální etické komise (LEK) Nemocnice Mělník (jednací řád) o nové žádosti o udělení souhlasu s provedením klinického hodnocení léčivého přípravku nebo s klinickou zkouškou zdravotnického prostředku
Standardní operační postup SOP EK - 008 Název : Hlášení, komunikace EK s ostatními subjekty
 Etická komise Nemocnice Na Homolce Roentgenova 2 150 30 Praha 5 Standardní operační postup SOP EK - 008 Název : Hlášení, komunikace EK s ostatními subjekty Vypracoval: MUDr.Vilma Benešová Eva Wišniewská
Etická komise Nemocnice Na Homolce Roentgenova 2 150 30 Praha 5 Standardní operační postup SOP EK - 008 Název : Hlášení, komunikace EK s ostatními subjekty Vypracoval: MUDr.Vilma Benešová Eva Wišniewská
Národní akční plán pro vzácná onemocnění na léta 2015-2017
 Národní akční plán pro vzácná onemocnění na léta 2015-2017 1. Zlepšení informovanosti o Cíle Úkoly Termín Výstupy Gestor Spolupráce Předpoklady 1.1. Provoz, rozvoj a aktualizace webových portálů pro ;
Národní akční plán pro vzácná onemocnění na léta 2015-2017 1. Zlepšení informovanosti o Cíle Úkoly Termín Výstupy Gestor Spolupráce Předpoklady 1.1. Provoz, rozvoj a aktualizace webových portálů pro ;
Národní akční plán pro vzácná onemocnění na léta
 Národní akční plán pro vzácná onemocnění na léta 2015-2017 1. Zlepšení informovanosti o Cíle Úkoly Termín Výstupy Gestor Spolupráce Předpoklady 1.1. Provoz, rozvoj a aktualizace webových portálů pro ;
Národní akční plán pro vzácná onemocnění na léta 2015-2017 1. Zlepšení informovanosti o Cíle Úkoly Termín Výstupy Gestor Spolupráce Předpoklady 1.1. Provoz, rozvoj a aktualizace webových portálů pro ;
NEINTERVENČNÍ POREGISTRAČNÍ STUDIE BEZPEČNOSTI
 1 NEINTERVENČNÍ POREGISTRAČNÍ STUDIE BEZPEČNOSTI SOUHRN A DOPORUČENÍ Mgr. Veronika Deščíková 2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV červen 2015 Úvod a obsah Proč PASS? Intervence vs. neintervence Druhy studií/definice
1 NEINTERVENČNÍ POREGISTRAČNÍ STUDIE BEZPEČNOSTI SOUHRN A DOPORUČENÍ Mgr. Veronika Deščíková 2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV červen 2015 Úvod a obsah Proč PASS? Intervence vs. neintervence Druhy studií/definice
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 FARMAKOVIGILANČNÍ INSPEKCE FARMAKOVIGILANČNÍ INSPEKCE: PŘEHLED A ČASTÉ NEDOSTATKY Zuzana Chomátová FARMAKOVIGILANČNÍ INSPEKCE / právní základ Farmakovigilanční inspekce právní základ Nařízení Evropského
FARMAKOVIGILANČNÍ INSPEKCE FARMAKOVIGILANČNÍ INSPEKCE: PŘEHLED A ČASTÉ NEDOSTATKY Zuzana Chomátová FARMAKOVIGILANČNÍ INSPEKCE / právní základ Farmakovigilanční inspekce právní základ Nařízení Evropského
Program časného záchytu karcinomu prostaty u populace mužů v dispenzární péči po onkologických onemocněních
 Program časného záchytu karcinomu prostaty u populace mužů v dispenzární péči po onkologických onemocněních CZ.03.2.63/0.0/0.0/15_039/0008167 Program časného záchytu karcinomu prostaty u populace mužů
Program časného záchytu karcinomu prostaty u populace mužů v dispenzární péči po onkologických onemocněních CZ.03.2.63/0.0/0.0/15_039/0008167 Program časného záchytu karcinomu prostaty u populace mužů
B. Zhodnocení dosažených výsledků z hlediska stanovených cílů a harmonogramu projektu Obsah Cíle, kritéria a harmonogram projektu...
 Obsah B. Zhodnocení dosažených výsledků z hlediska stanovených cílů a harmonogramu projektu Projekt Zhodnocení účinnosti nákladné léčby vzácných autoimunitních nervosvalových onemocnění IČP 29/13/NAP,
Obsah B. Zhodnocení dosažených výsledků z hlediska stanovených cílů a harmonogramu projektu Projekt Zhodnocení účinnosti nákladné léčby vzácných autoimunitních nervosvalových onemocnění IČP 29/13/NAP,
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 ZÁKLADNÍ DOKUMENT FARMAKOVIGILANČNÍHO SYSTÉMU ZÁKLADNÍ DOKUMENT FARMAKOVIGILANČNÍHO SYSTÉMU (PSMF) Ing. Zuzana Chomátová ZÁKLADNÍ DOKUMENT FARMAKOVIGILANČNÍHO SYSTÉMU/ legislativní rámec PSMF legislativní
ZÁKLADNÍ DOKUMENT FARMAKOVIGILANČNÍHO SYSTÉMU ZÁKLADNÍ DOKUMENT FARMAKOVIGILANČNÍHO SYSTÉMU (PSMF) Ing. Zuzana Chomátová ZÁKLADNÍ DOKUMENT FARMAKOVIGILANČNÍHO SYSTÉMU/ legislativní rámec PSMF legislativní
ČESKÉ VYSOKÉ UČENÍ TECHNICKÉ V PRAZE
 ČESKÉ VYSOKÉ UČENÍ TECHNICKÉ V PRAZE Č.j.: 3/12/51924/Moos PŘÍKAZ REKTORA č. 1/2012 Pravidla pro kompetence a odpovědnosti při správě informačního systému ČVUT Pravidla pro kompetence a odpovědnosti při
ČESKÉ VYSOKÉ UČENÍ TECHNICKÉ V PRAZE Č.j.: 3/12/51924/Moos PŘÍKAZ REKTORA č. 1/2012 Pravidla pro kompetence a odpovědnosti při správě informačního systému ČVUT Pravidla pro kompetence a odpovědnosti při
Etické komise a jejich úloha v posuzování výzkumných studií, Fórum etických komisí
 Etické komise a jejich úloha v posuzování výzkumných studií, Fórum etických komisí MUDr. Alice Němcová Právní rámec Zákon o léčivech 378/2007 Sb. Vyhláška 226/2008 Sb. Zákon o zdravotnických prostředcích
Etické komise a jejich úloha v posuzování výzkumných studií, Fórum etických komisí MUDr. Alice Němcová Právní rámec Zákon o léčivech 378/2007 Sb. Vyhláška 226/2008 Sb. Zákon o zdravotnických prostředcích
Národní akční plán pro Alzheimerovu nemoc a obdobná onemocnění 2020? 1. setkání pracovní skupiny
 Národní akční plán pro Alzheimerovu nemoc a obdobná onemocnění 2020? 1. setkání pracovní skupiny 19. 3. 2019 Program setkání 1) Představení členů pracovní skupiny 2) Proces tvorby národního akčního plánu
Národní akční plán pro Alzheimerovu nemoc a obdobná onemocnění 2020? 1. setkání pracovní skupiny 19. 3. 2019 Program setkání 1) Představení členů pracovní skupiny 2) Proces tvorby národního akčního plánu
DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ
 1 DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ MUDr. Alice Němcová Oddělení klinického hodnocení, Sekce registrací DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ 2 Obsah prezentace: Pravidla distribuce
1 DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ MUDr. Alice Němcová Oddělení klinického hodnocení, Sekce registrací DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ 2 Obsah prezentace: Pravidla distribuce
Všem obchodním partnerům. V Praze dne Věc: informace o zpracování osobních údajů. Vážení obchodní partneři,
 Všem obchodním partnerům V Praze dne 22.5.2018 Věc: informace o zpracování osobních údajů Vážení obchodní partneři, naše společnost, se sídlem:, 130 00 Praha 3, Žižkov,, IČO: 034 58 059, zapsaná v obchodním
Všem obchodním partnerům V Praze dne 22.5.2018 Věc: informace o zpracování osobních údajů Vážení obchodní partneři, naše společnost, se sídlem:, 130 00 Praha 3, Žižkov,, IČO: 034 58 059, zapsaná v obchodním
[ 1 ] MUDr.Jana Mladá Seminář oddělení farmakovigilance červen Státní ústav kontrolu léčiv
![[ 1 ] MUDr.Jana Mladá Seminář oddělení farmakovigilance červen Státní ústav kontrolu léčiv [ 1 ] MUDr.Jana Mladá Seminář oddělení farmakovigilance červen Státní ústav kontrolu léčiv](/thumbs/104/162117622.jpg) [ 1 ] Státní ústav pro kontrolu léčiv [ 2 ] Několik slov úvodem MUDr. Jana Mladá Oddělení farmakovigilance [ 3 ] O čem dnes? Změna legislativy Jak jsem na tom s českým zákonem? Co se bude dít po 21.7.2012?
[ 1 ] Státní ústav pro kontrolu léčiv [ 2 ] Několik slov úvodem MUDr. Jana Mladá Oddělení farmakovigilance [ 3 ] O čem dnes? Změna legislativy Jak jsem na tom s českým zákonem? Co se bude dít po 21.7.2012?
ZADAVATEL POVINNOSTI A ODPOVĚDNOST
 1 ZADAVATEL POVINNOSTI A ODPOVĚDNOST MUDr. Alžběta Kalašová OKH SÚKL 2 Právní rámec: Zákon č. 378/2007 Sb., o léčivech a změně některých souvisejících zákonů (zákon o léčivech) ve znění pozdějších předpisů
1 ZADAVATEL POVINNOSTI A ODPOVĚDNOST MUDr. Alžběta Kalašová OKH SÚKL 2 Právní rámec: Zákon č. 378/2007 Sb., o léčivech a změně některých souvisejících zákonů (zákon o léčivech) ve znění pozdějších předpisů
Výzva k podání nabídek na veřejnou zakázku malého rozsahu na dodávky
 Město Šumperk Městský úřad Šumperk nám. Míru 1, 787 01 Šumperk Naše čj.: MUSP 125946/2017 Naše sp. zn.: 125945/2017 TAJ/PAKO *MUSPX01TUVGN * Výzva k podání nabídek na veřejnou zakázku malého rozsahu na
Město Šumperk Městský úřad Šumperk nám. Míru 1, 787 01 Šumperk Naše čj.: MUSP 125946/2017 Naše sp. zn.: 125945/2017 TAJ/PAKO *MUSPX01TUVGN * Výzva k podání nabídek na veřejnou zakázku malého rozsahu na
Farmakovigilance z pohledu ochrany osobních údajů
 Farmakovigilance z pohledu ochrany osobních údajů JUDr. Klára Novotná, Ph.D., Head Data Privacy CEE, Novartis 24.. 209, Courtyard by Marriott Prague City, Praha Farmakovigilance Farmakovigilance sledování
Farmakovigilance z pohledu ochrany osobních údajů JUDr. Klára Novotná, Ph.D., Head Data Privacy CEE, Novartis 24.. 209, Courtyard by Marriott Prague City, Praha Farmakovigilance Farmakovigilance sledování
Česká gastroenterologická společnost v rámci systému zdravotní péče
 Česká gastroenterologická společnost v rámci systému zdravotní péče Ve dnech 12. 13. 4. 2018 se ve Vile Stiassni v Brně na pracovním jednání sešli členové výboru České gastroenterologické společnosti České
Česká gastroenterologická společnost v rámci systému zdravotní péče Ve dnech 12. 13. 4. 2018 se ve Vile Stiassni v Brně na pracovním jednání sešli členové výboru České gastroenterologické společnosti České
Systémová analýza a opatření v rámci GDPR
 Systémová analýza a opatření v rámci GDPR Kraje a právnické osoby zřizované kraji 1. března 2018 Cíle systémové analýzy Dne 25. května 2018 nabývá účinnosti nařízení Evropského parlamentu a Rady (EU) 2016/679
Systémová analýza a opatření v rámci GDPR Kraje a právnické osoby zřizované kraji 1. března 2018 Cíle systémové analýzy Dne 25. května 2018 nabývá účinnosti nařízení Evropského parlamentu a Rady (EU) 2016/679
Jednací řád Etické komise Fakultní nemocnice Královské Vinohrady
 FAKULTNÍ NEMOCNICE KRÁLOVSKÉ VINOHRADY S MĚRNICE ORGA N I Z AČNÍHO ÚTVA R U S M O U _10000_02 rev.00 Jednací řád Etické komise Fakultní Úroveň dokumentu: IV Datum vydání: 01.06.2011 Datum účinnosti: 01.06.2011
FAKULTNÍ NEMOCNICE KRÁLOVSKÉ VINOHRADY S MĚRNICE ORGA N I Z AČNÍHO ÚTVA R U S M O U _10000_02 rev.00 Jednací řád Etické komise Fakultní Úroveň dokumentu: IV Datum vydání: 01.06.2011 Datum účinnosti: 01.06.2011
Ústav veřejného zdravotnictví a medicínského práva - otázky SRZk 2018/ Vztah lékař pacient, historický vývoj, Úmluva o právech a biomedicíně
 Ústav veřejného zdravotnictví a medicínského práva - otázky SRZk 2018/2019 A. Medicínské právo 1. Vztah lékař pacient, historický vývoj, Úmluva o právech a biomedicíně 2. Právní systémy, hierarchie právních
Ústav veřejného zdravotnictví a medicínského práva - otázky SRZk 2018/2019 A. Medicínské právo 1. Vztah lékař pacient, historický vývoj, Úmluva o právech a biomedicíně 2. Právní systémy, hierarchie právních
Projekt edukační platforma I-COP EDU
 Projekt edukační platforma I-COP V rámci realizace projektu Edukační a informační platforma onkologických center CZ.1.07/2.4.00/31.0020 Blaha M., Lysý M., Pukyová J., Šulc D., Dušek L. Motivace projektu
Projekt edukační platforma I-COP V rámci realizace projektu Edukační a informační platforma onkologických center CZ.1.07/2.4.00/31.0020 Blaha M., Lysý M., Pukyová J., Šulc D., Dušek L. Motivace projektu
Zákon o. zdravotnických prostředcích. z pohledu plátců
 Zákon o zdravotnických prostředcích z pohledu plátců Ing. Martin Jelínek, Ph.D. ředitel Odboru léčiv a zdravotnických prostředků, VZP ČR 9. 4. 2014 PROGRAM NOVÝ ZÁKON o zdravotnických prostředcích Z POHLEDU
Zákon o zdravotnických prostředcích z pohledu plátců Ing. Martin Jelínek, Ph.D. ředitel Odboru léčiv a zdravotnických prostředků, VZP ČR 9. 4. 2014 PROGRAM NOVÝ ZÁKON o zdravotnických prostředcích Z POHLEDU
Obsah. 1 Plnění dílčích aktivit Plnění harmonogramu projektu Plnění cílů projektu Počet center a případů...6.
 B. Zhodnocení dosažených výsledků z hlediska stanovených cílů a harmonogramu projektu Projekt Zhodnocení vztahu kvality a nákladů u péče o pacienty se vzácným autoimunitním 26/16/RPZP Obsah 1 Plnění dílčích
B. Zhodnocení dosažených výsledků z hlediska stanovených cílů a harmonogramu projektu Projekt Zhodnocení vztahu kvality a nákladů u péče o pacienty se vzácným autoimunitním 26/16/RPZP Obsah 1 Plnění dílčích
Farmakovigilance v KH změny a novinky
 Státní ústav pro kontrolu léčiv [ 1 ] Farmakovigilance v KH změny a novinky MUDr. Tomáš Boráň Oddělení klinického hodnocení Farmakovigilance v KH [ 2 ] Obsah CT-3 Aktualizace pokynu KLH-21 DSUR Chyby v
Státní ústav pro kontrolu léčiv [ 1 ] Farmakovigilance v KH změny a novinky MUDr. Tomáš Boráň Oddělení klinického hodnocení Farmakovigilance v KH [ 2 ] Obsah CT-3 Aktualizace pokynu KLH-21 DSUR Chyby v
Podmínky ochrany osobních údajů
 Podmínky ochrany osobních údajů Foxtrot Technologies s.r.o., se sídlem Jivenská 2, 140 00 Praha 4, Česká republika, identifikační číslo: 25709054, společnost vedená u Městského soudu v Praze, spisová značka:
Podmínky ochrany osobních údajů Foxtrot Technologies s.r.o., se sídlem Jivenská 2, 140 00 Praha 4, Česká republika, identifikační číslo: 25709054, společnost vedená u Městského soudu v Praze, spisová značka:
Projekt edukační platforma I-COP EDU Nemocnice Jihlava
 Projekt edukační platforma I-COP Nemocnice Jihlava V rámci realizace projektu Edukační a informační platforma onkologických center CZ.1.07/2.4.00/31.0020 Blaha M., Klika P., Janča D., Mužík J., Dušek L.
Projekt edukační platforma I-COP Nemocnice Jihlava V rámci realizace projektu Edukační a informační platforma onkologických center CZ.1.07/2.4.00/31.0020 Blaha M., Klika P., Janča D., Mužík J., Dušek L.
98/2012 Sb. VYHLÁŠKA. ze dne 22. března 2012
 98/2012 Sb. VYHLÁŠKA ze dne 22. března 2012 o zdravotnické dokumentaci Změna: 236/2013 Sb. Změna: 364/2015 Sb. Změna: XXX/2017 Sb. Ministerstvo zdravotnictví stanoví podle 120 zákona č. 372/2011 Sb., o
98/2012 Sb. VYHLÁŠKA ze dne 22. března 2012 o zdravotnické dokumentaci Změna: 236/2013 Sb. Změna: 364/2015 Sb. Změna: XXX/2017 Sb. Ministerstvo zdravotnictví stanoví podle 120 zákona č. 372/2011 Sb., o
Ekonomické limity vs. správný odborný postup. Dagmar Záleská
 Ekonomické limity vs. správný odborný postup Dagmar Záleská Základní otázky Na co má pojištěnec nárok? Lze nárok pojištěnce na bezplatnou péči omezovat ekonomickými limity? Je přípustné, aby ekonomické
Ekonomické limity vs. správný odborný postup Dagmar Záleská Základní otázky Na co má pojištěnec nárok? Lze nárok pojištěnce na bezplatnou péči omezovat ekonomickými limity? Je přípustné, aby ekonomické
J.Ruprich et al., CZVP SZÚ, Brno 4.12.2014
 J.Ruprich et al., CZVP SZÚ, Brno 4.12.2014 1 Program 1. Úvod, obecné představení projektu Nutrivigilance (prof. J. Ruprich, 35 min.) 10:00 hod 2. Potraviny nového typu (Doc. V. Ostrý, 20 min.) 3. Web Nutrivigilance
J.Ruprich et al., CZVP SZÚ, Brno 4.12.2014 1 Program 1. Úvod, obecné představení projektu Nutrivigilance (prof. J. Ruprich, 35 min.) 10:00 hod 2. Potraviny nového typu (Doc. V. Ostrý, 20 min.) 3. Web Nutrivigilance
Aktuální stav přípravy. Národní strategie elektronického zdravotnictví. v České republice
 Aktuální stav přípravy Národní strategie elektronického zdravotnictví v České republice 17. září 2014 Malostranský palác, Praha Konference ICT ve zdravotnictví Ing. Martin Zeman Oddělení poradců a strategií
Aktuální stav přípravy Národní strategie elektronického zdravotnictví v České republice 17. září 2014 Malostranský palác, Praha Konference ICT ve zdravotnictví Ing. Martin Zeman Oddělení poradců a strategií
ZÁSADY OCHRANY OSOBNÍCH ÚDAJŮ
 ZÁSADY OCHRANY OSOBNÍCH ÚDAJŮ Obecné zásady Účinnost od 20. 5. 2018 1. ÚVODNÍ USTANOVENÍ 1.1. Gransy s.r.o., se sídlem Bořivojova 35, Praha 3, 13000, Czech Republic, IČO 28087755, zapsaná v obchodním rejstříku
ZÁSADY OCHRANY OSOBNÍCH ÚDAJŮ Obecné zásady Účinnost od 20. 5. 2018 1. ÚVODNÍ USTANOVENÍ 1.1. Gransy s.r.o., se sídlem Bořivojova 35, Praha 3, 13000, Czech Republic, IČO 28087755, zapsaná v obchodním rejstříku
Medikamentózně refrakterní ulcerózní kolitida
 Medikamentózně refrakterní ulcerózní kolitida VIII. webinář Kazuistiky IBD pacientů 2018 8.10.2018 Karin Malíčková Milan Lukáš ulcerózní pankolitida od roku 2010 (od 16.roku věku) 2010 2011 biologická
Medikamentózně refrakterní ulcerózní kolitida VIII. webinář Kazuistiky IBD pacientů 2018 8.10.2018 Karin Malíčková Milan Lukáš ulcerózní pankolitida od roku 2010 (od 16.roku věku) 2010 2011 biologická
Zajímavé dotazy, důležitá upozornění a dobré rady na konec
 [ 1 ] Zajímavé dotazy, důležitá upozornění a dobré rady na konec MUDr. Alice Němcová Změny v dokumentaci schválené posouzení CTA a vydání povolení/schválení ohlášeného KH Text vložený do rozhodnutí: Klinické
[ 1 ] Zajímavé dotazy, důležitá upozornění a dobré rady na konec MUDr. Alice Němcová Změny v dokumentaci schválené posouzení CTA a vydání povolení/schválení ohlášeného KH Text vložený do rozhodnutí: Klinické
Elektronická zdravotní dokumentace, eprekripce 29.října 2007 - Praha. MUDr. Pavel Neugebauer Předseda SPLDD ČR, člen Správní rady ČNFeH
 Elektronická zdravotní dokumentace, eprekripce 29.října 2007 - Praha MUDr. Pavel Neugebauer Předseda SPLDD ČR, člen Správní rady ČNFeH Právní rámec Zákon číslo 20/1966 Sb. o péči o zdraví lidu V. část
Elektronická zdravotní dokumentace, eprekripce 29.října 2007 - Praha MUDr. Pavel Neugebauer Předseda SPLDD ČR, člen Správní rady ČNFeH Právní rámec Zákon číslo 20/1966 Sb. o péči o zdraví lidu V. část
Farmakovigilance v KH
 Státní ústav pro kontrolu léčiv Farmakovigilance v KH MUDr. Tomáš Boráň Oddělení klinického hodnocení Seminář 14. 5. a 28. 5. 2013 1 Farmakovigilance v KH Obsah Přehled legislativy a doporučení Základní
Státní ústav pro kontrolu léčiv Farmakovigilance v KH MUDr. Tomáš Boráň Oddělení klinického hodnocení Seminář 14. 5. a 28. 5. 2013 1 Farmakovigilance v KH Obsah Přehled legislativy a doporučení Základní
MZ A POHLED NA LÉKOVÉ INTERAKCE. PharmDr. Alena Tomášková 24. únor 2015
 MZ A POHLED NA LÉKOVÉ INTERAKCE PharmDr. Alena Tomášková 24. únor 2015 Lékové interakce O lékové interakci mluvíme tehdy, když při současném podávání dvou nebo více léčivých přípravků dojde ke změně účinku
MZ A POHLED NA LÉKOVÉ INTERAKCE PharmDr. Alena Tomášková 24. únor 2015 Lékové interakce O lékové interakci mluvíme tehdy, když při současném podávání dvou nebo více léčivých přípravků dojde ke změně účinku
Sekce registrací Oddělení klinického hodnocení Oddělení posuzování farmaceutické dokumentace a STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 1 NAŘÍZENÍ EVROPSKÉHO PARLAMENTU A RADY (EU) č. 536/2014 ze dne 16. dubna 2014 o klinických hodnoceních humánních léčivých přípravků a o zrušení směrnice 2001/20/ES Sekce registrací Oddělení klinického
1 NAŘÍZENÍ EVROPSKÉHO PARLAMENTU A RADY (EU) č. 536/2014 ze dne 16. dubna 2014 o klinických hodnoceních humánních léčivých přípravků a o zrušení směrnice 2001/20/ES Sekce registrací Oddělení klinického
Jednání KR a VR ČNHP Praha
 Jednání KR a VR ČNHP 21. 2. 2017 Praha Program 10:30 Zahájení Představení registru v Clade-IS (Pavlíčková, 90 min) Postřehy k vyplňování (všichni, 30 min) 12:30 Oběd Propojení registru s WAPPS-Hemo (Ovesná,
Jednání KR a VR ČNHP 21. 2. 2017 Praha Program 10:30 Zahájení Představení registru v Clade-IS (Pavlíčková, 90 min) Postřehy k vyplňování (všichni, 30 min) 12:30 Oběd Propojení registru s WAPPS-Hemo (Ovesná,
Úloha SUKL v uplatňování farmakoekonomiky a HTA
 Úloha SUKL v uplatňování farmakoekonomiky a HTA [ 1 ] Činnost SUKL jako organizační slo ky státu Je dána zákonem 378/2007 Sb. ZABEZPEČOVÁNÍ LÉČIV Díl 1 Úkoly orgánů vykonávajících státní správu v oblasti
Úloha SUKL v uplatňování farmakoekonomiky a HTA [ 1 ] Činnost SUKL jako organizační slo ky státu Je dána zákonem 378/2007 Sb. ZABEZPEČOVÁNÍ LÉČIV Díl 1 Úkoly orgánů vykonávajících státní správu v oblasti
GDPR informace podle čl. 13 uvedeného nařízení
 GDPR informace podle čl. 13 uvedeného nařízení 1. Ochrana osobních údajů Informace o zpracování osobních údajů ve smyslu čl. 12, 13 a 14 nařízení Evropského parlamentu a rady (EU) č. 2016/679, o ochraně
GDPR informace podle čl. 13 uvedeného nařízení 1. Ochrana osobních údajů Informace o zpracování osobních údajů ve smyslu čl. 12, 13 a 14 nařízení Evropského parlamentu a rady (EU) č. 2016/679, o ochraně
Název výkonu, event. číslo: I. Tento registrační list je předložen jako: (odpovídající zaškrtnout)
 Registrační list zdravotního výkonu, na základě kterého je na Ministerstvu zdravotnictví výkon zadáván do databáze Seznamu zdravotních výkonů s bodovými hodnotami, která je podkladem k vydání příslušné
Registrační list zdravotního výkonu, na základě kterého je na Ministerstvu zdravotnictví výkon zadáván do databáze Seznamu zdravotních výkonů s bodovými hodnotami, která je podkladem k vydání příslušné
2019 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 Edukační materiály EDUKAČNÍ MATERIÁLY NOVÁ VERZE POKYNU PHV-7 VERZE 1 MVDr. Kristýna Králová Seminář Aktuality ve farmakovigilanci, SÚKL Edukační materiály Aktualizace pokynu PHV-7 zjednodušení spolupráce
Edukační materiály EDUKAČNÍ MATERIÁLY NOVÁ VERZE POKYNU PHV-7 VERZE 1 MVDr. Kristýna Králová Seminář Aktuality ve farmakovigilanci, SÚKL Edukační materiály Aktualizace pokynu PHV-7 zjednodušení spolupráce
Metodika pro komunikaci změn v Seznamu výkonů s bodovými hodnotami. Podmínky pro zpracování aktualizace SZV pro účely klasifikace DRG
 Metodika pro komunikaci změn v Seznamu výkonů s bodovými hodnotami Podmínky pro zpracování aktualizace SZV pro účely klasifikace DRG Verze: 1_0.1 Autor: Národní referenční centrum Datum 22. 5. 2012 1 Obsah
Metodika pro komunikaci změn v Seznamu výkonů s bodovými hodnotami Podmínky pro zpracování aktualizace SZV pro účely klasifikace DRG Verze: 1_0.1 Autor: Národní referenční centrum Datum 22. 5. 2012 1 Obsah
SMĚRNICE DĚKANA Č. 4/2013
 Vysoké učení technické v Brně Datum vydání: 11. 10. 2013 Čj.: 076/17900/2013/Sd Za věcnou stránku odpovídá: Hlavní metodik kvality Za oblast právní odpovídá: --- Závaznost: Fakulta podnikatelská (FP) Vydává:
Vysoké učení technické v Brně Datum vydání: 11. 10. 2013 Čj.: 076/17900/2013/Sd Za věcnou stránku odpovídá: Hlavní metodik kvality Za oblast právní odpovídá: --- Závaznost: Fakulta podnikatelská (FP) Vydává:
Odůvodnění veřejné zakázky dle 156 odst. 1 zákona č. 137/2006 Sb., o veřejných zakázkách v souladu s vyhláškou 232/2012 Sb.
 Odůvodnění veřejné zakázky dle 156 odst. 1 zákona č. 137/2006 Sb., o veřejných zakázkách v souladu s vyhláškou 232/2012 Sb. Název veřejné zakázky: Modernizace a obnova přístrojového vybavení komplexního
Odůvodnění veřejné zakázky dle 156 odst. 1 zákona č. 137/2006 Sb., o veřejných zakázkách v souladu s vyhláškou 232/2012 Sb. Název veřejné zakázky: Modernizace a obnova přístrojového vybavení komplexního
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2 DOKUMENTACE KLINICKÉ ZKOUŠKY Státní ústav pro kontrolu léčiv Mgr. Martina Rejnková odborný hodnotitel, odd. klinického hodnocení zdravotnických prostředků 3 Obsah: legislativa součásti dokumentace KZZP
2 DOKUMENTACE KLINICKÉ ZKOUŠKY Státní ústav pro kontrolu léčiv Mgr. Martina Rejnková odborný hodnotitel, odd. klinického hodnocení zdravotnických prostředků 3 Obsah: legislativa součásti dokumentace KZZP
VÝROČNÍ ZPRÁVA. Koordinační středisko transplantací
 VÝROČNÍ ZPRÁVA Koordinační středisko transplantací Zpráva o stavu a činnosti KST za rok 2013 Statistické údaje o transplantacích za rok 2013 Zpráva o přístupu k informacím za rok 2013 Základní informace
VÝROČNÍ ZPRÁVA Koordinační středisko transplantací Zpráva o stavu a činnosti KST za rok 2013 Statistické údaje o transplantacích za rok 2013 Zpráva o přístupu k informacím za rok 2013 Základní informace
Aktuální změny v legislativě zdravotnických prostředků. Odbor farmacie Mgr. Kateřina Pavlíková
 Aktuální změny v legislativě zdravotnických prostředků Odbor farmacie Mgr. Kateřina Pavlíková Základní ustanovení Nový zákon o zdravotnických prostředcích účinnost: 1.4 2015 sjednocuje význam pojmů tak,
Aktuální změny v legislativě zdravotnických prostředků Odbor farmacie Mgr. Kateřina Pavlíková Základní ustanovení Nový zákon o zdravotnických prostředcích účinnost: 1.4 2015 sjednocuje význam pojmů tak,
P R A C O V N Í P O S T U P. P_0106 rev.01. Způsob posuzování studie k vydání stanoviska. Zpracoval: Garant Schválil: Prof. MUDr. Jan Pachl, CSc.
 FAKULTNÍ NEMOCNICE KRÁLOVSKÉ VINOHRADY P R A C O V N Í P O S T U P P_0106 rev.01 Způsob posuzování studie k vydání stanoviska Datum vydání: 23.10.2017 Datum účinnosti: 01.11.2017 Doba platnosti: Bez omezení,
FAKULTNÍ NEMOCNICE KRÁLOVSKÉ VINOHRADY P R A C O V N Í P O S T U P P_0106 rev.01 Způsob posuzování studie k vydání stanoviska Datum vydání: 23.10.2017 Datum účinnosti: 01.11.2017 Doba platnosti: Bez omezení,
