Chemická struktura B
|
|
|
- Martin Fišer
- před 6 lety
- Počet zobrazení:
Transkript
1 Chemcká struktura B Elektronová struktura molekul Lubomír Rulíšek, Martn Srnec rulsek@uochb.cas.cz; srnec@h-nst.cas.cz (2016/17: pondělí CH3 8:10 9:40, CH3 9:50 10:35) 1
2 Přednáška 6: Od vodíku k protenům Atomové orbtaly vodíku ( přesné ednoelektronové vlnové funkce elektronu v kulově symetrcké pol ádra) Molekulové orbtaly reálných systémů ( přblžné ednoelektronové vlnové funkce, echž antsymetrzovaný součn nám dá přblžnou vlnovou funkc systému, tedy úplný pops eho elektronové struktury)
3 Schrödnger Equaton Free-Partcle Drac Equaton 3
4 Q-Chem World Wave Functon Theory Ĥ e Ψ e (r;r) = E e Ψ e (r;r) Ψ, ρ Densty Functonal Theory (DFT) Varatonal, perturbatonal treatment, (QMC) HF MR-SCF (CASSCF) CI MP2 CASPT2 CCSD(T) MR-CI FCI Herarchy Hundreds of functonals avalable - Local densty approxmaton (LDA) - Generalzed gradent approx. (GGA) - Meta-GGA - Hybrd (+HF exchange) + (emprcal dsperson, densty-fttng) John Perdew: Jaccob s Ladder? LR personal pck : PBE, TPSS(h), B3LYP, M06 s, wb97xd 4
5 Vícelektronové atomy, lneární molekuly, nelneární molekuly Bornova-Oppenhemerova aproxmace V en nám neumožňue provést separac, proměnných, my přesto provedeme (BO aproxmace) 5
6 Tvar vlnové funkce (vícečástcové systémy) Přednáška číslo 1: Paulho vylučovací prncp ΨΨ = ΨΨ rr 11, rr 22, rr 33,, rrrr Částce (elektrony, protony) sou dentcké rys kvantové mechanky Pro fermony (elektrony) ΨΨ rr 11, rr 22, rr 33,, rrrr = ΨΨ rr 11, rr 33, rr 22,, rrrr Pro bosony (fotony, atomová ádra) ΨΨ rr 11, rr 22, rr 33,, rrrr = ΨΨ rr 11, rr 33, rr 22,, rrrr Paulho vylučovací prncp: žádné fermony nemohou být ve steném stavu Nemůžeme říc, že eden elektron e zde, a druhý tam, de vždy o pár elektronů... 6
7 Hartreeho součn (bosony) ΧΧ rr 11, rr 22, rr 33,, rrrr = χχ 11 rr 11 χχ 22 rr 22 χχ nn rr nn Antsymetrzovaný Hartreeho součn: Slaterův determnant (fermony) Atomový č molekulový orbtal 7
8 Výstavbový prncp (Aufbau prncple) 8
9 N-elektronové stavy v atomech El. konfgurace: počet elektronů v daných atomových (molekulových) orbtalech Příklad: N = [Ar]4s 2 3d 8, [Ar]4s 1 3d 9, [Ar]4s 0 3d 10 Cu = [Ar]4s 1 3d 10, [Ar]4s 1 3d 10 dobře popsány pomocí momentu hybnost 2S+1 L J Podrobná kuchařka, ak pro danou konfgurac vyrobt všechny termy: (Youtube: Term symbols) Tabulky 9
10 Hundova pravdla základní elektronový stav molekuly vždy, exctované stavy většnou 1. Pro danou elektronovou konfgurac má nenžší energ člen s nevyšší multplctou, tedy s maxmální velkostí celkového spnu. 2. Př dané multplctě má nenžší energ konfgurace s maxmální velkostí orbtálního momentu hybnost, tedy s maxmální hodnotou orbtálního kvantového čísla. 3. Má-l atom valenční slupku zaplněnou méně ak z půlky, nabývá v základním stavu hodnota celkového momentu hybnost J = L + S mnmální hodnoty. Je-l valenční slupka zaplněna více ak z půlky, nabývá hodnoty maxmální. 10
11 Obecné přístupy k řešení SchR: varační, perturbační Ψ( q electrons ) guess Hˆ electrons Ψ = EΨ Ψ ( q electrons ) [ optmzed E Ψ ] optmzed ε Optmze Ψ and obtan E through a varaton guess electrons guess [ Ψ ] = E[ Ψ ] guess Ψ Hˆ Ψ guess Ψ Ψ guess ε(c) opt = Ψ opt Hˆ Ψ opt electrons Ψ ε[ Ψ( c0, c1,..., cp )] ε ( c0, c1,.., cp ) = 0 c opt Ψ opt Optmze Ψ and obtan E through a perturbaton (0) Hˆ λ = Hˆ + λ ˆ Let λ be a perturbatonal parameter 0 λ 1 We seek the soluton n the form: Ψ E ( ) V (0) (1) 2 (2) ( λ) = Ψ + λψ + λ Ψ +... (0) (1) 2 (2) ( λ) = E + λe + λ E +... Then, solvng Ĥ ( λ) Ψ( λ) = E( λ) Ψ( λ) c 11
12 Kvantová cheme: WFT (níže), DFT(dále) Aneb ak vyřešt SchR pro atomové a molekulové systémy Sem-emprcké metody (MNDO, AM1, PM3, etc.) Výpočetní náročnost Ab nto metody Multconfguratonal HF (MCSCF, CASSCF) perturbatonal herarchy (CASPT2, CASPT3) exctaton herarchy (MR-CISD, MR-CCSD) Hartree Fock (HF-SCF) Korelační energe (většnou <1% celkové energe) perturbatonal herarchy (MP2, MP3, MP4, ) exctaton herarchy (CIS, CISD, CISDT, ) (CCS, CCSD, CCSDT,...) Full CI 12
13 Nástn Hartreeho-Fockovy(-Roothanovy) metody alas SCF metody Antsymetrzovaný Hartreeho součn: Slaterův determnant Atomový č molekulový orbtal 13
14 Molekulové orbtaly, coby prvky Slaterova det., sou konstruovány z atomových orbtalů: Sada bázových funkcí (bass set) ψ = N = 1 c a ϕa (lneární kombnace atomových orbtalů, LCAO) Hydrogen-lke (one-electron) AOs are always of the form: ( θ, ϑ) R( r) Y ( θ ϑ) ϕ r =, where R(r) s the radal component that decays exponentally, lm wth ncreasng dstance from the nucleus e -ζr 14
15 Báze atomových orbtalů DZ DZP TZ TZP TZPD QZVPD 15
16 HF rovnce: Co se stane, když dosadíme SD to Schr. rovnce? Hˆ Ψ electrons ( r ) = EΨ( r ) electrons electrons Ψ Hˆ electrons Ψ = E Ψ Ψ f Ψ Ψ =1 hˆ one electron Ψ + Ψ hˆ, two electron Ψ = Ψ, < E E = Slaterova-Condonova pravdla (působení edno a dvou-elektronových operátorů na SD) 1 χ hˆ one electron χ + χχ hˆ two electron χχ χχ hˆ two electron χ χ 2 one-electron ntegrals { }, two-electron Coulomb ntegrals two-electron exchange ntegrals 16
17 E Ψ = Ψ ˆ Ψ + Ψ ˆ [ ] h one electron, htwo electron, < Ψ spnorbtals f Ψ 1 Slater determnant E = { χχ hˆ two electron χχ χχ hˆ two electron χ } 1 χ hˆ one electron χ + χ 2 one-electron ntegrals Condton: χ χ = δ MOs LCAO, (and E mnmzed trough varatonal approach) two-electron Coulomb ntegrals Fock equaton Fˆχ = ε χ = Fˆ two-electron exchange ntegrals 1 2 hˆ ψ Jˆ Kˆ ψ = one electron + Jˆ Kˆ Fock operator = Fockan Fock matrx n the bass of AOs Workng Roothaan equaton: orbtal energy of -th MO AO-overlap matrx { F( c) ε S} c = 0 Vector of LCAO coeffcents for th MO { F ( c) ε 1} c = 0 In fact, F depends on c: see next page thus, equatons has to be solved teratvely -> self-consstent feld 17
18 F nucle 1 ϕ Tˆ el ϕq ϕ p Vˆ e n ϕq + Prs ϕ pϕr Vˆ e e ϕqϕs ϕ k pϕr Vˆ, e e ϕsϕq 2 pq = p k r, s AOs h pq densty matrx = occuped 2 c c r s Ths s what s optmzed teratvely to get E mnmzed Program flow: Compute and store all overlap, one-electron and two electron ntegrals Choose a molecular geometry Guess ntal densty matrx P (0) Choose a bass set Construct and solve Roothaan equaton Replace P (n-1) wth P n Construct P from occuped MOs HF converged pq yes ( h F ) AO 1 E HF = Pqp pq + 2 pq Is new P (n) smlar to P (n-1)? for restrcted Hartree-Fock method no 18
19 Computatonal bottleneck the evaluaton of two-electron (four-center) ntegrals Restrcted (closed-shell / open-shell HF) unrestrcted HF spn-symmetry broken α α α α { F ε S } c = 0 β β β β { F ε S } c = 0 ϕ ˆ pϕr Ve e ϕqϕs β α β β α ( c, c ); F ( c c ) β F, S 2 Ψ = S( S + 1) Ψ RHF RHF S 2 Ψ S( S + 1) Ψ UHF UHF Spn contamnaton Koopmansův teorém: IP = ε 19
20 Post-SCF (post-hf) metody Korelační energe: E corr = E exact - E HF 20
21 The total energy s represented as a functonal of densty: E DFT metody: 2 základní teorémy 1 st Hohenberg-Kohn theorem: shows that electron densty of an arbtrary molecular system (n an electroncally nondegenerate ground state) n the absence of external electromagnetc felds determnes unambguously statc external potental 2 nd Hohenberg-Kohn theorem: proves that the correct ground state electron densty mnmzes the energy E[ρ] [ ρ] = V [ ρ] + T[ ρ] + V [ ρ] = ρ( r) v ( r) dr + T[ ρ] V [ ρ] ne ee v ext ( r) = nucle k = 1 Z 1 ext + k r R k ee nucleus-electron attracton energy knetc energy of (nteractng) electrons electron-electron nteracton energy 21
22 Molekulové vlastnost Consder a molecule n an external electrc feld ε. E de dε 2 d E dε 1 2 ( ε ) = E( ε = 0) + ε + ε ε = 0 ε = 0 Dpole moment (µ) Polarzablty (α) Frst hyperpolarzablty (ß) µ = α = β = de dε 2 d E 2 dε 3 d E 3 dε ε = 0 ε = 0 ε = 0 22
23 Molekulové vlastnost α de dε α α 2 d E dε dε β 2 d E dx dε α β 3 d E dε dε dε de dx 2 d E dx dx 3 d E dx dx dx α 3 d E dx dε dε γ 4 d E dx dx dx dx k k β l dpole moment; n a smlar way also multpole moments, electrc feld gradents, etc. polarzablty (frst) hyperpolarzablty forces on nucle harmonc force constants; harmonc vbratonal frequences cubc force constants; anharmonc correctons to dstances and rotatonal constants quartc force constants; anharmonc correctons to vbratonal frequences dpole dervatves; nfrared ntenstes polarzablty dervatves; Raman ntenstes 23
24 Optmalzace molekulové geometre 24
25 Od vodíku k protenům Kvantová cheme: vývo DFT a WFT metod Molekulové vlastnost Chemcká reaktvta: např. teore aktvovaného komplexu (TST) Výpočetní cheme: aplkace metod Chemcká struktura (př. 1-5): taemný kvantový svět, formalsmus QM, postuláty QM, analytcké řešení základních úloh, atom vodíku Molekulové modelování: větší systémy (+Statstcká Mechanka, solvatace, molekulová mechanka a dynamka) Molekulová symetre Nevazebné (ntermolekulární) nterakce Kvantová dynamka Struktura atomů, atomová spektra Atomová a molekulová spektroskope (př. 7-12): obecné prncpy, MW (rotační), IR (vbrační), Ramanova, CD, EPR, NMR,... 25
26 Ψ, ρ God speed, and good luck to you" (Armageddon) 26
Lambertův-Beerův zákon
 Lambertův-Beerův zákon Intenzta záření po průchodu kavtou se vzorkem: Integrovaný absorpční koecent: I nal = I ntal e ε c L A = ε ( ~ ν ) d~ ν Bezjednotková včna síla osclátoru: v cm -1 = 4.3 10 9 A Síla
Lambertův-Beerův zákon Intenzta záření po průchodu kavtou se vzorkem: Integrovaný absorpční koecent: I nal = I ntal e ε c L A = ε ( ~ ν ) d~ ν Bezjednotková včna síla osclátoru: v cm -1 = 4.3 10 9 A Síla
ÚVOD DO KVANTOVÉ CHEMIE
 ÚVOD DO KVANTOVÉ CHEME. Navození kvantové mechanky Postuláty kvantové mechanky, základy operátorové algebry, navození kvantové mechanky, jednoduché modely.. Vodíkový atom 3. Základní aproxmace používané
ÚVOD DO KVANTOVÉ CHEME. Navození kvantové mechanky Postuláty kvantové mechanky, základy operátorové algebry, navození kvantové mechanky, jednoduché modely.. Vodíkový atom 3. Základní aproxmace používané
Hartre-Fock method (HF)
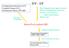 Cofgurato Iteracto (CI) Coupled Clusters (CC) Perturbato Theory (PT, MP) Electro correlato H Ψ = EΨ Bor-Oppehemer approxmato Model of depedet electros Product wave fucto (Slater determat) MO LCAO Hartre-Fock
Cofgurato Iteracto (CI) Coupled Clusters (CC) Perturbato Theory (PT, MP) Electro correlato H Ψ = EΨ Bor-Oppehemer approxmato Model of depedet electros Product wave fucto (Slater determat) MO LCAO Hartre-Fock
Ab initio výpočty v chemii a biochemii
 Ab initio výpočty v chemii a biochemii Doc. RNDr. Ing. Jaroslav Burda, CSc., jaroslav.burda@mff.cuni.cz Dr. Vladimír Sychrovský vladimir.sychrovsky@uochb.cas.cz Studijní literatura Szabo A., Ostlund N.S.
Ab initio výpočty v chemii a biochemii Doc. RNDr. Ing. Jaroslav Burda, CSc., jaroslav.burda@mff.cuni.cz Dr. Vladimír Sychrovský vladimir.sychrovsky@uochb.cas.cz Studijní literatura Szabo A., Ostlund N.S.
Operátory a maticové elementy
 Operátory a matice Operátory a maticové elementy operátory je výhodné reprezentovat maticemi maticové elementy operátorů jsou dány vztahy mezi Slaterovými determinanty obsahujícími ortonormální orbitaly
Operátory a matice Operátory a maticové elementy operátory je výhodné reprezentovat maticemi maticové elementy operátorů jsou dány vztahy mezi Slaterovými determinanty obsahujícími ortonormální orbitaly
Hartreeho-Fockova metoda (HF)
 Staonární Shrödngerova rovne H Ψ = EΨ Metoda konfgurační nterake Metoda vázanýh klastrů Poruhová teore Zahrnutí el. korelae Bornova-Oppenhemerova aproxmae Model nezávslýh elektronů Vlnová funke ve tvaru
Staonární Shrödngerova rovne H Ψ = EΨ Metoda konfgurační nterake Metoda vázanýh klastrů Poruhová teore Zahrnutí el. korelae Bornova-Oppenhemerova aproxmae Model nezávslýh elektronů Vlnová funke ve tvaru
Korelační energie. Celkovou elektronovou energii molekuly lze experimentálně určit ze vztahu. E vib. = E at. = 39,856, E d
 Korelační energe Referenční stavy Energ molekul a atomů lze vyjádřt vzhledem k různým referenčním stavům. V kvantové mechance za referenční stav s nulovou energí bereme stav odpovídající nenteragujícím
Korelační energe Referenční stavy Energ molekul a atomů lze vyjádřt vzhledem k různým referenčním stavům. V kvantové mechance za referenční stav s nulovou energí bereme stav odpovídající nenteragujícím
11 Kvantová teorie molekul
 11 Kvantová teore molekul Pops molekul v rámc kvantové teore je ústředním tématem kvantové cheme. Na rozdíl od atomů nejsou molekuly centrálně symetrcké, což výpočty jejch vlastností komplkuje. V důsledku
11 Kvantová teore molekul Pops molekul v rámc kvantové teore je ústředním tématem kvantové cheme. Na rozdíl od atomů nejsou molekuly centrálně symetrcké, což výpočty jejch vlastností komplkuje. V důsledku
Molekulová vibrace dvojatomové molekuly. Disociační křivka dvojatomové molekuly
 Molekulová vbrace dvojatomové molekuly Dsocační křvka dvojatomové molekuly x Potencální energe, E Repulsvní síly x Přtažlvé síly síly x Pro malé odchylky [(x-x ) ] možno aproxmovat parabolou, jak plyne
Molekulová vbrace dvojatomové molekuly Dsocační křvka dvojatomové molekuly x Potencální energe, E Repulsvní síly x Přtažlvé síly síly x Pro malé odchylky [(x-x ) ] možno aproxmovat parabolou, jak plyne
METODY VÝPOČETNÍ CHEMIE
 METODY VÝPOČETNÍ CHEMIE Metody výpočetní chemie Ab initio metody Semiempirické metody Molekulová mechanika Molekulová simulace Ab initio metody Ab initio - od počátku Metody kvantově-mechanické vycházejí
METODY VÝPOČETNÍ CHEMIE Metody výpočetní chemie Ab initio metody Semiempirické metody Molekulová mechanika Molekulová simulace Ab initio metody Ab initio - od počátku Metody kvantově-mechanické vycházejí
Molekuly. w konstrukce zkusmé funkce ve tvaru LCAO. atomový orbital - známe. rozvojový koeficient neznáme - počítáme
 Zdroje w Zdroje nejsou důsledně továny, za ož se hluboe omlouvám w Některé zdroje w L. Pela: Ideas of Quantum Chemstry w Gaussan: WhtePages w do. P. Nahtgall přednášky z podzmní školy w do. P. Jurečka
Zdroje w Zdroje nejsou důsledně továny, za ož se hluboe omlouvám w Některé zdroje w L. Pela: Ideas of Quantum Chemstry w Gaussan: WhtePages w do. P. Nahtgall přednášky z podzmní školy w do. P. Jurečka
VÝPOČETNÍ CHEMIE V ANALÝZE STRUKTURY
 VÝPOČETNÍ CHEMIE V ANALÝZE STRUKTURY A VLASTNOSTÍ MOLEKUL Michal Čajan Katedra anorganické chemie PřF UP v Olomouci MOLEKULOVÉ MODELOVÁNÍ V CHEMII MOLEKULOVÉ MODELOVÁNÍ aplikace zobrazení a analýza strukturních
VÝPOČETNÍ CHEMIE V ANALÝZE STRUKTURY A VLASTNOSTÍ MOLEKUL Michal Čajan Katedra anorganické chemie PřF UP v Olomouci MOLEKULOVÉ MODELOVÁNÍ V CHEMII MOLEKULOVÉ MODELOVÁNÍ aplikace zobrazení a analýza strukturních
ck f Podmínka pro nalezení nejvhodnější variační funkce (minimální energie): = 0
 Varačí teorém W Φ H Φ = ΦΦ E 0 Aproxmatví vlová fukce dává eerg, která je vždy větší (ebo rova) E 0 Leárí varačí fukce: Φ = k k W Podmíka pro alezeí ejvhodější varačí fukce (mmálí eerge): = 0 ck f c =>
Varačí teorém W Φ H Φ = ΦΦ E 0 Aproxmatví vlová fukce dává eerg, která je vždy větší (ebo rova) E 0 Leárí varačí fukce: Φ = k k W Podmíka pro alezeí ejvhodější varačí fukce (mmálí eerge): = 0 ck f c =>
Hartreeho-Fockova metoda (HF)
 Stacionární Schrödingerova rovnice H Ψ = EΨ Metoda konfigurační interakce Metoda vázaných klastrů Poruchová teorie Zahrnutí el. korelace Bornova-Oppenheimerova aproximace Model nezávislých elektronů Vlnová
Stacionární Schrödingerova rovnice H Ψ = EΨ Metoda konfigurační interakce Metoda vázaných klastrů Poruchová teorie Zahrnutí el. korelace Bornova-Oppenheimerova aproximace Model nezávislých elektronů Vlnová
Mul$determinantální metody: CASSCF
 Mul$determinantální metody: CASSCF Mul%konfiguračni (mnohadeterninantálni MC SCF) metody použivají narozdíl od metody Hartreeho- Focka pro popis N- elektronového systému větší počet Slaterových determinantů.
Mul$determinantální metody: CASSCF Mul%konfiguračni (mnohadeterninantálni MC SCF) metody použivají narozdíl od metody Hartreeho- Focka pro popis N- elektronového systému větší počet Slaterových determinantů.
Atom vodíku. Nejjednodušší soustava: p + e Řešitelná exaktně. Kulová symetrie. Potenciální energie mezi p + e. e =
 Atom vodíku Nejjednodušší soustava: p + e Řešitelná exaktně Kulová symetrie Potenciální energie mezi p + e V 2 e = 4πε r 0 1 Polární souřadnice využití kulové symetrie atomu Ψ(x,y,z) Ψ(r,θ, φ) x =? y=?
Atom vodíku Nejjednodušší soustava: p + e Řešitelná exaktně Kulová symetrie Potenciální energie mezi p + e V 2 e = 4πε r 0 1 Polární souřadnice využití kulové symetrie atomu Ψ(x,y,z) Ψ(r,θ, φ) x =? y=?
Modelové výpočty na H 2 a HeH +
 Modelové výpočty na H 2 a HeH + Minimální báze Všechny teoretické poznatky je užitečné ilustrovat modelovým výpočtem. Budeme aplikovat Hartree-Fockovy výpočty na uzavřených slupkách systémů H 2 a HeH +.
Modelové výpočty na H 2 a HeH + Minimální báze Všechny teoretické poznatky je užitečné ilustrovat modelovým výpočtem. Budeme aplikovat Hartree-Fockovy výpočty na uzavřených slupkách systémů H 2 a HeH +.
ĤΨ=EΨ. aproximace pro vlnovou funkci Ψ atomové orbitaly molekulové orbitaly mnoho-elektronové molekuly
 Chemická struktura Hartreeho-Fockova metoda základní metoda kvantové chemie, řešení Schrödingerovy rovnice Atomové a molekulové orbitaly, báze AO Hückelova metoda ĤΨ=EΨ aproximace pro Hamiltonián Ĥ repulze
Chemická struktura Hartreeho-Fockova metoda základní metoda kvantové chemie, řešení Schrödingerovy rovnice Atomové a molekulové orbitaly, báze AO Hückelova metoda ĤΨ=EΨ aproximace pro Hamiltonián Ĥ repulze
Kvantová teorie atomů
 Kvantová teorie atomů Kdo otevřel Pandořinu skříňku? l při studiu záření abs. černého tělesa (hvězda) použil Max von Planck (1900, NP 1918) předpoklad, že oscilátor má diskrétní spektrum, s velikostí kvanta
Kvantová teorie atomů Kdo otevřel Pandořinu skříňku? l při studiu záření abs. černého tělesa (hvězda) použil Max von Planck (1900, NP 1918) předpoklad, že oscilátor má diskrétní spektrum, s velikostí kvanta
ESR, spinový hamiltonián a spektra
 ER, spnový hamltonán a spektra NMR k k získávání důležtých nformací o struktuře látky využívá gyromagnetckých vlastností atomových jader. Podobně ER (EPR) využívá k obdobným účelům gyromagnetckých vlastností
ER, spnový hamltonán a spektra NMR k k získávání důležtých nformací o struktuře látky využívá gyromagnetckých vlastností atomových jader. Podobně ER (EPR) využívá k obdobným účelům gyromagnetckých vlastností
Univerzita Karlova v Praze Matematicko-fyzikální fakulta
 Unverzta Karlova v Praze Matematcko-fyzkální fakulta Martn Golan Katedra chemcké fyzky a optky Vedoucí bakalářské práce: Doc. RNDr. Ing. Jaroslav Burda, CSc. Studjní obor: Bofyzka a chemcká fyzka 2010
Unverzta Karlova v Praze Matematcko-fyzkální fakulta Martn Golan Katedra chemcké fyzky a optky Vedoucí bakalářské práce: Doc. RNDr. Ing. Jaroslav Burda, CSc. Studjní obor: Bofyzka a chemcká fyzka 2010
Atomové a molekulové orbitaly Ion molekuly vodíku. Molekula vodíku Heitler-Londonovou metodou. Metoda LCAO. Báze atomových orbitalů.
 Atomové a molekulové orbitaly Ion molekuly vodíku. Molekula vodíku Heitler-Londonovou metodou. Metoda LCAO. Báze atomových orbitalů. Ion molekuly vodíku H + 2 První použití metody je demonstrováno při
Atomové a molekulové orbitaly Ion molekuly vodíku. Molekula vodíku Heitler-Londonovou metodou. Metoda LCAO. Báze atomových orbitalů. Ion molekuly vodíku H + 2 První použití metody je demonstrováno při
Electron Density. One-el. Functions. Traditional Ab initio. Model of independent electrons. Electron correlation neglected
 CCSD(T) Stationary Schrödingr quation H Ψ = EΨ MP Elctron corrlation Expansion ovr Slatr dt. Φ= C0Ψ 0 + CSΨ S + CDΨ D + Non-rlativistic Hamiltonian Born-Oppnhimr approximaion occ Elctron Dnsity ρ( r) ϕ
CCSD(T) Stationary Schrödingr quation H Ψ = EΨ MP Elctron corrlation Expansion ovr Slatr dt. Φ= C0Ψ 0 + CSΨ S + CDΨ D + Non-rlativistic Hamiltonian Born-Oppnhimr approximaion occ Elctron Dnsity ρ( r) ϕ
Fyzika biopolymerů. Elektrostatické interakce makromolekul ve vodných roztocích. Vodné roztoky. Elektrostatická Poissonova rovnice.
 Fyzka bopolymerů Elektrostatcké nterakce makromolekul ve vodných roztocích Robert Vácha Kamence 5, A4 2.13 robert.vacha@mal.mun.cz Vodné roztoky ldské tělo se skládá z 55-75 % z vody (roztoků) většna roztoků
Fyzka bopolymerů Elektrostatcké nterakce makromolekul ve vodných roztocích Robert Vácha Kamence 5, A4 2.13 robert.vacha@mal.mun.cz Vodné roztoky ldské tělo se skládá z 55-75 % z vody (roztoků) většna roztoků
ATOM VODÍKU MODEL : STOJÍCÍ BODOVÉ JÁDRO A ELEKTRON VZÁJEMNĚ ELEKTROSTATICKY INTERAGUJÍCÍ SCHRÖDINGEROVA ROVNICE PRO PŘÍPAD POTENCIÁLNÍ ENERGIE.
 ATOMY + MOLEKULY ATOM VODÍKU MODEL : STOJÍCÍ BODOVÉ JÁDRO A ELEKTRON VZÁJEMNĚ ELEKTROSTATICKY INTERAGUJÍCÍ SCHRÖDINGEROVA ROVNICE H ˆψ = Eψ PRO PŘÍPAD POTENCIÁLNÍ ENERGIE Vˆ = Ze 2 4πε o r ŘEŠENÍ HLEDÁME
ATOMY + MOLEKULY ATOM VODÍKU MODEL : STOJÍCÍ BODOVÉ JÁDRO A ELEKTRON VZÁJEMNĚ ELEKTROSTATICKY INTERAGUJÍCÍ SCHRÖDINGEROVA ROVNICE H ˆψ = Eψ PRO PŘÍPAD POTENCIÁLNÍ ENERGIE Vˆ = Ze 2 4πε o r ŘEŠENÍ HLEDÁME
Od kvantové mechaniky k chemii
 Od kvantové mechaniky k chemii Jan Řezáč UOCHB AV ČR 19. září 2017 Jan Řezáč (UOCHB AV ČR) Od kvantové mechaniky k chemii 19. září 2017 1 / 33 Úvod Vztah mezi molekulovou strukturou a makroskopickými vlastnostmi
Od kvantové mechaniky k chemii Jan Řezáč UOCHB AV ČR 19. září 2017 Jan Řezáč (UOCHB AV ČR) Od kvantové mechaniky k chemii 19. září 2017 1 / 33 Úvod Vztah mezi molekulovou strukturou a makroskopickými vlastnostmi
Spinový moment hybnosti /magnetický moment, interakce s magnetickým polem
 Spnový oent hybnost /anetcký oent, nterakce s anetcký pole Velkost jednoho elektronového spnu: Velkost jednoho jaderného spnu: s s( s ) 3 ( ) Sudé Sudé Z 0 Sudé Lché Z... apř: He, C, 6 O celočíselné apř:
Spnový oent hybnost /anetcký oent, nterakce s anetcký pole Velkost jednoho elektronového spnu: Velkost jednoho jaderného spnu: s s( s ) 3 ( ) Sudé Sudé Z 0 Sudé Lché Z... apř: He, C, 6 O celočíselné apř:
13 Elektronová struktura molekul
 13 Elektronová struktura molekul Ústředním úkolem kvantové chemie po zavedení Bornovy-Oppenheimerovy aproximace je výpočet elektronové energie molekul Ĥ e ψ e ( r, R) = E e ( R)ψ e ( r, R), (13.1) kde
13 Elektronová struktura molekul Ústředním úkolem kvantové chemie po zavedení Bornovy-Oppenheimerovy aproximace je výpočet elektronové energie molekul Ĥ e ψ e ( r, R) = E e ( R)ψ e ( r, R), (13.1) kde
Teorie Molekulových Orbitalů (MO)
 Teorie Molekulových Orbitalů (MO) Kombinace atomových orbitalů na všech atomech v molekule Vhodná symetrie Vhodná (podobná) energie Z n AO vytvoříme n MO Pro začátek dvouatomové molekuly: H 2, F 2, CO,...
Teorie Molekulových Orbitalů (MO) Kombinace atomových orbitalů na všech atomech v molekule Vhodná symetrie Vhodná (podobná) energie Z n AO vytvoříme n MO Pro začátek dvouatomové molekuly: H 2, F 2, CO,...
Nerovnovážná termodynamika
 erovnovážná termodynamka Fázový prostor Dmenze 6 Bod ve ázovém prostoru ( phase pont ) ednoznačně určue dynamku systému pohybue se Soubor podmnožna ázového prostoru Hustota bodů ve ázovém prostoru: rakce
erovnovážná termodynamka Fázový prostor Dmenze 6 Bod ve ázovém prostoru ( phase pont ) ednoznačně určue dynamku systému pohybue se Soubor podmnožna ázového prostoru Hustota bodů ve ázovém prostoru: rakce
Univerzita Karlova v Praze Matematicko-fyzikální fakulta
 Univerzita Karlova v Praze Matematicko-fyzikální fakulta Diplomová práce Ladislav Benda Výpočetní studium struktury a vlastností klastrů ethanolu Katedra fyziky nízkých teplot Vedoucí diplomové práce:
Univerzita Karlova v Praze Matematicko-fyzikální fakulta Diplomová práce Ladislav Benda Výpočetní studium struktury a vlastností klastrů ethanolu Katedra fyziky nízkých teplot Vedoucí diplomové práce:
Born-Oppenheimerova aproximace
 Born-Oppenheimerova aproximace Oddělení elektronického a jaderného pohybu Jádra 2000 x těžší než elektrony elektrony kvantová chemie, popis systému (do 100 atomů) na základě vlastností elektronů (jádra
Born-Oppenheimerova aproximace Oddělení elektronického a jaderného pohybu Jádra 2000 x těžší než elektrony elektrony kvantová chemie, popis systému (do 100 atomů) na základě vlastností elektronů (jádra
Laserová technika prosince Katedra fyzikální elektroniky.
 Laserová technika 1 Aktivní prostředí Šíření rezonančního záření dvouhladinovým prostředím Jan Šulc Katedra fyzikální elektroniky České vysoké učení technické jan.sulc@fjfi.cvut.cz 22. prosince 2016 Program
Laserová technika 1 Aktivní prostředí Šíření rezonančního záření dvouhladinovým prostředím Jan Šulc Katedra fyzikální elektroniky České vysoké učení technické jan.sulc@fjfi.cvut.cz 22. prosince 2016 Program
Fyzika atomového jádra
 Fyzika atomového jádra (NJSF064) František Knapp http://www-ucjf.troja.mff.cuni.cz/~knapp/jf/ frantisek.knapp@mff.cuni.cz Slupkový model jádra evidence magických čísel: hmoty, separační energie, vazbové
Fyzika atomového jádra (NJSF064) František Knapp http://www-ucjf.troja.mff.cuni.cz/~knapp/jf/ frantisek.knapp@mff.cuni.cz Slupkový model jádra evidence magických čísel: hmoty, separační energie, vazbové
Relativistická kvantová mechanika
 Relatvstcká kvantová mechanka Mchal Lenc Poznámky k přednášce v jarním semestru Obrazy Postulát o kvantové kausaltě Evoluční operátor 3 Schrödngerův a Hesenbergův obraz 3 4 Interakční obraz4 Relatvta a
Relatvstcká kvantová mechanka Mchal Lenc Poznámky k přednášce v jarním semestru Obrazy Postulát o kvantové kausaltě Evoluční operátor 3 Schrödngerův a Hesenbergův obraz 3 4 Interakční obraz4 Relatvta a
PLANCK EINSTEIN BOHR de BROGLIE
 KVANTOVÁ MECHANIKA PLANCK 1858-1947 EINSTEIN 1879-1955 BOHR 1885-1962 de BROGLIE 1892-1987 HEISENBERG 1901-1976 SCHRÖDINGER 1887-1961 BORN 1882-1970 JORDAN 1902-1980 PAULI 1900-1958 DIRAC 1902-1984 VŠECHNO
KVANTOVÁ MECHANIKA PLANCK 1858-1947 EINSTEIN 1879-1955 BOHR 1885-1962 de BROGLIE 1892-1987 HEISENBERG 1901-1976 SCHRÖDINGER 1887-1961 BORN 1882-1970 JORDAN 1902-1980 PAULI 1900-1958 DIRAC 1902-1984 VŠECHNO
2. Elektrotechnické materiály
 . Elektrotechnické materiály Předpokladem vhodného využití elektrotechnických materiálů v konstrukci elektrotechnických součástek a zařízení je znalost jejich vlastností. Elektrické vlastnosti materiálů
. Elektrotechnické materiály Předpokladem vhodného využití elektrotechnických materiálů v konstrukci elektrotechnických součástek a zařízení je znalost jejich vlastností. Elektrické vlastnosti materiálů
Symetrie Platonovská tělesa
 Symetrie Platonovská tělesa 1 Symetrie Virus rýmy Virus obrny Virus slintavky a kulhavky 2 Symetrie molekul Jak jsou atomy v molekule uspořádány = ekvivalentní atomy 3 Prvky a operace symetrie Značka Prvek
Symetrie Platonovská tělesa 1 Symetrie Virus rýmy Virus obrny Virus slintavky a kulhavky 2 Symetrie molekul Jak jsou atomy v molekule uspořádány = ekvivalentní atomy 3 Prvky a operace symetrie Značka Prvek
Řešit atom vodíku znamená nalézt řešení Schrödingerovy rovnice s příslušným hamiltoniánem. 1 4πǫ 0. 2m e
 8 Atom vodíku Správné řešení atomu vodíku je jedním z velkých vítězství kvantové mechaniky. Podle klasické fyziky náboj, který se pohybuje se zrychlením (elektron obíhající vodíkové jádro proton), by měl
8 Atom vodíku Správné řešení atomu vodíku je jedním z velkých vítězství kvantové mechaniky. Podle klasické fyziky náboj, který se pohybuje se zrychlením (elektron obíhající vodíkové jádro proton), by měl
17 Vlastnosti molekul
 17 Vlastnosti molekul Experimentálně molekuly charakterizujeme pomocí nejrůznějších vlastností: můžeme změřit třeba NMR posuny, elektrické či magnetické parametry či třeba jejich optickou otáčivost. Tyto
17 Vlastnosti molekul Experimentálně molekuly charakterizujeme pomocí nejrůznějších vlastností: můžeme změřit třeba NMR posuny, elektrické či magnetické parametry či třeba jejich optickou otáčivost. Tyto
Kinetika spalovacích reakcí
 Knetka spalovacích reakcí Základy knetky spalování - nauka o průběhu spalovacích reakcí a závslost rychlost reakcí na různých faktorech Hlavní faktory: - koncentrace reagujících látek - teplota - tlak
Knetka spalovacích reakcí Základy knetky spalování - nauka o průběhu spalovacích reakcí a závslost rychlost reakcí na různých faktorech Hlavní faktory: - koncentrace reagujících látek - teplota - tlak
Teorie chemické vazby a molekulární geometrie Molekulární geometrie VSEPR
 Geometrie molekul Lewisovy vzorce poskytují informaci o tom které atomy jsou spojeny vazbou a o jakou vazbu se jedná (topologie molekuly). Geometrické uspořádání molekuly je charakterizováno: Délkou vazeb
Geometrie molekul Lewisovy vzorce poskytují informaci o tom které atomy jsou spojeny vazbou a o jakou vazbu se jedná (topologie molekuly). Geometrické uspořádání molekuly je charakterizováno: Délkou vazeb
10 Více-elektronové atomy
 1 Více-elektronové atomy Atom vodíku je asi nejsložitější soustava, kterou jsme schopni analyticky přesně vyřešit. Tato situace je pro chemika pochopitelně málo uspokojivá. Pomocí kvantové teorie bychom
1 Více-elektronové atomy Atom vodíku je asi nejsložitější soustava, kterou jsme schopni analyticky přesně vyřešit. Tato situace je pro chemika pochopitelně málo uspokojivá. Pomocí kvantové teorie bychom
Oddělení pohybu elektronů a jader
 Oddělení pohybu elektronů a ader Adiabatická aproximace Born-Oppenheimerova aproximace Důležité vztahy sou 4, 5, 7, 0,,, udělal sem to zbytečně podrobně, e to samostatný okruh Separace translačního pohybu:
Oddělení pohybu elektronů a ader Adiabatická aproximace Born-Oppenheimerova aproximace Důležité vztahy sou 4, 5, 7, 0,,, udělal sem to zbytečně podrobně, e to samostatný okruh Separace translačního pohybu:
Symetrie Platonovská tělesa
 Symetrie Platonovská tělesa 1 Symetrie Virus rýmy Virus obrny Virus slintavky a kulhavky 2 Symetrie molekul Jak jsou atomy v molekule uspořádány = ekvivalentní atomy 3 Prvky a operace symetrie Značk a
Symetrie Platonovská tělesa 1 Symetrie Virus rýmy Virus obrny Virus slintavky a kulhavky 2 Symetrie molekul Jak jsou atomy v molekule uspořádány = ekvivalentní atomy 3 Prvky a operace symetrie Značk a
Matematika I A ukázkový test 1 pro 2018/2019
 Matematka I A ukázkový test 1 pro 2018/2019 1. Je dána soustava rovnc s parametrem a R x y + z = 1 x + y + 3z = 1 (2a 1)x + (a + 1)y + z = 1 a a) Napšte Frobenovu větu (předpoklady + tvrzení). b) Vyšetřete
Matematka I A ukázkový test 1 pro 2018/2019 1. Je dána soustava rovnc s parametrem a R x y + z = 1 x + y + 3z = 1 (2a 1)x + (a + 1)y + z = 1 a a) Napšte Frobenovu větu (předpoklady + tvrzení). b) Vyšetřete
Elektronový obal atomu
 Elektronový obal atomu Vlnění o frekvenci v se může chovat jako proud částic (kvant - fotonů) o energii E = h.v Částice pohybující se s hybností p se může chovat jako vlna o vlnové délce λ = h/p Kde h
Elektronový obal atomu Vlnění o frekvenci v se může chovat jako proud částic (kvant - fotonů) o energii E = h.v Částice pohybující se s hybností p se může chovat jako vlna o vlnové délce λ = h/p Kde h
Stavba hmoty. Atomová teorie Korpuskulární model látky - chemické
 Stavba hmoty Atomová teorie Korpuskulární model látky - chemické látky jsou složeny z mikroskopických, chemicky dále neděčástic atomů. Později byl model rozšířen na molekuly a ionty (chemický druh - specie).
Stavba hmoty Atomová teorie Korpuskulární model látky - chemické látky jsou složeny z mikroskopických, chemicky dále neděčástic atomů. Později byl model rozšířen na molekuly a ionty (chemický druh - specie).
Přehled Ab Initio a semiempirických metod
 Přehled Ab Initio a semiempirických metod Pokud se vám bude zdát, že je v tom nějaký blud, tak tam asi je. Budu rád, když mě na něj upozorníte. Ab initio metody - od počátku, z prvotních principů, tzn.
Přehled Ab Initio a semiempirických metod Pokud se vám bude zdát, že je v tom nějaký blud, tak tam asi je. Budu rád, když mě na něj upozorníte. Ab initio metody - od počátku, z prvotních principů, tzn.
16 Semiempirické přístupy
 16 Semiempirické přístupy V této kapitole se podíváme na skupinu semiempirických metod. Ačkoli semiempirické metody také vycházejí z řešení elektronové Schrödingerovy rovnice, jejich rovnice obsahují dodatečné
16 Semiempirické přístupy V této kapitole se podíváme na skupinu semiempirických metod. Ačkoli semiempirické metody také vycházejí z řešení elektronové Schrödingerovy rovnice, jejich rovnice obsahují dodatečné
6 PŘEDNÁŠKA 6: Stav kvantového systému, úplná množina pozorovatelných. Operátor momentu hybnosti a kvadrátu momentu hybnosti.
 6 PŘEDNÁŠKA 6: Stav kvantového systému, úplná množina pozorovatelných Operátor momentu hybnosti a kvadrátu momentu hybnosti Víme už tedy téměř vše o operátorech Jsou to vlastně měřící přístroje v kvantové
6 PŘEDNÁŠKA 6: Stav kvantového systému, úplná množina pozorovatelných Operátor momentu hybnosti a kvadrátu momentu hybnosti Víme už tedy téměř vše o operátorech Jsou to vlastně měřící přístroje v kvantové
John Dalton Amadeo Avogadro
 Spojením atomů vznikají molekuly... John Dalton 1766 1844 Amadeo Avogadro 1776 1856 Výpočet molekuly 2, metoda valenční vazby Walter eitler 1904 1981 Fritz W. London 1900 1954 Teorie molekulových orbitalů
Spojením atomů vznikají molekuly... John Dalton 1766 1844 Amadeo Avogadro 1776 1856 Výpočet molekuly 2, metoda valenční vazby Walter eitler 1904 1981 Fritz W. London 1900 1954 Teorie molekulových orbitalů
Elektronový obal atomu
 Elektronový obal atomu Chemické vlastnosti atomů (a molekul) jsou určeny vlastnostmi elektronového obalu. Chceme znát energii a prostorové rozložení elektronů Znalosti o elektronovém obalu byly získány
Elektronový obal atomu Chemické vlastnosti atomů (a molekul) jsou určeny vlastnostmi elektronového obalu. Chceme znát energii a prostorové rozložení elektronů Znalosti o elektronovém obalu byly získány
8 Spin, Pauliho vylučovací princip, Periodická tabulka prvků.
 8 Spin, Pauliho vylučovací princip, Periodická tabulka prvků. Spin (podle SKM) Na minulé přednášce jsme viděli že elektron po orbitě atomového jádra rotuje ( L 0 ). Elektron je nabitá částice, po orbitě
8 Spin, Pauliho vylučovací princip, Periodická tabulka prvků. Spin (podle SKM) Na minulé přednášce jsme viděli že elektron po orbitě atomového jádra rotuje ( L 0 ). Elektron je nabitá částice, po orbitě
3. Absorpční spektroskopie
 3. Absorpční spetrosope Lambert-Beerův záon Nechť olmovaný svaze ntenzty (λ) dopadá na homogenní planparalelní vrstvu tloušťy l. (λ) (x) Př průchodu vrstvou (x, x+dx) se ntenzta dx sníží o d = -α(λ) (λ,x)
3. Absorpční spetrosope Lambert-Beerův záon Nechť olmovaný svaze ntenzty (λ) dopadá na homogenní planparalelní vrstvu tloušťy l. (λ) (x) Př průchodu vrstvou (x, x+dx) se ntenzta dx sníží o d = -α(λ) (λ,x)
 !!! #!! # % & ()!+ %& #( ) +,,!,!!./0./01 2 34 % 00 (1!#! #! #23 + )!!,,5,!+ 4)!005!! 6 )! %,76!,8, )! 44 %!! #! #236!!1 1 5 6 5+!!1 ( 9 9!5 6 + /+ # % 7 8 % : 4; 2,/! = %
!!! #!! # % & ()!+ %& #( ) +,,!,!!./0./01 2 34 % 00 (1!#! #! #23 + )!!,,5,!+ 4)!005!! 6 )! %,76!,8, )! 44 %!! #! #236!!1 1 5 6 5+!!1 ( 9 9!5 6 + /+ # % 7 8 % : 4; 2,/! = %
Lehký úvod do kvantové teorie II
 1 Lehký úvod do kvantové teorie II 5 Harmonický oscilátor Na příkladu harmonického oscilátoru, jehož klasické řešení známe z Fyziky 1, si ukážeme typické postupy při hledání vlastních hodnot operátoru
1 Lehký úvod do kvantové teorie II 5 Harmonický oscilátor Na příkladu harmonického oscilátoru, jehož klasické řešení známe z Fyziky 1, si ukážeme typické postupy při hledání vlastních hodnot operátoru
Teoretická chemie 1. cvičení
 Teoretická chemie 1. cvičení Teoretická část Základní úlohou kvantové chemie je nalézt elektronovou vlnovou funkci zkoumané molekuly Ψ a z ní poté odvodit všechny zajímavé vlastnosti této molekuly, např.
Teoretická chemie 1. cvičení Teoretická část Základní úlohou kvantové chemie je nalézt elektronovou vlnovou funkci zkoumané molekuly Ψ a z ní poté odvodit všechny zajímavé vlastnosti této molekuly, např.
Inovace studia molekulární a buněčné biologie
 Investice do rozvoje vzdělávání Inovace studia molekulární a buněčné biologie Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Investice do rozvoje vzdělávání
Investice do rozvoje vzdělávání Inovace studia molekulární a buněčné biologie Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Investice do rozvoje vzdělávání
Neurčitost a provázanost kvantový svět
 Pavel Cejnar Ústav částcové a jaderné fyzky MFF UK Přednáška 6 Neurčtost a provázanost kvantový svět Fyzka jako dobrodružství poznání MFF UK v Praze, letní semestr 5 Q-svět Nanofyzka Fyzka kondenzované
Pavel Cejnar Ústav částcové a jaderné fyzky MFF UK Přednáška 6 Neurčtost a provázanost kvantový svět Fyzka jako dobrodružství poznání MFF UK v Praze, letní semestr 5 Q-svět Nanofyzka Fyzka kondenzované
Orbitaly, VSEPR 1 / 18
 rbitaly, VSEPR Rezonanční struktury, atomové a molekulové orbitaly, hybridizace, určování tvaru molekuly pomocí teorie VSEPR, úvod do symetrie molekul, dipólový moment 1 / 18 Formální náboj Rozdíl mezi
rbitaly, VSEPR Rezonanční struktury, atomové a molekulové orbitaly, hybridizace, určování tvaru molekuly pomocí teorie VSEPR, úvod do symetrie molekul, dipólový moment 1 / 18 Formální náboj Rozdíl mezi
Látkové množství. 6,022 10 23 atomů C. Přípravný kurz Chemie 07. n = N. Doporučená literatura. Látkové množství n. Avogadrova konstanta N A
 Doporučená literatura Přípravný kurz Chemie 2006/07 07 RNDr. Josef Tomandl, Ph.D. Mailto: tomandl@med.muni.cz Předmět: Přípravný kurz chemie J. Vacík a kol.: Přehled středoškolské chemie. SPN, Praha 1990,
Doporučená literatura Přípravný kurz Chemie 2006/07 07 RNDr. Josef Tomandl, Ph.D. Mailto: tomandl@med.muni.cz Předmět: Přípravný kurz chemie J. Vacík a kol.: Přehled středoškolské chemie. SPN, Praha 1990,
Mezimolekulové interakce
 Mezimolekulové interakce, od teorie po interakce biomolekul s grafenem Pavel Banáš Mezimolekulové interakce slabé mezimolekulové interakce fyzikální původ mezimolekulárních interakcí poruchová teorie mezimolekulárních
Mezimolekulové interakce, od teorie po interakce biomolekul s grafenem Pavel Banáš Mezimolekulové interakce slabé mezimolekulové interakce fyzikální původ mezimolekulárních interakcí poruchová teorie mezimolekulárních
Orbitaly, VSEPR. Zdeněk Moravec, 16. listopadu / 21
 rbitaly, VSEPR Rezonanční struktury, atomové a molekulové orbitaly, hybridizace, určování tvaru molekuly pomocí teorie VSEPR, úvod do symetrie molekul, dipólový moment Zdeněk Moravec, http://z-moravec.net
rbitaly, VSEPR Rezonanční struktury, atomové a molekulové orbitaly, hybridizace, určování tvaru molekuly pomocí teorie VSEPR, úvod do symetrie molekul, dipólový moment Zdeněk Moravec, http://z-moravec.net
Víceatomové molekuly s jedním centrálním atomem
 Molekuly 2 Víceatomové molekuly s jedním centrálním atomem l u tříatomových molekul se uplatňuje směr vazby l dvě atomové spojnice (vazby) svírají vazebný úhel O H H Hybridizace l MO-LCAO se v empirických
Molekuly 2 Víceatomové molekuly s jedním centrálním atomem l u tříatomových molekul se uplatňuje směr vazby l dvě atomové spojnice (vazby) svírají vazebný úhel O H H Hybridizace l MO-LCAO se v empirických
Tepelná kapacita = T. Ē = 1 2 hν + hν. 1 = 1 e x. ln dx. Einsteinův výpočet (1907): Soustava N nezávislých oscilátorů se stejnou vlastní frekvencí má
 Tepelná kapacta C x = C V = ( ) dq ( ) du Dulong-Pettovo pravdlo: U = 3kT N C V = 3kN x V = T ( ) ds x Tepelná kapacta mřížky Osclátor s kvantovanou energí E n = ( n + 2) hν má střední hodnotu energe (po
Tepelná kapacta C x = C V = ( ) dq ( ) du Dulong-Pettovo pravdlo: U = 3kT N C V = 3kN x V = T ( ) ds x Tepelná kapacta mřížky Osclátor s kvantovanou energí E n = ( n + 2) hν má střední hodnotu energe (po
ρ = 0 (nepřítomnost volných nábojů)
 Učební text k přednášce UFY Světlo v izotropním látkovém prostředí Maxwellovy rovnice v izotropním látkovém prostředí: B rot + D rot H ( r, t) div D ρ rt, ( ) div B a materiálové vztahy D ε pro dielektrika
Učební text k přednášce UFY Světlo v izotropním látkovém prostředí Maxwellovy rovnice v izotropním látkovém prostředí: B rot + D rot H ( r, t) div D ρ rt, ( ) div B a materiálové vztahy D ε pro dielektrika
Optické spektroskopie 1 LS 2014/15
 Optické spektroskopie 1 LS 2014/15 Martin Kubala 585634179 mkubala@prfnw.upol.cz 1.Úvod Velikosti objektů v přírodě Dítě ~ 1 m (10 0 m) Prst ~ 2 cm (10-2 m) Vlas ~ 0.1 mm (10-4 m) Buňka ~ 20 m (10-5 m)
Optické spektroskopie 1 LS 2014/15 Martin Kubala 585634179 mkubala@prfnw.upol.cz 1.Úvod Velikosti objektů v přírodě Dítě ~ 1 m (10 0 m) Prst ~ 2 cm (10-2 m) Vlas ~ 0.1 mm (10-4 m) Buňka ~ 20 m (10-5 m)
Detekce nabitých částic Jak se ztrácí energie průchodem částice hmotou?
 Detekce nabitých částic Jak se ztrácí energie průchodem částice hmotou? 10/20/2004 1 Bethe Blochova formule (1) je maximální možná předaná energie elektronu N r e - vogadrovo čislo - klasický poloměr elektronu
Detekce nabitých částic Jak se ztrácí energie průchodem částice hmotou? 10/20/2004 1 Bethe Blochova formule (1) je maximální možná předaná energie elektronu N r e - vogadrovo čislo - klasický poloměr elektronu
jádro a elektronový obal jádro nukleony obal elektrony, pro chemii významné valenční elektrony
 atom jádro a elektronový obal jádro nukleony obal elektrony, pro chemii významné valenční elektrony molekula Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti seskupení alespoň dvou atomů
atom jádro a elektronový obal jádro nukleony obal elektrony, pro chemii významné valenční elektrony molekula Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti seskupení alespoň dvou atomů
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/
 Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Předmět: LRR/CHPB1/Chemie pro biology 1 Elektronový obal Mgr. Karel Doležal Dr. Cíl přednášky: seznámit posluchače se stavbou
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Předmět: LRR/CHPB1/Chemie pro biology 1 Elektronový obal Mgr. Karel Doležal Dr. Cíl přednášky: seznámit posluchače se stavbou
Fyzika IV. 1) orbitální magnetický moment (... moment proudové smyčky) gyromagnetický poměr: kvantování: Bohrův magneton: 2) spinový magnetický moment
 λ=21 cm 1) orbitální magnetický moment (... moment proudové smyčky) μ I S gyromagnetický poměr: kvantování: Bohrův magneton: 2) spinový magnetický moment 2 Zeemanův jev - rozštěpení spektrálních čar v
λ=21 cm 1) orbitální magnetický moment (... moment proudové smyčky) μ I S gyromagnetický poměr: kvantování: Bohrův magneton: 2) spinový magnetický moment 2 Zeemanův jev - rozštěpení spektrálních čar v
Kapitoly z fyzikální chemie KFC/KFCH. VII. Spektroskopie a fotochemie
 Kapitoly z fyzikální chemie KFC/KFCH VII. Spektroskopie a fotochemie Karel Berka Univerzita Palackého v Olomouci Katedra Fyzikální chemie karel.berka@upol.cz Spektroskopie Analýza světla Excitované Absorbované
Kapitoly z fyzikální chemie KFC/KFCH VII. Spektroskopie a fotochemie Karel Berka Univerzita Palackého v Olomouci Katedra Fyzikální chemie karel.berka@upol.cz Spektroskopie Analýza světla Excitované Absorbované
Atomové jádro, elektronový obal
 Atomové jádro, elektronový obal 1 / 9 Atomové jádro Atomové jádro je tvořeno protony a neutrony Prvek je látka skládající se z atomů se stejným počtem protonů Nuklid je systém tvořený prvky se stejným
Atomové jádro, elektronový obal 1 / 9 Atomové jádro Atomové jádro je tvořeno protony a neutrony Prvek je látka skládající se z atomů se stejným počtem protonů Nuklid je systém tvořený prvky se stejným
Diskutujte, jak široký bude pás spojený s fosforescencí versus fluorescencí. Udělejte odhad v cm -1.
 S použitím modelu volného elektronu (=částice v krabici) spočtěte vlnovou délku a vlnočet nejdlouhovlnějšího elektronového přechodu u molekuly dekapentaenu a oktatetraenu. Diskutujte polohu absorpčního
S použitím modelu volného elektronu (=částice v krabici) spočtěte vlnovou délku a vlnočet nejdlouhovlnějšího elektronového přechodu u molekuly dekapentaenu a oktatetraenu. Diskutujte polohu absorpčního
Přirovnání. Elektrony = obyvatelé panelového domu Kde bydlí paní Kostková? Musíme udat patro a číslo bytu.
 Kvantová čísla Dostupné z Metodického portálu www.rvp.cz, ISSN: 1802-4785, financovaného z ESF a státního rozpočtu ČR. Provozováno Výzkumným ústavem pedagogickým v Praze. Přirovnání Elektrony = obyvatelé
Kvantová čísla Dostupné z Metodického portálu www.rvp.cz, ISSN: 1802-4785, financovaného z ESF a státního rozpočtu ČR. Provozováno Výzkumným ústavem pedagogickým v Praze. Přirovnání Elektrony = obyvatelé
Překryv orbitalů. Vznik vazby překryvem orbitalů na dvou různých atomech A, B Obsazeno dvojicí elektronů Ψ = Ψ A Ψ Β
 Překryv orbitalů Vznik vazby překryvem orbitalů na dvou různých atomech A, B Obsazeno dvojicí elektronů Ψ = Ψ A Ψ Β Podmínky překryvu: Vhodná symetrie, znaménko vlnové funkce Vhodná energie, srovnatelná,
Překryv orbitalů Vznik vazby překryvem orbitalů na dvou různých atomech A, B Obsazeno dvojicí elektronů Ψ = Ψ A Ψ Β Podmínky překryvu: Vhodná symetrie, znaménko vlnové funkce Vhodná energie, srovnatelná,
Molekulová spektroskopie 1. Chemická vazba, UV/VIS
 Molekulová spektroskopie 1 Chemická vazba, UV/VIS 1 Chemická vazba Silová interakce mezi dvěma atomy. Chemické vazby jsou soudržné síly působící mezi jednotlivými atomy nebo ionty v molekulách. Chemická
Molekulová spektroskopie 1 Chemická vazba, UV/VIS 1 Chemická vazba Silová interakce mezi dvěma atomy. Chemické vazby jsou soudržné síly působící mezi jednotlivými atomy nebo ionty v molekulách. Chemická
Elektronový obal atomu
 Elektronový obal atomu Ondřej Havlíček.ročník F-Vt/SŠ Jsoucno je vždy něco, co jsme si sami zkonstruovali ve své mysli. Podstata takovýchto konstrukcí nespočívá v tom, že by byly odvozeny ze smyslových
Elektronový obal atomu Ondřej Havlíček.ročník F-Vt/SŠ Jsoucno je vždy něco, co jsme si sami zkonstruovali ve své mysli. Podstata takovýchto konstrukcí nespočívá v tom, že by byly odvozeny ze smyslových
Druhé kvantování. Slaterův determinant = χ χ
 Druhé kvntování Druhé kvntování žádná nová fyzk! jný formlsmus upltnění prncpu ntsymetre bez použtí Slterových determnntů. Antsymetrcké vlstnost vlnových funkcí jsou přeneseny n lgebrcké vlstnost dných
Druhé kvntování Druhé kvntování žádná nová fyzk! jný formlsmus upltnění prncpu ntsymetre bez použtí Slterových determnntů. Antsymetrcké vlstnost vlnových funkcí jsou přeneseny n lgebrcké vlstnost dných
Prověřování Standardního modelu
 Prověřování Standardního modelu 1) QCD hluboce nepružný rozptyl, elektron (mion) proton, strukturní funkce fotoprodukce γ proton produkce gluonů v e + e produkce jetů, hadronů 2) Elektroslabá torie interference
Prověřování Standardního modelu 1) QCD hluboce nepružný rozptyl, elektron (mion) proton, strukturní funkce fotoprodukce γ proton produkce gluonů v e + e produkce jetů, hadronů 2) Elektroslabá torie interference
Elektromagnetické záření. lineárně polarizované záření. Cirkulárně polarizované záření
 Elektromagnetické záření lineárně polarizované záření Cirkulárně polarizované záření Levotočivé Pravotočivé 1 Foton Jakékoli elektromagnetické vlnění je kvantováno na fotony, charakterizované: Vlnovou
Elektromagnetické záření lineárně polarizované záření Cirkulárně polarizované záření Levotočivé Pravotočivé 1 Foton Jakékoli elektromagnetické vlnění je kvantováno na fotony, charakterizované: Vlnovou
Teorie krystalového pole (ligandového)
 Teorie krystalového pole (ligandového) Literatura Title page Svatopluk Krupička: Fyzika feritů a příbuzných magnetických kysličníků Antonín A. Vlček: Struktura vlastnosti koordinačních sloučenin C.E. Housecroft,
Teorie krystalového pole (ligandového) Literatura Title page Svatopluk Krupička: Fyzika feritů a příbuzných magnetických kysličníků Antonín A. Vlček: Struktura vlastnosti koordinačních sloučenin C.E. Housecroft,
Teorie her pro FJFI ČVUT řešené úlohy
 Tyto úlohy volně doplňují přednášky z kursu teorie her. Rozsah látky a použité značení odpovídá slajdům dostupným na stránce věnované výuce. Γ S S Γ 3 o = o = o 3 = vítězná o o Γ u u(o ) = u(o ) = u(o
Tyto úlohy volně doplňují přednášky z kursu teorie her. Rozsah látky a použité značení odpovídá slajdům dostupným na stránce věnované výuce. Γ S S Γ 3 o = o = o 3 = vítězná o o Γ u u(o ) = u(o ) = u(o
Úvod do magnetizmu pevných látek
 Úvod do magnetzmu pevných látek. Úvod. Izolované magnetcké momenty 3. Prostředí 4. Interakce 5. agnetcké struktury 6. Doménová struktura a magnetzace .agnetzmus pevných látek -úvod. Zdroje magnetsmu -
Úvod do magnetzmu pevných látek. Úvod. Izolované magnetcké momenty 3. Prostředí 4. Interakce 5. agnetcké struktury 6. Doménová struktura a magnetzace .agnetzmus pevných látek -úvod. Zdroje magnetsmu -
VÍTEJTE V MIKROSVĚTĚ
 VÍTEJTE V MIKROSVĚTĚ Klasická vs. Moderní fyzika Klasická fyzika fyzika obyčejných věcí viditelných pouhým okem Moderní fyzika Relativita zabývá se tím co se pohybuje rychle nebo v silovém gravitačním
VÍTEJTE V MIKROSVĚTĚ Klasická vs. Moderní fyzika Klasická fyzika fyzika obyčejných věcí viditelných pouhým okem Moderní fyzika Relativita zabývá se tím co se pohybuje rychle nebo v silovém gravitačním
Poznámky k přednášce o grupách
 Mchal Lenc Poznámky ke grupám 465 Poznámky k přednášce o grupách Defnce a příklady grup Příklad : Cyklcká grupa o čtyřech prvcích Příklad : Grupy matc Příklad : Grupa O(n) 4 Příklad 4: Grupa U(n) 4 5 Příklad
Mchal Lenc Poznámky ke grupám 465 Poznámky k přednášce o grupách Defnce a příklady grup Příklad : Cyklcká grupa o čtyřech prvcích Příklad : Grupy matc Příklad : Grupa O(n) 4 Příklad 4: Grupa U(n) 4 5 Příklad
9 PŘEDNÁŠKA 9: Heisenbergovy relace neurčitosti, důsledky. Tunelový jev. Shrnutí probrané látky, příprava na zkoušku.
 9 PŘEDNÁŠKA 9: Hesenbergovy relace neurčtost, důsledky. Tunelový jev. Shrnutí probrané látky, příprava na zkoušku. Hesenbergovy relace neurčtost(tnqu.5., SKM) Jednoduchý pohled na věc: Vždy exstuje určtá
9 PŘEDNÁŠKA 9: Hesenbergovy relace neurčtost, důsledky. Tunelový jev. Shrnutí probrané látky, příprava na zkoušku. Hesenbergovy relace neurčtost(tnqu.5., SKM) Jednoduchý pohled na věc: Vždy exstuje určtá
( R) Proč, když máme QM? Born-Oppenheimerova aproximace. Molekulová mechanika. empirické potenciály silová pole
 Molekulová mechanka emprcké potencály slová pole Mchal Otyepka, PřF UP Olomouc Proč, když máme QM? běžná malá molekula kvantový chemk jásá středně velká molekula kvantovému chemkov tuhnou rysy a volí umírněné
Molekulová mechanka emprcké potencály slová pole Mchal Otyepka, PřF UP Olomouc Proč, když máme QM? běžná malá molekula kvantový chemk jásá středně velká molekula kvantovému chemkov tuhnou rysy a volí umírněné
Skupenské stavy. Kapalina Částečně neuspořádané Volný pohyb částic nebo skupin částic Částice blíže u sebe
 Skupenské stavy Plyn Zcela neuspořádané Hodně volného prostoru Zcela volný pohyb částic Částice daleko od sebe Kapalina Částečně neuspořádané Volný pohyb částic nebo skupin částic Částice blíže u sebe
Skupenské stavy Plyn Zcela neuspořádané Hodně volného prostoru Zcela volný pohyb částic Částice daleko od sebe Kapalina Částečně neuspořádané Volný pohyb částic nebo skupin částic Částice blíže u sebe
Fyzika pro chemiky II
 Fyzika pro chemiky II P. Klang, J. Novák, R. Štoudek, Ústav fyziky kondenzovaných látek, PřF MU Brno 18. února 2004 1 Optika 1. Rovinná elektromagnetická vlna o frekvenci f = 5.45 10 14 Hz polarizovaná
Fyzika pro chemiky II P. Klang, J. Novák, R. Štoudek, Ústav fyziky kondenzovaných látek, PřF MU Brno 18. února 2004 1 Optika 1. Rovinná elektromagnetická vlna o frekvenci f = 5.45 10 14 Hz polarizovaná
SPEKTRÁLNÍ METODY. Ing. David MILDE, Ph.D. Katedra analytické chemie Tel.: ; (c) David MILDE,
 SEKTRÁLNÍ METODY Ing. David MILDE, h.d. Katedra analytické chemie Tel.: 585634443; E-mail: david.milde@upol.cz (c) -2008 oužitá a doporučená literatura Němcová I., Čermáková L., Rychlovský.: Spektrometrické
SEKTRÁLNÍ METODY Ing. David MILDE, h.d. Katedra analytické chemie Tel.: 585634443; E-mail: david.milde@upol.cz (c) -2008 oužitá a doporučená literatura Němcová I., Čermáková L., Rychlovský.: Spektrometrické
Úvod do kvantového počítání
 2. přednáška Katedra počítačů, Fakulta elektrotechnická České vysoké učení technické v Praze 17. března 2005 Opakování Část I Přehled z minulé hodiny Opakování Alternativní výpočetní modely Kvantové počítače
2. přednáška Katedra počítačů, Fakulta elektrotechnická České vysoké učení technické v Praze 17. března 2005 Opakování Část I Přehled z minulé hodiny Opakování Alternativní výpočetní modely Kvantové počítače
Elementární částice. 1. Leptony 2. Baryony 3. Bosony. 4. Kvarkový model 5. Slabé interakce 6. Partonový model
 Elementární částice 1. Leptony 2. Baryony 3. Bosony 4. Kvarkový model 5. Slabé interakce 6. Partonový model I.S. Hughes: Elementary Particles M. Leon: Particle Physics W.S.C. Williams Nuclear and Particle
Elementární částice 1. Leptony 2. Baryony 3. Bosony 4. Kvarkový model 5. Slabé interakce 6. Partonový model I.S. Hughes: Elementary Particles M. Leon: Particle Physics W.S.C. Williams Nuclear and Particle
S. Civiš. Introduction to infrared and IR spectroscopy How an FTIR bench works Why we use a synchrotron Some examples
 S. Cvš Introducton to nfrared and IR spectroscopy How an FTIR bench works Why we use a synchrotron Some examples 1 Wllam Herschel Around 18, Herschel studed the spectrum of sunlght usng a prsm. He measured
S. Cvš Introducton to nfrared and IR spectroscopy How an FTIR bench works Why we use a synchrotron Some examples 1 Wllam Herschel Around 18, Herschel studed the spectrum of sunlght usng a prsm. He measured
Fyzika IV. Pojem prvku. alchymie. Paracelsus (16.st) Elektronová struktura atomů
 Elektronová struktura atomů Pojem prvku alchymie Paracelsus (16.st) Elektronová struktura atomů alchymie 17.-18.století - při hoření látky ztrácí těkavou součást - flogiston. látka = flogiston + popel
Elektronová struktura atomů Pojem prvku alchymie Paracelsus (16.st) Elektronová struktura atomů alchymie 17.-18.století - při hoření látky ztrácí těkavou součást - flogiston. látka = flogiston + popel
WORKSHEET 1: LINEAR EQUATION 1
 WORKSHEET 1: LINEAR EQUATION 1 1. Write down the arithmetical problem according the dictation: 2. Translate the English words, you can use a dictionary: equations to solve solve inverse operation variable
WORKSHEET 1: LINEAR EQUATION 1 1. Write down the arithmetical problem according the dictation: 2. Translate the English words, you can use a dictionary: equations to solve solve inverse operation variable
Molekuly. Všeobecně známý fakt: atomy se slučujou do molekul, pokud to zrovna nejsou atomy inertních plynů v posledním sloupci periodické tabulky
 Molekuly Všeobecně známý fakt: atomy se slučujou do molekul, pokud to zrovna nejsou atomy inertních plynů v posledním sloupci periodické tabulky Nejjednodušší případ: molekulární iont H +, tj. dva protony
Molekuly Všeobecně známý fakt: atomy se slučujou do molekul, pokud to zrovna nejsou atomy inertních plynů v posledním sloupci periodické tabulky Nejjednodušší případ: molekulární iont H +, tj. dva protony
GUIDELINES FOR CONNECTION TO FTP SERVER TO TRANSFER PRINTING DATA
 GUIDELINES FOR CONNECTION TO FTP SERVER TO TRANSFER PRINTING DATA What is an FTP client and how to use it? FTP (File transport protocol) - A protocol used to transfer your printing data files to the MAFRAPRINT
GUIDELINES FOR CONNECTION TO FTP SERVER TO TRANSFER PRINTING DATA What is an FTP client and how to use it? FTP (File transport protocol) - A protocol used to transfer your printing data files to the MAFRAPRINT
