16 Semiempirické přístupy
|
|
|
- Žaneta Horáčková
- před 7 lety
- Počet zobrazení:
Transkript
1 16 Semiempirické přístupy V této kapitole se podíváme na skupinu semiempirických metod. Ačkoli semiempirické metody také vycházejí z řešení elektronové Schrödingerovy rovnice, jejich rovnice obsahují dodatečné parametry, jejichž hodnoty se typicky získávají z přesnějších ab initio výpočtů nebo se z experimentálních dat. Semiempirické metody jsou přibližné na dvou úrovních. V první řadě, většina semiempirických metod nevychází z přesného molekulárního hamiltoniánu, ale určitého efektivního hamiltoniánu, ve kterém jsou zanedbány některé členy. Většina semiempirických metod se například soustředí pouze na valenční elektrony (příspěvek ostatních elektronů je brán jako konstanta), což celkový hamiltonián systému značně zjednoduší. Po určení hamiltoniánu se při odvození typické semiempirické metody postupuje obdobně jako při odvození HF rovnic. Zvolíme si konkrétní tvar vlnové funkce a zvolíme bázi (metoda MO-LCAO) a aplikací variačního principu odvodíme pracovní rovnice. V tomto kroku ale u semiempirických metod dojde k výše zmíněnému dalšímu zjednodušení. Některé členy z rovnic můžeme úplně zanedbat a položit rovno nule, anebo je můžeme považovat za parametry, se kterými dosáhneme nejlepšího souladu s experimenty pro určitý vybraný soubor molekul. Experimentálním údajem, vůči kterému se srovnáváme, mohou být termodynamické parametry daných látek. Při použití semiempirických metod je proto třeba být velmi obezřetný. Mohou fungovat skvěle pro látky, na které byla metoda parametrizována a látky jím podobné, ale pro odlišné struktury mohou hanebně selhávat. Motivací k vývoji semiempirických metod bylo zmenšení výpočetních nároků ab initio metod s pokud možno co nejmenším ovlivněním přesnosti. Dnes již mají vrchol své popularity za sebou. Nicméně i metody, které byly kvantitativně nepřesné, se ukázaly jako velmi užitečné, neboť dovolily kvalitativní pochopení zákonitostí chemických vazeb a jiných vlastností molekul. Na jednu takovou metodu, která nám dala známé Hückelovo pravidlo 4n +2 pro určení aromaticity, se nyní podíváme Hückelova metoda Hückelova metoda (dále jen HM) je historicky první a asi i nejjednodušší semiempirická metoda. Pro menší molekuly je pro použití této metody potřeba doslova jen tužka a papír. soustředíme se pouze na určitou skupinu elektronů, energeticky dobře oddělenou od ostatních elektronů. Typickým příkladem jsou π vazebné elektrony v konjugovaných uhlovodících, tedy elektrony v molekulových orbitalech složených z atomových p orbitalů. Hamiltonián HM metody má tvar H HMO = h π i,eff, (16.1) kde h π i,eff je jednoelektronový potenciál π elektronu, který v sobě obsahuje jak kinetickou energii, tak interakce s ostatními elektrony. Z tvaru hamiltoniánu coby součtu jednoelektronových členů je zřejmé, že elektrony jsou zde považovány za nezávislé (to je zásadní rozdíl oproti metodě HF, ve které je nezávislost elektronů vyjádřena pouze tvarem vlnové funkce). Konkrétní tvar těchto efektivních elektronových hamiltoniánů není specifikován, neboť, jak uvidíme dále, vlastně ani není potřeba. Dalším krokem je výběr báze. V případě metody HM to budou p z orbitaly všech uhlíkových atomů φ = c i χ i. (16.2) i 129
2 Matematický tvar těchto orbitalů nás ale opět nezajímá. Tím převedeme problém nalezeni vlnové funkce na jednodušší problém najití koeficientů c i. Pokud tuto vlnovou funkci dosadíme do Schrödingerovy s hamiltoniánem (16.1) a aplikujeme variační princip, dostaneme soustavu sekulárních rovnic. Z podmínky pro netriviální řešení této soustavy pak platí H ɛs =0. (16.3) Pro lepší ilustraci budeme nadále uvažovat výpočet pro molekulu butadienu. Elektronová báze se zde skládá ze čtyř p z orbitalů. Sekulární determinant zde má tvar H 11 ɛs 11 H 21 ɛs 21 H 31 ɛs 31 H 41 ɛs 41 H 12 ɛs 12 H 22 ɛs 22 H 32 ɛs 32 H 42 ɛs 42 H 11 ɛs 13 H 23 ɛs 23 H 33 ɛs 33 H 43 ɛs 43 =0. (16.4) H 11 ɛs 14 H 24 ɛs 24 H 34 ɛs 34 H 44 ɛs 44 Nyní bychom měli spočítat integrály H ij a S ij, které v principu závisí na geometrii systému. V rámci Hückelovy aproximace na ně ale pohlížíme jako na parametry metody a naložíme s nimi takto: zanedbáme překryvové integrály mezi AO na různých atomech tj. S ij = δ ij ; integrály H ii položíme rovny parametru α, těmto integrálům říkáme coulombovské integrály; integrály H ij položíme rovno nule, pokud orbitaly nepatří sousedním atomům. Nenulové integrály položíme rovno parametru β. Nazýváme je rezonančními integrály. Takto zjednodušené rovnice poté vyřešíme. Nejprve najdeme vlastní čísla přes sekulární determinant a následně určíme koeficienty c i. V případě butadienu bude Hückelův sekulární determinant vypadat následovně α ɛ β 0 0 β α ɛ β 0 0 β α ɛ β =0. (16.5) 0 0 β α ɛ Ve druhém kroku jsme determinant vydělili β a zavedli substituci x = α β. Nyní rozvojem ɛ determinantu podle prvního řádku dostaneme x 1 0 x 1 x x x x x = x4 3x 2 +1=0 Tuto kvartickou rovnici můžeme naštěstí převést na kvadratickou pomocí substituce y = x 2 a tedy Z toho vyplývají následující hodnoty energií y 2 3y +1=0; y 1 =2, 62; y 2 =0.382 x 1,2 =1, 62x 3,4 =0, 62 ɛ 1 = α +1, 62β ɛ 2 = α +0, 62β 130
3 Obrázek 33: Energetické hladiny butadienu dle Hückelovy metody a znázornění excitovaného stavu. ɛ 3 = α 0, 62β ɛ 4 = α 1, 62β Zpětným dosazením do sekulárních rovnic bychom poté dopočítali koeficienty c i a tím získali molekulové orbitaly. Ty potom obsadíme elektrony v souladu s Pauliho vylučovacím principem a celkovou energii dostaneme jako součet orbitálních energií. Jak nyní získáme parametry α a β? Vyjdeme z experimentálních dat. Parametr α má jednoduchou fyzikální interpretaci; jedná se o ionizační energii atomového orbitalu p z, která je experimentálně známá. Důležitější je parametr β, který určuje vzájemnou separaci molekulových orbitalů. Můžeme jej získat v zásadě dvěma způsoby: 1. Ze spektroskopických dat. Parametr zvolíme tak, aby nám seděly zvolené elektronové přechody (podrobnosti viz níže). Například fitováním na molekulu naftalenu získáme hodnotu β = 3, 48eV. 2. Z termochemických dat. K tomu se využívá konceptu delokalizační energie dvojných vazeb. Tuto energii můžeme experimentálně naměřit například pomocí hydrogenačního tepla. Její teoretický výpočet v rámci HM si ukážeme níže. Pojďme se nyní podívat na výpočet některých vlastností butadienu pomocí HM Excitační energie Jak můžeme pomocí HM spočítat excitační energii? Formálně excitujeme jeden elektron z obsazeného do neobsazeného orbitalu (viz obrázek 33) a potom spočítáme celkovou energii a od ní odečteme celkovou energii základního stavu. Pokud chceme spočítat nejnižší excitační energii butadienu, přesuneme jeden elektron z orbitalu 3 do orbitalu 2. Výsledná energie potom bude ΔE = ɛ 3 ɛ 4 =1, 24β = hc ν Vlnová délka excitujícího záření vyjde 287 nm, zatímco experimentální hodnota je kolem 200 nm. Soulad to není ideální, ale není ani tragický, na to že jsme jej získali tak jednoduše. HM také správně zachycuje experimentální fakt, že excitační energie se snižuje se zvyšující se délkou řetězce obsahující konjugované dvojné vazby Delokalizační energie Z organické chemie si ještě možná vzpomeneme, že konjugované dvojné vazby mají jiné vlastnosti než vazby izolované. Tuto delokalizaci můžeme vyjádřit pomocí poněkud nefyzikální veličiny delokalizační energie. 131
4 Pokud by se dvojné vazby vzájemně neovlivňovaly, tak by mělo platit, že HM energie nkrátkonjugovaného systému by se rovnala n-násobku energie ethenu, který má dvojnou vazbu jen jednu. Tato rovnost ale neplatí a rozdíl je právě delokalizační energie. Pojďme si vše ukázat na příkladě butadienu, jehož energii již známe. Musíme tedy dopočítat energii molekuly ethenu. Pro ten vychází následující sekulární determinant. α ɛ β β α ɛ =0 (16.6) z čehož (α ɛ) 2 = β 2 α ɛ = ±βɛ 1,2 = α ± β Pro butadien poté vychází delokalizační energie E D =0, 472β =35, 4kJ/mol. Experimentálně můžeme míru delokalizace určit pomocí hydrogenačních tepel butadienu a ethenu. Hydrogenační teplo ethenu (tj. entalpie reakce ethen + H 2 = ethan) je -136,94 kj/mol, zatímco hydrogenační teplo butadienu je -240 kj/mol. Experimentální delokalizační energie je tedy: E exp D =2 139, = 33, 8 kj/mol, což je v dobrém souladu s námi vypočtenou hodnotou Cyklické systémy a aromaticita Asi největším úspěchem HM bylo vysvětlení aromaticity cyklických molekul. Na obrázku 34 jsou znázorněny energetické hladiny cyklických systémů typu C n H n. Parametr α představuje energii elektronu v samostatném atomu uhlíku. jestliže elektron má energii nižší než α, interakce s okolními atomu vede k poklesu energie. Jinými slovy, dochází ke vzniku chemické vazby. energie větší než α indikuje destabilizaci. Pohled na diagram přitom pěkně ukazuje, odkud se vzalo známé Hückelovo pravidlo 4n +2. Je totiž hned patrné, že molekuly s 4n+2 elektrony jsou stabilní, molekuly s 4n+1 elektrony představují radikály, molekuly s 4n elektrony představují biradikály. Příklad 20 Zadání: Jak to bude s aromaticitou cyklopropenylového radikálu? A co cyklopentadienylový radikál? Řešení: V cyklopropenylu máme tři elektrony v p z orbitalech, stabilnější tedy bude cyklopropenylový kation. V cyklopentadienylu máme elektronů pět, stabilnější tedy bude cyklopendienylový anion, který se opravdu často vyskytuje jako ligand v komplexech kovů. 132
5 Obrázek 34: Energetické hladiny cyklických uhlovodíků obecného vzorce C n H n dle Hückelovy metody. Degenerované hladiny jsou pro přehlednost znázorněné jako dvě hladiny těsně nad sebou Rozšířená Hückelova metoda Hlavním vylepšením rozšířené Hückelovy metody (RHM) je zavrhnutí π-elektronové aproximace. Stále používáme jednoelektronový Hamiltonián a molekulové orbitaly rozvíjíme podobně jako v rovnici (16.2), ale zahrnujeme všechny valenční orbitaly. Atom uhlíku tedy do báze přispěje atomovými orbitaly 2s, 2p x,2p y a2p z. Zde jsou další pravidla pro RHM: Hodnotu coulombických integrálů opět aproximujeme ionizační energií daného orbitalu. H ii = I i Hodnoty překryvových integrálů se nezanedbávají, ale počítají se explicitně. Hodnoty rezonančních integrálů se získají dle vztahu: H ij = 1 2 K(I i + I j )S ij, (16.7) kde K je empirická konstanta, která má obvykle hodnotu 1,75. Opět řešíme sekulární rovnice (16.3), ale tentokrát již matice H neobsahuje žádné nuly (pokud náhodou není S ij =0ze symetrických důvodů). Jelikož počítáme explicitně překryvové integrály, tak řešení závisí na konkrétní geometrii molekuly. Tato metoda se tedy dá použít k minimalizaci geometrie, ale výsledky často nejsou příliš kvalitní (například molekula vody vychází jako lineární). Podobně jako v původní Hückelově metodě tvar sekulárních rovnic nezávisí na řešení, a tudíž není třeba iterovat. Rozšířená Hückelova metoda se proto i nyní rutinně využívá v kvantově chemických programech k prvotnímu nástřelu vlnové funkce. 133
6 16.3 Moderní semiempirické metody Modernější semiempirické metody již ve svém hamiltoniánu nezanedbávají mezielektronovou repulzi. Hamiltonián je potom téměř totožný s HF hamiltoniánem, akorát se soustředíme stále jen na valenční elektrony. Tyto metody poté iterativně řeší Roothanovy rovnice. Výpočetně nejnákladnější částí jsou stejně jako v Hartreeho-Fockově metodě dvouelektronové integrály, χ i χ j 1 r 12 χ kχ l dr 1 dr 2 (16.8) a proto se právě pro ně zavádí další aproximace. Velká část metod vychází z aproximace φ i (r)φ j (r)dr =0 i j, (16.9) které se říká zanedbání diferenciálního překryvu. Jednotlivé semiempirické metody se liší mimo jiné tím, na které orbitaly tuto aproximaci uplatňují. Pojďme si některé přiblížit: Asi nejjednodušší metodou z této třídy je metoda CNDO (z angl. Complete Neglect of Differential Overlap), která zavádí ZDO aproximaci důsledně pro všechny dvojice atomových orbitalů. Méně drastickou aproximaci představuje metoda INDO (z angl. Intermediate Neglect of Differential Overlap), která výše uvedený vztah neaplikuje na dvouelektronové integrály, ve kterých jsou všechny čtyři orbitaly na stejném atomu. Tato metoda byla Zernerem modifikována pro spektroskopické účely (metoda ZINDO). Metody CNDO a INDO byly vyvinuty ve skupině Johna Popla a byly parametrizovány tak, aby výsledky odpovídaly ab initio HF výpočtům pro minimální bázi. Jiný přistup zvolil M. Dewar, který semiempirické metody začal parametrizovat tak, aby odpovídaly experimentálním hodnotám, a tím dosáhl přesnosti často větší než samotná Hartreeho-Fockova metoda. Metody AM1 (y angl. Austin Model 1), PM3 (z angl. Parametric Model 3) a jejich novější verze PM6 a PM7 jsou využívány a rozvíjeny dodnes (jejich implementace je k nalezení například ve volně dostupném programu MOPAC). Kromě výše zmíněných metod existuje také hojně využívaná semiempirická metoda založená na DFT, takzvaná DFTB (DFT Tight Binding), a řada dalších metod, občas využívaných ke speciálním případům. 134
METODY VÝPOČETNÍ CHEMIE
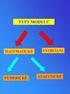
 METODY VÝPOČETNÍ CHEMIE Metody výpočetní chemie Ab initio metody Semiempirické metody Molekulová mechanika Molekulová simulace Ab initio metody Ab initio - od počátku Metody kvantově-mechanické vycházejí
METODY VÝPOČETNÍ CHEMIE Metody výpočetní chemie Ab initio metody Semiempirické metody Molekulová mechanika Molekulová simulace Ab initio metody Ab initio - od počátku Metody kvantově-mechanické vycházejí
Operátory a maticové elementy
 Operátory a matice Operátory a maticové elementy operátory je výhodné reprezentovat maticemi maticové elementy operátorů jsou dány vztahy mezi Slaterovými determinanty obsahujícími ortonormální orbitaly
Operátory a matice Operátory a maticové elementy operátory je výhodné reprezentovat maticemi maticové elementy operátorů jsou dány vztahy mezi Slaterovými determinanty obsahujícími ortonormální orbitaly
Od kvantové mechaniky k chemii
 Od kvantové mechaniky k chemii Jan Řezáč UOCHB AV ČR 19. září 2017 Jan Řezáč (UOCHB AV ČR) Od kvantové mechaniky k chemii 19. září 2017 1 / 33 Úvod Vztah mezi molekulovou strukturou a makroskopickými vlastnostmi
Od kvantové mechaniky k chemii Jan Řezáč UOCHB AV ČR 19. září 2017 Jan Řezáč (UOCHB AV ČR) Od kvantové mechaniky k chemii 19. září 2017 1 / 33 Úvod Vztah mezi molekulovou strukturou a makroskopickými vlastnostmi
Ab initio výpočty v chemii a biochemii
 Ab initio výpočty v chemii a biochemii Doc. RNDr. Ing. Jaroslav Burda, CSc., jaroslav.burda@mff.cuni.cz Dr. Vladimír Sychrovský vladimir.sychrovsky@uochb.cas.cz Studijní literatura Szabo A., Ostlund N.S.
Ab initio výpočty v chemii a biochemii Doc. RNDr. Ing. Jaroslav Burda, CSc., jaroslav.burda@mff.cuni.cz Dr. Vladimír Sychrovský vladimir.sychrovsky@uochb.cas.cz Studijní literatura Szabo A., Ostlund N.S.
17 Vlastnosti molekul
 17 Vlastnosti molekul Experimentálně molekuly charakterizujeme pomocí nejrůznějších vlastností: můžeme změřit třeba NMR posuny, elektrické či magnetické parametry či třeba jejich optickou otáčivost. Tyto
17 Vlastnosti molekul Experimentálně molekuly charakterizujeme pomocí nejrůznějších vlastností: můžeme změřit třeba NMR posuny, elektrické či magnetické parametry či třeba jejich optickou otáčivost. Tyto
Atomové a molekulové orbitaly Ion molekuly vodíku. Molekula vodíku Heitler-Londonovou metodou. Metoda LCAO. Báze atomových orbitalů.
 Atomové a molekulové orbitaly Ion molekuly vodíku. Molekula vodíku Heitler-Londonovou metodou. Metoda LCAO. Báze atomových orbitalů. Ion molekuly vodíku H + 2 První použití metody je demonstrováno při
Atomové a molekulové orbitaly Ion molekuly vodíku. Molekula vodíku Heitler-Londonovou metodou. Metoda LCAO. Báze atomových orbitalů. Ion molekuly vodíku H + 2 První použití metody je demonstrováno při
Mul$determinantální metody: CASSCF
 Mul$determinantální metody: CASSCF Mul%konfiguračni (mnohadeterninantálni MC SCF) metody použivají narozdíl od metody Hartreeho- Focka pro popis N- elektronového systému větší počet Slaterových determinantů.
Mul$determinantální metody: CASSCF Mul%konfiguračni (mnohadeterninantálni MC SCF) metody použivají narozdíl od metody Hartreeho- Focka pro popis N- elektronového systému větší počet Slaterových determinantů.
Přehled Ab Initio a semiempirických metod
 Přehled Ab Initio a semiempirických metod Pokud se vám bude zdát, že je v tom nějaký blud, tak tam asi je. Budu rád, když mě na něj upozorníte. Ab initio metody - od počátku, z prvotních principů, tzn.
Přehled Ab Initio a semiempirických metod Pokud se vám bude zdát, že je v tom nějaký blud, tak tam asi je. Budu rád, když mě na něj upozorníte. Ab initio metody - od počátku, z prvotních principů, tzn.
Modelové výpočty na H 2 a HeH +
 Modelové výpočty na H 2 a HeH + Minimální báze Všechny teoretické poznatky je užitečné ilustrovat modelovým výpočtem. Budeme aplikovat Hartree-Fockovy výpočty na uzavřených slupkách systémů H 2 a HeH +.
Modelové výpočty na H 2 a HeH + Minimální báze Všechny teoretické poznatky je užitečné ilustrovat modelovým výpočtem. Budeme aplikovat Hartree-Fockovy výpočty na uzavřených slupkách systémů H 2 a HeH +.
Teorie chemické vazby a molekulární geometrie Molekulární geometrie VSEPR
 Geometrie molekul Lewisovy vzorce poskytují informaci o tom které atomy jsou spojeny vazbou a o jakou vazbu se jedná (topologie molekuly). Geometrické uspořádání molekuly je charakterizováno: Délkou vazeb
Geometrie molekul Lewisovy vzorce poskytují informaci o tom které atomy jsou spojeny vazbou a o jakou vazbu se jedná (topologie molekuly). Geometrické uspořádání molekuly je charakterizováno: Délkou vazeb
Atom vodíku. Nejjednodušší soustava: p + e Řešitelná exaktně. Kulová symetrie. Potenciální energie mezi p + e. e =
 Atom vodíku Nejjednodušší soustava: p + e Řešitelná exaktně Kulová symetrie Potenciální energie mezi p + e V 2 e = 4πε r 0 1 Polární souřadnice využití kulové symetrie atomu Ψ(x,y,z) Ψ(r,θ, φ) x =? y=?
Atom vodíku Nejjednodušší soustava: p + e Řešitelná exaktně Kulová symetrie Potenciální energie mezi p + e V 2 e = 4πε r 0 1 Polární souřadnice využití kulové symetrie atomu Ψ(x,y,z) Ψ(r,θ, φ) x =? y=?
Teorie hybridizace. Vysvětluje vznik energeticky rovnocenných kovalentních vazeb a umožňuje předpovědět prostorový tvar molekul.
 Chemická vazba co je chemická vazba charakteristiky chemické vazby jak vzniká vazba znázornění chemické vazby kovalentní a koordinační vazba vazba σ a π jednoduchá, dvojná a trojná vazba polarita vazby
Chemická vazba co je chemická vazba charakteristiky chemické vazby jak vzniká vazba znázornění chemické vazby kovalentní a koordinační vazba vazba σ a π jednoduchá, dvojná a trojná vazba polarita vazby
Molekuly 1 12/4/2011. Molekula definice IUPAC. Molekuly. Proč existují molekuly? Kosselův model. Představy o molekulách
 1/4/011 Molekuly 1 Molekula definice IUPC elektricky neutrální entita sestávající z více nežli jednoho atomu. Přesně, molekula, v níž je počet atomů větší nežli jedna, musí odpovídat snížení na ploše potenciální
1/4/011 Molekuly 1 Molekula definice IUPC elektricky neutrální entita sestávající z více nežli jednoho atomu. Přesně, molekula, v níž je počet atomů větší nežli jedna, musí odpovídat snížení na ploše potenciální
Nekovalentní interakce
 Nekovalentní interakce Jan Řezáč UOCHB AV ČR 3. listopadu 2016 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 3. listopadu 2016 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii
Nekovalentní interakce Jan Řezáč UOCHB AV ČR 3. listopadu 2016 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 3. listopadu 2016 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii
Co je obsahem numerických metod?
 Numerické metody Úvod Úvod Co je obsahem numerických metod? Numerické metody slouží k přibližnému výpočtu věcí, které se přesně vypočítat bud nedají vůbec, nebo by byl výpočet neúměrně pracný. Obsahem
Numerické metody Úvod Úvod Co je obsahem numerických metod? Numerické metody slouží k přibližnému výpočtu věcí, které se přesně vypočítat bud nedají vůbec, nebo by byl výpočet neúměrně pracný. Obsahem
Vzpěr jednoduchého rámu, diferenciální operátory. Lenka Dohnalová
 1 / 40 Vzpěr jednoduchého rámu, diferenciální operátory Lenka Dohnalová ČVUT, fakulta stavební, ZS 2015/2016 katedra stavební mechaniky a katedra matematiky, Odborné vedení: doc. Ing. Jan Zeman, Ph.D.,
1 / 40 Vzpěr jednoduchého rámu, diferenciální operátory Lenka Dohnalová ČVUT, fakulta stavební, ZS 2015/2016 katedra stavební mechaniky a katedra matematiky, Odborné vedení: doc. Ing. Jan Zeman, Ph.D.,
Nekovalentní interakce
 Nekovalentní interakce Jan Řezáč UOCHB AV ČR 31. října 2017 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 31. října 2017 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii 4 Výpočty
Nekovalentní interakce Jan Řezáč UOCHB AV ČR 31. října 2017 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 31. října 2017 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii 4 Výpočty
ANALYTICKÁ GEOMETRIE LINEÁRNÍCH ÚTVARŮ V ROVINĚ
 ANALYTICKÁ GEOMETRIE LINEÁRNÍCH ÚTVARŮ V ROVINĚ Parametrické vyjádření přímky v rovině Máme přímku p v rovině určenou body A, B. Sestrojíme vektor u = B A. Pro bod B tím pádem platí: B = A + u. Je zřejmé,
ANALYTICKÁ GEOMETRIE LINEÁRNÍCH ÚTVARŮ V ROVINĚ Parametrické vyjádření přímky v rovině Máme přímku p v rovině určenou body A, B. Sestrojíme vektor u = B A. Pro bod B tím pádem platí: B = A + u. Je zřejmé,
Hamiltonián popisující atom vodíku ve vnějším magnetickém poli:
 Orbitální a spinový magnetický moment a jejich interakce s vnějším polem Vše na příkladu atomu H: Elektron (e - ) a jádro (u atomu H pouze p + ) mají vlastní magnetický moment (= spin). Tyto dva dipóly
Orbitální a spinový magnetický moment a jejich interakce s vnějším polem Vše na příkladu atomu H: Elektron (e - ) a jádro (u atomu H pouze p + ) mají vlastní magnetický moment (= spin). Tyto dva dipóly
a počtem sloupců druhé matice. Spočítejme součin A.B. Označme matici A.B = M, pro její prvky platí:
 Řešené příklady z lineární algebry - část 1 Typové příklady s řešením Příklady jsou určeny především k zopakování látky před zkouškou, jsou proto řešeny se znalostmi učiva celého semestru. Tento fakt se
Řešené příklady z lineární algebry - část 1 Typové příklady s řešením Příklady jsou určeny především k zopakování látky před zkouškou, jsou proto řešeny se znalostmi učiva celého semestru. Tento fakt se
Věta 12.3 : Věta 12.4 (princip superpozice) : [MA1-18:P12.7] rovnice typu y (n) + p n 1 (x)y (n 1) p 1 (x)y + p 0 (x)y = q(x) (6)
![Věta 12.3 : Věta 12.4 (princip superpozice) : [MA1-18:P12.7] rovnice typu y (n) + p n 1 (x)y (n 1) p 1 (x)y + p 0 (x)y = q(x) (6) Věta 12.3 : Věta 12.4 (princip superpozice) : [MA1-18:P12.7] rovnice typu y (n) + p n 1 (x)y (n 1) p 1 (x)y + p 0 (x)y = q(x) (6)](/thumbs/96/128965676.jpg) 1. Lineární diferenciální rovnice řádu n [MA1-18:P1.7] rovnice typu y n) + p n 1 )y n 1) +... + p 1 )y + p 0 )y = q) 6) počáteční podmínky: y 0 ) = y 0 y 0 ) = y 1 y n 1) 0 ) = y n 1. 7) Věta 1.3 : Necht
1. Lineární diferenciální rovnice řádu n [MA1-18:P1.7] rovnice typu y n) + p n 1 )y n 1) +... + p 1 )y + p 0 )y = q) 6) počáteční podmínky: y 0 ) = y 0 y 0 ) = y 1 y n 1) 0 ) = y n 1. 7) Věta 1.3 : Necht
ATOM VODÍKU MODEL : STOJÍCÍ BODOVÉ JÁDRO A ELEKTRON VZÁJEMNĚ ELEKTROSTATICKY INTERAGUJÍCÍ SCHRÖDINGEROVA ROVNICE PRO PŘÍPAD POTENCIÁLNÍ ENERGIE.
 ATOMY + MOLEKULY ATOM VODÍKU MODEL : STOJÍCÍ BODOVÉ JÁDRO A ELEKTRON VZÁJEMNĚ ELEKTROSTATICKY INTERAGUJÍCÍ SCHRÖDINGEROVA ROVNICE H ˆψ = Eψ PRO PŘÍPAD POTENCIÁLNÍ ENERGIE Vˆ = Ze 2 4πε o r ŘEŠENÍ HLEDÁME
ATOMY + MOLEKULY ATOM VODÍKU MODEL : STOJÍCÍ BODOVÉ JÁDRO A ELEKTRON VZÁJEMNĚ ELEKTROSTATICKY INTERAGUJÍCÍ SCHRÖDINGEROVA ROVNICE H ˆψ = Eψ PRO PŘÍPAD POTENCIÁLNÍ ENERGIE Vˆ = Ze 2 4πε o r ŘEŠENÍ HLEDÁME
Připomenutí co je to soustava lineárních rovnic
 Připomenutí co je to soustava lineárních rovnic Příklad 2x 3y + z = 5 3x + 5y + 2z = 4 x + 2y z = 1 Soustava lineárních rovnic obecně Maticový tvar: a 11 x 1 + a 12 x 2 + + a 1n x n = b 1 a 21 x 1 + a
Připomenutí co je to soustava lineárních rovnic Příklad 2x 3y + z = 5 3x + 5y + 2z = 4 x + 2y z = 1 Soustava lineárních rovnic obecně Maticový tvar: a 11 x 1 + a 12 x 2 + + a 1n x n = b 1 a 21 x 1 + a
Nejdřív spočítáme jeden příklad na variaci konstant pro lineární diferenciální rovnici 2. řádu s kostantními koeficienty. y + y = 4 sin t.
 1 Variace konstanty Nejdřív spočítáme jeden příklad na variaci konstant pro lineární diferenciální rovnici 2. řádu s kostantními koeficienty. Příklad 1 Najděte obecné řešení rovnice: y + y = 4 sin t. Co
1 Variace konstanty Nejdřív spočítáme jeden příklad na variaci konstant pro lineární diferenciální rovnici 2. řádu s kostantními koeficienty. Příklad 1 Najděte obecné řešení rovnice: y + y = 4 sin t. Co
Optické spektroskopie 1 LS 2014/15
 Optické spektroskopie 1 LS 2014/15 Martin Kubala 585634179 mkubala@prfnw.upol.cz 1.Úvod Velikosti objektů v přírodě Dítě ~ 1 m (10 0 m) Prst ~ 2 cm (10-2 m) Vlas ~ 0.1 mm (10-4 m) Buňka ~ 20 m (10-5 m)
Optické spektroskopie 1 LS 2014/15 Martin Kubala 585634179 mkubala@prfnw.upol.cz 1.Úvod Velikosti objektů v přírodě Dítě ~ 1 m (10 0 m) Prst ~ 2 cm (10-2 m) Vlas ~ 0.1 mm (10-4 m) Buňka ~ 20 m (10-5 m)
13 Elektronová struktura molekul
 13 Elektronová struktura molekul Ústředním úkolem kvantové chemie po zavedení Bornovy-Oppenheimerovy aproximace je výpočet elektronové energie molekul Ĥ e ψ e ( r, R) = E e ( R)ψ e ( r, R), (13.1) kde
13 Elektronová struktura molekul Ústředním úkolem kvantové chemie po zavedení Bornovy-Oppenheimerovy aproximace je výpočet elektronové energie molekul Ĥ e ψ e ( r, R) = E e ( R)ψ e ( r, R), (13.1) kde
Diferenciální rovnice 1
 Diferenciální rovnice 1 Základní pojmy Diferenciální rovnice n-tého řádu v implicitním tvaru je obecně rovnice ve tvaru,,,, = Řád diferenciální rovnice odpovídá nejvyššímu stupni derivace v rovnici použitému.
Diferenciální rovnice 1 Základní pojmy Diferenciální rovnice n-tého řádu v implicitním tvaru je obecně rovnice ve tvaru,,,, = Řád diferenciální rovnice odpovídá nejvyššímu stupni derivace v rovnici použitému.
Lingebraické kapitolky - Analytická geometrie
 Lingebraické kapitolky - Analytická geometrie Jaroslav Horáček KAM MFF UK 2013 Co je to vektor? Šipička na tabuli? Ehm? Množina orientovaných úseček majících stejný směr. Prvek vektorového prostoru. V
Lingebraické kapitolky - Analytická geometrie Jaroslav Horáček KAM MFF UK 2013 Co je to vektor? Šipička na tabuli? Ehm? Množina orientovaných úseček majících stejný směr. Prvek vektorového prostoru. V
1 Tyto materiály byly vytvořeny za pomoci grantu FRVŠ číslo 1145/2004.
 Prostá regresní a korelační analýza 1 1 Tyto materiály byly vytvořeny za pomoci grantu FRVŠ číslo 1145/2004. Problematika závislosti V podstatě lze rozlišovat mezi závislostí nepodstatnou, čili náhodnou
Prostá regresní a korelační analýza 1 1 Tyto materiály byly vytvořeny za pomoci grantu FRVŠ číslo 1145/2004. Problematika závislosti V podstatě lze rozlišovat mezi závislostí nepodstatnou, čili náhodnou
1 Projekce a projektory
 Cvičení 3 - zadání a řešení úloh Základy numerické matematiky - NMNM20 Verze z 5. října 208 Projekce a projektory Opakování ortogonální projekce Definice (Ortogonální projekce). Uvažujme V vektorový prostor
Cvičení 3 - zadání a řešení úloh Základy numerické matematiky - NMNM20 Verze z 5. října 208 Projekce a projektory Opakování ortogonální projekce Definice (Ortogonální projekce). Uvažujme V vektorový prostor
2. Polarita vazeb, rezonance, indukční a mezomerní
 32 Polarita vazeb a reaktivita 2. Polarita vazeb, rezonance, indukční a mezomerní efekty ktetové pravidlo je užitečné pro prvky druhé periody (,, ) a halogeny. Formální náboj atomu určíme jako rozdíl počtu
32 Polarita vazeb a reaktivita 2. Polarita vazeb, rezonance, indukční a mezomerní efekty ktetové pravidlo je užitečné pro prvky druhé periody (,, ) a halogeny. Formální náboj atomu určíme jako rozdíl počtu
Emise vyvolaná působením fotonů nebo částic
 Emise vyvolaná působením fotonů nebo částic PES (fotoelektronová spektroskopie) XPS (rentgenová fotoelektronová spektroskopie), ESCA (elektronová spektroskopie pro chemickou analýzu) UPS (ultrafialová
Emise vyvolaná působením fotonů nebo částic PES (fotoelektronová spektroskopie) XPS (rentgenová fotoelektronová spektroskopie), ESCA (elektronová spektroskopie pro chemickou analýzu) UPS (ultrafialová
Základy maticového počtu Matice, determinant, definitnost
 Základy maticového počtu Matice, determinant, definitnost Petr Liška Masarykova univerzita 18.9.2014 Matice a vektory Matice Matice typu m n je pravoúhlé (nebo obdélníkové) schéma, které má m řádků a n
Základy maticového počtu Matice, determinant, definitnost Petr Liška Masarykova univerzita 18.9.2014 Matice a vektory Matice Matice typu m n je pravoúhlé (nebo obdélníkové) schéma, které má m řádků a n
Teoretická chemie 1. cvičení
 Teoretická chemie 1. cvičení Teoretická část Základní úlohou kvantové chemie je nalézt elektronovou vlnovou funkci zkoumané molekuly Ψ a z ní poté odvodit všechny zajímavé vlastnosti této molekuly, např.
Teoretická chemie 1. cvičení Teoretická část Základní úlohou kvantové chemie je nalézt elektronovou vlnovou funkci zkoumané molekuly Ψ a z ní poté odvodit všechny zajímavé vlastnosti této molekuly, např.
Orbitaly, VSEPR 1 / 18
 rbitaly, VSEPR Rezonanční struktury, atomové a molekulové orbitaly, hybridizace, určování tvaru molekuly pomocí teorie VSEPR, úvod do symetrie molekul, dipólový moment 1 / 18 Formální náboj Rozdíl mezi
rbitaly, VSEPR Rezonanční struktury, atomové a molekulové orbitaly, hybridizace, určování tvaru molekuly pomocí teorie VSEPR, úvod do symetrie molekul, dipólový moment 1 / 18 Formální náboj Rozdíl mezi
Integrace. Numerické metody 7. května FJFI ČVUT v Praze
 Integrace Numerické metody 7. května 2018 FJFI ČVUT v Praze 1 Úvod Úvod 1D Kvadraturní vzorce Gaussovy kvadratury Více dimenzí Programy 1 Úvod Úvod - Úloha Máme funkci f( x) a snažíme se najít určitý integrál
Integrace Numerické metody 7. května 2018 FJFI ČVUT v Praze 1 Úvod Úvod 1D Kvadraturní vzorce Gaussovy kvadratury Více dimenzí Programy 1 Úvod Úvod - Úloha Máme funkci f( x) a snažíme se najít určitý integrál
14. přednáška. Přímka
 14 přednáška Přímka Začneme vyjádřením přímky v prostoru Přímku v prostoru můžeme vyjádřit jen parametricky protože obecná rovnice přímky v prostoru neexistuje Přímka v prostoru je určena bodem A= [ a1
14 přednáška Přímka Začneme vyjádřením přímky v prostoru Přímku v prostoru můžeme vyjádřit jen parametricky protože obecná rovnice přímky v prostoru neexistuje Přímka v prostoru je určena bodem A= [ a1
Orbitaly, VSEPR. Zdeněk Moravec, 16. listopadu / 21
 rbitaly, VSEPR Rezonanční struktury, atomové a molekulové orbitaly, hybridizace, určování tvaru molekuly pomocí teorie VSEPR, úvod do symetrie molekul, dipólový moment Zdeněk Moravec, http://z-moravec.net
rbitaly, VSEPR Rezonanční struktury, atomové a molekulové orbitaly, hybridizace, určování tvaru molekuly pomocí teorie VSEPR, úvod do symetrie molekul, dipólový moment Zdeněk Moravec, http://z-moravec.net
VEKTORY. Obrázek 1: Jediný vektor. Souřadnice vektoru jsou jeho průměty do souřadných os x a y u dvojrozměrného vektoru, AB = B A
 VEKTORY Vektorem se rozumí množina všech orientovaných úseček, které mají stejnou velikost, směr a orientaci, což vidíme na obr. 1. Jedna konkrétní orientovaná úsečka se nazývá umístění vektoru na obr.
VEKTORY Vektorem se rozumí množina všech orientovaných úseček, které mají stejnou velikost, směr a orientaci, což vidíme na obr. 1. Jedna konkrétní orientovaná úsečka se nazývá umístění vektoru na obr.
19 Eukleidovský bodový prostor
 19 Eukleidovský bodový prostor Eukleidovským bodovým prostorem rozumíme afinní bodový prostor, na jehož zaměření je definován skalární součin. Víme, že pomocí skalárního součinu jsou definovány pojmy norma
19 Eukleidovský bodový prostor Eukleidovským bodovým prostorem rozumíme afinní bodový prostor, na jehož zaměření je definován skalární součin. Víme, že pomocí skalárního součinu jsou definovány pojmy norma
Definice. Vektorový prostor V nad tělesem T je množina s operacemi + : V V V, tj. u, v V : u + v V : T V V, tj. ( u V )( a T ) : a u V které splňují
 Definice. Vektorový prostor V nad tělesem T je množina s operacemi + : V V V, tj. u, v V : u + v V : T V V, tj. ( u V )( a T ) : a u V které splňují 1. u + v = v + u, u, v V 2. (u + v) + w = u + (v + w),
Definice. Vektorový prostor V nad tělesem T je množina s operacemi + : V V V, tj. u, v V : u + v V : T V V, tj. ( u V )( a T ) : a u V které splňují 1. u + v = v + u, u, v V 2. (u + v) + w = u + (v + w),
2. Určete jádro KerL zobrazení L, tj. nalezněte alespoň jednu jeho bázi a určete jeho dimenzi.
 Řešené příklady z lineární algebry - část 3 Typové příklady s řešením Příklad 3.1: Zobrazení L: P 3 R 23 je zobrazení z prostoru P 3 všech polynomů do stupně 3 (včetně nulového polynomu) do prostoru R
Řešené příklady z lineární algebry - část 3 Typové příklady s řešením Příklad 3.1: Zobrazení L: P 3 R 23 je zobrazení z prostoru P 3 všech polynomů do stupně 3 (včetně nulového polynomu) do prostoru R
1 Analytická geometrie
 1 Analytická geometrie 11 Přímky Necht A E 3 a v R 3 je nenulový Pak p = A + v = {X E 3 X = A + tv, t R}, je přímka procházející bodem A se směrovým vektorem v Rovnici X = A + tv, t R, říkáme bodová rovnice
1 Analytická geometrie 11 Přímky Necht A E 3 a v R 3 je nenulový Pak p = A + v = {X E 3 X = A + tv, t R}, je přímka procházející bodem A se směrovým vektorem v Rovnici X = A + tv, t R, říkáme bodová rovnice
Polynomy a interpolace text neobsahuje přesné matematické definice, pouze jejich vysvětlení
 Polynomy a interpolace text neobsahuje přesné matematické definice, pouze jejich vysvětlení Polynom nad R = zobrazení f : R R f(x) = a n x n + a n 1 x n 1 +... + a 1 x + a 0, kde a i R jsou pevně daná
Polynomy a interpolace text neobsahuje přesné matematické definice, pouze jejich vysvětlení Polynom nad R = zobrazení f : R R f(x) = a n x n + a n 1 x n 1 +... + a 1 x + a 0, kde a i R jsou pevně daná
(Cramerovo pravidlo, determinanty, inverzní matice)
 KMA/MAT1 Přednáška a cvičení, Lineární algebra 2 Řešení soustav lineárních rovnic se čtvercovou maticí soustavy (Cramerovo pravidlo, determinanty, inverzní matice) 16 a 21 října 2014 V dnešní přednášce
KMA/MAT1 Přednáška a cvičení, Lineární algebra 2 Řešení soustav lineárních rovnic se čtvercovou maticí soustavy (Cramerovo pravidlo, determinanty, inverzní matice) 16 a 21 října 2014 V dnešní přednášce
VYBRANÉ PARTIE Z NUMERICKÉ MATEMATIKY
 VYBRANÉ PARTIE Z NUMERICKÉ MATEMATIKY Jan Krejčí 31. srpna 2006 jkrejci@physics.ujep.cz http://physics.ujep.cz/~jkrejci Obsah 1 Přímé metody řešení soustav lineárních rovnic 3 1.1 Gaussova eliminace...............................
VYBRANÉ PARTIE Z NUMERICKÉ MATEMATIKY Jan Krejčí 31. srpna 2006 jkrejci@physics.ujep.cz http://physics.ujep.cz/~jkrejci Obsah 1 Přímé metody řešení soustav lineárních rovnic 3 1.1 Gaussova eliminace...............................
Balmerova série. F. Grepl 1, M. Benc 2, J. Stuchlý 3 Gymnázium Havlíčkův Brod 1, Gymnázium Mnichovo Hradiště 2, Gymnázium Šumperk 3
 Balmerova série F. Grepl 1, M. Benc 2, J. Stuchlý 3 Gymnázium Havlíčkův Brod 1, Gymnázium Mnichovo Hradiště 2, Gymnázium Šumperk 3 Grepl.F@seznam.cz Abstrakt: Metodou dělených svazků jsme určili lámavý
Balmerova série F. Grepl 1, M. Benc 2, J. Stuchlý 3 Gymnázium Havlíčkův Brod 1, Gymnázium Mnichovo Hradiště 2, Gymnázium Šumperk 3 Grepl.F@seznam.cz Abstrakt: Metodou dělených svazků jsme určili lámavý
7. Derivace složené funkce. Budeme uvažovat složenou funkci F = f(g), kde některá z jejich součástí
 202-m3b2/cvic/7slf.tex 7. Derivace složené funkce. Budeme uvažovat složenou funkci F = fg, kde některá z jejich součástí může být funkcí více proměnných. Předpokládáme, že uvažujeme funkce, které mají
202-m3b2/cvic/7slf.tex 7. Derivace složené funkce. Budeme uvažovat složenou funkci F = fg, kde některá z jejich součástí může být funkcí více proměnných. Předpokládáme, že uvažujeme funkce, které mají
9 Kolmost vektorových podprostorů
 9 Kolmost vektorových podprostorů Od kolmosti dvou vektorů nyní přejdeme ke kolmosti dvou vektorových podprostorů. Budeme se zabývat otázkou, kdy jsou dva vektorové podprostory na sebe kolmé a jak to poznáme.
9 Kolmost vektorových podprostorů Od kolmosti dvou vektorů nyní přejdeme ke kolmosti dvou vektorových podprostorů. Budeme se zabývat otázkou, kdy jsou dva vektorové podprostory na sebe kolmé a jak to poznáme.
Operace s maticemi. 19. února 2018
 Operace s maticemi Přednáška druhá 19. února 2018 Obsah 1 Operace s maticemi 2 Hodnost matice (opakování) 3 Regulární matice 4 Inverzní matice 5 Determinant matice Matice Definice (Matice). Reálná matice
Operace s maticemi Přednáška druhá 19. února 2018 Obsah 1 Operace s maticemi 2 Hodnost matice (opakování) 3 Regulární matice 4 Inverzní matice 5 Determinant matice Matice Definice (Matice). Reálná matice
Vektory a matice. Obsah. Aplikovaná matematika I. Carl Friedrich Gauss. Základní pojmy a operace
 Vektory a matice Aplikovaná matematika I Dana Říhová Mendelu Brno Obsah 1 Vektory Základní pojmy a operace Lineární závislost a nezávislost vektorů 2 Matice Základní pojmy, druhy matic Operace s maticemi
Vektory a matice Aplikovaná matematika I Dana Říhová Mendelu Brno Obsah 1 Vektory Základní pojmy a operace Lineární závislost a nezávislost vektorů 2 Matice Základní pojmy, druhy matic Operace s maticemi
Kvantová fyzika atomárních soustav letní semestr VIII. KOTLÁŘSKÁ 23. DUBNA 2014
 F40 Kvantová fyzika atomárních soustav letní semestr 03-04 VIII. Vibrace víceatomových molekul cvičení KOTLÁŘSKÁ 3. DUBNA 04 Úvodem capsule o maticích a jejich diagonalisaci definice "vibračních módů"
F40 Kvantová fyzika atomárních soustav letní semestr 03-04 VIII. Vibrace víceatomových molekul cvičení KOTLÁŘSKÁ 3. DUBNA 04 Úvodem capsule o maticích a jejich diagonalisaci definice "vibračních módů"
10 Více-elektronové atomy
 1 Více-elektronové atomy Atom vodíku je asi nejsložitější soustava, kterou jsme schopni analyticky přesně vyřešit. Tato situace je pro chemika pochopitelně málo uspokojivá. Pomocí kvantové teorie bychom
1 Více-elektronové atomy Atom vodíku je asi nejsložitější soustava, kterou jsme schopni analyticky přesně vyřešit. Tato situace je pro chemika pochopitelně málo uspokojivá. Pomocí kvantové teorie bychom
Laserová technika prosince Katedra fyzikální elektroniky.
 Laserová technika 1 Aktivní prostředí Šíření rezonančního záření dvouhladinovým prostředím Jan Šulc Katedra fyzikální elektroniky České vysoké učení technické jan.sulc@fjfi.cvut.cz 22. prosince 2016 Program
Laserová technika 1 Aktivní prostředí Šíření rezonančního záření dvouhladinovým prostředím Jan Šulc Katedra fyzikální elektroniky České vysoké učení technické jan.sulc@fjfi.cvut.cz 22. prosince 2016 Program
Matematika (CŽV Kadaň) aneb Úvod do lineární algebry Matice a soustavy rovnic
 Přednáška třetí (a pravděpodobně i čtvrtá) aneb Úvod do lineární algebry Matice a soustavy rovnic Lineární rovnice o 2 neznámých Lineární rovnice o 2 neznámých Lineární rovnice o dvou neznámých x, y je
Přednáška třetí (a pravděpodobně i čtvrtá) aneb Úvod do lineární algebry Matice a soustavy rovnic Lineární rovnice o 2 neznámých Lineární rovnice o 2 neznámých Lineární rovnice o dvou neznámých x, y je
Born-Oppenheimerova aproximace
 Born-Oppenheimerova aproximace Oddělení elektronického a jaderného pohybu Jádra 2000 x těžší než elektrony elektrony kvantová chemie, popis systému (do 100 atomů) na základě vlastností elektronů (jádra
Born-Oppenheimerova aproximace Oddělení elektronického a jaderného pohybu Jádra 2000 x těžší než elektrony elektrony kvantová chemie, popis systému (do 100 atomů) na základě vlastností elektronů (jádra
Nebojte se kvant. Technische Universität Carolo Wilhelmina zu Braunschweig. Michal Kolář
 Nebojte se kvant Tomáš Kubař Technische Universität Carolo Wilhelmina zu Braunschweig Michal Kolář Ústav organické chemie a biochemie, Akademie věd České republiky, Praha I. Elektronová struktura molekul
Nebojte se kvant Tomáš Kubař Technische Universität Carolo Wilhelmina zu Braunschweig Michal Kolář Ústav organické chemie a biochemie, Akademie věd České republiky, Praha I. Elektronová struktura molekul
Diskutujte, jak široký bude pás spojený s fosforescencí versus fluorescencí. Udělejte odhad v cm -1.
 S použitím modelu volného elektronu (=částice v krabici) spočtěte vlnovou délku a vlnočet nejdlouhovlnějšího elektronového přechodu u molekuly dekapentaenu a oktatetraenu. Diskutujte polohu absorpčního
S použitím modelu volného elektronu (=částice v krabici) spočtěte vlnovou délku a vlnočet nejdlouhovlnějšího elektronového přechodu u molekuly dekapentaenu a oktatetraenu. Diskutujte polohu absorpčního
VÍTEJTE V MIKROSVĚTĚ
 VÍTEJTE V MIKROSVĚTĚ Klasická vs. Moderní fyzika Klasická fyzika fyzika obyčejných věcí viditelných pouhým okem Moderní fyzika Relativita zabývá se tím co se pohybuje rychle nebo v silovém gravitačním
VÍTEJTE V MIKROSVĚTĚ Klasická vs. Moderní fyzika Klasická fyzika fyzika obyčejných věcí viditelných pouhým okem Moderní fyzika Relativita zabývá se tím co se pohybuje rychle nebo v silovém gravitačním
1 0 0 u 22 u 23 l 31. l u11
 LU dekompozice Jedná se o rozklad matice A na dvě trojúhelníkové matice L a U, A=LU. Matice L je dolní trojúhelníková s jedničkami na diagonále a matice U je horní trojúhelníková. a a2 a3 a 2 a 22 a 23
LU dekompozice Jedná se o rozklad matice A na dvě trojúhelníkové matice L a U, A=LU. Matice L je dolní trojúhelníková s jedničkami na diagonále a matice U je horní trojúhelníková. a a2 a3 a 2 a 22 a 23
Balmerova série vodíku
 Balmerova série vodíku Eva Bartáková, SGAGY Kladno, evebartak@centrum.cz Adam Fadrhonc, SSOU a U, Černá za Bory, Pardubice, adam@kve.cz Lukáš Malina, gymn. Christiana Dopplera, Praha, lukas-malina@seznam.cz
Balmerova série vodíku Eva Bartáková, SGAGY Kladno, evebartak@centrum.cz Adam Fadrhonc, SSOU a U, Černá za Bory, Pardubice, adam@kve.cz Lukáš Malina, gymn. Christiana Dopplera, Praha, lukas-malina@seznam.cz
9.2. Zkrácená lineární rovnice s konstantními koeficienty
 9.2. Zkrácená lineární rovnice s konstantními koeficienty Cíle Řešíme-li konkrétní aplikace, které jsou popsány diferenciálními rovnicemi, velmi často zjistíme, že fyzikální nebo další parametry (hmotnost,
9.2. Zkrácená lineární rovnice s konstantními koeficienty Cíle Řešíme-li konkrétní aplikace, které jsou popsány diferenciálními rovnicemi, velmi často zjistíme, že fyzikální nebo další parametry (hmotnost,
Balmerova série, určení mřížkové a Rydbergovy konstanty
 Balmerova série, určení mřížkové a Rydbergovy konstanty V tomto laboratorním cvičení zkoumáme spektrální čáry 1. řádu vodíku a rtuti pomocí difrakční mřížky (mřížkového spektroskopu). Známé spektrální
Balmerova série, určení mřížkové a Rydbergovy konstanty V tomto laboratorním cvičení zkoumáme spektrální čáry 1. řádu vodíku a rtuti pomocí difrakční mřížky (mřížkového spektroskopu). Známé spektrální
Metoda nejmenších čtverců Michal Čihák 26. listopadu 2012
 Metoda nejmenších čtverců Michal Čihák 26. listopadu 2012 Metoda nejmenších čtverců Matematicko-statistická metoda používaná zejména při zpracování nepřesných dat (typicky experimentálních empirických
Metoda nejmenších čtverců Michal Čihák 26. listopadu 2012 Metoda nejmenších čtverců Matematicko-statistická metoda používaná zejména při zpracování nepřesných dat (typicky experimentálních empirických
Arnoldiho a Lanczosova metoda
 Arnoldiho a Lanczosova metoda 1 Částečný problém vlastních čísel Ne vždy je potřeba (a někdy to není ani technicky možné) nalézt celé spektrum dané matice (velké řídké matice). Úloze, ve které chceme aproximovat
Arnoldiho a Lanczosova metoda 1 Částečný problém vlastních čísel Ne vždy je potřeba (a někdy to není ani technicky možné) nalézt celé spektrum dané matice (velké řídké matice). Úloze, ve které chceme aproximovat
Teorie Molekulových Orbitalů (MO)
 Teorie Molekulových Orbitalů (MO) Kombinace atomových orbitalů na všech atomech v molekule Vhodná symetrie Vhodná (podobná) energie Z n AO vytvoříme n MO Pro začátek dvouatomové molekuly: H 2, F 2, CO,...
Teorie Molekulových Orbitalů (MO) Kombinace atomových orbitalů na všech atomech v molekule Vhodná symetrie Vhodná (podobná) energie Z n AO vytvoříme n MO Pro začátek dvouatomové molekuly: H 2, F 2, CO,...
Elektronový obal atomu
 Elektronový obal atomu Ondřej Havlíček.ročník F-Vt/SŠ Jsoucno je vždy něco, co jsme si sami zkonstruovali ve své mysli. Podstata takovýchto konstrukcí nespočívá v tom, že by byly odvozeny ze smyslových
Elektronový obal atomu Ondřej Havlíček.ročník F-Vt/SŠ Jsoucno je vždy něco, co jsme si sami zkonstruovali ve své mysli. Podstata takovýchto konstrukcí nespočívá v tom, že by byly odvozeny ze smyslových
1 Řešení soustav lineárních rovnic
 1 Řešení soustav lineárních rovnic 1.1 Lineární rovnice Lineární rovnicí o n neznámých x 1,x 2,..., x n s reálnými koeficienty rozumíme rovnici ve tvaru a 1 x 1 + a 2 x 2 +... + a n x n = b, (1) kde koeficienty
1 Řešení soustav lineárních rovnic 1.1 Lineární rovnice Lineární rovnicí o n neznámých x 1,x 2,..., x n s reálnými koeficienty rozumíme rovnici ve tvaru a 1 x 1 + a 2 x 2 +... + a n x n = b, (1) kde koeficienty
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Chemický vzorec je zápis chemické látky. Izolovaný atom se zapíše značkou prvku. Fe atom železa Molekula je svazek atomů. Počet atomů v molekule
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Chemický vzorec je zápis chemické látky. Izolovaný atom se zapíše značkou prvku. Fe atom železa Molekula je svazek atomů. Počet atomů v molekule
0.1 Úvod do lineární algebry
 Matematika KMI/PMATE 1 01 Úvod do lineární algebry 011 Lineární rovnice o 2 neznámých Definice 011 Lineární rovnice o dvou neznámých x, y je rovnice, která může být vyjádřena ve tvaru ax + by = c, kde
Matematika KMI/PMATE 1 01 Úvod do lineární algebry 011 Lineární rovnice o 2 neznámých Definice 011 Lineární rovnice o dvou neznámých x, y je rovnice, která může být vyjádřena ve tvaru ax + by = c, kde
Oddělení pohybu elektronů a jader
 Oddělení pohybu elektronů a ader Adiabatická aproximace Born-Oppenheimerova aproximace Důležité vztahy sou 4, 5, 7, 0,,, udělal sem to zbytečně podrobně, e to samostatný okruh Separace translačního pohybu:
Oddělení pohybu elektronů a ader Adiabatická aproximace Born-Oppenheimerova aproximace Důležité vztahy sou 4, 5, 7, 0,,, udělal sem to zbytečně podrobně, e to samostatný okruh Separace translačního pohybu:
stránkách přednášejícího.
 Předmět: MA 4 Dnešní látka Iterační metoda Jacobiova iterační metoda Gaussova-Seidelova iterační metoda Superrelaxační metoda (metoda SOR) Metoda sdružených gradientů Četba: Text o lineární algebře v Příručce
Předmět: MA 4 Dnešní látka Iterační metoda Jacobiova iterační metoda Gaussova-Seidelova iterační metoda Superrelaxační metoda (metoda SOR) Metoda sdružených gradientů Četba: Text o lineární algebře v Příručce
INVESTICE DO ROZVOJE VZDĚLÁVÁNÍ. Modernizace studijního programu Matematika na PřF Univerzity Palackého v Olomouci CZ.1.07/2.2.00/28.
 INVESTICE DO ROZVOJE VZDĚLÁVÁNÍ Modernizace studijního programu Matematika na PřF Univerzity Palackého v Olomouci CZ.1.07/2.2.00/28.0141 Báze vektorových prostorů, transformace souřadnic Michal Botur Přednáška
INVESTICE DO ROZVOJE VZDĚLÁVÁNÍ Modernizace studijního programu Matematika na PřF Univerzity Palackého v Olomouci CZ.1.07/2.2.00/28.0141 Báze vektorových prostorů, transformace souřadnic Michal Botur Přednáška
ATOMOVÁ SPEKTROMETRIE
 ATOMOVÁ SPEKTROMETRIE Atomová spektrometrie valenčních e - 1. OES (AES). AAS 3. AFS 1 Atomová spektra čárová spektra Tok záření P - množství zářivé energie (Q E ) přenesené od zdroje za jednotku času.
ATOMOVÁ SPEKTROMETRIE Atomová spektrometrie valenčních e - 1. OES (AES). AAS 3. AFS 1 Atomová spektra čárová spektra Tok záření P - množství zářivé energie (Q E ) přenesené od zdroje za jednotku času.
Lineární algebra : Metrická geometrie
 Lineární algebra : Metrická geometrie (16. přednáška) František Štampach, Karel Klouda LS 2013/2014 vytvořeno: 6. května 2014, 10:42 1 2 Úvod Zatím jsme se lineární geometrii věnovali v kapitole o lineárních
Lineární algebra : Metrická geometrie (16. přednáška) František Štampach, Karel Klouda LS 2013/2014 vytvořeno: 6. května 2014, 10:42 1 2 Úvod Zatím jsme se lineární geometrii věnovali v kapitole o lineárních
Lineární stabilita a teorie II. řádu
 Lineární stabilita a teorie II. řádu Sestavení podmínek rovnováhy na deformované konstrukci Konstrukce s a bez počáteční imperfekce Výpočet s malými vs. s velkými deformacemi ANKC-C 1 Zatěžovacídráhy [Šejnoha,
Lineární stabilita a teorie II. řádu Sestavení podmínek rovnováhy na deformované konstrukci Konstrukce s a bez počáteční imperfekce Výpočet s malými vs. s velkými deformacemi ANKC-C 1 Zatěžovacídráhy [Šejnoha,
Soustavy. Terminologie. Dva pohledy na soustavu lin. rovnic. Definice: Necht A = (a i,j ) R m,n je matice, b R m,1 je jednosloupcová.
 [1] Terminologie [2] Soustavy lineárních rovnic vlastnosti množin řešení metody hledání řešení nejednoznačnost zápisu řešení Definice: Necht A = (a i,j ) R m,n je matice, b R m,1 je jednosloupcová matice.
[1] Terminologie [2] Soustavy lineárních rovnic vlastnosti množin řešení metody hledání řešení nejednoznačnost zápisu řešení Definice: Necht A = (a i,j ) R m,n je matice, b R m,1 je jednosloupcová matice.
Úvodní informace Soustavy lineárních rovnic. 12. února 2018
 Úvodní informace Soustavy lineárních rovnic Přednáška první 12. února 2018 Obsah 1 Úvodní informace 2 Soustavy lineárních rovnic 3 Matice Frobeniova věta Úvodní informace Olga Majlingová : Na Okraji, místnost
Úvodní informace Soustavy lineárních rovnic Přednáška první 12. února 2018 Obsah 1 Úvodní informace 2 Soustavy lineárních rovnic 3 Matice Frobeniova věta Úvodní informace Olga Majlingová : Na Okraji, místnost
1 Linearní prostory nad komplexními čísly
 1 Linearní prostory nad komplexními čísly V této přednášce budeme hledat kořeny polynomů, které se dále budou moci vyskytovat jako složky vektorů nebo matic Vzhledem k tomu, že kořeny polynomu (i reálného)
1 Linearní prostory nad komplexními čísly V této přednášce budeme hledat kořeny polynomů, které se dále budou moci vyskytovat jako složky vektorů nebo matic Vzhledem k tomu, že kořeny polynomu (i reálného)
6 PŘEDNÁŠKA 6: Stav kvantového systému, úplná množina pozorovatelných. Operátor momentu hybnosti a kvadrátu momentu hybnosti.
 6 PŘEDNÁŠKA 6: Stav kvantového systému, úplná množina pozorovatelných Operátor momentu hybnosti a kvadrátu momentu hybnosti Víme už tedy téměř vše o operátorech Jsou to vlastně měřící přístroje v kvantové
6 PŘEDNÁŠKA 6: Stav kvantového systému, úplná množina pozorovatelných Operátor momentu hybnosti a kvadrátu momentu hybnosti Víme už tedy téměř vše o operátorech Jsou to vlastně měřící přístroje v kvantové
jádro a elektronový obal jádro nukleony obal elektrony, pro chemii významné valenční elektrony
 atom jádro a elektronový obal jádro nukleony obal elektrony, pro chemii významné valenční elektrony molekula Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti seskupení alespoň dvou atomů
atom jádro a elektronový obal jádro nukleony obal elektrony, pro chemii významné valenční elektrony molekula Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti seskupení alespoň dvou atomů
Řešit atom vodíku znamená nalézt řešení Schrödingerovy rovnice s příslušným hamiltoniánem. 1 4πǫ 0. 2m e
 8 Atom vodíku Správné řešení atomu vodíku je jedním z velkých vítězství kvantové mechaniky. Podle klasické fyziky náboj, který se pohybuje se zrychlením (elektron obíhající vodíkové jádro proton), by měl
8 Atom vodíku Správné řešení atomu vodíku je jedním z velkých vítězství kvantové mechaniky. Podle klasické fyziky náboj, který se pohybuje se zrychlením (elektron obíhající vodíkové jádro proton), by měl
4.1 Řešení základních typů diferenciálních rovnic 1.řádu
 4. Řešení základních tpů diferenciálních rovnic.řádu 4..4 Určete řešení z() Cauchov úloh pro rovnici + = 0 vhovující počáteční podmínce z =. Po separaci proměnných v rovnici dostaneme rovnici = d a po
4. Řešení základních tpů diferenciálních rovnic.řádu 4..4 Určete řešení z() Cauchov úloh pro rovnici + = 0 vhovující počáteční podmínce z =. Po separaci proměnných v rovnici dostaneme rovnici = d a po
Vazby v pevných látkách
 Vazby v pevných látkách Hlavní body 1. Tvorba pevných látek 2. Van der Waalsova vazba elektrostatická interakce indukovaných dipólů 3. Iontová vazba elektrostatická interakce iontů 4. Kovalentní vazba
Vazby v pevných látkách Hlavní body 1. Tvorba pevných látek 2. Van der Waalsova vazba elektrostatická interakce indukovaných dipólů 3. Iontová vazba elektrostatická interakce iontů 4. Kovalentní vazba
John Dalton Amadeo Avogadro
 Spojením atomů vznikají molekuly... John Dalton 1766 1844 Amadeo Avogadro 1776 1856 Výpočet molekuly 2, metoda valenční vazby Walter eitler 1904 1981 Fritz W. London 1900 1954 Teorie molekulových orbitalů
Spojením atomů vznikají molekuly... John Dalton 1766 1844 Amadeo Avogadro 1776 1856 Výpočet molekuly 2, metoda valenční vazby Walter eitler 1904 1981 Fritz W. London 1900 1954 Teorie molekulových orbitalů
Matematika 1 MA1. 1 Analytická geometrie v prostoru - základní pojmy. 4 Vzdálenosti. 12. přednáška ( ) Matematika 1 1 / 32
 Matematika 1 12. přednáška MA1 1 Analytická geometrie v prostoru - základní pojmy 2 Skalární, vektorový a smíšený součin, projekce vektoru 3 Přímky a roviny 4 Vzdálenosti 5 Příčky mimoběžek 6 Zkouška;
Matematika 1 12. přednáška MA1 1 Analytická geometrie v prostoru - základní pojmy 2 Skalární, vektorový a smíšený součin, projekce vektoru 3 Přímky a roviny 4 Vzdálenosti 5 Příčky mimoběžek 6 Zkouška;
1. Kvantové jámy. Tabulka 1: Efektivní hmotnosti nosičů v krystalech GaAs, AlAs, v jednotkách hmotnosti volného elektronu m o.
 . Kvantové jámy Pokročilé metody růstu krystalů po jednotlivých vrstvách (jako MBE) dovolují vytvořit si v krystalu libovolný potenciál. Jeden z hojně používaných materiálů je: GaAs, AlAs a jejich ternární
. Kvantové jámy Pokročilé metody růstu krystalů po jednotlivých vrstvách (jako MBE) dovolují vytvořit si v krystalu libovolný potenciál. Jeden z hojně používaných materiálů je: GaAs, AlAs a jejich ternární
Otázku, kterými body prochází větev implicitní funkce řeší následující věta.
 1 Implicitní funkce Implicitní funkce nejsou funkce ve smyslu definice, že funkce bodu z definičního oboru D přiřadí právě jednu hodnotu z oboru hodnot H. Přesnější termín je funkce zadaná implicitně.
1 Implicitní funkce Implicitní funkce nejsou funkce ve smyslu definice, že funkce bodu z definičního oboru D přiřadí právě jednu hodnotu z oboru hodnot H. Přesnější termín je funkce zadaná implicitně.
Operace s maticemi
 Operace s maticemi Seminář druhý 17.10. 2018 Obsah 1 Operace s maticemi 2 Hodnost matice 3 Regulární matice 4 Inverzní matice Matice Definice (Matice). Reálná matice typu m n je obdélníkové schema A =
Operace s maticemi Seminář druhý 17.10. 2018 Obsah 1 Operace s maticemi 2 Hodnost matice 3 Regulární matice 4 Inverzní matice Matice Definice (Matice). Reálná matice typu m n je obdélníkové schema A =
SPECIÁLNÍCH PRIMITIVNÍCH FUNKCÍ INTEGRACE RACIONÁLNÍCH FUNKCÍ
 VÝPOČET PEIÁLNÍH PRIMITIVNÍH FUNKÍ Obecně nelze zadat algoritmus, který by vždy vedl k výpočtu primitivní funkce. Nicméně eistují jisté třídy funkcí, pro které eistuje algoritmus, který vždy vede k výpočtu
VÝPOČET PEIÁLNÍH PRIMITIVNÍH FUNKÍ Obecně nelze zadat algoritmus, který by vždy vedl k výpočtu primitivní funkce. Nicméně eistují jisté třídy funkcí, pro které eistuje algoritmus, který vždy vede k výpočtu
Příklady pro předmět Aplikovaná matematika (AMA) část 1
 Příklady pro předmět plikovaná matematika (M) část 1 1. Lokální extrémy funkcí dvou a tří proměnných Nalezněte lokální extrémy funkcí: (a) f 1 : f 1 (x, y) = x 3 3x + y 2 + 2y (b) f 2 : f 2 (x, y) = 1
Příklady pro předmět plikovaná matematika (M) část 1 1. Lokální extrémy funkcí dvou a tří proměnných Nalezněte lokální extrémy funkcí: (a) f 1 : f 1 (x, y) = x 3 3x + y 2 + 2y (b) f 2 : f 2 (x, y) = 1
Maticí typu (m, n), kde m, n jsou přirozená čísla, se rozumí soubor mn veličin a jk zapsaných do m řádků a n sloupců tvaru:
 3 Maticový počet 3.1 Zavedení pojmu matice Maticí typu (m, n, kde m, n jsou přirozená čísla, se rozumí soubor mn veličin a jk zapsaných do m řádků a n sloupců tvaru: a 11 a 12... a 1k... a 1n a 21 a 22...
3 Maticový počet 3.1 Zavedení pojmu matice Maticí typu (m, n, kde m, n jsou přirozená čísla, se rozumí soubor mn veličin a jk zapsaných do m řádků a n sloupců tvaru: a 11 a 12... a 1k... a 1n a 21 a 22...
Cvičení 5 - Inverzní matice
 Cvičení 5 - Inverzní matice Pojem Inverzní matice Buď A R n n. A je inverzní maticí k A, pokud platí, AA = A A = I n. Matice A, pokud existuje, je jednoznačná. A stačí nám jen jedna rovnost, aby platilo,
Cvičení 5 - Inverzní matice Pojem Inverzní matice Buď A R n n. A je inverzní maticí k A, pokud platí, AA = A A = I n. Matice A, pokud existuje, je jednoznačná. A stačí nám jen jedna rovnost, aby platilo,
Soustavy linea rnı ch rovnic
 [1] Soustavy lineárních rovnic vlastnosti množin řešení metody hledání řešení nejednoznačnost zápisu řešení a) soustavy, 10, b) P. Olšák, FEL ČVUT, c) P. Olšák 2010, d) BI-LIN, e) L, f) 2009/2010, g)l.
[1] Soustavy lineárních rovnic vlastnosti množin řešení metody hledání řešení nejednoznačnost zápisu řešení a) soustavy, 10, b) P. Olšák, FEL ČVUT, c) P. Olšák 2010, d) BI-LIN, e) L, f) 2009/2010, g)l.
IB112 Základy matematiky
 IB112 Základy matematiky Řešení soustavy lineárních rovnic, matice, vektory Jan Strejček IB112 Základy matematiky: Řešení soustavy lineárních rovnic, matice, vektory 2/53 Obsah Soustava lineárních rovnic
IB112 Základy matematiky Řešení soustavy lineárních rovnic, matice, vektory Jan Strejček IB112 Základy matematiky: Řešení soustavy lineárních rovnic, matice, vektory 2/53 Obsah Soustava lineárních rovnic
Afinita je stručný název pro afinní transformaci prostoru, tj.vzájemně jednoznačné afinní zobrazení bodového prostoru A n na sebe.
 4 Afinita Afinita je stručný název pro afinní transformaci prostoru, tj.vzájemně jednoznačné afinní zobrazení bodového prostoru A n na sebe. Poznámka. Vzájemně jednoznačným zobrazením rozumíme zobrazení,
4 Afinita Afinita je stručný název pro afinní transformaci prostoru, tj.vzájemně jednoznačné afinní zobrazení bodového prostoru A n na sebe. Poznámka. Vzájemně jednoznačným zobrazením rozumíme zobrazení,
SOUSTAVY LINEÁRNÍCH ALGEBRAICKÝCH ROVNIC
 SOUSTAVY LINEÁRNÍCH ALGEBRAICKÝCH ROVNIC Pojm: Algebraická rovnice... rovnice obsahující pouze celé nezáporné mocnin neznámé, tj. a n n + a n 1 n 1 +... + a 2 2 + a 1 + a 0 = 0, kde n je přirozené číslo.
SOUSTAVY LINEÁRNÍCH ALGEBRAICKÝCH ROVNIC Pojm: Algebraická rovnice... rovnice obsahující pouze celé nezáporné mocnin neznámé, tj. a n n + a n 1 n 1 +... + a 2 2 + a 1 + a 0 = 0, kde n je přirozené číslo.
