Struktura a neobvyklé vlastnosti vody
|
|
|
- Vilém Hruška
- před 8 lety
- Počet zobrazení:
Transkript
1 5/42 Regelace ledu VYSOKÁ ŠKOLA CHEMICKO-TECHNOLOGICKÁ Ústav fyzikální chemie Struktura a neobvyklé vlastnosti vody t= Jiøí Kolafa (ad Qtání )2ρled λmgttání ρled ρ t = èas λ = tepelná vodivost drátu m = hmotnost záva¾í Qtání = specická entalpie tání jiri.kolafa@vscht.cz Pøehled anomálií (teplo tání na jednotku hmotnosti) Mpembùv jev a d ρ g Co je a jak se stanovuje struktura Vysvìtlené anomálie = prùmìr ledu = prùmìr drátu = hustota = tíhové zrychlení Jaký tvar má kapka 2/42 Je anomální? Voda vykazuje pøekvapující øadu fyzikálních vlastností, nìkteré zjevnì jedineèné, které slou¾í k denici její neobvyklé þosobnostiÿ. F. H. Stillinger Adv. Chem. Phys. 3, (975) 3/42 Je anomální? Voda vykazuje pøekvapující øadu fyzikálních vlastností, nìkteré zjevnì jedineèné, které slou¾í k denici její neobvyklé þosobnostiÿ. F. H. Stillinger Adv. Chem. Phys. 3, (975) Stalo se populárním zdùrazòovat þanomálníÿ aspekt vlastností vody. Tato móda smìøuje k zakrytí faktu, ¾e tyto þanomálieÿ jsou vìt¹inou pouze malými odchylkami od normálních vlastností asociujících kapalin. C. M. Davis & J. Jarzynski ve sborníku Water and Aqueous Solutions (red. R. A. Horne), Wiley, NY (972) 6/42 Anomálie: Studená ( C) plave na teplej¹í (4 C) maximum hustoty pøi 3.98 C (tì¾ká :.9 C) unikátní chování mizí za vysokých tlakù rybníky zamrzají odshora 7/42 Hodnì tepla! vysoké body tání a varu podobné látky jsou plyny: H2S, NH3, HF (tvaru = 9 C) velká tepelná kapacita v porovnání s ostatními látkami (ale NH3, aj.) velká tepelná kapacita v porovnání s ledem a párou velké výparné teplo i teplo tání... spoleèné s ostatními asociujícími kapalinami Pozn.: asociující kapalina = mající vodíkové vazby (viz dále) 4/42 objem ledu : objem vody =.9 pomìrnì vzácné; prvky: Si (.2), Ga (.3), Ge, Ce, Bi (.28), Pu pøi zvý¹ení tlaku teplota tání klesá (do 22 C pøi 2 MPa) tlak 25 MPa po zmrznutí vody v uzavøené nádobì (ledová bomba) þregelaceÿ ledu 8/42 Porovnání teplot tání a varu { el. struktura 6 kriticka teplota teplota/k Led plave na vodì 4 teplota varu 2 teplota tani tì¾ký led se potopí v obyèejné vodì (mean Ocean Water:.5% D) +2 2 { obyèejný led pøi teplotì tání ( C):.967 g cm =.86 { tì¾ký led pøi teplotì tání (3.8 C):.77 g cm 3 CH4 NH3 H2O HF Ne
2 Porovnání teplot tání { homology 9/42 Anomálie: Teplotní závislosti 3/42 3 H 2 O 25 2 H 2 Se H 2 Te H 2 Po teplota tani/k 5 H 2 S GeH 4 SnH 4 CH 4 credit: SiH M/g mol - Tepelná kapacita Izobarická specická tepelná kapacitaÿ (døíve þmìrné teploÿ) látka C p,sp /(J kg K ) 4.2 vodní pára.95 led 2. amoniak (stlaè.) 4.7 sulfan ( 63 C) 2. ethylalkohol 2.4 pentan 2.3 kys. octová 2. benzen.7 chlorid uhlièitý.8 rtu».4 sulfan.5 amoniak 2.2 /42 Podchlazená Kam ani vìdec nemù¾e, tam extrapoluje [supercooling.sh] 4/42 Dal¹í rekordy /42 Amorfní ledy (skla) 5/42 velká viskozita (pomalu teèe).89 mpa s, cf. pentan.22 mpa s (25 C) ochlazování malá stlaèitelnost (malá zmìna objemu s tlakem).46 GPa, cf. CCl 4.5 GPa (25 C) velké povrchové napìtí (vodomìrky se neutopí) velká permitivita, i ledu malý index lomu, zvl. ledu velká vodivost (ne¾ odpovídá H + /H 3 O + + OH ) nízkohustotní amorfní led (LDA, ASW): napaøování extrémnì rychlé ochlazení vysokohustotní amorfní led (HDA): stlaèení ledu Ih èi LDA (?) rychlé ochlazení stlaèené vody velmi vysokohustotní amorfní led (VHDA): credit: Teplotní závislosti 2/42 Scénáø dvou kritických bodù 6/42 hustota izotermická stlaèitelnost: min. pøi 46 C adiabatická stlaèitelnost rychlost zvuku: max. pøi 73 C) tepelná kapacita (pøi konst. tlaku): min. pøi 35 C rozpustnosti plynù (He, Ne,... ) mají teplotní minimum viskozita klesne (pro t < 3 C) pøi zvý¹ení tlaku neobvyklá závislost viskozity na teplotì, pod. autodifúze index lomu max. C, tepelná vodivost max. 3 C podivnosti pøi malých teplotách obvyklé chování pøi vy¹¹ích... jsou i jiné scénáøe credit: O. Mishima, H.E. Stanley
3 Mnoho ledù 7/42 Mpembùv jev 2/42 kelímek s horkou vodou pøimrzne k námraze, èím¾ se zvý¹í odvod tepla { mù¾e být èást vody se vypaøí { samo nestaèí (pùvodnì) studenou vodu lze víc podchladit { za urèitých podmínek rozpu¹tìné plyny sni¾ují bod mrazu { nepatrnì zahøátím se rozbijí þklastryÿ / þstrukturyÿ { nesmysl Anomálie: Mnoho ledù aj. struktur [show/krystaly.sh] 8/42 Jak popí¹u strukturu { korelaèní funkce 22/42 obyèejný led Ih led Ic klatrát typu I náhodnì rozmístìné molekuly (ideální plyn) kapalina Anomálie: Entropie 9/42 Struktura tekutin { korelaèní funkce 23/42 Entropie je míra chaosu v systému... (dodatková) entropie neobvykle klesne po pøidání inertních látek (uhlovodíky, plyny) hydrofobní jevy i pøi velmi nízkých teplotách obsahuje led velkou neuspoøádanost (podobnì N 2 O, CO) Mpembùv jev þhorká zmrzne rychleji ne¾ studenáÿ Aristoteles, 35 pø.n.l. Erasto Mpemba, Tanzanie, 963 [jkv /home/jiri/tex/talks/water/p*-mpemba.jpg] 2/42 Jak získám strukturu { experiment 24/42 studená vla¾ná horká Mìøím (neutrony, elektrony, rtg.) þstrukturní faktorÿ
4 Jak získám strukturu? 25/42 Studium vodíkových vazeb v kapalné vodì [show/.sh] 29/42 v poèítaèi modelujeme (simulujeme) vzorek nìkolika set molekul vody vypoèteme korelaèní funkce a dal¹í vlastnosti a srovnáme s experimentem studujeme dal¹í vlastnosti vodíkových vazeb inverzní Fourierova transformace Statistická termodynamika a model vody 26/42 Problém 3/42 Kdy jsou dvì molekuly vázány vodíkovou vazbou? O-O TIP4P jedna molekula dvì molekuly mnoho molekul g(r) 2.5 O-H H-H Energie páru molekul,2 vyjádøena vzorcem, napø.: [ ] σ u(, 2 2) = 4E min r O r O2 2 σ 6 r O r O2 6 + q q 2 4πɛ r q r q2 dvojice nábojù r/nm Vsuvka: molekulové simulace Metoda Monte Carlo pou¾ívá náhodná èísla. Napø. Metropolisova metoda: náhodnì hýbnu jednou molekulou zmìnu pøijmu: { pokud se energie sní¾í: v¾dy { pokud se energie zvý¹í: jen nìkdy (s pravdìpodobností e (zmìna energie)/kt ) opakuji mnohokrát [simolant x] 27/42 Metoda molekulové dynamiky numericky øe¹í Newtonovy pohybové rovnice, d 2 r i /dt 2 a i = f i /m i. Napø. metoda leap-frog: zrychlení = zmìna rychlosti za jednotku èasu (tj. krok h) v i (t + h/2) = v i (t h/2) + h a(t) rychlost = dráha (zmìna polohy) za jednotku èasu (tj. krok h) r i (t + h) = r i (t) + h v i (t + h/2) a opakujeme pro t =, h, 2h, 3h,... (typicky h = fs = 5 s) Problém Kdy jsou dvì molekuly vázány vodíkovou vazbou? 3 O-O 2.5 TIP4P 2 g(r).5 O-H H-H r/nm... kdy¾ OH <.244 nm 3/42 Vodíková vazba (mùstek) slab¹í ne¾ kovalentní vazba: C{C silnìj¹í ne¾ disperzní (van der Waalsova) síla: CH 4 CH 4 smìrová závislost typická doba ¾ivota = pikosekundy ( ps = 2 s) [show/hbond.sh] 28/42 kromì vody: NH 3, organické kyseliny, alkoholy (asociující kapaliny); bílkoviny, DNA,... Voda jako sí» vodíkových vazeb systém vodíkových vazeb je propojen v prùmìru 3{4 vazby na molekulu nejvíce je molekul s 3{4 vazbami [show/tetraedr.sh] 32/42 nejbli¾¹í sousedi molekuly jsou èasto uspoøádáni do ètyøstìnu sí» obsahuje kruhy: 5{6 nejèastìj¹í typický èas zmìny struktury je ps na vazbu výraznìj¹í pøi ni¾¹ích teplotách Ale dimer nemá tetraedrické uspoøádání, tetraedriènost je do znaèné míry dána tím, ¾e máme 2 vodíky k navázání a tvarem minima.
5 Vysvìtlené anomálie { struktura... ale podobnì CCl 4, Si 33/42 Vysvìtlené tepelné vlastnosti vodíkové vazby mají hodnì energie 37/42 se zvy¹ující se teplotou je jich ménì a jsou slab¹í... ale kvantové efekty tepelnou kapacitu za nízkých teplot naopak sni- ¾ují tì¾ká je anomálnìj¹í v páøe (témìø) nejsou v ledu jsou nasycené nemìní se s teplotou podobnì ostatní asociující kapaliny Vysvìtlené anomálie { hustota pøi ni¾¹ích teplotách je uspoøádání molekul ètyøstìnovitìj¹í (ledu-podobné) okolo ètyøstìnovitìj¹ích molekul je víc prázdného prostoru 34/42 Vysvìtlené mechanické vlastnosti velká viskozita: sí» vazeb brání pohybu vrstev kapaliny 38/42 sní¾ení viskozity s tlakem: poru¹í se systém vodíkových vazeb (molekuly se natlaèí do prázdných míst) malá stlaèitelnost: tuhá sí» (i kdy¾ mezi molekulami je hodnì místa { ale pro nízké teploty se zvy¹uje) a to v¹e se zvýrazní pro nízké teploty Samoopakující se struktury 35/42 Entropie [traj/ice.sh] 39/42 entropie ledu [Speedy, 984] zákrytové tetramery støídavé tetramery po pøidání inertních látek i iontù má okolo ménì mo¾ností, jak tvoøit vodíkové vazby { pevné þledovceÿ sni¾ují entropii Samoopakující se struktury 36/42 Podchlazená vìt¹ina molekul má 4 vodíkové vazby mnoho pìtiúhelníkù o nìco ménì ¹estiúhelníkù (polo)pravidelné mnohostìny [/home/jiri/tex/talks/water/show/frozendrop.sh] 4/42 Máme zákrytový tetramer bude nejspí¹ v pìtiúhelníku (úhel 8 ) Máme pìtiúhelník mnoho zákrytových tetramerù U pìtiúhelníkù jsou dutiny Máme støídavý tetramer bude nejspí¹ v ¹estiúhelníku...
6 Tvar de¹»ové kapky 4/42 Moderní meteorologické radary s duální polarizací umo¾òují rozli¹it anizotropní kapky od v prùmìru izotropních krup. credit: Wikipedia The End 42/42
Struktura a neobvyklé vlastnosti vody
 5/46 Regelace ledu VYSOKÁ ŠKOLA CHEMICKO-TECHNOLOGICKÁ Ústav fyzikální chemie Struktura a neobvyklé vlastnosti vody t= Jiøí Kolafa (ad Qtání )2ρled λmgttání ρled ρ t = èas λ = tepelná vodivost drátu m
5/46 Regelace ledu VYSOKÁ ŠKOLA CHEMICKO-TECHNOLOGICKÁ Ústav fyzikální chemie Struktura a neobvyklé vlastnosti vody t= Jiøí Kolafa (ad Qtání )2ρled λmgttání ρled ρ t = èas λ = tepelná vodivost drátu m
Struktura a neobvyklé vlastnosti vody
 VYSOKÁ ŠKOLA CHEMICKO-TECHNOLOGICKÁ Ústav fyzikální chemie Struktura a neobvyklé vlastnosti vody Pøehled anomálií Mpembùv jev Jiøí Kolafa jiri.kolafa@vscht.cz Co je a jak se stanovuje struktura Vysvìtlené
VYSOKÁ ŠKOLA CHEMICKO-TECHNOLOGICKÁ Ústav fyzikální chemie Struktura a neobvyklé vlastnosti vody Pøehled anomálií Mpembùv jev Jiøí Kolafa jiri.kolafa@vscht.cz Co je a jak se stanovuje struktura Vysvìtlené
Struktura a neobvyklé vlastnosti vody
 VYSOKÁ KOLA CHEMICKO-TECHNOLOGICKÁ Ústav fyzikální chemie Struktura a neobvyklé vlastnosti vody Přehled anomálií Mpembův jev Jiří Kolafa jiri.kolafa@vscht.cz Co je a jak se stanovuje struktura Vysvětlené
VYSOKÁ KOLA CHEMICKO-TECHNOLOGICKÁ Ústav fyzikální chemie Struktura a neobvyklé vlastnosti vody Přehled anomálií Mpembův jev Jiří Kolafa jiri.kolafa@vscht.cz Co je a jak se stanovuje struktura Vysvětlené
Rovnováha kapalina{pára u binárních systémù
 Rovnováha kapalina{pára u binárních systémù 1 Pøedpoklad: 1 kapalná fáze Oznaèení: molární zlomky v kapalné fázi: x i molární zlomky v plynné fázi: y i Poèet stupòù volnosti: v = k f + 2 = 2 stav smìsi
Rovnováha kapalina{pára u binárních systémù 1 Pøedpoklad: 1 kapalná fáze Oznaèení: molární zlomky v kapalné fázi: x i molární zlomky v plynné fázi: y i Poèet stupòù volnosti: v = k f + 2 = 2 stav smìsi
Stanislav Labík. Ústav fyzikální chemie V CHT Praha budova A, 3. patro u zadního vchodu, místnost
 Stanislav Labík Ústav fyzikální chemie V CHT Praha budova A, 3. patro u zadního vchodu, místnost 325 labik@vscht.cz 220 444 257 http://www.vscht.cz/fch/ Výuka Letní semestr N403032 Základy fyzikální chemie
Stanislav Labík Ústav fyzikální chemie V CHT Praha budova A, 3. patro u zadního vchodu, místnost 325 labik@vscht.cz 220 444 257 http://www.vscht.cz/fch/ Výuka Letní semestr N403032 Základy fyzikální chemie
Tepelná vodivost. střední rychlost. T 1 > T 2 z. teplo přenesené za čas dt: T 1 T 2. tepelný tok střední volná dráha. součinitel tepelné vodivosti
 Tepelná vodivost teplo přenesené za čas dt: T 1 > T z T 1 S tepelný tok střední volná dráha T součinitel tepelné vodivosti střední rychlost Tepelná vodivost součinitel tepelné vodivosti při T = 300 K součinitel
Tepelná vodivost teplo přenesené za čas dt: T 1 > T z T 1 S tepelný tok střední volná dráha T součinitel tepelné vodivosti střední rychlost Tepelná vodivost součinitel tepelné vodivosti při T = 300 K součinitel
Skupenské stavy. Kapalina Částečně neuspořádané Volný pohyb částic nebo skupin částic Částice blíže u sebe
 Skupenské stavy Plyn Zcela neuspořádané Hodně volného prostoru Zcela volný pohyb částic Částice daleko od sebe Kapalina Částečně neuspořádané Volný pohyb částic nebo skupin částic Částice blíže u sebe
Skupenské stavy Plyn Zcela neuspořádané Hodně volného prostoru Zcela volný pohyb částic Částice daleko od sebe Kapalina Částečně neuspořádané Volný pohyb částic nebo skupin částic Částice blíže u sebe
Viriálová stavová rovnice 1 + s.1
 Viriálová stavová rovnice 1 + s.1 (Mírnì nestandardní odvození Prùmìrná energie molekul okolo vybrané molekuly (β = 1/(k B T : 0 u(r e βu(r 4πr 2 dr Energie souboru N molekul: U = f 2 k B T + N 2 2V Tlak
Viriálová stavová rovnice 1 + s.1 (Mírnì nestandardní odvození Prùmìrná energie molekul okolo vybrané molekuly (β = 1/(k B T : 0 u(r e βu(r 4πr 2 dr Energie souboru N molekul: U = f 2 k B T + N 2 2V Tlak
Termochemie { práce. Práce: W = s F nebo W = F ds. Objemová práce (p vn = vnìj¹í tlak): W = p vn dv. Vratný dìj: p = p vn (ze stavové rovnice) W =
 Termochemie { práce Práce: W = s F nebo W = Objemová práce (p vn = vnìj¹í tlak): W = V2 V 1 p vn dv s2 Vratný dìj: p = p vn (ze stavové rovnice) W = V2 V 1 p dv s 1 F ds s.1 Diferenciální tvar: dw = pdv
Termochemie { práce Práce: W = s F nebo W = Objemová práce (p vn = vnìj¹í tlak): W = V2 V 1 p vn dv s2 Vratný dìj: p = p vn (ze stavové rovnice) W = V2 V 1 p dv s 1 F ds s.1 Diferenciální tvar: dw = pdv
Skupenské stavy látek. Mezimolekulární síly
 Skupenské stavy látek Mezimolekulární síly 1 Interakce iont-dipól Např. hydratační (solvatační) interakce mezi Na + (iont) a molekulou vody (dipól). Jde o nejsilnější mezimolekulární (nevazebnou) interakci.
Skupenské stavy látek Mezimolekulární síly 1 Interakce iont-dipól Např. hydratační (solvatační) interakce mezi Na + (iont) a molekulou vody (dipól). Jde o nejsilnější mezimolekulární (nevazebnou) interakci.
Opakování
 Slabé vazebné interakce Opakování Co je to atom? Opakování Opakování Co je to atom? Atom je nejmenší částice hmoty, chemicky dále nedělitelná. Skládá se z atomového jádra obsahujícího protony a neutrony
Slabé vazebné interakce Opakování Co je to atom? Opakování Opakování Co je to atom? Atom je nejmenší částice hmoty, chemicky dále nedělitelná. Skládá se z atomového jádra obsahujícího protony a neutrony
Fyzikální chemie. Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302. 14. února 2013
 Fyzikální chemie Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302 14. února 2013 Co je fyzikální chemie? Co je fyzikální chemie? makroskopický přístup: (klasická) termodynamika nerovnovážná
Fyzikální chemie Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302 14. února 2013 Co je fyzikální chemie? Co je fyzikální chemie? makroskopický přístup: (klasická) termodynamika nerovnovážná
U218 - Ústav procesní a zpracovatelské techniky FS ČVUT v Praze. ! t 2 :! Stacionární děj, bez vnitřního zdroje, se zanedbatelnou viskózní disipací
 VII. cená konvekce Fourier Kirchhoffova rovnice T!! ρ c p + ρ c p u T λ T + µ d t :! (g d + Q" ) (VII 1) Stacionární děj bez vnitřního zdroje se zanedbatelnou viskózní disipací! (VII ) ρ c p u T λ T 1.
VII. cená konvekce Fourier Kirchhoffova rovnice T!! ρ c p + ρ c p u T λ T + µ d t :! (g d + Q" ) (VII 1) Stacionární děj bez vnitřního zdroje se zanedbatelnou viskózní disipací! (VII ) ρ c p u T λ T 1.
Do známky zkoušky rovnocenným podílem započítávají získané body ze zápočtového testu.
 Podmínky pro získání zápočtu a zkoušky z předmětu Chemicko-inženýrská termodynamika pro zpracování ropy Zápočet je udělen, pokud student splní zápočtový test alespoň na 50 %. Zápočtový test obsahuje 3
Podmínky pro získání zápočtu a zkoušky z předmětu Chemicko-inženýrská termodynamika pro zpracování ropy Zápočet je udělen, pokud student splní zápočtový test alespoň na 50 %. Zápočtový test obsahuje 3
Nekovalentní interakce
 Nekovalentní interakce Jan Řezáč UOCHB AV ČR 31. října 2017 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 31. října 2017 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii 4 Výpočty
Nekovalentní interakce Jan Řezáč UOCHB AV ČR 31. října 2017 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 31. října 2017 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii 4 Výpočty
Klasická termodynamika (aneb pøehled FCH I)
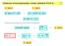 Klasická termodynamika (aneb pøehled FCH I) 1/16 0. zákon 1. zákon id. plyn: pv = nrt pv κ = konst (id., ad.) id. plyn: U = U(T) }{{} Carnotùv cyklus dq T = 0 2. zákon rg, K,... lim S = 0 T 0 S, ds = dq
Klasická termodynamika (aneb pøehled FCH I) 1/16 0. zákon 1. zákon id. plyn: pv = nrt pv κ = konst (id., ad.) id. plyn: U = U(T) }{{} Carnotùv cyklus dq T = 0 2. zákon rg, K,... lim S = 0 T 0 S, ds = dq
POKYNY VLASTNOSTI LÁTEK
 POKYNY vypracuj postupně zadané úkoly, které ti pomohou získat základní informace o vlastnostech látek tyto informace pak použij na závěr při vypracování testu zkontroluj si správné řešení úkolů a odpovědi
POKYNY vypracuj postupně zadané úkoly, které ti pomohou získat základní informace o vlastnostech látek tyto informace pak použij na závěr při vypracování testu zkontroluj si správné řešení úkolů a odpovědi
Fyzikální chemie. ochrana životního prostředí analytická chemie chemická technologie denní. Platnost: od 1. 9. 2009 do 31. 8. 2013
 Učební osnova předmětu Fyzikální chemie Studijní obor: Aplikovaná chemie Zaměření: Forma vzdělávání: Celkový počet vyučovacích hodin za studium: Analytická chemie Chemická technologie Ochrana životního
Učební osnova předmětu Fyzikální chemie Studijní obor: Aplikovaná chemie Zaměření: Forma vzdělávání: Celkový počet vyučovacích hodin za studium: Analytická chemie Chemická technologie Ochrana životního
Zadání příkladů řešených na výpočetních cvičeních z Fyzikální chemie I, obor CHTP. Termodynamika. Příklad 10
 Zadání příkladů řešených na výpočetních cvičeních z Fyzikální chemie I, obor CHTP Termodynamika Příklad 1 Stláčením ideálního plynu na 2/3 původního objemu vzrostl při stálé teplotě jeho tlak na 15 kpa.
Zadání příkladů řešených na výpočetních cvičeních z Fyzikální chemie I, obor CHTP Termodynamika Příklad 1 Stláčením ideálního plynu na 2/3 původního objemu vzrostl při stálé teplotě jeho tlak na 15 kpa.
Kapaliny Molekulové vdw síly, vodíkové můstky
 Kapaliny Molekulové vdw síly, vodíkové můstky Metalické roztavené kovy, ionty + elektrony, elektrostatické síly Iontové roztavené soli, FLINAK (LiF + NaF + KF), volně pohyblivé anionty a kationty, iontová
Kapaliny Molekulové vdw síly, vodíkové můstky Metalické roztavené kovy, ionty + elektrony, elektrostatické síly Iontové roztavené soli, FLINAK (LiF + NaF + KF), volně pohyblivé anionty a kationty, iontová
Termomechanika 9. přednáška Doc. Dr. RNDr. Miroslav Holeček
 Termomechanika 9. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Termomechanika 9. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Kapaliny Molekulové vdw síly, vodíkové můstky
 Kapaliny Molekulové vdw síly, vodíkové můstky Metalické roztavené kovy, ionty + elektrony, elektrostatické síly Iontové roztavené soli, FLINAK (LiF + NaF + KF), volně pohyblivé anionty a kationty, iontová
Kapaliny Molekulové vdw síly, vodíkové můstky Metalické roztavené kovy, ionty + elektrony, elektrostatické síly Iontové roztavené soli, FLINAK (LiF + NaF + KF), volně pohyblivé anionty a kationty, iontová
Nekovalentní interakce
 Nekovalentní interakce Jan Řezáč UOCHB AV ČR 3. listopadu 2016 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 3. listopadu 2016 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii
Nekovalentní interakce Jan Řezáč UOCHB AV ČR 3. listopadu 2016 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 3. listopadu 2016 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii
Termodynamika 2. UJOP Hostivař 2014
 Termodynamika 2 UJOP Hostivař 2014 Skupenské teplo tání/tuhnutí je (celkové) teplo, které přijme pevná látka při přechodu na kapalinu během tání nebo naopak Značka Veličina Lt J Nedochází při něm ke změně
Termodynamika 2 UJOP Hostivař 2014 Skupenské teplo tání/tuhnutí je (celkové) teplo, které přijme pevná látka při přechodu na kapalinu během tání nebo naopak Značka Veličina Lt J Nedochází při něm ke změně
Mezimolekulové interakce
 Mezimolekulové interakce Interakce molekul reaktivně vzniká či zaniká kovalentní vazba překryv elektronových oblaků, mění se vlastnosti nereaktivně vznikají molekulové komplexy slabá, nekovalentní, nechemická,
Mezimolekulové interakce Interakce molekul reaktivně vzniká či zaniká kovalentní vazba překryv elektronových oblaků, mění se vlastnosti nereaktivně vznikají molekulové komplexy slabá, nekovalentní, nechemická,
Kontrolní otázky k 1. přednášce z TM
 Kontrolní otázky k 1. přednášce z TM 1. Jak závisí hodnota izobarického součinitele objemové roztažnosti ideálního plynu na teplotě a jak na tlaku? Odvoďte. 2. Jak závisí hodnota izochorického součinitele
Kontrolní otázky k 1. přednášce z TM 1. Jak závisí hodnota izobarického součinitele objemové roztažnosti ideálního plynu na teplotě a jak na tlaku? Odvoďte. 2. Jak závisí hodnota izochorického součinitele
PROCESY V TECHNICE BUDOV 8
 UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY PROCESY V TECHNICE BUDOV 8 Dagmar Janáčová, Hana Charvátová Zlín 2013 Tento studijní materiál vznikl za finanční podpory Evropského sociálního
UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY PROCESY V TECHNICE BUDOV 8 Dagmar Janáčová, Hana Charvátová Zlín 2013 Tento studijní materiál vznikl za finanční podpory Evropského sociálního
Základem molekulové fyziky je kinetická teorie látek. Vychází ze tří pouček:
 Molekulová fyzika zkoumá vlastnosti látek na základě jejich vnitřní struktury, pohybu a vzájemného působení částic, ze kterých se látky skládají. Termodynamika se zabývá zákony přeměny různých forem energie
Molekulová fyzika zkoumá vlastnosti látek na základě jejich vnitřní struktury, pohybu a vzájemného působení částic, ze kterých se látky skládají. Termodynamika se zabývá zákony přeměny různých forem energie
3 VODA SLOUČENINA PLNÁ PŘEKVAPENÍ
 3 VODA SLOUČENINA PLNÁ PŘEKVAPENÍ Voda (H 2 O) je sloučenina klíčová pro život na naší planetě; třebaže velmi jednoduchá, patří k těm, jejichž výzkum není zdaleka ukončen. Molekula tvořená pouhými třemi
3 VODA SLOUČENINA PLNÁ PŘEKVAPENÍ Voda (H 2 O) je sloučenina klíčová pro život na naší planetě; třebaže velmi jednoduchá, patří k těm, jejichž výzkum není zdaleka ukončen. Molekula tvořená pouhými třemi
Úvodní info. Studium
 [mozilla le:/home/jiri/www/fch/cz/pomucky/kolafa/n4316.html] 1/16 Úvodní info Jiøí Kolafa Ústav fyzikální chemie V CHT Praha budova A, místnost 325 (zadním vchodem) jiri.kolafa@vscht.cz 2244 4257 Web pøedmìtu:
[mozilla le:/home/jiri/www/fch/cz/pomucky/kolafa/n4316.html] 1/16 Úvodní info Jiøí Kolafa Ústav fyzikální chemie V CHT Praha budova A, místnost 325 (zadním vchodem) jiri.kolafa@vscht.cz 2244 4257 Web pøedmìtu:
a) Jaká je hodnota polytropického exponentu? ( 1,5257 )
 Ponorka se potopí do 50 m. Na dně ponorky je výstupní tunel o průměru 70 cm a délce, m. Tunel je napojen na uzavřenou komoru o objemu 4 m. Po otevření vnějšího poklopu vnikne z části voda tunelem do komory.
Ponorka se potopí do 50 m. Na dně ponorky je výstupní tunel o průměru 70 cm a délce, m. Tunel je napojen na uzavřenou komoru o objemu 4 m. Po otevření vnějšího poklopu vnikne z části voda tunelem do komory.
Molekulární dynamika vody a alkoholů
 Molekulární dynamika vody a alkoholů Pavel Petrus Katedra fyziky, Univerzita J. E. Purkyně, Ústí nad Labem 10. týden 22.4.2010 Modely vody SPC SPC/E TIP4P TIP5P Modely alkoholů OPLS TraPPE Radiální distribuční
Molekulární dynamika vody a alkoholů Pavel Petrus Katedra fyziky, Univerzita J. E. Purkyně, Ústí nad Labem 10. týden 22.4.2010 Modely vody SPC SPC/E TIP4P TIP5P Modely alkoholů OPLS TraPPE Radiální distribuční
Plyn. 11 plynných prvků. Vzácné plyny. He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2
 Plyny Plyn T v, K Vzácné plyny 11 plynných prvků He, Ne, Ar, Kr, Xe, Rn 165 Rn 211 N 2 O 2 77 F 2 90 85 Diatomické plynné prvky Cl 2 238 H 2, N 2, O 2, F 2, Cl 2 H 2 He Ne Ar Kr Xe 20 4.4 27 87 120 1 Plyn
Plyny Plyn T v, K Vzácné plyny 11 plynných prvků He, Ne, Ar, Kr, Xe, Rn 165 Rn 211 N 2 O 2 77 F 2 90 85 Diatomické plynné prvky Cl 2 238 H 2, N 2, O 2, F 2, Cl 2 H 2 He Ne Ar Kr Xe 20 4.4 27 87 120 1 Plyn
Termomechanika 8. přednáška Doc. Dr. RNDr. Miroslav Holeček
 Termomechanika 8. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Termomechanika 8. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Opakování: Standardní stav þ ÿ
 Opakování: Standardní stav þ ÿ s.1 12. øíjna 215 Standardní stav þ ÿ = èistá slo¾ka ve stavu ideálního plynu za teploty soustavy T a standardního tlaku = 1 kpa, døíve 11,325 kpa. Èistá látka: Pøibli¾nì:
Opakování: Standardní stav þ ÿ s.1 12. øíjna 215 Standardní stav þ ÿ = èistá slo¾ka ve stavu ideálního plynu za teploty soustavy T a standardního tlaku = 1 kpa, døíve 11,325 kpa. Èistá látka: Pøibli¾nì:
Fyzika (učitelství) Zkouška - teoretická fyzika. Čas k řešení je 120 minut (6 minut na úlohu): snažte se nejprve rychle vyřešit ty nejsnazší úlohy,
 Státní bakalářská zkouška. 9. 05 Fyzika (učitelství) Zkouška - teoretická fyzika (test s řešením) Jméno: Pokyny k řešení testu: Ke každé úloze je správně pouze jedna odpověď. Čas k řešení je 0 minut (6
Státní bakalářská zkouška. 9. 05 Fyzika (učitelství) Zkouška - teoretická fyzika (test s řešením) Jméno: Pokyny k řešení testu: Ke každé úloze je správně pouze jedna odpověď. Čas k řešení je 0 minut (6
UČIVO. Termodynamická teplota. První termodynamický zákon Přenos vnitřní energie
 PŘEDMĚT: FYZIKA ROČNÍK: SEXTA VÝSTUP UČIVO MEZIPŘEDM. VZTAHY, PRŮŘEZOVÁ TÉMATA, PROJEKTY, KURZY POZNÁMKY Zná 3 základní poznatky kinetické teorie látek a vysvětlí jejich praktický význam Vysvětlí pojmy
PŘEDMĚT: FYZIKA ROČNÍK: SEXTA VÝSTUP UČIVO MEZIPŘEDM. VZTAHY, PRŮŘEZOVÁ TÉMATA, PROJEKTY, KURZY POZNÁMKY Zná 3 základní poznatky kinetické teorie látek a vysvětlí jejich praktický význam Vysvětlí pojmy
Plyn. 11 plynných prvků. Vzácné plyny. He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2
 Plyny Plyn T v, K Vzácné plyny 11 plynných prvků He, Ne, Ar, Kr, Xe, Rn 165 Rn 211 N 2 O 2 77 F 2 90 85 Diatomické plynné prvky Cl 2 238 H 2, N 2, O 2, F 2, Cl 2 H 2 He Ne Ar Kr Xe 20 4.4 27 87 120 1 Plyn
Plyny Plyn T v, K Vzácné plyny 11 plynných prvků He, Ne, Ar, Kr, Xe, Rn 165 Rn 211 N 2 O 2 77 F 2 90 85 Diatomické plynné prvky Cl 2 238 H 2, N 2, O 2, F 2, Cl 2 H 2 He Ne Ar Kr Xe 20 4.4 27 87 120 1 Plyn
Mol. fyz. a termodynamika
 Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Teorie Pøíèné vlny se ¹íøí v napjaté strunì pøibli¾nì rychlostí. v =
 24. roèník, úloha V. E... strunatci (8 bodù; prùmìr 4,80; øe¹ilo 5 studentù) Vytvoøte si zaøízení, na kterém bude moci být upevnìna struna (èi gumièka) s promìnlivou délkou tak, ¾e bude napínána stále
24. roèník, úloha V. E... strunatci (8 bodù; prùmìr 4,80; øe¹ilo 5 studentù) Vytvoøte si zaøízení, na kterém bude moci být upevnìna struna (èi gumièka) s promìnlivou délkou tak, ¾e bude napínána stále
U218 Ústav procesní a zpracovatelské techniky FS ČVUT v Praze. Seminář z PHTH. 3. ročník. Fakulta strojní ČVUT v Praze
 Seminář z PHTH 3. ročník Fakulta strojní ČVUT v Praze U218 - Ústav procesní a zpracovatelské techniky 1 Přenos tepla 2 Mechanismy přenosu tepla Vedení (kondukce) Fourierův zákon homogenní izotropní prostředí
Seminář z PHTH 3. ročník Fakulta strojní ČVUT v Praze U218 - Ústav procesní a zpracovatelské techniky 1 Přenos tepla 2 Mechanismy přenosu tepla Vedení (kondukce) Fourierův zákon homogenní izotropní prostředí
Teplota a její měření
 Teplota a její měření Teplota a její měření Číslo DUM v digitálním archivu školy VY_32_INOVACE_07_03_01 Teplota, Celsiova a Kelvinova teplotní stupnice, převodní vztahy, příklady. Tepelná výměna, měrná
Teplota a její měření Teplota a její měření Číslo DUM v digitálním archivu školy VY_32_INOVACE_07_03_01 Teplota, Celsiova a Kelvinova teplotní stupnice, převodní vztahy, příklady. Tepelná výměna, měrná
Matematika II Aplikace derivací
 Matematika II Aplikace derivací RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Derivace slo¾ené funkce Vìta o derivaci slo¾ené funkce.
Matematika II Aplikace derivací RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Derivace slo¾ené funkce Vìta o derivaci slo¾ené funkce.
5.4 Adiabatický děj Polytropický děj Porovnání dějů Základy tepelných cyklů První zákon termodynamiky pro cykly 42 6.
 OBSAH Předmluva 9 I. ZÁKLADY TERMODYNAMIKY 10 1. Základní pojmy 10 1.1 Termodynamická soustava 10 1.2 Energie, teplo, práce 10 1.3 Stavy látek 11 1.4 Veličiny popisující stavy látek 12 1.5 Úlohy technické
OBSAH Předmluva 9 I. ZÁKLADY TERMODYNAMIKY 10 1. Základní pojmy 10 1.1 Termodynamická soustava 10 1.2 Energie, teplo, práce 10 1.3 Stavy látek 11 1.4 Veličiny popisující stavy látek 12 1.5 Úlohy technické
TERMOMECHANIKA 15. Základy přenosu tepla
 FSI VUT v Brně, Energetický ústav Odbor termomechaniky a techniky prostředí Prof. Ing. Milan Pavelek, CSc. TERMOMECHANIKA 15. Základy přenosu tepla OSNOVA 15. KAPITOLY Tři mechanizmy přenosu tepla Tepelný
FSI VUT v Brně, Energetický ústav Odbor termomechaniky a techniky prostředí Prof. Ing. Milan Pavelek, CSc. TERMOMECHANIKA 15. Základy přenosu tepla OSNOVA 15. KAPITOLY Tři mechanizmy přenosu tepla Tepelný
Fázová rozhraní a mezifázová energie
 Fázová rozhraní a mezifázová energie druhy: l/g l/l }{{} mobilní s/g s/l s/s 1/14 Pøíklad. Kolik % molekul vody je na povrchu kapièky mlhy o prùmìru a) 0.1 mm (hranice viditelnosti okem) b) 200 nm (hranice
Fázová rozhraní a mezifázová energie druhy: l/g l/l }{{} mobilní s/g s/l s/s 1/14 Pøíklad. Kolik % molekul vody je na povrchu kapièky mlhy o prùmìru a) 0.1 mm (hranice viditelnosti okem) b) 200 nm (hranice
VYBRANÉ STATĚ Z PROCESNÍHO INŢENÝRSTVÍ cvičení 12
 UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY VYBRANÉ STATĚ Z PROCESNÍHO INŢENÝRSTVÍ cvičení 2 Termodynamika reálných plynů část 2 Hana Charvátová, Dagmar Janáčová Zlín 203 Tento studijní
UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY VYBRANÉ STATĚ Z PROCESNÍHO INŢENÝRSTVÍ cvičení 2 Termodynamika reálných plynů část 2 Hana Charvátová, Dagmar Janáčová Zlín 203 Tento studijní
Fyzikální chemie Úvod do studia, základní pojmy
 Fyzikální chemie Úvod do studia, základní pojmy HMOTA A JEJÍ VLASTNOSTI POSTAVENÍ FYZIKÁLNÍ CHEMIE V PŘÍRODNÍCH VĚDÁCH HISTORIE FYZIKÁLNÍ CHEMIE ZÁKLADNÍ POJMY DEFINICE FORMY HMOTY Formy a nositelé hmoty
Fyzikální chemie Úvod do studia, základní pojmy HMOTA A JEJÍ VLASTNOSTI POSTAVENÍ FYZIKÁLNÍ CHEMIE V PŘÍRODNÍCH VĚDÁCH HISTORIE FYZIKÁLNÍ CHEMIE ZÁKLADNÍ POJMY DEFINICE FORMY HMOTY Formy a nositelé hmoty
2.4 Stavové chování směsí plynů Ideální směs Ideální směs reálných plynů Stavové rovnice pro plynné směsi
 1. ZÁKLADNÍ POJMY 1.1 Systém a okolí 1.2 Vlastnosti systému 1.3 Vybrané základní veličiny 1.3.1 Množství 1.3.2 Délka 1.3.2 Délka 1.4 Vybrané odvozené veličiny 1.4.1 Objem 1.4.2 Hustota 1.4.3 Tlak 1.4.4
1. ZÁKLADNÍ POJMY 1.1 Systém a okolí 1.2 Vlastnosti systému 1.3 Vybrané základní veličiny 1.3.1 Množství 1.3.2 Délka 1.3.2 Délka 1.4 Vybrané odvozené veličiny 1.4.1 Objem 1.4.2 Hustota 1.4.3 Tlak 1.4.4
Termomechanika 6. přednáška Doc. Dr. RNDr. Miroslav Holeček
 Termomechanika 6. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Termomechanika 6. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Maturitní témata fyzika
 Maturitní témata fyzika 1. Kinematika pohybů hmotného bodu - mechanický pohyb a jeho sledování, trajektorie, dráha - rychlost hmotného bodu - rovnoměrný pohyb - zrychlení hmotného bodu - rovnoměrně zrychlený
Maturitní témata fyzika 1. Kinematika pohybů hmotného bodu - mechanický pohyb a jeho sledování, trajektorie, dráha - rychlost hmotného bodu - rovnoměrný pohyb - zrychlení hmotného bodu - rovnoměrně zrychlený
Matematika II Urèitý integrál
 Matematika II Urèitý integrál RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Motivace Je dána funkce f(x) = 2 + x2 x 4. Urèete co
Matematika II Urèitý integrál RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Motivace Je dána funkce f(x) = 2 + x2 x 4. Urèete co
MEMBRÁNY AMPEROMETRICKÝCH SENSORŮ
 MEMBRÁNY AMPEROMETRICKÝCH SENSORŮ Literatura: Petr Skládal: Biosensory (elektronická verze) Zajoncová L. Pospíšková K.(2009) Membrány Amperometrických biosensorů. Chem. Listy Belluzo 2008 upravila Pospošková
MEMBRÁNY AMPEROMETRICKÝCH SENSORŮ Literatura: Petr Skládal: Biosensory (elektronická verze) Zajoncová L. Pospíšková K.(2009) Membrány Amperometrických biosensorů. Chem. Listy Belluzo 2008 upravila Pospošková
Molekulární simulace iontových kapalin
 INSTITUTE OF CHEMICAL TECHNOLOGY, PRAGUE Department of Physical Chemistry Molekulární simulace iontových kapalin Jiøí Kolafa jiri.kolafa@vscht.cz www.vscht.cz/fch/cz/lide/jiri.kolafa.html tato pøedná¹ka:
INSTITUTE OF CHEMICAL TECHNOLOGY, PRAGUE Department of Physical Chemistry Molekulární simulace iontových kapalin Jiøí Kolafa jiri.kolafa@vscht.cz www.vscht.cz/fch/cz/lide/jiri.kolafa.html tato pøedná¹ka:
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Seminář chemie (SCH) Náplň: Obecná chemie, anorganická chemie, chemické výpočty, základy analytické chemie Třída: 3. ročník a septima Počet hodin: 2 hodiny týdně Pomůcky: Vybavení odborné učebny,
Předmět: Seminář chemie (SCH) Náplň: Obecná chemie, anorganická chemie, chemické výpočty, základy analytické chemie Třída: 3. ročník a septima Počet hodin: 2 hodiny týdně Pomůcky: Vybavení odborné učebny,
6. Jaký je výkon vařiče, který ohřeje 1 l vody o 40 C během 5 minut? Měrná tepelná kapacita vody je W)
 TEPLO 1. Na udržení stále teploty v místnosti se za hodinu spotřebuje 4,2 10 6 J tepla. olik vody proteče radiátorem ústředního topení za hodinu, jestliže má voda při vstupu do radiátoru teplotu 80 ºC
TEPLO 1. Na udržení stále teploty v místnosti se za hodinu spotřebuje 4,2 10 6 J tepla. olik vody proteče radiátorem ústředního topení za hodinu, jestliže má voda při vstupu do radiátoru teplotu 80 ºC
Plyn. 11 plynných prvků. Vzácné plyny He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2
 Plyny Plyn T v, K 11 plynných prvků Vzácné plyny He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2 H 2 20 He 4.4 Ne 27 Ar 87 Kr 120 Xe 165 Rn 211 N 2 77 O 2 90 F 2 85 Cl 2 238 1 Plyn
Plyny Plyn T v, K 11 plynných prvků Vzácné plyny He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2 H 2 20 He 4.4 Ne 27 Ar 87 Kr 120 Xe 165 Rn 211 N 2 77 O 2 90 F 2 85 Cl 2 238 1 Plyn
TEPELNÉ JEVY. Mgr. Jan Ptáčník - GJVJ - Fyzika - Tercie
 TEPELNÉ JEVY Mgr. Jan Ptáčník - GJVJ - Fyzika - Tercie Vnitřní energie tělesa Každé těleso se skládá z látek. Látky se skládají z částic. neustálý neuspořádaný pohyb kinetická energie vzájemné působení
TEPELNÉ JEVY Mgr. Jan Ptáčník - GJVJ - Fyzika - Tercie Vnitřní energie tělesa Každé těleso se skládá z látek. Látky se skládají z částic. neustálý neuspořádaný pohyb kinetická energie vzájemné působení
Přehled základních fyzikálních veličin užívaných ve výpočtech v termomechanice. Autor Ing. Jan BRANDA Jazyk Čeština
 Identifikátor materiálu: ICT 2 41 Registrační číslo projektu CZ.1.07/1.5.00/34.0796 Název projektu Vzděláváme pro život Název příjemce podpory SOU plynárenské Pardubice název materiálu (DUM) Mechanika
Identifikátor materiálu: ICT 2 41 Registrační číslo projektu CZ.1.07/1.5.00/34.0796 Název projektu Vzděláváme pro život Název příjemce podpory SOU plynárenské Pardubice název materiálu (DUM) Mechanika
Třídění látek. Chemie 1.KŠPA
 Třídění látek Chemie 1.KŠPA Systém (soustava) Vymezím si kus prostoru, látky v něm obsažené nazýváme systém soustava okolí svět Stěny soustavy Soustava může být: Izolovaná = stěny nedovolí výměnu částic
Třídění látek Chemie 1.KŠPA Systém (soustava) Vymezím si kus prostoru, látky v něm obsažené nazýváme systém soustava okolí svět Stěny soustavy Soustava může být: Izolovaná = stěny nedovolí výměnu částic
TERMOMECHANIKA 1. Základní pojmy
 1 FSI VUT v Brně, Energetický ústav Odbor termomechaniky a techniky prostředí prof. Ing. Milan Pavelek, CSc. TERMOMECHANIKA 1. Základní pojmy OSNOVA 1. KAPITOLY Termodynamická soustava Energie, teplo,
1 FSI VUT v Brně, Energetický ústav Odbor termomechaniky a techniky prostředí prof. Ing. Milan Pavelek, CSc. TERMOMECHANIKA 1. Základní pojmy OSNOVA 1. KAPITOLY Termodynamická soustava Energie, teplo,
Řešení: Fázový diagram vody
 Řešení: 1) Menší hustota ledu v souladu s Archimédovým zákonem zapříčiňuje plování jedu ve vodě. Vodní nádrže a toky tudíž zamrzají shora (od hladiny). Kdyby hustota ledu byla větší než hustota vody, docházelo
Řešení: 1) Menší hustota ledu v souladu s Archimédovým zákonem zapříčiňuje plování jedu ve vodě. Vodní nádrže a toky tudíž zamrzají shora (od hladiny). Kdyby hustota ledu byla větší než hustota vody, docházelo
POŽADAVKY KE STÁTNÍ ZÁVĚREČNÉ ZKOUŠCE MAGISTERSKÉ STUDIUM POČÍTAČOVÉ MODELOVÁNÍ VE VĚDĚ A TECHNICE (NAVAZUJÍCÍ STUDIUM I DOBÍHAJÍCÍ 5-LETÉ STUDIUM)
 POŽADAVKY KE STÁTNÍ ZÁVĚREČNÉ ZKOUŠCE MAGISTERSKÉ STUDIUM POČÍTAČOVÉ MODELOVÁNÍ VE VĚDĚ A TECHNICE (NAVAZUJÍCÍ STUDIUM I DOBÍHAJÍCÍ 5-LETÉ STUDIUM) Organizace zkoušky Zkouška je ústní a má čtyři části:
POŽADAVKY KE STÁTNÍ ZÁVĚREČNÉ ZKOUŠCE MAGISTERSKÉ STUDIUM POČÍTAČOVÉ MODELOVÁNÍ VE VĚDĚ A TECHNICE (NAVAZUJÍCÍ STUDIUM I DOBÍHAJÍCÍ 5-LETÉ STUDIUM) Organizace zkoušky Zkouška je ústní a má čtyři části:
TRUBKA COBRAPEX S KYSLÍKOVOU BARIÉROU
 TRUBKA COBRAPEX S KYSLÍKOVOU BARIÉROU 2 TRUBKA COBRAPEX S KYSLÍK. BARIÉROU 2.1. TRUBKA COBRAPEX Trubka COBRAPEX s EVOH (ethylen vinyl alkohol) kyslíkovou bariérou z vysokohustotního polyethylenu síťovaného
TRUBKA COBRAPEX S KYSLÍKOVOU BARIÉROU 2 TRUBKA COBRAPEX S KYSLÍK. BARIÉROU 2.1. TRUBKA COBRAPEX Trubka COBRAPEX s EVOH (ethylen vinyl alkohol) kyslíkovou bariérou z vysokohustotního polyethylenu síťovaného
4. Kolmou tlakovou sílu působící v kapalině na libovolně orientovanou plochu S vyjádříme jako
 1. Pojem tekutiny je A) synonymem pojmu kapaliny B) pojmem označujícím souhrnně kapaliny a plyny C) synonymem pojmu plyny D) označením kapalin se zanedbatelnou viskozitou 2. Příčinou rozdílné tekutosti
1. Pojem tekutiny je A) synonymem pojmu kapaliny B) pojmem označujícím souhrnně kapaliny a plyny C) synonymem pojmu plyny D) označením kapalin se zanedbatelnou viskozitou 2. Příčinou rozdílné tekutosti
Fázové heterogenní rovnováhy Fáze = homogenní část soustavy, oddělná fyzickým rozhraním, na rozhraní se vlastnosti mění skokem
 Fázové heterogenní rovnováhy Fáze = homogenní část soustavy, oddělná fyzickým rozhraním, na rozhraní se vlastnosti mění skokem Rovnováha Tepelná - T všude stejná Mechanická - p všude stejný Chemická -
Fázové heterogenní rovnováhy Fáze = homogenní část soustavy, oddělná fyzickým rozhraním, na rozhraní se vlastnosti mění skokem Rovnováha Tepelná - T všude stejná Mechanická - p všude stejný Chemická -
Fyzika, maturitní okruhy (profilová část), školní rok 2014/2015 Gymnázium INTEGRA BRNO
 1. Jednotky a veličiny soustava SI odvozené jednotky násobky a díly jednotek skalární a vektorové fyzikální veličiny rozměrová analýza 2. Kinematika hmotného bodu základní pojmy kinematiky hmotného bodu
1. Jednotky a veličiny soustava SI odvozené jednotky násobky a díly jednotek skalární a vektorové fyzikální veličiny rozměrová analýza 2. Kinematika hmotného bodu základní pojmy kinematiky hmotného bodu
Struktura atomů a molekul
 Struktura atomů a molekul Obrazová příloha Michal Otyepka tento text byl vysázen systémem L A TEX2 ε ii Úvod Dokument obsahuje všechny obrázky tak, jak jsou uvedeny ve druhém vydání skript Struktura atomů
Struktura atomů a molekul Obrazová příloha Michal Otyepka tento text byl vysázen systémem L A TEX2 ε ii Úvod Dokument obsahuje všechny obrázky tak, jak jsou uvedeny ve druhém vydání skript Struktura atomů
Kapaliny Molekulové vdw síly, vodíkové můstky
 Kapaliny Molekulové vdw síly, vodíkové můstky Metalické roztavené kovy, ionty + elektrony, elektrostatické síly Iontové roztavené soli, FLINAK (LiF + NaF + KF), volně pohyblivé anionty a kationty, iontová
Kapaliny Molekulové vdw síly, vodíkové můstky Metalické roztavené kovy, ionty + elektrony, elektrostatické síly Iontové roztavené soli, FLINAK (LiF + NaF + KF), volně pohyblivé anionty a kationty, iontová
Veličiny- základní N A. Látkové množství je dáno podílem N částic v systému a Avogadrovy konstanty NA
 YCHS, XCHS I. Úvod: plán přednášek a cvičení, podmínky udělení zápočtu a zkoušky. Základní pojmy: jednotky a veličiny, základy chemie. Stavba atomu a chemická vazba. Skupenství látek, chemické reakce,
YCHS, XCHS I. Úvod: plán přednášek a cvičení, podmínky udělení zápočtu a zkoušky. Základní pojmy: jednotky a veličiny, základy chemie. Stavba atomu a chemická vazba. Skupenství látek, chemické reakce,
Metody využívající rentgenové záření. Rentgenografie, RTG prášková difrakce
 Metody využívající rentgenové záření Rentgenografie, RTG prášková difrakce 1 Rentgenovo záření 2 Rentgenovo záření X-Ray Elektromagnetické záření Ionizující záření 10 nm 1 pm Využívá se v lékařství a krystalografii.
Metody využívající rentgenové záření Rentgenografie, RTG prášková difrakce 1 Rentgenovo záření 2 Rentgenovo záření X-Ray Elektromagnetické záření Ionizující záření 10 nm 1 pm Využívá se v lékařství a krystalografii.
Příklady k zápočtu molekulová fyzika a termodynamika
 Příklady k zápočtu molekulová fyzika a termodynamika 1. Do vody o teplotě t 1 70 C a hmotnosti m 1 1 kg vhodíme kostku ledu o teplotě t 2 10 C a hmotnosti m 2 2 kg. Do soustavy vzápětí přilijeme další
Příklady k zápočtu molekulová fyzika a termodynamika 1. Do vody o teplotě t 1 70 C a hmotnosti m 1 1 kg vhodíme kostku ledu o teplotě t 2 10 C a hmotnosti m 2 2 kg. Do soustavy vzápětí přilijeme další
12. Struktura a vlastnosti pevných látek
 12. Struktura a vlastnosti pevných látek Osnova: 1. Látky krystalické a amorfní 2. Krystalová mřížka, příklady krystalových mřížek 3. Poruchy krystalových mřížek 4. Druhy vazeb mezi atomy 5. Deformace
12. Struktura a vlastnosti pevných látek Osnova: 1. Látky krystalické a amorfní 2. Krystalová mřížka, příklady krystalových mřížek 3. Poruchy krystalových mřížek 4. Druhy vazeb mezi atomy 5. Deformace
Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny
 Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny Hustota toku Zatím jsme studovali pouze soustavy, které byly v rovnovážném stavu není-li soustava v silovém poli, je hustota částic stejná
Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny Hustota toku Zatím jsme studovali pouze soustavy, které byly v rovnovážném stavu není-li soustava v silovém poli, je hustota částic stejná
PDWHULiO FS>-NJ ±. FS>NFDONJ ± ƒ& VW teur åhoh]r FtQ KOLQtN N HPtN. OHG DONRKRO ROHM FFD FFD SHWUROHM UWX YRGD Y]GXFK YRGQtSiUD KHOLXP
![PDWHULiO FS>-NJ ±. FS>NFDONJ ± ƒ& VW teur åhoh]r FtQ KOLQtN N HPtN. OHG DONRKRO ROHM FFD FFD SHWUROHM UWX YRGD Y]GXFK YRGQtSiUD KHOLXP PDWHULiO FS>-NJ ±. FS>NFDONJ ± ƒ& VW teur åhoh]r FtQ KOLQtN N HPtN. OHG DONRKRO ROHM FFD FFD SHWUROHM UWX YRGD Y]GXFK YRGQtSiUD KHOLXP](/thumbs/50/25995224.jpg) Vážení zákazníci, dovolujeme si Vás upozornit, že na tuto ukázku knihy se vztahují autorská práva, tzv. copyright. To znamená, že ukázka má sloužit výhradnì pro osobní potøebu potenciálního kupujícího
Vážení zákazníci, dovolujeme si Vás upozornit, že na tuto ukázku knihy se vztahují autorská práva, tzv. copyright. To znamená, že ukázka má sloužit výhradnì pro osobní potøebu potenciálního kupujícího
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie 1. ročník a kvinta 2 hodiny týdně Školní tabule, interaktivní tabule, tyčinkové a kalotové modely molekul, zpětný projektor, transparenty,
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie 1. ročník a kvinta 2 hodiny týdně Školní tabule, interaktivní tabule, tyčinkové a kalotové modely molekul, zpětný projektor, transparenty,
J., HÁJEK B., VOTINSKÝ J.
 Kontakty a materiály J. Šedlbauer e-mail: josef.sedlbauer@tul.cz tel.: 48-535-3375 informace a materiály k Obecné chemii: www.fp.tul.cz/kch/sedlbauer (odkaz na předmět) konzultace: úterý odpoledne nebo
Kontakty a materiály J. Šedlbauer e-mail: josef.sedlbauer@tul.cz tel.: 48-535-3375 informace a materiály k Obecné chemii: www.fp.tul.cz/kch/sedlbauer (odkaz na předmět) konzultace: úterý odpoledne nebo
2.3 CHEMICKÁ VAZBA. Molekula bílého fosforu P 4 a kyseliny sírové H 2 SO 4. Předpona piko p je dílčí jednotkou a udává velikost m.
 2.3 CHEMICKÁ VAZBA Spojováním dvou a více atomů vznikají molekuly. Jestliže dochází ke spojování výhradně atomů téhož chemického prvku, pak se jedná o molekuly daného prvku (vodíku H 2, dusíku N 2, ozonu
2.3 CHEMICKÁ VAZBA Spojováním dvou a více atomů vznikají molekuly. Jestliže dochází ke spojování výhradně atomů téhož chemického prvku, pak se jedná o molekuly daného prvku (vodíku H 2, dusíku N 2, ozonu
Cvičení z termodynamiky a statistické fyziky
 Cvičení termodynamiky a statistické fyiky 1Nechť F(x, y=xe y Spočtěte F/ x, F/, 2 F/ x 2, 2 F/ x, 2 F/ x, 2 F/ x 2 2 Bud dω = A(x, ydx+b(x, ydy libovolná diferenciální forma(pfaffián Ukažte, ževpřípadě,žedωjeúplnýdiferenciál(existujefunkce
Cvičení termodynamiky a statistické fyiky 1Nechť F(x, y=xe y Spočtěte F/ x, F/, 2 F/ x 2, 2 F/ x, 2 F/ x, 2 F/ x 2 2 Bud dω = A(x, ydx+b(x, ydy libovolná diferenciální forma(pfaffián Ukažte, ževpřípadě,žedωjeúplnýdiferenciál(existujefunkce
5.7 Vlhkost vzduchu 5.7.5 Absolutní vlhkost 5.7.6 Poměrná vlhkost 5.7.7 Rosný bod 5.7.8 Složení vzduchu 5.7.9 Měření vlhkosti vzduchu
 Fázové přechody 5.6.5 Fáze Fázové rozhraní 5.6.6 Gibbsovo pravidlo fází 5.6.7 Fázový přechod Fázový přechod prvního druhu Fázový přechod druhého druhu 5.6.7.1 Clausiova-Clapeyronova rovnice 5.6.8 Skupenství
Fázové přechody 5.6.5 Fáze Fázové rozhraní 5.6.6 Gibbsovo pravidlo fází 5.6.7 Fázový přechod Fázový přechod prvního druhu Fázový přechod druhého druhu 5.6.7.1 Clausiova-Clapeyronova rovnice 5.6.8 Skupenství
Teplotní roztažnost Přenos tepla Kinetická teorie plynů
 Teplotní roztažnost Přenos tepla Kinetická teorie plynů Teplotní roztažnost pevných látek l a kapalin Teplotní délková roztažnost Teplotní objemová roztažnost a závislost hustoty na teplotě Objemová roztažnost
Teplotní roztažnost Přenos tepla Kinetická teorie plynů Teplotní roztažnost pevných látek l a kapalin Teplotní délková roztažnost Teplotní objemová roztažnost a závislost hustoty na teplotě Objemová roztažnost
Změny délky s teplotou
 Termika Teplota t Dokážeme vnímat horko a zimu. Veličinu, kterou zavádíme pro popis, nazýváme teplota teplotu (horko-chlad) však nerozlišíme zcela přesně (líh, mentol, chilli, kapalný dusík) měříme empiricky
Termika Teplota t Dokážeme vnímat horko a zimu. Veličinu, kterou zavádíme pro popis, nazýváme teplota teplotu (horko-chlad) však nerozlišíme zcela přesně (líh, mentol, chilli, kapalný dusík) měříme empiricky
Matematika II Lineární diferenciální rovnice
 Matematika II Lineární diferenciální rovnice RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Lineární diferenciální rovnice Denice
Matematika II Lineární diferenciální rovnice RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Lineární diferenciální rovnice Denice
c) vysvětlení jednotlivých veličin ve vztahu pro okamžitou výchylku, jejich jednotky
 Harmonický kmitavý pohyb a) vysvětlení harmonického kmitavého pohybu b) zápis vztahu pro okamžitou výchylku c) vysvětlení jednotlivých veličin ve vztahu pro okamžitou výchylku, jejich jednotky d) perioda
Harmonický kmitavý pohyb a) vysvětlení harmonického kmitavého pohybu b) zápis vztahu pro okamžitou výchylku c) vysvětlení jednotlivých veličin ve vztahu pro okamžitou výchylku, jejich jednotky d) perioda
Metody využívající rentgenové záření. Rentgenovo záření. Vznik rentgenova záření. Metody využívající RTG záření
 Metody využívající rentgenové záření Rentgenovo záření Rentgenografie, RTG prášková difrakce 1 2 Rentgenovo záření Vznik rentgenova záření X-Ray Elektromagnetické záření Ionizující záření 10 nm 1 pm Využívá
Metody využívající rentgenové záření Rentgenovo záření Rentgenografie, RTG prášková difrakce 1 2 Rentgenovo záření Vznik rentgenova záření X-Ray Elektromagnetické záření Ionizující záření 10 nm 1 pm Využívá
Šíření tepla. Obecnéprincipy
 Šíření tepla Obecnéprincipy Šíření tepla Obecně: Šíření tepla je výměna tepelné energie v tělese nebo mezi tělesy, která nastává při rozdílu teplot. Těleso s vyšší teplotou má větší tepelnou energii. Šíření
Šíření tepla Obecnéprincipy Šíření tepla Obecně: Šíření tepla je výměna tepelné energie v tělese nebo mezi tělesy, která nastává při rozdílu teplot. Těleso s vyšší teplotou má větší tepelnou energii. Šíření
DUM č. 12 v sadě. 10. Fy-1 Učební materiály do fyziky pro 2. ročník gymnázia
 projekt GML Brno Docens DUM č. 12 v sadě 10. Fy-1 Učební materiály do fyziky pro 2. ročník gymnázia Autor: Vojtěch Beneš Datum: 03.05.2014 Ročník: 1. ročník Anotace DUMu: Kapaliny, změny skupenství Materiály
projekt GML Brno Docens DUM č. 12 v sadě 10. Fy-1 Učební materiály do fyziky pro 2. ročník gymnázia Autor: Vojtěch Beneš Datum: 03.05.2014 Ročník: 1. ročník Anotace DUMu: Kapaliny, změny skupenství Materiály
9. Struktura a vlastnosti plynů
 9. Struktura a vlastnosti plynů Osnova: 1. Základní pojmy 2. Střední kvadratická rychlost 3. Střední kinetická energie molekuly plynu 4. Stavová rovnice ideálního plynu 5. Jednoduché děje v plynech a)
9. Struktura a vlastnosti plynů Osnova: 1. Základní pojmy 2. Střední kvadratická rychlost 3. Střední kinetická energie molekuly plynu 4. Stavová rovnice ideálního plynu 5. Jednoduché děje v plynech a)
4. V jednom krychlovém metru (1 m 3 ) plynu je 2, molekul. Ve dvou krychlových milimetrech (2 mm 3 ) plynu je molekul
 Fyzika 20 Otázky za 2 body. Celsiova teplota t a termodynamická teplota T spolu souvisejí známým vztahem. Vyberte dvojici, která tento vztah vyjadřuje (zaokrouhleno na celá čísla) a) T = 253 K ; t = 20
Fyzika 20 Otázky za 2 body. Celsiova teplota t a termodynamická teplota T spolu souvisejí známým vztahem. Vyberte dvojici, která tento vztah vyjadřuje (zaokrouhleno na celá čísla) a) T = 253 K ; t = 20
Měření povrchového napětí
 Měření povrchového napětí Úkol : 1. Změřte pomocí kapilární elevace povrchové napětí daných kapalin při dané teplotě. 2. Změřte pomocí kapkové metody povrchové napětí daných kapalin při dané teplotě. Pomůcky
Měření povrchového napětí Úkol : 1. Změřte pomocí kapilární elevace povrchové napětí daných kapalin při dané teplotě. 2. Změřte pomocí kapkové metody povrchové napětí daných kapalin při dané teplotě. Pomůcky
Elektrochemie. Pøedmìt elektrochemie: disociace (roztoky elektrolytù, taveniny solí) vodivost jevy na rozhraní s/l (elektrolýza, èlánky)
 Elektrochemie 1 Pøedmìt elektrochemie: disociace (roztoky elektrolytù, taveniny solí) vodivost jevy na rozhraní s/l (elektrolýza, èlánky) Vodièe: I. tøídy { vodivost zpùsobena pohybem elektronù uvnitø
Elektrochemie 1 Pøedmìt elektrochemie: disociace (roztoky elektrolytù, taveniny solí) vodivost jevy na rozhraní s/l (elektrolýza, èlánky) Vodièe: I. tøídy { vodivost zpùsobena pohybem elektronù uvnitø
Průvodka. CZ.1.07/1.5.00/ Zkvalitnění výuky prostřednictvím ICT. III/2 Inovace a zkvalitnění výuky prostřednictvím ICT
 Průvodka Číslo projektu Název projektu Číslo a název šablony klíčové aktivity CZ.1.07/1.5.00/34.0802 Zkvalitnění výuky prostřednictvím ICT III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Příjemce
Průvodka Číslo projektu Název projektu Číslo a název šablony klíčové aktivity CZ.1.07/1.5.00/34.0802 Zkvalitnění výuky prostřednictvím ICT III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Příjemce
Zákony ideálního plynu
 5.2Zákony ideálního plynu 5.1.1 Ideální plyn 5.1.2 Avogadrův zákon 5.1.3 Normální podmínky 5.1.4 Boyleův-Mariottův zákon Izoterma 5.1.5 Gay-Lussacův zákon 5.1.6 Charlesův zákon 5.1.7 Poissonův zákon 5.1.8
5.2Zákony ideálního plynu 5.1.1 Ideální plyn 5.1.2 Avogadrův zákon 5.1.3 Normální podmínky 5.1.4 Boyleův-Mariottův zákon Izoterma 5.1.5 Gay-Lussacův zákon 5.1.6 Charlesův zákon 5.1.7 Poissonův zákon 5.1.8
Příklady k opakování TERMOMECHANIKY
 Příklady k opakování TERMOMECHANIKY P1) Jaký teoretický výkon musí mít elektrický vařič, aby se 12,5 litrů vody o teplotě 14 C za 15 minuty ohřálo na teplotu 65 C, jestliže hustota vody je 1000 kg.m -3
Příklady k opakování TERMOMECHANIKY P1) Jaký teoretický výkon musí mít elektrický vařič, aby se 12,5 litrů vody o teplotě 14 C za 15 minuty ohřálo na teplotu 65 C, jestliže hustota vody je 1000 kg.m -3
Potenciální energie atom{atom
 Potenciální energie atom{atom 1/16 Londonovy (disperzní) síly: na del¹ích vzdálenostech, v¾dy pøita¾livé Model uktuující dipól { uktuující dipól elst. pole E 1/r 3 indukovaný dipól µ ind E energie u(r)
Potenciální energie atom{atom 1/16 Londonovy (disperzní) síly: na del¹ích vzdálenostech, v¾dy pøita¾livé Model uktuující dipól { uktuující dipól elst. pole E 1/r 3 indukovaný dipól µ ind E energie u(r)
ASYNCHRONNÍ DYNAMOMETRY ØADY ASD DO 1000 kw
 ELEKTRICKÉ STROJE A POHONY ASYNCHRONNÍ DYNAMOMETRY ØADY ASD DO 1000 kw Asynchronní dynamometry øady ASD jsou urèeny k mìøení mechanického výkonu na høídeli zkou¹eného stroje a k vyvozování regulovaného
ELEKTRICKÉ STROJE A POHONY ASYNCHRONNÍ DYNAMOMETRY ØADY ASD DO 1000 kw Asynchronní dynamometry øady ASD jsou urèeny k mìøení mechanického výkonu na høídeli zkou¹eného stroje a k vyvozování regulovaného
Některé základní pojmy
 Klasifikace látek Některé základní pojmy látka látka čistá chemické individuum fáze směs prvek sloučenina homogenní směs heterogenní směs plynná směs kapalný roztok tuhý roztok Homogenní a heterogenní
Klasifikace látek Některé základní pojmy látka látka čistá chemické individuum fáze směs prvek sloučenina homogenní směs heterogenní směs plynná směs kapalný roztok tuhý roztok Homogenní a heterogenní
