Iónové (soľotvorné) halogenidy alkalických kovov, kovov alkalických zemín, kovov 3. skupiny a niektorých lantanoidov topenia
|
|
|
- Radim Šimon Kubíček
- před 8 lety
- Počet zobrazení:
Transkript
1 Iónové (soľotvorné) haloenidy sú haloenidy alkalických kovov, kovov alkalických zemín, kovov 3. skupiny a niektorých lantanoidov majú vysoké teploty topenia a varu v roztavenom stave vedú elektrický prúd majú prevažne iónové väzby kovalentný charakter väzby rastie: s rastom polarizovateľnosti (deformovatelnosti) haloenidového aniónu: NaF < NaCl < NaBr < NaI so zväčšujúcou sa nábojovou hustotou katiónu: KCl< CaCl2 < CaF2 ScCl3 vznik iónových fluoridov ovplyvňujú dva kľúčové faktory: malá disociačná eneria väzby F F v porovnaní s ostatnými haloénmi fluoridy majú väčšiu mriežkovú eneriu v porovnaní s ostatnými haloenidmi (spôsobené malým aniónom F s veľkou nábojovou hustotou)
2 vplyv veľkosti X na mriežkovú eneriu je evidentný z tabuľky, v ktorej sú uvedené hodnoty mriežkových enerií pre haloenidy NaX (všetky majú štruktúrny typ NaCl) Haloenid NaF NaCl NaBr NaI Mriežková eneria (kj.mol -1 ) väčšina iónových chloridov, bromidov a jodidov sú rozpustné vo vode, často kryštalizujú ako hydráty mnohé fluoridy kovov sú však nerozpustné F (133 pm) je oveľa menší ako Cl (181pm) rozpustnosť fluoridov sa líši od rozpustnosti zodpovedajúcich chloridov dôsledok rozdielu vo veľkosti mriežkovej enerie medzi fluoridmi a chloridmi kovov napr. CaF2 je nerozpustný a CaCl2 je rozpustný (mriežková eneria CaF2 je väčšia v porovnaní s CaCl2 (malý Ca 2+ (99 pm) s veľkou nábojovou hustotou je spolu s malým F ) AF je rozpustný, zatiaľ čo ACl je málo rozpustný (veľký A + (126 pm) má relatívne nízku mriežkovú eneriu s malým F ) málorozpustné haloenidy sú CuX, AX, TlX, H2X2 a PbX2
3 Polymérne kovalentné haloenidy sú viazané prevažne kovalentnými väzbami do nekonečných reťazcov, vrstiev alebo priestorových útvarov sú to haloenidy Be prechodných kovov v nízkych oxidačných číslach (II a III) kovových p - prvkov v roztavenom stave len slabo vedú elektrický prúd v plynnom stave majú niektoré (BeCl2, Fe2Cl6, ZnCl2) molekulovú štruktúru BeCl2 CdI2 Príprava haloenidov nasledovnými metódami: 2GaBr3 (s) syntéza z prvkov: 2Ga (s) + 3Br2 () PbCl2
4 syntézou z prvkov obyčajne vzniká haloenid obsahujúci atóm kovu vo vyššom oxidačnom stave napr. dichlór reauje ako silné oxidačné činidlo a vzniká chlorid železitý 2Fe() s + 3Cl2() 2FeCl3() s reakcia kovu s haloenvodíkom: pri reakcii kovu s haloenovodíkom vzniká haloenid obsahujúci atóm kovu v nižšom oxidačnom stave použitie slabého oxidačného činidla chlorovodíka vedie k vzniku chloridu železnatého Fe() s + 2HCl() FeCl2() s + H2() uvedenými spôsobmi sme schopný pripraviť bezvodé haloenidy MXn hydratované haloenidy kovov MXn.xH2O sa pripravujú reakciou: Zn() s + 2HCl( aq) ZnCl2( aq) + H2( ) rozpúšťaním neušľachtilých kovov v HX(aq) a následnou kryštalizáciou roztoku reakciou oxidov, hydroxidov, resp. solí slabých kyselín s HX(aq) (MCl2.6H2O MO a HCl(aq) a následnou kryštalizáciou roztoku) MO() s + 2HCl( aq) + 5H2 O MCl2$ 6H2O() s
5 bezvodá soľ sa nemôže pripraviť jednoduchým zohrievaním hydrátu, pretože dochádza k hydrolytickému rozkladu haloenidu zohrievanie MCl2.6H2O(s) vedie k tvorbe M(OH)Cl: MCl2$ 6H2O() s M( OH) Cl() s + HCl() + 5H2O() na získanie bezvodého MCl2 z hydrátu, musíme vodu odstrániť chemickým spôsobom v diestóriu za použitia SOCl2: MCl2$ 6H2O() s + 6SOCl2() l MCl2() s + 6SO2() + 12HCl() uvedená reakcia predstavuje všeobecný spôsob dehydratácie chloridov kovov nie všetky jodidy kovov, v ktorých má kovový ión vyšší oxidačný stav môžeme pripraviť samotný jodidový anión má redukčné vlastnosti (napr. jodidový anión bude redukovať Cu(II) na Cu(I): Cu ( aq) + 4I ( aq) 2CuI( s) + I2( s) v dôsledku tejto reakcie CuI2 neexistuje
6 Typy vzájomných zlúčenín haloénov a ich iónov tvoria interhaloenidy XY, XY3, XY5, a XY7 (X je haloén s vyšším atómovým číslom a Y s nižším atómovým číslom) známe sú nasledovné kombinácie (stav pri teplote 25 C a tlaku 100kPa): Zlúčenina Stav Zlúčenina Stav Zlúčenina Stav ClF bezfarebný plyn BrF ClF3 bezfarebný plyn BrF3 ClF5 bezfarebný plyn BrF5 svetlohnedý plyn IF nestála tuhá látka svetložltá kvapalina IF3 žltá tuhá látka bezfarebná kvapalina IF5 bezfarebná kvapalina IF7 bezfarebný plyn od vzájomných zlúčenín haloénov polyhaloenidové ióny: dôležitá je tvorba aniónu I3, umožňuje rozpustenie I2 vo vodnom roztoku I : I2() s + I - ( aq) I - 3 ( aq) mnoho ďalších polyjodidových iónov ako sú I5, I7 a I9 ale tieto sú menej stabilné ako I3 Oxidačný stav stredového atómu Katióny Anióny +I +III +V +VII ClF2 + ClF4 + ClF6 + ICl2 + BrF4 + BrF6 + IF4 + IF6 + BrCl2 - ClF4 - BrF6 - ICl2 - BrF4 - IF6 - IF8 - IBr2 - ICl4 - I3 -
7 interhaloenidové zlúčeniny sú pre anoranických chemikov zaujímavé aj z pohľadu ich tvaru (na základe VSEPR) zlúčeniny typu: XY majú tvar lineárny XY3 majú tvar T XF5 má tvar štvorcovej pyramídy IF7, ktorý má tvar vzácne sa vyskytujúcej pentaonálnej bipyramídy interhaloenidové zlúčeniny môžu reaovaťako Lewisove kyseliny alebo zásady: BrF3() l + KF( s) KBrF4( s) + - BrF3() l + SbF5 ( s) 6BrF2@ 6SbF6@ ( solv) vo vodnom roztoku hydrolyzujú na kyselinu haloenvodíkovú viac elektroneatívneho haloénu a oxokyselinu menej elektroneatívneho haloénu: BrCl() + H2O() l HCl( aq) + HBrO( aq) BrF3() l + 2H2O() l 3HF( aq) + HBrO2( aq) možno použiť ako aprotické rozpúšťadlá (v kvapalnom stave podliehajú vlastnej ionizácii): BrF () l BrF ( solv) + BrF ( solv) IF () l IF ( solv) + IF ( solv)
8 Príprava a vlastnosti haloenovodíkov (binárnych zlúčenín haloénov s vodíkom): syntézou z prvkov H2 () + Cl2() 2HCl() reakciou haloenidu so silnou neprchavou kyselinou (najčastejšie H2SO4) CaF2 () s + H2SO4( konc) CaSO4() s + 2HF() NaCl() s + H2SO4( konc) NaHSO4( aq) + HCl() reakciou s koncentrovanou H2SO4 sa nedá pripraviť HBr a HI (dochádza k ich oxidácii) 2NaBr() s + 2H2SO4( konc) Br2() l + Na2SO4( aq) + H2O() l používa sa H3PO4 (nemá oxidačné vlastnosti) KI() s + H3PO4( aq) KH2PO4( aq) + HI() Fluorovodík vysoká teplota varu HF je dôsledkom veľmi silných vodíkových väzieb medzi susednými molekulami Kyselina fluorovodíková - slabá kyselina s pka = 3.2 na rozdiel od ostatných kyselín HX, ktoré sú veľmi silné a majú záporné hodnoty pka (väzba vodík-fluór je oveľa silnejšia ako iné väzby vodík-haloén) + - HF( aq) + H2O( l) H3O ( aq) + F ( aq)
9 sila HF(aq) pri vyšších koncentráciach fluorovodíka sa stáva dôležitou tvorba dimérných molekúl (HF)2 a ich ionizáciou vzniká veľmi stabilný lineárny hydroéndifluoridový anión HF2 (z roztoku môžu kryštalizovať MHF2 M alkalický kov) je veľmi korozívna, hoci slabá kyselina reauje so sklom (uchováva sa v plastických nádobách) reakciou so sklom vzniká SiF6 2 používa sa ako východisková látka na syntézu zlúčenín obsahujúcich fluór (NaF fluoridácia vody) Kyselina chlorovodíková chlorovodík je extrémne rozpustný vo vode (~ 38% hm. HCl) technicky čistá je často sfarbená do žltá (od železitých iónov) silná kyselina (pka = 7) vo vodnom roztoku takmer úplne ionizovaná nemá oxidačné vlastnosti Zn() s + 2HCl( aq) ZnCl2( aq) + H2() použitie odstránenie hrdze z povrchu ocele čistenie lukózy a kukuričného sirupu kyslé spracovanie ropných a plynových vrtov priemyselná výroba chemikálii obsahujúcich chlór
10 Oxokyseliny haloénov v tabuľke sú uvedené známe oxokyseliny haloénov (z toho aj v bezvodom stave HClO4, HIO3, HIO4 a H5IO6) H5IO6 vo forme bielych kryštálov (teplota topenia 128 C) sa pripravuje odparovaním vodného roztoku HIO4 Oxidačný stav Clór Bróm Jód I HClO HBrO HIO III HClO2 HBrO2? - V HClO3 HBrO3 HIO3 HI3O8 VII HClO4 HBrO4 HIO4 H5IO6 H4I2O9 relatívna sila oxokyselín chlóru: stupeň ionizácie kyseliny v závislosti od ph HClO je ionizovaná až pri hodnotách ph väčších ako 6 naopak, HClO3 a HClO4 sú úplne ionizované v celej oblasti ph od 0 po 14
11 oxokyseliny haloénov a ich ióny sú silné oxidovadlá (Frostov diaramu chlóru pre kyslé a zásadité prostredie) chloristanový anión (oxidačný stav atómu Cl VII ) môže vystupovať len ako oxidačné činidlo častice obsahujúce atómy Cl v nižších oxidačných stavoch (okrem Cl ) aj ako redukovadlá (vo všeobecnosti sú to však oxidovadlá) oxokyseliny a ich anióny sú omnoho lepšie oxidačné činidlá v kyslom ako zásaditom roztoku mnohé častice chlóru sú citlivé na disproporcionáciu
12 Kyselina chlórna a chlornanový anión tvoria sa pri rozpúšťaní chlóru v studenej vode: + - Cl2() + 2H2O() l H3O ( aq) + Cl ( aq) + HClO( aq) HClO je veľmi slabá kyselina, roztoky chlórnanov sú veľmi zásadité v dôsledku hydrolýzy: - - ClO ( aq) + H2O( l) HClO( aq) + OH ( aq) Oxidačné vlastnosti chlórnanového aniónu - bieliace a antibakteriálne účinky dve zlúčeniny priemyselnej dôležitosti sú chlórnan sodný a chlórnan vápenatý NaClO je stabilný len v roztoku, ako tuhý zdroj chlórnanových iónov sa používa Ca(ClO)2 roztok NaClO (5%) sa používa v komerčných bieliacich roztokoch (bielenie a odfarbenie celulózy a textilu) príprava NaClO3 zavadzaním chlóru do teplého roztoku hydroxidu sodného: teplo Cl2 () + 6NaOH( aq) NaClO3( aq) + 5NaCl() s + 3H2O() l KClO3 sa používa vo veľkých množstvách na výrobu zápaliek a ohňostrojov chlorečnany podobne ako chloristany sú silné oxidačné činidlá, ktoré môžu neočakávane explodovať pri zmiešaní s redukčným činidlom pozoruhodné množstvo NaClO3 sa spotrebuje pri výrobe ClO2
13 chlorečnany sa pri zahrievaní rozkladajú zahrievamím chlorečnanu pri teplotách nižších ako 370 C, nastáva disproporcionácia za tvorby Cl a ClO4 : 3T 4KClO3 () s 3KClO4( aq) + KCl() s uvedená reakcia poskytuje syntetickú možnosť prípravy chloristanu ak sa KClO3 zohrieva nad teplotou 370 C, vznikajúci chloristan sa ďalej rozkladá: 3T KClO4 () s KCl() s + O2() Kyselina chloristá a chloristanový anión čistá kyselina je bezfarebná explozívna kvapalina so silnými oxidačnými vlastnosťami (kontakt s oranickými materiálmi ako je drevo a papier spôsobí okamžite požiar) koncentrovaná kyselina (obyčajne 60% vodný roztok) sa oveľa častejšie používa ako veľmi silné oxidačné činidlo (oxidácia zliatin kovov na kovové ióny pre ich analýzu) než ako kyselina zriedený studený roztok HClO4 je pomerne bezpečný NH4ClO4 sa používa spolu s redukovadlom - Al v nosných raketách raketoplánov: 6NH4 ClO4() s + 8Al() s 4Al2O3() s + 3N2() + 3Cl2() + 12H2O() pri manipulácii a skladovaní NH4ClO4 musíme brať do úvahy jeho hyroskopickú povahu ako aj skutočnosť, že pri zahriatí nad 200 C sa rozkladá
14 Kyanidový anión ako pseudohaloenidový anión CN sa podobá na haloenidové anióny nasledovnými spôsobmi: kyanidy A(I), Pb(II) a H(I) sú nerozpustné podobne ako zodpovedajúce chloridy, bromidy a jodidy, napr.: CN - ( aq) + A + ( aq) ACN( s) podobne ako ACl aj ACN reaujú s NH3 za tvorby [A(NH3)2] + (aq): + - ACN() s + 2NH3( aq) 6 A^NH3h2@ + CN ( aq) CN je konjuovanou zásadou k slabej kyseline HCN(aq), podobne ako F k HF(aq): + - HCN( aq) + H2O( l) H3O ( aq) + CN ( aq) CN tvorí veľký počet komplexných iónov s prechodnými kovmi ako je [Cu(CN)4] 2, ktorý sa podobá na analó [CuCl4] 2 CN môžeme oxidovať na zodpovedajúci (CN)2, pod. ako X na X2: Cu ( aq) + 4CN ( aq) 2CuCN() s + ( CN) 2( ) dikyán reauje so zásadami za vzniku kyanidu a kyanatanových aniónov: ( CN) 2( ) + 2OH - - ( aq) CN ( aq) + NCO - ( aq) + H2O( l) dikyán tvorí pseudo-interhaloenidové zlúčeniny ako je ICN, tým istým spôsobom haloény tvoria interhaloenidové zlúčeniny ako je ICl
15 Oxidy chlóru najmä v nepárnych oxidačných stavoch sú termodynamicky nestabilné avšak kineticky stabilné ClO zodpovedá za vznik ozónovej diery a pokles koncentrácie O3 (zachytáva UV žiarenie) rozpad CFC (freóny) vznik Cl2 s príchodom jari, slnečné svetlo spôsobuje rozklad Cl2 na atómy chlóru: h y : Cl2() 2Cl () : Cl () + O3() ClO() + O2() ClO sa zúčastňuje reakčného katalytického cyklu (reenerujú sa atómy Cl, pôsobiace ako katalyzátor pri konverzii O3 na O2) prvým krokom procesu je zrážka dvoch ClO za tvorby ClOOCl (je potrebná prítomnosť molekuly E2 - napr. N2, O2..., ktorá prijíma prebytočnú eneriu): * 2ClO() + E2() Cl2O2() + E2() slnečné svetlo spôsobuje asymetrický rozpad: hy Cl2O2() ClOO() + Cl : () častice ClOO sú veľmi nestále: ClOO() O2 () + Cl : ()
16 ClO2 je žltý plyn, kondenzujúci pri 11 C na tmavočervenú kvapalinu paramanetická radikálová častica, podobne ako NO2, veľmi silné oxidačné činidlo veľké množstvo ClO2 (aq, zried.) na bielenie celulózy pri výrobe bieleho papiera ClO2 sa pri bielení uprednostňuje pred Cl2, pretože nevznikajú nebezpečné chlórované odpadové látky reakcia prípravy pozostáva z redukcie oxidačného stavu +V (ClO3 ): ClO3 ( aq) + 4H ( aq) + 2Cl ( aq) 2ClO2( ) + Cl2( ) + 2H2O( l) Bioloické aspekty každý stabilný člen skupiny má bioloickú funkciu fluór veľký počet rastlín (okolo 1000) produkuje FCH2COO (toxický anión pre zvieratá a ľudí blokuje Krebsov cyklus u cicavcov, čo spôsobuje nahromadenie kyseliny citrónovej a vedie k zlyhaniu srdca) chlór anióny Cl zohrávajú zásadnú úlohu v iónovej rovnováhe v našom tele (len vyrovnávajú kladný náboj Na + a K + ) naproti tomu zlúčeniny obsahujúce atómy chlóru viazaný kovalentným spôsobom sú veľmi škodlivé (napr. DDT a PCB v súčasnosti úplný zákaz výroby zlúčenín obsahujúcich kovalentne viazaný chlór)
17 skupinou zlúčenín značného záujmu sú substituované trihaloenometány (THM) vznikajú chloráciou vody (voda obsahuje oranické látky) pri jej dezinfekcii, aby ju bolo možné použiť pre ľudskú spotrebu proces chlóracie spôsobuje framentáciu zložitých oranických molekúl (napr. huminové kyseliny) za tvorby malých chlórovaných molekúl (napr. trichlometán CHCl3) v súčasnosti je povolená maximálna hodnota THM 100 ppb; lepšie je používať ozón alebo ClO2 ako primárny dezinfikátor zásob vody bróm najdiskutovanejšou zlúčeninou je CH3Br širokospektrálny dezinfekčný prostriedok používaný na ničenie škodcov, hlíst, buriny a hlodavcov okolo ton (vo svetovom meradle) sa ho použije každoročne (75% na dezinfekciu pôdy, 22% po žatve a 3% ako nástroj boja proti škodcom) poškodzuje ozónovú vrstvu, je asi 50 krát účinnejšia ako chlór CH3Br má smrtiaci účinok aj na necieľové oranizmy
18 jód okolo 75% jódu v ľudskom tele sa nachádza v jednom orane v štítnej žľaze jód sa používa pri syntéze hormónu tyroxínu a trijodotyroninu obidva hormóny sú nevyhnutné pre rast a pre reuláciu nervovo svalových funkcií pre zabezpečenie dostatku jódu v oranizme sa pridáva jodid draselný do domácej soli (jodidovaná soľ) Hormón tyroxín
PRVKY 17. SKUPINY (HALOGÉNY)
 PRVKY 17. SKUPINY (HALOGÉNY) Tabuľka 4.1 Atómové vlastnosti halogénov F Cl Br I elektrónová afinita, A 1 / kj mol 1 328 349 325 295 prvá ionizačná energia, I 1 / kj mol 1 1681 1251 1139 1008 elektronegativita,
PRVKY 17. SKUPINY (HALOGÉNY) Tabuľka 4.1 Atómové vlastnosti halogénov F Cl Br I elektrónová afinita, A 1 / kj mol 1 328 349 325 295 prvá ionizačná energia, I 1 / kj mol 1 1681 1251 1139 1008 elektronegativita,
SLOVENSKÁ KOMISIA CHEMICKEJ OLYMPIÁDY CHEMICKÁ OLYMPIÁDA. 49. ročník, školský rok 2012/2013 Kategória C. Študijné kolo
 SLOVENSKÁ KOMISIA CHEMICKEJ OLYMPIÁDY CHEMICKÁ OLYMPIÁDA 49. ročník, školský rok 2012/201 Kategória C Študijné kolo RIEŠENIE A HODNOTENIE TEORETICKÝCH ÚLOH RIEŠENIE A HODNOTENIE ÚLOH Z ANORGANICKEJ A VŠEOBECNEJ
SLOVENSKÁ KOMISIA CHEMICKEJ OLYMPIÁDY CHEMICKÁ OLYMPIÁDA 49. ročník, školský rok 2012/201 Kategória C Študijné kolo RIEŠENIE A HODNOTENIE TEORETICKÝCH ÚLOH RIEŠENIE A HODNOTENIE ÚLOH Z ANORGANICKEJ A VŠEOBECNEJ
DUM č. 19 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 19 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 19 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
16.5.2010 Halogeny 1
 16.5.010 Halogeny 1 16.5.010 Halogeny Prvky VII.A skupiny: F, Cl, Br, I,(At) Obecnávalenčníkonfigurace:ns np 5 Pro plné zaplnění valenční vrstvy potřebují 1 e - - nejčastější sloučeniny s oxidačním číslem
16.5.010 Halogeny 1 16.5.010 Halogeny Prvky VII.A skupiny: F, Cl, Br, I,(At) Obecnávalenčníkonfigurace:ns np 5 Pro plné zaplnění valenční vrstvy potřebují 1 e - - nejčastější sloučeniny s oxidačním číslem
RNDr. Daniela Kravecová, PhD. Premonštrátske gymnázium, Kováčska 28, Košice
 Redoxné reakcie RNDr. Daniela Kravecová, PhD. Premonštrátske gymnázium, Kováčska 28, Košice Redoxné reakcie Redoxné reakcie sú chemické reakcie, pri ktorých dochádza k zmene oxidačného čísla atómov alebo
Redoxné reakcie RNDr. Daniela Kravecová, PhD. Premonštrátske gymnázium, Kováčska 28, Košice Redoxné reakcie Redoxné reakcie sú chemické reakcie, pri ktorých dochádza k zmene oxidačného čísla atómov alebo
Astat - radioaktivní pevná látka - krátký poločas rozpadu (8,3 hod) - nejstabilnější je izotop At 210. Sloučeniny
 Halogeny - název od řeckého hals = sůl (pro jejich schopnost tvořit velkou řadu solí) - prvky 17. skupiny - mají sedm valenčních elektronů - tvoří dvouatomové molekuly - jsou jedovaté s dráždivými účinky
Halogeny - název od řeckého hals = sůl (pro jejich schopnost tvořit velkou řadu solí) - prvky 17. skupiny - mají sedm valenčních elektronů - tvoří dvouatomové molekuly - jsou jedovaté s dráždivými účinky
VII.A skupina - HALOGÉNY strana 1 z 5. F, Cl. Br, I, At
 HALOGÉNY prvky p 5 strana 1 z 5 F, Cl. Br, I, At - HALS gr. = soľ (schopnosť tvoriť celý rad solí) CHARAKTERISTIKA 17.sk - VII.A sk - 7 valenčných elektrónov - el. konfigurácia valenčnej vrstvy je ns np
HALOGÉNY prvky p 5 strana 1 z 5 F, Cl. Br, I, At - HALS gr. = soľ (schopnosť tvoriť celý rad solí) CHARAKTERISTIKA 17.sk - VII.A sk - 7 valenčných elektrónov - el. konfigurácia valenčnej vrstvy je ns np
VY_52_INOVACE_08_II.1.7_SOLI SOLI. PROCVIČOVÁNÍ a) PRACOVNÍ LIST
 VY_52_INOVACE_08_II.1.7_SOLI SOLI PROCVIČOVÁNÍ a) PRACOVNÍ LIST PRACOVNÍ LIST 1. Pojmenuj kyselinu a odděl aniontovou skupinu. H 2 SO 4 HClO 3 H 2 SO 3 H 2 CO 3 H 2 SiO 4 HCl HNO 3 H 2 Se HClO H 2 WO 4
VY_52_INOVACE_08_II.1.7_SOLI SOLI PROCVIČOVÁNÍ a) PRACOVNÍ LIST PRACOVNÍ LIST 1. Pojmenuj kyselinu a odděl aniontovou skupinu. H 2 SO 4 HClO 3 H 2 SO 3 H 2 CO 3 H 2 SiO 4 HCl HNO 3 H 2 Se HClO H 2 WO 4
III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Prvky VII. hlavní skupiny (F, Cl, Br,, I, At)
 Prvky VII. hlavní skupiny (F, Cl, Br,, I, At) I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn
Prvky VII. hlavní skupiny (F, Cl, Br,, I, At) I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn
Halové prvky (halogény), ns 2 np 5
 Halové prvky (halogény), ns 2 np 5 F, Cl, Br, I, At (v danom okamihu 25g v zemskej kôre, t ½ = 8 hod.) Tvorba väzieb: Elektrónová konfigurácia ns 2 np 5 (ns 2 np x2 np y2 np z1 ) do elektrónovej konfigurácie
Halové prvky (halogény), ns 2 np 5 F, Cl, Br, I, At (v danom okamihu 25g v zemskej kôre, t ½ = 8 hod.) Tvorba väzieb: Elektrónová konfigurácia ns 2 np 5 (ns 2 np x2 np y2 np z1 ) do elektrónovej konfigurácie
Sú ažné úlohy Chemickej olympiády v kategórii B
 Sú ažné úlohy Chemickej olympiády v kategórii B Pre 2. ročníky stredných škôl 44. ro ník - 2007/08 Vydala IUVENTA v spolupráci so Slovenskou komisiou Chemickej olympiády v roku 2008 ÚLOHY Z ANORGANICKEJ
Sú ažné úlohy Chemickej olympiády v kategórii B Pre 2. ročníky stredných škôl 44. ro ník - 2007/08 Vydala IUVENTA v spolupráci so Slovenskou komisiou Chemickej olympiády v roku 2008 ÚLOHY Z ANORGANICKEJ
Oxidační číslo je rovno náboji, který by atom získal po p idělení všech vazebných elektronových párů atomům s větší elektronegativitou.
 NÁZVOSLOVÍ Oxidační číslo je rovno náboji, který by atom získal po p idělení všech vazebných elektronových párů atomům s větší elektronegativitou. -II +III -II +I O N O H Oxidační čísla se značí ímskými
NÁZVOSLOVÍ Oxidační číslo je rovno náboji, který by atom získal po p idělení všech vazebných elektronových párů atomům s větší elektronegativitou. -II +III -II +I O N O H Oxidační čísla se značí ímskými
2. Do pripravenej schémy (do sivo pofarbených polí) vpíšte prvky podľa stúpajúceho protónového čísla v smere zľava doprava.
 1. Na obrázku sú zašifrované značky piatich chemických prvkov. Dokážete ich nájsť? Uveďte ich slovenský názov, latinský názov, značku a protónové číslo. 2. Do pripravenej schémy (do sivo pofarbených polí)
1. Na obrázku sú zašifrované značky piatich chemických prvkov. Dokážete ich nájsť? Uveďte ich slovenský názov, latinský názov, značku a protónové číslo. 2. Do pripravenej schémy (do sivo pofarbených polí)
II. Chemické názvosloví
 II. Chemické názvosloví 1. Oxidy jsou dvouprvkové sloučeniny kyslíku a jiného prvku. Názvy oxidů jsou dvouslovné. Tvoří je podstatné jméno oxid (postaru kysličník) a přídavné jméno utvořené od názvu prvku
II. Chemické názvosloví 1. Oxidy jsou dvouprvkové sloučeniny kyslíku a jiného prvku. Názvy oxidů jsou dvouslovné. Tvoří je podstatné jméno oxid (postaru kysličník) a přídavné jméno utvořené od názvu prvku
1H 1s. 8O 1s 2s 2p - - - - - - H O H
 OXIDAČNÍ ČÍSLO 1H 1s 8O 1s 2s 2p 1H 1s - - - - + - - + - - + - - H O H +I -II +I H O H - - - - Elektronegativita: Oxidační číslo vodíku: H +I Oxidační číslo kyslíku: O -II Platí téměř ve všech sloučeninách.
OXIDAČNÍ ČÍSLO 1H 1s 8O 1s 2s 2p 1H 1s - - - - + - - + - - + - - H O H +I -II +I H O H - - - - Elektronegativita: Oxidační číslo vodíku: H +I Oxidační číslo kyslíku: O -II Platí téměř ve všech sloučeninách.
Kuchyňská sůl = chlorid sodný. Modrá skalice = síran měďnatý SO 4. Potaš = uhličitan draselný K 2 CO 3
 SOLI Kuchyňská sůl Modrá skalice Potaš Kuchyňská sůl = chlorid sodný Na Cl Modrá skalice = síran měďnatý Cu SO 4 Potaš = uhličitan draselný K 2 CO 3 Chemické názvosloví solí Soli = sloučeniny odvozené
SOLI Kuchyňská sůl Modrá skalice Potaš Kuchyňská sůl = chlorid sodný Na Cl Modrá skalice = síran měďnatý Cu SO 4 Potaš = uhličitan draselný K 2 CO 3 Chemické názvosloví solí Soli = sloučeniny odvozené
Halogeny a jejich sloučeniny
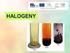 Halogeny a jejich sloučeniny Mgr. Jana Pertlová Copyright istudium, 2008, http://www.istudium.cz Žádná část této publikace nesmí být publikována a šířena žádným způsobem a v žádné podobě bez výslovného
Halogeny a jejich sloučeniny Mgr. Jana Pertlová Copyright istudium, 2008, http://www.istudium.cz Žádná část této publikace nesmí být publikována a šířena žádným způsobem a v žádné podobě bez výslovného
ANODA KATODA elektrolyt:
 Ukázky z pracovních listů 1) Naznač pomocí šipek, které částice putují k anodě a které ke katodě. Co je elektrolytem? ANODA KATODA elektrolyt: Zn 2+ Cl - Zn 2+ Zn 2+ Cl - Cl - Cl - Cl - Cl - Zn 2+ Cl -
Ukázky z pracovních listů 1) Naznač pomocí šipek, které částice putují k anodě a které ke katodě. Co je elektrolytem? ANODA KATODA elektrolyt: Zn 2+ Cl - Zn 2+ Zn 2+ Cl - Cl - Cl - Cl - Cl - Zn 2+ Cl -
Triviální Voda (H 2 O) Amoniak Soda. Systematické. Většina názvů se skládá ze 2 slov Výjimka: např. chlorovodík např. jodid draselný (KI)
 Názvosloví anorganických sloučenin České názvosloví je jednoznačné Názvosloví anorganických sloučenin Triviální Voda (H 2 O) Amoniak Soda Systematické Většina názvů se skládá ze 2 slov Výjimka: např. chlorovodík
Názvosloví anorganických sloučenin České názvosloví je jednoznačné Názvosloví anorganických sloučenin Triviální Voda (H 2 O) Amoniak Soda Systematické Většina názvů se skládá ze 2 slov Výjimka: např. chlorovodík
Názvosloví anorganických sloučenin
 Názvosloví anorganických sloučenin Oxidační číslo udává náboj, kterým by byl atom prvku nabit, kdyby všechny elektrony vazeb v molekule patřily elektronegativnějším vazebným partnerům (atomům) udává náboj,
Názvosloví anorganických sloučenin Oxidační číslo udává náboj, kterým by byl atom prvku nabit, kdyby všechny elektrony vazeb v molekule patřily elektronegativnějším vazebným partnerům (atomům) udává náboj,
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 03.04.2013 Číslo DUMu: VY_32_INOVACE_14_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné
 Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 03.04.2013 Číslo DUMu: VY_32_INOVACE_14_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 03.04.2013 Číslo DUMu: VY_32_INOVACE_14_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
-ičelý -natý -ičitý - ečný (-ičný) -istý -ný -itý -ový
 1 Halogenidy dvouprvkové sloučeniny halogenů s jinými prvky atomy halogenů mají v halogenidech oxidační číslo -I 1) Halogenidy - názvosloví Podstatné jméno názvu je zakončeno koncovkou.. Zakončení přídavného
1 Halogenidy dvouprvkové sloučeniny halogenů s jinými prvky atomy halogenů mají v halogenidech oxidační číslo -I 1) Halogenidy - názvosloví Podstatné jméno názvu je zakončeno koncovkou.. Zakončení přídavného
TEORETICKÁ ČÁST (OH) +II
 POKYNY nejprve si prostuduj teoretickou část s uvedenými typovým příklady jakmile si budeš jist, že teoretickou část zvládáš, procvič si své dovednosti na příkladech k procvičování jako doplňující úlohu
POKYNY nejprve si prostuduj teoretickou část s uvedenými typovým příklady jakmile si budeš jist, že teoretickou část zvládáš, procvič si své dovednosti na příkladech k procvičování jako doplňující úlohu
Ukázky z pracovních listů B
 Ukázky z pracovních listů B 1) Označ každou z uvedených rovnic správným názvem z nabídky. nabídka: termochemická, kinetická, termodynamická, Arrheniova, 2 HgO(s) 2Hg(g) + O 2 (g) H = 18,9kJ/mol v = k.
Ukázky z pracovních listů B 1) Označ každou z uvedených rovnic správným názvem z nabídky. nabídka: termochemická, kinetická, termodynamická, Arrheniova, 2 HgO(s) 2Hg(g) + O 2 (g) H = 18,9kJ/mol v = k.
název soli tvoří podstatné a přídavné jméno
 OPAKOVÁNÍ název soli tvoří podstatné a přídavné jméno podstatné jméno charakterizuje anion soli a jeho náboj: chlorid Cl - přídavné jméno charakterizuje kation soli a jeho oxidační číslo: sodný Na + podstatné
OPAKOVÁNÍ název soli tvoří podstatné a přídavné jméno podstatné jméno charakterizuje anion soli a jeho náboj: chlorid Cl - přídavné jméno charakterizuje kation soli a jeho oxidační číslo: sodný Na + podstatné
ROZTOKY. sú homogénne sústavy zložené z dvoch alebo viacerých zložiek. ich zloženie možno v určitých hraniciach plynule meniť
 ROZTOKY Klasifikácia roztokov Kvapalné roztoky Polárne a nepolárne rozpúšťadlá Hydratácia a solvatácia iónov Vyjadrovanie zloženia roztokov. Koncentrácia roztokov ROZTOKY sú homogénne sústavy zložené z
ROZTOKY Klasifikácia roztokov Kvapalné roztoky Polárne a nepolárne rozpúšťadlá Hydratácia a solvatácia iónov Vyjadrovanie zloženia roztokov. Koncentrácia roztokov ROZTOKY sú homogénne sústavy zložené z
SLOVENSKÁ KOMISIA CHEMICKEJ OLYMPIÁDY
 SLOVENSKÁ KOMISIA CHEMICKEJ OLYMPIÁDY CHEMICKÁ OLYMPIÁDA 50. ročník, školský rok 2013/2014 Kategória C Školské kolo TEORETICKÉ ÚLOHY ÚLOHY ŠKOLSKÉHO KOLA Chemická olympiáda kategória C 50. ročník školský
SLOVENSKÁ KOMISIA CHEMICKEJ OLYMPIÁDY CHEMICKÁ OLYMPIÁDA 50. ročník, školský rok 2013/2014 Kategória C Školské kolo TEORETICKÉ ÚLOHY ÚLOHY ŠKOLSKÉHO KOLA Chemická olympiáda kategória C 50. ročník školský
Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/
 Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/34.0448 Číslo projektu Číslo materiálu Název školy Autor Tematický celek Ročník CZ.1.07/1.5.00/34.0448 ICT- PZC 2/9 Procvičování názvosloví v
Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/34.0448 Číslo projektu Číslo materiálu Název školy Autor Tematický celek Ročník CZ.1.07/1.5.00/34.0448 ICT- PZC 2/9 Procvičování názvosloví v
6. Nekovy chlor a vodí k
 6. Nekovy chlor a vodí k 1) Obecná charakteristika nekovů 2) Chlor a jeho sloučeniny 3) Vodík a jeho sloučeniny Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu.
6. Nekovy chlor a vodí k 1) Obecná charakteristika nekovů 2) Chlor a jeho sloučeniny 3) Vodík a jeho sloučeniny Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu.
Seminář z chemie. RNDr. Jana Fauknerová Matějčková místnost: 617,
 Seminář z chemie RNDr. Jana Fauknerová Matějčková místnost: 617, 615 email: Jana.Matejckova@lf3.cuni.cz Semináře týden datum název semináře či praktika 1. 30.9. Názvosloví v anorganické chemii 2. 11.10.
Seminář z chemie RNDr. Jana Fauknerová Matějčková místnost: 617, 615 email: Jana.Matejckova@lf3.cuni.cz Semináře týden datum název semináře či praktika 1. 30.9. Názvosloví v anorganické chemii 2. 11.10.
VY_32_INOVACE_30_HBENO6
 Halogeny Temacká oblast : Chemie anorganická chemie Datum vytvoření: 8. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Halogeny jejich vlastnos a důležité sloučeniny
Halogeny Temacká oblast : Chemie anorganická chemie Datum vytvoření: 8. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Halogeny jejich vlastnos a důležité sloučeniny
1) BEZKYSLÍKATÉ KYSELINY:
 KYSELINY Jsou to látky, které se ve vodě štěpí na kationty H + a anionty (radikály) kyseliny (např. Cl -, NO 3-, SO 4 2- ). 1) BEZKYSLÍKATÉ KYSELINY: (koncovka -vodíková) Kyselina fluorovod vodíková chlorovod
KYSELINY Jsou to látky, které se ve vodě štěpí na kationty H + a anionty (radikály) kyseliny (např. Cl -, NO 3-, SO 4 2- ). 1) BEZKYSLÍKATÉ KYSELINY: (koncovka -vodíková) Kyselina fluorovod vodíková chlorovod
PRVKY 17. (VII. A) SKUPINY
 PRVKY 17. (VII. A) SKUPINY TEST Úkol č. 1 Doplň následující text správnými informacemi o prvcích 17. skupiny: Prvky 17. skupiny periodické soustavy prvků jsou společným názvem označovány halogeny. Do této
PRVKY 17. (VII. A) SKUPINY TEST Úkol č. 1 Doplň následující text správnými informacemi o prvcích 17. skupiny: Prvky 17. skupiny periodické soustavy prvků jsou společným názvem označovány halogeny. Do této
Súťažné úlohy Chemickej olympiády v kategórii B
 Súťažné úlohy Chemickej olympiády v kategórii B Pre druhé ročníky stredných škôl Študijné kolo Riešenie a hodnotenie teoretických a praktických úloh 2007/08 Vydala Iuventa v spolupráci so Slovenskou komisiou
Súťažné úlohy Chemickej olympiády v kategórii B Pre druhé ročníky stredných škôl Študijné kolo Riešenie a hodnotenie teoretických a praktických úloh 2007/08 Vydala Iuventa v spolupráci so Slovenskou komisiou
Gymnázium, Brno, Elgartova 3
 Gymnázium, Brno, Elgartova 3 GE - Vyšší kvalita výuky CZ.1.07/1.5.00/34.0925 III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Téma: Základy názvosloví Autor: Název: Mgr. Petra Holzbecherová Anorganické
Gymnázium, Brno, Elgartova 3 GE - Vyšší kvalita výuky CZ.1.07/1.5.00/34.0925 III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Téma: Základy názvosloví Autor: Název: Mgr. Petra Holzbecherová Anorganické
Základy analýzy potravin Přednáška 1
 ANALÝZA POTRAVIN Význam a využití kontrola jakosti surovin, výrobků jakost výživová jakost technologická jakost hygienická autenticita, identita potravinářských materiálů hodnocení stravy (diety) Analytické
ANALÝZA POTRAVIN Význam a využití kontrola jakosti surovin, výrobků jakost výživová jakost technologická jakost hygienická autenticita, identita potravinářských materiálů hodnocení stravy (diety) Analytické
CHO cvičení, FSv, ČVUT v Praze
 2. Chemické rovnice Chemická rovnice je schématický zápis chemického děje (reakce), který nás informuje o reaktantech (výchozích látkách), produktech, dále o stechiometrii reakce tzn. o vzájemném poměru
2. Chemické rovnice Chemická rovnice je schématický zápis chemického děje (reakce), který nás informuje o reaktantech (výchozích látkách), produktech, dále o stechiometrii reakce tzn. o vzájemném poměru
NÁZVOSLOVÍ ANORGANICKÝCH SLOUČENIN
 NÁZVOSLOVÍ ANORGANICKÝCH SLOUČENIN univerzální jazyk chemiků ( abeceda; chem. vzorce ; chem. rovnice ) české názvosloví je jedno z nejdokonalejších na světě (prof. Emil Votoček) OXIDAČNÍ ČÍSLO = náboj,
NÁZVOSLOVÍ ANORGANICKÝCH SLOUČENIN univerzální jazyk chemiků ( abeceda; chem. vzorce ; chem. rovnice ) české názvosloví je jedno z nejdokonalejších na světě (prof. Emil Votoček) OXIDAČNÍ ČÍSLO = náboj,
Vyšší odborná škola, Obchodní akademie a Střední odborná škola EKONOM, o. p. s. Litoměřice, Palackého 730/1
 DUM Základy přírodních věd DUM III/2-T30 Téma: Kyseliny Střední škola Rok: 2012 2013 Varianta: A Kyseliny Zpracoval: Mgr. Pavel Hrubý Mgr. Josef Kormaník VÝKLAD jsou to sloučeniny KYSELINY ve vodných roztocích
DUM Základy přírodních věd DUM III/2-T30 Téma: Kyseliny Střední škola Rok: 2012 2013 Varianta: A Kyseliny Zpracoval: Mgr. Pavel Hrubý Mgr. Josef Kormaník VÝKLAD jsou to sloučeniny KYSELINY ve vodných roztocích
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost.
 Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
PERIODICKÁ SÚSTAVA PRVKOV
 PERIODICKÁ SÚSTAVA PRVKOV PERIODICKÝ ZÁKON Mendelejev (1869) zoradil 68 známych prvkov do sústavy na základe periodického zákona: Vlastnosti prvkov a ich zlúčenín sú periodickou funkciou ich atómových
PERIODICKÁ SÚSTAVA PRVKOV PERIODICKÝ ZÁKON Mendelejev (1869) zoradil 68 známych prvkov do sústavy na základe periodického zákona: Vlastnosti prvkov a ich zlúčenín sú periodickou funkciou ich atómových
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939. Název projektu: Investice do vzdělání - příslib do budoucnosti
 Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
ANODA KATODA elektrolyt:
 Ukázky z pracovnívh listů 1) Naznač pomocí šipek, které částice putují k anodě a které ke katodě. Co je elektrolytem? ANODA KATODA elektrolyt: Zn 2+ Cl - Zn 2+ Zn 2+ Cl - Cl - Cl - Cl - Cl - Zn 2+ Cl -
Ukázky z pracovnívh listů 1) Naznač pomocí šipek, které částice putují k anodě a které ke katodě. Co je elektrolytem? ANODA KATODA elektrolyt: Zn 2+ Cl - Zn 2+ Zn 2+ Cl - Cl - Cl - Cl - Cl - Zn 2+ Cl -
Výukový materiál zpracován v rámci operačního projektu. EU peníze školám. Registrační číslo projektu: CZ.1.07/1.5.00/34.0512
 Výukový materiál zpracován v rámci operačního projektu EU peníze školám Registrační číslo projektu: CZ.1.07/1.5.00/34.0512 Střední škola ekonomiky, obchodu a služeb SČMSD Benešov, s.r.o. CHEMIE Anorganická
Výukový materiál zpracován v rámci operačního projektu EU peníze školám Registrační číslo projektu: CZ.1.07/1.5.00/34.0512 Střední škola ekonomiky, obchodu a služeb SČMSD Benešov, s.r.o. CHEMIE Anorganická
Redoxní reakce - rozdělení
 zdroj: http://xantina.hyperlink.cz/ Redoxní reakce - rozdělení Redoxní reakce můžeme rozdělit podle počtu atomů, které během reakce mění svá oxidační čísla. 1. Atomy dvou prvků mění svá oxidační čísla
zdroj: http://xantina.hyperlink.cz/ Redoxní reakce - rozdělení Redoxní reakce můžeme rozdělit podle počtu atomů, které během reakce mění svá oxidační čísla. 1. Atomy dvou prvků mění svá oxidační čísla
POKYNY TEORETICKÁ ČÁST
 POKYNY nejprve si prostuduj teoretickou část s uvedenými typovým příklady jakmile si budeš jist, že teoretickou část zvládáš, procvič si své dovednosti na příkladech k procvičování jako doplňující úlohu
POKYNY nejprve si prostuduj teoretickou část s uvedenými typovým příklady jakmile si budeš jist, že teoretickou část zvládáš, procvič si své dovednosti na příkladech k procvičování jako doplňující úlohu
Kyseliny. Gerber (~1300) příprava H 2 SO 4, HNO 3. Libavius příprava HCl a aqua regia (rozpouští Au)
 Kyseliny Gerber (~1300) příprava H 2 SO 4, HNO 3 Libavius příprava HCl a aqua regia (rozpouští Au) Chemická látka produkovaná na světě v největším množství za rok: H 2 SO 4 Andreas Libau (Libavius) (1540-1616)
Kyseliny Gerber (~1300) příprava H 2 SO 4, HNO 3 Libavius příprava HCl a aqua regia (rozpouští Au) Chemická látka produkovaná na světě v největším množství za rok: H 2 SO 4 Andreas Libau (Libavius) (1540-1616)
Teorie kyselin a zásad poznámky 5.A GVN
 Teorie kyselin a zásad poznámky 5A GVN 13 června 2007 Arrheniova teorie platná pouze pro vodní roztoky kyseliny jsou látky schopné ve vodném roztoku odštěpit vodíkový kation H + HCl H + + Cl - CH 3 COOH
Teorie kyselin a zásad poznámky 5A GVN 13 června 2007 Arrheniova teorie platná pouze pro vodní roztoky kyseliny jsou látky schopné ve vodném roztoku odštěpit vodíkový kation H + HCl H + + Cl - CH 3 COOH
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939. Název projektu: Investice do vzdělání - příslib do budoucnosti
 Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
Didaktika chemického anorg. názvosloví
 Didaktika chemického anorg. názvosloví RNDr. Milan Šmídl, Ph.D. 1 Didaktické zpracování zopakovat základní pojmy týkající se tvorby a čtení chemického názvosloví a správných českých a latinských názvů
Didaktika chemického anorg. názvosloví RNDr. Milan Šmídl, Ph.D. 1 Didaktické zpracování zopakovat základní pojmy týkající se tvorby a čtení chemického názvosloví a správných českých a latinských názvů
DUM VY_52_INOVACE_12CH04
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH04 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH04 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ)
 KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Úloha 1 Ic), IIa), IIId), IVb) za každé správné přiřazení po 1 bodu; celkem Úloha 2 8 bodů 1. Sodík reaguje s vodou za vzniku hydroxidu sodného a dalšího produktu.
KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Úloha 1 Ic), IIa), IIId), IVb) za každé správné přiřazení po 1 bodu; celkem Úloha 2 8 bodů 1. Sodík reaguje s vodou za vzniku hydroxidu sodného a dalšího produktu.
DUM VY_52_INOVACE_12CH06
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH06 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH06 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Příklad Sestavte rovnice následujících dějů: reakce hydroxidu sodného s kyselinou tetrahydrogendifosforečnou 4NaOH + H 4 P 2 O 7 Na 4 P 2 O 7
 Příklad 2.2.9. Sestavte rovnice následujících dějů: reakce hydroxidu sodného s kyselinou tetrahydrogendifosforečnou 4NaOH + H 4 P 2 O 7 Na 4 P 2 O 7 + 4H 2 O reakce dimerního oxidu antimonitého s kyselinou
Příklad 2.2.9. Sestavte rovnice následujících dějů: reakce hydroxidu sodného s kyselinou tetrahydrogendifosforečnou 4NaOH + H 4 P 2 O 7 Na 4 P 2 O 7 + 4H 2 O reakce dimerního oxidu antimonitého s kyselinou
Gymnázium Jana Pivečky a Střední odborná škola Slavičín. III/2 Inovace a zkvalitnění výuky prostřednictvím ITC
 Název projektu Číslo projektu Název školy Autor Název šablony Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748 Gymnázium Jana Pivečky a Střední odborná škola Slavičín Mgr. Veronika Prchlíková
Název projektu Číslo projektu Název školy Autor Název šablony Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748 Gymnázium Jana Pivečky a Střední odborná škola Slavičín Mgr. Veronika Prchlíková
NEVLASTNÁ VODIVOSŤ POLOVODIČOVÉHO MATERIÁLU TYPU P
 NEVLASTNÁ VODIVOSŤ POLOVODIČOVÉHO MATERIÁLU TYPU P 1. VLASTNÉ POLOVODIČE Vlastnými polovodičmi nazývame polovodiče chemicky čisté, bez prímesí iných prvkov. V súčasnosti je najpoužívanejším polovodičovým
NEVLASTNÁ VODIVOSŤ POLOVODIČOVÉHO MATERIÁLU TYPU P 1. VLASTNÉ POLOVODIČE Vlastnými polovodičmi nazývame polovodiče chemicky čisté, bez prímesí iných prvkov. V súčasnosti je najpoužívanejším polovodičovým
Chemická väzba. CHÉMIA Ing. Iveta Bruončová. Moderné vzdelávanie pre vedomostnú spoločnosť/projekt je spolufinancovaný zo zdrojov EÚ
 Chemická väzba CHÉMIA Ing. Iveta Bruončová Moderné vzdelávanie pre vedomostnú spoločnosť/projekt je spolufinancovaný zo zdrojov EÚ Podmienky vzniku chemickej väzby nevyhnutným predpokladom vzniku molekuly
Chemická väzba CHÉMIA Ing. Iveta Bruončová Moderné vzdelávanie pre vedomostnú spoločnosť/projekt je spolufinancovaný zo zdrojov EÚ Podmienky vzniku chemickej väzby nevyhnutným predpokladom vzniku molekuly
Modul 02 Přírodovědné předměty
 Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 Přírodovědné předměty VII.A skupina 17. skupina
Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 Přírodovědné předměty VII.A skupina 17. skupina
Chemické názvosloví anorganických sloučenin 1
 Chemické názvosloví anorganických sloučenin 1 Dvouprvkové sloučeniny Dostupné z Metodického portálu www.rvp.cz, ISSN: 1802-4785, financovaného z ESF a státního rozpočtu ČR. Provozováno Výzkumným ústavem
Chemické názvosloví anorganických sloučenin 1 Dvouprvkové sloučeniny Dostupné z Metodického portálu www.rvp.cz, ISSN: 1802-4785, financovaného z ESF a státního rozpočtu ČR. Provozováno Výzkumným ústavem
Přehled zakončení názvů anorganických sloučenin a iontů
 Hodnota kladného oxidačního čísla Přehled zakončení názvů anorganických sloučenin a iontů Zakončení příd. jména binární sl. hydroxidu soli kationtu Zakončení přídavného jména kyseliny jejího aniontu Zakončení
Hodnota kladného oxidačního čísla Přehled zakončení názvů anorganických sloučenin a iontů Zakončení příd. jména binární sl. hydroxidu soli kationtu Zakončení přídavného jména kyseliny jejího aniontu Zakončení
SLOVENSKÁ KOMISIA CHEMICKEJ OLYMPIÁDY
 SLOVENSKÁ KOMISIA CHEMICKEJ OLYMPIÁDY CHEMICKÁ OLYMPIÁDA 53. ročník, školský rok 2016/2017 Kategória C Krajské kolo TEORETICKÉ ÚLOHY ÚLOHY Z ANORGANICKEJ, VŠEOBECNEJ A ORGANICKEJ CHÉMIE Chemická olympiáda
SLOVENSKÁ KOMISIA CHEMICKEJ OLYMPIÁDY CHEMICKÁ OLYMPIÁDA 53. ročník, školský rok 2016/2017 Kategória C Krajské kolo TEORETICKÉ ÚLOHY ÚLOHY Z ANORGANICKEJ, VŠEOBECNEJ A ORGANICKEJ CHÉMIE Chemická olympiáda
Názvosloví kyselin a hydroxidů
 Názvosloví kyselin a hydroxidů Dostupné z Metodického portálu www.rvp.cz, ISSN: 1802-4785, financovaného z ESF a státního rozpočtu ČR. Provozováno Výzkumným ústavem pedagogickým v Praze. Kyseliny Kyseliny
Názvosloví kyselin a hydroxidů Dostupné z Metodického portálu www.rvp.cz, ISSN: 1802-4785, financovaného z ESF a státního rozpočtu ČR. Provozováno Výzkumným ústavem pedagogickým v Praze. Kyseliny Kyseliny
DUM VY_52_INOVACE_12CH19
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH19 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH19 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Masarykova střední škola zemědělská a Vyšší odborná škola, Opava, příspěvková organizace
 Číslo projektu Číslo materiálu Název školy Autor Průřezové téma Tematický celek CZ.1.07/1.5.00/34.0565 VY_32_INOVACE_347_Chemické reakce a rovnice Masarykova střední škola zemědělská a Vyšší odborná škola,
Číslo projektu Číslo materiálu Název školy Autor Průřezové téma Tematický celek CZ.1.07/1.5.00/34.0565 VY_32_INOVACE_347_Chemické reakce a rovnice Masarykova střední škola zemědělská a Vyšší odborná škola,
U 218 - Ústav procesní a zpracovatelské techniky FS ČVUT
 Sloučeniny, jejichž stavební částice (molekuly, ionty) jsou tvořeny atomy dvou různých chemických prvků. Obecný vzorec: M m X n M - prvek s kladným oxidačním číslem OM X - prvek se záporným oxidačním číslem
Sloučeniny, jejichž stavební částice (molekuly, ionty) jsou tvořeny atomy dvou různých chemických prvků. Obecný vzorec: M m X n M - prvek s kladným oxidačním číslem OM X - prvek se záporným oxidačním číslem
Sú ažné úlohy Chemickej olympiády v kategórii C. Krajské kolo Zadanie teoretických úloh 2007/2008
 Sú ažné úlohy Chemickej olympiády v kategórii C Pre prvé ročníky stredných škôl Krajské kolo Zadanie teoretických úloh 2007/2008 Vydala IUVENTA v spolupráci so Slovenskou komisiou Chemickej olympiády v
Sú ažné úlohy Chemickej olympiády v kategórii C Pre prvé ročníky stredných škôl Krajské kolo Zadanie teoretických úloh 2007/2008 Vydala IUVENTA v spolupráci so Slovenskou komisiou Chemickej olympiády v
HALOGENIDY. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 27. 2. 2013. Ročník: osmý
 Autor: Mgr. Stanislava Bubíková HALOGENIDY Datum (období) tvorby: 27. 2. 2013 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Anorganické sloučeniny 1 Anotace: Žáci se seznámí s dvouprvkovými
Autor: Mgr. Stanislava Bubíková HALOGENIDY Datum (období) tvorby: 27. 2. 2013 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Anorganické sloučeniny 1 Anotace: Žáci se seznámí s dvouprvkovými
Střední průmyslová škola strojnická Vsetín Číslo projektu. Druh učebního materiálu prezentace Pravidla pro tvorbu vzorců a názvů kyselin a solí
 Název školy Střední průmyslová škola strojnická Vsetín Číslo projektu CZ.1.07/1.5.00/34.0483 Autor RNDr. Miroslava Pospíšilíková Název šablony III/2 Název DUMu 10.3 Názvosloví kyselin a solí Tematická
Název školy Střední průmyslová škola strojnická Vsetín Číslo projektu CZ.1.07/1.5.00/34.0483 Autor RNDr. Miroslava Pospíšilíková Název šablony III/2 Název DUMu 10.3 Názvosloví kyselin a solí Tematická
Ing. Motešický POLOVODIČE
 Ing. Motešický POLOVODIČE Zopakujme si: Látky z hľadiska vedenia elektrického prúdu delíme na: 1. vodiče - kladú prechádzajúcemu el. I nízky R, majú vysokú el. vodivosť G, látka má veľké množstvo voľných
Ing. Motešický POLOVODIČE Zopakujme si: Látky z hľadiska vedenia elektrického prúdu delíme na: 1. vodiče - kladú prechádzajúcemu el. I nízky R, majú vysokú el. vodivosť G, látka má veľké množstvo voľných
VII. skupina PS, ns 2 np 5 Fluor, chlor, brom, jod, astat
 VII. skupina PS, ns 2 np 5 Fluor, chlor, brom, jod, astat Charakteristika: název halogeny (halové prvky) je odvozen z řečtiny a znamená solitvorný. se silně elektronegativními prvky jako je kyslík nebo
VII. skupina PS, ns 2 np 5 Fluor, chlor, brom, jod, astat Charakteristika: název halogeny (halové prvky) je odvozen z řečtiny a znamená solitvorný. se silně elektronegativními prvky jako je kyslík nebo
Autorem materiálu je Ing. Dagmar Berková, Waldorfská škola Příbram, Hornická 327, Příbram, okres Příbram Inovace školy Příbram, EUpenizeskolam.
 Šablona č. I, sada č. 2 Vzdělávací oblast Vzdělávací obor Tematický okruh Téma Člověk a příroda Chemie Obecná a anorganická chemie Oxidy, sulfidy, halogenovodíky a halogenovodíkové kyseliny, redoxní reakce
Šablona č. I, sada č. 2 Vzdělávací oblast Vzdělávací obor Tematický okruh Téma Člověk a příroda Chemie Obecná a anorganická chemie Oxidy, sulfidy, halogenovodíky a halogenovodíkové kyseliny, redoxní reakce
RIEŠENIE A HODNOTENIE ÚLOH Z TECHNOLOGICKÝCH VÝPOČTOV (I) Chemická olympiáda kategória EF úroveň E 45. ročník Školský rok 2008/2009
 RIEŠENIE A HODNOTENIE ÚLOH Z TECHNOLOGICKÝCH VÝPOČTOV (I) Chemická olympiáda kategória EF úroveň E 45. ročník Školský rok 2008/2009 Celoštátne kolo Ľudmila Glosová Stredná odborná škola, Nováky Maximálne
RIEŠENIE A HODNOTENIE ÚLOH Z TECHNOLOGICKÝCH VÝPOČTOV (I) Chemická olympiáda kategória EF úroveň E 45. ročník Školský rok 2008/2009 Celoštátne kolo Ľudmila Glosová Stredná odborná škola, Nováky Maximálne
Otázky a jejich autorské řešení
 Otázky a jejich autorské řešení Otázky: 1a Co jsou to amfoterní látky? a. látky krystalizující v krychlové soustavě b. látky beztvaré c. látky, které se chovají jako kyselina nebo jako zásada podle podmínek
Otázky a jejich autorské řešení Otázky: 1a Co jsou to amfoterní látky? a. látky krystalizující v krychlové soustavě b. látky beztvaré c. látky, které se chovají jako kyselina nebo jako zásada podle podmínek
Vyšší odborná škola, Obchodní akademie a Střední odborná škola EKONOM, o. p. s. Litoměřice, Palackého 730/1
 DUM Základy přírodních věd DUM III/2-T3-11 Téma: Soli Střední škola ok: 2012 2013 Varianta: A Soli Zpracoval: Mgr. Pavel Hrubý Mgr. Josef Kormaník SOLI sůl je sloučenina, která se skládá z iontu kovu a
DUM Základy přírodních věd DUM III/2-T3-11 Téma: Soli Střední škola ok: 2012 2013 Varianta: A Soli Zpracoval: Mgr. Pavel Hrubý Mgr. Josef Kormaník SOLI sůl je sloučenina, která se skládá z iontu kovu a
Gymnázium, Brno, Elgartova 3
 Gymnázium, Brno, Elgartova 3 Šablona: III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Název projektu: GE Vyšší kvalita výuky Číslo projektu: CZ.1.07/1.5.00/34.0925 Autor: Mgr. Petra Holzbecherová
Gymnázium, Brno, Elgartova 3 Šablona: III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Název projektu: GE Vyšší kvalita výuky Číslo projektu: CZ.1.07/1.5.00/34.0925 Autor: Mgr. Petra Holzbecherová
Chemické názvosloví anorganických sloučenin 2
 Chemické názvosloví anorganických sloučenin 2 Tříprvkové sloučeniny Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je. Mgr. Vlastimil Vaněk. Dostupné z Metodického portálu www.rvp.cz, ISSN:
Chemické názvosloví anorganických sloučenin 2 Tříprvkové sloučeniny Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je. Mgr. Vlastimil Vaněk. Dostupné z Metodického portálu www.rvp.cz, ISSN:
12.CHALKOGENY A HALOGENY
 12.CHALKOGENY A HALOGENY Chalkogeny ( česky se jedná o prvky ) 1) Popiš obecnou charakteristiku dané skupiny (počet valenčních elektronů, obecná elektronová konfigurace valenční vrstvy, způsoby dosažení
12.CHALKOGENY A HALOGENY Chalkogeny ( česky se jedná o prvky ) 1) Popiš obecnou charakteristiku dané skupiny (počet valenčních elektronů, obecná elektronová konfigurace valenční vrstvy, způsoby dosažení
NABÍDKA PRODUKTŮ PRO ŠKOLY
 NABÍDKA PRODUKTŮ PRO ŠKOLY Naše společnost Puralab s.r.o. se zaměřuje na výrobu chemických látek, především pak na výrobu vysoce čistých látek, nejčastěji anorganických solí kovů. Jako doplňkový sortiment
NABÍDKA PRODUKTŮ PRO ŠKOLY Naše společnost Puralab s.r.o. se zaměřuje na výrobu chemických látek, především pak na výrobu vysoce čistých látek, nejčastěji anorganických solí kovů. Jako doplňkový sortiment
Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/
 Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/34.0448 Číslo projektu Číslo materiálu Název školy Autor Tematický celek Ročník CZ.1.07/1.5.00/34.0448 ICT-PZC_2_6 Test obecná chemie Střední
Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/34.0448 Číslo projektu Číslo materiálu Název školy Autor Tematický celek Ročník CZ.1.07/1.5.00/34.0448 ICT-PZC_2_6 Test obecná chemie Střední
Gymnázium a Střední odbornáškola, Rokycany, Mládežníků 1115
 Gymnázium a Střední odbornáškola, Rokycany, Mládežníků 1115 Číslo projektu: CZ.1.07/1.5.00/34.0410 Číslo šablony: 1 Název materiálu: Ročník: Identifikace materiálu: Jméno autora: Předmět: Tématický celek:
Gymnázium a Střední odbornáškola, Rokycany, Mládežníků 1115 Číslo projektu: CZ.1.07/1.5.00/34.0410 Číslo šablony: 1 Název materiálu: Ročník: Identifikace materiálu: Jméno autora: Předmět: Tématický celek:
CZ.1.07/1.5.00/ Zkvalitnění výuky prostřednictvím ICT. Halogeny VY_32_INOVACE_18_18. Mgr. Věra Grimmerová
 Průvodka Číslo projektu Název projektu Číslo a název šablony klíčové aktivity CZ.1.07/1.5.00/34.0802 Zkvalitnění výuky prostřednictvím ICT III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Příjemce
Průvodka Číslo projektu Název projektu Číslo a název šablony klíčové aktivity CZ.1.07/1.5.00/34.0802 Zkvalitnění výuky prostřednictvím ICT III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Příjemce
I II III IV V VI VII VIII I II III IV V VI VII VIII. Li Be B C N O F Ne. K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
 Halogeny prvky s 2 p 5 ACH 09 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K
Halogeny prvky s 2 p 5 ACH 09 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K
EU peníze středním školám digitální učební materiál
 EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
45. ročník. ŠKOLNÍ KOLO kategorie D. Národní institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády
 Národní institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 45. ročník 2008 2009 ŠKOLNÍ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH Národní institut dětí
Národní institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 45. ročník 2008 2009 ŠKOLNÍ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH Národní institut dětí
VII. skupina PS, ns 2 np 5
 VII. skupina PS, ns 2 np 5 Fluor, chlor, brom, jod, astat Charakteristika: název halogeny (halové prvky) je odvozen z řečtiny a znamená solitvorný. se silně elektronegativními prvky jako je kyslík nebo
VII. skupina PS, ns 2 np 5 Fluor, chlor, brom, jod, astat Charakteristika: název halogeny (halové prvky) je odvozen z řečtiny a znamená solitvorný. se silně elektronegativními prvky jako je kyslík nebo
KOMPLEXOTVORNÉ REAKCE
 KOMPLEXOTVORNÉ REAKCE RNDr. Milan Šmídl, Ph.D. Cvičení z analytické chemie ZS 2014/2015 Komplexní sloučeniny - ligandy (L) se váží k centrálnímu atomu (M) - komplexem může být elektroneutrální nebo nabitý
KOMPLEXOTVORNÉ REAKCE RNDr. Milan Šmídl, Ph.D. Cvičení z analytické chemie ZS 2014/2015 Komplexní sloučeniny - ligandy (L) se váží k centrálnímu atomu (M) - komplexem může být elektroneutrální nebo nabitý
[ ] d[ Y] rychlost REAKČNÍ KINETIKA X Y
![[ ] d[ Y] rychlost REAKČNÍ KINETIKA X Y [ ] d[ Y] rychlost REAKČNÍ KINETIKA X Y](/thumbs/78/77051926.jpg) REAKČNÍ KINETIKA Faktory ovlivňující rychlost chemických reakcí Chemická povaha reaktantů - reaktivita Fyzikální stav reaktantů homogenní vs. heterogenní reakce Teplota 10 C zvýšení rychlosti 2x 3x zýšení
REAKČNÍ KINETIKA Faktory ovlivňující rychlost chemických reakcí Chemická povaha reaktantů - reaktivita Fyzikální stav reaktantů homogenní vs. heterogenní reakce Teplota 10 C zvýšení rychlosti 2x 3x zýšení
DUM č. 18 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 18 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 18 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
Názvy slou enin. íslovkové p edpony
 Názvy slou enin Název slou eniny se skládá z podstatného a p ídavného jména. Podstatné jméno udává druh chemické slou eniny. Název je bu obecný (kyselina, hydroxid,...), nebo je odvozen od elektronegativní
Názvy slou enin Název slou eniny se skládá z podstatného a p ídavného jména. Podstatné jméno udává druh chemické slou eniny. Název je bu obecný (kyselina, hydroxid,...), nebo je odvozen od elektronegativní
Halogeny prvky s 2 p 5
 Halogeny prvky s 2 p 5 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N F Ne 3 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K Ca Sc Ti
Halogeny prvky s 2 p 5 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N F Ne 3 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K Ca Sc Ti
Oxidácia a redukcia redoxné reakcie prenos elektrónu zmena náboja
 Oxidácia a redukcia redoxné reakcie sú reakcie, v ktorých sa v dôsledku zmeny zloženia, štruktúry alebo náboja reagujúcich častíc mení oxidačné číslo atómov jedného alebo viacerých prvkov v týchto časticiach
Oxidácia a redukcia redoxné reakcie sú reakcie, v ktorých sa v dôsledku zmeny zloženia, štruktúry alebo náboja reagujúcich častíc mení oxidačné číslo atómov jedného alebo viacerých prvkov v týchto časticiach
Tematický výchovno-vzdelávací plán z predmetu chémia pre 8. ročník
 Tematický výchovno-vzdelávací plán z predmetu chémia pre 8. ročník Stupeň vzdelania: ISCED 2 nižšie sekundárne vzdelávanie Vzdelávacia oblasť: Človek a príroda Predmet: Chémia Ročník: ôsmy Počet hodín:
Tematický výchovno-vzdelávací plán z predmetu chémia pre 8. ročník Stupeň vzdelania: ISCED 2 nižšie sekundárne vzdelávanie Vzdelávacia oblasť: Človek a príroda Predmet: Chémia Ročník: ôsmy Počet hodín:
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost.
 Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
POZNÁMKY K PRÍPRAVE PRAKTICKEJ ČASTI
 POZNÁMKY K PRÍPRAVE PRAKTICKEJ ČASTI Chemická olympiáda kategória C 51. ročník šk. rok 2014/2015 Domáce kolo Mária Linkešová Maximálne 40 bodov (b), resp. 143 pomocných bodov (pb) Pri prepočte pomocných
POZNÁMKY K PRÍPRAVE PRAKTICKEJ ČASTI Chemická olympiáda kategória C 51. ročník šk. rok 2014/2015 Domáce kolo Mária Linkešová Maximálne 40 bodov (b), resp. 143 pomocných bodov (pb) Pri prepočte pomocných
materiál č. šablony/č. sady/č. materiálu: Autor:
 Masarykova základní škola Klatovy, tř. Národních mučedníků 185, 339 01 Klatovy; 376312154, fax 376326089 E-mail: skola@maszskt.investtel.cz; internet: www.maszskt.investtel.cz Kód přílohy vzdělávací VY_32_INOVACE_CH8SA_01_02_19
Masarykova základní škola Klatovy, tř. Národních mučedníků 185, 339 01 Klatovy; 376312154, fax 376326089 E-mail: skola@maszskt.investtel.cz; internet: www.maszskt.investtel.cz Kód přílohy vzdělávací VY_32_INOVACE_CH8SA_01_02_19
Vplyv aniónov na sorpciu
 UNIVERZITA KOMENSKÉHO V BRATISLAVE PRÍRODOVEDECKÁ FAKULTA Vplyv aniónov na sorpciu 99m TcO 4- na Sn-hydroxyapatit JADROVÁ CHÉMIA V ŠKOLSTVE, VÝSKUME, PRIEMYSLE A PREVÁDZKE JADROVÝCH ELEKTRÁRNÍ Modra-Harmónia
UNIVERZITA KOMENSKÉHO V BRATISLAVE PRÍRODOVEDECKÁ FAKULTA Vplyv aniónov na sorpciu 99m TcO 4- na Sn-hydroxyapatit JADROVÁ CHÉMIA V ŠKOLSTVE, VÝSKUME, PRIEMYSLE A PREVÁDZKE JADROVÝCH ELEKTRÁRNÍ Modra-Harmónia
Iontové reakce. Iontové reakce. Protolytické reakce. Teorie kyselin a zásad. Kyseliny dle Brønstedovy. nstedovy-lowryho teorie. Sytnost (proticita(
 Iontové reakce Iontové reakce Reakce v roztocích elektrolytů Protolytické (acidobazické) reakce reaktanty si vyměňují Redoxní (oxidačně redukční) reakce reaktanty si vyměňují e Srážecí reakce ionty tvoří
Iontové reakce Iontové reakce Reakce v roztocích elektrolytů Protolytické (acidobazické) reakce reaktanty si vyměňují Redoxní (oxidačně redukční) reakce reaktanty si vyměňují e Srážecí reakce ionty tvoří
Kyseliny. Gerber - Jabir ibn Hayyan ( ) Chemická látka produkovaná na světě v největším množství za rok: H 2 SO 4
 Kyseliny Gerber - Jabir ibn Hayyan (721-815) Andreas Libau (Libavius) (1540-1616) Gerber - příprava z H 2 SO 4 a solí: HNO 3, HCl a aqua regia, izolace kyseliny citronové, octové a vinné Libavius - příprava
Kyseliny Gerber - Jabir ibn Hayyan (721-815) Andreas Libau (Libavius) (1540-1616) Gerber - příprava z H 2 SO 4 a solí: HNO 3, HCl a aqua regia, izolace kyseliny citronové, octové a vinné Libavius - příprava
