Možnosti systémové léčby karcinomu prostaty
|
|
|
- Stanislava Staňková
- před 9 lety
- Počet zobrazení:
Transkript
1 168 Možnosti systémové léčby karcinomu prostaty MUDr. Kamil Belej, Ph.D., FEBU, MUDr. Ondřej Kaplan Urologické oddělení, Ústřední vojenská nemocnice, Praha Systémová léčba karcinomu prostaty spočívá v podávání látek ovlivňujících primární nádor i metastatická ložiska. Jejím základem je hormonální léčba, doplněná o prevenci a terapii kostních změn a případnou chemoterapii. V článku je uveden souhrn současného stavu problematiky a možnosti použití jednotlivých způsobů léčby. Klíčová slova: karcinom prostaty, hormonální léčba, bisfosfonáty, chemoterapie. Possibilities in systemic therapy of the prostate cancer Systemic therapy of the prostate cancer comprises an application of the medication influencing primary tumor and also metastases. This treatment is based on the hormonal therapy combined with prevention and therapy of the bone changes and in some cases chemotherapy. Current status in this field and possible use of the certain treatment modalities are summarized in the article. Key words: prostate cancer, hormonal therapy, bisphosphonates, chemotherapy. Urolog. pro Praxi, 2009; 10(3): Hormonální léčba Strategii použití hormonální léčby jsme popsali v jiném článku (1) a dále budou uvedeny jen údaje související s jejím praktickým použitím a indikacemi, včetně možných režimů podání. Antiandrogeny Cyproteronacetát (CPA) byl prvním steroidním antiandrogenem zavedeným do klinické praxe. Z hlediska farmakodynamického působí dvojitým mechanizmem: inhibuje sekreci gonadotropinů (progesteronový antigonadotropní účinek) a blokuje androgenní receptor na buněčné úrovni, což způsobuje pokles hladiny testosteronu, dihydrotestosteronu, estradiolu, FSH a LH. Byl prokázán i slabý glukokortikoidní účinek, který pravděpodobně nemá vliv na léčbu karcinomu prostaty, ale projevuje se v interakcích s jinými léky. Při aplikaci CPA dochází ke ztrátě libida a potence v důsledku snížení koncentrace testosteronu, což je důležité zejména u mladších pacientů. CPA může způsobit i kardiovaskulární nežádoucí účinky, které se však vyskytují v menším rozsahu než při léčbě dietylstilbestrolem. Mezi další účinky patří gynekomastie, hepatotoxicita a alopecie. Ke kontraindikacím patří onemocnění jater, Dubin-Johnsonův/Rotorův syndrom, v minulosti zjištěný nebo stávající nádor jater, těžké chronické deprese, těžký diabetes mellitus s cévními změnami, srpkovitá anémie, trombembolické příhody (i v anamnéze) a dekompenzovaná arteriální hypertenze. Důležitá je informace, že CPA snižuje účinek perorálních antidiabetik a inzulinu. Při dlouhotrvající léčbě (> 1 3 měsíce) je potřeba u nemocných s diabetes mellitus sledovat pečlivěji glykemii, jaterní testy (AST, ALT, bilirubin), krevní tlak u nemocných s hypertenzí a psychický stav pacientů s depresí. CPA se používá při maximální androgenní blokádě nebo sekundární hormonální léčbě a v prevenci návalů horka a flare up fenoménu po kastraci. Nadále zůstává i jako účinná alternativa při nesnášenlivosti nesteroidních antiandrogenů při recidivě karcinomu prostaty po lokální léčbě nebo u metastatického karcinomu prostaty. Nesteroidní antiandrogeny se váží na steroidní receptory v jádru buňky. V cílových tkáních inhibují vychytávání androgenů a inhibují vazbu na androgenní receptor a blokují tak androgenní stimulaci. Nesteroidní antiandrogeny obecně (podobně jako steroidní látky) nezpůsobují flare up efekt, metabolický syndrom a neovlivňují ani kostní metabolizmus. Ve srovnání s cyproteronacetátem nemá léčba významné nežádoucí účinky na kardiovaskulární systém. Při léčbě nesteroidními antiandrogeny je zachováno libido a potence, jako důsledek vzestupu hladiny testosteronu, dihydrotestosteronu, estradiolu a LH. První používanou látkou je flutamid. Je kontraindikován při těžší poruše funkce jater a léčba by neměla být započata u pacientů, u nichž hodnoty transamináz převyšují 2 3 horní hranici normálu. U všech pacientů musí být pravidelně sledovány jaterní testy a je potřeba je odebrat kdykoliv při prvních příznacích poruchy jater (pruritus, žloutenka, flu-like syndrom, atd.). Je indikován při maximální androgenní blokádě nebo sekundární hormonální léčbě. Lze jej použít jako alternativu při nesnášenlivosti bicalutamidu při recidivě karcinomu po lokální léčbě. Další látkou z této skupiny je nilutamid. Při jeho použití je důležité, že aplikace může být spojena s disulfiramovým efektem (intolerance alkoholu) a dále s poklesem rychlosti adaptace na přechod světlo tma. Nežádoucí účinky jsou však reverzibilní a po přerušení léčby rychle vymizí. U pacientů může dojít k rozvoji intersticiální pneumonie s možnou progresí v plicní fibrózu. Před podáním u nemocných s dechovými potížemi musí proto být provedeno plicní vyšetření a pacienty nutno upozornit, aby dýchací obtíže hlásili lékaři. Dále je třeba monitorovat jaterní funkce jsou-li hodnoty jaterních testů 3 vyšší než horní hranice normy, je nutné léčbu ukončit. Poruchy zraku mohou zhoršit schopnosti řízení motorových vozidel nebo obsluhy strojů. Nilutamid inhibicí cytochromu P 450 (CYP450) v játrech zvyšuje hladiny současně podávaných antagonistů vitaminu K, diazepamu a teofylinu. Nilutamid je určen pro maximální androgenní blokádu nebo sekundární hormonální léčbu. Poslední látkou z této skupiny je bicalutamid. Kromě gynekomastie mají při jeho použití největší význam jaterní změny různého stupně, které se ve studiích většinou objevily do 6 měsíců od začátku léčby a jsou přechodného rázu. Proto se doporučuje pravidelné sledování jaterních testů. Bicalutamid je kontraindikován při přecitlivělosti na účinnou látku. Nutno poznamenat, že inhibuje cytochrom P450 3A4 (ten metabolizuje kolem 60 % xenobiotik i endogenních látek), takže je třeba opatrnost při současném podávání léčiv, které jsou metabolizovány převážně touto cestou (např. cyklosporinu, astemizolu, terfenadinu, blokátorů kalciového kanálu, cisapridu). Současné podávání jiných inhibitorů CYP450 (např. cimetidinu, ketokonazolu) vede ke zpomalenému odbourávání bicalutamidu a tím k jeho vyšší účinnosti. Podobně jako fluta-
2 170 mid vytěsňuje z vazby na bílkoviny krevní plazmy zvláště kumarinová antikoagulancia, proto je nutno v případě současné antikoagulační léčby warfarinem pečlivě monitorovat protrombinový čas (INR). Jelikož použití bicalutamidu přineslo výrazný posun v hormonální léčbě, bude jeho použití v léčbě karcinomu prostaty probráno podrobněji. Jak již bylo uvedeno, je flutamid a nilutamid indikován v rámci maximální androgenní blokády nebo sekundární hormonální léčby. Z dostupných studií vyplývá, že monoterapie nilutamidem a flutamidem nemá stanovené indikace, a tudíž ji nelze použít v běžné klinické praxi (2). Naopak bicalutamid je možno kromě uvedených indikací, kdy se používá v dávce 50 mg denně, při monoterapii použít. Na základě studií, hodnotících účinnost dávek bicalutamidu podle snížení hladiny PSA, byla stanovena jeho dávka pro monoterapii, a to 150 mg 1 denně. V rámci klinického hodnocení byla tato dávka srovnávána s hormonální ablací (orchiektomií nebo goserelinacetátem v dávce 3,6 mg podaným každých 28 dnů) u nemocných s lokalizovaným, lokálně pokročilým nebo metastatickým karcinomem prostaty. U nemocných s metastatickým karcinomem prostaty byla po průměrné době sledování 1,9 roku prokázána významně lepší účinnost kastrace. Na základě uvedených výsledků byla studie v této skupině přerušena a všichni nemocní podstoupili kastraci. V podrobnější analýze souboru léčeného bicalutamidem se zjistilo, že do určité vstupní hladiny PSA (< 400 ng/ml) bylo přežívání stejné jako ve skupině s kastrací. Zjištění lze vysvětlit klinickou účinností antiandrogenu, která je dána celkovým počtem přítomných androgenních receptorů a průnikem léku do tkáně nádoru což závisí na jeho celkovém objemu a (většinou) odpovídající hladině PSA. V současnosti tudíž není doporučeno jeho použití u nemocných se vzdálenými metastázami. U nemocných s lokalizovaným nebo lokálně pokročilým karcinomem prostaty se na základě povzbudivých prvních výsledků pokračovalo podle programu EPC (Early Prostate Cancer). V něm se hodnotí účinnost bicalutamidu v uvedené dávce, podávané jako doplněk standardní léčby (radikální prostatektomie, radioterapie, sledování). Program zahrnuje tři probíhající randomizované, dvojitě zaslepené, placebem kontrolované klinické studie u více než osmi tisíc mužů. První analýza byla provedena po průměrném tříletém sledování (3), druhá po více než pěti letech (4) a poslední v loňském roce po průměrném sledování 7,4 roku (5). Čtvrtá a poslední analýza byla plánována na konec roku 2008 a bude zveřejněna v dohledné době. Primárními výslednými ukazateli hodnocení léčby bylo celkové přežití a přežití bez objektivní progrese onemocnění (PFS, progression-free survival). Při celkovém hodnocení se zjistilo, že bicalutamid snížil riziko objektivní progrese onemocnění o 21 % ve srovnání se samostatnou standardní léčbou, ale nebyl zjištěn rozdíl v celkovém přežití. Snížení rizika objektivní progrese bylo nejméně výrazné u nemocných s nízkým rizikem lokální recidivy nebo generalizace. Z praktického hlediska je důležité, že podání bicalutamidu v dávce 150 mg denně nezměnilo žádný ze sledovaných parametrů u nemocných s lokalizovaným karcinomem prostaty bez ohledu na užitou standardní léčbu (6), tzn. ani při pozorném sledování. Naproti tomu byl u všech typů použité základní léčby zlepšen PFS u lokálně pokročilého karcinomu. Kromě toho bylo při použití radioterapie nebo watchful waiting v kombinaci s bicalutamidem zjištěno statisticky významné zlepšení celkového přežití. Výsledky použití kombinace radioterapie a bicalutamidu přinesly nový standard v adjuvantní léčbě, jelikož doposud byly v hormonální léčbě používány jen LH-RH analoga nebo orchiektomie. Kombinace s radikální prostatektomií u pacientů s lokálně pokročilým karcinomem prostaty tento účinek nepřinesla. Je otázkou, co v tomto ohledu přinese závěrečné hodnocení souboru a podrobnější analýza podle dalších prognostických faktorů jako jsou Gleasonovo skóre nebo PSA v době zahájení léčby. V rámci studie byl zároveň hodnocen vliv léčby na kvalitu života a výskyt nežádoucích účinků hormonální léčby. Dotazník hodnotící kvalitu života za 12 měsíců od zahájení léčby obsahoval několik položek. Z devíti hodnocených parametrů byla ve dvou položkách (libido, fyzická kondice) zjištěn statisticky významný rozdíl v neprospěch kastrace. Nemocní s metastatickým onemocněním hodnotili vliv léčby podobně. LH-RH analoga Pro praktické použití LH-RH analog je důležité uvést několik důležitých skutečností. LH-RH analoga mají delší biologický poločas než přirozený hormon, déle se váží na receptory v hypofýze a působí jako superagonisté. Kastrační hladiny testosteronu je dosaženo do 1 2 týdnů od zahájení léčby, ale k inhibici růstu buněk těmito látkami dochází ještě před dosažením kastračních hladin testosteronu. Samotný účinek léčby LH-RH analogy je srovnatelný s chirurgickou kastrací. Považuje se za standardní způsob hormonální léčby karcinomu prostaty a poskytuje výhody ireverzibilní kastrace. Obecně se ale léčba LH-RH analogy považuje za finančně náročnou alternativu bilaterální orchiektomie, navíc s potřebou aspoň přechodné kombinace s antiandrogeny. Léčba LH-RH agonisty přináší i několik problémů souvisejících s dosažením kastračních hladin testosteronu. Nejvýznamnější je výskyt fenoménu vzplanutí ( flare-up phenomenon), tzn. úvodního vzestupu hladiny testosteronu trvajícího 1 až 2 týdny, který může stimulovat růst nádoru. Proto LH-RH agonisty nelze použít v úvodní monoterapii u mužů s příznaky nebo komplikacemi metastatického onemocnění. Dalším závažným faktem je potenciálně neúplný kastrační účinek a možnost kolísání hladin androgenů při léčbě depotními preparáty LHRH agonistů (tzv. miniflare fenomén). V práci posuzující kastrační účinek LH-RH agonistů se uvádí, že existuje část mužů jenž má po monoterapii LH-RH agonisty hodnoty testosteronu nad kastrační hladinou (7). Zároveň bylo potvrzeno, že nemocní léčení depotními LH-RH analogy s kastrační hladinou testosteronu mohou mít intermitentní vzestupy PSA při změnách hladiny testosteronu. Tato situace však nenastává u každého pacienta a vyskytuje se jen u hormonálně závislého karcinomu prostaty. Změny hladin testosteronu závisí na molekulárních charakteristikách androgenního receptoru a na rezistenci vůči androgenům, kterou indukují růstové faktory. Nejdůležitější podmínkou hodnocení účinnosti medikamentózní kastrace při léčbě LH-RH analogy musí být tedy sledování hladin testosteronu a dosažení jejich trvalého snížení pod kastrační hodnotu. To platí i při vzestupu hladiny PSA po dlouhodobějším podávání LH-RH analog, jelikož může vzniknout tolerance nebo i rezistence k jejich podávání na základě zatím blíže nepopsaných mechanizmů. Při dosažení kastračních hladin stačí monoterapie LH-RH analogy. V opačném případě je indikováno doplnění androgenní blokády o léčbu antiandrogenem nebo orchiektomie. Tyto údaje nebyly ověřeny ve studii a vychází z doporučení National Comprehensive Cancer Network (8). Intermitentní androgenní blokáda Další důležitou kapitolou je možnost přerušované hormonální léčby. Ta má, zejména u metastatického karcinomu prostaty pouze paliativní účinek, a jednou z možností, jak snížit zátěž nemocných při zachované účinnosti léčby, může být intermitentní androgenní blokáda (IAB). Účinná reverzibilní androgenní blokáda je
3 171 možná jen pomocí léků a její zavedení podpořila dostupnost LH-RH analogů a antiandrogenů. Výhody IAB zahrnují snížení výskytu nežádoucích účinků, snížení nákladů na léčbu a potenciálně i oddálení vzniku hormonální rezistence onemocnění. Jejím cílem je potlačení růstu nádoru při snížených hladinách testosteronu a obnovení sexuálních funkcí v období vysazení léčby. Princip IAB spočívá v zahájení účinné suprese androgenů po zjištění diagnózy karcinomu prostaty, která obvykle trvá 6 9 měsíců. Potom následuje vysazení léčby a další sledování pacientů v pravidelných intervalech. Opakovaná měření hladiny PSA umožňují zachycení progrese onemocnění po vysazení léčby. Léčba se obnoví v případě, že sledované laboratorní hodnoty (PSA) dosáhnou hranice pro nasazení léčby. Období podávání léčby a jejího vysazení se označuje jako jeden cyklus léčby. K potlačení účinku androgenů v rámci IAB lze použít různé způsoby léčby, tzn. monoterapii LH-RH analogy, nesteroidními antiandrogeny nebo jejich kombinací. Princip IAB předpokládá, že trvalé a dlouhodobé snížení hladiny androgenů vede k rychlejšímu vzniku hormonální rezistence. IAB by tak měla umožnit obnovení citlivosti buněk k androgenům po vysazení hormonální léčby a přispět k prodloužení doby do vzniku hormonální rezistence. V současnosti ale neexistují žádné klinické údaje potvrzující tuto hypotézu. Trvalá léčba má významné nežádoucí účinky a vliv na kvalitu života asymptomatických pacientů. IAB by měla rovněž umožnit minimalizaci nežádoucích účinků léčby při zachované účinnosti. Důležitou otázkou zůstává, jestli může IAB zlepšit délku přežití. Ve všech publikovaných studiích byla potvrzena účinnost léčby v dalších cyklech u nemocných, kteří zareagovali na první cyklus. Kromě toho bylo potvrzeno obnovení libida a subjektivní zlepšení celkového stavu v době vysazení léčby (9). Použití IAB je založeno na několika teoretických předpokladech a klinických zkušenostech. K teoretickým předpokladům indikace IAB lze zahrnout hypotézu o zachování schopnosti apoptózy a diferenciace kmenových buněk při změnách hladin androgenů. Mezi fakta, potvrzená v klinických studiích a podporující použití IAB patří poznatek, že účinek hormonální léčby závisí na agresivitě a rychlosti odstranění androgenů (10). Někteří nemocní mají dlouhodobou remisi po 1 cyklu a IAB přináší zvýšení kvality života bez významných nežádoucích účinků. Na druhou stranu může hormonální léčba způsobit trvalý pokles hladiny testosteronu, která se po vysazení léčby nezvýší, a tito nemocní z IAB nemají prospěch (11). Mezi nejasnosti související s použitím IAB patří doba trvání hormonální léčby a monitorování odpovědi na léčbu. Hormonální léčba by se měla podávat do dosažení maximálního stupně apoptózy způsobené kastrací a měla by se ukončit před vznikem hormonální rezistence karcinomu. Nejvýraznější pokles PSA v průběhu tří měsíců od zahájení léčby pravděpodobně souvisí se snížením jeho tvorby v buňkách reagujících na hormonální léčbu, ale zánik těchto buněk nastává až po 8 9 měsících. Nemožnost dosažení normálních hodnot PSA v průběhu podávání léčby se obecně považuje za nepříznivý prognostický faktor. Nelze však určit, do jaké míry se na hladině PSA mohou u některých pacientů podílet jiná onemocnění prostaty ovlivňující hladinu PSA. V současnosti není k dispozici způsob ověřování citlivosti buněk na hormonální léčbu a neexistují žádné prognostické faktory hodnotící reakci nádoru na snížení hladiny androgenů. K dalším nejasnostem patří optimální délka vysazení léčby a kritéria pro její obnovení. Navíc nebyla zatím vyloučena možnost progrese nádoru v době vysazení léčby a rozvoj hormonální rezistence. V současnosti neexistují žádná doporučení týkající se indikací IAB. Všechny provedené studie hodnotily malý počet vybraných pacientů, měly krátkou dobu sledování a nebyly randomizované. Navíc je nelze srovnávat, protože se lišily vstupními kritérii, jako jsou stádium nádoru, druh podávané léčby a kompliance nemocných. Základní podmínkou úspěšnosti IAB byla rychlá reakce na zahájení hormonální léčby a kompliance pacientů. Nejvhodnějšími kandidáty pro IAB jsou nemocní s malým objemem nádoru. Patří mezi ně muži s asymptomatickou ; 10(3) Urologie pro praxi
4 172 recidivou karcinomu po předchozí kurativní lokální léčbě a pacienti s postižením uzlin nebo vzdálenými metastázami a snížením PSA pod 4 ng/ml po zahájení hormonální léčby. Nevhodní jsou nemocní s velkoobjemovým onemocněním a progredujícím nebo symptomatickým karcinomem. Potenciálními kandidáty pro IAB mohou být nemocní s lokalizovaným karcinomem odmítající radikální léčbu. IAB je bezpečná forma léčby a v prospektivních studiích se nevyskytla žádná neočekávaná událost. Ve většině studií dosáhla doba vysazení téměř 50 % trvání léčby a významně se tak snížila i cena léčby (12). Nemocní s IAB uvedli zlepšení celkového stavu, kvality života a obnovení libida v době vysazení léčby. Průměrná doba do klinické progrese odpovídala výsledkům dlouhodobé kontinuální léčby u stejné skupiny pacientů. Do zveřejnění definitivních výsledků probíhajících studií se IAB považuje za alternativní postup a není indikována v běžné klinické praxi (13). Kostní změny u karcinomu prostaty Další důležitou oblastí jsou kostní změny, jež mohou nastat u nemocných s karcinomem prostaty. Zahrnují nejenom metastatické postižení, ale i důsledky hormonální léčby. Karcinom prostaty postihuje kosti v %. Jedná se o prototyp nádoru s osteoblastickou aktivitou, způsobující nadměrnou novotvorbu kosti, která je ale méněcenná. Kostní hmota vznikající působením nádoru roste velmi rychle a má nehomogenní strukturu, odlišnou od normální kosti. Zvýšená hustota kosti, viditelná na rentgenovém snímku, odpovídá ve skutečnosti sklerotizaci postižené kosti a nevzniká jen působením osteoblastů. Jedná se o komplexní proces, zahrnující interakce kostního mikroprostředí s nádorovými buňkami prostřednictvím četných aktivačních a inhibičních faktorů. Vzniká tak začarovaný kruh autonomní kostní přestavby. Histopatologické studie prokázaly, že v místech osteoblastické aktivity buněk karcinomu prostaty probíhá zvýšené vychytávání vápníku, které musí být kompenzováno zvýšenou resorpcí kalcia ze střeva a zvýšenou aktivitou osteoklastů v místech s normální kostí. Samotná podstata změny kostní tkáně kolem metastázy karcinomu prostaty spočívá v nerovnováze mezi kostní resorpcí a novotvorbou, při níž převažuje osteoblastická aktivita. U osteolytických metastáz jiných nádorů nebo při osteoporóze naopak nastává nerovnováha ve prospěch resorpce kostí s nedostatečnou osteoplazií. Metastázy karcinomu prostaty obvykle postihují kosti s dobrým prokrvením, což jsou u dospělého muže hlavně kosti osového skeletu s krvetvornou kostní dření (lebka, obratle, žebra, pánevní kosti). Postižení končetinových kostí se považuje za nepříznivý prognostický faktor. Celkový rozsah metastáz odpovídá prognóze nemocného z hlediska doby do selhání léčby a přežívání. Metabolizmus kostí ovlivňuje i hypogonadizmus jeden z nejvýznamnějších rizikových faktorů osteoporózy u starších mužů. Doprovází kastrační léčbu v jakékoliv formě a nevyskytuje se při léčbě bicalutamidem (14). Na rozdíl od přímého postižení karcinomem se většinou jedná o difuzní postižení všech kostí. U nemocných s karcinomem prostaty se nejčastěji jedná o syndrom s rychlým obratem kostní hmoty (15). Patogenetický proces odpovídá zvýšené rezorpci kostí (zvýšená aktivita osteoklastů) při obvyklé novotvorbě (normální aktivita osteoblastů). Tyto změny vedou k významné remodelaci kostí, způsobují snižování hustoty kostí a u některých nemocných vzniká osteopenie nebo osteoporóza (16). Snížení hladiny androgenů dále přináší účinky ovlivňující pohybový aparát, endokrinní a kardiovaskulární systém a zahrnují i poruchy duševního stavu. Testosteron je spojen s udržováním tělesné hmotnosti a rozložením tukové tkáně, přičemž snížení androgenů způsobuje ztrátu hmotnosti a zvýšení objemu tuku v těle. Všechny uvedené změny přispívají ke zhoršení pohyblivosti nemocných a doplňují komplex rizikových faktorů. Léčba kostních změn je často kombinovaná. K možnostem paliativní léčby kostních metastáz karcinomu prostaty patří hormonální a analgetická léčba, aplikace bisfosfonátů, radioterapie, aplikace radioizotopů, chemoterapie a ortopedické pomůcky nebo operace. Jelikož zatím nejsou jednoznačně určeny všechny faktory ovlivňující vznik osteoporózy a stanovena účinná léčba, je potřeba dbát na preventivní opatření. Nejvhodnějším způsobem je fyzická aktivita a rehabilitace odpovídající možnostem nemocného. Další prevencí je dobrá výživa, omezení příjmu alkoholu, zákaz kouření a minimalizace užívání léků ovlivňujících pozornost a pohybový aparát. V neposlední řadě je vhodné odstranění překážek (kluzkých povrchů, schodů ) a ulehčení pohybu (madla, úchyty, noční osvětlení, berly ). Z farmakologického hlediska se kromě látek ovlivňujících nádorové onemocnění doporučuje několik skupin léků, které nepřímo působí na kostní metabolizmus. Při prokázané osteoporóze se podávají preparáty obsahující vápník ( mg/den) a vitamin D ( m. j./den) (27). Výhodou této léčby při dlouhodobém užívání je její nízká cena, dobrá snášenlivost a bezpečnost. Bisfosfonáty jsou látky podobné pyrofosfátu, což je normální součást kosti. In vitro inhibují precipitaci fosforečnanu vápenatého, blokují jeho přeměnu na hydroxyapatit, zpomalují agregaci krystalů hydroxyapatitu do větších shluků a zpomalují jejich rozpouštění. Liší se od pyrofosfátu tím, že kromě fyzikálně-chemické vazby na povrch kosti působí toxicky na osteoklasty. Po průniku do krve se bisfosfonáty selektivně dostávají do míst zvýšené kostní přestavby a váží se na místa s odhalenou kostní anorganickou matrix. Jsou to oblasti s největší aktivitou osteoklastů, kde tyto buňky způsobují uvolnění bisfosfonátů z povrchu kostí. Po oddělení od okolní kosti se bisfosfonát dostává aktivním transportem (pinocytózou) do cytoplazmy osteoklastu. Určitá koncentrace léku v buňce způsobí útlum činnosti osteoklastu a následně jeho apoptózu (18). Bisfosfonáty tak pravděpodobně umožňují přerušení circulus vitiosus patologické kostní přestavby. Nicméně přesné mechanizmy inhibice kostní rezorpce nejsou zcela známy. Laboratorně se účinek bisfosfonátů projeví jako změna sérové koncentrace kalcia, fosforu nebo hořčíku a vylučování kalcia a dalších markerů kostní přestavby močí (19). Vzhledem k přítomnosti kostní rezorpce u metastáz karcinomu prostaty působí bisfosfonáty i na osteoblastické metastázy. Protože novotvorba kosti a její rezorpce jsou spojeny, je kostní tvorba také snížena, ale méně než rezorpce, což vede k progresivnímu přírůstku kostní hmoty. Během léčby bisfosfonáty se tvoří normální kost, ve které je látka inkorporována do kostní matrix, kde je inaktivní. Ve studiích in vitro bylo prokázáno, že bisfosfonáty snižují adhezi nádorových buněk ke kosti, snižují aktivitu osteoklastů, zabraňují vylučování látek přitahujících maligní buňky ke kosti a urychlují apoptózu nádorových buněk, nacházejících se na kostní matrix. Odpovídají tomu i výsledky klinických studií, ve kterých nastalo zlepšení kostních bolestí dříve, než se mohl projevit účinek léku na samotnou kostní přestavbu. Bisfosfonáty jsou k dispozici v perorální a parenterální formě. Po perorálním podání je rezorpce z gastrointestinálního traktu nízká a biologická dostupnost je 1 3 %. Jelikož se bisfosfonáty vstřebávají ze střeva na základě prosté difuze, nejlépe se vstřebávají látky s malou molekulou (dichlorometylen bisfosfonát klodronát). Tento fakt vychází z nízké lipofility látek (nerozpustnosti v tucích) a negativního náboje molekuly, což zabraňuje využití aktivních forem transportu stěnou střevní. Díky silné afinitě látek k vápníku a dalším dvojmocným kation tům (hořčík, železo, hliník) je jeho ab-
5 173 sorpce zanedbatelná, pokud je užíván s nápoji, jídlem nebo léky, které tyto kationty obsahují. Při perorální léčbě se vyskytují zejména gastrointestinální nežádoucí účinky, které vyžadují částečné omezení režimu nemocného. Omezení jsou důležitá zejména u skupiny perorálních bisfosfonátů obsahujících dusík v postranním řetězci (alendronát a risedronát). Takzvané jednoduché bisfosfonáty (klodronát) mají mnohem menší výskyt nežádoucích gastrointestinálních účinků, protože obsahují v postranním řetězci jednoduché ligandy. Perorální bisfosfonáty se musí užívat až poté, co pacient vstane (tedy ne vleže) a musí se užívat s plnou sklenicí čisté vody. Pacient nesmí tabletu žvýkat nebo nechávat rozpustit v ústech, jinak může dojít ke vzniku orofaryngeální ulcerace. Po požití tablety nesmí znovu lehnout až do doby po prvním jídle a nesmí jíst alespoň minut po požití tablety. Z výše uvedených důvodů se lék užívá buď před spaním a to nejméně dvě hodiny po večerním jídle nebo ráno na lačný žaludek hodinu před snídaní. Ke zvýšení gastrointestinální tolerance lze, pokud je to nutné, denní dávku rozdělit na několik dávek. V závislosti na preparátu vedou nežádoucí účinky k přerušení léčby až u pětiny nemocných. Z výše uvedených údajů vyplývají i kontraindikace perorální léčby: a) abnormality jícnu, které zpomalují jeho vyprazdňování, jako jsou striktury nebo achalázie b) akutní ezofagitida a jícnové vředy c) akutní vředová choroba žaludku a duodena d) neschopnost stát nebo sedět vzpřímeně alespoň 30 minut e) přecitlivělost na jakoukoliv složku přípravku nebo léčba jinou látkou z této skupiny. Parenterální podání minimalizuje výskyt dyspepsií, je účinnější, ale zároveň náročnější na aplikaci. Většinou se aplikuje v počáteční fázi léčby k dosažení rychlejšího účinku, dále při udržovací léčbě v případě intolerance perorálních forem, nebo při kontraindikaci perorálního podání. Přípravek se ředí infuzními roztoky, které nesmějí obsahovat vápník (fyziologický roztok nebo 5% roztok glukózy). Aplikuje se pomalou i. v. infuzí a infuzní kanyla by měla být pečlivě zavedena do větší žíly, aby se minimalizovala možnost vzniku lokálních nežádoucích reakcí. Bisfosfonáty jsou vylučovány především ledvinami. Během léčby je potřeba dodržet dostatečný přívod tekutin, sledovat funkci ledvin a při mírném a středním stupni renální insuficience dávku redukovat. Při těžké renální insuficienci je podání bisfosfonátů kontraindikováno. Z praktického hlediska je navíc důležité, že dávkování bisfosfonátů se liší podle jednotlivých indikací a je potřeba se řídit doporučeními výrobce. Obecně lze konstatovat, že dávky používané v léčbě osteoporózy různé etiologie nebo Pagetovy nemoci jsou mnohem menší než dávky podávané u kostních změn při maligních onemocněních. Například v prevenci a léčbě osteoporózy stačí podat kyselinu zoledronovou jednou ročně (20), v prevenci kostních metastáz karcinomu prostaty jednou za 3 měsíce a u metastazujícího onemocnění (včetně komplikací) jednou za měsíc (21). Vyplývá to z patofyziologické podstaty procesů, narušujících strukturu kosti a metabolizmu buněk zapojených do těchto změn. Chemoterapie Progreduje-li nádor po hormonální léčbě, rozvinul se hormonálně nezávislý nádor neboli nádor nereagující na hormonální léčbu. V této fázi je obvykle indikována chemoterapie. V minulosti se karcinom prostaty považoval za chemorezistentní, ale tento názor je v současnosti považován za zastaralý. Vyplývá to z pozorování, že počet pozitivních odpovědí na chemoterapii karcinomu prostaty se neliší od počtu odpovědí na léčbu u solidních nádorů, považovaných za chemosenzitivní. V chemoterapii karcinomu prostaty bylo vyzkoušeno několik druhů látek s cytostatickým účinkem. Mezi nejvýznamnější jistě patří estramustinfosfát, derivát 17-β-estradiolfosfátu vázaný na molekulu dusíkatého yperitu. Mezi další léky zkoušené v kombinaci s estramustinem patří doxorubicin a vinkaalkaloidy. Další látkou používanou v chemoterapii karcinomu prostaty je derivát antrachinonu mitoxantron, původně určený k léčbě akutní myeloidní leukémie. Deriváty antracyklinu jsou spojeny s kardiotoxicitou, ta je ale nižší než u doxo rubicinu. Příkladem randomizované studie s mitoxantronem byla práce CALGB (Cancer and Leukemia Group B), hodnotící 242 nemocných s hormonálně rezistentním karcinomem prostaty bez předchozí chemoterapie (22). Nemocní dostávali samotný hydrokortison nebo hydrokortison s mitoxantronem. Později se začal používat prednison pro jeho lepší farmakologické vlastnosti. Nemocní léčení mitoxantronem uváděli dlouhodobé zlepšení fyzického a sociálního stavu, celkové kvality života, anorexie, obstipace a dalších příznaků. Dobré výsledky stran subjektivního zlepšení a minimálního výskytu závažných nežádoucích účinků vedly FDA (Food and Drug Administration, USA) k povolení používání mitoxantronu a prednisonu u nemocných s příznaky metastatického hormonálně rezistentního karcinomu prostaty. Tato kombinace byla ve své době jediným oficiálně schváleným protokolem chemoterapie. Výraznou změnu znamenala studie hodnotící použití docetaxelu u nemocných s generalizovaným karcinomem prostaty ve dvou režimech podání, srovnanou s kombinací mitoxantron a prednison. Původní studie (23) i další analýzy (24) potvrdily účinnost léčby docetaxelem, podávaným každé 3 týdny, z hlediska výskytu a trvání biochemické odpovědi, snížení bolesti, prodloužení doby do vzniku bolesti a zlepšení kvality života nemocných. Výsledky nebyly závislé na věku nebo celkovém stavu nemocných hodnocených pomocí skóre Karnofského. Jako nepříznivé prognostické faktory byly stanoveny přítomnost viscerálních metastáz, snížená hladina hemoglobinu, zvýšená hladina alkalické fosfatázy a vysoké Gleasonovo skóre. Příznivým faktorem byla biochemická progrese jako jediná známka hormonální rezistence. V současnosti je aplikace docetaxelu v režimu popsaném ve studii standardem chemoterapie karcinomu prostaty. Literatura 1. Belej K, Kaplan O. Hormonální regulace a možnosti jejího ovlivnění v léčbě karcinomu prostaty. Klin Farmakol Farm 2007; 21(3 4): Widmark A, Klepp O, Solberg A, et al. Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG-7/SFUO-3): an open randomised phase III trial. Lancet 2009; 373: See WA, Wirth MP, McLeod DG, et al. Bicalutamide ( Casodex ) 150 mg as immediate therapy either alone or as adjuvant to standard care in patients with localized or locally advanced prostate cancer: first analysis of the Early Prostate Cancer Program. J Urol 2002; 168(2), Iversen P, Tyrrell CJ, Kaisary AV, et al. Bicalutamide monotherapy compared with castration in patients with non metastatic locally advanced prostate cancer: 6.3 years of followup. J Urol 2000; 164: Iversen P, Roder MA. The Early Prostate Cancer program: bicalutamide in nonmetastatic prostate cancer. Expert Rev Anticancer Ther 2008; 8(3): McLeod DG, Iversen P, See WA, et al. Bicalutamide 150 mg plus standard care vs standard care alone for early prostate cancer. BJU Int 2006; 97(2): Oefelein MG, Cornum R. Failure to achieve castrate levels of testosterone during luteinizing hormone-releasing hormone agonist therapy: the case for monitoring serum testosterone levels and a treatment decision algorithm. J Urol 2000; 164: Mohler J, Prostate Cancer Panel Members. NCCN Clinical Practice Guidelines in Oncology Prostate Cancer, v PDF/prostate.pdf. 9. Dušek P, Kawaciuk I, Jarolím L, Teršípová L. Intermitentní androgenní suprese u karcinomu prostaty desetileté zkušenosti. Vybrané otázky onkologie XI. Praha: Galén, 2007: ; 10(3) Urologie pro praxi
6 Seruga B, Tannock IF. Intermittent androgen blockade should be regarded as standard therapy in prostate cancer. Nat Clin Pract Oncol 2008; 5(10): Tunn U. The current status of intermittent androgen deprivation (IAD) therapy for prostate cancer: putting IAD under the spotlight. BJU Int 2007; 99(Suppl 1): Matoušková M, Hanuš M. Cena hormonální léčby karcinomu prostaty Farmakoekonomické aspekty indikací léčby. Urolog. pro Praxi 2008; 9(1): Conti PD, Atallah AN, Arruda H, et al. Intermittent versus continuous androgen suppression for prostatic cancer. Cochrane Database Syst Rev 2007; 17(4): CD Sieber PR, Keiller DL, Kahnoski RJ, et al. Bicalutamide 150 mg maintains bone mineral density during monotherapy for localized or locally advanced prostate cancer. J Urol 2004; 171: Hatano T, Oishi Y, Furuta, A, et al. Incidence of bone fracture in patients receiving luteinizing hormone-releasing hormone agonists for prostate cancer. BJU Int 2000; 86: Tuck SP, Francis RM. Testosterone, bone and osteoporosis. Front Horm Res 2009; 37: Smith MR. Osteoporosis during androgen deprivation therapy for prostate cancer. Urology, 2002; 60(Suppl 3A): Drake MT, Clarke BL, Khola S. Bisphosphonates: mechanism of action and role in clinical practice. Mayo Clin Proc 2008; 83(9): Lein M, Wirth M, Miller K, et al. Markers of bone turnover in men with metastatic prostate cancer treated with zoledronic acid for detection of bone metastases progression. Eur Urol 2007; 52: Black DM, Delmas PD, Eastell R, et al. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med 2007; 356: Kolombo I, Kolombová J, Vlásek T. Místo bisfosfonátů při skeletovém postižení v uroonkologii. Urolog. pro Praxi 2006; 5: Kantoff PW, Halabi S, Conaway M, et al. Hydrocortisone with or without mitoxantrone in men with hormonerefractory prostate cancer: results of the cancer and leukemia group B 9182 study. J Clin Oncol 1999; 17: Tannock IF, de Wit R, Berry WR, et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. N Engl J Med 2004; 351: Berthold DR, Pond GR, Soban F, et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer: updated survival in the TAX 327 study. J Clin Oncol 2008; 26: MUDr. Kamil Belej, Ph.D., FEBU Urologické oddělení, ÚVN U Vojenské nemocnice Praha 6-Střešovice belejkam@uvn.cz
Hormonální léčba metastatického karcinomu prostaty. Marko Babjuk. FN Motol a 2 LFUK, Praha
 Hormonální léčba metastatického karcinomu prostaty Marko Babjuk FN Motol a 2 LFUK, Praha Hormonální osa Androgenní suprese potlačuje růst prostatických buněk. Efektu lze dosáhnout chirurgickou kastrací
Hormonální léčba metastatického karcinomu prostaty Marko Babjuk FN Motol a 2 LFUK, Praha Hormonální osa Androgenní suprese potlačuje růst prostatických buněk. Efektu lze dosáhnout chirurgickou kastrací
Doporučené postupy pro hormonální léčbu karcinomu prostaty 2012
 Závěr expertní komise ve složení: Babjuk M, Hora M, Katolická J, Kubecová M, Matoušková M, Melichar B, Petera J, Soumarová R, Študent V Podmínkou pro nasazení hormonální terapie je histologicky verifikovaný
Závěr expertní komise ve složení: Babjuk M, Hora M, Katolická J, Kubecová M, Matoušková M, Melichar B, Petera J, Soumarová R, Študent V Podmínkou pro nasazení hormonální terapie je histologicky verifikovaný
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, SÍLA LÉČIVÉHO PŘÍPRAVKU, ZPŮSOB PODÁNÍ, ŽADATEL A DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, SÍLA LÉČIVÉHO PŘÍPRAVKU, ZPŮSOB PODÁNÍ, ŽADATEL A DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Členský stát Dánsko Německo Irsko Itálie Španělsko Držitel rozhodnutí
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, SÍLA LÉČIVÉHO PŘÍPRAVKU, ZPŮSOB PODÁNÍ, ŽADATEL A DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Členský stát Dánsko Německo Irsko Itálie Španělsko Držitel rozhodnutí
Nové možnosti. terapeutického ovlivnění pokročilého karcinomu prostaty. Mám nádor prostaty a co dál? Jana Katolická
 MEZINÁRODNÍ CENTRUM KLINICKÉHO VÝZKUMU Nové možnosti TVOŘÍME BUDOUCNOST MEDICÍNY terapeutického ovlivnění pokročilého karcinomu prostaty Jana Katolická Primář onkologicko-chirurgické oddělení Mám nádor
MEZINÁRODNÍ CENTRUM KLINICKÉHO VÝZKUMU Nové možnosti TVOŘÍME BUDOUCNOST MEDICÍNY terapeutického ovlivnění pokročilého karcinomu prostaty Jana Katolická Primář onkologicko-chirurgické oddělení Mám nádor
Hormonální léčba metastatického karcinomu prostaty. Marko Babjuk. FN Motol a 2 LFUK, Praha
 Hormonální léčba metastatického karcinomu prostaty Marko Babjuk FN Motol a 2 LFUK, Praha Hormonální osa DHT a AR Testosterone 5a-R AR s DHT ligandem (Dimery) DHT Hsp 70 RA (Inaktivní) Hsp 90 Androgen Response
Hormonální léčba metastatického karcinomu prostaty Marko Babjuk FN Motol a 2 LFUK, Praha Hormonální osa DHT a AR Testosterone 5a-R AR s DHT ligandem (Dimery) DHT Hsp 70 RA (Inaktivní) Hsp 90 Androgen Response
Co mě může potkat při návratu onemocnění. Nové přístupy biologická léčba karcinomu prostaty. MUDr. Hana Študentová, Ph.D.
 Co mě může potkat při návratu onemocnění. Nové přístupy biologická léčba karcinomu prostaty MUDr. Hana Študentová, Ph.D. Obsah Obecný úvod Androgenní signalizace Možnosti systémové léčby Závěr Koho se
Co mě může potkat při návratu onemocnění. Nové přístupy biologická léčba karcinomu prostaty MUDr. Hana Študentová, Ph.D. Obsah Obecný úvod Androgenní signalizace Možnosti systémové léčby Závěr Koho se
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010
 Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUTAMID SANDOZ 250 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Flutamidum
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUTAMID SANDOZ 250 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Flutamidum
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje bicalutamidum 50 mg, resp. 150 mg. Pomocné látky viz bod 6.1.
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. 4080/06 a 4081/06 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicaluplex 50 mg Bicaluplex 150 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. 4080/06 a 4081/06 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicaluplex 50 mg Bicaluplex 150 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
Léčba lokalizovaného a lokálně pokročilého karcinomu prostaty (ct1-3 N0 M0)
 4.3. ZHOUBNÝ NOVOTVAR PROSTATY Léčba lokalizovaného a lokálně pokročilého karcinomu prostaty (ct1-3 N0 M0) Léčba nízce rizikového (ct1-2a a GS 6 a PSA < 10 μg/l) a středně rizikového (ct2b-c a/nebo GS
4.3. ZHOUBNÝ NOVOTVAR PROSTATY Léčba lokalizovaného a lokálně pokročilého karcinomu prostaty (ct1-3 N0 M0) Léčba nízce rizikového (ct1-2a a GS 6 a PSA < 10 μg/l) a středně rizikového (ct2b-c a/nebo GS
M. Babjuk Urologická klinika 2.LF UK a FN Motol
 Operační léčba jako součást multimodálního přístupu k léčbě vysocerizikového karcinomu prostaty M. Babjuk Urologická klinika 2.LF UK a FN Motol Synopse Definice Výsledky a místo operační léčby Kombinace
Operační léčba jako součást multimodálního přístupu k léčbě vysocerizikového karcinomu prostaty M. Babjuk Urologická klinika 2.LF UK a FN Motol Synopse Definice Výsledky a místo operační léčby Kombinace
Kazuistika ČUS. MUDr. PharmDr Jan Dvořák RTO klinika FNKV, 3. LF UK
 Kazuistika ČUS MUDr. PharmDr Jan Dvořák RTO klinika FNKV, 3. LF UK Pacient S.U. Dg. C61 v roce 2009, 56 let 8/2009 biopsie GLS 9 (4+5), PSA 8.22 μg/l 11/2009 RAPE, pt2c pn0(5 uzlin) M0, GS 7 (4+3), R0
Kazuistika ČUS MUDr. PharmDr Jan Dvořák RTO klinika FNKV, 3. LF UK Pacient S.U. Dg. C61 v roce 2009, 56 let 8/2009 biopsie GLS 9 (4+5), PSA 8.22 μg/l 11/2009 RAPE, pt2c pn0(5 uzlin) M0, GS 7 (4+3), R0
Možnosti léčby kastračně rezistentního metastatického karcinomu prostaty
 Možnosti léčby kastračně rezistentního metastatického karcinomu prostaty Iveta Kolářová Oddělení klinické a radiační onkologie Pardubice Multiscan s.r.o. Pardubická krajská nemocnice, a.s. Pardubice 19.9.2012
Možnosti léčby kastračně rezistentního metastatického karcinomu prostaty Iveta Kolářová Oddělení klinické a radiační onkologie Pardubice Multiscan s.r.o. Pardubická krajská nemocnice, a.s. Pardubice 19.9.2012
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU CYSAXAL 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje cyproteroni acetas 100 mg. Pomocné látky: monohydrát laktosy 167,0
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU CYSAXAL 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje cyproteroni acetas 100 mg. Pomocné látky: monohydrát laktosy 167,0
LÉČBA RELAPSU MNOHOČETNÉHO MYELOMU. MUDr. Miroslava Schützová. 5. vzdělávací seminář pro nemocné s mnohočetným myelomem, jejich rodinu a přátele
 LÉČBA RELAPSU MNOHOČETNÉHO MYELOMU MUDr. Miroslava Schützová 5. vzdělávací seminář pro nemocné s mnohočetným myelomem, jejich rodinu a přátele 20. - 21. listopadu 2009 Karlova Studánka ČESKÁ MYELOMOVÁ
LÉČBA RELAPSU MNOHOČETNÉHO MYELOMU MUDr. Miroslava Schützová 5. vzdělávací seminář pro nemocné s mnohočetným myelomem, jejich rodinu a přátele 20. - 21. listopadu 2009 Karlova Studánka ČESKÁ MYELOMOVÁ
Možnosti léčby CRPC. Michaela Matoušková
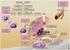 Možnosti léčby CRPC Michaela Matoušková Pokročilý karcinom prostaty prevalence CaP 65215 pokročilý CaP st. III 8492 st. IV 5884 14376 CRPC cca 900-1000 Zdroj dat www.uroweb.cz CRPC Kastrační hladina testosteronu
Možnosti léčby CRPC Michaela Matoušková Pokročilý karcinom prostaty prevalence CaP 65215 pokročilý CaP st. III 8492 st. IV 5884 14376 CRPC cca 900-1000 Zdroj dat www.uroweb.cz CRPC Kastrační hladina testosteronu
: Medikamentózní léčba kastračně rezistentního karcinomu. Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1. LF UK a TN KOC ( NNB+VFN+TN )
 : Medikamentózní léčba kastračně rezistentního karcinomu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1. LF UK a TN KOC ( NNB+VFN+TN ) Vývoj standardizované incidence a úmrtnosv ( na 100 000
: Medikamentózní léčba kastračně rezistentního karcinomu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1. LF UK a TN KOC ( NNB+VFN+TN ) Vývoj standardizované incidence a úmrtnosv ( na 100 000
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls148317/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicaluplex 50 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá tableta
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls148317/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicaluplex 50 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá tableta
Nejnovější metody léčby karcinomu prostaty
 Nejnovější metody léčby karcinomu prostaty FN a LFUK HRADEC KRÁLOVÉ Josef Košna Urologická klinika FN a LFUK Hradec Králové Úvod Nádor prostaty je druhým nejčastějším nádorem u mužů po kožních nádorech
Nejnovější metody léčby karcinomu prostaty FN a LFUK HRADEC KRÁLOVÉ Josef Košna Urologická klinika FN a LFUK Hradec Králové Úvod Nádor prostaty je druhým nejčastějším nádorem u mužů po kožních nádorech
Registr Herceptin Karcinom prsu
 I. Primární diagnostika Registr Herceptin Karcinom prsu Vstupní parametry Rok narození Věk Kód zdravotní pojišťovny (výběr) o 111 o 201 o 205 o 207 o 209 o 211 o 213 o 217 o 222 Datum stanovení diagnózy
I. Primární diagnostika Registr Herceptin Karcinom prsu Vstupní parametry Rok narození Věk Kód zdravotní pojišťovny (výběr) o 111 o 201 o 205 o 207 o 209 o 211 o 213 o 217 o 222 Datum stanovení diagnózy
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU CALUMID 150 mg potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje bicalutamidum 150 mg. Jedna tableta přípravku Calumid
1. NÁZEV PŘÍPRAVKU CALUMID 150 mg potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje bicalutamidum 150 mg. Jedna tableta přípravku Calumid
Kazuistika: Inkretiny při léčbě obezity a diabetu 2. typu
 Kazuistika: Inkretiny při léčbě obezity a diabetu 2. typu Jaromíra Gajdová II. Interní klinika LF UP a FN Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických a klinických předmětů
Kazuistika: Inkretiny při léčbě obezity a diabetu 2. typu Jaromíra Gajdová II. Interní klinika LF UP a FN Tvorba a ověření e-learningového prostředí pro integraci výuky preklinických a klinických předmětů
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-BICALUTAMID 150 Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje bicalutamidum 150 mg. Pomocné látky: Jedna tableta obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-BICALUTAMID 150 Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje bicalutamidum 150 mg. Pomocné látky: Jedna tableta obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls30652/2013 a sp.zn.: sukls114464/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BIKALARD potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje bicalutamidum.
sp.zn.: sukls30652/2013 a sp.zn.: sukls114464/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BIKALARD potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje bicalutamidum.
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
Radioterapie po radikální prostatektomii
 Radioterapie po radikální prostatektomii Štěpán Veselý Urologická klinika UK 2. LF a FN Motol, Praha ART po RRP - ART (aplikace u high-risk do 90 dnů po operaci) high-risk: - pozitivní chirurgické okraje
Radioterapie po radikální prostatektomii Štěpán Veselý Urologická klinika UK 2. LF a FN Motol, Praha ART po RRP - ART (aplikace u high-risk do 90 dnů po operaci) high-risk: - pozitivní chirurgické okraje
Evropský den onemocnění prostaty 15. září 2005 Aktivita Evropské urologické asociace a České urologické společnosti
 Evropský den onemocnění prostaty 15. září 2005 Aktivita Evropské urologické asociace a České urologické společnosti prim. MUDr. Jan Mečl Urologické oddělení Krajská nemocnice Liberec Co je to prostata?
Evropský den onemocnění prostaty 15. září 2005 Aktivita Evropské urologické asociace a České urologické společnosti prim. MUDr. Jan Mečl Urologické oddělení Krajská nemocnice Liberec Co je to prostata?
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Pomocná látka: monohydrát laktosy 181 mg v jedné potahované tabletě.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicalutanorm 150 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bicalutamidum 150 mg v jedné potahované tabletě. Pomocná látka: monohydrát laktosy
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicalutanorm 150 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bicalutamidum 150 mg v jedné potahované tabletě. Pomocná látka: monohydrát laktosy
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DIPHERELINE S.R. 3 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek pro přípravu injekční suspenze: Léčivá látka: Triptorelinum..... 4,2 mg *) (Ut triptorelini
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DIPHERELINE S.R. 3 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek pro přípravu injekční suspenze: Léčivá látka: Triptorelinum..... 4,2 mg *) (Ut triptorelini
Pomocné látky: jedna tableta obsahuje 181 mg monohydrátu laktózy.
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls7817/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicalutamide Pharmacenter 150 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls7817/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicalutamide Pharmacenter 150 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím
 Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referralové
Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referralové
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Potahované tablety. Bílé, kulaté, bikonvexní, potahované tablety, na jedné straně vyraženo BCM 50.
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls7815/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicalutamide Pharmacenter 50 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls7815/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicalutamide Pharmacenter 50 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
= lokálně pokročilý CaP + lokalizovaný (ct1, ct2) se špatnými prognostickými faktory ct3a PSA > 20 ng/ml GS > 7
 Léčba vysocerizikového karcinomu prostaty pohled urologa M. Babjuk Urologická klinika 2.LF UK a FN Motol High-risk CaP = lokálně pokročilý CaP + lokalizovaný (ct1, ct2) se špatnými prognostickými faktory
Léčba vysocerizikového karcinomu prostaty pohled urologa M. Babjuk Urologická klinika 2.LF UK a FN Motol High-risk CaP = lokálně pokročilý CaP + lokalizovaný (ct1, ct2) se špatnými prognostickými faktory
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls202826/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-BICALUTAMID 150 mg Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje bicalutamidum 150 mg. Pomocné
Sp.zn.sukls202826/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-BICALUTAMID 150 mg Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje bicalutamidum 150 mg. Pomocné
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY
 NÁDORY PROSTATY 63 XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY Kolektiv autorů Úvod Léčivý přípravek (radium-223 dichlorid) byl 13. listopadu 2013 schválen
NÁDORY PROSTATY 63 XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY Kolektiv autorů Úvod Léčivý přípravek (radium-223 dichlorid) byl 13. listopadu 2013 schválen
Možnosti léčby CRPC s časem přibývají
 Možnosti léčby CRPC s časem přibývají Jana Katolická Onkologicko-chirurgické oddělení Fakultní nemocnice u Sv. Anny Mnoho studií - jen čtyři nové léky Enzalutamid Abirateron + prednison Cabazitaxel Radium-223
Možnosti léčby CRPC s časem přibývají Jana Katolická Onkologicko-chirurgické oddělení Fakultní nemocnice u Sv. Anny Mnoho studií - jen čtyři nové léky Enzalutamid Abirateron + prednison Cabazitaxel Radium-223
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls193897/2010 a příloha ke sp.zn.sukls99850/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls193897/2010 a příloha ke sp.zn.sukls99850/2012 1. NÁZEV PŘÍPRAVKU LANBICA 150 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls193897/2010 a příloha ke sp.zn.sukls99850/2012 1. NÁZEV PŘÍPRAVKU LANBICA 150 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Pomocná látka: monohydrát laktosy 181 mg v jedné potahované tabletě.
 Příloha č. 3k rozhodnutí o registraci sp.zn. sukls100869/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bikauk 150 mg Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bicalutamidum 150 mg v
Příloha č. 3k rozhodnutí o registraci sp.zn. sukls100869/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bikauk 150 mg Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bicalutamidum 150 mg v
Biochemie kosti. Anatomie kosti. Kostní buňky. Podpůrná funkce. Udržování homeostasy minerálů. Sídlo krvetvorného systému
 Biochemie kosti Podpůrná funkce Udržování homeostasy minerálů Sídlo krvetvorného systému Anatomie kosti Haversovy kanálky okostice lamely oddělené lakunami Kostní buňky Osteoblasty Osteocyty Osteoklasty
Biochemie kosti Podpůrná funkce Udržování homeostasy minerálů Sídlo krvetvorného systému Anatomie kosti Haversovy kanálky okostice lamely oddělené lakunami Kostní buňky Osteoblasty Osteocyty Osteoklasty
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU CALUMID 50 mg potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje bicalutamidum 50 mg. Jedna tableta přípravku Calumid
1. NÁZEV PŘÍPRAVKU CALUMID 50 mg potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje bicalutamidum 50 mg. Jedna tableta přípravku Calumid
Jedna tableta obsahuje bicalutamidum 50 mg. Pomocná látka: monohydrát laktózy Úplný seznam pomocných látek viz bod 6.1.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BIKALARD 50 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje bicalutamidum 50 mg. Pomocná látka: monohydrát laktózy Úplný
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BIKALARD 50 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje bicalutamidum 50 mg. Pomocná látka: monohydrát laktózy Úplný
Vztah pacienta k diagnostice a léčbě idiopatických střevních zánětů možnosti a problémy
 Vztah pacienta k diagnostice a léčbě idiopatických střevních zánětů možnosti a problémy Vladimír Zbořil Interní - hepatogastroenterologická klinika Fakultní nemocnice Bohunice Masarykova Univerzita BRNO
Vztah pacienta k diagnostice a léčbě idiopatických střevních zánětů možnosti a problémy Vladimír Zbořil Interní - hepatogastroenterologická klinika Fakultní nemocnice Bohunice Masarykova Univerzita BRNO
CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT IKARUS. Neintervenční epidemiologická studie
 CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT Neintervenční epidemiologická studie PROTOKOL PROJEKTU Verze: 4.0 Datum: 26.09.2006 Strana 2 PROTOKOL PROJEKTU
CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT Neintervenční epidemiologická studie PROTOKOL PROJEKTU Verze: 4.0 Datum: 26.09.2006 Strana 2 PROTOKOL PROJEKTU
Příloha č. 2 k rozhodnutí o povolení souběžného dovozu sp. zn.:sukls5516/2010
 Příloha č. 2 k rozhodnutí o povolení souběžného dovozu sp. zn.:sukls5516/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Casodex 150 Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta
Příloha č. 2 k rozhodnutí o povolení souběžného dovozu sp. zn.:sukls5516/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Casodex 150 Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta
PŘÍLOHA I. Page 1 of 5
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, KONCENTRACE VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB(Y) PODÁNÍ, DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Page 1 of 5 Členský stát Žadatel
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, KONCENTRACE VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB(Y) PODÁNÍ, DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Page 1 of 5 Členský stát Žadatel
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicaluplex 50 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá tableta obsahuje 50 mg bicalutamidum. Pomocná látka se známým účinkem: Jedna
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicaluplex 50 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá tableta obsahuje 50 mg bicalutamidum. Pomocná látka se známým účinkem: Jedna
Národní onkologické centrum V. A. Fanardžyana
 Národní onkologické centrum V. A. Fanardžyana Klinické studie provedené v Národním onkologickém centru, s nádorovým onemocněním mléčné žlázy, konečníku, střeva, plic a děložního čípku. STANDARDNÍ CHEMOTERAPIE,
Národní onkologické centrum V. A. Fanardžyana Klinické studie provedené v Národním onkologickém centru, s nádorovým onemocněním mléčné žlázy, konečníku, střeva, plic a děložního čípku. STANDARDNÍ CHEMOTERAPIE,
Léčba high-risk a lokálně pokročilého karcinomu prostaty - guidelines. Tomáš Hradec Urologická klinika VFN a 1.LF v Praze
 Léčba high-risk a lokálně pokročilého karcinomu prostaty - guidelines Tomáš Hradec Urologická klinika VFN a 1.LF v Praze High-risk lokalizovaný a lokálně pokročilý karcinom prostaty GR LE Doplnit screening
Léčba high-risk a lokálně pokročilého karcinomu prostaty - guidelines Tomáš Hradec Urologická klinika VFN a 1.LF v Praze High-risk lokalizovaný a lokálně pokročilý karcinom prostaty GR LE Doplnit screening
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje bicalutamidum 150 mg. Jedna tableta obsahuje 168,75 mg monohydrátu laktózy jako pomocné látky.
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls61976/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicalutamide Farmaprojects 150 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls61976/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicalutamide Farmaprojects 150 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Endometriosis: Prolongovaná léčba triptorelinem potlačí sekreci estradiolu a tak umožní uklidnění ektopické tkáně endometria.
 Příbalová informace Rp. Informace pro použití, čtěte pozorně! DIPHERELINE L.A. 3,75 mg Prášek pro přípravu injekční suspenze s rozpouštědlem Držitel rozhodnutí o registraci Beaufour Ipsen Pharma, 24 rue
Příbalová informace Rp. Informace pro použití, čtěte pozorně! DIPHERELINE L.A. 3,75 mg Prášek pro přípravu injekční suspenze s rozpouštědlem Držitel rozhodnutí o registraci Beaufour Ipsen Pharma, 24 rue
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLANUTA 50 mg Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje bicalutamidum 50 mg. Pomocné látky: 62,7 mg monohydrátu
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLANUTA 50 mg Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje bicalutamidum 50 mg. Pomocné látky: 62,7 mg monohydrátu
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-BICALUTAMID 50 Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 50 mg bicalutamidum. Pomocné látky: Jedna tableta obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-BICALUTAMID 50 Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 50 mg bicalutamidum. Pomocné látky: Jedna tableta obsahuje
19. ZHOUBNÝ NOVOTVAR PROSTATY (C61)
 19. ZHOUBNÝ NOVOTVAR PROSTATY (C61) 19.1 Léčba lokalizovaného a lokálně pokročilého karcinomu prostaty (ct1-3 N0 M0) 19.1.1 Léčba nízce rizikového (ct1-2a a GS 6 a PSA < 10 µg/l) a středně rizikového (ct2b-c
19. ZHOUBNÝ NOVOTVAR PROSTATY (C61) 19.1 Léčba lokalizovaného a lokálně pokročilého karcinomu prostaty (ct1-3 N0 M0) 19.1.1 Léčba nízce rizikového (ct1-2a a GS 6 a PSA < 10 µg/l) a středně rizikového (ct2b-c
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
sp.zn.sukls103802/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ANDROCUR DEPOT 300 mg, injekční roztok
 sp.zn.sukls103802/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ANDROCUR DEPOT 300 mg, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule o obsahu 3 ml obsahuje cyproteroni acetas
sp.zn.sukls103802/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ANDROCUR DEPOT 300 mg, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule o obsahu 3 ml obsahuje cyproteroni acetas
Poruchy spojené s menstruačním cyklem a jejich léčba. MUDr. Zdeňka Vyhnánková
 Poruchy spojené s menstruačním cyklem a jejich léčba MUDr. Zdeňka Vyhnánková Hormonální změny během menstruačního cyklu do ovulace stoupá hladina estrogenů 10x, hladina progesteronu je nulová v druhé polovině
Poruchy spojené s menstruačním cyklem a jejich léčba MUDr. Zdeňka Vyhnánková Hormonální změny během menstruačního cyklu do ovulace stoupá hladina estrogenů 10x, hladina progesteronu je nulová v druhé polovině
CZ PAR. QUETIAPINI FUMARAS Seroquel. UK/W/0004/pdWS/001 NL/W/0004/pdWS/001
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Prevence osteoporózy a sarkopenie role vitaminu D
 Prevence osteoporózy a sarkopenie role vitaminu D Kostní remodelace permanentní kontrolovaná resorpce kosti osteoklasty s následnou náhradou kosti osteoblasty délka cyklu 3-4 měsíce kostní remodelační
Prevence osteoporózy a sarkopenie role vitaminu D Kostní remodelace permanentní kontrolovaná resorpce kosti osteoklasty s následnou náhradou kosti osteoblasty délka cyklu 3-4 měsíce kostní remodelační
Věstník MINISTERSTVA ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY OBSAH:
 Věstník Ročník 2012 MINISTERSTVA ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY Částka 5 Vydáno: 29. ČERVNA 2012 Cena: 59 Kč OBSAH: 1. Doporučený postup při provádění kastrací v souvislosti s parafilně motivovanými sexuálními
Věstník Ročník 2012 MINISTERSTVA ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY Částka 5 Vydáno: 29. ČERVNA 2012 Cena: 59 Kč OBSAH: 1. Doporučený postup při provádění kastrací v souvislosti s parafilně motivovanými sexuálními
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls199328/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicalutamid Actavis 50 mg Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bicalutamidum 50 mg v jedné potahované tabletě.
Sp.zn. sukls199328/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicalutamid Actavis 50 mg Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bicalutamidum 50 mg v jedné potahované tabletě.
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls167025/2008 a příloha ke sp.zn.sukls240643/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls167025/2008 a příloha ke sp.zn.sukls240643/2009 1. NÁZEV PŘÍPRAVKU Bicalutamid Actavis 150 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls167025/2008 a příloha ke sp.zn.sukls240643/2009 1. NÁZEV PŘÍPRAVKU Bicalutamid Actavis 150 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ
Biologická léčba karcinomu prsu. Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN)
 Biologická léčba karcinomu prsu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN) Cílená léčba Ca prsu Trastuzumab (HercepNn) AnN HER2 neu pronlátka LapaNnib (Tyverb)
Biologická léčba karcinomu prsu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN) Cílená léčba Ca prsu Trastuzumab (HercepNn) AnN HER2 neu pronlátka LapaNnib (Tyverb)
CMG LÉČBA RELAPSU, NOVÉ LÉKY, KLINICKÉ STUDIE. MUDr. Miroslava Schützová. Poděbrady 11. září 2010. Hemato-onkologické odd. FN Plzeň NADAČNÍ FOND
 LÉČBA RELAPSU, NOVÉ LÉKY, KLINICKÉ STUDIE MUDr. Miroslava Schützová Hemato-onkologické odd. FN Plzeň Poděbrady 11. září 2010 ČESKÁ MYELOMOVÁ SKUPINA CZECH CMG M Y E L O M A NADAČNÍ FOND GROUP Česká myelomová
LÉČBA RELAPSU, NOVÉ LÉKY, KLINICKÉ STUDIE MUDr. Miroslava Schützová Hemato-onkologické odd. FN Plzeň Poděbrady 11. září 2010 ČESKÁ MYELOMOVÁ SKUPINA CZECH CMG M Y E L O M A NADAČNÍ FOND GROUP Česká myelomová
Potahovaná tableta. Popis přípravku: bílé, kulaté, bikonvexní potahované tablety o průměru 6,5 mm.
 Sp.zn. sukls199099/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Binabic 50 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje bicalutamidum 50 mg. Pomocné
Sp.zn. sukls199099/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Binabic 50 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje bicalutamidum 50 mg. Pomocné
Léčba pokročilého karcinomu prostaty v kombinaci s léčbou LHRH analogy nebo chirurgickou kastrací.
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls11422/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Bicalutamide Morningside 50 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls11422/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Bicalutamide Morningside 50 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
BONEFOS (Dinatrii clodronas) koncentrát pro přípravu infúzního roztoku
 Příloha č. 2 ke sdělení sp. zn. sukls18805/2011 a příloha ke sp. zn. sukls18806/2011 Příbalová informace:informace pro uživatele BONEFOS (Dinatrii clodronas) koncentrát pro přípravu infúzního roztoku Držitel
Příloha č. 2 ke sdělení sp. zn. sukls18805/2011 a příloha ke sp. zn. sukls18806/2011 Příbalová informace:informace pro uživatele BONEFOS (Dinatrii clodronas) koncentrát pro přípravu infúzního roztoku Držitel
Jeden sáček obsahuje testosteronum 50 mg v 5 g gelu. Úplný seznam pomocných látek viz bod 6.1.
 Sp.zn.sukls30369/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Androgel 50 mg, gel v sáčku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje testosteronum 50 mg v 5 g gelu. Úplný seznam pomocných
Sp.zn.sukls30369/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Androgel 50 mg, gel v sáčku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje testosteronum 50 mg v 5 g gelu. Úplný seznam pomocných
Bílé až téměř bílé válcovité tyčinky (přibližné rozměry: průměr 1,5 mm, délka 13 mm, hmotnost 44 mg), z biologicky degradovatelné polymerní matrice.
 Sp.zn.sukls85858/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Reseligo 10,8 mg implantát v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden implantát obsahuje goserelinum
Sp.zn.sukls85858/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Reseligo 10,8 mg implantát v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden implantát obsahuje goserelinum
VNL. Onemocnění bílé krevní řady
 VNL Onemocnění bílé krevní řady Změny leukocytů V počtu leukocytů Ve vzájemném zastoupení morfologických typů leukocytů Ve funkci leukocytů Reaktivní změny leukocytů Leukocytóza: při bakteriální infekci
VNL Onemocnění bílé krevní řady Změny leukocytů V počtu leukocytů Ve vzájemném zastoupení morfologických typů leukocytů Ve funkci leukocytů Reaktivní změny leukocytů Leukocytóza: při bakteriální infekci
SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC)
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls124244/2007 1. NÁZEV PŘÍPRAVKU DIPHERELINE S.R. 11,25 mg SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek: 1
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls124244/2007 1. NÁZEV PŘÍPRAVKU DIPHERELINE S.R. 11,25 mg SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek: 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls199328/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicalutamid Actavis 150 mg Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bicalutamidum 150 mg v jedné potahované tabletě.
Sp.zn. sukls199328/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicalutamid Actavis 150 mg Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bicalutamidum 150 mg v jedné potahované tabletě.
REZISTENTNÍ ARTERIÁLNÍ HYPERTENZE
 REZISTENTNÍ ARTERIÁLNÍ HYPERTENZE Autor: Jakub Flašík Výskyt Hypertenze je definována jako obtížně léčitelná (rezistentni) tehdy když se nedaří dosáhnou cílových hodnot krevního tlaku (
REZISTENTNÍ ARTERIÁLNÍ HYPERTENZE Autor: Jakub Flašík Výskyt Hypertenze je definována jako obtížně léčitelná (rezistentni) tehdy když se nedaří dosáhnou cílových hodnot krevního tlaku (
Kongres medicíny pro praxi IFDA Praha, Míčovna Pražský hrad 24.října 2015
 Kongres medicíny pro praxi IFDA Praha, Míčovna Pražský hrad 24.října 2015 Glifloziny v terapii DM 2 Zkušenosti z praxe MUDr. Barbora Doležalová IDE CR s.r.o., Chrudim Univerzita Pardubice, Fakulta zdravotnických
Kongres medicíny pro praxi IFDA Praha, Míčovna Pražský hrad 24.října 2015 Glifloziny v terapii DM 2 Zkušenosti z praxe MUDr. Barbora Doležalová IDE CR s.r.o., Chrudim Univerzita Pardubice, Fakulta zdravotnických
4.4 Zvláštní upozornění a opatření pro použití 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce 4.6 Těhotenství a kojení
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLANUTA 150 mg Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje bicalutamidum 150 mg. Pomocné látky: 188,0 mg monohydrátu
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLANUTA 150 mg Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje bicalutamidum 150 mg. Pomocné látky: 188,0 mg monohydrátu
CZ PAR QUETIAPINUM. Seroquel. UK/W/0004/pdWS/001. NL/W/0004/pdWS/001
 CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
Stratifikace pacientů, prognostické faktory. Jana Katolická FN u svaté Anny, Brno
 Stratifikace pacientů, prognostické faktory Jana Katolická FN u svaté Anny, Brno mcrcp heterogenní onemocnění Absence validovaných biomarkerů pro identifikaci pacienta : Se špatnou prognózou Rezistentní
Stratifikace pacientů, prognostické faktory Jana Katolická FN u svaté Anny, Brno mcrcp heterogenní onemocnění Absence validovaných biomarkerů pro identifikaci pacienta : Se špatnou prognózou Rezistentní
dihpočet nemocných s ca prostatae
 CZ989 I. BLOK me k dispozici nové a slibné preparáty, které by mohly blokovat progresi pokročilého onemocnění, ale také daleko efektivněji nežli tradičními anodyny ovlivnit symptomatologii bolestí. Karcinom
CZ989 I. BLOK me k dispozici nové a slibné preparáty, které by mohly blokovat progresi pokročilého onemocnění, ale také daleko efektivněji nežli tradičními anodyny ovlivnit symptomatologii bolestí. Karcinom
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicaluplex 150 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá tableta obsahuje 150 mg bicalutamidum. Pomocná látka se známým účinkem: Jedna
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicaluplex 150 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá tableta obsahuje 150 mg bicalutamidum. Pomocná látka se známým účinkem: Jedna
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
Norifaz 35 mg potahované tablety
 Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls18991/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Norifaz 35 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta
Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls18991/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Norifaz 35 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta
1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Undestor 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum. Přípravek obsahuje oranžovou
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Undestor 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum. Přípravek obsahuje oranžovou
Nové možnosti v léčbě generalizovaného karcinomu prostaty. MUDr. Jaroslav Hájek Klinika onkologická, FN Ostrava
 Nové možnosti v léčbě generalizovaného karcinomu prostaty MUDr. Jaroslav Hájek Klinika onkologická, FN Ostrava 29.6.2017 Karcinom prostaty průběh onemocnění Docetaxel/chemoterapie Smrt Objem nádoru Lokální
Nové možnosti v léčbě generalizovaného karcinomu prostaty MUDr. Jaroslav Hájek Klinika onkologická, FN Ostrava 29.6.2017 Karcinom prostaty průběh onemocnění Docetaxel/chemoterapie Smrt Objem nádoru Lokální
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
RENIS - Votrient. Klinický registr pacientů s renálním karcinomem. Stav registru k datu 26. 3. 2012
 RENIS - Votrient Klinický registr pacientů s renálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr. Zbyněk
RENIS - Votrient Klinický registr pacientů s renálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr. Zbyněk
RADA A POUČENÍ LÉKAŘE
 RADA A POUČENÍ LÉKAŘE Obsah: Uživatelky kombinované hormonální antikoncepce Léčebné účinky kombinované hormonální antikoncepce Kontraindikace kombinované hormonální antikoncepce Vysvětlivky: COC = z anglického
RADA A POUČENÍ LÉKAŘE Obsah: Uživatelky kombinované hormonální antikoncepce Léčebné účinky kombinované hormonální antikoncepce Kontraindikace kombinované hormonální antikoncepce Vysvětlivky: COC = z anglického
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Pomocná látka se známým účinkem: monohydrát laktosy 181 mg v jedné potahované tabletě.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicalutanorm 150 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bicalutamidum 150 mg v jedné potahované tabletě. Pomocná látka se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bicalutanorm 150 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bicalutamidum 150 mg v jedné potahované tabletě. Pomocná látka se známým účinkem:
Zdravotní deník pro sledování léčby
 Zdravotní deník pro sledování léčby Péče o muže s rakovinou prostaty Proč bych měl být sledován pravidelně? Lékaři mi nedávno zjistili rakovinu prostaty, se kterou se budu dlouhodobě léčit. Můj lékař zvolil
Zdravotní deník pro sledování léčby Péče o muže s rakovinou prostaty Proč bych měl být sledován pravidelně? Lékaři mi nedávno zjistili rakovinu prostaty, se kterou se budu dlouhodobě léčit. Můj lékař zvolil
Urychlení úpravy krvetvorby poškozené cytostatickou terapií (5-fluorouracil a cisplatina) p.o. aplikací IMUNORu
 Urychlení úpravy krvetvorby poškozené cytostatickou terapií (5-fluorouracil a cisplatina) p.o. aplikací IMUNORu Úvod Myelosuprese (poškození krvetvorby) patří mezi nejčastější vedlejší účinky chemoterapie.
Urychlení úpravy krvetvorby poškozené cytostatickou terapií (5-fluorouracil a cisplatina) p.o. aplikací IMUNORu Úvod Myelosuprese (poškození krvetvorby) patří mezi nejčastější vedlejší účinky chemoterapie.
5. PORUŠENÁ TOLERANCE S - definována výsledkem orálního glu. testu jde o hodnotu ve 120. minutě 7,7-11,1 mmol/l. Společně s obezitou.
 VÝŽIVA V PREVENCI DM 1. DM I. absolutní nedostatek inzulinu dochází kvůli destrukci β- buněk L. ostrůvků autoimunně podmíněným zánětem. Všechny věkové kategorie nejvíce děti. Prim prevence výživou nemá
VÝŽIVA V PREVENCI DM 1. DM I. absolutní nedostatek inzulinu dochází kvůli destrukci β- buněk L. ostrůvků autoimunně podmíněným zánětem. Všechny věkové kategorie nejvíce děti. Prim prevence výživou nemá
Paliativní péče o mladého pacienta s generalizovaným karcinomem prostaty
 Klinika onkologická Fakultní nemocnice Ostrava a Mobilní hospicová jednotka Ondrášek Paliativní péče o mladého pacienta s generalizovaným karcinomem prostaty Atestační práce v oboru : paliativní medicína
Klinika onkologická Fakultní nemocnice Ostrava a Mobilní hospicová jednotka Ondrášek Paliativní péče o mladého pacienta s generalizovaným karcinomem prostaty Atestační práce v oboru : paliativní medicína
Diagnostika a příznaky mnohočetného myelomu
 Diagnostika a příznaky mnohočetného myelomu J.Minařík, V.Ščudla Mnohočetný myelom Nekontrolované zmnožení nádorově změněných plasmatických buněk v kostní dřeni Mnohočetný = obvykle více oblastí kostní
Diagnostika a příznaky mnohočetného myelomu J.Minařík, V.Ščudla Mnohočetný myelom Nekontrolované zmnožení nádorově změněných plasmatických buněk v kostní dřeni Mnohočetný = obvykle více oblastí kostní
R.A. Burger, 1 M.F. Brady, 2 J. Rhee, 3 M.A. Sovak, 3 H. Nguyen, 3 M.A. Bookman 4
 NEZÁVISLÉ RADIOLOOGICKÉ HODNOCENÍ STUDIE FÁZE III GOG218 S BEVACIZUMABEM (BEV) V PRIMÁRNÍ LÉČBĚ POKROČILÉHO EPITELOVÉHO NÁDORU VAJEČNÍKŮ, PRIMÁRNÍHO NÁDORU PERITONEA NEBO VEJCOVODŮ. R.A. Burger, 1 M.F.
NEZÁVISLÉ RADIOLOOGICKÉ HODNOCENÍ STUDIE FÁZE III GOG218 S BEVACIZUMABEM (BEV) V PRIMÁRNÍ LÉČBĚ POKROČILÉHO EPITELOVÉHO NÁDORU VAJEČNÍKŮ, PRIMÁRNÍHO NÁDORU PERITONEA NEBO VEJCOVODŮ. R.A. Burger, 1 M.F.
Osteoporóza. Osteoporóza ztráta jak organické, tak anorganické složky (řídnutí) Osteomalácie ztráta anorganické složky (měknutí)
 Terapie osteoporozy Osteoporóza systémová choroba kostry charakterizovaná snížením kostní hmoty se zhoršením mikroarchitektury kosti a s následným vzestupem fragility a rizikem zlomenin Osteoporóza Osteoporóza
Terapie osteoporozy Osteoporóza systémová choroba kostry charakterizovaná snížením kostní hmoty se zhoršením mikroarchitektury kosti a s následným vzestupem fragility a rizikem zlomenin Osteoporóza Osteoporóza
Zkušenosti z chirurgickou léčbou karcinomu prostaty. Broďák M. Urologická klinika LFUK a FN Hradec Králové
 Zkušenosti z chirurgickou léčbou karcinomu prostaty Broďák M. Urologická klinika LFUK a FN Hradec Králové www.urologie-hk.cz Úvod Nejčastější zhoubný nádor u mužů (mimo nádorů kůže) Narůstající incidence,
Zkušenosti z chirurgickou léčbou karcinomu prostaty Broďák M. Urologická klinika LFUK a FN Hradec Králové www.urologie-hk.cz Úvod Nejčastější zhoubný nádor u mužů (mimo nádorů kůže) Narůstající incidence,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls205958/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-FLUTAMIDE Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje flutamidum 250 mg. Pomocné
sp.zn. sukls205958/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-FLUTAMIDE Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje flutamidum 250 mg. Pomocné
