Fenomenologická termodynamika
|
|
|
- Marcela Hrušková
- před 9 lety
- Počet zobrazení:
Transkript
1 Atkins 1 Fenomenologická termodynamika Popisuje makroskopický stav Neuvažuje vnitřní stavbu hmoty okolí termodynamická soustava (systém) okolí Vnitřní parametry teplota T vnitřní energie U tlak p látková množství n1, n2, Vnější podmínky Objem V externí silová pole
2 Axiomy termodynamiky Existence termodynamické rovnováhy Za neměnných vnějších podmínek dojde soustava do rovnováhy Aditivita vnitřní energie Vnitřní energie soustavy je součtem vnitřních energií jejích makroskopických částí intenzivní a extenzivní vel. Nultý zákon termodynamiky Stav soustavy závisí na jediném vnitřním parametru, vnitřní energii Místo vnitřní energie (extenzivní vel.) lze použít teploty (intenzivní vel.) Asociativita teploty tj. jestli T 1 =T 2 a T 2 =T 3, pak musí T 1 =T 3 Intenzivní vel. nezávisí na n tlak p teplota T mol. zlomek x Extenzivní vel. závisí na n objem V Vnitřní energie U
3 Teplota ΔH dil =+3.87 kj/mol Topné hnízdo Led Led+NaCl Led+CaCl 2 Suchý led (CO 2 ) Suchý led+aceton Tekutý dusík Tekuté helium ~200 C 0 C -20 C -55 C -79 C -86 C -196 C -269 C
4 Atkins 1.1 Termodynamický stav a stavová rovnice změna T Black box systém [n,v] změna p Stavová rovnic e Ideální plyn (bez interakcí a vnitřního objemu) Boyleův zákon Gay-Lussacův zákon Charlesův zákon pv = konst. pv = nrt V T = konst. p T = konst.
5 Atkins 1.1 Termodynamický děj Vratný (reverzibilní) Nevratný (ireverzibilní) izotermický T = konst. pv = konst. izobarický p = konst. T V = konst. izochorický V = konst. T p = konst. adiabatický Q = konst. pv κ = konst.
6 Atkins 2 I. zákon termodynamiky teplo dodané systému práce vykonaná systémem Q Systém U = Q W W U = Q W du = ᵭQ ᵭW Claussiova konvence du = ᵭQ pdv ᵭW = +pdv
7 Atkins 2 I. zákon termodynamiky energie dodaná systému ve formě tepla Q Systém U = Q + W energie dodaná systému ve formě práce W U = Q + W du = ᵭQ + ᵭW IUPAC konvence du = ᵭQ pdv ᵭW = pdv
8 I. zákon termodynamiky znaménková konvence Atkins 2 Claussiova konvence du = ᵭQ ᵭW ᵭW = +pdv du = ᵭQ pdv IUPAC konvence du = ᵭQ + ᵭW ᵭW = pdv du = ᵭQ pdv
9 Atkins 2.1 mechanická F = konst. W = F s ᵭW = F ds W = F ds povrchová S ᵭW = σds W = σds smáčivost kapilarita utajený var 0 0 s práce Povrchové napětí objemová ᵭW = pdv W = pdv 0 V Přechod kondenzovaná-plynná fáze Změna objemu v plynné fázi Reakce v plynné fázi elektrická ᵭW = UdQ = U dq dt t dt = UI dt W = UIdt 0
10 Atkins Joule-Thomsonův jev p 1 > p 2 U = U 2 U 1 = p 2 V m2 + p 1 V m1 enthalpie H = U + pv H = H 2 H 1 = 0 du = ᵭQ pdv dh = d U + pv dh = ᵭQ + Vdp Adiabatická expanze přes porézní membránu (dq=0) Inverzní teplota pod inv. teplotou se plyn ochlazuje Za pokojové teploty se ochlazují všechny plyny kromě H 2, He a Ne Zachovává se celková enthalpie
11 Tepelná kapacita C = Q T c m = C m c = c m M [J K -1 ] [J kg -1 K -1 ] [J mol -1 K -1 ] Měrná tepelná kapacita Molární tepelná kapacita konstantní objem V = konst. dv = 0 ᵭQ = du + ᵭW = du + pdv = du c V = U T V konstantní tlak p = konst. dp = 0 c p = Q T p = U T p + p V T p = U + pv T p = H T p n = 1mol pv = RT H = U + RT c p = c V + R Mayerova rovnice
12 Tepelná kapacita ekvipartiční teorém Rovnoměrné rozdělení energie do stupňů volnosti Každý stupeň volnosti přispívající kvadraticky k energii přispívá k energii v průměru 1 2 k BT Poloha a natočení molekuly nepřispívá Energie není kvadratickou funkcí polohy a natočení Hybnosti a vibrace přispívají 1 2 k BT Translační a rotační stupně volnosti přispívají k celkové energii 1 2 k BT Vibrační stupně volnosti přispívají členemk B T Molární vnitřní energie Atomární plyn 2-atomová molekula Více-atomová molekula U m = 3 2 RT U m = 7 2 RT U m = 3NRT
13 Tepelná kapacita Cv [J/mol K] He 12.5 Ne 12.5 Ar 12.5 Kr 12.5 Xe 12.5 Cv [J/mol K] H CO 20.2 N Cl Br 2 (g) 28.2
14 Tepelná kapacita Cv [J/mol K] Vzduch Ar Oxid uhličitý Pára (100 C) Voda (25 C) dusík 20.8 Neon kyslík 21.0
15 Tepelná kapacita pevná fáze Vysoké teploty ekvipartiční teorém C V =3R Nízké teploty Einsteinova teorie Debyeho teorie C V ~T 3
16 kalorimetrie Q = mc m T 2 T 1 m 1 c m,1 T T 1 mc m T 2 T 1 = m 2 c m,2 T 2 T = UIt
17 Atkins I-2.1 DSC diferenční skenovací kalorimetrie Teplotní program zahřívání, chlazení Měření oproti referenci - kompenzace rozdílu teplot Fázové změny, tání, krystalizace, skelný přechod, etc.
18 ICT izotermální kalorimetrická titrace Titrace daného alikvótního podílu ligandu Měření oproti referenci - kompenzace rozdílu teplot Síla vazby ligand-protein (K, ΔH, ΔS, ΔG)
19 Atkins 2.2 termochemie C(grafit) + O 2 H = 393, 5 kj/mol Exotermická reakce H = 393, 5 kj/mol CO 2 C(grafit) + O 2 CO 2 H = +393, 5 kj/mol Endotermická reakce I. Termochemický zákon (Lavoisierův-Laplaceův) Tepelné zabarvení dopředné a zpětné reakce se liší pouze znaménkem
20 Atkins 2.2 termochemie H = 1, 9 kj/mol C(grafit) + O 2 H = 393, 5 kj/mol C(diamant) + O 2 H = 395, 4 kj/mol CO 2 C(grafit) + O 2 H = 393, 5 kj/mol CO 2 H = 395, 4 kj/mol C(diamant) + O 2 CO 2 C(grafit) H = 1, 9 kj/mol C(diamant) II. Termochemický zákon (Hessův) Reakční teplo závisí pouze na počátečním a koncovém stavu, nikoli na mezistupních reakce
21 Atkins 2.2 Slučovací enthalpie D sluč H termochemie Reakční teplo slučování z prvků v jejich standardním stavu (C, Si, ale H 2, Cl 2 etc.) Spalná ethalpie DH sp Reakční teplo při hoření Δ r H ө = Δ r H ө = Reační teplo D r H teplo z D sp H a D sluč H Hessův z. Závislost reakčního tepla na teplotě (Kirchhoffův zákon) prod reakt T 2 r H ө T 2 = r H ө T 1 + C pm dt T 1 ν i Δ sluč H i ө ν i Δ sp H i ө reakt prod ν i Δ sluč H i ө ν i Δ sp H i ө
22 Standardní stavy Standardní tlak p ө =10 5 Pa Standardní teplota není definována, ale používá se T= K popř. T= K Standardní stav látky Termodynamicky nejstabilnější forma (alotrop) prvku (např. grafit u uhlíku) plyn plyn za stand. tlaku a ideálního chování kapalina/pevná látka za stand. tlaku roztok jednotková molalita/látková koncentrace a chování jako při nekonečném zředění
23 Atkins 2.2 termochemie Slučovací a spalné enthalpie D sluč H a D sp H D sluč H [kj/mol] D sp H [kj/kg] Vodík Metan Ethan Propan Butan Oxid uhličitý
24 Atkins 2.2 termochemie Rozpouštěcí enthalpie D dil H Změna enthalpie asociovaná s rozpuštěním solutu v solventu Rozpouštění nevazebné interakce Vodíkové můstky Disperzní interakce Hydrofóbní efekt Ztráta interakce Solvent-solvent Endotercký proces Exotercký proces Interakce Solut-solvent Ztráta interakce Solut-solut (krystal) Rozpouštěcí enthalpie ΔH sol dil
25 Atkins 2.2 termochemie Rozpouštěcí enthalpie D dil H ve vodě za 25 C D dil H [kj/mol] Kyselina chlorovodíková Dusičnan amonný Amoniak Hydroxid draselný Hydroxid cesný Chlorid sodný Chlornan draselný Kyselina octová Hydroxid sodný
26 Atkins 3 II. zákon termodynamiky Clausiusova formulace: teplo přechází z teplejšího na chladnější těleso Thomsonova, Plankova, (Oswaldova) formulace: nelze kompletně a periodicky převádět teplo na práci bez změn v okolí entropie Vyšší teplota Q in Vyšší teplota Q in ds = ᵭQ T du = TdS pdv W out Q out W out U = U S, V Nižší teplota du = U S V ds + U V S dv
27 III. zákon termodynamiky Nernstův teorém Při teplotě absolutní nuly (T=0K) je entropie čisté pevné látky (ideální krystal) rovna nule Při teplotě absolutní nuly (T=0K) se změna entropie čisté pevné látky (ideální krystal) blíží nule Definice absolutních hodnot termodynamických veličin Reziduální entropie Amorfní materiály, krystalografické polymorfie Např. orientace molekul v krystalu CO lim S T T 0 lim S T T 0 = 0 = 0
28 Atkins Termodynamické potenciály Vnitřní energie Enthalpie Helmholtzova energie Gibbsova energie U H = U + pv F = U TS G = H TS du = TdS pdv dh = TdS + Vdp df = SdT pdv dg = SdT + Vdp U = U S, V H = H S, p F = F T, V G = G T, p adiabatickoizochorický děj adiabatickoizobarický děj izotermickoizochorický děj izotermickoizobarický děj + dω neobj. neobjemová práce, např. + σds + μ i dn i i
29 Atkins Termodynamické potenciály du = dh = U S V ds + U V S dv = TdS pdv H S p ds + H p S dp = TdS + Vdp dg = df = G T p dt + F T V dt + G p T dp = SdT + Vdp F V T dv = SdT pdv
30 Neplést s teorií Elektromagnetického pole Maxwellovy rovnice Atkins df(x, y) = y f x y dx + f x y = x f y x dy f y x du = dh = dg = df = U S V ds + U V S dv = TdS pdv H ds + H dp = TdS + Vdp S p p S G T p dt + F T V dt + G p T dp = SdT + Vdp F V T dv = SdT pdv 2 U S V = + 2 H S p = + 2 G T p = 2 F T V = T V S = T = + p S S = + p T S V T = p S V V S p V T p p T V
31 Atkins Maxwellovy rovnice koeficient tepelné roztažnosti tepelná kompresibilita Maxwellovy rovnice y f x y = x f y x Cyklické relace z y x = z x y x y z
32 Atkins Chemická síla Chemický potenciál Chemická práce du = TdS pdv + μ i dn i dh = TdS + Vdp + μ i dn i dg = SdT + Vdp + μ i dn i df = SdT pdv + μ i dn i i i i i μ i = U = H = G = F n i n S,V,n i n j i S,p,n i n j i T,p,n i j i T,V,n j i
33 Atkins Chemický potenciál Molární Gibbsova energie (izotermicko-izobarické podmínky) G m = μ G = nμ G = n i μ i i Molární Helmholtzova energie (izotermicko-izochorické podmínky) F m = μ F = nμ F = n i μ i i Molární enthalpie (adiabaticko-izobarické podmínky) H m = μ H = nμ H = n i μ i i Molární vnitřní energie (adiabaticko-izochorické podmínky) U m = μ U = nμ U = n i μ i i p A = p 0,A x A Závislost na tlaku Raultův zákon Závislost na aktivitě μ i = μ ө i + RT ln p p ө μ i = μ ө i + RT ln ax i
34 Atkins 5.4 Efektivní koncentrace Chemická aktivita látky ve směsích (roztocích) spolu interagují v rovnováze a kinetice nehraje roli pouze množství látky, ale i její okolí neideální chování roztoků Aktivitní koeficient molární zlomek a i = γ x,i x i = γ c,i c i c i ө = γ c m,i molární koncentrace a i = e μ μ ө i RT c m,i ө c m,i molalita Plyny fugacita (efektivní tlak) a i = f i p ө
8. Chemické reakce Energetika - Termochemie
 - Termochemie TERMOCHEMIE oddíl termodynamiky Tepelné zabarvení chemických reakcí Samovolnost chemických reakcí Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti - Termochemie TERMOCHEMIE
- Termochemie TERMOCHEMIE oddíl termodynamiky Tepelné zabarvení chemických reakcí Samovolnost chemických reakcí Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti - Termochemie TERMOCHEMIE
Fyzikální chemie. Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302. 14. února 2013
 Fyzikální chemie Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302 14. února 2013 Co je fyzikální chemie? Co je fyzikální chemie? makroskopický přístup: (klasická) termodynamika nerovnovážná
Fyzikální chemie Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302 14. února 2013 Co je fyzikální chemie? Co je fyzikální chemie? makroskopický přístup: (klasická) termodynamika nerovnovážná
Kapitoly z fyzikální chemie KFC/KFCH. II. Termodynamika
 Kapitoly z fyzikální chemie KFC/KFCH II. Termodynamika Karel Berka Univerzita Palackého v Olomouci Katedra Fyzikální chemie karel.berka@upol.cz Termodynamika therme - teplo a dunamis - síla popis jak systémy
Kapitoly z fyzikální chemie KFC/KFCH II. Termodynamika Karel Berka Univerzita Palackého v Olomouci Katedra Fyzikální chemie karel.berka@upol.cz Termodynamika therme - teplo a dunamis - síla popis jak systémy
2.4 Stavové chování směsí plynů Ideální směs Ideální směs reálných plynů Stavové rovnice pro plynné směsi
 1. ZÁKLADNÍ POJMY 1.1 Systém a okolí 1.2 Vlastnosti systému 1.3 Vybrané základní veličiny 1.3.1 Množství 1.3.2 Délka 1.3.2 Délka 1.4 Vybrané odvozené veličiny 1.4.1 Objem 1.4.2 Hustota 1.4.3 Tlak 1.4.4
1. ZÁKLADNÍ POJMY 1.1 Systém a okolí 1.2 Vlastnosti systému 1.3 Vybrané základní veličiny 1.3.1 Množství 1.3.2 Délka 1.3.2 Délka 1.4 Vybrané odvozené veličiny 1.4.1 Objem 1.4.2 Hustota 1.4.3 Tlak 1.4.4
FYZIKÁLNÍ CHEMIE chemická termodynamika
 FYZIKÁLNÍ CHEMIE chemická termodynamika ermodynamika jako vědní disciplína Základní zákony termodynamiky Práce, teplo a energie Vnitřní energie a entalpie Chemická termodynamika Definice termodynamiky
FYZIKÁLNÍ CHEMIE chemická termodynamika ermodynamika jako vědní disciplína Základní zákony termodynamiky Práce, teplo a energie Vnitřní energie a entalpie Chemická termodynamika Definice termodynamiky
Termodynamika materiálů. Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn
 Termodynamika materiálů Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn Důležité konstanty Standartní podmínky Avogadrovo číslo N A = 6,023.10
Termodynamika materiálů Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn Důležité konstanty Standartní podmínky Avogadrovo číslo N A = 6,023.10
Kapitoly z fyzikální chemie KFC/KFCH. II. Termodynamika
 Kapitoly z fyzikální chemie KFC/KFCH II. Termodynamika Karel Berka Univerzita Palackého v Olomouci Katedra Fyzikální chemie karel.berka@upol.cz Termodynamika therme - teplo a dunamis - síla popis jak systémy
Kapitoly z fyzikální chemie KFC/KFCH II. Termodynamika Karel Berka Univerzita Palackého v Olomouci Katedra Fyzikální chemie karel.berka@upol.cz Termodynamika therme - teplo a dunamis - síla popis jak systémy
Termodynamika a živé systémy. Helena Uhrová
 Termodynamika a živé systémy Helena Uhrová Základní pojmy termodynamiky soustava izolovaná otevřená okolí vlastnosti soustavy znaky popisující soustavu stav rovnováhy tok m či E =0 funkce stavu - soubor
Termodynamika a živé systémy Helena Uhrová Základní pojmy termodynamiky soustava izolovaná otevřená okolí vlastnosti soustavy znaky popisující soustavu stav rovnováhy tok m či E =0 funkce stavu - soubor
Tepelná vodivost. střední rychlost. T 1 > T 2 z. teplo přenesené za čas dt: T 1 T 2. tepelný tok střední volná dráha. součinitel tepelné vodivosti
 Tepelná vodivost teplo přenesené za čas dt: T 1 > T z T 1 S tepelný tok střední volná dráha T součinitel tepelné vodivosti střední rychlost Tepelná vodivost součinitel tepelné vodivosti při T = 300 K součinitel
Tepelná vodivost teplo přenesené za čas dt: T 1 > T z T 1 S tepelný tok střední volná dráha T součinitel tepelné vodivosti střední rychlost Tepelná vodivost součinitel tepelné vodivosti při T = 300 K součinitel
Zákony ideálního plynu
 5.2Zákony ideálního plynu 5.1.1 Ideální plyn 5.1.2 Avogadrův zákon 5.1.3 Normální podmínky 5.1.4 Boyleův-Mariottův zákon Izoterma 5.1.5 Gay-Lussacův zákon 5.1.6 Charlesův zákon 5.1.7 Poissonův zákon 5.1.8
5.2Zákony ideálního plynu 5.1.1 Ideální plyn 5.1.2 Avogadrův zákon 5.1.3 Normální podmínky 5.1.4 Boyleův-Mariottův zákon Izoterma 5.1.5 Gay-Lussacův zákon 5.1.6 Charlesův zákon 5.1.7 Poissonův zákon 5.1.8
soustava - část prostoru s látkovou náplní oddělená od okolí skutečnými nebo myšlenými stěnami okolí prostor vně uvažované soustavy
 Soustava soustava - část prostoru s látkovou náplní oddělená od okolí skutečnými nebo myšlenými stěnami okolí prostor vně uvažované soustavy Okolí Hraniční plocha Soustava Soustava Rozdělení podle vztahu
Soustava soustava - část prostoru s látkovou náplní oddělená od okolí skutečnými nebo myšlenými stěnami okolí prostor vně uvažované soustavy Okolí Hraniční plocha Soustava Soustava Rozdělení podle vztahu
Termodynamika. T [K ]=t [ 0 C] 273,15 T [ K ]= t [ 0 C] termodynamická teplota: Stavy hmoty. jednotka: 1 K (kelvin) = 1/273,16 část termodynamické
![Termodynamika. T [K ]=t [ 0 C] 273,15 T [ K ]= t [ 0 C] termodynamická teplota: Stavy hmoty. jednotka: 1 K (kelvin) = 1/273,16 část termodynamické Termodynamika. T [K ]=t [ 0 C] 273,15 T [ K ]= t [ 0 C] termodynamická teplota: Stavy hmoty. jednotka: 1 K (kelvin) = 1/273,16 část termodynamické](/thumbs/24/2778201.jpg) Termodynamika termodynamická teplota: Stavy hmoty jednotka: 1 K (kelvin) = 1/273,16 část termodynamické teploty trojného bodu vody (273,16 K = 0,01 o C). 0 o C = 273,15 K T [K ]=t [ 0 C] 273,15 T [ K ]=
Termodynamika termodynamická teplota: Stavy hmoty jednotka: 1 K (kelvin) = 1/273,16 část termodynamické teploty trojného bodu vody (273,16 K = 0,01 o C). 0 o C = 273,15 K T [K ]=t [ 0 C] 273,15 T [ K ]=
Nultá věta termodynamická
 TERMODYNAMIKA Nultá věta termodynamická 2 Práce 3 Práce - příklady 4 1. věta termodynamická 5 Entalpie 6 Tepelné kapacity 7 Vnitřní energie a entalpie ideálního plynu 8 Výpočet tepla a práce 9 Adiabatický
TERMODYNAMIKA Nultá věta termodynamická 2 Práce 3 Práce - příklady 4 1. věta termodynamická 5 Entalpie 6 Tepelné kapacity 7 Vnitřní energie a entalpie ideálního plynu 8 Výpočet tepla a práce 9 Adiabatický
Termochemie se zabývá tepelným zabarvením chemických reakcí Vychází z 1. termodynamického zákona. U změna vnitřní energie Q teplo W práce
 Termochemie Termochemie se zabývá tepelným zabarvením chemických reakcí Vychází z 1. termodynamického zákona U = Q + W U změna vnitřní energie Q teplo W práce Teplo a práce dodané soustavě zvyšují její
Termochemie Termochemie se zabývá tepelným zabarvením chemických reakcí Vychází z 1. termodynamického zákona U = Q + W U změna vnitřní energie Q teplo W práce Teplo a práce dodané soustavě zvyšují její
CHEMICKÁ ENERGETIKA. Celá termodynamika je logicky odvozena ze tří základních principů, které mají axiomatický charakter.
 CHEMICKÁ ENERGETIKA Energetickou stránkou soustav a změnami v těchto soustavách se zabývá fyzikální disciplína termodynamika. Z široké oblasti obecné termodynamiky se chemická termodynamika zajímá o chemické
CHEMICKÁ ENERGETIKA Energetickou stránkou soustav a změnami v těchto soustavách se zabývá fyzikální disciplína termodynamika. Z široké oblasti obecné termodynamiky se chemická termodynamika zajímá o chemické
Fyzikální chemie. 1.2 Termodynamika
 Fyzikální chemie. ermodynamika Mgr. Sylvie Pavloková Letní semestr 07/08 děj izotermický izobarický izochorický konstantní V ermodynamika rvní termodynamický zákon (zákon zachování energie): U Q + W izotermický
Fyzikální chemie. ermodynamika Mgr. Sylvie Pavloková Letní semestr 07/08 děj izotermický izobarický izochorický konstantní V ermodynamika rvní termodynamický zákon (zákon zachování energie): U Q + W izotermický
CHEMICKÁ ENERGETIKA. Celá termodynamika je logicky odvozena ze tří základních principů, které mají axiomatický charakter.
 CHEMICKÁ ENERGETIKA Energetickou stránkou soustav a změnami v těchto soustavách se zabývá fyzikální disciplína termodynamika. Z široké oblasti obecné termodynamiky se chemická termodynamika zajímá o chemické
CHEMICKÁ ENERGETIKA Energetickou stránkou soustav a změnami v těchto soustavách se zabývá fyzikální disciplína termodynamika. Z široké oblasti obecné termodynamiky se chemická termodynamika zajímá o chemické
Termodynamika - Formy energie
 Termodynamika - Formy energie Energetické přeměny při chemických a fyzikálních procesech, přenos energie mezi látkami, vzájemné přeměny různých druhů energie, Rozhoduje pouze počáteční a konečný stav Nezávisí
Termodynamika - Formy energie Energetické přeměny při chemických a fyzikálních procesech, přenos energie mezi látkami, vzájemné přeměny různých druhů energie, Rozhoduje pouze počáteční a konečný stav Nezávisí
Termochemie. Katedra materiálového inženýrství a chemie A Ing. Martin Keppert Ph.D.
 Termochemie Ing. Martin Keppert Ph.D. Katedra materiálového inženýrství a chemie keppert@fsv.cvut.cz A 329 http://tpm.fsv.cvut.cz/ Termochemie: tepelné jevy při chemických reakcích Chemická reakce: CH
Termochemie Ing. Martin Keppert Ph.D. Katedra materiálového inženýrství a chemie keppert@fsv.cvut.cz A 329 http://tpm.fsv.cvut.cz/ Termochemie: tepelné jevy při chemických reakcích Chemická reakce: CH
Mol. fyz. a termodynamika
 Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
7.TERMODYNAMIKA. 7) Doplň údaj o reakčním teple(tepelným zabarvením rce).
 Termodynamika 7.TERMODYNAMIKA 1) Vysvětli pojem termodynamika, druhy soustav (uveď příklady), stavové veličiny (uveď druhy-měřitelné stavové veličiny a stavové fce, příklady, vysvětli rozdíl) 2) Co je
Termodynamika 7.TERMODYNAMIKA 1) Vysvětli pojem termodynamika, druhy soustav (uveď příklady), stavové veličiny (uveď druhy-měřitelné stavové veličiny a stavové fce, příklady, vysvětli rozdíl) 2) Co je
Elektroenergetika 1. Termodynamika
 Elektroenergetika 1 Termodynamika Termodynamika Popisuje procesy, které zahrnují změny teploty, přeměny energie a vzájemný vztah mezi tepelnou energií a mechanickou prací Opakování fyziky Termodynamický
Elektroenergetika 1 Termodynamika Termodynamika Popisuje procesy, které zahrnují změny teploty, přeměny energie a vzájemný vztah mezi tepelnou energií a mechanickou prací Opakování fyziky Termodynamický
Plyn. 11 plynných prvků. Vzácné plyny. He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2
 Plyny Plyn T v, K Vzácné plyny 11 plynných prvků He, Ne, Ar, Kr, Xe, Rn 165 Rn 211 N 2 O 2 77 F 2 90 85 Diatomické plynné prvky Cl 2 238 H 2, N 2, O 2, F 2, Cl 2 H 2 He Ne Ar Kr Xe 20 4.4 27 87 120 1 Plyn
Plyny Plyn T v, K Vzácné plyny 11 plynných prvků He, Ne, Ar, Kr, Xe, Rn 165 Rn 211 N 2 O 2 77 F 2 90 85 Diatomické plynné prvky Cl 2 238 H 2, N 2, O 2, F 2, Cl 2 H 2 He Ne Ar Kr Xe 20 4.4 27 87 120 1 Plyn
Elektroenergetika 1. Termodynamika a termodynamické oběhy
 Termodynamika a termodynamické oběhy Termodynamika Popisuje procesy, které zahrnují změny teploty, přeměny energie a vzájemný vztah mezi tepelnou energií a mechanickou prací Opakování fyziky Termodynamický
Termodynamika a termodynamické oběhy Termodynamika Popisuje procesy, které zahrnují změny teploty, přeměny energie a vzájemný vztah mezi tepelnou energií a mechanickou prací Opakování fyziky Termodynamický
Průvodka. CZ.1.07/1.5.00/ Zkvalitnění výuky prostřednictvím ICT. III/2 Inovace a zkvalitnění výuky prostřednictvím ICT. Pořadí DUMu v sadě 10
 Průvodka Číslo projektu Název projektu Číslo a název šablony klíčové aktivity CZ.1.07/1.5.00/34.0802 Zkvalitnění výuky prostřednictvím ICT III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Příjemce
Průvodka Číslo projektu Název projektu Číslo a název šablony klíčové aktivity CZ.1.07/1.5.00/34.0802 Zkvalitnění výuky prostřednictvím ICT III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Příjemce
6. Stavy hmoty - Plyny
 skupenství plynné plyn x pára (pod kritickou teplotou) stavové chování Ideální plyn Reálné plyny Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti skupenství plynné reálný plyn ve stavu
skupenství plynné plyn x pára (pod kritickou teplotou) stavové chování Ideální plyn Reálné plyny Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti skupenství plynné reálný plyn ve stavu
Osnova pro předmět Fyzikální chemie II magisterský kurz
 Osnova pro předmět Fyzikální chemie II magisterský kurz Časový a obsahový program přednášek Týden Obsahová náplň přednášky Pozn. Stavové chování tekutin 1,2a 1, 2a Molekulární přístup kinetická teorie
Osnova pro předmět Fyzikální chemie II magisterský kurz Časový a obsahový program přednášek Týden Obsahová náplň přednášky Pozn. Stavové chování tekutin 1,2a 1, 2a Molekulární přístup kinetická teorie
TERMOCHEMIE, TERMOCHEMICKÉ ZÁKONY, TERMODYNAMIKA, ENTROPIE
 TERMOCHEMIE, TERMOCHEMICKÉ ZÁKONY, TERMODYNAMIKA, ENTROPIE Chemická reakce: Jestliže se za vhodných podmínek vyskytnou 2 látky schopné spolu reagovat, nastane chemická reakce. Při ní z výchozích látek
TERMOCHEMIE, TERMOCHEMICKÉ ZÁKONY, TERMODYNAMIKA, ENTROPIE Chemická reakce: Jestliže se za vhodných podmínek vyskytnou 2 látky schopné spolu reagovat, nastane chemická reakce. Při ní z výchozích látek
CHEMIE. Pracovní list č. 4 - žákovská verze Téma: Tepelné zabarvení chemických reakcí. Mgr. Kateřina Dlouhá. Student a konkurenceschopnost
 www.projektsako.cz CHEMIE Pracovní list č. 4 - žákovská verze Téma: Tepelné zabarvení chemických reakcí Lektor: Projekt: Reg. číslo: Mgr. Kateřina Dlouhá Student a konkurenceschopnost CZ.1.07/1.1.07/03.0075
www.projektsako.cz CHEMIE Pracovní list č. 4 - žákovská verze Téma: Tepelné zabarvení chemických reakcí Lektor: Projekt: Reg. číslo: Mgr. Kateřina Dlouhá Student a konkurenceschopnost CZ.1.07/1.1.07/03.0075
Fyzikální chemie. ochrana životního prostředí analytická chemie chemická technologie denní. Platnost: od 1. 9. 2009 do 31. 8. 2013
 Učební osnova předmětu Fyzikální chemie Studijní obor: Aplikovaná chemie Zaměření: Forma vzdělávání: Celkový počet vyučovacích hodin za studium: Analytická chemie Chemická technologie Ochrana životního
Učební osnova předmětu Fyzikální chemie Studijní obor: Aplikovaná chemie Zaměření: Forma vzdělávání: Celkový počet vyučovacích hodin za studium: Analytická chemie Chemická technologie Ochrana životního
Chemická kinetika. Reakce 1. řádu rychlost přímo úměrná koncentraci složky
 Chemická kinetika Chemická kinetika Reakce 0. řádu reakční rychlost nezávisí na čase a probíhá konstantní rychlostí v = k (rychlost se rovná rychlostní konstantě) velmi pomalé reakce (prakticky se nemění
Chemická kinetika Chemická kinetika Reakce 0. řádu reakční rychlost nezávisí na čase a probíhá konstantní rychlostí v = k (rychlost se rovná rychlostní konstantě) velmi pomalé reakce (prakticky se nemění
Termodynamické zákony
 Termodynamické zákony Makroskopická práce termodynamické soustavy Již jsme uvedli, že změna vnitřní energie soustavy je obecně vyvolána dvěma ději: tepelnou výměnou mezi soustavou a okolím a konáním práce
Termodynamické zákony Makroskopická práce termodynamické soustavy Již jsme uvedli, že změna vnitřní energie soustavy je obecně vyvolána dvěma ději: tepelnou výměnou mezi soustavou a okolím a konáním práce
FYZIKÁLNÍ CHEMIE I: 2. ČÁST
 Univerzita J. E. Purkyně v Ústí nad Labem Přírodovědecká fakulta FYZIKÁLNÍ CHEMIE I: 2. ČÁST KCH/P401 Ivo Nezbeda Ústí nad Labem 2013 1 Obor: Klíčová slova: Anotace: Toxikologie a analýza škodlivin, Chemie
Univerzita J. E. Purkyně v Ústí nad Labem Přírodovědecká fakulta FYZIKÁLNÍ CHEMIE I: 2. ČÁST KCH/P401 Ivo Nezbeda Ústí nad Labem 2013 1 Obor: Klíčová slova: Anotace: Toxikologie a analýza škodlivin, Chemie
Do známky zkoušky rovnocenným podílem započítávají získané body ze zápočtového testu.
 Podmínky pro získání zápočtu a zkoušky z předmětu Chemicko-inženýrská termodynamika pro zpracování ropy Zápočet je udělen, pokud student splní zápočtový test alespoň na 50 %. Zápočtový test obsahuje 3
Podmínky pro získání zápočtu a zkoušky z předmětu Chemicko-inženýrská termodynamika pro zpracování ropy Zápočet je udělen, pokud student splní zápočtový test alespoň na 50 %. Zápočtový test obsahuje 3
Magnetokalorický jev MCE
 Magnetokalorický jev a jeho aplikační potenciál P. Svoboda Katedra fyziky kondenzovaných látek Magnetokalorický jev MCE MCE: znám déle než 120 let renesance zájmu během posledních 35 let PROČ? Připomínka
Magnetokalorický jev a jeho aplikační potenciál P. Svoboda Katedra fyziky kondenzovaných látek Magnetokalorický jev MCE MCE: znám déle než 120 let renesance zájmu během posledních 35 let PROČ? Připomínka
Stanislav Labík. Ústav fyzikální chemie V CHT Praha budova A, 3. patro u zadního vchodu, místnost
 Stanislav Labík Ústav fyzikální chemie V CHT Praha budova A, 3. patro u zadního vchodu, místnost 325 labik@vscht.cz 220 444 257 http://www.vscht.cz/fch/ Výuka Letní semestr N403032 Základy fyzikální chemie
Stanislav Labík Ústav fyzikální chemie V CHT Praha budova A, 3. patro u zadního vchodu, místnost 325 labik@vscht.cz 220 444 257 http://www.vscht.cz/fch/ Výuka Letní semestr N403032 Základy fyzikální chemie
Plyn. 11 plynných prvků. Vzácné plyny He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2
 Plyny Plyn T v, K 11 plynných prvků Vzácné plyny He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2 H 2 20 He 4.4 Ne 27 Ar 87 Kr 120 Xe 165 Rn 211 N 2 77 O 2 90 F 2 85 Cl 2 238 1 Plyn
Plyny Plyn T v, K 11 plynných prvků Vzácné plyny He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2 H 2 20 He 4.4 Ne 27 Ar 87 Kr 120 Xe 165 Rn 211 N 2 77 O 2 90 F 2 85 Cl 2 238 1 Plyn
VZOROVÝ ZKOUŠKOVÝ TEST z fyzikální chemie( 1
 VZOROVÝ ZKOUŠKOVÝ TEST z fyzikální chemie(www.vscht.cz/fch/zktesty/) 1 Zkouškový test z FCH I, 10. srpna 2015 Vyplňuje student: Příjmení a jméno: Kroužek: Upozornění: U úloh označených ikonou uveďte výpočet
VZOROVÝ ZKOUŠKOVÝ TEST z fyzikální chemie(www.vscht.cz/fch/zktesty/) 1 Zkouškový test z FCH I, 10. srpna 2015 Vyplňuje student: Příjmení a jméno: Kroužek: Upozornění: U úloh označených ikonou uveďte výpočet
Termochemie. Verze VG
 Termochemie Verze VG Termochemie Termochemie je oblast termodynamiky zabývající se studiem tepelného zabarvení chemických reakcí. Reakce, při kterých se teplo uvolňuje = exotermní. Reakce, při kterých
Termochemie Verze VG Termochemie Termochemie je oblast termodynamiky zabývající se studiem tepelného zabarvení chemických reakcí. Reakce, při kterých se teplo uvolňuje = exotermní. Reakce, při kterých
Molekulová fyzika a termika. Přehled základních pojmů
 Molekulová fyzika a termika Přehled základních pojmů Kinetická teorie látek Vychází ze tří experimentálně ověřených poznatků: 1) Látky se skládají z částic - molekul, atomů nebo iontů, mezi nimiž jsou
Molekulová fyzika a termika Přehled základních pojmů Kinetická teorie látek Vychází ze tří experimentálně ověřených poznatků: 1) Látky se skládají z částic - molekul, atomů nebo iontů, mezi nimiž jsou
PLYNNÉ LÁTKY. Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník
 PLYNNÉ LÁTKY Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník Ideální plyn Po molekulách ideálního plynu požadujeme: 1.Rozměry molekul ideálního plynu jsou ve srovnání se střední vzdáleností molekul
PLYNNÉ LÁTKY Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník Ideální plyn Po molekulách ideálního plynu požadujeme: 1.Rozměry molekul ideálního plynu jsou ve srovnání se střední vzdáleností molekul
Plyn. 11 plynných prvků. Vzácné plyny. He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2
 Plyny Plyn T v, K Vzácné plyny 11 plynných prvků He, Ne, Ar, Kr, Xe, Rn 165 Rn 211 N 2 O 2 77 F 2 90 85 Diatomické plynné prvky Cl 2 238 H 2, N 2, O 2, F 2, Cl 2 H 2 He Ne Ar Kr Xe 20 4.4 27 87 120 1 Plyn
Plyny Plyn T v, K Vzácné plyny 11 plynných prvků He, Ne, Ar, Kr, Xe, Rn 165 Rn 211 N 2 O 2 77 F 2 90 85 Diatomické plynné prvky Cl 2 238 H 2, N 2, O 2, F 2, Cl 2 H 2 He Ne Ar Kr Xe 20 4.4 27 87 120 1 Plyn
Fyzikální chemie Úvod do studia, základní pojmy
 Fyzikální chemie Úvod do studia, základní pojmy HMOTA A JEJÍ VLASTNOSTI POSTAVENÍ FYZIKÁLNÍ CHEMIE V PŘÍRODNÍCH VĚDÁCH HISTORIE FYZIKÁLNÍ CHEMIE ZÁKLADNÍ POJMY DEFINICE FORMY HMOTY Formy a nositelé hmoty
Fyzikální chemie Úvod do studia, základní pojmy HMOTA A JEJÍ VLASTNOSTI POSTAVENÍ FYZIKÁLNÍ CHEMIE V PŘÍRODNÍCH VĚDÁCH HISTORIE FYZIKÁLNÍ CHEMIE ZÁKLADNÍ POJMY DEFINICE FORMY HMOTY Formy a nositelé hmoty
N A = 6,023 10 23 mol -1
 Pro vyjadřování množství látky se v chemii zavádí veličina látkové množství. Značí se n, jednotkou je 1 mol. Látkové množství je jednou ze základních veličin soustavy SI. Jeden mol je takové množství látky,
Pro vyjadřování množství látky se v chemii zavádí veličina látkové množství. Značí se n, jednotkou je 1 mol. Látkové množství je jednou ze základních veličin soustavy SI. Jeden mol je takové množství látky,
metoda je základem fenomenologické vědy termodynamiky, statistická metoda je základem kinetické teorie plynů, na níž si princip této metody ukážeme.
 Přednáška 1 Úvod Při studiu tepelných vlastností látek a jevů probíhajících při tepelné výměně budeme používat dvě různé metody zkoumání: termodynamickou a statistickou. Termodynamická metoda je základem
Přednáška 1 Úvod Při studiu tepelných vlastností látek a jevů probíhajících při tepelné výměně budeme používat dvě různé metody zkoumání: termodynamickou a statistickou. Termodynamická metoda je základem
Termodynamika 2. UJOP Hostivař 2014
 Termodynamika 2 UJOP Hostivař 2014 Skupenské teplo tání/tuhnutí je (celkové) teplo, které přijme pevná látka při přechodu na kapalinu během tání nebo naopak Značka Veličina Lt J Nedochází při něm ke změně
Termodynamika 2 UJOP Hostivař 2014 Skupenské teplo tání/tuhnutí je (celkové) teplo, které přijme pevná látka při přechodu na kapalinu během tání nebo naopak Značka Veličina Lt J Nedochází při něm ke změně
Energie, její formy a měření
 Energie, její formy a měření aneb Od volného pádu k E=mc 2 Přednášející: Martin Zápotocký Seminář Aplikace lékařské biofyziky 2014/5 Definice energie Energos (ἐνεργός) = pracující, aktivní; ergon = práce
Energie, její formy a měření aneb Od volného pádu k E=mc 2 Přednášející: Martin Zápotocký Seminář Aplikace lékařské biofyziky 2014/5 Definice energie Energos (ἐνεργός) = pracující, aktivní; ergon = práce
= 2,5R 1,5R =1,667 T 2 =T 1. W =c vm W = ,5R =400,23K. V 1 =p 2. p 1 V 2. =p 2 R T. p 2 p 1 1 T 1 =p 2 1 T 2. =p 1 T 1,667 = ,23
 15-17 Jeden mol argonu, o kterém budeme předpokládat, že se chová jako ideální plyn, byl adiabaticky vratně stlačen z tlaku 100 kpa na tlak p 2. Počáteční teplota byla = 300 K. Kompresní práce činila W
15-17 Jeden mol argonu, o kterém budeme předpokládat, že se chová jako ideální plyn, byl adiabaticky vratně stlačen z tlaku 100 kpa na tlak p 2. Počáteční teplota byla = 300 K. Kompresní práce činila W
Přednášky z lékařské biofyziky Biofyzikální ústav Lékařské fakulty Masarykovy univerzity, Brno
 Přednášky z lékařské biofyziky Biofyzikální ústav Lékařské fakulty Masarykovy univerzity, Brno JAMES WATT 19.1.1736-19.8.1819 Termodynamika principy, které vládnou přírodě Obsah přednášky Vysvětlení základních
Přednášky z lékařské biofyziky Biofyzikální ústav Lékařské fakulty Masarykovy univerzity, Brno JAMES WATT 19.1.1736-19.8.1819 Termodynamika principy, které vládnou přírodě Obsah přednášky Vysvětlení základních
Základem molekulové fyziky je kinetická teorie látek. Vychází ze tří pouček:
 Molekulová fyzika zkoumá vlastnosti látek na základě jejich vnitřní struktury, pohybu a vzájemného působení částic, ze kterých se látky skládají. Termodynamika se zabývá zákony přeměny různých forem energie
Molekulová fyzika zkoumá vlastnosti látek na základě jejich vnitřní struktury, pohybu a vzájemného působení částic, ze kterých se látky skládají. Termodynamika se zabývá zákony přeměny různých forem energie
Termochemie { práce. Práce: W = s F nebo W = F ds. Objemová práce (p vn = vnìj¹í tlak): W = p vn dv. Vratný dìj: p = p vn (ze stavové rovnice) W =
 Termochemie { práce Práce: W = s F nebo W = Objemová práce (p vn = vnìj¹í tlak): W = V2 V 1 p vn dv s2 Vratný dìj: p = p vn (ze stavové rovnice) W = V2 V 1 p dv s 1 F ds s.1 Diferenciální tvar: dw = pdv
Termochemie { práce Práce: W = s F nebo W = Objemová práce (p vn = vnìj¹í tlak): W = V2 V 1 p vn dv s2 Vratný dìj: p = p vn (ze stavové rovnice) W = V2 V 1 p dv s 1 F ds s.1 Diferenciální tvar: dw = pdv
PRŮMYSLOVÉ TECHNOLOGIE I - SOUBOR OTÁZEK KE ZKOUŠCE
 PRŮMYSLOVÉ TECHNOLOGIE I - SOUBOR OTÁZEK KE ZKOUŠCE 1. PRVKY 5. SKUPINY (N,P,As,Sb,Bi) obecné zákonitosti ve skupině DUSÍK Výskyt, chemické vlastnosti molekulární dusík Amoniak vlastnosti, příprava, hydrolýza,
PRŮMYSLOVÉ TECHNOLOGIE I - SOUBOR OTÁZEK KE ZKOUŠCE 1. PRVKY 5. SKUPINY (N,P,As,Sb,Bi) obecné zákonitosti ve skupině DUSÍK Výskyt, chemické vlastnosti molekulární dusík Amoniak vlastnosti, příprava, hydrolýza,
Poznámky k cvičením z termomechaniky Cvičení 3.
 Vnitřní energie U Vnitřní energie U je stavová veličina U = U (p, V, T), ale závisí pouze na teplotě (experiment Gay-Lussac / Joule) U = f(t) Pro měrnou vnitřní energii (tedy pro vnitřní energii jednoho
Vnitřní energie U Vnitřní energie U je stavová veličina U = U (p, V, T), ale závisí pouze na teplotě (experiment Gay-Lussac / Joule) U = f(t) Pro měrnou vnitřní energii (tedy pro vnitřní energii jednoho
Rovnováha Tepelná - T všude stejná
 Fázové heterogenní rovnováhy Fáze = homogenní část soustavy, oddělná fyzickým rozhraním, na rozhraní se vlastnosti mění skokem Rovnováha Tepelná - T všude stejná Mechanická - p všude stejný Chemická -
Fázové heterogenní rovnováhy Fáze = homogenní část soustavy, oddělná fyzickým rozhraním, na rozhraní se vlastnosti mění skokem Rovnováha Tepelná - T všude stejná Mechanická - p všude stejný Chemická -
Teplota jedna ze základních jednotek soustavy SI, vyjadřována je v Kelvinech (značka K) další používané stupnice: Celsiova, Fahrenheitova
 1 Rozložení, distribuce tepla Teplota je charakteristika tepelného stavu hmoty je to stavová veličina, charakterizující termodynamickou rovnováhu systému. Teplo vyjadřuje kinetickou energii částic. Teplota
1 Rozložení, distribuce tepla Teplota je charakteristika tepelného stavu hmoty je to stavová veličina, charakterizující termodynamickou rovnováhu systému. Teplo vyjadřuje kinetickou energii částic. Teplota
Termodynamika. Děj, který není kvazistatický, se nazývá nestatický.
 Termodynamika Zabývá se ději, při nichž se mění tepelná energie v jiné druhy energie (zejména mechanické). Studuje vlastnosti látek bez přihlédnutí k jejich mikrostruktuře. Je vystavěna na axiomech (0.,
Termodynamika Zabývá se ději, při nichž se mění tepelná energie v jiné druhy energie (zejména mechanické). Studuje vlastnosti látek bez přihlédnutí k jejich mikrostruktuře. Je vystavěna na axiomech (0.,
Otázky ke zkoušce z obecné chemie (Prof. RNDr. Karel Procházka, DrSc.)
 Otázky ke zkoušce z obecné chemie (Prof. RNDr. Karel Procházka, DrSc.) Na ústní zkoušku se může přihlásit student, který má zápočet ze cvičení a úspěšně složenou zkouškovou písemku. Na ústní zkoušku se
Otázky ke zkoušce z obecné chemie (Prof. RNDr. Karel Procházka, DrSc.) Na ústní zkoušku se může přihlásit student, který má zápočet ze cvičení a úspěšně složenou zkouškovou písemku. Na ústní zkoušku se
IDEÁLNÍ PLYN. Stavová rovnice
 IDEÁLNÍ PLYN Stavová rovnice Ideální plyn ) rozměry molekul jsou zanedbatelné vzhledem k jejich vzdálenostem 2) molekuly plynu na sebe působí jen při vzájemných srážkách 3) všechny srážky jsou dokonale
IDEÁLNÍ PLYN Stavová rovnice Ideální plyn ) rozměry molekul jsou zanedbatelné vzhledem k jejich vzdálenostem 2) molekuly plynu na sebe působí jen při vzájemných srážkách 3) všechny srážky jsou dokonale
Obsah Chemická reakce... 2 PL:
 Obsah Chemická reakce... 2 PL: Vyčíslení chemické rovnice - řešení... 3 Tepelný průběh chemické reakce... 4 Rychlost chemických reakcí... 4 Rozdělení chemických reakcí... 4 1 Chemická reakce děj, při němž
Obsah Chemická reakce... 2 PL: Vyčíslení chemické rovnice - řešení... 3 Tepelný průběh chemické reakce... 4 Rychlost chemických reakcí... 4 Rozdělení chemických reakcí... 4 1 Chemická reakce děj, při němž
Aplikovaná fyzikální chemie. Magda Škvorová KFCH CN463 tel. 3302
 Aplikovaná fyzikální chemie Aplikovaná fyzikální chemie Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302 1. září 2014 Aplikovaná fyzikální chemie Bylo nebylo... Bylo nebylo... Nejvzácnějšímu
Aplikovaná fyzikální chemie Aplikovaná fyzikální chemie Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302 1. září 2014 Aplikovaná fyzikální chemie Bylo nebylo... Bylo nebylo... Nejvzácnějšímu
bak-06=1/1 http://www.vscht.cz/fch/cz/pomucky/kolafa/n403011p.html
 bak-06=1/1 pst=101325 = 1.013e+05 Pa R=8.314 = 8.314JK 1 mol 1 Gibbsovo fázové pravidlo v = k f + 2 C počet stupnů volnosti počet složek počet fází počet vazných podmínek 1. Gibbsovo fázové pravidlo Určete
bak-06=1/1 pst=101325 = 1.013e+05 Pa R=8.314 = 8.314JK 1 mol 1 Gibbsovo fázové pravidlo v = k f + 2 C počet stupnů volnosti počet složek počet fází počet vazných podmínek 1. Gibbsovo fázové pravidlo Určete
Termomechanika 4. přednáška
 ermomechanika 4. přednáška Miroslav Holeček Upozornění: ato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím citovaných zdrojů
ermomechanika 4. přednáška Miroslav Holeček Upozornění: ato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím citovaných zdrojů
MAGISTERSKÝ VÝBĚR úloh ze sbírek
 MAGISTERSKÝ VÝBĚR úloh ze sbírek Příklady a úlohy z fyzikální chemie I a II (VŠCHT Praha 2000 a VŠCHT Praha 2002) (http://www.vscht.cz/fch/cz/pomucky/sbfchold.html) k nimž je doplněno zanedbatelné množství
MAGISTERSKÝ VÝBĚR úloh ze sbírek Příklady a úlohy z fyzikální chemie I a II (VŠCHT Praha 2000 a VŠCHT Praha 2002) (http://www.vscht.cz/fch/cz/pomucky/sbfchold.html) k nimž je doplněno zanedbatelné množství
Termomechanika 6. přednáška Doc. Dr. RNDr. Miroslav Holeček
 Termomechanika 6. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Termomechanika 6. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
VYBRANÉ STATĚ Z PROCESNÍHO INŢENÝRSTVÍ cvičení 12
 UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY VYBRANÉ STATĚ Z PROCESNÍHO INŢENÝRSTVÍ cvičení 2 Termodynamika reálných plynů část 2 Hana Charvátová, Dagmar Janáčová Zlín 203 Tento studijní
UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY VYBRANÉ STATĚ Z PROCESNÍHO INŢENÝRSTVÍ cvičení 2 Termodynamika reálných plynů část 2 Hana Charvátová, Dagmar Janáčová Zlín 203 Tento studijní
Tepelné reakce podle tepelné bilance
 1Termochemie a výpočet reakčního tepla termochemie reakční teplo H termochemické rovnice termochemické zákony výpočet reakčního tepla z disociač ních energií vazeb, z termochemických rovnic, ze standartních
1Termochemie a výpočet reakčního tepla termochemie reakční teplo H termochemické rovnice termochemické zákony výpočet reakčního tepla z disociač ních energií vazeb, z termochemických rovnic, ze standartních
1. Termochemie - příklady 1. ročník
 1. Termochemie - příklady 1. ročník 1.1. Urči reakční teplo reakce: C (g) + 1/2 O 2 (g) -> CO (g), ΔH 1 =?, známe-li C (g) + O 2 (g) -> CO 2 (g) ΔH 2 = -393,7 kj/mol CO (g) + 1/2 O 2 -> CO 2 (g) ΔH 3 =
1. Termochemie - příklady 1. ročník 1.1. Urči reakční teplo reakce: C (g) + 1/2 O 2 (g) -> CO (g), ΔH 1 =?, známe-li C (g) + O 2 (g) -> CO 2 (g) ΔH 2 = -393,7 kj/mol CO (g) + 1/2 O 2 -> CO 2 (g) ΔH 3 =
FYZIKÁLNÍ CHEMIE I: 1. ČÁST KCH/P401
 Univerzita J. E. Purkyně v Ústí nad Labem Přírodovědecká fakulta FYZIKÁLNÍ CHEMIE I: 1. ČÁST KCH/P401 Magda Škvorová Ústí nad Labem 2013 Obor: Toxikologie a analýza škodlivin, Chemie (dvouoborová) Klíčová
Univerzita J. E. Purkyně v Ústí nad Labem Přírodovědecká fakulta FYZIKÁLNÍ CHEMIE I: 1. ČÁST KCH/P401 Magda Škvorová Ústí nad Labem 2013 Obor: Toxikologie a analýza škodlivin, Chemie (dvouoborová) Klíčová
Termodynamika (td.) se obecně zabývá vzájemnými vztahy a přeměnami různých druhů
 Termodynamika (td.) se obecně zabývá vzájemnými vztahy a přeměnami různých druhů energií (mechanické, tepelné, elektrické, magnetické, chemické a jaderné) při td. dějích. Na rozdíl od td. cyklických dějů
Termodynamika (td.) se obecně zabývá vzájemnými vztahy a přeměnami různých druhů energií (mechanické, tepelné, elektrické, magnetické, chemické a jaderné) při td. dějích. Na rozdíl od td. cyklických dějů
Molekulová fyzika a termodynamika
 Molekulová fyzika a termodynamika Molekulová fyzika a termodynamika Úvod, vnitřní energie soustavy, teplo, teplota, stavová rovnice ideálního plynu Termodynamické zákony, termodynamické děje Teplotní a
Molekulová fyzika a termodynamika Molekulová fyzika a termodynamika Úvod, vnitřní energie soustavy, teplo, teplota, stavová rovnice ideálního plynu Termodynamické zákony, termodynamické děje Teplotní a
Kolik energie by se uvolnilo, kdyby spalování ethanolu probíhalo při teplotě o 20 vyšší? Je tato energie menší nebo větší než při teplotě 37 C?
 TERMOCHEMIE Reakční entalpie při izotermním průběhu reakce, rozsah reakce 1 Kolik tepla se uvolní (nebo spotřebuje) při výrobě 2,2 kg acetaldehydu C 2 H 5 OH(g) = CH 3 CHO(g) + H 2 (g) (a) při teplotě
TERMOCHEMIE Reakční entalpie při izotermním průběhu reakce, rozsah reakce 1 Kolik tepla se uvolní (nebo spotřebuje) při výrobě 2,2 kg acetaldehydu C 2 H 5 OH(g) = CH 3 CHO(g) + H 2 (g) (a) při teplotě
Složení soustav (roztoky, koncentrace látkového množství)
 VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
Opakování: Standardní stav þ ÿ
 Opakování: Standardní stav þ ÿ s.1 12. øíjna 215 Standardní stav þ ÿ = èistá slo¾ka ve stavu ideálního plynu za teploty soustavy T a standardního tlaku = 1 kpa, døíve 11,325 kpa. Èistá látka: Pøibli¾nì:
Opakování: Standardní stav þ ÿ s.1 12. øíjna 215 Standardní stav þ ÿ = èistá slo¾ka ve stavu ideálního plynu za teploty soustavy T a standardního tlaku = 1 kpa, døíve 11,325 kpa. Èistá látka: Pøibli¾nì:
DOUČOVÁNÍ KVINTA CHEMIE
 1. ÚVOD DO STUDIA CHEMIE 1) Co studuje chemie? 2) Rozděl chemii na tři důležité obory. DOUČOVÁNÍ KVINTA CHEMIE 2. NÁZVOSLOVÍ ANORGANICKÝCH SLOUČENIN 1) Pojmenuj: BaO, N 2 0, P 4 O 10, H 2 SO 4, HMnO 4,
1. ÚVOD DO STUDIA CHEMIE 1) Co studuje chemie? 2) Rozděl chemii na tři důležité obory. DOUČOVÁNÍ KVINTA CHEMIE 2. NÁZVOSLOVÍ ANORGANICKÝCH SLOUČENIN 1) Pojmenuj: BaO, N 2 0, P 4 O 10, H 2 SO 4, HMnO 4,
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie 1. ročník a kvinta 2 hodiny týdně Školní tabule, interaktivní tabule, tyčinkové a kalotové modely molekul, zpětný projektor, transparenty,
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie 1. ročník a kvinta 2 hodiny týdně Školní tabule, interaktivní tabule, tyčinkové a kalotové modely molekul, zpětný projektor, transparenty,
Klasická termodynamika (aneb pøehled FCH I)
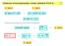 Klasická termodynamika (aneb pøehled FCH I) 1/16 0. zákon 1. zákon id. plyn: pv = nrt pv κ = konst (id., ad.) id. plyn: U = U(T) }{{} Carnotùv cyklus dq T = 0 2. zákon rg, K,... lim S = 0 T 0 S, ds = dq
Klasická termodynamika (aneb pøehled FCH I) 1/16 0. zákon 1. zákon id. plyn: pv = nrt pv κ = konst (id., ad.) id. plyn: U = U(T) }{{} Carnotùv cyklus dq T = 0 2. zákon rg, K,... lim S = 0 T 0 S, ds = dq
Energie v chemických reakcích
 Energie v chemických reakcích Energetická bilance reakce CH 4 + Cl 2 = CH 3 Cl + HCl rozštěpení vazeb vznik nových vazeb V chemických reakcích dochází ke změně vazeb mezi atomy. Vazebná energie uvolnění
Energie v chemických reakcích Energetická bilance reakce CH 4 + Cl 2 = CH 3 Cl + HCl rozštěpení vazeb vznik nových vazeb V chemických reakcích dochází ke změně vazeb mezi atomy. Vazebná energie uvolnění
Digitální učební materiál. III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Příjemce podpory Gymnázium, Jevíčko, A. K.
 Digitální učební materiál Číslo projektu CZ.1.07/1.5.00/34.0802 Název projektu Zkvalitnění výuky prostřednictvím ICT Číslo a název šablony klíčové aktivity III/2 Inovace a zkvalitnění výuky prostřednictvím
Digitální učební materiál Číslo projektu CZ.1.07/1.5.00/34.0802 Název projektu Zkvalitnění výuky prostřednictvím ICT Číslo a název šablony klíčové aktivity III/2 Inovace a zkvalitnění výuky prostřednictvím
Teplo, práce a 1. věta termodynamiky
 eplo, práce a. věta termodynamiky eplo ( tepelná energie) Nyní již víme, že látka (plyn) s vyšší teplotou obsahuje částice (molekuly), které se pohybují s vyššími rychlostmi a můžeme posoudit, co se stane
eplo, práce a. věta termodynamiky eplo ( tepelná energie) Nyní již víme, že látka (plyn) s vyšší teplotou obsahuje částice (molekuly), které se pohybují s vyššími rychlostmi a můžeme posoudit, co se stane
Thermos teplo Dynamic změna
 Termodynamika Plán přednášky: Předmět studia Základní pojmy Termodynamické zákony předmět studia Co je to termodynamika? Soubor matematických modelů a představ, které nám umožňují popsat jakým způsobem
Termodynamika Plán přednášky: Předmět studia Základní pojmy Termodynamické zákony předmět studia Co je to termodynamika? Soubor matematických modelů a představ, které nám umožňují popsat jakým způsobem
Trocha termodynamiky ještě nikdy nikoho nezabila (s pravděpodobností
 Trocha termodynamiky ještě nikdy nikoho nezabila (s pravděpodobností 95 %) Studium tohoto podpůrného textu není k vyřešení úlohy B3 potřeba, slouží spíše k obohacení vašich znalostí o rovnovážných dějích,
Trocha termodynamiky ještě nikdy nikoho nezabila (s pravděpodobností 95 %) Studium tohoto podpůrného textu není k vyřešení úlohy B3 potřeba, slouží spíše k obohacení vašich znalostí o rovnovážných dějích,
Katalýza / inhibice. Katalýza. Katalyzátory. Inhibitory. katalyzátor: Faktory ovlivňující rychlost chemické reakce. Homogenní
 Katalýza Katalýza / inhibice Homogenní acidobazická (katalyzátor: H + nebo OH - ) autokatalýza (katalyzátor: produkt reakce) selektivní (katalyzátor: enzym) Ovlivnění rychlosti chemické reakce pomocí katalyzátoru
Katalýza Katalýza / inhibice Homogenní acidobazická (katalyzátor: H + nebo OH - ) autokatalýza (katalyzátor: produkt reakce) selektivní (katalyzátor: enzym) Ovlivnění rychlosti chemické reakce pomocí katalyzátoru
Model dokonalého spalování pevných a kapalných paliv Teoretické základy spalování. Teoretické základy spalování
 Spalování je fyzikálně chemický pochod, při kterém probíhá organizovaná příprava hořlavé směsi paliva s okysličovadlem a jejich slučování (hoření) za intenzivního uvolňování tepla, což způsobuje prudké
Spalování je fyzikálně chemický pochod, při kterém probíhá organizovaná příprava hořlavé směsi paliva s okysličovadlem a jejich slučování (hoření) za intenzivního uvolňování tepla, což způsobuje prudké
Fáze a fázové přechody
 Kvantová a statistická fyzika 2 (Termodynamika a statistická fyzika) Fáze a fázové přechody Pojem fáze je zobecněním pojmu skupenství, označuje homogenní část makroskopického tělesa. Jednotlivé fáze v
Kvantová a statistická fyzika 2 (Termodynamika a statistická fyzika) Fáze a fázové přechody Pojem fáze je zobecněním pojmu skupenství, označuje homogenní část makroskopického tělesa. Jednotlivé fáze v
Termodynamické zákony
 ermoynamické zákony. termoynamický zákon (zákon zachování energie) (W je práce vykonaná na systém) teplo Q oané systému plus vynaložená práce W zvyšují vnitřní energii systému U (W je práce vykonaná systémem)
ermoynamické zákony. termoynamický zákon (zákon zachování energie) (W je práce vykonaná na systém) teplo Q oané systému plus vynaložená práce W zvyšují vnitřní energii systému U (W je práce vykonaná systémem)
Inovace bakalářského studijního oboru Aplikovaná chemie CZ.1.07/2.2.00/ Výpočty z chemických vzorců
 Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
III. STRUKTURA A VLASTNOSTI PLYNŮ
 III. STRUKTURA A VLASTNOSTI PLYNŮ 3.1 Ideální plyn a) ideální plyn model, předpoklady: 1. rozměry molekul malé (ve srovnání se střední vzdáleností molekul). molekuly na sebe navzálem silově nepůsobí (mimo
III. STRUKTURA A VLASTNOSTI PLYNŮ 3.1 Ideální plyn a) ideální plyn model, předpoklady: 1. rozměry molekul malé (ve srovnání se střední vzdáleností molekul). molekuly na sebe navzálem silově nepůsobí (mimo
T0 Teplo a jeho měření
 Teplo a jeho měření 1 Teplo 2 Kalorimetrie Kalorimetr 3 Tepelná kapacita 3.1 Měrná tepelná kapacita Měrná tepelná kapacita při stálém objemu a stálém tlaku Poměr měrných tepelných kapacit 3.2 Molární tepelná
Teplo a jeho měření 1 Teplo 2 Kalorimetrie Kalorimetr 3 Tepelná kapacita 3.1 Měrná tepelná kapacita Měrná tepelná kapacita při stálém objemu a stálém tlaku Poměr měrných tepelných kapacit 3.2 Molární tepelná
Hmotnost atomů a molekul 6 Látkové množství 11. Rozdělení směsí 16 Separační metody 20. Hustota, hmotnostní a objemový zlomek 25.
 Obsah Obecná chemie II. 1. Látkové množství Hmotnost atomů a molekul 6 Látkové množství 11 2. Směsi Rozdělení směsí 16 Separační metody 20 3. Chemické výpočty Hustota, hmotnostní a objemový zlomek 25 Koncentrace
Obsah Obecná chemie II. 1. Látkové množství Hmotnost atomů a molekul 6 Látkové množství 11 2. Směsi Rozdělení směsí 16 Separační metody 20 3. Chemické výpočty Hustota, hmotnostní a objemový zlomek 25 Koncentrace
Teplota a její měření
 Teplota a její měření Teplota a její měření Číslo DUM v digitálním archivu školy VY_32_INOVACE_07_03_01 Teplota, Celsiova a Kelvinova teplotní stupnice, převodní vztahy, příklady. Tepelná výměna, měrná
Teplota a její měření Teplota a její měření Číslo DUM v digitálním archivu školy VY_32_INOVACE_07_03_01 Teplota, Celsiova a Kelvinova teplotní stupnice, převodní vztahy, příklady. Tepelná výměna, měrná
Kapitoly z fyzikální chemie KFC/KFCH. I. Základní pojmy FCH a kinetická teorie plynů
 Kapitoly z fyzikální chemie KFC/KFCH I. Základní pojmy FCH a kinetická teorie plynů RNDr. Karel Berka, Ph.D. Univerzita Palackého v Olomouci Zkouška a doporučená literatura Ústní kolokvium Doporučená literatura
Kapitoly z fyzikální chemie KFC/KFCH I. Základní pojmy FCH a kinetická teorie plynů RNDr. Karel Berka, Ph.D. Univerzita Palackého v Olomouci Zkouška a doporučená literatura Ústní kolokvium Doporučená literatura
Ideální plyn. Stavová rovnice Děje v ideálním plynu Práce plynu, Kruhový děj, Tepelné motory
 Struktura a vlastnosti plynů Ideální plyn Vlastnosti ideálního plynu: Ideální plyn Stavová rovnice Děje v ideálním plynu Práce plynu, Kruhový děj, epelné motory rozměry molekul jsou ve srovnání se střední
Struktura a vlastnosti plynů Ideální plyn Vlastnosti ideálního plynu: Ideální plyn Stavová rovnice Děje v ideálním plynu Práce plynu, Kruhový děj, epelné motory rozměry molekul jsou ve srovnání se střední
Fázové heterogenní rovnováhy Fáze = homogenní část soustavy, oddělná fyzickým rozhraním, na rozhraní se vlastnosti mění skokem
 Fázové heterogenní rovnováhy Fáze = homogenní část soustavy, oddělná fyzickým rozhraním, na rozhraní se vlastnosti mění skokem Rovnováha Tepelná - T všude stejná Mechanická - p všude stejný Chemická -
Fázové heterogenní rovnováhy Fáze = homogenní část soustavy, oddělná fyzickým rozhraním, na rozhraní se vlastnosti mění skokem Rovnováha Tepelná - T všude stejná Mechanická - p všude stejný Chemická -
Teorie transportu plynů a par polymerními membránami. Doc. Ing. Milan Šípek, CSc. Ústav fyzikální chemie VŠCHT Praha
 Teorie transportu plynů a par polymerními membránami Doc. Ing. Milan Šípek, CSc. Ústav fyzikální chemie VŠCHT Praha Úvod Teorie transportu Difuze v polymerních membránách Propustnost polymerních membrán
Teorie transportu plynů a par polymerními membránami Doc. Ing. Milan Šípek, CSc. Ústav fyzikální chemie VŠCHT Praha Úvod Teorie transportu Difuze v polymerních membránách Propustnost polymerních membrán
C5250 Chemie životního prostředí II definice pojmů
 C5250 Chemie životního prostředí II definice pojmů Na základě materiálů Ivana Holoubka a Josefa Zemana zpracoval Jiří Kalina. Ekotoxikologie věda studující vlivy chemických, fyzikálních a biologických
C5250 Chemie životního prostředí II definice pojmů Na základě materiálů Ivana Holoubka a Josefa Zemana zpracoval Jiří Kalina. Ekotoxikologie věda studující vlivy chemických, fyzikálních a biologických
Hydrochemie koncentrace látek (výpočty)
 Atomová hmotnostní konstanta/jednotka m u Relativní atomová hmotnost Relativní molekulová hmotnost Látkové množství (mol) mol je takové množství látky, které obsahuje tolik částic, kolik je atomů ve 2
Atomová hmotnostní konstanta/jednotka m u Relativní atomová hmotnost Relativní molekulová hmotnost Látkové množství (mol) mol je takové množství látky, které obsahuje tolik částic, kolik je atomů ve 2
Termomechanika. Doc. Dr. RNDr. Miroslav HOLEČEK
 ermomechanika. přednáška Doc. Dr. RNDr. Miroslav HOLEČEK Upozornění: ato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím citovaných
ermomechanika. přednáška Doc. Dr. RNDr. Miroslav HOLEČEK Upozornění: ato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím citovaných
