Termodynamika a živé systémy. Helena Uhrová
|
|
|
- Karolína Musilová
- před 8 lety
- Počet zobrazení:
Transkript
1 Termodynamika a živé systémy Helena Uhrová
2 Základní pojmy termodynamiky soustava izolovaná otevřená okolí vlastnosti soustavy znaky popisující soustavu stav rovnováhy tok m či E =0 funkce stavu - soubor vlastností vystihujících podmínky za nichž je soustava v rovnováze rovnováha systému stabilní (E P = E Pmin ) nestabilní ustálený stav proměnné systému konstantní, v systému ale existuje tok energie nebo hmoty
3 Termodynamické veličiny a funkce Termodynamický systém stav systému popsán stavovými veličinami a funkcemi Stavové vlastnosti nebo proměnné dělíme na intenzivní proměnné, nezávislé na velikosti systému hustota, molární volná entalpie, chemický potenciál, tlak, teplo extenzivní proměnné, závislé na velikosti systému hmotnost, energie,entalpie, entropie, objem
4 stavové veličiny velikost závisí pouze na stavu systému,ne na způsobu, jak se systém do tohoto stavu dostal (p, V, T, c). stavové rovnice matematické vztahy mezi stavovými veličinami (pv = nrt) kruhový děj systém se po vykonání určitého děje vrátí do výchozího stavu děj vratný nekonečně malou změnou určité stavové veličiny lze dosáhnout změny směru průběhu děje (rovnovážné stavy) nevratný systém samostatně přešel do energeticky chudšího stavu (nerovnovážné stavy)
5 typy fyzikálních veličin gradient fyzikální veličiny termodynamické síly gradient fyzikální veličiny - způsobující transport termodynamické toky tok tepla, látky termodynamická síla může způsobit jakýkoliv termodynamický tok (termodifuze)
6 1. věta termodynamická vnitřní energie U - součet všech druhů energie v systému (tepelná, energie vazby, záření, potenciální energie struktury) U = U U = Q+ W B A změna U je závislá pouze na počátečním a konečném stavu a vůbec nezáleží na cestě, kterou byl přechod uskutečněn.
7 Rozdíl mezi teplem a prací Teplo představuje součet kinetických energií částic systému. Mikrofyzikální neuspořádaná forma výměny energie mezi systémy nebo složkami. Teplo se může, není-li převedeno na práci, spotřebovat pouze na zvýšení vnitřní energie systému. Práce je makrofyzikální uspořádanou formou předávání energie ze systému, který ji koná, do systému, který ji získává. Práce se může spotřebovat na zvýšení obsahu jakéhokoliv druhu energie. Může se konat jen na úkor U nebo dodáním Q. Q ani W nejsou stavové veličiny - závislé na ději proběhlém v systému
8 Přechody mezi výchozím a koncovým stavem Reverzibilní přechod - charakterizován cestou sestávající z velmi malých kroků či změn na souřadnicích. To, že se takový krok vyskytne, je více pravděpodobné, než že tato situace nenastane. Ireverzibilní přechod - každý stav či substav stavu dosažený během přechodu je mnohem více pravděpodobný než ten, který mu předcházel. Možnost že se reakce sama obrátí je v uvedeném případě extrémně malá a přechod pokládáme za nevratný.
9 Plyn v trubici expanze práci koná systém, tedy ΔV 0, V 2 V 1, ΔU negativní, energie systému klesá komprese práce je konána na systému ΔV 0, V 2 V 1 ΔU= dq p dv pro T = konst. dq=pdv=-dw
10 Druhy práce chemická - μdn mechanická - pdv elektrická - Φdq práce je produktem extenzivních nebo intenzivních proměnných. vlastní vnitřní proměnné μ - chemický potenciál p - tlak Φ - elektrický potenciál
11 Entalpie H Z 1. věty termodynamické - teplo dodané systému se spotřebuje na práci, kterou systém koná a na zvýšení vnitřní energie systému. Q = ΔU W = ΔU + pdv (p = konst.) H = U + pdv (tepelný obsah) Při samovolně probíhající exotermní chemické reakci entalpie soustavy klesá a energie se uvolňuje v podobě tepla.
12 Tepelná kapacita (měrné teplo) množství tepla potřebného k ohřátí 1 kg látky o 1 C dqp H dqv U cp = = cv = = dt T dt T p V Velikost c závisí na způsobu ohřevu a na teplotě dané látky. Je-li konaná práce čistě mechanická (tedy ani chemická či elektrická) a p = konst., pak je změna entalpie rovna absorbovanému teplu za konstantního tlaku
13 2. věta termodynamická nelze trvale získávat práci odebíráním tepla z jednoho zásobníku o určité teplotě, aniž bychom část tepla neodevzdali zásobníku chladnějšímu Carnot η = Q 1 -Q 2 /Q 1 = T 1 -T 2 /T 1 část tepla, která přešla do chladnějšího zásobníku, ztratila schopnost konat práci degradace energie - při převodu tepla z vyšší na nižší teplotu
14 ds = dq/t Entropie S (J.K -1 ) (ΔS = S 2 S 1 ) je nezávislá na způsobu přechodu Výpočet entropie ireverzibilních dějů soustavu musíme z výchozího do konečného stavu dostat vratně ze součtů ΔS dostaneme celkovou změnu, která je rovna celkové změně entropie nevratného procesu
15 Matematické shrnutí 2. věty termodynamické Izolovaný systém ΔS 0 reverzibilní děj ds r = 0 ireverzibilní děj ds ir > 0 - entropie soustavy vzrůstá nebo zůstává nezměněna - v rovnováze je entropie maximální Neizolovaný systém reverzibilní děj ds r = dq/t ireverzibilní děj ds ir > dq/t
16 Statistický charakter entropie Samovolně probíhající ireverzibilní děj představuje přechod soustavy ze stavu méně pravděpodobného do pravděpodobnějšího Vzrůst entropie při tomto ději lze vyjádřit jako funkci termodynamické pravděpodobnosti W soustavy statistickou formulací Boltzmannovou R 23 S = k.lnw = lnw = 1,38.10 lnw N A
17 Souvislost entropie a informace K úplnému popisu systému je zapotřebí informace Množství informace I vyjadřujeme vztahem I = ln (P 1 /P) P apriorní pravděpodobnost události P 1 pravděpodobnost pro získání informace (pro jednoduchost předpokládáme, že všechny informace jsou pravdivé a jednoznačné, tedy že P 1 = 1). Informace se vyjadřuje v bitech. Velikost 1 bitu má informace o události, jejíž pravděpodobnost je ½ Operace spojené se získáváním informací o systému vedou ke zvýšení entropie systému
18 Volná energie A A = U TS, za konst. V a T je da = dq TdS Úbytek volné energie je roven maximální práci, kterou systém vykoná při izotermickém reverzibilním ději Celková vnitřní energie U se skládá z volné energie a z vázané energie o velikosti TS, která je izotermálně neužitečná Při nevratném ději, probíhajícím v soustavě při konstantní teplotě,volná energie ubývá a v rovnováze dosahuje minimální hodnoty
19 Gibbsova energie G G = H TS, (T, p = konst.) dg = dh TdS Její úbytek je roven maximální užitečné práci (celková reverzibilní práce zmenšená o práci proti vnějšímu tlaku), kterou systém koná při izotermicko adiabatickém ději. Gibbsova volná energie při izotermicko izobarickém ději ubývá a v rovnováze dosahuje minima
20 Maxwellovy vztahy diferenciály termodynamických potenciálů du = T ds p dv dh = V dp + TdS da = p dv S dt dg = V dp S dt
21 Chemický potenciál Stav systému je dostatečně určen dvěma stavovými veličinami nebo funkcemi a počtem molů n jednotlivých látek. Změna složení souvisí se změnou energie. Každý druh energie lze vyjádřit faktorem - intenzitním - chemický potenciál μ - kapacitním - přírůstek molů látky v případě chemické energie
22 G µ = i n i T, pn,, j i j - změna Gibbsovy volné energie způsobená přídavkem 1 molu složky i do systému množství ostatních složek se nemění - reakce probíhají v roztocích při stálém p a T - změna chemické energie je částečně rovna změně maximální užitečné práce, tj. Gibbsově volné energii, která odpovídá změně složení systému
23 Koncentrační závislost Gibbsovy energie G = H TS = U + pv TS tedy G = f (p) reverzibilní neizolovaný systém zahrnuje jen pv práci dg = (du + pdv)+ Vdp (TdS) - SdT du = dq - pdv dq dq Q = du + pdv = TdS pro p, T 0 dg = Vdp - SdT pro dt = 0 dg = Vdp dg = Vdc p = konst. c = koncentrace (mol)
24 pc = nrt pv = nrt V = nrt c dc G = dg = G G = V. dc = nrt = nrt ln c c c 2 1 G 1 = G 0 G 2 = G { } 0 c 0 n 0 G = G + nrt ln = G + nrt ln c ( c = 1 M ) { 0 c } { }
25 Závislost na koncentraci reaktantů a produktů na A + nb B nc C + nd D 0 ( ) n 0 A A G = G + RT ln c c = 1M = + 0 G G RT ln = = c n { } C { } c C n D { } A { } 0 G RT ln krovnov. 2,3RT log krovnov. < G k rovnov. >1 G A c c B n n D B > 0 krovnov. <1
26 Termodynamika a živé systémy teoretická pozorování složitých procesů v organismech se provádějí na základě kinetiky, tedy termodynamiky ireverzibilních dějů živý organismus se vyznačuje - vysokým stupněm neuspořádanosti - během ontogeneze se vyvíjí k vyšším stupňům diferenciace a komplexity, čímž zdánlivě odporuje stávajícím fyzikálním zákonům
27 Živý organismus jako celek i jeho hlavní části - není systémem izolovaným od vnějšího prostředí - z termodynamického hlediska představuje otevřený systém, tj. systém s trvalou výměnou látek, energie a informace s okolím - dodávaná energie se spotřebovává na udržování uspořádané struktury systému - dochází k neustálé přeměně jednotlivých druhů energií - systém se udržuje ve stavu dynamické rovnováhy
28 Zásady termodynamiky otevřených systémů Otevřené systémy směřují k dynamické rovnováze (stacionárnímu stavu), vyznačující se minimální entropií. Přechod otevřeného systému k dynamické rovnováze může způsobit pokles entropie. Dynamické rovnováhy mají obecně stabilní charakter a vyznačují se kompenzačními mechanismy.
29 Klasická ireverzibilní termodynamika hraniční případ -termodynamika otevřených systémů V živém organismu probíhají dva protichůdné děje - ireverzibilní pochod projevující se degradací energie a vzrůstem entropie - organismus svými životními pochody brání vzrůstu entropie - v určitých fázích svého vývoje dokonce vnitřní entropii snižuje. Ke skutečné termodynamické rovnováze dojde až po smrti organismu
Termodynamika materiálů. Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn
 Termodynamika materiálů Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn Důležité konstanty Standartní podmínky Avogadrovo číslo N A = 6,023.10
Termodynamika materiálů Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn Důležité konstanty Standartní podmínky Avogadrovo číslo N A = 6,023.10
Termodynamika (td.) se obecně zabývá vzájemnými vztahy a přeměnami různých druhů
 Termodynamika (td.) se obecně zabývá vzájemnými vztahy a přeměnami různých druhů energií (mechanické, tepelné, elektrické, magnetické, chemické a jaderné) při td. dějích. Na rozdíl od td. cyklických dějů
Termodynamika (td.) se obecně zabývá vzájemnými vztahy a přeměnami různých druhů energií (mechanické, tepelné, elektrické, magnetické, chemické a jaderné) při td. dějích. Na rozdíl od td. cyklických dějů
Elektroenergetika 1. Termodynamika a termodynamické oběhy
 Termodynamika a termodynamické oběhy Termodynamika Popisuje procesy, které zahrnují změny teploty, přeměny energie a vzájemný vztah mezi tepelnou energií a mechanickou prací Opakování fyziky Termodynamický
Termodynamika a termodynamické oběhy Termodynamika Popisuje procesy, které zahrnují změny teploty, přeměny energie a vzájemný vztah mezi tepelnou energií a mechanickou prací Opakování fyziky Termodynamický
Elektroenergetika 1. Termodynamika
 Elektroenergetika 1 Termodynamika Termodynamika Popisuje procesy, které zahrnují změny teploty, přeměny energie a vzájemný vztah mezi tepelnou energií a mechanickou prací Opakování fyziky Termodynamický
Elektroenergetika 1 Termodynamika Termodynamika Popisuje procesy, které zahrnují změny teploty, přeměny energie a vzájemný vztah mezi tepelnou energií a mechanickou prací Opakování fyziky Termodynamický
Přednášky z lékařské biofyziky Biofyzikální ústav Lékařské fakulty Masarykovy univerzity, Brno
 Přednášky z lékařské biofyziky Biofyzikální ústav Lékařské fakulty Masarykovy univerzity, Brno JAMES WATT 19.1.1736-19.8.1819 Termodynamika principy, které vládnou přírodě Obsah přednášky Vysvětlení základních
Přednášky z lékařské biofyziky Biofyzikální ústav Lékařské fakulty Masarykovy univerzity, Brno JAMES WATT 19.1.1736-19.8.1819 Termodynamika principy, které vládnou přírodě Obsah přednášky Vysvětlení základních
Fyzikální chemie. Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302. 14. února 2013
 Fyzikální chemie Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302 14. února 2013 Co je fyzikální chemie? Co je fyzikální chemie? makroskopický přístup: (klasická) termodynamika nerovnovážná
Fyzikální chemie Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302 14. února 2013 Co je fyzikální chemie? Co je fyzikální chemie? makroskopický přístup: (klasická) termodynamika nerovnovážná
FYZIKÁLNÍ CHEMIE chemická termodynamika
 FYZIKÁLNÍ CHEMIE chemická termodynamika ermodynamika jako vědní disciplína Základní zákony termodynamiky Práce, teplo a energie Vnitřní energie a entalpie Chemická termodynamika Definice termodynamiky
FYZIKÁLNÍ CHEMIE chemická termodynamika ermodynamika jako vědní disciplína Základní zákony termodynamiky Práce, teplo a energie Vnitřní energie a entalpie Chemická termodynamika Definice termodynamiky
Termodynamické zákony
 Termodynamické zákony Makroskopická práce termodynamické soustavy Již jsme uvedli, že změna vnitřní energie soustavy je obecně vyvolána dvěma ději: tepelnou výměnou mezi soustavou a okolím a konáním práce
Termodynamické zákony Makroskopická práce termodynamické soustavy Již jsme uvedli, že změna vnitřní energie soustavy je obecně vyvolána dvěma ději: tepelnou výměnou mezi soustavou a okolím a konáním práce
Kapitoly z fyzikální chemie KFC/KFCH. II. Termodynamika
 Kapitoly z fyzikální chemie KFC/KFCH II. Termodynamika Karel Berka Univerzita Palackého v Olomouci Katedra Fyzikální chemie karel.berka@upol.cz Termodynamika therme - teplo a dunamis - síla popis jak systémy
Kapitoly z fyzikální chemie KFC/KFCH II. Termodynamika Karel Berka Univerzita Palackého v Olomouci Katedra Fyzikální chemie karel.berka@upol.cz Termodynamika therme - teplo a dunamis - síla popis jak systémy
8. Chemické reakce Energetika - Termochemie
 - Termochemie TERMOCHEMIE oddíl termodynamiky Tepelné zabarvení chemických reakcí Samovolnost chemických reakcí Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti - Termochemie TERMOCHEMIE
- Termochemie TERMOCHEMIE oddíl termodynamiky Tepelné zabarvení chemických reakcí Samovolnost chemických reakcí Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti - Termochemie TERMOCHEMIE
CHEMICKÁ ENERGETIKA. Celá termodynamika je logicky odvozena ze tří základních principů, které mají axiomatický charakter.
 CHEMICKÁ ENERGETIKA Energetickou stránkou soustav a změnami v těchto soustavách se zabývá fyzikální disciplína termodynamika. Z široké oblasti obecné termodynamiky se chemická termodynamika zajímá o chemické
CHEMICKÁ ENERGETIKA Energetickou stránkou soustav a změnami v těchto soustavách se zabývá fyzikální disciplína termodynamika. Z široké oblasti obecné termodynamiky se chemická termodynamika zajímá o chemické
CHEMICKÁ ENERGETIKA. Celá termodynamika je logicky odvozena ze tří základních principů, které mají axiomatický charakter.
 CHEMICKÁ ENERGETIKA Energetickou stránkou soustav a změnami v těchto soustavách se zabývá fyzikální disciplína termodynamika. Z široké oblasti obecné termodynamiky se chemická termodynamika zajímá o chemické
CHEMICKÁ ENERGETIKA Energetickou stránkou soustav a změnami v těchto soustavách se zabývá fyzikální disciplína termodynamika. Z široké oblasti obecné termodynamiky se chemická termodynamika zajímá o chemické
IDEÁLNÍ PLYN. Stavová rovnice
 IDEÁLNÍ PLYN Stavová rovnice Ideální plyn ) rozměry molekul jsou zanedbatelné vzhledem k jejich vzdálenostem 2) molekuly plynu na sebe působí jen při vzájemných srážkách 3) všechny srážky jsou dokonale
IDEÁLNÍ PLYN Stavová rovnice Ideální plyn ) rozměry molekul jsou zanedbatelné vzhledem k jejich vzdálenostem 2) molekuly plynu na sebe působí jen při vzájemných srážkách 3) všechny srážky jsou dokonale
Termodynamika v biochemii
 Termodynamika v biochemii Studium energetických změn Klasická x statistická Rovnovážná x nerovnovážná lineárn rní a nelineárn rní Základní pojmy Makroskopický systém, okolí systému Termodynamický systém
Termodynamika v biochemii Studium energetických změn Klasická x statistická Rovnovážná x nerovnovážná lineárn rní a nelineárn rní Základní pojmy Makroskopický systém, okolí systému Termodynamický systém
2.4 Stavové chování směsí plynů Ideální směs Ideální směs reálných plynů Stavové rovnice pro plynné směsi
 1. ZÁKLADNÍ POJMY 1.1 Systém a okolí 1.2 Vlastnosti systému 1.3 Vybrané základní veličiny 1.3.1 Množství 1.3.2 Délka 1.3.2 Délka 1.4 Vybrané odvozené veličiny 1.4.1 Objem 1.4.2 Hustota 1.4.3 Tlak 1.4.4
1. ZÁKLADNÍ POJMY 1.1 Systém a okolí 1.2 Vlastnosti systému 1.3 Vybrané základní veličiny 1.3.1 Množství 1.3.2 Délka 1.3.2 Délka 1.4 Vybrané odvozené veličiny 1.4.1 Objem 1.4.2 Hustota 1.4.3 Tlak 1.4.4
Termomechanika 4. přednáška
 ermomechanika 4. přednáška Miroslav Holeček Upozornění: ato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím citovaných zdrojů
ermomechanika 4. přednáška Miroslav Holeček Upozornění: ato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím citovaných zdrojů
Fyzikální chemie Úvod do studia, základní pojmy
 Fyzikální chemie Úvod do studia, základní pojmy HMOTA A JEJÍ VLASTNOSTI POSTAVENÍ FYZIKÁLNÍ CHEMIE V PŘÍRODNÍCH VĚDÁCH HISTORIE FYZIKÁLNÍ CHEMIE ZÁKLADNÍ POJMY DEFINICE FORMY HMOTY Formy a nositelé hmoty
Fyzikální chemie Úvod do studia, základní pojmy HMOTA A JEJÍ VLASTNOSTI POSTAVENÍ FYZIKÁLNÍ CHEMIE V PŘÍRODNÍCH VĚDÁCH HISTORIE FYZIKÁLNÍ CHEMIE ZÁKLADNÍ POJMY DEFINICE FORMY HMOTY Formy a nositelé hmoty
Termomechanika 6. přednáška Doc. Dr. RNDr. Miroslav Holeček
 Termomechanika 6. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Termomechanika 6. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Termodynamika. Děj, který není kvazistatický, se nazývá nestatický.
 Termodynamika Zabývá se ději, při nichž se mění tepelná energie v jiné druhy energie (zejména mechanické). Studuje vlastnosti látek bez přihlédnutí k jejich mikrostruktuře. Je vystavěna na axiomech (0.,
Termodynamika Zabývá se ději, při nichž se mění tepelná energie v jiné druhy energie (zejména mechanické). Studuje vlastnosti látek bez přihlédnutí k jejich mikrostruktuře. Je vystavěna na axiomech (0.,
ÚVOD DO TERMODYNAMIKY
 ÚVOD DO TERMODYNAMIKY Termodynamika: Nauka o obecných zákonitostech, kterými se se řídí transformace CELKOVÉ energie makroskopických systémů v její různé formy. Je založena na výsledcích experimentílních
ÚVOD DO TERMODYNAMIKY Termodynamika: Nauka o obecných zákonitostech, kterými se se řídí transformace CELKOVÉ energie makroskopických systémů v její různé formy. Je založena na výsledcích experimentílních
Mol. fyz. a termodynamika
 Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
LOGO. Struktura a vlastnosti plynů Ideální plyn
 Struktura a vlastnosti plynů Ideální plyn Ideální plyn Protože popsat chování plynů je nad naše možnosti, zavádíme zjednodušený model tzv. ideálního plynu, který má tyto vlastnosti: Částice ideálního plynu
Struktura a vlastnosti plynů Ideální plyn Ideální plyn Protože popsat chování plynů je nad naše možnosti, zavádíme zjednodušený model tzv. ideálního plynu, který má tyto vlastnosti: Částice ideálního plynu
Molekulová fyzika a termika. Přehled základních pojmů
 Molekulová fyzika a termika Přehled základních pojmů Kinetická teorie látek Vychází ze tří experimentálně ověřených poznatků: 1) Látky se skládají z částic - molekul, atomů nebo iontů, mezi nimiž jsou
Molekulová fyzika a termika Přehled základních pojmů Kinetická teorie látek Vychází ze tří experimentálně ověřených poznatků: 1) Látky se skládají z částic - molekul, atomů nebo iontů, mezi nimiž jsou
FYZIKÁLNÍ CHEMIE I: 2. ČÁST
 Univerzita J. E. Purkyně v Ústí nad Labem Přírodovědecká fakulta FYZIKÁLNÍ CHEMIE I: 2. ČÁST KCH/P401 Ivo Nezbeda Ústí nad Labem 2013 1 Obor: Klíčová slova: Anotace: Toxikologie a analýza škodlivin, Chemie
Univerzita J. E. Purkyně v Ústí nad Labem Přírodovědecká fakulta FYZIKÁLNÍ CHEMIE I: 2. ČÁST KCH/P401 Ivo Nezbeda Ústí nad Labem 2013 1 Obor: Klíčová slova: Anotace: Toxikologie a analýza škodlivin, Chemie
Poznámky k cvičením z termomechaniky Cvičení 3.
 Vnitřní energie U Vnitřní energie U je stavová veličina U = U (p, V, T), ale závisí pouze na teplotě (experiment Gay-Lussac / Joule) U = f(t) Pro měrnou vnitřní energii (tedy pro vnitřní energii jednoho
Vnitřní energie U Vnitřní energie U je stavová veličina U = U (p, V, T), ale závisí pouze na teplotě (experiment Gay-Lussac / Joule) U = f(t) Pro měrnou vnitřní energii (tedy pro vnitřní energii jednoho
Teplo, práce a 1. věta termodynamiky
 eplo, práce a. věta termodynamiky eplo ( tepelná energie) Nyní již víme, že látka (plyn) s vyšší teplotou obsahuje částice (molekuly), které se pohybují s vyššími rychlostmi a můžeme posoudit, co se stane
eplo, práce a. věta termodynamiky eplo ( tepelná energie) Nyní již víme, že látka (plyn) s vyšší teplotou obsahuje částice (molekuly), které se pohybují s vyššími rychlostmi a můžeme posoudit, co se stane
Magnetokalorický jev MCE
 Magnetokalorický jev a jeho aplikační potenciál P. Svoboda Katedra fyziky kondenzovaných látek Magnetokalorický jev MCE MCE: znám déle než 120 let renesance zájmu během posledních 35 let PROČ? Připomínka
Magnetokalorický jev a jeho aplikační potenciál P. Svoboda Katedra fyziky kondenzovaných látek Magnetokalorický jev MCE MCE: znám déle než 120 let renesance zájmu během posledních 35 let PROČ? Připomínka
VYBRANÉ STATĚ Z PROCESNÍHO INŢENÝRSTVÍ cvičení 12
 UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY VYBRANÉ STATĚ Z PROCESNÍHO INŢENÝRSTVÍ cvičení 2 Termodynamika reálných plynů část 2 Hana Charvátová, Dagmar Janáčová Zlín 203 Tento studijní
UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY VYBRANÉ STATĚ Z PROCESNÍHO INŢENÝRSTVÍ cvičení 2 Termodynamika reálných plynů část 2 Hana Charvátová, Dagmar Janáčová Zlín 203 Tento studijní
Kapitoly z fyzikální chemie KFC/KFCH. II. Termodynamika
 Kapitoly z fyzikální chemie KFC/KFCH II. Termodynamika Karel Berka Univerzita Palackého v Olomouci Katedra Fyzikální chemie karel.berka@upol.cz Termodynamika therme - teplo a dunamis - síla popis jak systémy
Kapitoly z fyzikální chemie KFC/KFCH II. Termodynamika Karel Berka Univerzita Palackého v Olomouci Katedra Fyzikální chemie karel.berka@upol.cz Termodynamika therme - teplo a dunamis - síla popis jak systémy
Fyzikální chemie. 1.2 Termodynamika
 Fyzikální chemie. ermodynamika Mgr. Sylvie Pavloková Letní semestr 07/08 děj izotermický izobarický izochorický konstantní V ermodynamika rvní termodynamický zákon (zákon zachování energie): U Q + W izotermický
Fyzikální chemie. ermodynamika Mgr. Sylvie Pavloková Letní semestr 07/08 děj izotermický izobarický izochorický konstantní V ermodynamika rvní termodynamický zákon (zákon zachování energie): U Q + W izotermický
Teplota jedna ze základních jednotek soustavy SI, vyjadřována je v Kelvinech (značka K) další používané stupnice: Celsiova, Fahrenheitova
 1 Rozložení, distribuce tepla Teplota je charakteristika tepelného stavu hmoty je to stavová veličina, charakterizující termodynamickou rovnováhu systému. Teplo vyjadřuje kinetickou energii částic. Teplota
1 Rozložení, distribuce tepla Teplota je charakteristika tepelného stavu hmoty je to stavová veličina, charakterizující termodynamickou rovnováhu systému. Teplo vyjadřuje kinetickou energii částic. Teplota
TERMOMECHANIKA 1. Základní pojmy
 1 FSI VUT v Brně, Energetický ústav Odbor termomechaniky a techniky prostředí prof. Ing. Milan Pavelek, CSc. TERMOMECHANIKA 1. Základní pojmy OSNOVA 1. KAPITOLY Termodynamická soustava Energie, teplo,
1 FSI VUT v Brně, Energetický ústav Odbor termomechaniky a techniky prostředí prof. Ing. Milan Pavelek, CSc. TERMOMECHANIKA 1. Základní pojmy OSNOVA 1. KAPITOLY Termodynamická soustava Energie, teplo,
Klasická termodynamika (aneb pøehled FCH I)
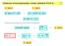 Klasická termodynamika (aneb pøehled FCH I) 1/16 0. zákon 1. zákon id. plyn: pv = nrt pv κ = konst (id., ad.) id. plyn: U = U(T) }{{} Carnotùv cyklus dq T = 0 2. zákon rg, K,... lim S = 0 T 0 S, ds = dq
Klasická termodynamika (aneb pøehled FCH I) 1/16 0. zákon 1. zákon id. plyn: pv = nrt pv κ = konst (id., ad.) id. plyn: U = U(T) }{{} Carnotùv cyklus dq T = 0 2. zákon rg, K,... lim S = 0 T 0 S, ds = dq
metoda je základem fenomenologické vědy termodynamiky, statistická metoda je základem kinetické teorie plynů, na níž si princip této metody ukážeme.
 Přednáška 1 Úvod Při studiu tepelných vlastností látek a jevů probíhajících při tepelné výměně budeme používat dvě různé metody zkoumání: termodynamickou a statistickou. Termodynamická metoda je základem
Přednáška 1 Úvod Při studiu tepelných vlastností látek a jevů probíhajících při tepelné výměně budeme používat dvě různé metody zkoumání: termodynamickou a statistickou. Termodynamická metoda je základem
Termodynamika. T [K ]=t [ 0 C] 273,15 T [ K ]= t [ 0 C] termodynamická teplota: Stavy hmoty. jednotka: 1 K (kelvin) = 1/273,16 část termodynamické
![Termodynamika. T [K ]=t [ 0 C] 273,15 T [ K ]= t [ 0 C] termodynamická teplota: Stavy hmoty. jednotka: 1 K (kelvin) = 1/273,16 část termodynamické Termodynamika. T [K ]=t [ 0 C] 273,15 T [ K ]= t [ 0 C] termodynamická teplota: Stavy hmoty. jednotka: 1 K (kelvin) = 1/273,16 část termodynamické](/thumbs/24/2778201.jpg) Termodynamika termodynamická teplota: Stavy hmoty jednotka: 1 K (kelvin) = 1/273,16 část termodynamické teploty trojného bodu vody (273,16 K = 0,01 o C). 0 o C = 273,15 K T [K ]=t [ 0 C] 273,15 T [ K ]=
Termodynamika termodynamická teplota: Stavy hmoty jednotka: 1 K (kelvin) = 1/273,16 část termodynamické teploty trojného bodu vody (273,16 K = 0,01 o C). 0 o C = 273,15 K T [K ]=t [ 0 C] 273,15 T [ K ]=
Ideální plyn. Stavová rovnice Děje v ideálním plynu Práce plynu, Kruhový děj, Tepelné motory
 Struktura a vlastnosti plynů Ideální plyn Vlastnosti ideálního plynu: Ideální plyn Stavová rovnice Děje v ideálním plynu Práce plynu, Kruhový děj, epelné motory rozměry molekul jsou ve srovnání se střední
Struktura a vlastnosti plynů Ideální plyn Vlastnosti ideálního plynu: Ideální plyn Stavová rovnice Děje v ideálním plynu Práce plynu, Kruhový děj, epelné motory rozměry molekul jsou ve srovnání se střední
10. Energie a její transformace
 10. Energie a její transformace Energie je nejdůležitější vlastností hmoty a záření. Je obsažena v každém kousku hmoty i ve světelném paprsku. Je ve vesmíru a všude kolem nás. S energií se setkáváme na
10. Energie a její transformace Energie je nejdůležitější vlastností hmoty a záření. Je obsažena v každém kousku hmoty i ve světelném paprsku. Je ve vesmíru a všude kolem nás. S energií se setkáváme na
Základem molekulové fyziky je kinetická teorie látek. Vychází ze tří pouček:
 Molekulová fyzika zkoumá vlastnosti látek na základě jejich vnitřní struktury, pohybu a vzájemného působení částic, ze kterých se látky skládají. Termodynamika se zabývá zákony přeměny různých forem energie
Molekulová fyzika zkoumá vlastnosti látek na základě jejich vnitřní struktury, pohybu a vzájemného působení částic, ze kterých se látky skládají. Termodynamika se zabývá zákony přeměny různých forem energie
Energie v chemických reakcích
 Energie v chemických reakcích Energetická bilance reakce CH 4 + Cl 2 = CH 3 Cl + HCl rozštěpení vazeb vznik nových vazeb V chemických reakcích dochází ke změně vazeb mezi atomy. Vazebná energie uvolnění
Energie v chemických reakcích Energetická bilance reakce CH 4 + Cl 2 = CH 3 Cl + HCl rozštěpení vazeb vznik nových vazeb V chemických reakcích dochází ke změně vazeb mezi atomy. Vazebná energie uvolnění
Do známky zkoušky rovnocenným podílem započítávají získané body ze zápočtového testu.
 Podmínky pro získání zápočtu a zkoušky z předmětu Chemicko-inženýrská termodynamika pro zpracování ropy Zápočet je udělen, pokud student splní zápočtový test alespoň na 50 %. Zápočtový test obsahuje 3
Podmínky pro získání zápočtu a zkoušky z předmětu Chemicko-inženýrská termodynamika pro zpracování ropy Zápočet je udělen, pokud student splní zápočtový test alespoň na 50 %. Zápočtový test obsahuje 3
PLYNNÉ LÁTKY. Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník
 PLYNNÉ LÁTKY Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník Ideální plyn Po molekulách ideálního plynu požadujeme: 1.Rozměry molekul ideálního plynu jsou ve srovnání se střední vzdáleností molekul
PLYNNÉ LÁTKY Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník Ideální plyn Po molekulách ideálního plynu požadujeme: 1.Rozměry molekul ideálního plynu jsou ve srovnání se střední vzdáleností molekul
9. Struktura a vlastnosti plynů
 9. Struktura a vlastnosti plynů Osnova: 1. Základní pojmy 2. Střední kvadratická rychlost 3. Střední kinetická energie molekuly plynu 4. Stavová rovnice ideálního plynu 5. Jednoduché děje v plynech a)
9. Struktura a vlastnosti plynů Osnova: 1. Základní pojmy 2. Střední kvadratická rychlost 3. Střední kinetická energie molekuly plynu 4. Stavová rovnice ideálního plynu 5. Jednoduché děje v plynech a)
Termodynamika 1. UJOP Hostivař 2014
 Termodynamika 1 UJOP Hostivař 2014 Termodynamika Zabývá se tepelnými ději obecně. Existují 3 termodynamické zákony: 1. Celkové množství energie (všech druhů) izolované soustavy zůstává zachováno. 2. Teplo
Termodynamika 1 UJOP Hostivař 2014 Termodynamika Zabývá se tepelnými ději obecně. Existují 3 termodynamické zákony: 1. Celkové množství energie (všech druhů) izolované soustavy zůstává zachováno. 2. Teplo
Energie, její formy a měření
 Energie, její formy a měření aneb Od volného pádu k E=mc 2 Přednášející: Martin Zápotocký Seminář Aplikace lékařské biofyziky 2014/5 Definice energie Energos (ἐνεργός) = pracující, aktivní; ergon = práce
Energie, její formy a měření aneb Od volného pádu k E=mc 2 Přednášející: Martin Zápotocký Seminář Aplikace lékařské biofyziky 2014/5 Definice energie Energos (ἐνεργός) = pracující, aktivní; ergon = práce
1.4. II. věta termodynamiky
 ... věta termodynamiky Slovní formulace: homsonova formulace: Nelze sestrojit periodicky pracující stroj, který by konal práci, přičemž by ochlazoval jediné těleso, jehož teplota by byla všude stejná,
... věta termodynamiky Slovní formulace: homsonova formulace: Nelze sestrojit periodicky pracující stroj, který by konal práci, přičemž by ochlazoval jediné těleso, jehož teplota by byla všude stejná,
přednáška č. 6 Elektrárny B1M15ENY Tepelné oběhy: Stavové změny Typy oběhů Možnosti zvýšení účinnosti Ing. Jan Špetlík, Ph.D.
 Elektrárny B1M15ENY přednáška č. 6 Tepelné oběhy: Stavové změny Typy oběhů Možnosti zvýšení účinnosti Ing. Jan Špetlík, Ph.D. ČVUT FEL Katedra elektroenergetiky E-mail: spetlij@fel.cvut.cz Termodynamika:
Elektrárny B1M15ENY přednáška č. 6 Tepelné oběhy: Stavové změny Typy oběhů Možnosti zvýšení účinnosti Ing. Jan Špetlík, Ph.D. ČVUT FEL Katedra elektroenergetiky E-mail: spetlij@fel.cvut.cz Termodynamika:
5.4 Adiabatický děj Polytropický děj Porovnání dějů Základy tepelných cyklů První zákon termodynamiky pro cykly 42 6.
 OBSAH Předmluva 9 I. ZÁKLADY TERMODYNAMIKY 10 1. Základní pojmy 10 1.1 Termodynamická soustava 10 1.2 Energie, teplo, práce 10 1.3 Stavy látek 11 1.4 Veličiny popisující stavy látek 12 1.5 Úlohy technické
OBSAH Předmluva 9 I. ZÁKLADY TERMODYNAMIKY 10 1. Základní pojmy 10 1.1 Termodynamická soustava 10 1.2 Energie, teplo, práce 10 1.3 Stavy látek 11 1.4 Veličiny popisující stavy látek 12 1.5 Úlohy technické
Stanislav Labík. Ústav fyzikální chemie V CHT Praha budova A, 3. patro u zadního vchodu, místnost
 Stanislav Labík Ústav fyzikální chemie V CHT Praha budova A, 3. patro u zadního vchodu, místnost 325 labik@vscht.cz 220 444 257 http://www.vscht.cz/fch/ Výuka Letní semestr N403032 Základy fyzikální chemie
Stanislav Labík Ústav fyzikální chemie V CHT Praha budova A, 3. patro u zadního vchodu, místnost 325 labik@vscht.cz 220 444 257 http://www.vscht.cz/fch/ Výuka Letní semestr N403032 Základy fyzikální chemie
Termodynamické zákony
 ermoynamické zákony. termoynamický zákon (zákon zachování energie) (W je práce vykonaná na systém) teplo Q oané systému plus vynaložená práce W zvyšují vnitřní energii systému U (W je práce vykonaná systémem)
ermoynamické zákony. termoynamický zákon (zákon zachování energie) (W je práce vykonaná na systém) teplo Q oané systému plus vynaložená práce W zvyšují vnitřní energii systému U (W je práce vykonaná systémem)
Moravské gymnázium Brno s.r.o. RNDr. Miroslav Štefan
 Číslo projektu CZ.1.07/1.5.00/34.0743 Název školy Moravské gymnázium Brno s.r.o. Autor RNDr. Miroslav Štefan Tematická oblast Chemie obecná termodynamika Ročník 1. ročník Datum tvorby 22.4.2014 Anotace
Číslo projektu CZ.1.07/1.5.00/34.0743 Název školy Moravské gymnázium Brno s.r.o. Autor RNDr. Miroslav Štefan Tematická oblast Chemie obecná termodynamika Ročník 1. ročník Datum tvorby 22.4.2014 Anotace
Tepelná vodivost. střední rychlost. T 1 > T 2 z. teplo přenesené za čas dt: T 1 T 2. tepelný tok střední volná dráha. součinitel tepelné vodivosti
 Tepelná vodivost teplo přenesené za čas dt: T 1 > T z T 1 S tepelný tok střední volná dráha T součinitel tepelné vodivosti střední rychlost Tepelná vodivost součinitel tepelné vodivosti při T = 300 K součinitel
Tepelná vodivost teplo přenesené za čas dt: T 1 > T z T 1 S tepelný tok střední volná dráha T součinitel tepelné vodivosti střední rychlost Tepelná vodivost součinitel tepelné vodivosti při T = 300 K součinitel
Termochemie { práce. Práce: W = s F nebo W = F ds. Objemová práce (p vn = vnìj¹í tlak): W = p vn dv. Vratný dìj: p = p vn (ze stavové rovnice) W =
 Termochemie { práce Práce: W = s F nebo W = Objemová práce (p vn = vnìj¹í tlak): W = V2 V 1 p vn dv s2 Vratný dìj: p = p vn (ze stavové rovnice) W = V2 V 1 p dv s 1 F ds s.1 Diferenciální tvar: dw = pdv
Termochemie { práce Práce: W = s F nebo W = Objemová práce (p vn = vnìj¹í tlak): W = V2 V 1 p vn dv s2 Vratný dìj: p = p vn (ze stavové rovnice) W = V2 V 1 p dv s 1 F ds s.1 Diferenciální tvar: dw = pdv
Thermos teplo Dynamic změna
 Termodynamika Plán přednášky: Předmět studia Základní pojmy Termodynamické zákony předmět studia Co je to termodynamika? Soubor matematických modelů a představ, které nám umožňují popsat jakým způsobem
Termodynamika Plán přednášky: Předmět studia Základní pojmy Termodynamické zákony předmět studia Co je to termodynamika? Soubor matematických modelů a představ, které nám umožňují popsat jakým způsobem
TERMOMECHANIKA PRO STUDENTY STROJNÍCH FAKULT prof. Ing. Milan Pavelek, CSc. Brno 2013
 Vysoké učení technické v Brně Fakulta strojního inženýrství, Energetický ústav Odbor termomechaniky a techniky prostředí TERMOMECHANIKA PRO STUDENTY STROJNÍCH FAKULT prof. Ing. Milan Pavelek, CSc. Brno
Vysoké učení technické v Brně Fakulta strojního inženýrství, Energetický ústav Odbor termomechaniky a techniky prostředí TERMOMECHANIKA PRO STUDENTY STROJNÍCH FAKULT prof. Ing. Milan Pavelek, CSc. Brno
Termodynamika 2. UJOP Hostivař 2014
 Termodynamika 2 UJOP Hostivař 2014 Skupenské teplo tání/tuhnutí je (celkové) teplo, které přijme pevná látka při přechodu na kapalinu během tání nebo naopak Značka Veličina Lt J Nedochází při něm ke změně
Termodynamika 2 UJOP Hostivař 2014 Skupenské teplo tání/tuhnutí je (celkové) teplo, které přijme pevná látka při přechodu na kapalinu během tání nebo naopak Značka Veličina Lt J Nedochází při něm ke změně
dq = 0 T dq ds = definice entropie T Entropie Při pohledu na Clausiův integrál pro vratné cykly :
 Entropie Při pohledu na Clausiův integrál pro vratné cykly : si dříve či později jistě uvědomíme, že nulová hodnota integrálu nějaké veličiny při kruhovém termodynamickém procesu je základním znakem toho,
Entropie Při pohledu na Clausiův integrál pro vratné cykly : si dříve či později jistě uvědomíme, že nulová hodnota integrálu nějaké veličiny při kruhovém termodynamickém procesu je základním znakem toho,
Fenomenologická termodynamika
 Atkins 1 Fenomenologická termodynamika Popisuje makroskopický stav Neuvažuje vnitřní stavbu hmoty okolí termodynamická soustava (systém) okolí Vnitřní parametry teplota T vnitřní energie U tlak p látková
Atkins 1 Fenomenologická termodynamika Popisuje makroskopický stav Neuvažuje vnitřní stavbu hmoty okolí termodynamická soustava (systém) okolí Vnitřní parametry teplota T vnitřní energie U tlak p látková
VNITŘNÍ ENERGIE. Mgr. Jan Ptáčník - GJVJ - Fyzika - 2. ročník - Termika
 VNITŘNÍ ENERGIE Mgr. Jan Ptáčník - GJVJ - Fyzika - 2. ročník - Termika Zákon zachování energie Ze zákona zachování mechanické energie platí: Ek + Ep = konst. Ale: Vnitřní energie tělesa Každé těleso má
VNITŘNÍ ENERGIE Mgr. Jan Ptáčník - GJVJ - Fyzika - 2. ročník - Termika Zákon zachování energie Ze zákona zachování mechanické energie platí: Ek + Ep = konst. Ale: Vnitřní energie tělesa Každé těleso má
Popis fyzikálního chování látek
 Popis fyzikálního chování látek pro vysvětlení noha fyzikálních jevů již nevystačíe s pouhý echanický popise Terodynaika oblast fyziky, která kroě echaniky zkouá vlastnosti akroskopických systéů, zejéna
Popis fyzikálního chování látek pro vysvětlení noha fyzikálních jevů již nevystačíe s pouhý echanický popise Terodynaika oblast fyziky, která kroě echaniky zkouá vlastnosti akroskopických systéů, zejéna
Cvičení z termomechaniky Cvičení 3.
 Příklad 1 1kg plynu při izobarickém ohřevu o 710 [ C] z teploty 40[ C] vykonal práci 184,5 [kj.kg -1 ]. Vypočítejte molovou hmotnost plynu, množství přivedeného tepla a změnu vnitřní energie ΔT = 710 [K]
Příklad 1 1kg plynu při izobarickém ohřevu o 710 [ C] z teploty 40[ C] vykonal práci 184,5 [kj.kg -1 ]. Vypočítejte molovou hmotnost plynu, množství přivedeného tepla a změnu vnitřní energie ΔT = 710 [K]
soustava - část prostoru s látkovou náplní oddělená od okolí skutečnými nebo myšlenými stěnami okolí prostor vně uvažované soustavy
 Soustava soustava - část prostoru s látkovou náplní oddělená od okolí skutečnými nebo myšlenými stěnami okolí prostor vně uvažované soustavy Okolí Hraniční plocha Soustava Soustava Rozdělení podle vztahu
Soustava soustava - část prostoru s látkovou náplní oddělená od okolí skutečnými nebo myšlenými stěnami okolí prostor vně uvažované soustavy Okolí Hraniční plocha Soustava Soustava Rozdělení podle vztahu
Nultá věta termodynamická
 TERMODYNAMIKA Nultá věta termodynamická 2 Práce 3 Práce - příklady 4 1. věta termodynamická 5 Entalpie 6 Tepelné kapacity 7 Vnitřní energie a entalpie ideálního plynu 8 Výpočet tepla a práce 9 Adiabatický
TERMODYNAMIKA Nultá věta termodynamická 2 Práce 3 Práce - příklady 4 1. věta termodynamická 5 Entalpie 6 Tepelné kapacity 7 Vnitřní energie a entalpie ideálního plynu 8 Výpočet tepla a práce 9 Adiabatický
Vnitřní energie, práce, teplo.
 Vnitřní energie, práce, teplo. Vnitřní energie tělesa Částice uvnitř látek mají kinetickou a potenciální energii. Je to energie uvnitř tělesa, proto ji nazýváme vnitřní energie. Značíme ji písmenkem U
Vnitřní energie, práce, teplo. Vnitřní energie tělesa Částice uvnitř látek mají kinetickou a potenciální energii. Je to energie uvnitř tělesa, proto ji nazýváme vnitřní energie. Značíme ji písmenkem U
Zpracování teorie 2010/11 2011/12
 Zpracování teorie 2010/11 2011/12 Cykly Děje Proudění (turbíny) počet v: roce 2010/11 a roce 2011/12 Chladící zařízení (nakreslete cyklus a nakreslete schéma)... zde 13 + 2 (15) Izochorický děj páry (nakreslit
Zpracování teorie 2010/11 2011/12 Cykly Děje Proudění (turbíny) počet v: roce 2010/11 a roce 2011/12 Chladící zařízení (nakreslete cyklus a nakreslete schéma)... zde 13 + 2 (15) Izochorický děj páry (nakreslit
3.1. Newtonovy zákony jsou základní zákony klasické (Newtonovy) mechaniky
 3. ZÁKLADY DYNAMIKY Dynamika zkoumá příčinné souvislosti pohybu a je tedy zdůvodněním zákonů kinematiky. K pojmům používaným v kinematice zavádí pojem hmoty a síly. Statický výpočet Dynamický výpočet -
3. ZÁKLADY DYNAMIKY Dynamika zkoumá příčinné souvislosti pohybu a je tedy zdůvodněním zákonů kinematiky. K pojmům používaným v kinematice zavádí pojem hmoty a síly. Statický výpočet Dynamický výpočet -
Vnitřní energie, práce a teplo
 Vnitřní energie, práce a teplo Zákon zachování mechanické energie V izolované soustavě těles je v každém okamžiku úhrnná mechanická energie stálá. Mění se navzájem jen potenciální energie E p a kinetická
Vnitřní energie, práce a teplo Zákon zachování mechanické energie V izolované soustavě těles je v každém okamžiku úhrnná mechanická energie stálá. Mění se navzájem jen potenciální energie E p a kinetická
Cvičení z termodynamiky a statistické fyziky
 Cvičení termodynamiky a statistické fyiky 1Nechť F(x, y=xe y Spočtěte F/ x, F/, 2 F/ x 2, 2 F/ x, 2 F/ x, 2 F/ x 2 2 Bud dω = A(x, ydx+b(x, ydy libovolná diferenciální forma(pfaffián Ukažte, ževpřípadě,žedωjeúplnýdiferenciál(existujefunkce
Cvičení termodynamiky a statistické fyiky 1Nechť F(x, y=xe y Spočtěte F/ x, F/, 2 F/ x 2, 2 F/ x, 2 F/ x, 2 F/ x 2 2 Bud dω = A(x, ydx+b(x, ydy libovolná diferenciální forma(pfaffián Ukažte, ževpřípadě,žedωjeúplnýdiferenciál(existujefunkce
Termochemie. Katedra materiálového inženýrství a chemie A Ing. Martin Keppert Ph.D.
 Termochemie Ing. Martin Keppert Ph.D. Katedra materiálového inženýrství a chemie keppert@fsv.cvut.cz A 329 http://tpm.fsv.cvut.cz/ Termochemie: tepelné jevy při chemických reakcích Chemická reakce: CH
Termochemie Ing. Martin Keppert Ph.D. Katedra materiálového inženýrství a chemie keppert@fsv.cvut.cz A 329 http://tpm.fsv.cvut.cz/ Termochemie: tepelné jevy při chemických reakcích Chemická reakce: CH
Digitální učební materiál. III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Příjemce podpory Gymnázium, Jevíčko, A. K.
 Digitální učební materiál Číslo projektu CZ.1.07/1.5.00/34.0802 Název projektu Zkvalitnění výuky prostřednictvím ICT Číslo a název šablony klíčové aktivity III/2 Inovace a zkvalitnění výuky prostřednictvím
Digitální učební materiál Číslo projektu CZ.1.07/1.5.00/34.0802 Název projektu Zkvalitnění výuky prostřednictvím ICT Číslo a název šablony klíčové aktivity III/2 Inovace a zkvalitnění výuky prostřednictvím
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 15.03.2013 Číslo DUMu: VY_32_INOVACE_11_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné
 Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 15.03.2013 Číslo DUMu: VY_32_INOVACE_11_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 15.03.2013 Číslo DUMu: VY_32_INOVACE_11_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
8 Elasticita kaučukových sítí
 8 Elasticita kaučukových sítí Elastomerní polymerní látky (např. kaučuky) tvoří ze / chemické příčné vazby a / fyzikální uzly. Vyznačují se schopností deformovat se již malou silou nejméně o 00 % své původní
8 Elasticita kaučukových sítí Elastomerní polymerní látky (např. kaučuky) tvoří ze / chemické příčné vazby a / fyzikální uzly. Vyznačují se schopností deformovat se již malou silou nejméně o 00 % své původní
Termomechanika. Doc. Dr. RNDr. Miroslav HOLEČEK
 ermomechanika. přednáška Doc. Dr. RNDr. Miroslav HOLEČEK Upozornění: ato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím citovaných
ermomechanika. přednáška Doc. Dr. RNDr. Miroslav HOLEČEK Upozornění: ato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím citovaných
IDEÁLNÍ PLYN 14. TEPELNÉ STROJE, PRVNÍ A DRUHÝ TERMODYNAMICKÝ ZÁKON
 IDEÁLNÍ PLYN 14. TEPELNÉ STROJE, PRVNÍ A DRUHÝ TERMODYNAMICKÝ ZÁKON Autor: Ing. Eva Jančová DESS SOŠ a SOU spol. s r. o. TEPELNÝ STROJ Tepelný stroj je stroj, který pracuje na základě prvního termodynamického
IDEÁLNÍ PLYN 14. TEPELNÉ STROJE, PRVNÍ A DRUHÝ TERMODYNAMICKÝ ZÁKON Autor: Ing. Eva Jančová DESS SOŠ a SOU spol. s r. o. TEPELNÝ STROJ Tepelný stroj je stroj, který pracuje na základě prvního termodynamického
Termodynamika - Formy energie
 Termodynamika - Formy energie Energetické přeměny při chemických a fyzikálních procesech, přenos energie mezi látkami, vzájemné přeměny různých druhů energie, Rozhoduje pouze počáteční a konečný stav Nezávisí
Termodynamika - Formy energie Energetické přeměny při chemických a fyzikálních procesech, přenos energie mezi látkami, vzájemné přeměny různých druhů energie, Rozhoduje pouze počáteční a konečný stav Nezávisí
SVOBODA, E., BAKULE, R.
 Termodynamika 1. Termodynamika 2. Termodynamická soustava 3. Termodynamický stav 4. Veličiny: látkové množství, molární veličina, vnitřní energie, práce v termodynamice 5. Termodynamické principy: nultý
Termodynamika 1. Termodynamika 2. Termodynamická soustava 3. Termodynamický stav 4. Veličiny: látkové množství, molární veličina, vnitřní energie, práce v termodynamice 5. Termodynamické principy: nultý
Termodynamika. Martin Keppert. Katedra materiálového inženýrství a chemie
 Termodynamika Martin Keppert Katedra materiálového inženýrství a chemie keppert@fsv.cvut.cz http://tpm.fsv.cvut.cz/ Co to je termodynamika Nauka o energii, jejích formách a přenosu Energie schopnost systému
Termodynamika Martin Keppert Katedra materiálového inženýrství a chemie keppert@fsv.cvut.cz http://tpm.fsv.cvut.cz/ Co to je termodynamika Nauka o energii, jejích formách a přenosu Energie schopnost systému
ÚVODNÍ POJMY, VNITŘNÍ ENERGIE, PRÁCE A TEPLO POJMY K ZOPAKOVÁNÍ. Testové úlohy varianta A
 Škola: Autor: DUM: Vzdělávací obor: Tematický okruh: Téma: Masarykovo gymnázium Vsetín Mgr. Jitka Novosadová MGV_F_SS_3S3_D08_Z_OPAK_T_Uvodni_pojmy_vnitrni_energie _prace_teplo_t Člověk a příroda Fyzika
Škola: Autor: DUM: Vzdělávací obor: Tematický okruh: Téma: Masarykovo gymnázium Vsetín Mgr. Jitka Novosadová MGV_F_SS_3S3_D08_Z_OPAK_T_Uvodni_pojmy_vnitrni_energie _prace_teplo_t Člověk a příroda Fyzika
Fluktuace termodynamických veličin
 Kvantová a statistická fyzika (Termodynamika a statistická fyzika Fluktuace termodynamických veličin Fluktuace jsou odchylky hodnot fyzikálních veličin od svých středních (rovnovážných hodnot. Mají původ
Kvantová a statistická fyzika (Termodynamika a statistická fyzika Fluktuace termodynamických veličin Fluktuace jsou odchylky hodnot fyzikálních veličin od svých středních (rovnovážných hodnot. Mají původ
TERMOCHEMIE, TERMOCHEMICKÉ ZÁKONY, TERMODYNAMIKA, ENTROPIE
 TERMOCHEMIE, TERMOCHEMICKÉ ZÁKONY, TERMODYNAMIKA, ENTROPIE Chemická reakce: Jestliže se za vhodných podmínek vyskytnou 2 látky schopné spolu reagovat, nastane chemická reakce. Při ní z výchozích látek
TERMOCHEMIE, TERMOCHEMICKÉ ZÁKONY, TERMODYNAMIKA, ENTROPIE Chemická reakce: Jestliže se za vhodných podmínek vyskytnou 2 látky schopné spolu reagovat, nastane chemická reakce. Při ní z výchozích látek
TERMODYNAMIKA 1. AXIOMATICKÁ VÝSTAVBA KLASICKÉ TD Základní pojmy
 ERMODYNAMIKA. AXIOMAICKÁ ÝSABA KLASICKÉ D.. Základní ojmy Soustava (systém) je část rostoru od okolí oddělený stěnou uzavřená - stěna brání výměně hmoty mezi soustavou a okolím vers. otevřená (uzavřená
ERMODYNAMIKA. AXIOMAICKÁ ÝSABA KLASICKÉ D.. Základní ojmy Soustava (systém) je část rostoru od okolí oddělený stěnou uzavřená - stěna brání výměně hmoty mezi soustavou a okolím vers. otevřená (uzavřená
TERMODYNAMIKA 1. AXIOMATICKÁ VÝSTAVBA KLASICKÉ TD Základní pojmy
 ERMODYNAMIKA. AXIOMAICKÁ ÝSABA KLASICKÉ D.. Základní ojmy Soustava (systém) je část rostoru od okolí oddělený stěnou uzavřená - stěna brání výměně hmoty mezi soustavou a okolím vers. otevřená (uzavřená
ERMODYNAMIKA. AXIOMAICKÁ ÝSABA KLASICKÉ D.. Základní ojmy Soustava (systém) je část rostoru od okolí oddělený stěnou uzavřená - stěna brání výměně hmoty mezi soustavou a okolím vers. otevřená (uzavřená
Termodynamika par. Rovnovážný diagram látky 1 pevná fáze, 2 kapalná fáze, 3 plynná fáze
 ermodynamika par Fázové změny látky: Přivádíme-li pevné fázi látky teplo, dochází při jisté teplotě a tlaku ke změně pevné fáze na fázi kapalnou (tání) Jestliže spojíme body tání při různých tlacích, získáme
ermodynamika par Fázové změny látky: Přivádíme-li pevné fázi látky teplo, dochází při jisté teplotě a tlaku ke změně pevné fáze na fázi kapalnou (tání) Jestliže spojíme body tání při různých tlacích, získáme
Práce, energie a další mechanické veličiny
 Práce, energie a další mechanické veličiny Úvod V předchozích přednáškách jsme zavedli základní mechanické veličiny (rychlost, zrychlení, síla, ) Popis fyzikálních dějů usnadňuje zavedení dalších fyzikálních
Práce, energie a další mechanické veličiny Úvod V předchozích přednáškách jsme zavedli základní mechanické veličiny (rychlost, zrychlení, síla, ) Popis fyzikálních dějů usnadňuje zavedení dalších fyzikálních
Molekulová fyzika a termodynamika
 Molekulová fyzika a termodynamika Molekulová fyzika a termodynamika Úvod, vnitřní energie soustavy, teplo, teplota, stavová rovnice ideálního plynu Termodynamické zákony, termodynamické děje Teplotní a
Molekulová fyzika a termodynamika Molekulová fyzika a termodynamika Úvod, vnitřní energie soustavy, teplo, teplota, stavová rovnice ideálního plynu Termodynamické zákony, termodynamické děje Teplotní a
Rovnováha Tepelná - T všude stejná
 Fázové heterogenní rovnováhy Fáze = homogenní část soustavy, oddělná fyzickým rozhraním, na rozhraní se vlastnosti mění skokem Rovnováha Tepelná - T všude stejná Mechanická - p všude stejný Chemická -
Fázové heterogenní rovnováhy Fáze = homogenní část soustavy, oddělná fyzickým rozhraním, na rozhraní se vlastnosti mění skokem Rovnováha Tepelná - T všude stejná Mechanická - p všude stejný Chemická -
TERMODYNAMICKÁ ROVNOVÁHA, PASIVNÍ A AKTIVNÍ TRANSPORT
 TERMODYNAMICKÁ ROVNOVÁHA, PASIVNÍ A AKTIVNÍ TRANSPORT Termodynamická rovnováha systému je charakterizována absencí spontánních procesů. Poněvadž práce může být konána pouze systémem, který směřuje ke spontánní
TERMODYNAMICKÁ ROVNOVÁHA, PASIVNÍ A AKTIVNÍ TRANSPORT Termodynamická rovnováha systému je charakterizována absencí spontánních procesů. Poněvadž práce může být konána pouze systémem, který směřuje ke spontánní
VÝUKOVÝ MATERIÁL. 0301 Ing. Yvona Bečičková Tematická oblast
 VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
Fyzikální chemie. ochrana životního prostředí analytická chemie chemická technologie denní. Platnost: od 1. 9. 2009 do 31. 8. 2013
 Učební osnova předmětu Fyzikální chemie Studijní obor: Aplikovaná chemie Zaměření: Forma vzdělávání: Celkový počet vyučovacích hodin za studium: Analytická chemie Chemická technologie Ochrana životního
Učební osnova předmětu Fyzikální chemie Studijní obor: Aplikovaná chemie Zaměření: Forma vzdělávání: Celkový počet vyučovacích hodin za studium: Analytická chemie Chemická technologie Ochrana životního
Teorie transportu plynů a par polymerními membránami. Doc. Ing. Milan Šípek, CSc. Ústav fyzikální chemie VŠCHT Praha
 Teorie transportu plynů a par polymerními membránami Doc. Ing. Milan Šípek, CSc. Ústav fyzikální chemie VŠCHT Praha Úvod Teorie transportu Difuze v polymerních membránách Propustnost polymerních membrán
Teorie transportu plynů a par polymerními membránami Doc. Ing. Milan Šípek, CSc. Ústav fyzikální chemie VŠCHT Praha Úvod Teorie transportu Difuze v polymerních membránách Propustnost polymerních membrán
TEPLO A TEPELNÉ STROJE
 TEPLO A TEPELNÉ STROJE STROJE A ZAŘÍZENÍ ČÁSTI A MECHANISMY STROJŮ ENERGIE,, PRÁCE A TEPLO Energie - z řeckého energia: aktivita, činnost. Ve strojírenské praxi se projevuje jako dominantní energie mechanická.
TEPLO A TEPELNÉ STROJE STROJE A ZAŘÍZENÍ ČÁSTI A MECHANISMY STROJŮ ENERGIE,, PRÁCE A TEPLO Energie - z řeckého energia: aktivita, činnost. Ve strojírenské praxi se projevuje jako dominantní energie mechanická.
ZÁKLADY STAVEBNÍ FYZIKY
 ZÁKLADY STAVEBNÍ FYZIKY Doc.Ing.Václav Kupilík, CSc. První termodynamická věta představuje zákon o zachování energie. Podle tohoto zákona nemůže energie samovolně vznikat nebo zanikat, ale může se pouze
ZÁKLADY STAVEBNÍ FYZIKY Doc.Ing.Václav Kupilík, CSc. První termodynamická věta představuje zákon o zachování energie. Podle tohoto zákona nemůže energie samovolně vznikat nebo zanikat, ale může se pouze
Termomechanika 8. přednáška Doc. Dr. RNDr. Miroslav Holeček
 Termomechanika 8. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Termomechanika 8. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Zákony ideálního plynu
 5.2Zákony ideálního plynu 5.1.1 Ideální plyn 5.1.2 Avogadrův zákon 5.1.3 Normální podmínky 5.1.4 Boyleův-Mariottův zákon Izoterma 5.1.5 Gay-Lussacův zákon 5.1.6 Charlesův zákon 5.1.7 Poissonův zákon 5.1.8
5.2Zákony ideálního plynu 5.1.1 Ideální plyn 5.1.2 Avogadrův zákon 5.1.3 Normální podmínky 5.1.4 Boyleův-Mariottův zákon Izoterma 5.1.5 Gay-Lussacův zákon 5.1.6 Charlesův zákon 5.1.7 Poissonův zákon 5.1.8
VÝUKA CHEMIE. Clausiovo kritérium a extenzivní podmínky termodynamické rovnováhy
 VÝUKA CHEMIE Chemické listy, v souladu s celosvětovým trendem v oblasti informatiky, budou postupně stále více přecházet na elektronickou formu publikování. V současnosti si lze na internetové adrese http://staff.vscht.cz/chem_listy
VÝUKA CHEMIE Chemické listy, v souladu s celosvětovým trendem v oblasti informatiky, budou postupně stále více přecházet na elektronickou formu publikování. V současnosti si lze na internetové adrese http://staff.vscht.cz/chem_listy
Katalýza / inhibice. Katalýza. Katalyzátory. Inhibitory. katalyzátor: Faktory ovlivňující rychlost chemické reakce. Homogenní
 Katalýza Katalýza / inhibice Homogenní acidobazická (katalyzátor: H + nebo OH - ) autokatalýza (katalyzátor: produkt reakce) selektivní (katalyzátor: enzym) Ovlivnění rychlosti chemické reakce pomocí katalyzátoru
Katalýza Katalýza / inhibice Homogenní acidobazická (katalyzátor: H + nebo OH - ) autokatalýza (katalyzátor: produkt reakce) selektivní (katalyzátor: enzym) Ovlivnění rychlosti chemické reakce pomocí katalyzátoru
Poznámky k cvičením z termomechaniky Cvičení 4. Postulát, že nedochází k výměně tepla má dopad na první větu termodynamickou
 Adiabatická změna: Při adiabatickém ději nedochází k výměně tepla s okolím, tedy platí: dq = 0; dq = 0 () Postulát, že nedochází k výměně tepla má dopad na první větu termodynamickou Pro její první tvar:
Adiabatická změna: Při adiabatickém ději nedochází k výměně tepla s okolím, tedy platí: dq = 0; dq = 0 () Postulát, že nedochází k výměně tepla má dopad na první větu termodynamickou Pro její první tvar:
Osnova pro předmět Fyzikální chemie II magisterský kurz
 Osnova pro předmět Fyzikální chemie II magisterský kurz Časový a obsahový program přednášek Týden Obsahová náplň přednášky Pozn. Stavové chování tekutin 1,2a 1, 2a Molekulární přístup kinetická teorie
Osnova pro předmět Fyzikální chemie II magisterský kurz Časový a obsahový program přednášek Týden Obsahová náplň přednášky Pozn. Stavové chování tekutin 1,2a 1, 2a Molekulární přístup kinetická teorie
VZOROVÝ ZKOUŠKOVÝ TEST z fyzikální chemie( 1
 VZOROVÝ ZKOUŠKOVÝ TEST z fyzikální chemie(www.vscht.cz/fch/zktesty/) 1 Zkouškový test z FCH I, 10. srpna 2015 Vyplňuje student: Příjmení a jméno: Kroužek: Upozornění: U úloh označených ikonou uveďte výpočet
VZOROVÝ ZKOUŠKOVÝ TEST z fyzikální chemie(www.vscht.cz/fch/zktesty/) 1 Zkouškový test z FCH I, 10. srpna 2015 Vyplňuje student: Příjmení a jméno: Kroužek: Upozornění: U úloh označených ikonou uveďte výpočet
