POUŽITÍ ORGANOSLOUČENIN PŘECHODNÝCH KOVŮ V KATALÝZE
|
|
|
- Daniel Mach
- před 7 lety
- Počet zobrazení:
Transkript
1 POUŽITÍ ORGANOSLOUČENIN PŘECHODNÝCH KOVŮ V KATALÝZE Komplexy přechodných kovů jsou v současné době velmi intenzivně využívány při řadě katalytických procesů nejen v chemickém výzkumu, ale i v průmyslové praxi. Následují pouze základní reakce s průmyslovou aplikací. 1. Polymerizace a oligomerizace alkenů a alkinů Při studiu vysokotlaké inserce ethylenu do vazby Al-C při přípravě alkylhlinitých sloučenin s dlouhými řetězci zjistil K.Ziegler, že za přítomnosti solí některých přechodných kovů dochází za relativně mírných podmínek (nízké teploty a tlaky) k oligomeraci, ev. polymerizaci ethylenu. Jako nejvhodnější se ukázaly katalyzátory na bázi TiCl 4. Prvním krokem reakce je vznik aktivního katalyzátoru, tj. reakce TiCl 4 + Et 3 Al EtTiCl 3 + Et 2 A1C1 Titan jako centrální atom je pak reakčním centrem polymerizačního procesu Dochází tedy k inserci molekuly ethylenu (migrující částicí je σ-ethyl) a prodloužení řetězce o skupinu CH 2 -CH 2. Inserce pak
2 může pokračovat další koordinací ethylenu atd. Ukončení tvorby polymeru může proběhnout buď β-eliminací přičemž vznikající Ti-hydrid může podléhat další inserční reakci nebo působením H 2 (opět za vzniku hydridokomplexu) ukončíme polymerační proces Při polymeraci propylenu je situace složitější. G. Natta zjistil, že polymerace propylenu může probíhat na různých katalyzátorech, odvozených nejen od TiCl 4, ale i TiCl 3 a VCl 4 (do Nattova objevu byl propylen považován za nepolymerizovatelný). Dle použitého katalyzátoru a reakčních podmínek mohou vznikat polymery
3 Katalýza na TiCl 3 -Et 3 Al katalyzátoru je heterogenní, TiCl 4 ev. VCl 4 -Et 3 Al jsou katalyzátory homogenní. Při heterogenní katalýze (experimentálně méně výhodné) je vznikající polymer izotaktický, krystalický, tedy z praktického hlediska široce použitelný. Ostatní (homogenní) katalyzátory poskytují směsi syndiotaktického a ataktického polymeru olejovité až voskovité konsistence. Podíl jednotlivých izomerů lze ovlivnit jednak reakčními podmínkami (např. teplotou, kdy na VC1 3 za vyšších teplot vzniká ataktický polymer), jednak přítomností různých typů ligandů na centrálním atomu titanu. Hlavní faktory ovlivňující vznik toho kterého izomeru jsou: a) způsob přechodu η 2 -vazby na σ-vazbu b) způsob koordinace η 2 -propylenu na centrální atom K přechodu (inserci) η 2 -vazby na σ-vazbu může docházet - podle typu uhlíkového atomu vázaného na centrální atom kovu - dvojím způsobem: buď primární inserci
4 nebo sekundární insercí Methylová skupina na α či β uhlíku ovlivňuje totiž vznik izo či syndiotaktického polymeru, protože koordinace další molekuly propylenu může proběhnout čtyřmi způsoby: V případě (a) a (b), kdy methylová skupina je na β -uhlíku, vzniká izotaktický polymer, případy (c) a (d) vedou k syndiotaktickému polymeru. Projevují se tedy sférické vlivy α- methylových skupin. Pro polymeraci propylenu byl navržen i jiný, tzv. karbenový mechanismus. Tento postup předpokládá α-eliminaci H atomu a vznik karbonového intermediátu
5 Následuje koordinace propylenu a vznik metallacyklobutanu. Vodíkový atom se posléze váže zpět na původní uhlíkový atom a resultuje alkylderivát o propylenovou jednotku delší K. Ziegler a G. Natta obdrželi za svoje výzkumy na tomto poli v r Nobelovu cenu. Na katalyzátorech založených na bázi Ni-derivátů (NiCl 2 nebo Ni(acac) 2 + Et 3 AI) dochází většinou pouze k dimerizaci ethylenu a vzniku 1-butenu. Základem reakce je vznik nestálého σ-etni(acac) 2 Tuto sloučeninu je možno stabilizovat dalším vhodným ligandem, např. PPh 3. Jinak dochází snadno k (β-eliminaci a vzniku hydridu. Tato reakce je vratná. Insercí další molekuly ethylenu vzniká σ-butyl komplex, z něhož resultuje β-eliminací 1-buten : Složitější je dimerizace propylenu, protože může docházet jednak k primární, jednak k sekundární inserci. Další molekula propylenu po
6 inserci může poskytovat různě větvené šestiuhlíkové řetězce, které (β-eliminací poskytují celkem šest možných izomerů hexenu. Polymerizace ev. oligomerizace alkinů je známa už od r (Reppeho syntézy), l samotný acetylen je reaktivní sloučeninou, ochotně tvoří komplexy a může podléhat řadě katalyzovaných reakcí (viz str. 52). Nejdůležitějšími reakcemi jsou jeho cyklizace. Na katalyzátorech Ni(CO) 4 ev. Ni(CN) dochází při teplotách K a tlacích 1,5-2 MPa k cyklizaci na cyklooktatetraen Je-li v katalyzátoru centrální atom Ni v tetraedrickém, ev. oktaedrickém uspořádání a jeden z ligandů je PPh 3 (ostatní ligandy mohou být CO, acac, salicylaldehyd), dochází k cyklotrimerizaci na benzen Reakci lze uskutečnit i se substituovanými acetyleny. Tak na palladiových katalyzátorech s vazbami Pd-Cl může docházet k inserčním reakcím a po dalších mezistupních pak rezultují substituované cyklobutadieny a benzeny. Za přítomnosti CO jako ligandu může ovšem docházet ke vzniku chinonů, metallacyklopentadienů aj. Také polymerizace dienů byla velmi intenzivně studována. Výzkum byl motivován snahou po syntéze umělé pryže. Dříve navrhované organolithné katalyzátory byly zcela vytlačeny jednak
7 Zieglerovými katalyzátory, jednak katalyzátory na bázi komplexů Ni, Co, ale i Rh aj. Podle volby katalyzátoru i různých druhů ligandu lze butadien dimerizovat na Na TiCl 4 - AlkAlCl 2 lze butadien trimerizovat na cyklododekatrien Polymerizace butadienů probíhá vždy přes mezistupně η 3 -allylkomplexů, které přecházejí na σ- allylderiváty a další insercí η 3 -allylderivátů dochází k
8 polymerizaci. Podobně probíhá i nejdůležitější průmyslově aplikovaná reakce - polymerizace izoprenu (2-methyl butadien-1,3). 2. Syntézy s oxidem uhelnatým Oxid uhelnatý je jednou z nejdůležitějších výchozích surovin průmyslové chemie. Navzdory svému nenasycenému charakteru je za běžných podmínek málo reaktivní, proto vyžaduje určitou aktivaci. Ta je realizována přechodnými kovy, s nimiž oxid uhelnatý vytváří ochotně karbonyly, podléhající pak dalším reakcím Hydroformylace olefinů (tzv. oxoproces) Základní reakci přestavuje rovnice Katalyzátory na bázi kobaltu poskytují směs aldehydů s lineárními a rozvětvenými řetězci, rhodiové katalyzátory upřednostňují řetězce lineární. Proto jim je v současnosti dávána přednost. Mechanismus reakce byl objasněn v r (O.Roelen) a probíhá následovně : a) b) koordinačně nenasycený HCo(CO) koordinuje molekulu olefinu
9 c) následuje inserční reakce d) koordinačně nenasycený komplex váže molekulu CO e) f) Působením H 2 dochází k oxidativní adici g) a reduktivní eliminací se odštěpuje aldehyd za současné regenerace hydrido-trikarbonylu kobaltu
10 Katalýza na rhodiových katalyzátorech byla studována G. Wilkinsonem (1976) na komplexu RhH(CO) (PPh 3 ) 2. Hydroformylační reakce probíhá za normálního tlaku a při 290 K s podíly konverze olefinu až 90% a selektivní přeměnou na n-aldehyd. Mechanismus reakce je obdobný jako v případě katalýzy HCo(CO) 4. Světová produkce aldehydů Jako prekurzorů dalších organických derivátů se ročně pohybuje v milionech tun! 2.2 Karboxylace olefinu Tato reakce, vedoucí k syntéze karboxylových kyselin, jejich esterů ev. amidů se svým mechanismem podobá hydroformylační reakci. Také zde je katalyzátorem Co 2 (CO) 8, přesněji řečeno hydrido(tetrakarbonyl)kobaltu HCo(CO) 4. Na rozdíl od hydroformylace, kde se na reakci vedle olefinu a oxidu uhelnatého podílí vodík, při karboxylaci je vodík nahrazen nukleofilem, obsahujícím aktivní vodík : vodou, alkoholem či aminem. Reakce pak vede ke kyselinám, esterům, amidům. Schematicky můžeme psát Také při těchto reakcích vznikají při použití vyšších olefinů vedle lineárních též rozvětvené řetězce kyselin (esterů, amidů). Reakce je navíc komplikována tím, že při práci ve vodném prostředí dochází za přítomnosti katalyzátorů k nežádoucí boční reakci
11 a přítomnost vodíku umožňuje pak boční hydroformylační reakci. Karboxylace olefinů bývá realizována při teplotách K a tlaku MPa. Průmyslově se touto metodou vyrábí kyselina propionová, vyšší karboxylové kyseliny se získávají v prostředí methanolu, ev. ethanolu ve formě methyl či ethylesterů. Obdobou karboxylační reakce olefinů je průmyslová výroba akrylové kyseliny a jejích esterů karboxylací acetylenu; reakce je vlastně varietou Reppeho syntéz. Jako katalyzátor slouží Ni(CO) 4 Ve vodném roztoku může reakce za katalýzy Co 2 (CO) 8 probíhat i do druhého stupně za vzniku kyseliny jantarové HC=CH (acetylen) + 2 CO + 2 H 2 O -- HOOC-CH 2 CH 2 -COOH 2.3 Karboxylace methanolu - syntéza kyseliny octové Kyselina octová s roční celosvětovou produkcí převyšující 5 milionů tun představuje jednu z nejdůležitějších surovin pro přípravu vinylacetátu, acetátů celulozy, tereftalové kyseliny, esterů kyseliny octové, chlorooctové kyseliny atd. Pochopitelně zdaleka nestačí pro takovou produkci fermentativní oxidace ethanolu, ani oxidace acetaldehydu získávaného katalytickou hydratací acetylenu, ani acetaldehydu získávaného Wackerovou metodou (viz dále). Byly vypracovány dva postupy karboxylace methanolu (jak methanol, tak oxid uhelnatý lze pohodlně získat z uhlí). Reakce probíhá podle sumární rovnice CH 3 OH + CO - CH 3 COOH
12 Starší, dnes už neužívaný postup používal jako katalyzátor komplexy Co I a směs CH 3 OH a CO reagovala až při teplotách 480 K a tlaku 70 Mpa (nehledě na korozivní vlastnosti reagentů). Novější postup, pracující za podstatně mírnějších podmínek (450 K, 0,1-4 MPa) s vysokými výtěžky (99% počítáno na methanol) používá jako katalyzátor směs Ph 4 As + [Rh(CO) 2 I 2 ] - + Mel. Reakční schéma (prokázané podrobným studiem dílčích mechanismů) lze psát hydrolýzou CH 3 COI + H 2 O CH 3 COOH + HI Reakcí in situ se regeneruje methyljodid CH 3 OH + HI CH 3 I + H 2 O V alternativním mechanismu může docházet místo reduktivní eliminace CH 3 COI přímo k hydrolýze acetylovaného Rh III komplexu.
13 2.4 Reakce vodního plynu Při reakci vodní páry s rozžhaveným koksem vzniká tzv. vodní plyn C + H 2 O CO + H 2 Pro plynulý chod endothermní reakce je potřebí vhánět vzduch, proto vodní plyn (nebo též syntézní plyn) obsahuje také asi 5% CO 2 a 6% N 2. Vodní plyn je používán jako palivo, v poslední době však je důležitým výchozím materiálem pro výrobu celé rady látek. Už v létech F.Fischer a H.Tropsch vypracovali postup, kdy na heterogenních katalyzátorech (Fe + Cu + KOH + CaO) docházelo k syntéze kapalných směsí alkoholů, alkenů, alkanů a vody Složení produktů lze ovlivnit typem katalyzátoru, teplotou a tlakem. Fischerův a Tropschův proces byl používán v době 2. světové války v Německu při nedostatku přírodních kapalných paliv (ropa), v poslední době je intenzivně studován díky zdražení ropy jako alternativní zdroj tekutých paliv (zásoby použitelného uhlí se odhadují na zhruba 250 let). Hydrogenace oxidu uhelnatého probíhá dvěma způsoby. Při prvém dochází ke štěpení vazby C-O (tato reakce je připisována Fischerově-Tropschově reakci), při druhém zůstává vazba C - O zachována, příkladem této reakce je syntéza ethylenglykolu. Mechanismus vzniku uhlovodíků je dosud nejasný. Katalýza je heterogenní, probíhá na povrchu katalyzátoru, proto studium
14 mechanismů je velmi obtížné, odtud doslova kontraverzní názory na průběh reakce. Předpokládá se, že reakce probíhá přes mezistupně Klíčovým krokem hydrogenace je vznik formylkomplexu (jednoduchá inserce CO na vazbu M-H je termodynamicky nevýhodná, proto se uvažuje o inzerci za přítomnosti Lewisových kyselin), vlastní reakce pak předpokládá vznik hydridů M-H. Alternativní možnost uvažuje aktivaci vazby C-0 interakcí karbonylové skupiny s více atomy kovu - terminální CO má kratší vazbu než můstkový, ev. vázaný na tři kovové atomy. Na povrchu katalyzátoru vznikající karbonová skupina =CH 2 pak podléhá reakci s M-H za vzniku M-CH 3, která insercí =CH 2 prodlužuje řetězec na CH 2 CH 3 atd. Druhý typ reakce, zachovávající vazbu C-0, je syntéza ethylenglykolu. Reakce je katalyzována rhodiovými katalyzátory a i když probíhá za vysokých tlaků i teplot ( MPa, K), poskytuje až 70% výtěžky. Jako katalyzující intermediát byl identifikován [Rh 12 (CO) 30 ] 2-. Také zde je mechanismus reakce nejasný, předpokládá se, že reakce probíhá obdobně jako v případě reakce hydridu zirkonu s CO Také při syntetické výrobě methanolu (výchozí látka pro výrobu syntetické kyseliny octové a v novější době i benzinu) zůstává vazba CO zachována
15 Reakce probíhá na heterogenních katalyzátorech Cu-Zn-Cr 2 O 3 nebo Cu-Zn-Al 2 O 3. I když byly navrženy i homogenní katalyzátory (např. Co 2 (CO) 8 ), heterogenním katalyzátorům je dávána přednost pro rychlejší syntézu. Aktivní složkou katalyzátoru je měď (buď Cu I či Cu 0 ) aktivující oxid uhelnatý, a zinek, aktivující molekulární H 2. V poslední době je značná pozornost věnována homologizačním reakcím poskytujícím acetaldehyd a ethanol (vedle směsi vyšších alkoholů). 2.5 Oxidační reakce Oxidační reakce mají v organické chemii zcela mimořádný význam. Nejlacinější oxidace vzdušným kyslíkem probíhá většinou radikálově, s nízkou selektivitou (tj. s řadou vedlejších produktů) a lze ji jen obtížně kontrolovat. Při využití rozpustných komplexů přechodných kovů jako katalyzátorů se ve velké většině oxidačních reakcí ukázalo, že tyto komplexy působí jako inhibitory rozkladu peroxidu vodíku, který vzniká jako meziprodukt oxidačního procesu. Skutečným katalyzátorem oxidace ethylenu na acetaldehyd se ukázal být PdCl 2. Sumární rovnice této oxidace (tzv. Wackerův proces) lze psát následovně :
16 Základním předpokladem využití reakce je regenerace katalyzátoru, tj. oxidace elementárního palladia měďnatou solí v silně kyselém prostředí. Oxidační reakce probíhá následujícím mechanismem : a) reakce PdCl 4 2- s ethylenem za vzniku (η 2 -C 2 H 4 )Pd 2+ intermediátu b) nukleofilní atak H 2 O či OH - (buď substituce na Pd 2+ či atak na koordinovaný ethylen) c) inserce ethylenu do vazby Pd - OH d) přesmyk protonu a odštěpení aldehydu e) regenerační reakce
17 Pd + 4 Cl Cu > PdCl Cu + 4 Cu + + O H + > 4 Cu H 2 O I když výroba acetaldehydu touto metodou v současnosti ustoupila do pozadí díky levnější karbonylaci methanolu, stále ještě je tento postup průmyslově využíván (acetaldehyd potřebujeme pro výrobu syntetické kyseliny octové a acetanhydridu). 2.6 Hydrogenační reakce Hydrogenační reakce katalyzované komplexy přechodných kovů jsou nejčastěji studovanými reakcemi ze všech homogenních katalytických procesů. Roční počet studií jde do stovek. Nejdůkladněji byl prostudován proces hydrogenace olefinů. I když katalyzátorů byla navržena celá řada, nejlépe prozkoumanou reakcí je katalýza Wilkinsonovým katalyzátorem RhCl(PPh 3 ) 3. Hydrogenační reakci lze opět rozdělit na několik kroků : a) částečná disociace komplexu a adice rozpouštědla b) oxidativní adice H 2 c) substituce rozpouštědla alkenem za vzniku η 2 -komplexu
18 d) inserce vodíku za vzniku o-alkyl komplexu a adice rozpouštědla e) reduktivní eliminace a regenerace RhClS(PPh 3 ) 2 Reakci lze přisoudit i jiné, poněkud odlišné pořadí reakcí, v podstatě však jednotlivé meziprodukty zůstávají stejné. Hydrogenačních katalyzátorů byla studována celá řada, pro ukázku uvádíme alespoň některé : Za studia mechanismů těchto reakcí obdržel G.Wilkinson (vedle zásluh o studium ferrocenu) v r Nobelovu cenu.
19 Výhledy homogenní katalýzy Katalytické procesy jsou už z hlediska mechanismu reakce dosti podrobně prostudovány a jsou průmyslově využívány už několik desetiletí. V poslední době vystoupily některé průmyslové koncerny s novými výrobami dalších důležitých látek, ev. s efektivnějšími postupy výroby látek běžně vyráběných. Důležitým momentem těchto výrob je snaha o použití lacinějších výchozích surovin - místo drahé ropy se přechází na lacinější uhlí (tzv. C 1 -chemie). Většina těchto výrob je založena na homogenní katalýze organosloučeninami přechodných kovů. V některých případech byly popsány i jednotlivé kroky reakčního mechanismu, v jiných případech je průběh nejasný. V dalším proto uvádíme pouze sumární rovnice reakcí a příp. podmínky reakce a užitý katalyzátor. a) Výroba acetanhydridu ze syntézního plynu. Jednotlivé kroky reakce lze psát Jako aktivní katalyzátor je používán cis-[rh(co) 2 I 2 ] -, reakce probíhá při 450 K a 5,5 MPa. Acetanhydrid slouží k výrobě acetátu celulózy b) Výroba adipové kyseliny, resp. jejího dimethylesteru (dosud oxidací cyklohexanu na Co 2+ katalyzátorech) z butadienu. Reakce probíhá ve dvou krocích, je katalyzována Co 2 (CO) 8 a vyžaduje přítomnost heterocyklické terc. dusíkaté base, např. pyridinu
20 c) Aldehyd kyseliny máselné se vyrábí modifikovanou hydroformylační reakcí z propenu podle sumární rovnice Rhodiový katalyzátor má místo PPh 3 jiný ligand, totiž a je díky sulfonové skupině rozpustný ve vodě. Reakce probíhá ve dvoufázovém systému s produkcí až 95 % lineárního butanalu. Mechanismus reakce je obdobný běžné hydroformylační reakci. d) Diethylester kyseliny ěťavelové vzniká na palladiových katalyzátorech podle sumární rovnice Ethylnitrit se získává recyklováním unikajícího NO 2 NO + 1/ EtOH > 2 EtONO + H 2 O Reakční mechanismus předpokládá oxidativní adici RONO na Pd, v druhém kroku inserci CO. Podobně je možno vyrábět i methyl, ev. n-butylester. Diethyloxalát se používá jako prekurzor pro výrobu ethylenglykolu. e) Dimethylester kyseliny uhličité se vyrábí podle sumární rovnice
21 Reakce je dvoustupňová Dimethylkarbonát je používán místo fosgenu COC1 2 jako přenašeč CO při výrobě karbamátú reakcí s aminy, druhotně pak při výrobě isokyanátů, vznikajících štěpením karbamátú. f) Alkyl fenylkarbamáty lze jako prekurzory pro přípravu isokyanátů získat dvojím postupem : a) Oxidativní karbonylací aminů podle sumární rovnice Katalýza je heterogenní a reakce v ethanolu probíhá s 96% výtěžkem. β) Reduktivní karbonylací nitrobenzenu v methanolu při 430 K a 10 MPa za použití Ru 3 (CO) 12 katalyzátoru. Zde dochází nejprve k redukci nitrobenzenu na anilin, který podléhá oxidativní karbonylaci. Ru 3 (CO) 12 v průběhu reakce přechází na hydrid a elementární ruthenium. Jako vedlejší produkt vzniká difenylmočovina. g) Aromatické polykarbonáty lze získat bez použití fosgenu podle rovnice
22 Jako organická base se používá 2,2,6,6,N-pentamethyl piperidin, reakce je uskutečňována v homogenní fázi CH 2 Cl 2, Pd 0 je regenerováno oxidací komplexem bis(benzoinoximato)manganatým. h) Propionová kyselina se získává homologizační reakcí z kyseliny octové Jako promotor reakce slouží MeI, ev. HI, důležitým meziproduktem je acetyljodid, vznikající reakcí Reakce nemá jednoznačný průběh, vedle kyseliny propionové vzniká i kyselina máselná, valerová, ethan, propan a octan ethylnatý. i) Vinylacetát, dříve získávaný z acetylenu, později ethenu a kyseliny octové, se dnes vyrábí podle schématu CH 3 OH + 2 CH 3 COOH > 2 CH 3 COOCH H 2 0 CH 3 COOCH 3 + CO > (CH 3 CO) 2 O (CH 3 CO) 2 O+CH 3 COOCH 3 + CO + H 2 >CH 3 CH(OOCCH 3 ) 2 + CH 3 COOH
23 CH 3 CH(OOCCH 3 ) 2 > CH 2 =CHOOCCH 3 + CH 3 COOH Katalyzující prekurzory jsou RhCl 3, CH 3 I a promotorem je 3-pikolin. Jako katalyzující komplex byl identifikován [Rh(CO) 2 I 2 ] -. Reakce, probíhající při 420 K a 7 MPa má výtěžnost až 89%.
H H C C C C C C H CH 3 H C C H H H H H H
 Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Organická chemie (KATA) rychlý souhrn a opakování
 Organická chemie (KATA) rychlý souhrn a opakování Molekulové orbitaly hybridizace N a O Polarita vazby, induktivní efekt U kovalentní vazby mezi rozdílnými atomy, nebude elektronový pár oběma atomy sdílen
Organická chemie (KATA) rychlý souhrn a opakování Molekulové orbitaly hybridizace N a O Polarita vazby, induktivní efekt U kovalentní vazby mezi rozdílnými atomy, nebude elektronový pár oběma atomy sdílen
Karboxylové kyseliny
 Karboxylové kyseliny Názvosloví pokud je karboxylováskupina součástířetězce, sloučenina mákoncovku -ovákyselina. Pokud je mimo řetězec má sloučenina koncovku karboxylová kyselina. butanová kyselina cyklohexankarboxylová
Karboxylové kyseliny Názvosloví pokud je karboxylováskupina součástířetězce, sloučenina mákoncovku -ovákyselina. Pokud je mimo řetězec má sloučenina koncovku karboxylová kyselina. butanová kyselina cyklohexankarboxylová
Obsah. 2. Mechanismus a syntetické využití nejdůležitějších organických reakcí 31 2.1. Adiční reakce 31 2.1.1. Elektrofilní adice (A E
 Obsah 1. Typy reakcí, reakčních komponent a jejich roztřídění 6 1.1. Formální kritérium pro klasifikaci reakcí 6 1.2. Typy reakčních komponent a způsob jejich vzniku jako další kriterium pro klasifikaci
Obsah 1. Typy reakcí, reakčních komponent a jejich roztřídění 6 1.1. Formální kritérium pro klasifikaci reakcí 6 1.2. Typy reakčních komponent a způsob jejich vzniku jako další kriterium pro klasifikaci
Chemie organokovových sloučenin mezi organickou a anorganickou chemií
 Chemie organokovových sloučenin mezi organickou a anorganickou chemií Jiří Pospíšil j.pospisil@upol.cz pospisil@orgchem.upol.cz http://www.thepospisilresearchgroup.cz/prednasky/ Na úvod Hodnotící metody
Chemie organokovových sloučenin mezi organickou a anorganickou chemií Jiří Pospíšil j.pospisil@upol.cz pospisil@orgchem.upol.cz http://www.thepospisilresearchgroup.cz/prednasky/ Na úvod Hodnotící metody
HYDROXYDERIVÁTY. Alkoholy Fenoly Bc. Miroslava Wilczková
 HYDROXYDERIVÁTY Alkoholy Fenoly Bc. Miroslava Wilczková HYDROXYDERIVÁTY Alkoholy -OH skupina vázána na uhlíkový atom alifatického řetězce Fenoly -OH skupina vázána na uhlíku, který je součástí aromatického
HYDROXYDERIVÁTY Alkoholy Fenoly Bc. Miroslava Wilczková HYDROXYDERIVÁTY Alkoholy -OH skupina vázána na uhlíkový atom alifatického řetězce Fenoly -OH skupina vázána na uhlíku, který je součástí aromatického
Karboxylové kyseliny a jejich funkční deriváty
 Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
Alkeny. Alkeny. Největšíprůmyslový význam majíethen (ethylen) a propen (propylen) jako suroviny pro další přeměny nebo pro polymerace
 Alkeny Dvojná vazba je tvořena jednou vazbou sigma a jednou vazbou pí. Dvojná vazba je kratší než vazba jednoduchá a všechny čtyři atomy vázané na dvojnou vazbu leží v jedné rovině. Fyzikální vlastnosti
Alkeny Dvojná vazba je tvořena jednou vazbou sigma a jednou vazbou pí. Dvojná vazba je kratší než vazba jednoduchá a všechny čtyři atomy vázané na dvojnou vazbu leží v jedné rovině. Fyzikální vlastnosti
Karbonylové sloučeniny
 Karbonylové sloučeniny více než 120 o 120 o C O C C d + d - C O C sp 2 C sp 2 R C O H R 1 C O R 2 1.aldehydy, ketony Nu E R C O R C O 2. karboxylové kyseliny a funkční deriváty O H 3. deriváty kys. uhličité
Karbonylové sloučeniny více než 120 o 120 o C O C C d + d - C O C sp 2 C sp 2 R C O H R 1 C O R 2 1.aldehydy, ketony Nu E R C O R C O 2. karboxylové kyseliny a funkční deriváty O H 3. deriváty kys. uhličité
ETHYLEN - PRŮMYSLOVÉ ZPRACOVÁNÍ
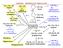 H ethanol CH= acetaldehyd CH octová kys. C CH= vinylacetát ETHYLE - PRŮMYSLVÉ ZPRACVÁÍ oxiran (ethylenoxid) ~ 10 % + 2 ~ 20 % -H 2 + KYS. KATAL. ETHE CH= styren (-CH- -) n Ph polystyren PS a jeho kopolymery
H ethanol CH= acetaldehyd CH octová kys. C CH= vinylacetát ETHYLE - PRŮMYSLVÉ ZPRACVÁÍ oxiran (ethylenoxid) ~ 10 % + 2 ~ 20 % -H 2 + KYS. KATAL. ETHE CH= styren (-CH- -) n Ph polystyren PS a jeho kopolymery
Přechodné kovy v organické chemii
 1 Přechodné kovy v organické chemii Moderní organická chemie využívá přechodné kovy v řadě katalytických i stechiometrických reakcí z nichž některé mají zásadní význam pro průmyslovou výrobu. Je to důsledek
1 Přechodné kovy v organické chemii Moderní organická chemie využívá přechodné kovy v řadě katalytických i stechiometrických reakcí z nichž některé mají zásadní význam pro průmyslovou výrobu. Je to důsledek
Kyslíkaté deriváty. 1) Hydroxyderiváty: a) Alkoholy b) Fenoly. řešení. Dle OH = hydroxylová skupina
 Kyslíkaté deriváty řešení 1) Hydroxyderiváty: a) Alkoholy b) Fenoly Dle = hydroxylová skupina 1 Hydroxyderiváty Alifatické alkoholy: náhrada 1 nebo více atomů H. hydroxylovou skupinou (na 1 atom C vázaná
Kyslíkaté deriváty řešení 1) Hydroxyderiváty: a) Alkoholy b) Fenoly Dle = hydroxylová skupina 1 Hydroxyderiváty Alifatické alkoholy: náhrada 1 nebo více atomů H. hydroxylovou skupinou (na 1 atom C vázaná
UHLOVODÍKY ALKANY (...)
 UHLOVODÍKY ALKANY (...) alifatické nasycené uhlovodíky nerozvětvené i rozvětvené mezi atomy uhlíku pouze jednoduché vazby (σ vazby), mezi nimi úhel 109 28 název: kmen + an obecný vzorec C n H 2n + 2 tvoří
UHLOVODÍKY ALKANY (...) alifatické nasycené uhlovodíky nerozvětvené i rozvětvené mezi atomy uhlíku pouze jednoduché vazby (σ vazby), mezi nimi úhel 109 28 název: kmen + an obecný vzorec C n H 2n + 2 tvoří
CH 3 -CH 3 -> CH 3 -CH 2 -OH -> CH 3 -CHO -> CH 3 -COOH ethan ethanol ethanal kyselina octová
 KARBOXYLOVÉ KYSELINY Karboxylové kyseliny jsou sloučeniny, v jejichž molekule je karboxylová funkční skupina: Jsou nejvyššími organickými oxidačními produkty uhlovodíků: primární aldehydy uhlovodíky alkoholy
KARBOXYLOVÉ KYSELINY Karboxylové kyseliny jsou sloučeniny, v jejichž molekule je karboxylová funkční skupina: Jsou nejvyššími organickými oxidačními produkty uhlovodíků: primární aldehydy uhlovodíky alkoholy
CH 2 = CH 2 ethen systematický název propen CH 2 = CH CH 3 but-1-en CH 2 = CH CH 2 CH 3 but-2-en CH 3 CH = CH CH 3 buta-1,3-dien CH 2 = CH CH = CH 2
 Základní názvy organických látek alifatické nasycené alkany (příklady s nerozvětvenými řetězci) methan CH 4 ethan CH 3 CH 3 propan CH 3 CH 2 CH 3 butan CH 3 CH 2 CH 2 CH 3 pentan CH 3 CH 2 CH 2 CH 2 CH
Základní názvy organických látek alifatické nasycené alkany (příklady s nerozvětvenými řetězci) methan CH 4 ethan CH 3 CH 3 propan CH 3 CH 2 CH 3 butan CH 3 CH 2 CH 2 CH 3 pentan CH 3 CH 2 CH 2 CH 2 CH
Hydroxysloučeniny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Únor
 Hydroxysloučeniny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Únor 2011 Mgr. Alena Jirčáková Hydroxysloučeniny Dělení hydroxysloučenin: Deriváty
Hydroxysloučeniny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Únor 2011 Mgr. Alena Jirčáková Hydroxysloučeniny Dělení hydroxysloučenin: Deriváty
Příklady k semináři z organické chemie OCH/SOCHA. Doc. RNDr. Jakub Stýskala, Ph.D.
 Příklady k semináři z organické chemie /SA Doc. RNDr. Jakub Stýskala, Ph.D. Příklady k procvičení 1. Které monochlorované deriváty vzniknou při radikálové chloraci následující sloučeniny. Který z nich
Příklady k semináři z organické chemie /SA Doc. RNDr. Jakub Stýskala, Ph.D. Příklady k procvičení 1. Které monochlorované deriváty vzniknou při radikálové chloraci následující sloučeniny. Který z nich
OCH/OC2. Karbonylové sloučeniny 1
 OCH/OC2 Karbonylové sloučeniny 1 1 Rozdělení Aldehyd Keton Karboxylová kyselina Acylhalogenid Ester Anhydrid Amid Azid Hydrazid Hydroxamová kyselina Lakton Laktam 2 Rozdělení Deriváty kyseliny uhličité
OCH/OC2 Karbonylové sloučeniny 1 1 Rozdělení Aldehyd Keton Karboxylová kyselina Acylhalogenid Ester Anhydrid Amid Azid Hydrazid Hydroxamová kyselina Lakton Laktam 2 Rozdělení Deriváty kyseliny uhličité
1. ročník Počet hodin
 SOUSTAVY LÁTEK A JEJICH SLOŽENÍ rozdělení přírodních látek a vlastnosti chemických látek soustavy látek a jejich složení STAVBA ATOMU historie pohledu na atom složení a struktura atomu stavba atomu VELIČINY
SOUSTAVY LÁTEK A JEJICH SLOŽENÍ rozdělení přírodních látek a vlastnosti chemických látek soustavy látek a jejich složení STAVBA ATOMU historie pohledu na atom složení a struktura atomu stavba atomu VELIČINY
Ropa Kondenzované uhlovodíky
 Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší?
 16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší? 4) Urči typy konstituční izomerie. 5) Co je tautomerie
16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší? 4) Urči typy konstituční izomerie. 5) Co je tautomerie
Organická chemie pro biochemiky II část 14 14-1
 rganická chemie pro biochemiky II část 14 14-1 oxidace a redukce mají v organické chemii trochu jiný charakter než v chemii anorganické obvykle u jde o adici na systém s dvojnou vazbou či štěpení vazby
rganická chemie pro biochemiky II část 14 14-1 oxidace a redukce mají v organické chemii trochu jiný charakter než v chemii anorganické obvykle u jde o adici na systém s dvojnou vazbou či štěpení vazby
4. ročník - seminář Vzdělávací obor - Člověk a příroda
 Gymnázium, Milevsko, Masarykova 183 Školní vzdělávací program (ŠVP) pro vyšší stupeň osmiletého studia a čtyřleté studium Vyučovací předmět - Chemie 4. ročník - seminář Vzdělávací obor - Člověk a příroda
Gymnázium, Milevsko, Masarykova 183 Školní vzdělávací program (ŠVP) pro vyšší stupeň osmiletého studia a čtyřleté studium Vyučovací předmět - Chemie 4. ročník - seminář Vzdělávací obor - Člověk a příroda
Aminy a další dusíkaté deriváty
 Aminy a další dusíkaté deriváty Aminy jsou sloučeniny příbuzné amoniaku, u kterých jsou nahrazeny jeden, dva nebo všechny tři atomy vodíku alkylovými nebo arylovými skupinami. Aminy mají stejně jako amoniak,
Aminy a další dusíkaté deriváty Aminy jsou sloučeniny příbuzné amoniaku, u kterých jsou nahrazeny jeden, dva nebo všechny tři atomy vodíku alkylovými nebo arylovými skupinami. Aminy mají stejně jako amoniak,
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 16, 566 01 Vysoké Mýto Alkeny Vlastnosti dvojné vazby Hybridizace uhlíku vázaného dvojnou vazbou je sp. Valenční úhel který svírají vazby na uhlíkovém atomu je přibližně
Gymnázium Vysoké Mýto nám. Vaňorného 16, 566 01 Vysoké Mýto Alkeny Vlastnosti dvojné vazby Hybridizace uhlíku vázaného dvojnou vazbou je sp. Valenční úhel který svírají vazby na uhlíkovém atomu je přibližně
Substituční deriváty karboxylových kyselin
 Substituční deriváty karboxylových kyselin Vznikají substitucemi v, ke změnám v karboxylové funkční skupině. Poloha nové skupiny se často ve spojení s triviálními názvy označuje řeckými písmeny: Mají vlastnosti
Substituční deriváty karboxylových kyselin Vznikají substitucemi v, ke změnám v karboxylové funkční skupině. Poloha nové skupiny se často ve spojení s triviálními názvy označuje řeckými písmeny: Mají vlastnosti
Charakteristika Teorie kyselin a zásad. Příprava kyselin Vlastnosti + typické reakce. Významné kyseliny. Arrheniova teorie Teorie Brönsted-Lowryho
 Petra Ustohalová 1 harakteristika Teorie kyselin a zásad Arrheniova teorie Teorie Brönsted-Lowryho Příprava kyselin Vlastnosti + typické reakce Fyzikální a chemické Významné kyseliny 2 Látky, které ve
Petra Ustohalová 1 harakteristika Teorie kyselin a zásad Arrheniova teorie Teorie Brönsted-Lowryho Příprava kyselin Vlastnosti + typické reakce Fyzikální a chemické Významné kyseliny 2 Látky, které ve
2016 Organická chemie testové otázky
 Hodnocení (max. 20 bodů): Číslo kód: 2016 Organická chemie testové otázky 1. Která metoda vede ke tvorbě aminů 1 b. a Gabrielova syntéza b Claisenova kondenzace c Reakce ethyl acetátu s ethylaminem d Reakce
Hodnocení (max. 20 bodů): Číslo kód: 2016 Organická chemie testové otázky 1. Která metoda vede ke tvorbě aminů 1 b. a Gabrielova syntéza b Claisenova kondenzace c Reakce ethyl acetátu s ethylaminem d Reakce
VY_32_INOVACE_29_HBENO5
 Alkany reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 15. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Výroba alkanů. Reakvita alkanů, důležité
Alkany reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 15. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Výroba alkanů. Reakvita alkanů, důležité
Vlastnosti. Pozor! H 3 C CH 3 H CH 3
 Alkeny Vlastnosti C n 2n obsahují dvojné vazby uhlíky v sp 2 hybridizaci násobná vazba vzniká překryvem 2p orbitalů obou atomů uhlíku nad a pod prostorem obsazeným vazbou aby k překryvu mohlo dojít, musí
Alkeny Vlastnosti C n 2n obsahují dvojné vazby uhlíky v sp 2 hybridizaci násobná vazba vzniká překryvem 2p orbitalů obou atomů uhlíku nad a pod prostorem obsazeným vazbou aby k překryvu mohlo dojít, musí
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Reakce aldehydů a ketonů s N-nukleofily
 Reakce aldehydů a ketonů s N-nukleofily bdobně jako aminy se adují na karbonyl i jiné dusíkaté nukleofily: 2,4-dinitrofenylhydrazin aceton 2,4dinitrofenylhydrazon 2,4-dinitrofenylhydrazon acetaldehydu
Reakce aldehydů a ketonů s N-nukleofily bdobně jako aminy se adují na karbonyl i jiné dusíkaté nukleofily: 2,4-dinitrofenylhydrazin aceton 2,4dinitrofenylhydrazon 2,4-dinitrofenylhydrazon acetaldehydu
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
1. Jeden elementární záporný náboj 1,602.10-19 C nese částice: a) neutron b) elektron c) proton d) foton
 varianta A řešení (správné odpovědi jsou podtrženy) 1. Jeden elementární záporný náboj 1,602.10-19 C nese částice: a) neutron b) elektron c) proton d) foton 2. Sodný kation Na + vznikne, jestliže atom
varianta A řešení (správné odpovědi jsou podtrženy) 1. Jeden elementární záporný náboj 1,602.10-19 C nese částice: a) neutron b) elektron c) proton d) foton 2. Sodný kation Na + vznikne, jestliže atom
VLASTNOSTI ALKANŮ 2. RADIKÁLOVÁ SUBSTITUCE 3. ELIMINAČNÍ REAKCE VÝZNAMNÉ ALKANY. Substituční reakce. Sulfochlorace alkanů. Termolýza.
 Kromě CO 2 vznikají i saze roste svítivost Substituční reakce vazby: C C C H jsou nepolární => jsou radikálové S R...radikálová substituce 3 fáze... VLASTNOSTI ALKANŮ tady něco chybí... 2. RADIKÁLOVÁ SUBSTITUCE
Kromě CO 2 vznikají i saze roste svítivost Substituční reakce vazby: C C C H jsou nepolární => jsou radikálové S R...radikálová substituce 3 fáze... VLASTNOSTI ALKANŮ tady něco chybí... 2. RADIKÁLOVÁ SUBSTITUCE
Nerozvětvené (atomy C jsou spojeny maximálně s dvěma dalšími C) Rozvětvené (atomy C jsou spojeny s více než dvěma dalšími C)
 Otázka: Uhlovodíky Předmět: Chemie Přidal(a): Majdush Obsahují ve svých molekulách pouze atomy uhlíku a vodíku Nejjednodušší org. sloučeniny Uhlík je schopný řetězit se a vytvářet tak nejrůznější řetězce,
Otázka: Uhlovodíky Předmět: Chemie Přidal(a): Majdush Obsahují ve svých molekulách pouze atomy uhlíku a vodíku Nejjednodušší org. sloučeniny Uhlík je schopný řetězit se a vytvářet tak nejrůznější řetězce,
CHEMIE - Úvod do organické chemie
 Název školy Číslo projektu Autor Název šablony Název DUMu Stupeň a typ vzdělávání Vzdělávací oblast Vzdělávací obor Vzdělávací okruh Druh učebního materiálu Cílová skupina Anotace SŠHS Kroměříž CZ.1.07/1.5.00/34.0911
Název školy Číslo projektu Autor Název šablony Název DUMu Stupeň a typ vzdělávání Vzdělávací oblast Vzdělávací obor Vzdělávací okruh Druh učebního materiálu Cílová skupina Anotace SŠHS Kroměříž CZ.1.07/1.5.00/34.0911
Autor: Tomáš Galbička Téma: Alkany a cykloalkany Ročník: 2.
 Alkany uhlovodíky s otevřeným řetězcem a pouze jednoduchými vazbami vazby sigma, největší výskyt elektronů na spojnici jader v názvu mají koncovku an Cykloalkany uhlovodíky s uzavřeným řetězcem a pouze
Alkany uhlovodíky s otevřeným řetězcem a pouze jednoduchými vazbami vazby sigma, největší výskyt elektronů na spojnici jader v názvu mají koncovku an Cykloalkany uhlovodíky s uzavřeným řetězcem a pouze
Rozdělení uhlovodíků
 Rozdělení uhlovodíků 1/8 Alkany a cykloalkany Obecné vzorce: alkany C n H 2n+2, cykloalkany C n H 2n, kde n je přirozené číslo Homologický přírustek: - CH 2 - Alkany přímé ( n - alkany) rozvětvené Primární,
Rozdělení uhlovodíků 1/8 Alkany a cykloalkany Obecné vzorce: alkany C n H 2n+2, cykloalkany C n H 2n, kde n je přirozené číslo Homologický přírustek: - CH 2 - Alkany přímé ( n - alkany) rozvětvené Primární,
Reaktivita karboxylové funkce
 eaktivita karboxylové funkce - M efekt, - I efekt - I efekt < + M efekt - I efekt kyslíku eaktivita: 1) itlivost na působení bází - tvorba solí karboxylových kyselin (také většina nukleofilů zde působí
eaktivita karboxylové funkce - M efekt, - I efekt - I efekt < + M efekt - I efekt kyslíku eaktivita: 1) itlivost na působení bází - tvorba solí karboxylových kyselin (také většina nukleofilů zde působí
ZŠ ÚnO, Bratří Čapků 1332
 Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Vysoká škola chemicko-technologická v Praze. Ústav organické technologie. Václav Matoušek
 Vysoká škola chemicko-technologická v Praze Ústav organické technologie VŠCHT PRAHA SVOČ 2005 Václav Matoušek Školitel : Ing. Petr Kačer, PhD. Prof. Ing. Libor Červený, DrSc. Proč asymetrická hydrogenace?
Vysoká škola chemicko-technologická v Praze Ústav organické technologie VŠCHT PRAHA SVOČ 2005 Václav Matoušek Školitel : Ing. Petr Kačer, PhD. Prof. Ing. Libor Červený, DrSc. Proč asymetrická hydrogenace?
Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch
 Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch Atom, složení a struktura Chemické prvky-názvosloví, slučivost Chemické sloučeniny, molekuly Chemická vazba
Sekunda (2 hodiny týdně) Chemické látky a jejich vlastnosti Směsi a jejich dělení Voda, vzduch Atom, složení a struktura Chemické prvky-názvosloví, slučivost Chemické sloučeniny, molekuly Chemická vazba
Quiz Karboxylové kyseliny & jejich deriváty
 Quiz Karboxylové kyseliny & jejich deriváty 1. Určete produkt(y) reakce propionylchloridu s následujícími reaktanty: 2 i) C 3 C 2 C 2 2 (nadbytek) b) C 3 C 2 C 2 C 2 Li (nadbytek) j) m-toluidin (nadbytek)
Quiz Karboxylové kyseliny & jejich deriváty 1. Určete produkt(y) reakce propionylchloridu s následujícími reaktanty: 2 i) C 3 C 2 C 2 2 (nadbytek) b) C 3 C 2 C 2 C 2 Li (nadbytek) j) m-toluidin (nadbytek)
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Alklany a cykloalkany Homologická řada alkanů Nerozvětvené alkany tvoří homologickou řadu obecného vzorce C n H 2n+2, kde n jsou malá celá čísla.
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Alklany a cykloalkany Homologická řada alkanů Nerozvětvené alkany tvoří homologickou řadu obecného vzorce C n H 2n+2, kde n jsou malá celá čísla.
OCH/OC2. Heterocyklické sloučeniny
 CH/C2 Heterocyklické sloučeniny 1 ázvosloví 5-ti členné heterocykly 6-ti členné heterocykly 2 ázvosloví earomatické (nasycené) heterocykly. 3 Aromaticita heterocyklů 4 Aromaticita heterocyklů 5 Rezonanční
CH/C2 Heterocyklické sloučeniny 1 ázvosloví 5-ti členné heterocykly 6-ti členné heterocykly 2 ázvosloví earomatické (nasycené) heterocykly. 3 Aromaticita heterocyklů 4 Aromaticita heterocyklů 5 Rezonanční
PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKOUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2011
 Kód uchazeče:... Datum:... PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2011 30 otázek maximum: 60 bodů čas: 60 minut 1. Napište názvy anorganických sloučenin: (4
Kód uchazeče:... Datum:... PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2011 30 otázek maximum: 60 bodů čas: 60 minut 1. Napište názvy anorganických sloučenin: (4
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Alkyny. C n H 2n-2 (obsahuje jednu trojnou vazbu) uhlíky v sp hybridizaci
 Alkyny C n H 2n-2 (obsahuje jednu trojnou vazbu) uhlíky v sp hybridizaci 1 Klasifikace 2 Alkyny - dvě π vazby; lineární uspořádání Pozor! 3 Vlastnosti -π elektrony jsou méně mobilní než u alkenů H CH 3
Alkyny C n H 2n-2 (obsahuje jednu trojnou vazbu) uhlíky v sp hybridizaci 1 Klasifikace 2 Alkyny - dvě π vazby; lineární uspořádání Pozor! 3 Vlastnosti -π elektrony jsou méně mobilní než u alkenů H CH 3
Aromacké uhlovodíky reakce
 Aromacké uhlovodíky reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 20. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Reakce výroby nesubstuovaných
Aromacké uhlovodíky reakce Temacká oblast : Chemie organická chemie Datum vytvoření: 20. 7. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Reakce výroby nesubstuovaných
projektu OPVK 1.5 Peníze středn CZ.1.07/1.5.00/ Název projektu: Ing. Eva Kubíčková edmět: Deriváty uhlovodíků 41-l/01)
 VY_32_INOVACE_CHK3 1760 KUB Výukový materiál l v rámci r projektu OPVK 1.5 Peníze středn edním škol kolám Číslo projektu: CZ.1.07/1.5.00/34.0883 Název projektu: Rozvoj vzdělanosti Číslo šablony: III/2
VY_32_INOVACE_CHK3 1760 KUB Výukový materiál l v rámci r projektu OPVK 1.5 Peníze středn edním škol kolám Číslo projektu: CZ.1.07/1.5.00/34.0883 Název projektu: Rozvoj vzdělanosti Číslo šablony: III/2
Úvod do studia organické chemie
 Úvod do studia organické chemie 1828... Wöhler... uměle připravil močovinu Organická chemie - chemie sloučenin uhlíku a vodíku, případně dalších prvků (O, N, X, P, S) Příčiny stability uhlíkových řetězců:
Úvod do studia organické chemie 1828... Wöhler... uměle připravil močovinu Organická chemie - chemie sloučenin uhlíku a vodíku, případně dalších prvků (O, N, X, P, S) Příčiny stability uhlíkových řetězců:
Platinové kovy. Obecné vlastnosti. Ruthenium a osmium. Jméno: Jana Homolková UČO:
 Platinové kovy Obecné vlastnosti Patří zde prvky druhé a třetí triády 8. skupiny periodického systému. Prvky druhé triády (Ru, Rh, Pd) se nazývají lehké platinové kovy. Prvky třetí triády se nazývají (Os,
Platinové kovy Obecné vlastnosti Patří zde prvky druhé a třetí triády 8. skupiny periodického systému. Prvky druhé triády (Ru, Rh, Pd) se nazývají lehké platinové kovy. Prvky třetí triády se nazývají (Os,
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 VY_32_INOVACE_C.3.01 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT
VY_32_INOVACE_C.3.01 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT
nenasycené uhlovodíky nestálé, přeměňují se na karbonyly
 Otázka: Alkoholy, fenoly, ethery a jejich sirné podoby Předmět: Chemie Přidal(a): VityVity Hydroxylové sloučeniny - deriváty uhlovodíků obsahující hydroxylovou skupinu -OH - dělí se na alkoholy hydroxylová
Otázka: Alkoholy, fenoly, ethery a jejich sirné podoby Předmět: Chemie Přidal(a): VityVity Hydroxylové sloučeniny - deriváty uhlovodíků obsahující hydroxylovou skupinu -OH - dělí se na alkoholy hydroxylová
Úvod Obecný vzorec alkoholů je R-OH.
 Alkoholy a fenoly Úvod becný vzorec alkoholů je R-. Názvosloví alkoholů a fenolů Běžná jména alkoholů se odvozují od alifatického zbytku připojeného k hydroxylové skupině, ke kterému se přidá slovo alkohol.
Alkoholy a fenoly Úvod becný vzorec alkoholů je R-. Názvosloví alkoholů a fenolů Běžná jména alkoholů se odvozují od alifatického zbytku připojeného k hydroxylové skupině, ke kterému se přidá slovo alkohol.
Učební osnovy pracovní
 2 týdně, povinný Chemické reakce II. Žák: používá s porozuměním pojmy oxidace, red. vysvětlí podstatu výroby kovů z rud nakreslí schéma elektrolýzy a galvanického článku, porovná oba děje, uvede příklady
2 týdně, povinný Chemické reakce II. Žák: používá s porozuměním pojmy oxidace, red. vysvětlí podstatu výroby kovů z rud nakreslí schéma elektrolýzy a galvanického článku, porovná oba děje, uvede příklady
Základní škola a mateřská škola Hutisko Solanec. žák uvede základní druhy uhlovodíků, jejich použití a zdroje. Chemie - 9. ročník
 Základní škola a mateřská škola Hutisko Solanec Digitální učební materiál Anotace: Autor: Jazyk: Očekávaný výstup: Speciální vzdělávací potřeby: Klíčová slova: Druh učebního materiálu: Druh interaktivity:
Základní škola a mateřská škola Hutisko Solanec Digitální učební materiál Anotace: Autor: Jazyk: Očekávaný výstup: Speciální vzdělávací potřeby: Klíčová slova: Druh učebního materiálu: Druh interaktivity:
Polymerizace. Polytransformace
 vznik makromolekuly Polymerizace Polytransformace Podmínky vzniku makromolekuly Podmínky vzniku makromolekuly 1) chemická podmínka Výchozí nízkomolekulární látka(y) musí být z pohledu polymerní reakce
vznik makromolekuly Polymerizace Polytransformace Podmínky vzniku makromolekuly Podmínky vzniku makromolekuly 1) chemická podmínka Výchozí nízkomolekulární látka(y) musí být z pohledu polymerní reakce
16.UHLOVODÍKY A IZOMERIE ORGANICKÝCH SLOUČENIN IZOMERIE:
 16.UHLOVODÍKY A IZOMERIE ORGANICKÝCH SLOUČENIN IZOMERIE: 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem se liší? 4) Vyber správné
16.UHLOVODÍKY A IZOMERIE ORGANICKÝCH SLOUČENIN IZOMERIE: 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem se liší? 4) Vyber správné
Heterogenní katalýza
 Ústav fyzikální chemie Jaroslava Heyrovského AV ČR Heterogenní katalýza Blanka Wichterlová Katalýza cíle Zvýšení rychlosti reakce termodynamicky schůdné Snížení aktivační bariéry tvorbou vazby s katalyzátorem
Ústav fyzikální chemie Jaroslava Heyrovského AV ČR Heterogenní katalýza Blanka Wichterlová Katalýza cíle Zvýšení rychlosti reakce termodynamicky schůdné Snížení aktivační bariéry tvorbou vazby s katalyzátorem
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné
 Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 12.02.2013 Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 12.02.2013 Číslo DUMu: VY_32_INOVACE_10_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
Základní chemické pojmy
 MZ CHEMIE 2015 MO 1 Základní chemické pojmy Atom, molekula, prvek, protonové číslo. Sloučenina, chemicky čistá látka, směs, dělení směsí. Relativní atomová hmotnost, molekulová hmotnost, atomová hmotnostní
MZ CHEMIE 2015 MO 1 Základní chemické pojmy Atom, molekula, prvek, protonové číslo. Sloučenina, chemicky čistá látka, směs, dělení směsí. Relativní atomová hmotnost, molekulová hmotnost, atomová hmotnostní
TVORBA UHLÍKATÝCH PRODUKTŮ PŘI I PYROLÝZE UHLOVODÍKŮ
 TVORBA UHLÍKATÝCH PRODUKTŮ PŘI I PYROLÝZE UHLOVODÍKŮ Martin Hrádel 5. ročník Školitel: Doc. Ing. Zdeněk Bělohlav, CSc. Obsah Úvod Mechanismus vzniku a vlastnosti uhlíkatých produktů Provozního sledování
TVORBA UHLÍKATÝCH PRODUKTŮ PŘI I PYROLÝZE UHLOVODÍKŮ Martin Hrádel 5. ročník Školitel: Doc. Ing. Zdeněk Bělohlav, CSc. Obsah Úvod Mechanismus vzniku a vlastnosti uhlíkatých produktů Provozního sledování
Organická chemie 3.ročník studijního oboru - kosmetické služby.
 Organická chemie 3.ročník studijního oboru - kosmetické služby. T-5 Karboxylové sloučeniny NEJDŮLEŽITĚJŠÍ K.K. A JEJICH VLASTNOSTI Zpracováno v rámci projektu Zlepšení podmínek ke vzdělávání Registrační
Organická chemie 3.ročník studijního oboru - kosmetické služby. T-5 Karboxylové sloučeniny NEJDŮLEŽITĚJŠÍ K.K. A JEJICH VLASTNOSTI Zpracováno v rámci projektu Zlepšení podmínek ke vzdělávání Registrační
Experimentální biologie Bc. chemie
 Experimentální biologie Bc. chemie 1. značte prvek s největší elektronegativitou: a) draslík b) chlor c) uhlík d) vápník e) fluor 3. Mezi p prvky nepatří: a) P b) As c) Fe d) B e) Si 4. Radioaktivní záření
Experimentální biologie Bc. chemie 1. značte prvek s největší elektronegativitou: a) draslík b) chlor c) uhlík d) vápník e) fluor 3. Mezi p prvky nepatří: a) P b) As c) Fe d) B e) Si 4. Radioaktivní záření
KARBOXYLOVÉ KYSELINY
 KARBOXYLOVÉ KYSELINY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 29. 11. 2012 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci se seznámí s
KARBOXYLOVÉ KYSELINY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 29. 11. 2012 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci se seznámí s
Inovace studia molekulární a buněčné biologie
 Investice do rozvoje vzdělávání Inovace studia molekulární a buněčné biologie Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Investice do rozvoje vzdělávání
Investice do rozvoje vzdělávání Inovace studia molekulární a buněčné biologie Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Investice do rozvoje vzdělávání
PROPEN - PŘEHLED VYUŽITÍ
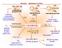 PRPEN - PŘEHLED VYUŽITÍ polymery propandioly propylenkarbonát isopropanolaminy C 4 aldehydy alkoholy kyseliny jejich estery CH methyloxiran (propylenoxid) hydroformylace hydrokarbonylace + 2 isopropylbenzen
PRPEN - PŘEHLED VYUŽITÍ polymery propandioly propylenkarbonát isopropanolaminy C 4 aldehydy alkoholy kyseliny jejich estery CH methyloxiran (propylenoxid) hydroformylace hydrokarbonylace + 2 isopropylbenzen
Karboxylové kyseliny
 Karboxylové kyseliny Učební text, Hb 2008 Obsahují jednu nebo více charakteristických karboxylových skupin COOH. Název vznikl kombinací karboxyl = karbonyl + hydroxyl Obecný vzorec např. R-COOH, HOOC-R-COOH,
Karboxylové kyseliny Učební text, Hb 2008 Obsahují jednu nebo více charakteristických karboxylových skupin COOH. Název vznikl kombinací karboxyl = karbonyl + hydroxyl Obecný vzorec např. R-COOH, HOOC-R-COOH,
HYDROXYLOVÉ SLOUČENINY KYSLÍKATÉ DERIVÁTY UHLOVODÍKŮ
 VY_52_INOVACE_08_II.2.2 _HYDROXYLOVÉ SLOUČENINY HYDROXYLOVÉ SLOUČENINY KYSLÍKATÉ DERIVÁTY UHLOVODÍKŮ NOVÉ UČIVO KYSLÍKATÉ DERIVÁTY UHLOVODÍKŮ HYDROXYLOVÉ SLOUČENINY 9. TŘÍDA KYSLÍKATÉ DERIVÁTY UHLOVODÍKŮ
VY_52_INOVACE_08_II.2.2 _HYDROXYLOVÉ SLOUČENINY HYDROXYLOVÉ SLOUČENINY KYSLÍKATÉ DERIVÁTY UHLOVODÍKŮ NOVÉ UČIVO KYSLÍKATÉ DERIVÁTY UHLOVODÍKŮ HYDROXYLOVÉ SLOUČENINY 9. TŘÍDA KYSLÍKATÉ DERIVÁTY UHLOVODÍKŮ
Seminář z chemie. Charakteristika vyučovacího předmětu
 Seminář z chemie Časová dotace: 2 hodiny ve 3. ročníku, 4 hodiny ve 4. Ročníku Charakteristika vyučovacího předmětu Seminář je zaměřený na přípravu ke školní maturitě z chemie a k přijímacím zkouškám na
Seminář z chemie Časová dotace: 2 hodiny ve 3. ročníku, 4 hodiny ve 4. Ročníku Charakteristika vyučovacího předmětu Seminář je zaměřený na přípravu ke školní maturitě z chemie a k přijímacím zkouškám na
KARBOXYLOVÉ KYSELINY C OH COOH. řešení. uhlovodíkový zbytek. KARBOXYLOVÝCH funkčních skupin. - obsahují 1 či více
 KARBXYLVÉ KYSELINY - obsahují 1 či více KARBXYLVÝCH funkčních skupin. - nejvyšší organické oxidační produkty uhlovodíků řešení R CH R C H R = uhlovodíkový zbytek 1 KARBXYLVÉ KYSELINY Dělení dle: a) typu
KARBXYLVÉ KYSELINY - obsahují 1 či více KARBXYLVÝCH funkčních skupin. - nejvyšší organické oxidační produkty uhlovodíků řešení R CH R C H R = uhlovodíkový zbytek 1 KARBXYLVÉ KYSELINY Dělení dle: a) typu
Chemie 2018 CAUS strana 1 (celkem 5)
 Chemie 2018 CAUS strana 1 (celkem 5) 1. Vápník má atomové číslo 20, hmotnostní 40. Kolik elektronů obsahuje kationt Ca 2+? a) 18 b) 20 c) 40 d) 60 2. Kolik elektronů ve valenční sféře má atom Al? a) 1
Chemie 2018 CAUS strana 1 (celkem 5) 1. Vápník má atomové číslo 20, hmotnostní 40. Kolik elektronů obsahuje kationt Ca 2+? a) 18 b) 20 c) 40 d) 60 2. Kolik elektronů ve valenční sféře má atom Al? a) 1
Alkany a cykloalkany
 Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Září 2010 Mgr. Alena Jirčáková Charakteristika alkanů: Malá reaktivita, odolné chemickým činidlům Nasycené
Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Září 2010 Mgr. Alena Jirčáková Charakteristika alkanů: Malá reaktivita, odolné chemickým činidlům Nasycené
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 KARBONYLOVÉ SLOUČENINY = látky, které obsahují karbonylovou skupinu Aldehydy mají skupinu C=O na konci řetězce, aldehydická skupina má potom tvar... Názvosloví aldehydů: V systematickém názvu je zakončení
KARBONYLOVÉ SLOUČENINY = látky, které obsahují karbonylovou skupinu Aldehydy mají skupinu C=O na konci řetězce, aldehydická skupina má potom tvar... Názvosloví aldehydů: V systematickém názvu je zakončení
TEST + ŘEŠENÍ. PÍSEMNÁ ČÁST PŘIJÍMACÍ ZKOUŠKY Z CHEMIE bakalářský studijní obor Bioorganická chemie 2010
 30 otázek maximum: 60 bodů TEST + ŘEŠEÍ PÍSEMÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CEMIE bakalářský studijní obor Bioorganická chemie 2010 1. apište názvy anorganických sloučenin: (4 body) 4 BaCr 4 kyselina peroxodusičná
30 otázek maximum: 60 bodů TEST + ŘEŠEÍ PÍSEMÁ ČÁST PŘIJÍMACÍ ZKUŠKY Z CEMIE bakalářský studijní obor Bioorganická chemie 2010 1. apište názvy anorganických sloučenin: (4 body) 4 BaCr 4 kyselina peroxodusičná
Názvosloví uhlovodíků
 Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Říjen 2010 Mgr. Alena Jirčáková Varianty názvosloví: Triviální názvosloví tradiční, souvisí s výskytem
Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Říjen 2010 Mgr. Alena Jirčáková Varianty názvosloví: Triviální názvosloví tradiční, souvisí s výskytem
Chemie. 5. K uvedeným vzorcům (1 5) přiřaďte tvar struktury (A D) jejich molekuly. 1) CO 2 2) SO 2 3) SO 3 4) NH 3 5) BF 3.
 Chemie 1. Analýzou vzorku bylo zjištěno, že vzorek o hmotnosti 25 g obsahuje 15,385 g mědi, 3,845 g síry a zbytek připadá na kyslík. Který empirický vzorec uvedeným výsledkům analýzy odpovídá? A r (Cu)
Chemie 1. Analýzou vzorku bylo zjištěno, že vzorek o hmotnosti 25 g obsahuje 15,385 g mědi, 3,845 g síry a zbytek připadá na kyslík. Který empirický vzorec uvedeným výsledkům analýzy odpovídá? A r (Cu)
Organická chemie 3.ročník studijního oboru - kosmetické služby.
 Organická chemie 3.ročník studijního oboru - kosmetické služby. T-6 ALKANY Zpracováno v rámci projektu Zlepšení podmínek ke vzdělávání Registrační číslo projektu: CZ.1.07/1.5.00/34.0639 ŠABLONA III / 2
Organická chemie 3.ročník studijního oboru - kosmetické služby. T-6 ALKANY Zpracováno v rámci projektu Zlepšení podmínek ke vzdělávání Registrační číslo projektu: CZ.1.07/1.5.00/34.0639 ŠABLONA III / 2
EU peníze středním školám digitální učební materiál
 EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
ORGANICKÁ CHEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Zápočet udělil(a)...
 RGANICKÁ CHEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Zápočet udělil(a)... Počet bodů v části A:... Počet bodů v části B:... Počet bodů celkem:...
RGANICKÁ CHEMIE I pro bakalářský stud. program (Varianta A) Jméno a příjmení... Datum... Kroužek/Fakulta.../... Zápočet udělil(a)... Počet bodů v části A:... Počet bodů v části B:... Počet bodů celkem:...
Inovace výuky prostřednictvím šablon pro SŠ. Gymnázium Jana Pivečky a Střední odborná škola Slavičín Mgr. Veronika Prchlíková
 Název projektu Číslo projektu Název školy Autor Název šablony Název DUMu Stupeň a typ vzdělávání Vzdělávací oblast Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748 Gymnázium Jana Pivečky
Název projektu Číslo projektu Název školy Autor Název šablony Název DUMu Stupeň a typ vzdělávání Vzdělávací oblast Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748 Gymnázium Jana Pivečky
Karboxylová skupina vzniká připojením hydroxylové skupiny OH ke karbonylové skupině (oxoskupině) >C=O. Souhrnně
 Karboxylové kyseliny 1. Obecná charakteristika karboxylových kyselin Karboxylová skupina vzniká připojením hydroxylové skupiny OH ke karbonylové skupině (oxoskupině) >C=O. Souhrnně můžeme tuto skupinu
Karboxylové kyseliny 1. Obecná charakteristika karboxylových kyselin Karboxylová skupina vzniká připojením hydroxylové skupiny OH ke karbonylové skupině (oxoskupině) >C=O. Souhrnně můžeme tuto skupinu
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/
 Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 LRR/CHPB2 Chemie pro biology 2 Reakce a reakční mechanismy v organické chemii Lucie Szüčová Osnova: homolytické a heterolytické
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 LRR/CHPB2 Chemie pro biology 2 Reakce a reakční mechanismy v organické chemii Lucie Szüčová Osnova: homolytické a heterolytické
Inovace profesní přípravy budoucích učitelů chemie
 Inovace profesní přípravy budoucích učitelů chemie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í CZ.1.07/2.2.00/15.0324 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem
Inovace profesní přípravy budoucích učitelů chemie I n v e s t i c e d o r o z v o j e v z d ě l á v á n í CZ.1.07/2.2.00/15.0324 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem
KARBOXYLOVÉ KYSELINY
 KARBXYLVÉ KYSELINY kyslíkaté deriváty uhlovodíků v jejichž molekulách se vyskytuje jedna nebo více karboxylových skupin karboxylová skupina vzniká spojením karbonylové a hydroxylové skupiny rozlišujeme:
KARBXYLVÉ KYSELINY kyslíkaté deriváty uhlovodíků v jejichž molekulách se vyskytuje jedna nebo více karboxylových skupin karboxylová skupina vzniká spojením karbonylové a hydroxylové skupiny rozlišujeme:
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Reakce a činidla v organické chemii I v organické chemii platí, že reakce je děj při němž dochází ke změně složení a vlastností látek. Při reakcích
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Reakce a činidla v organické chemii I v organické chemii platí, že reakce je děj při němž dochází ke změně složení a vlastností látek. Při reakcích
OCH/OC2. Karboxylové kyseliny
 OCH/OC2 Karboxylové kyseliny 1 Struktura a fyzikální vlastnosti karboxylová skupina je planární vazebné úhly přibližně 120 molekuly karboxylových kyselin jsou silně asociovány vodíkovými vazbami tvorba
OCH/OC2 Karboxylové kyseliny 1 Struktura a fyzikální vlastnosti karboxylová skupina je planární vazebné úhly přibližně 120 molekuly karboxylových kyselin jsou silně asociovány vodíkovými vazbami tvorba
Polymery lze rozdělit podle několika kritérií. Podle původu rozlišujeme polymery přírodní a syntetické. Přírodní polymery jsou:
 MAKROMOLEKULÁRNÍ LÁTKY (POLYMERY) Makromolekuly jsou molekulové systémy složené z velkého počtu atomů vázaných chemickými vazbami do dlouhých řetězců. Tyto řetězce tvoří pravidelně se opakující části,
MAKROMOLEKULÁRNÍ LÁTKY (POLYMERY) Makromolekuly jsou molekulové systémy složené z velkého počtu atomů vázaných chemickými vazbami do dlouhých řetězců. Tyto řetězce tvoří pravidelně se opakující části,
DUM VY_52_INOVACE_12CH24
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH24 autor: Kristýna Anna olníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 9. vzdělávací oblast: vzdělávací obor: tematický
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH24 autor: Kristýna Anna olníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 9. vzdělávací oblast: vzdělávací obor: tematický
Autoři: Pavel Zachař, David Sýkora Ukázky spekter k procvičování na semináři: Tento soubor je pouze prvním ilustrativním seznámením se základními prin
 Autoři: Pavel Zachař, David Sýkora Ukázky spekter k procvičování na semináři: Tento soubor je pouze prvním ilustrativním seznámením se základními principy hmotnostní spektrometrie a v žádném případě nezahrnuje
Autoři: Pavel Zachař, David Sýkora Ukázky spekter k procvičování na semináři: Tento soubor je pouze prvním ilustrativním seznámením se základními principy hmotnostní spektrometrie a v žádném případě nezahrnuje
EU peníze středním školám digitální učební materiál
 EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
Organická chemie. názvosloví acyklických uhlovodíků
 Organická chemie názvosloví acyklických uhlovodíků Obsah definice vlastnosti organických sloučenin prvkové složen ení organických sloučenin vazby v molekulách org. sloučenin rozdělen lení organických sloučenin
Organická chemie názvosloví acyklických uhlovodíků Obsah definice vlastnosti organických sloučenin prvkové složen ení organických sloučenin vazby v molekulách org. sloučenin rozdělen lení organických sloučenin
ALKENY NENASYCENÉ UHLOVODÍKY
 ALKENY NENASYCENÉ ULOVODÍKY 1 ALKENY - mají ve svých molekulách alespoň jednu dvojnou vazbu- C=C homologický vzorec : C n 2n názvy od alkanů zakončeny koncovkou en CYKLOALKENY - homologický vzorec : C
ALKENY NENASYCENÉ ULOVODÍKY 1 ALKENY - mají ve svých molekulách alespoň jednu dvojnou vazbu- C=C homologický vzorec : C n 2n názvy od alkanů zakončeny koncovkou en CYKLOALKENY - homologický vzorec : C
AMINOKYSELINY REAKCE
 CHEMIE POTRAVIN - cvičení AMINOKYSELINY REAKCE Milena Zachariášová (milena.zachariasova@vscht.cz) Ústav chemie a analýzy potravin, VŠCHT Praha REAKCE AMINOKYSELIN část 1 ELIMINAČNÍ REAKCE DEKARBOXYLACE
CHEMIE POTRAVIN - cvičení AMINOKYSELINY REAKCE Milena Zachariášová (milena.zachariasova@vscht.cz) Ústav chemie a analýzy potravin, VŠCHT Praha REAKCE AMINOKYSELIN část 1 ELIMINAČNÍ REAKCE DEKARBOXYLACE
Chemie - 3. ročník. přesahy, vazby, mezipředmětové vztahy průřezová témata. očekávané výstupy RVP. témata / učivo. očekávané výstupy ŠVP.
 očekávané výstupy RVP témata / učivo Chemie - 3. ročník Žák: očekávané výstupy ŠVP přesahy, vazby, mezipředmětové vztahy průřezová témata 1.1., 1.2., 1.3., 1.4., 2.1. 1. Látky přírodní nebo syntetické
očekávané výstupy RVP témata / učivo Chemie - 3. ročník Žák: očekávané výstupy ŠVP přesahy, vazby, mezipředmětové vztahy průřezová témata 1.1., 1.2., 1.3., 1.4., 2.1. 1. Látky přírodní nebo syntetické
OCH/OC2. Karbonylové sloučeniny 2
 OCH/OC2 Karbonylové sloučeniny 2 1 Reaktivita karbonylových sloučenin Nukleofilní adice na karbonylovou skupinu A N vody vznik hydrátů A N alkoholů tvorba acetalů a ketalů A N HCN vznik kyanhydrinů A N
OCH/OC2 Karbonylové sloučeniny 2 1 Reaktivita karbonylových sloučenin Nukleofilní adice na karbonylovou skupinu A N vody vznik hydrátů A N alkoholů tvorba acetalů a ketalů A N HCN vznik kyanhydrinů A N
