Polymery. Pøírodní (polysacharidy, polypeptidy, polynukleotidy... ) Syntéza ji¾ 19. stol., osmotický tlak koloidní hypotéza
|
|
|
- Veronika Šmídová
- před 8 lety
- Počet zobrazení:
Transkript
1 Polymery [show -IG pic/ala30; show -Iggg -b2 pic/ala30] 1/31 Pøírodní (polysacharidy, polypeptidy, polynukleotidy... ) Syntéza ji¾ 19. stol., osmotický tlak koloidní hypotéza 1920 Hermann Staudinger (Nobel 1953): makromolekulární hypotéza (polymery jsou koloidní ve v¹ech rozpou¹tìdlech). 1930{ vìk polymerù poly(oxyethylen) poly(ethylen oxid) polyethylen glykol poly alanin [-NH-CHCH 3 -CO-] N DNA credit: wikipedie
2 Stupeò polymerace [blend -g -m0 pic/ala30] 2/31 Stupeò polymerace = poèet jednotek v øetìzci. Pozn. Tradiènì polyethylen monomer = -CH 2 -CH 2 - Molární hmotnost øetìzce M = NM mon Jednotky: g/mol = Da (Dalton), kg/mol = kda Pro cca N < 20: oligomer Pøíklad. Kolik by vá¾ilo vlákno polyalaninu ([-NH-CHCH 3 -CO-] N, v konformaci α- -¹roubovice) namotané jednou okolo rovníku? 30 µg
3 Struktura polymeru 3/31 Mikrostruktura (primární struktura) = organizace vazeb a skupin podél vlákna (napø. poøadí aminokyselin v proteinu) Sekundární struktura = lokální prostorové uspoøádání (napø. α-helix, β-sheet) Terciální struktura = slo¾ení lokálních struktur (protein { øízeno hlavnì hydrofobní interakcí) Kvartérní struktura = skládání vy¹¹ích jednotek myoglobin credit: wikipedie
4 Fáze 4/31 Polymer v roztoku Tavenina, skelný pøechod... T g : η = Pa s... Sklo (amorfní) (Semi)krystalický: lamely, sferulity Tekuté krystaly credit: wikipedie
5 Izomerie [che/showpoly.sh] 5/31 sekvenèní, napø. polypropylen hlava-ocas (head-to-tail): [-CH 2 -CHCH 3 -CH 2 -CHCH 3 -], hlava-hlava (head-to-head): [-CH 2 -CHCH 3 -CHCH 3 -CH 2 -] strukturní, napø. cis, trans polybutadien -CH 2 -CH=CH-CH 2 - stereoizomerie { struktura okolo ètyøvazného C: izotaktický head-to-tail polypropylen, polyvinylchorid aj.: substituenty (postranní øetìzce) ve stejné konformaci vzhl. k øetìzci syndiotaktický: substituenty se pravidelnì støídají v konformaci vzhl. k øetìzci ataktický: substituenty se støídají náhodnì Kopolymery (2 typy monomerù), obecnì heteropolymery: støídavý ABABABABABABABABABAB náhodný ABBABAABABBABBAAABABBAB blokový AAAAABBBBBAAAABBBBBBAAA
6 Vìtvení 6/31 lineární kruhový ring hvìzda star høeben comb ¾ebøík ladder dendrimer zesítìný
7 Fraktály [show/fraktaly.sh] 7/31 Problém: jaká je délka pobøe¾í? Odpovìï: zále¾í na metru m: l = const m 1 D D = 1.02 pro Ji¾ní Afriku D = 1.25 pro západní pobøe¾í GB Fraktál: geometrický útvar, která je podobný (po transformaci obsahující zmìnu mìøítka) své èásti. Pro náhodný fraktál staèí podobnost ve statistickém smyslu (Skoro)denice fraktální dimenze: D = lim m 0 log N m log(1/m) kde N m = poèet úseèek/ètvereèkù/krychlièek... o délce/stranì/hranì/... m nutných k pokrytí útvaru. (1/m je poèet úseèek o délce m nutných k pokrytí jednotkové úseèky, která má dimenzi 1.)
8 Fraktální dimenze [mz show/kochsim.gif] 8/31 Pøíklad. Vypoètìte fraktální dimenzi úseèky o délce l. Odpovìï: N m = l/m, D = lim log(l/m)/ log(1/m) = 1 Pøíklad. Vypoètìte fraktální dimenzi Kochovy køivky ln 4/ ln 3. = 1.26 Pøíklad. Vypoètìte fraktální dimenzi trajektorie Brownova pohybu. 1 krok náhodné procházky o 1 ( 1/2, 1/2 ): R 2 = 1, m = 1, l = 1, N m = 1 2 kroky náhodné procházky: R 2 = 1, m = 1/ 2, l = 2, N m = l/m = 2 D = 2 (nezávisí na dimenzi prostoru.)
9 Distribuce velikosti øetìzcù 9/31 Monodisperzní polymer, koloid aj.: = v¹echny molekuly/èástice jsou stejné Polydisperzní = rùzná velikost. Popis: molární zlomek: x N = hmotnostní zlomek: w N = n N n N N m N mn = n NM N nn M N = Nn N NnN = Nx N NxN N Èíselnì (poèetnì) støední molární hmotnost (koligativní vlastnosti) M n = nn M N nn = x N M N Hmotnostnì støední molární hmotnost (rozptyl): nn M 2 M w = N = w nn M N M N N
10 Disperzita 10/31 je míra neuniformity velikostí èástic denovaná jako D = M w M n Té¾ se nazývá index polydisperzity (PDI, polydispersity index). Uniformní (monodisperzní) systém: D = 1. Neuniformní (polydisperzní) systém: D > 1. termíny monodisperzita, polydisperzita, PDI se podle IUPACu nedoporuèují Pøíklad. Ve tøídì je 20 anorketièek (m = 30 kg) a 10 tlou¹tíkù (m = 90 kg). Vypoètìte støední hmotnosti a disperzitu. Mn = 50 kg, Mw = 66 kg, Mz = 79.1 kg, D = 1.32
11 Ideální øetìzec 11/31 Ideální øetìzec je model lineárního polymeru, kdy jsou zanedbány interakce vzdálených èástí øetìzce mezi sebou. Jsou v¹ak uva¾ovány interakce blízkých èlánkù v tom smyslu, ¾e øetìzec není zcela exibilní. NB: Interakce = repulze (protínání) a atrakce (pøitahování), té¾ propletení (entanglement) Dobrý model pro: øetezec v tzv. θ-rozpou¹tìdle, kdy se pøita¾livé a odpudivé síly vyrovnávají jeden øetìzec v taveninì (rozpu¹tìný v ostatních øetìzcích) Øetìzec polymeru je: málo exibilní na krátkých vzdálenostech (nìkolik vazeb) zcela exibilní na del¹ích vzdálenostech
12 Konformace ideálního øetìzce Vzdálenost koncù (end-to-end), n= poèet vazeb: n R n = r i Izotropie: R n = 0 i=1 Støední kvadratická vzdálenost konec-konec: R 2 n Volnì spojené vazby stejné délky l, náhodný smìr: R 2 n = r i r i = r 2 i = nl2 i i i proto¾e r i r j = 0 pro i j. Obecnì r i r j 0 pro vazby blízko u sebe, r i r j 0 pro i, j daleko Floryho charakteristický pomìr C n = R 2 n R 2 n volnì spojený = 1 n 12/31 cos θ ij kde θ ij je úhel mezi r i a r j, r i r j = l cos θ ij. Obvykle nás zajímá limita: i j C = lim n C n = cos θ 0i, i=1 R 2 n n = C nl 2
13 Kuhnova délka 13/31 je délka vazby ekvivalentního volnì spojeného øetìzce stejné nata¾ené délky (contour length) R max R 2 n = n b b 2! = C nl 2, n b b = R max b = C nl 2 1,4-polyisopren: C = 4.7, b = 0.84 nm ataktický polystyren: C = 9.5, b = 1.8 nm R max
14 Pøíklad Vypoètìte Kuhnovu délku polyethylenu. Data: C = 7.4 CC = 1.54 A CCC= 112 [show simul/pe] 14/31 14 A
15 Volnì rotující (skloubený) øetìzec 15/31 úhel èlánkù θ = 180 vazebný úhel dal¹í èlánek nekorelován (nulový torzní èlen) Zøejmì r 0 r 1 = l 2 cos θ r random r 0 r 1 = cos θ r 0 + r random r 2 = cos θ r 1 + r random. cokoliv = 0 r 0 r j = l 2 cos θ 0j = l 2 cos j θ C = cos j θ = 1 + i=1 2 cos θ 1 cos θ = 1 + cos θ 1 cos θ Pro PE vyjde 2.2 { pøíli¹ málo (torzní èlen je významný)
16 Perzistentní délka øetìzce a ohebný øetìzec [simul/worm.sh] 16/31 Korelace podél øetìzce se zpravidla rozpadají exponenciálnì: r 0 r j l 2 = cos θ 0j = e z/l p, volnì rot.: cos θ 0j = cos j l θ l p = ln(cos θ) kde z = jl je délka mìøená podél øetìzce (contour) a l p je perzistentní délka øetìzce = charakteristická délka rozpadu korelací Ohebný øetìzec: worm-like, èervovitý, vhodný pro DNA ap. Z volnì rotujícího se získá limitou θ 0, l 0: Floryho pomìr: Kuhnova délka: l l p = ln(cos θ) = 2l θ 2 C = 1 + cos θ 1 cos θ 4 θ 2 b = C nl 2 R max = C nl 2 nl cos(θ/2) = 2l p DNA: l p = 50 nm, b = 100 nm; nanotrubièka více Ukázka: vazby α = 0, bez torze, ni¾¹í a vy¹¹í teplota slo¾itìj¹í modely mohou mít více perzistentních délek
17 Vzdálenost koncù ohebného øetìzce 17/31 krátký øetìzec: R R max = nl, R 2 = R 2 max dlouhý øetìzec: R 2 n C nl 2 = 2R max l p støednì dlouhý øetìzec: R 2 n = = 2 Rmax 0 Rmax 0 = 2l 2 p [ exp dy dy Rmax 0 Rmax y ( R max l p dz exp dz exp ) ( [ ] y z l p [ z y ] l p 1 R max l p )] Pøesnìj¹í modely Bránìná rotace (torze): π(φ) = exp[ u torsion (φ)/k B T] Pro velku bariéru torzního potenciálu staèí uva¾ovat stavy t, g +, g a místo integrace pøes úhly sèítáme pøes konformace øetìzce, napø.: {tttg + ttg tg + ttg tg + tttttg + tttg + ttg tg + ttt}
18 Polomìr setrvaènosti (gyraèní polomìr) 18/31 vhodný i pro vìtvené polymery experimentálnì lépe dostupný ne¾ konec-konec (difrakce) Pøedpoklad: v¹echny èlánky mají stejnou hmotnost R 2 g = 1 N N ( R i R cm ) 2 i=1 n = poèet vazeb N=poèet èlánkù N = n + 1 N R cm = 1 N R i Alternativní vyjádøení: i=1 R 2 g = 1 N N R 2 i R2 cm i=1 R 2 g = 1 N 2 ( R i R j ) 2 i<j Pøíklad: tyèinka délky R max : R 2 g = R 2 max/12
19 Polomìr setrvaènosti ideálního øetìzce [xmaple maple/gyr.mws] 19/31 Aproximace pro R max l g b, n N. Poèítáme støední hodnotu: kde R 2 g 1 n 2 n 0 dy n y dz [ R(y) R(z)] 2 [ R(y) R(z)] 2 = y z b 2 R 2 g nb2 6 podle denice Kuhnova monomeru R 2 = Nb 2 (Debye): R 2 g = R2 6 Pro kruhový (cyklický) polymer R 2 g = Nb2 12 Pro f-hvìzdu R 2 g = (N/f)b2 6 (3 2/f)
20 [traj/brown.sh] 20/31 Analogie ideálního øetìzce a Brownova pohybu Ideální lineární øetìzec: R 2 n = nb 2 Brownùv pohyb: R(τ) 2 = 6Dτ Analogie: nb 2 6Dτ Odvodili jsme (ve 3D): 3D: c( r, τ) = (4πDτ) 3/2 exp ( ) r2 4Dτ To¾ známe rozdìlovací funkci vzdáleností konec-konec: ( ) ) 2π 3/2 π(n, R) = 3 nb2 exp ( R2 2 3 nb2... platí pro R R max
21 Deformace øetìzce (entropická pru¾ina) π(n, R) = ( ) ) 2π 3/2 3 nb2 exp ( R2 2 3 nb2 þpoèetÿ øetìzcù délky n se vzdáleností koncù R je 21/31 W( R) = W 0 π(n, R) kde W 0 je konstanta (závislá na n). Entropie je pak: Helmholtzova energie S( R) = k B ln W( R) = S(0) k B R 2 F( R) = U TS = U(0) + k B T 2 3 nb2 R2 2 3 nb2 Síla ve smìru x ( R = (R x, R y, R z )): pro velké výchylky ( ) F pøestává být závislost f x vs. R x lineární x nb f x = = 3k BTR x R 2 energie je stejná, ale èím dále jsou konce, tím ménì je konformací { øízeno entropií
22 [cd pic; jkv -n1 -sf 22/31 Deformace øetìzce (entropická pru¾ina) II V¹imnìte si, ¾e F( R) U(0) = k B T R2 2 3 nb2 = 3 2 k BT R2 R 2 n, tj. klubko má energii k BT, je-li nata¾eno o svou velikost R 2 n 1/2. Natahujme klubko silou f x. Denujme \blob" jako èást klubka, která má: energii nata¾ení k B T g Kuhnových segmentù velikost ξ, R 2 g 1/2 = ξ nata¾ení ξ chová se (skoro) jako náhodné klubko: ξ 2 = gb 2 poèet blobù = n/g Proto¾e bloby jsou spojeny (skoro) za sebou, platí R x = ξn/g, g = (nb/r x ) 2 energie = k BTn g = k BTR 2 x nb 2 (øádovì to samé)
23 Reálný øetìzec: vylouèený objem 23/31 Pro èlánek = tuhá koule (jen repulze = odpudivost) { pro rèl < d u(r) = u(r) = 0 jindy je vylouèený objem roven: v = 4π 3 d3, d = 2r èl = dosah interakce Roz¹íøení denice zahrnující i pøita¾livé síly: [ ] v = e u(r)/kbt 1 d r dω dω pro nekulaté molekuly atermální rozpou¹tìdlo = jen repulze: v b 2 d na èlánek délky b dobré rozpou¹tìdlo 0 < v < b 2 d (PS v benzenu) theta-rozpou¹tìdlo v = 0 (PS v cyklohexanu, t = 34.5 C) ¹patné rozpou¹tìdlo b 2 d < v < 0 (PS v ethanolu) nerozpou¹tìdlo v b 2 d (PS ve vodì)
24 Floryho teorie polymeru v dobrém rozpou¹tìdle 24/31 klubko o velikosti R v roztoku je slo¾eno z N Kuhnových segmentù o velikosti b pøedpoklad: (Kuhnovy) èlánky (monomery) jsou rozmístìny rovnomìrnì pravdìp., ¾e 1 èlánek se dotkne jednoho z N jiných = vn/r 3 poèet dotykù celkem = vn 2 /R 3 energie na dotyk øádovì k B T Vnitøní energie: Entropie nata¾ení o R Helmholtzova energie: U k B Tv N2 R 3 S k BR 2 Nb 2 F = U TS k B T ( ) v N2 R 3 + R2 Nb 2
25 Floryho teorie polymeru v dobrém rozpou¹tìdle II 25/31 Helmholtzova energie: Minimum pro F = U TS k B T ( ) v N2 R 3 + R2 Nb 2 R = R F v 1/5 b 2/5 N 3/5 N 3/5 Pro srovnání: pøesnìj¹í teorie R N ideální øetìzec R N 1/2 Zdroj pøesnìj¹í teorie: MC neprotínající se náhodné procházky (self-avoiding walk) na møí¾ce { fraktál, univerzální chování. Pùvodní velikost = R id = bn 1/2, pomìr nabobtnání je R F R id = tj. klubko nabobtná pro N > b 6 /v 2. ( ) vn 1/2 1/5 b 3
26 Deformace øetìzce III 26/31 Klubko natahujeme silou f x. Na krátké ¹kále se (témìø) nenatahuje. Na ¹kále ξ se natáhne o ξ. Tento \blob" má: g èlánkù þelementární tepelnou energiiÿ k B T chová se (skoro) jako Floryho [ideální] klubko: 5/3 ξ g [1/2] Bloby ji¾ jsou spojeny (skoro) za sebou: R x = ξn/g = N/g2/5 [1/2] g = (N/R x ) 5/2 [2] K Energie = k BTN g = k B T ( R x R F [id] ) 5/2 [2] nata¾ení reálného øetìzce v dobrém rozpou¹tìdle staèí men¹í síla ne¾ pro ideální øetìzec. Síla pak ale roste s výchylkou rychleji.
27 Floryho teorie polymeru ve ¹patném rozpou¹tìdle 27/31 Helmholtzova energie: F = U TS k B T kde ale v < 0 minimum pro R = 0. ( ) v N2 R 3 + R2 Nb 2 klubko ve ¹patném rozpou¹tìdle se bude smr¹»ovat A¾ do R = 0 ale ne. Proti smr¹»ování pùsobí: pokles entropie zpùsobený omezením pohybu (nestaèí) tøíèásticové interakce (w) ( wn... po odvození vyjde R v ) 1/3... podobný výsledek odvodíme pozdìji na základì ¹kálovacích úvah
28 Závislost vylouèeného objemu na teplotì 28/31 Uva¾ujme pro jednoduchost model pravoúhlé jámy (square-well) 2 LJ u(r)/ε 1 mezi èlánky èi Kuhnovy segmenty 0 (aproximovanými sféricky symetrickou interakcí) r/σ, pro r < σ u SW (r) = ɛ, pro r < σ < λσ 0 pro λσ < r pak 3 HS r/σ [ ] v = e u(r)/kbt 1 d r = 4π 3 σ3 4π 3 σ3 (λ 3 1)(e ɛ/kbt 1) pro ɛ k B T (nebo v aproximaci støedního pole, λ, ɛ 0): ( v 1 θ ) b 3 T kde b 3 = 4π 3 σ3. Pozn.: T θ: atermální rozpou¹tìdlo (v = const) T = θ: theta-rozpou¹tìdlo, v = 0 SW r/σ
29 Vliv teploty na reálné øetìzce 29/31 Tepelný blob = témìø ideální oblast øetìzce s energií k B T: oznaème velikost = ξ T, poèet (Kuhnových) èlánkù = g T Idealita øetìzce: ξ T bg 1/2 T Z Floryho teorie: U k B T v N2 ξ 3 T! = k B T g T b6 v 2 Pozn.: v < 0 ¹patné rozpou¹tìdlo, v > 0 dobré rozpou¹tìdlo g T = 1, v b 3, ξ T b: rozvinutý øetìzec v atermálním rozpou¹tìdle g T = 1, v b 3, ξ T b: zkolabovaný øetìzec v ne-rozpou¹tìdle g T > N, v < b 3 N 1/2, ξ T > bn 1/2 : témìø ideální øetìzec (θ-rozpou¹tìdlo) 1 < g T < N, b 3 N 1/2 < v < b 3, b < ξ T < bn 1/2 : ideální na krátké ¹kále, neideální na del¹í = þneideální øetìzec z blobùÿ
30 Dlouhý reálný øetìzec 30/31... jako þneideální øetìzec z blobùÿ dobré rozpou¹tìdlo, v (b 3 N 1/2, b 3 ): øetìzec se chová jako náhodná procházka bez protínání N/g T odpuzujících se tepelných blobù, velikost (end-to-end vzdálenost) je R ξ T ( N g T ) Flory v 1/5 b 2/5 N 3/5 èím lep¹í rozpou¹tìdlo, tím men¹í jsou globule, je jich více a øetìzec víc nabobtná ¹patné rozpou¹tìdlo, v ( b 3, b 3 N 1/2 ): pøitahující se tepelné bloby se tìsnì slo¾í do globule o velikosti R ξ T ( N g T ) 1/3 b2 v 1/3N1/3 èím hor¹í rozpou¹tìdlo, tím vìt¹í hustota Kuhnových monomerù v blobu a proto i globule
31 Fraktální dimenze Øetìzec v lineární konformaci: velikost R N D = 1 31/31 Øetìzec v dobrém rozpou¹tìdle: R N N R 1/0.588 = R 1.7 D = 1.7 Øetìzec v θ-rozpou¹tìdle, trajektorie Brownova pohybu: R N 1/2 D = 2 Øetìzec ve ¹patném rozpou¹tìdle: D = 3 Dendrimer vzniklý difuznì øízenou agregací (ve 3D): D = 2.5 (obr. nahoøe) Brokolice D = 2.66 Povrch plic D = 2.97
Potenciální energie atom{atom
 Potenciální energie atom{atom 1/16 Londonovy (disperzní) síly: na del¹ích vzdálenostech, v¾dy pøita¾livé Model uktuující dipól { uktuující dipól elst. pole E 1/r 3 indukovaný dipól µ ind E energie u(r)
Potenciální energie atom{atom 1/16 Londonovy (disperzní) síly: na del¹ích vzdálenostech, v¾dy pøita¾livé Model uktuující dipól { uktuující dipól elst. pole E 1/r 3 indukovaný dipól µ ind E energie u(r)
Rovnováha kapalina{pára u binárních systémù
 Rovnováha kapalina{pára u binárních systémù 1 Pøedpoklad: 1 kapalná fáze Oznaèení: molární zlomky v kapalné fázi: x i molární zlomky v plynné fázi: y i Poèet stupòù volnosti: v = k f + 2 = 2 stav smìsi
Rovnováha kapalina{pára u binárních systémù 1 Pøedpoklad: 1 kapalná fáze Oznaèení: molární zlomky v kapalné fázi: x i molární zlomky v plynné fázi: y i Poèet stupòù volnosti: v = k f + 2 = 2 stav smìsi
Stanislav Labík. Ústav fyzikální chemie V CHT Praha budova A, 3. patro u zadního vchodu, místnost
 Stanislav Labík Ústav fyzikální chemie V CHT Praha budova A, 3. patro u zadního vchodu, místnost 325 labik@vscht.cz 220 444 257 http://www.vscht.cz/fch/ Výuka Letní semestr N403032 Základy fyzikální chemie
Stanislav Labík Ústav fyzikální chemie V CHT Praha budova A, 3. patro u zadního vchodu, místnost 325 labik@vscht.cz 220 444 257 http://www.vscht.cz/fch/ Výuka Letní semestr N403032 Základy fyzikální chemie
Viriálová stavová rovnice 1 + s.1
 Viriálová stavová rovnice 1 + s.1 (Mírnì nestandardní odvození Prùmìrná energie molekul okolo vybrané molekuly (β = 1/(k B T : 0 u(r e βu(r 4πr 2 dr Energie souboru N molekul: U = f 2 k B T + N 2 2V Tlak
Viriálová stavová rovnice 1 + s.1 (Mírnì nestandardní odvození Prùmìrná energie molekul okolo vybrané molekuly (β = 1/(k B T : 0 u(r e βu(r 4πr 2 dr Energie souboru N molekul: U = f 2 k B T + N 2 2V Tlak
Klasická termodynamika (aneb pøehled FCH I)
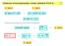 Klasická termodynamika (aneb pøehled FCH I) 1/16 0. zákon 1. zákon id. plyn: pv = nrt pv κ = konst (id., ad.) id. plyn: U = U(T) }{{} Carnotùv cyklus dq T = 0 2. zákon rg, K,... lim S = 0 T 0 S, ds = dq
Klasická termodynamika (aneb pøehled FCH I) 1/16 0. zákon 1. zákon id. plyn: pv = nrt pv κ = konst (id., ad.) id. plyn: U = U(T) }{{} Carnotùv cyklus dq T = 0 2. zákon rg, K,... lim S = 0 T 0 S, ds = dq
Aproximace funkcí. Chceme þvzoreèekÿ. Známe: celý prùbìh funkce
 Aproximace funkcí 1/13 Známe: celý prùbìh funkce Chceme þvzoreèekÿ hodnoty ve vybraných bodech, pøíp. i derivace Kvalita údajù: známe pøesnì (máme algoritmus) známe pøibli¾nì (experiment èi simulace) {
Aproximace funkcí 1/13 Známe: celý prùbìh funkce Chceme þvzoreèekÿ hodnoty ve vybraných bodech, pøíp. i derivace Kvalita údajù: známe pøesnì (máme algoritmus) známe pøibli¾nì (experiment èi simulace) {
Polymery struktura. Vlastnosti polymerů určeny jejich fyzikální a chemickou strukturou
 Polymery struktura Vlastnosti polymerů určeny jejich fyzikální a chemickou strukturou 1 vazba Atom (jádro, obal) elektronové orbitaly (s,p,d,f) - vrstvy (výstavbová pravidla, elektronová konfigurace) 2
Polymery struktura Vlastnosti polymerů určeny jejich fyzikální a chemickou strukturou 1 vazba Atom (jádro, obal) elektronové orbitaly (s,p,d,f) - vrstvy (výstavbová pravidla, elektronová konfigurace) 2
Neideální plyny. Z e dr dr dr. Integrace přes hybnosti. Neideální chování
 eideální plyny b H Q(, V, T )... e dp 3... dpdr... dr! h Integrace přes hybnosti QVT (,, ) pmkt! h 3 / e dr dr dr /... U kt... eideální chování p kt r B ( T) r B ( T) r 3 3 Vyšší koeficinety velice složité
eideální plyny b H Q(, V, T )... e dp 3... dpdr... dr! h Integrace přes hybnosti QVT (,, ) pmkt! h 3 / e dr dr dr /... U kt... eideální chování p kt r B ( T) r B ( T) r 3 3 Vyšší koeficinety velice složité
Stavové rovnice. v = (zobecnìný) vylouèený objem. plyn + kapalina
 Stavové rovnice Stavová rovnice je vztah mezi p, T, V a n (u smìsí slo¾ením n i ), alternativnì p, T, Vm = V/n (u smìsí je¹tì x i ) èi jinými ekvivalentními velièinami. plyn ideální plyn: pvm/rt = 1 viriálová
Stavové rovnice Stavová rovnice je vztah mezi p, T, V a n (u smìsí slo¾ením n i ), alternativnì p, T, Vm = V/n (u smìsí je¹tì x i ) èi jinými ekvivalentními velièinami. plyn ideální plyn: pvm/rt = 1 viriálová
Termochemie { práce. Práce: W = s F nebo W = F ds. Objemová práce (p vn = vnìj¹í tlak): W = p vn dv. Vratný dìj: p = p vn (ze stavové rovnice) W =
 Termochemie { práce Práce: W = s F nebo W = Objemová práce (p vn = vnìj¹í tlak): W = V2 V 1 p vn dv s2 Vratný dìj: p = p vn (ze stavové rovnice) W = V2 V 1 p dv s 1 F ds s.1 Diferenciální tvar: dw = pdv
Termochemie { práce Práce: W = s F nebo W = Objemová práce (p vn = vnìj¹í tlak): W = V2 V 1 p vn dv s2 Vratný dìj: p = p vn (ze stavové rovnice) W = V2 V 1 p dv s 1 F ds s.1 Diferenciální tvar: dw = pdv
MAKROMOLEKULÁRNÍ CHEMIE
 MAKROMOLEKULÁRNÍ Doporučená literatura: CHEMIE OCH/MMC/MMCH doc.rndr. Jakub Stýskala, Ph.D. 1. Nálepa K.: Stručné základy chemie a fyziky polymerů, UPOL, 1990 2. Vollmert B: Základy makromolekulární chemie,
MAKROMOLEKULÁRNÍ Doporučená literatura: CHEMIE OCH/MMC/MMCH doc.rndr. Jakub Stýskala, Ph.D. 1. Nálepa K.: Stručné základy chemie a fyziky polymerů, UPOL, 1990 2. Vollmert B: Základy makromolekulární chemie,
Plyn. 11 plynných prvků. Vzácné plyny. He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2
 Plyny Plyn T v, K Vzácné plyny 11 plynných prvků He, Ne, Ar, Kr, Xe, Rn 165 Rn 211 N 2 O 2 77 F 2 90 85 Diatomické plynné prvky Cl 2 238 H 2, N 2, O 2, F 2, Cl 2 H 2 He Ne Ar Kr Xe 20 4.4 27 87 120 1 Plyn
Plyny Plyn T v, K Vzácné plyny 11 plynných prvků He, Ne, Ar, Kr, Xe, Rn 165 Rn 211 N 2 O 2 77 F 2 90 85 Diatomické plynné prvky Cl 2 238 H 2, N 2, O 2, F 2, Cl 2 H 2 He Ne Ar Kr Xe 20 4.4 27 87 120 1 Plyn
Polymery struktura. Vlastnosti polymerů určeny jejich fyzikální a chemickou strukturou
 Polymery struktura Vlastnosti polymerů určeny jejich fyzikální a chemickou strukturou 1 2 Chemická vazba 3 Teorie kovalentní vazby - překryv elektronových orbitalů - sdílený elektronový pár - energie vazby
Polymery struktura Vlastnosti polymerů určeny jejich fyzikální a chemickou strukturou 1 2 Chemická vazba 3 Teorie kovalentní vazby - překryv elektronových orbitalů - sdílený elektronový pár - energie vazby
Matematika II Lineární diferenciální rovnice
 Matematika II Lineární diferenciální rovnice RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Lineární diferenciální rovnice Denice
Matematika II Lineární diferenciální rovnice RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Lineární diferenciální rovnice Denice
Matematika II Urèitý integrál
 Matematika II Urèitý integrál RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Motivace Je dána funkce f(x) = 2 + x2 x 4. Urèete co
Matematika II Urèitý integrál RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Motivace Je dána funkce f(x) = 2 + x2 x 4. Urèete co
Statistická termodynamika (mechanika)
 Statistická termodynamika (mechanika) 1/16 Makroskopické velièiny jsou výsledkem zprùmìrovaného chování mnoha èástic Tlak ideálního plynu z kinetické teorie 1 [tchem/simplyn.sh] 2/16 Molekula = hmotný
Statistická termodynamika (mechanika) 1/16 Makroskopické velièiny jsou výsledkem zprùmìrovaného chování mnoha èástic Tlak ideálního plynu z kinetické teorie 1 [tchem/simplyn.sh] 2/16 Molekula = hmotný
Nekovalentní interakce
 Nekovalentní interakce Jan Řezáč UOCHB AV ČR 31. října 2017 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 31. října 2017 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii 4 Výpočty
Nekovalentní interakce Jan Řezáč UOCHB AV ČR 31. října 2017 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 31. října 2017 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii 4 Výpočty
III. STRUKTURA A VLASTNOSTI PLYNŮ
 III. STRUKTURA A VLASTNOSTI PLYNŮ 3.1 Ideální plyn a) ideální plyn model, předpoklady: 1. rozměry molekul malé (ve srovnání se střední vzdáleností molekul). molekuly na sebe navzálem silově nepůsobí (mimo
III. STRUKTURA A VLASTNOSTI PLYNŮ 3.1 Ideální plyn a) ideální plyn model, předpoklady: 1. rozměry molekul malé (ve srovnání se střední vzdáleností molekul). molekuly na sebe navzálem silově nepůsobí (mimo
Látkové množství n poznámky 6.A GVN
 Látkové množství n poznámky 6.A GVN 10. září 2007 charakterizuje látky z hlediska počtu částic (molekul, atomů, iontů), které tato látka obsahuje je-li v tělese z homogenní látky N částic, pak látkové
Látkové množství n poznámky 6.A GVN 10. září 2007 charakterizuje látky z hlediska počtu částic (molekul, atomů, iontů), které tato látka obsahuje je-li v tělese z homogenní látky N částic, pak látkové
Polymery lze rozdělit podle několika kritérií. Podle původu rozlišujeme polymery přírodní a syntetické. Přírodní polymery jsou:
 MAKROMOLEKULÁRNÍ LÁTKY (POLYMERY) Makromolekuly jsou molekulové systémy složené z velkého počtu atomů vázaných chemickými vazbami do dlouhých řetězců. Tyto řetězce tvoří pravidelně se opakující části,
MAKROMOLEKULÁRNÍ LÁTKY (POLYMERY) Makromolekuly jsou molekulové systémy složené z velkého počtu atomů vázaných chemickými vazbami do dlouhých řetězců. Tyto řetězce tvoří pravidelně se opakující části,
Polymery základní pojmy, názvosloví, struktura
 Polymery základní pojmy, názvosloví, struktura 1 Literatura: H. Schejbalová/ I. Stibor, Úvod do studia organické a makromolekulární chemie, TUL, 2004 I. Prokopová, Makromolekulární chemie, VŠCHT Praha,
Polymery základní pojmy, názvosloví, struktura 1 Literatura: H. Schejbalová/ I. Stibor, Úvod do studia organické a makromolekulární chemie, TUL, 2004 I. Prokopová, Makromolekulární chemie, VŠCHT Praha,
Vlastnosti polymerů určeny jejich fyzikální a chemickou strukturou
 struktura Vlastnosti polymerů určeny jejich fyzikální a chemickou strukturou izolované makromolekuly Konstituce: typ a řazení jednotek, (kovalentní, primární struktura) Konfigurace: prostorové uspořádání
struktura Vlastnosti polymerů určeny jejich fyzikální a chemickou strukturou izolované makromolekuly Konstituce: typ a řazení jednotek, (kovalentní, primární struktura) Konfigurace: prostorové uspořádání
MATERIÁLOVÁ PROBLEMATIKA PŘI SEPARACI PLYNŮ A PAR
 MATERIÁLOVÁ PROBLEMATIKA PŘI SEPARACI PLYNŮ A PAR Ing. Miroslav Bleha, CSc. Ústav makromolekulární chemie AV ČR, v.v.i. bleha@imc.cas.cz Membrány - separační medium i chemický reaktor Membránové materiály
MATERIÁLOVÁ PROBLEMATIKA PŘI SEPARACI PLYNŮ A PAR Ing. Miroslav Bleha, CSc. Ústav makromolekulární chemie AV ČR, v.v.i. bleha@imc.cas.cz Membrány - separační medium i chemický reaktor Membránové materiály
Opakování: Standardní stav þ ÿ
 Opakování: Standardní stav þ ÿ s.1 12. øíjna 215 Standardní stav þ ÿ = èistá slo¾ka ve stavu ideálního plynu za teploty soustavy T a standardního tlaku = 1 kpa, døíve 11,325 kpa. Èistá látka: Pøibli¾nì:
Opakování: Standardní stav þ ÿ s.1 12. øíjna 215 Standardní stav þ ÿ = èistá slo¾ka ve stavu ideálního plynu za teploty soustavy T a standardního tlaku = 1 kpa, døíve 11,325 kpa. Èistá látka: Pøibli¾nì:
VLASTNOSTI VLÁKEN. 3. Tepelné vlastnosti vláken
 VLASNOSI VLÁKEN 3. epelné vlastnosti vláken 3.. Úvod epelné vlastnosti vláken jsou velice důležité, neboť jsou rozhodující pro volbu vhodných parametrů zpracování i použití vláken. Závisí na chemickém
VLASNOSI VLÁKEN 3. epelné vlastnosti vláken 3.. Úvod epelné vlastnosti vláken jsou velice důležité, neboť jsou rozhodující pro volbu vhodných parametrů zpracování i použití vláken. Závisí na chemickém
Nekovalentní interakce
 Nekovalentní interakce Jan Řezáč UOCHB AV ČR 3. listopadu 2016 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 3. listopadu 2016 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii
Nekovalentní interakce Jan Řezáč UOCHB AV ČR 3. listopadu 2016 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 3. listopadu 2016 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii
Polymery: minimum, které bychom si měli pamatovat. Lukáš Horný
 Polymery: minimum, které bychom si měli pamatovat ČVUT v Praze, fakulta strojní, ústav mechaniky, biomechaniky a mechatroniky Obor: Biomechanika a lékařské přístroje Lukáš Horný Lukas.horny@fs.cvut.cz
Polymery: minimum, které bychom si měli pamatovat ČVUT v Praze, fakulta strojní, ústav mechaniky, biomechaniky a mechatroniky Obor: Biomechanika a lékařské přístroje Lukáš Horný Lukas.horny@fs.cvut.cz
Teorie Pøíèné vlny se ¹íøí v napjaté strunì pøibli¾nì rychlostí. v =
 24. roèník, úloha V. E... strunatci (8 bodù; prùmìr 4,80; øe¹ilo 5 studentù) Vytvoøte si zaøízení, na kterém bude moci být upevnìna struna (èi gumièka) s promìnlivou délkou tak, ¾e bude napínána stále
24. roèník, úloha V. E... strunatci (8 bodù; prùmìr 4,80; øe¹ilo 5 studentù) Vytvoøte si zaøízení, na kterém bude moci být upevnìna struna (èi gumièka) s promìnlivou délkou tak, ¾e bude napínána stále
Matematika II Limita a spojitost funkce, derivace
 Matematika II Limita a spojitost funkce, derivace RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Prstencové a kruhové okolí bodu
Matematika II Limita a spojitost funkce, derivace RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Prstencové a kruhové okolí bodu
Matematika II Funkce více promìnných
 Matematika II Funkce více promìnných RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Euklidovský n-rozmìrný prostor Def. Euklidovským
Matematika II Funkce více promìnných RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Euklidovský n-rozmìrný prostor Def. Euklidovským
Typy molekul, látek a jejich vazeb v organismech
 Typy molekul, látek a jejich vazeb v organismech Typy molekul, látek a jejich vazeb v organismech Organismy se skládají z molekul rozličných látek Jednotlivé látky si organismus vytváří sám z jiných látek,
Typy molekul, látek a jejich vazeb v organismech Typy molekul, látek a jejich vazeb v organismech Organismy se skládají z molekul rozličných látek Jednotlivé látky si organismus vytváří sám z jiných látek,
Struktura polymerů. Příprava (výroba).struktura vlastnosti. Materiálové inženýrství (Nauka o materiálu) Základní představy: přírodní vs.
 Struktura polymerů Základní představy: přírodní vs. syntetické V.Švorčík, vaclav.svorcik@vscht.cz celulóza přírodní kaučuk Příprava (výroba).struktura vlastnosti Materiálové inženýrství (Nauka o materiálu)
Struktura polymerů Základní představy: přírodní vs. syntetické V.Švorčík, vaclav.svorcik@vscht.cz celulóza přírodní kaučuk Příprava (výroba).struktura vlastnosti Materiálové inženýrství (Nauka o materiálu)
Termické chování polymerů
 Termické chování polymerů 1 amorfní a semikrystalické polymery Semikrystalické polymery krystalická fáze je rozptýlena ve fázi amorfní (dvoufázový systém). Kryst. fáze těsnější uložení makromolekul roste
Termické chování polymerů 1 amorfní a semikrystalické polymery Semikrystalické polymery krystalická fáze je rozptýlena ve fázi amorfní (dvoufázový systém). Kryst. fáze těsnější uložení makromolekul roste
Genomické databáze. Shlukování proteinových sekvencí. Ivana Rudolfová. školitel: doc. Ing. Jaroslav Zendulka, CSc.
 Genomické databáze Shlukování proteinových sekvencí Ivana Rudolfová školitel: doc. Ing. Jaroslav Zendulka, CSc. Obsah Proteiny Zdroje dat Predikce struktury proteinů Cíle disertační práce Vstupní data
Genomické databáze Shlukování proteinových sekvencí Ivana Rudolfová školitel: doc. Ing. Jaroslav Zendulka, CSc. Obsah Proteiny Zdroje dat Predikce struktury proteinů Cíle disertační práce Vstupní data
Pravdìpodobnostní popis
 Pravdìpodobnostní popis 1/19 klasická mechanika { stav = { r 1,..., r N, p 1,..., p N } stavù je { hustota pravdìpodobnosti stavù ρ( r 1,..., r N, p 1,..., p N ) kvantové mechaniky { stav = stavù je koneènì
Pravdìpodobnostní popis 1/19 klasická mechanika { stav = { r 1,..., r N, p 1,..., p N } stavù je { hustota pravdìpodobnosti stavù ρ( r 1,..., r N, p 1,..., p N ) kvantové mechaniky { stav = stavù je koneènì
8 Elasticita kaučukových sítí
 8 Elasticita kaučukových sítí Elastomerní polymerní látky (např. kaučuky) tvoří ze / chemické příčné vazby a / fyzikální uzly. Vyznačují se schopností deformovat se již malou silou nejméně o 00 % své původní
8 Elasticita kaučukových sítí Elastomerní polymerní látky (např. kaučuky) tvoří ze / chemické příčné vazby a / fyzikální uzly. Vyznačují se schopností deformovat se již malou silou nejméně o 00 % své původní
Rozpustnost Rozpustnost neelektrolytů
 Rozpustnost Podobné se rozpouští v podobném látky jejichž molekuly na sebe působí podobnými mezimolekulárními silami budou pravděpodobně navzájem rozpustné. Př.: nepolární látky jsou rozpustné v nepolárních
Rozpustnost Podobné se rozpouští v podobném látky jejichž molekuly na sebe působí podobnými mezimolekulárními silami budou pravděpodobně navzájem rozpustné. Př.: nepolární látky jsou rozpustné v nepolárních
Statistická termodynamika (mechanika)
 Statistická termodynamika (mechanika) 1/18 Makroskopické velièiny jsou výsledkem zprùmìrovaného chování mnoha èástic Tlak ideálního plynu z kinetické teorie 1 [simolant -I0] 2/18 Molekula = hmotný bod
Statistická termodynamika (mechanika) 1/18 Makroskopické velièiny jsou výsledkem zprùmìrovaného chování mnoha èástic Tlak ideálního plynu z kinetické teorie 1 [simolant -I0] 2/18 Molekula = hmotný bod
Molekulová fyzika a termika. Přehled základních pojmů
 Molekulová fyzika a termika Přehled základních pojmů Kinetická teorie látek Vychází ze tří experimentálně ověřených poznatků: 1) Látky se skládají z částic - molekul, atomů nebo iontů, mezi nimiž jsou
Molekulová fyzika a termika Přehled základních pojmů Kinetická teorie látek Vychází ze tří experimentálně ověřených poznatků: 1) Látky se skládají z částic - molekul, atomů nebo iontů, mezi nimiž jsou
Plasty. Základy materiálového inženýrství. Katedra materiálu Strojní fakulty Technická univerzita v Liberci Doc. Ing. Karel Daďourek, 2010
 Plasty Základy materiálového inženýrství Katedra materiálu Strojní fakulty Technická univerzita v Liberci Doc. Ing. Karel Daďourek, 2010 Základní vlastnosti plastů Výroba z levných surovin. Jsou to sloučeniny
Plasty Základy materiálového inženýrství Katedra materiálu Strojní fakulty Technická univerzita v Liberci Doc. Ing. Karel Daďourek, 2010 Základní vlastnosti plastů Výroba z levných surovin. Jsou to sloučeniny
Fyzikální chemie. Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302. 14. února 2013
 Fyzikální chemie Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302 14. února 2013 Co je fyzikální chemie? Co je fyzikální chemie? makroskopický přístup: (klasická) termodynamika nerovnovážná
Fyzikální chemie Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302 14. února 2013 Co je fyzikální chemie? Co je fyzikální chemie? makroskopický přístup: (klasická) termodynamika nerovnovážná
Plyn. 11 plynných prvků. Vzácné plyny. He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2
 Plyny Plyn T v, K Vzácné plyny 11 plynných prvků He, Ne, Ar, Kr, Xe, Rn 165 Rn 211 N 2 O 2 77 F 2 90 85 Diatomické plynné prvky Cl 2 238 H 2, N 2, O 2, F 2, Cl 2 H 2 He Ne Ar Kr Xe 20 4.4 27 87 120 1 Plyn
Plyny Plyn T v, K Vzácné plyny 11 plynných prvků He, Ne, Ar, Kr, Xe, Rn 165 Rn 211 N 2 O 2 77 F 2 90 85 Diatomické plynné prvky Cl 2 238 H 2, N 2, O 2, F 2, Cl 2 H 2 He Ne Ar Kr Xe 20 4.4 27 87 120 1 Plyn
Matematika II, úroveň A ukázkový test č. 1 (2018) 1. a) Napište postačující podmínku pro diferencovatelnost funkce n-proměnných v otevřené
 2. 3. 2018 Matematika II, úroveň A ukázkový test č. 1 (2018) 1. a) Napište postačující podmínku pro diferencovatelnost funkce n-proměnných v otevřené mn. M E n. Zapište a načrtněte množinu D, ve které
2. 3. 2018 Matematika II, úroveň A ukázkový test č. 1 (2018) 1. a) Napište postačující podmínku pro diferencovatelnost funkce n-proměnných v otevřené mn. M E n. Zapište a načrtněte množinu D, ve které
 Antonín Kamarýt Opakujeme si MATEMATIKU 3 doplnìné vydání Pøíprava k pøijímacím zkouškám na støední školy Pøíruèka má za úkol pomoci ètenáøùm pøipravit se k pøijímacím zkouškám na støední školu Pøíruèka
Antonín Kamarýt Opakujeme si MATEMATIKU 3 doplnìné vydání Pøíprava k pøijímacím zkouškám na støední školy Pøíruèka má za úkol pomoci ètenáøùm pøipravit se k pøijímacím zkouškám na støední školu Pøíruèka
nomenklatura Procesní názvy Strukturní názvy
 nomenklatura Procesní názvy skládají se z triviálního nebo semisystematického názvu monomeru použitého pro jejich syntézu s předsazením předpony poly- (např. polystyren, polyakrylonitril) Strukturní názvy
nomenklatura Procesní názvy skládají se z triviálního nebo semisystematického názvu monomeru použitého pro jejich syntézu s předsazením předpony poly- (např. polystyren, polyakrylonitril) Strukturní názvy
Fourierovské metody v teorii difrakce a ve strukturní analýze
 Osnova přednášky na 31 kolokviu Krystalografické společnosti Výpočetní metody v rtg a neutronové strukturní analýze Nové Hrady, 16 20 6 2003 Fourierovské metody v teorii difrakce a ve strukturní analýze
Osnova přednášky na 31 kolokviu Krystalografické společnosti Výpočetní metody v rtg a neutronové strukturní analýze Nové Hrady, 16 20 6 2003 Fourierovské metody v teorii difrakce a ve strukturní analýze
Fluktuace termodynamických veličin
 Kvantová a statistická fyzika (Termodynamika a statistická fyzika Fluktuace termodynamických veličin Fluktuace jsou odchylky hodnot fyzikálních veličin od svých středních (rovnovážných hodnot. Mají původ
Kvantová a statistická fyzika (Termodynamika a statistická fyzika Fluktuace termodynamických veličin Fluktuace jsou odchylky hodnot fyzikálních veličin od svých středních (rovnovážných hodnot. Mají původ
Prof. Ing. Václav Švorčík, DrSc.
 Prof. Ing. Václav Švorčík, DrSc. Ústav inženýrství pevných látek Fakulta chemické technologie Vysoká škola chemicko-technologická v Praze tel.: 220445149, 220445150 e-mail: vaclav.svorcik@vscht.cz tkáňové
Prof. Ing. Václav Švorčík, DrSc. Ústav inženýrství pevných látek Fakulta chemické technologie Vysoká škola chemicko-technologická v Praze tel.: 220445149, 220445150 e-mail: vaclav.svorcik@vscht.cz tkáňové
11. Koloidní roztoky makromolekul
 11. Koloidní roztoky makromolekul Vysokomolekulární látky se ve vhodném rozpouštědle mohou samovolně rozpouštět za vzniku termodynamicky stálých pravých roztoků, jejichž částice koloidních rozměrů jsou
11. Koloidní roztoky makromolekul Vysokomolekulární látky se ve vhodném rozpouštědle mohou samovolně rozpouštět za vzniku termodynamicky stálých pravých roztoků, jejichž částice koloidních rozměrů jsou
Matematika II Aplikace derivací
 Matematika II Aplikace derivací RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Derivace slo¾ené funkce Vìta o derivaci slo¾ené funkce.
Matematika II Aplikace derivací RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Derivace slo¾ené funkce Vìta o derivaci slo¾ené funkce.
Matematika I Ètvercové matice - determinanty
 Matematika I Ètvercové matice - determinanty RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Co u¾ známe? vektory - základní operace
Matematika I Ètvercové matice - determinanty RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Co u¾ známe? vektory - základní operace
Matematika II Extrémy funkcí více promìnných
 Matematika II Extrémy funkcí více promìnných RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Parciální derivace vy¹¹ích øádù Def.
Matematika II Extrémy funkcí více promìnných RNDr. Renata Klufová, Ph. D. Jihoèeská univerzita v Èeských Budìjovicích EF Katedra aplikované matematiky a informatiky Parciální derivace vy¹¹ích øádù Def.
Prof. Ing. Václav Švorčík, DrSc.
 Prof. Ing. Václav Švorčík, DrSc. Ústav inženýrství pevných látek Fakulta chemické technologie Vysoká škola chemicko-technologická v Praze tel.: 220445149, 220445150 e-mail: vaclav.svorcik@vscht.cz Sylabus
Prof. Ing. Václav Švorčík, DrSc. Ústav inženýrství pevných látek Fakulta chemické technologie Vysoká škola chemicko-technologická v Praze tel.: 220445149, 220445150 e-mail: vaclav.svorcik@vscht.cz Sylabus
Monte Carlo. Simulační metoda založená na užití stochastických procesů a generace náhodných čísel.
 Monte Carlo Simulační metoda založená na užití stochastických procesů a generace náhodných čísel. Typy MC simulací a) MC integrace b) Geometrické MC c) Termodynamické MC d) Modelování vývoje na strukturální
Monte Carlo Simulační metoda založená na užití stochastických procesů a generace náhodných čísel. Typy MC simulací a) MC integrace b) Geometrické MC c) Termodynamické MC d) Modelování vývoje na strukturální
CVIČENÍ č. 3 STATIKA TEKUTIN
 Rovnováha, Síly na rovinné stěny CVIČENÍ č. 3 STATIKA TEKUTIN Příklad č. 1: Nákladní automobil s cisternou ve tvaru kvádru o rozměrech H x L x B se pohybuje přímočarým pohybem po nakloněné rovině se zrychlením
Rovnováha, Síly na rovinné stěny CVIČENÍ č. 3 STATIKA TEKUTIN Příklad č. 1: Nákladní automobil s cisternou ve tvaru kvádru o rozměrech H x L x B se pohybuje přímočarým pohybem po nakloněné rovině se zrychlením
Reologie tavenin polystyrenových plastů. Závěrečná práce LS Pythagoras
 Reologie tavenin polystyrenových plastů Závěrečná práce LS Pythagoras Úvod, cíl práce Reologické vlastnosti taveniny PS plastů jsou důležitou informací při jejich zpracování vytlačováním nebo vstřikováním
Reologie tavenin polystyrenových plastů Závěrečná práce LS Pythagoras Úvod, cíl práce Reologické vlastnosti taveniny PS plastů jsou důležitou informací při jejich zpracování vytlačováním nebo vstřikováním
Vybrané technologie povrchových úprav. Základy vakuové techniky Doc. Ing. Karel Daďourek 2006
 Vybrané technologie povrchových úprav Základy vakuové techniky Doc. Ing. Karel Daďourek 2006 Střední rychlost plynů Rychlost molekuly v p = (2 k N A ) * (T/M 0 ), N A = 6. 10 23 molekul na mol (Avogadrova
Vybrané technologie povrchových úprav Základy vakuové techniky Doc. Ing. Karel Daďourek 2006 Střední rychlost plynů Rychlost molekuly v p = (2 k N A ) * (T/M 0 ), N A = 6. 10 23 molekul na mol (Avogadrova
TRUBKA COBRAPEX S KYSLÍKOVOU BARIÉROU
 TRUBKA COBRAPEX S KYSLÍKOVOU BARIÉROU 2 TRUBKA COBRAPEX S KYSLÍK. BARIÉROU 2.1. TRUBKA COBRAPEX Trubka COBRAPEX s EVOH (ethylen vinyl alkohol) kyslíkovou bariérou z vysokohustotního polyethylenu síťovaného
TRUBKA COBRAPEX S KYSLÍKOVOU BARIÉROU 2 TRUBKA COBRAPEX S KYSLÍK. BARIÉROU 2.1. TRUBKA COBRAPEX Trubka COBRAPEX s EVOH (ethylen vinyl alkohol) kyslíkovou bariérou z vysokohustotního polyethylenu síťovaného
Aplikace multifraktální geometrie na finančních trzích
 Aplikace multifraktální geometrie na finančních trzích 5. studentské kolokvium a letní škola matematické fyziky Stará Lesná Fakulta jaderná a fyzikálně inženýrská ČVUT, Praha 1. 9. 2011 Úvod náhodné procesy
Aplikace multifraktální geometrie na finančních trzích 5. studentské kolokvium a letní škola matematické fyziky Stará Lesná Fakulta jaderná a fyzikálně inženýrská ČVUT, Praha 1. 9. 2011 Úvod náhodné procesy
Text m ºe být postupn upravován a dopl ován. Datum poslední úpravy najdete u odkazu na staºení souboru. Veronika Sobotíková
 Tento text není samostatným studijním materiálem. Jde jen o prezentaci promítanou na p edná²kách, kde k ní p idávám slovní komentá. N které d leºité ásti látky pí²u pouze na tabuli a nejsou zde obsaºeny.
Tento text není samostatným studijním materiálem. Jde jen o prezentaci promítanou na p edná²kách, kde k ní p idávám slovní komentá. N které d leºité ásti látky pí²u pouze na tabuli a nejsou zde obsaºeny.
Statistická termodynamika (mechanika) Makroskopické velièiny jsou výsledkem zprùmìrovaného chování mnoha èástic
 Statistická termodynamika (mechanika) 1/23 Makroskopické velièiny jsou výsledkem zprùmìrovaného chování mnoha èástic Tlak ideálního plynu z kinetické teorie 1 [simolant -I0] 2/23 Molekula = hmotný bod
Statistická termodynamika (mechanika) 1/23 Makroskopické velièiny jsou výsledkem zprùmìrovaného chování mnoha èástic Tlak ideálního plynu z kinetické teorie 1 [simolant -I0] 2/23 Molekula = hmotný bod
Plyn. 11 plynných prvků. Vzácné plyny He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2
 Plyny Plyn T v, K 11 plynných prvků Vzácné plyny He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2 H 2 20 He 4.4 Ne 27 Ar 87 Kr 120 Xe 165 Rn 211 N 2 77 O 2 90 F 2 85 Cl 2 238 1 Plyn
Plyny Plyn T v, K 11 plynných prvků Vzácné plyny He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2 H 2 20 He 4.4 Ne 27 Ar 87 Kr 120 Xe 165 Rn 211 N 2 77 O 2 90 F 2 85 Cl 2 238 1 Plyn
Úloha 1: Vypočtěte hustotu uhlíku (diamant), křemíku, germania a α-sn (šedý cín) z mřížkové konstanty a hmotnosti jednoho atomu.
 Úloha : Vypočtěte hustotu uhlíku (diamant), křemíku, germania a α-sn (šedý cín) z mřížkové konstanty a hmotnosti jednoho atomu. Všechny zadané prvky mají krystalovou strukturu kub. diamantu. (http://en.wikipedia.org/wiki/diamond_cubic),
Úloha : Vypočtěte hustotu uhlíku (diamant), křemíku, germania a α-sn (šedý cín) z mřížkové konstanty a hmotnosti jednoho atomu. Všechny zadané prvky mají krystalovou strukturu kub. diamantu. (http://en.wikipedia.org/wiki/diamond_cubic),
Odhad změny rotace Země při změně poloměru
 Odhad změny rotace Země při změně poloměru NDr. Pavel Samohýl. Seznam symbolů A, A, A součinitel vztahu pro závislost hustoty Země na vzdálenosti od středu, totéž v minulosti a současnosti B, B, B součinitel
Odhad změny rotace Země při změně poloměru NDr. Pavel Samohýl. Seznam symbolů A, A, A součinitel vztahu pro závislost hustoty Země na vzdálenosti od středu, totéž v minulosti a současnosti B, B, B součinitel
N A = 6,023 10 23 mol -1
 Pro vyjadřování množství látky se v chemii zavádí veličina látkové množství. Značí se n, jednotkou je 1 mol. Látkové množství je jednou ze základních veličin soustavy SI. Jeden mol je takové množství látky,
Pro vyjadřování množství látky se v chemii zavádí veličina látkové množství. Značí se n, jednotkou je 1 mol. Látkové množství je jednou ze základních veličin soustavy SI. Jeden mol je takové množství látky,
Kapitoly z fyzikální chemie KFC/KFCH. I. Základní pojmy FCH a kinetická teorie plynů
 Kapitoly z fyzikální chemie KFC/KFCH I. Základní pojmy FCH a kinetická teorie plynů RNDr. Karel Berka, Ph.D. Univerzita Palackého v Olomouci Zkouška a doporučená literatura Ústní kolokvium Doporučená literatura
Kapitoly z fyzikální chemie KFC/KFCH I. Základní pojmy FCH a kinetická teorie plynů RNDr. Karel Berka, Ph.D. Univerzita Palackého v Olomouci Zkouška a doporučená literatura Ústní kolokvium Doporučená literatura
Tématické celky { kontrolní otázky.
 Tématické celky kontrolní otázky. Základy teorie pravdìpodobnosti..pravdìpodobnostní míra základní pojmy... Vysvìtlete pojem náhody, náhodného pokusu, náhodného jevu a jeho mno- ¾inovou interpretaci. Popi¹te
Tématické celky kontrolní otázky. Základy teorie pravdìpodobnosti..pravdìpodobnostní míra základní pojmy... Vysvìtlete pojem náhody, náhodného pokusu, náhodného jevu a jeho mno- ¾inovou interpretaci. Popi¹te
Fázová rozhraní a mezifázová energie
 Fázová rozhraní a mezifázová energie druhy: l/g l/l }{{} mobilní s/g s/l s/s 1/14 Pøíklad. Kolik % molekul vody je na povrchu kapièky mlhy o prùmìru a) 0.1 mm (hranice viditelnosti okem) b) 200 nm (hranice
Fázová rozhraní a mezifázová energie druhy: l/g l/l }{{} mobilní s/g s/l s/s 1/14 Pøíklad. Kolik % molekul vody je na povrchu kapièky mlhy o prùmìru a) 0.1 mm (hranice viditelnosti okem) b) 200 nm (hranice
Vektor náhodných veli in - práce s více prom nnými
 Vektor náhodných veli in - práce s více prom nnými 12. kv tna 2015 N kdy k popisu n jaké situace pot ebujeme více neº jednu náhodnou veli inu. Nap. v k, hmotnost, vý²ku. Mezi t mito veli inami mohou být
Vektor náhodných veli in - práce s více prom nnými 12. kv tna 2015 N kdy k popisu n jaké situace pot ebujeme více neº jednu náhodnou veli inu. Nap. v k, hmotnost, vý²ku. Mezi t mito veli inami mohou být
Diferenciální rovnice a jejich aplikace. (Brkos 2011) Diferenciální rovnice a jejich aplikace 1 / 36
 Diferenciální rovnice a jejich aplikace Zdeněk Kadeřábek (Brkos 2011) Diferenciální rovnice a jejich aplikace 1 / 36 Obsah 1 Co to je derivace? 2 Diferenciální rovnice 3 Systémy diferenciálních rovnic
Diferenciální rovnice a jejich aplikace Zdeněk Kadeřábek (Brkos 2011) Diferenciální rovnice a jejich aplikace 1 / 36 Obsah 1 Co to je derivace? 2 Diferenciální rovnice 3 Systémy diferenciálních rovnic
F7030 Rentgenový rozptyl na tenkých vrstvách
 F7030 Rentgenový rozptyl na tenkých vrstvách O. Caha PřF MU Prezentace k přednášce Numerické simulace Příklady experimentů Vybrané vztahy Sylabus Elementární popis vlnového pole: Rtg vlna ve vakuu; Greenova
F7030 Rentgenový rozptyl na tenkých vrstvách O. Caha PřF MU Prezentace k přednášce Numerické simulace Příklady experimentů Vybrané vztahy Sylabus Elementární popis vlnového pole: Rtg vlna ve vakuu; Greenova
spinový rotační moment (moment hybnosti) kvantové číslo jaderného spinu I pro NMR - jádra s I 0
 Spektroskopie NMR - teoretické základy spin nukleonů, spin jádra, kvantová čísla energetické stavy jádra v magnetickém poli rezonanční podmínka - instrumentace pulsní metody, pulsní sekvence relaxační
Spektroskopie NMR - teoretické základy spin nukleonů, spin jádra, kvantová čísla energetické stavy jádra v magnetickém poli rezonanční podmínka - instrumentace pulsní metody, pulsní sekvence relaxační
Elektrická dvojvrstva
 1 Elektrická dvojvrstva o povrchový náboj (především hydrofobních) částic vyrovnáván ekvivalentním množstvím opačně nabitých iontů (protiiontů) o náboj koloidní částice + obal protiiontů = tzv. elektrická
1 Elektrická dvojvrstva o povrchový náboj (především hydrofobních) částic vyrovnáván ekvivalentním množstvím opačně nabitých iontů (protiiontů) o náboj koloidní částice + obal protiiontů = tzv. elektrická
Základy vakuové techniky
 Základy vakuové techniky Střední rychlost plynů Rychlost molekuly v p = (2 k N A ) * (T/M 0 ), N A = 6. 10 23 molekul na mol (Avogadrova konstanta), k = 1,38. 10-23 J/K.. Boltzmannova konstanta, T.. absolutní
Základy vakuové techniky Střední rychlost plynů Rychlost molekuly v p = (2 k N A ) * (T/M 0 ), N A = 6. 10 23 molekul na mol (Avogadrova konstanta), k = 1,38. 10-23 J/K.. Boltzmannova konstanta, T.. absolutní
1. Spo t te limity (m ºete pouºívat l'hospitalovo pravidlo) x cotg x 1. c) lim. g) lim e x 1. cos(x) =
 I. L'HOSPITALOVO PRAVIDLO A TAYLOR V POLYNOM. Spo t te limity (m ºete pouºívat l'hospitalovo pravidlo) a) lim tg sin ( + ) / e e) lim a a i) lim a a, a > P ipome me si: 3 tg 4 2 tg b) lim 3 sin 4 2 sin
I. L'HOSPITALOVO PRAVIDLO A TAYLOR V POLYNOM. Spo t te limity (m ºete pouºívat l'hospitalovo pravidlo) a) lim tg sin ( + ) / e e) lim a a i) lim a a, a > P ipome me si: 3 tg 4 2 tg b) lim 3 sin 4 2 sin
Roztoky - druhy roztoků
 Roztoky - druhy roztoků Roztok = homogenní směs molekul, které mohou být v pevném (s), kapalném (l) nebo plynném (g) stavu Složka 1 Složka 2 Stav směsi Příklad G G G Vzduch G L L Sodová voda (CO 2 ) G
Roztoky - druhy roztoků Roztok = homogenní směs molekul, které mohou být v pevném (s), kapalném (l) nebo plynném (g) stavu Složka 1 Složka 2 Stav směsi Příklad G G G Vzduch G L L Sodová voda (CO 2 ) G
Jak velký je atom? Počet atomů v m : N = Objem jednoho atomu V=1/N. Velikost atomu: a= V
 Na velikosti záleží Jak velký je atom? Avogadrovo číslo NA=6,022.1023 je počet částic v jednom molu. Molární hmotnost Ma je hmotnost jednoho molu látky. Hustota r je hmotnost jednoho metru krychlového
Na velikosti záleží Jak velký je atom? Avogadrovo číslo NA=6,022.1023 je počet částic v jednom molu. Molární hmotnost Ma je hmotnost jednoho molu látky. Hustota r je hmotnost jednoho metru krychlového
2 Stanovení teploty tání semikrystalických polymerů v práškové formě
 2 Stanovení teploty tání semikrystalických polymerů v práškové formě Teorie Schopnost molekul uspořádat se těsně do pravidelné krystalické mřížky je dána strukturními a termodynamickými předpoklady. Zahříváme-li
2 Stanovení teploty tání semikrystalických polymerů v práškové formě Teorie Schopnost molekul uspořádat se těsně do pravidelné krystalické mřížky je dána strukturními a termodynamickými předpoklady. Zahříváme-li
Mol. fyz. a termodynamika
 Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Skupenské stavy. Kapalina Částečně neuspořádané Volný pohyb částic nebo skupin částic Částice blíže u sebe
 Skupenské stavy Plyn Zcela neuspořádané Hodně volného prostoru Zcela volný pohyb částic Částice daleko od sebe Kapalina Částečně neuspořádané Volný pohyb částic nebo skupin částic Částice blíže u sebe
Skupenské stavy Plyn Zcela neuspořádané Hodně volného prostoru Zcela volný pohyb částic Částice daleko od sebe Kapalina Částečně neuspořádané Volný pohyb částic nebo skupin částic Částice blíže u sebe
Měření kinematické a dynamické viskozity kapalin
 Úloha č. 2 Měření kinematické a dynamické viskozity kapalin Úkoly měření: 1. Určete dynamickou viskozitu z měření doby pádu kuličky v kapalině (glycerinu, roztoku polysacharidu ve vodě) při laboratorní
Úloha č. 2 Měření kinematické a dynamické viskozity kapalin Úkoly měření: 1. Určete dynamickou viskozitu z měření doby pádu kuličky v kapalině (glycerinu, roztoku polysacharidu ve vodě) při laboratorní
nano.tul.cz Inovace a rozvoj studia nanomateriálů na TUL
 Inovace a rozvoj studia nanomateriálů na TUL nano.tul.cz Tyto materiály byly vytvořeny v rámci projektu ESF OP VK: Inovace a rozvoj studia nanomateriálů na Technické univerzitě v Liberci 9. Návody na cvičení
Inovace a rozvoj studia nanomateriálů na TUL nano.tul.cz Tyto materiály byly vytvořeny v rámci projektu ESF OP VK: Inovace a rozvoj studia nanomateriálů na Technické univerzitě v Liberci 9. Návody na cvičení
6. Stavy hmoty - Plyny
 skupenství plynné plyn x pára (pod kritickou teplotou) stavové chování Ideální plyn Reálné plyny Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti skupenství plynné reálný plyn ve stavu
skupenství plynné plyn x pára (pod kritickou teplotou) stavové chování Ideální plyn Reálné plyny Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti skupenství plynné reálný plyn ve stavu
Význam interakční konstanty, Karplusova rovnice. konfigurace na dvojné vazbě a na šestičlenných kruzích konformace furanosového kruhu TOCSY
 Význam interakční konstanty, Karplusova rovnice konfigurace na dvojné vazbě a na šestičlenných kruzích konformace furanosového kruhu TOCSY Karplusova rovnice ve strukturní analýze J(H,H) = A + B cos f
Význam interakční konstanty, Karplusova rovnice konfigurace na dvojné vazbě a na šestičlenných kruzích konformace furanosového kruhu TOCSY Karplusova rovnice ve strukturní analýze J(H,H) = A + B cos f
Elektrické jevy na membránách
 Elektrické jevy na membránách Polopropustná (semipermeabilní) membrána; frita, diafragma propou¹tí ionty, vzniká el. napìtí rùzné koncentrace iontù na obou stranách rùzná propustnost/difuzivita pro rùzné
Elektrické jevy na membránách Polopropustná (semipermeabilní) membrána; frita, diafragma propou¹tí ionty, vzniká el. napìtí rùzné koncentrace iontù na obou stranách rùzná propustnost/difuzivita pro rùzné
Filtrace v prostorové oblasti
 prostorová oblast (spatial domain) se vztahuje k obrazu samotnému - metody zpracování obrazu jsou zalo¾eny na pøímou manipulaci s pixely v obraze transformaèní oblast (transform domain) - metody zpracování
prostorová oblast (spatial domain) se vztahuje k obrazu samotnému - metody zpracování obrazu jsou zalo¾eny na pøímou manipulaci s pixely v obraze transformaèní oblast (transform domain) - metody zpracování
v trojúhelníku P QC sestrojíme vý¹ky na základnu a jedno rameno, patu vý¹ky na rameno oznaèíme R a patu na základnu S
 Øe¹ení 5. série IV. roèníku kategorie JUNIOR RS-IV-5-1 Pro na¹e úvahy bude vhodné upravit si na¹í rovnici do tvaru 3 jx 1 4 j+2 = 5 + 4 sin 2x: Budeme uva¾ovat o funkci na pravé stranì na¹í rovnice, tj.
Øe¹ení 5. série IV. roèníku kategorie JUNIOR RS-IV-5-1 Pro na¹e úvahy bude vhodné upravit si na¹í rovnici do tvaru 3 jx 1 4 j+2 = 5 + 4 sin 2x: Budeme uva¾ovat o funkci na pravé stranì na¹í rovnice, tj.
Metody spektrální. Metody molekulové spektroskopie NMR. Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti
 Metody spektrální Metody molekulové spektroskopie NMR Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti Spektroskopie NMR - teoretické základy spin nukleonů, spin jádra, kvantová čísla
Metody spektrální Metody molekulové spektroskopie NMR Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti Spektroskopie NMR - teoretické základy spin nukleonů, spin jádra, kvantová čísla
Fázová rozhraní a mezifázová energie
 Fázová rozhraní a mezifázová energie druhy: l/g l/l }{{} mobilní 1/15 s/g s/l s/s povrch koule = 4πr 2 Pøíklad. Kolik % molekul vody je na povrchu kapièky mlhy o prùmìru a) 0.1 mm (hranice viditelnosti
Fázová rozhraní a mezifázová energie druhy: l/g l/l }{{} mobilní 1/15 s/g s/l s/s povrch koule = 4πr 2 Pøíklad. Kolik % molekul vody je na povrchu kapièky mlhy o prùmìru a) 0.1 mm (hranice viditelnosti
VY_32_INOVACE_CHK4_5460 ŠAL
 VY_32_INOVACE_CHK4_5460 ŠAL Výukový materiál v rámci projektu OPVK 1.5 Peníze středním školám Číslo projektu: CZ.1.07/1.5.00/34.0883 Název projektu: Rozvoj vzdělanosti Číslo šablony: III/2 Datum vytvoření:
VY_32_INOVACE_CHK4_5460 ŠAL Výukový materiál v rámci projektu OPVK 1.5 Peníze středním školám Číslo projektu: CZ.1.07/1.5.00/34.0883 Název projektu: Rozvoj vzdělanosti Číslo šablony: III/2 Datum vytvoření:
POLYMERY PRINCIPY, STRUKTURA, VLASTNOSTI. Doc. ing. Jaromír LEDERER, CSc.
 POLYMERY PRINCIPY, STRUKTURA, VLASTNOSTI Doc. ing. Jaromír LEDERER, CSc. O čem budeme mluvit Úvod do chemie a technologie polymerů Makromolekulární řetězce Struktura, fázový stav a základní vlastnosti
POLYMERY PRINCIPY, STRUKTURA, VLASTNOSTI Doc. ing. Jaromír LEDERER, CSc. O čem budeme mluvit Úvod do chemie a technologie polymerů Makromolekulární řetězce Struktura, fázový stav a základní vlastnosti
Elementární reakce. stechiometrický zápis vystihuje mechanismus (Cl. + H 2 HCl + H. ) 2 NO 2 ; radioak-
 Elementární reakce 1/15 stechiometrický zápis vystihuje mechanismus (Cl. + H 2 HCl + H. ) 2 NO 2 ; radioak- reakce monomolekulární (rozpad molekuly: N 2 O 4 tivní rozpad; izomerizace) reakce bimolekulární
Elementární reakce 1/15 stechiometrický zápis vystihuje mechanismus (Cl. + H 2 HCl + H. ) 2 NO 2 ; radioak- reakce monomolekulární (rozpad molekuly: N 2 O 4 tivní rozpad; izomerizace) reakce bimolekulární
OBECNÁ CHEMIE. Kurz chemie pro fyziky MFF-UK přednášející: Jaroslav Burda, KChFO.
 OBECNÁ CHEMIE Kurz chemie pro fyziky MFF-UK přednášející: Jaroslav Burda, KChFO burda@karlov.mff.cuni.cz HMOTA, JEJÍ VLASTNOSTI A FORMY Definice: Každý hmotný objekt je charakterizován dvěmi vlastnostmi
OBECNÁ CHEMIE Kurz chemie pro fyziky MFF-UK přednášející: Jaroslav Burda, KChFO burda@karlov.mff.cuni.cz HMOTA, JEJÍ VLASTNOSTI A FORMY Definice: Každý hmotný objekt je charakterizován dvěmi vlastnostmi
PDWHULiO FS>-NJ ±. FS>NFDONJ ± ƒ& VW teur åhoh]r FtQ KOLQtN N HPtN. OHG DONRKRO ROHM FFD FFD SHWUROHM UWX YRGD Y]GXFK YRGQtSiUD KHOLXP
![PDWHULiO FS>-NJ ±. FS>NFDONJ ± ƒ& VW teur åhoh]r FtQ KOLQtN N HPtN. OHG DONRKRO ROHM FFD FFD SHWUROHM UWX YRGD Y]GXFK YRGQtSiUD KHOLXP PDWHULiO FS>-NJ ±. FS>NFDONJ ± ƒ& VW teur åhoh]r FtQ KOLQtN N HPtN. OHG DONRKRO ROHM FFD FFD SHWUROHM UWX YRGD Y]GXFK YRGQtSiUD KHOLXP](/thumbs/50/25995224.jpg) Vážení zákazníci, dovolujeme si Vás upozornit, že na tuto ukázku knihy se vztahují autorská práva, tzv. copyright. To znamená, že ukázka má sloužit výhradnì pro osobní potøebu potenciálního kupujícího
Vážení zákazníci, dovolujeme si Vás upozornit, že na tuto ukázku knihy se vztahují autorská práva, tzv. copyright. To znamená, že ukázka má sloužit výhradnì pro osobní potøebu potenciálního kupujícího
Význam interakční konstanty, Karplusova rovnice
 LEKCE 9 Význam interakční konstanty, Karplusova rovnice konfigurace na dvojné vazbě a na šestičlenných kruzích konformace furanosového kruhu TCSY T E E 1 E 1 T 0 6 T E 1 T 0 88 7 0 T E 0 0 E T 0 5 108
LEKCE 9 Význam interakční konstanty, Karplusova rovnice konfigurace na dvojné vazbě a na šestičlenných kruzích konformace furanosového kruhu TCSY T E E 1 E 1 T 0 6 T E 1 T 0 88 7 0 T E 0 0 E T 0 5 108
Zákony ideálního plynu
 5.2Zákony ideálního plynu 5.1.1 Ideální plyn 5.1.2 Avogadrův zákon 5.1.3 Normální podmínky 5.1.4 Boyleův-Mariottův zákon Izoterma 5.1.5 Gay-Lussacův zákon 5.1.6 Charlesův zákon 5.1.7 Poissonův zákon 5.1.8
5.2Zákony ideálního plynu 5.1.1 Ideální plyn 5.1.2 Avogadrův zákon 5.1.3 Normální podmínky 5.1.4 Boyleův-Mariottův zákon Izoterma 5.1.5 Gay-Lussacův zákon 5.1.6 Charlesův zákon 5.1.7 Poissonův zákon 5.1.8
IDEÁLNÍ PLYN. Stavová rovnice
 IDEÁLNÍ PLYN Stavová rovnice Ideální plyn ) rozměry molekul jsou zanedbatelné vzhledem k jejich vzdálenostem 2) molekuly plynu na sebe působí jen při vzájemných srážkách 3) všechny srážky jsou dokonale
IDEÁLNÍ PLYN Stavová rovnice Ideální plyn ) rozměry molekul jsou zanedbatelné vzhledem k jejich vzdálenostem 2) molekuly plynu na sebe působí jen při vzájemných srážkách 3) všechny srážky jsou dokonale
Roztok. Homogenní směs molekul, které mohou být v pevném, kapalném nebo plynném stavu. Pravé roztoky
 Roztok Homogenní směs molekul, které mohou být v pevném, kapalném nebo plynném stavu Pravé roztoky Micelární a koloidní roztoky (suspenze): částice velké 1 nm 10 µm Tyndallův jev rozptyl světla 1 Druhy
Roztok Homogenní směs molekul, které mohou být v pevném, kapalném nebo plynném stavu Pravé roztoky Micelární a koloidní roztoky (suspenze): částice velké 1 nm 10 µm Tyndallův jev rozptyl světla 1 Druhy
