PŘEDMLUVA. Praha, prosinec Anatol Malijevský
|
|
|
- Emil Kolář
- před 6 lety
- Počet zobrazení:
Transkript
1 PŘEDMLUVA Tento učební text vznikl z přednášek pro studenty magisterského a doktorského studia specializace fyzikální chemie na fakultě chemicko-inženýrské Vysoké školy chemicko-technologické v Praze. V průběhu patnácti let jsem měl při přednášení, konzultacích a zkoušení příležitost sledovat odezvu studentů na probíranou látku. Díky této zpětné vazbě jsem obsah učiva průběžně modifikoval. Učebnicesikladetřicíle.Prvnímahlavnímjeseznámitstudentysmodernía stále se vyvíjející větví termodynamiky. Druhým cílem je poskytnout nový pohled na klasickou(fenomenologickou) termodynamiku, založený na chování molekul. Nakonec se snažím seznámit studenty s některými matematickými dovednostmi, jež jsou při výkladu potřebné a neprobírají se přitom v základním kurzu matematiky na VŠCHT vpraze. Praha, prosinec 2008 Anatol Malijevský
2 2
3 Obsah 1 Fenomenologická termodynamika Axiomyfenomenologickétermodynamiky Základnípojmytermodynamiky Termodynamickýsystém Termodynamickéveličiny Stavsystémuajehozměny Termodynamickýděj Definicezákladníchtermodynamickýchveličin Entalpie Helmholtzovaenergie Gibbsovaenergie Tepelnékapacity Absolutníarelativnítermodynamickéveličiny SpojenéformulaceI.aII.větytermodynamické Některévlastnostitotálníhodiferenciálu Gibbsovyrovnice DerivaceU,H,FaGpodlepřirozenýchproměnných Maxwellovyrelace Totálnídiferenciálentropiejakofunkce T, V a T, p Přechod od přirozených proměnných k proměnným T, V nebo T, p Podmínkytermodynamickérovnováhy Můžebýttermodynamikaaplikovanoumechanikou?
4 2 Statistická termodynamika Termodynamickýstavsystémuamikrostavy Statistickýsoubor Fázovýprostor,fázovýbod,fázovátrajektorie Časovýprůměrtermodynamickéveličiny Souborovýprůměrtermodynamickéveličiny Postulátystatistickétermodynamiky Pravděpodobnost výskytu mikroskopického stavu systému Pravděpodobnostvmikrokanonickémsouboru Pravděpodobnostvkanonickémsouboru Vztahy pro termodynamické funkce v kanonickém souboru Vnitřníenergie Helmholtzovaenergie Ostatnítermodynamickéveličiny Ještěněcoentropie Ideální plyn Partičnífunkceideálníhoplynu Separaceenergiemolekuly Translačnípříspěvky Rotačnípříspěvky Rotacelineárnímolekuly Rotacenelineárnímolekuly Vibračnípříspěvky Vibracedvouatomovémolekuly Vibracevíceatomovémolekuly Příspěvkyexcitovanýchelektronů Směsideálníchplynů Ideálníplyn závěrečnépoznámky
5 6 Ideální krystal Einsteinovateorieideálníhokrystalu Debyeovateorieideálníhokrystalu Mezimolekulární síly Podstatamezimolekulárníchsil Odpudivésíly Přitažlivésíly Párový mezimolekulární potenciál, pravidlo párové aditivity Párovýpotenciál Vícečásticovémezimolekulárnípotenciály Pravidlopárovéaditivity Modelovépárovépotenciály Ideálníplyn Tuhékoule Modelpravoúhlépotenciálovéjámy(squarewell) Lennard-Jonesůvmodel Lineárníaobecnémolekuly Potenciályskutečnýchmolekul Reálný plyn Konfiguračníintegrál Viriálovýrozvojvestatistickétermodynamice Odvozenívztahuprodruhýviriálovýkoeficient Druhýviriálovýkoeficientmodelovýchpárovýchpotenciálů Třetíviriálovýkoeficient Vyššíviriálovékoeficienty leskabídaviriálovéhorozvoje Struktura tekutiny Pojemvnitřnístrukturytekutiny Párovádistribučnífunkce
6 9.3 Párovádistribučnífunkceapotenciálníenergiesystému Párovádistribučnífunkceatermodynamickéveličiny Počítačové experimenty IntegraceMonteCarlo ExperimentMonteCarlo Metropolisůvalgoritmus Molekulovádynamika Počítačovéexperimentyareálnéexperimenty Teorie tekutin Poruchovéteorie Teorieintegrálníchrovnic Klasická termodynamika očima termodynamiky statistické Axiomaditivity Axiomoexistencitermodynamickérovnováhy Zobecněnípojmuteplota zápornéabsolutníteploty I.termodynamickýzákon II.termodynamickýzákon III.termodynamickýzákon Termodynamikaaběhčasu Dodatky Dodatek 1 Extrémyfunkcevíceproměnných Vázanéextrémy Substitučnímetoda Metoda Lagrangeových součinitelů pro funkci dvou proměnných MetodaLagrangeovýchsoučinitelů obecnýpřípad Dodatek 2 Náhradasoučtuřadyintegrálem
7 Aproximacelnn! Stirlingůvvzorec Dodatek 3 LineárnídiferenciálnírovniceI.řádu metodavariacekonstant Dodatek 4 Laplaceův-Gaussůvintegrál Dodatek 5 Derivováníintegrálupodleparametru Dodatek 6 Integracevesférickýchsouřadnicích Sférickásoustavasouřadnic Substitucevtrojnémintegrálu jacobiántransformace Literatura 129 7
8 8
9 Kapitola 1 Fenomenologická termodynamika Fenomenologickátermodynamika 1 jezaloženananěkolikaaxiomech 2,obecnýchanedokazatelných tvrzeních plynoucích z pozorování světa, v němž žijeme. Z nich dokáže odvodit velké množství důležitých vztahů. Nezajímá ji vnitřní struktura systému na systém pohlíží jako na černou skříňku, viz obr 1.1. Změníme-li teplotu uzavřeného systému(konstantní objem a látkové množství), změní se jeho tlak. Změnu tlaku můžeme měřit. Fenomenologická termodynamika však neodpovídá na otázku, proč ke změně tlaku došlo. změna T systém změna p [n, V] Obrázek 1.1: Termodynamický systém jako černá skříňka. Fenomenologická termodynamika nemá žádné prostředky k určení číselných hodnot konstant charakterizujících termodynamickou soustavu. Nedokáže, například, určit hodnoty konstant ve stavových rovnicích, například van der Waalsově nebo Redlichově-Kwongově, nebo hodnoty a, b, c v tomto empirickém vzorci pro závislost izobarické tepelné kapacity ideálního plynu na teplotě C 0 p = a+bt+ c T2. (1.1) 1 Pojemfenomenologickáznamenápopisná,popisujícíjevy.Použiljsemjejproto,abychodlišil tento obor od termodynamiky statistické, jež bude předmětem našeho studia. 2 Někdyserozlišujemezipojmyaxiomapostulát.Vtěchtoskriptechbudoupoužíványjako synonyma. 9
10 Tyto konstanty se pak určují z výsledků měření. Je třeba si uvědomit, že experimenty jsou zpravidla časově náročné a nákladné. Nemožnost výpočtu číselných hodnot konstant je zásadním omezením fenomenologické termodynamiky. 1.1 Axiomy fenomenologické termodynamiky V této podkapitole je vyjmenováno šest axiomů, na nichž je postavena rovnovážná fenomenologická termodynamika. Jejich zdůvodnění a především molekulární interpretaci najde čtenář v závěrečné, dvanácté kapitole. Axiom aditivity. Podle tohoto axiomu je vnitřní energie termodynamického systému součtem vnitřních energií jeho makroskopických částí. Odtud plyne, že vnitřní energie n molů látky je n-násobkem vnitřní molární vnitřní energie, energie jednoho molu. Axiom aditivity tak dovoluje dělit termodynamické veličiny na extenzivní a intenzivní, viz Axiom o existenci termodynamické rovnováhy. Postuluje se, že u každé termodynamické soustavy při neměnných vnějších podmínkách existuje stav termodynamické rovnováhy, v němž se její makroskopické proměnné nemění s časem, a z něhož se nemůže soustava spontánně dostat. Rozumí se rovněž, že libovolná soustava v termodynamicky nerovnovážném stavu dospěje při neměnných vnějších podmínkách vždy do stavu termodynamické rovnováhy. Nultý termodynamický zákon Postuluje se existence teploty jako intenzivního parametru, určujícího termodynamickou rovnováhu mezi tepelně izolovanými soustavami. Podle tohoto axiomu dvě adiabaticky izolované soustavy ve stavu termodynamické rovnováhy přivedené do tepelného kontaktu vytvoří termodynamicky rovnovážnou soustavu 10
11 tehdy a jen tehdy, mají-li stejnou teplotu. První termodynamický zákon Postuluje se existence stavové funkce zvané vnitřní energie U, pro jejíž totální diferenciál platí du= - dq+ - dw, (1.2) kdesymboly - dqa - dw nejsou totálními diferenciály, ale představují infinitezimálně maléhodnotytepla qapráce wdodanédosystému.tentoaxiomrozšiřujezákon zachování energie, jež lze v mechanice odvodit pro konzervativní soustavy, na tzv. disipativní systémy, systémy v nichž běží makroskopické procesy, při kterých dochází k výměně tepla mezi systémem a jeho okolím. Druhý termodynamický zákon Podle tohoto postulátu existuje stavová funkce S, zvaná entropie, pro niž platí ds= ds > dq - T dq - T při rovnovážných(vratných) dějích (1.3) při nerovnovážných(nevratných) dějích (1.4) Speciálněproadiabatickyizolovanésoustavy( - dq=0)platí,žepřinerovnovážných procesech entropie roste a dosahuje svého maxima ve stavu termodynamické rovnováhy kde τječas. Třetí termodynamický zákon ds dτ 0, (1.5) Jeznámaslabší,Nernstovaformulace 3,asilnější,Planckovaformulace,III.zákona. Podle Plancka je entropie každé krystalické soustavy při absolutní nule nulová lim S=0. (1.6) T 0 Důsledkem třetí věty je tvrzení, že žádným konečným procesem nelze dosáhnout teploty0k;ktétoteplotěselzejenpřibližovat. 3 Nernstpostuluje,žezměnaentropiepřilibovolnémprocesusesklesajícíteplotoublížínule lim T 0 S=0.Podrobnějijevčeskéliteratuřediskutovánatřetívětaveskriptech[1]. 11
12 Poznámka: V české literatuře termodynamické zákony běžně nazývají větami, například I. větatermodynamická.termínzákonjepřesnější,neboť věta můžepůsobitdojmem,žejilzeodvodit.vtétoprácibudemepojmy termodynamickávěta a termodynamickýzákon používatjakosynonyma. 1.2 Základní pojmy termodynamiky V této podkapitole jsou shrnuty některé základní pojmy, veličiny a vztahy fenomenologické termodynamiky. Podrobnější výklad v češtině najde čtenář ve skriptech a učebních textech, ze kterých jsem čerpal[1, 2, 3] Termodynamický systém Zvolenou část světa, která je předmětem termodynamického bádání, nazýváme termodynamickým systémem nebo stručněji systémem. Část světa, jež není systémem nazýváme okolím systému. Jestliže systém nevyměňuje ani hmotu ani energii s okolím, mluvíme o izolovaném systému. Jestližemezisystémemaokolímdocházíkvýměněenergie,nevšakkvýměněhmoty, mluvíme o uzavřeném systému. Jestliže systém vyměňuje s okolím jak energii, tak hmotu, mluvíme o otevřeném systému. Určitou oblast zkoumaného systému, ve které jsou jeho vlastnosti konstantní nebo se spojitě mění v prostoru, nazýváme fází. Pokud je systém tvořen jednou fází, nazýváme jej homogenním. Pokud systém obsahuje více fází, nazýváme jej heterogenním systémem Termodynamické veličiny Při pozorování libovolného systému lze určit celou řadu jeho vlastností. Vlastnosti, které nás z termodynamického hlediska zajímají, nazýváme termodynamickými veličinami. Jsou to například teplota, tlak, objem, entalpie, entropie. 12
13 Poznámka: Synonymně k pojmu termodynamická veličina se používají tyto pojmy: termodynamická funkce, termodynamická proměnná, stavová veličina(tj. veličina určující stav systému), stavová funkce, stavová proměnná. Termodynamické veličiny rozdělujeme na extenzivní a intenzivní. Uvažujme homogenní systém ve stavu termodynamické rovnováhy bez přítomnosti vnějších silových polí. Veličiny, které se při dělení systému na menší podsystémy nemění, se nazývají intenzivní. Veličiny, jejichž hodnoty jsou přímo úměrné látkovému množství, se nazývají extenzivní. Typickými intenzivními veličinami jsou teplota, tlak nebo složení vyjádřené molárními zlomky. Typickými extenzivními veličinami jsou objem, hmota, počet částic. Pro každou extenzivní veličinu X platí X= X 1 + X 2, kde X i jeveličinapodsystému,tj.makroskopickéčástisystému. Každou extenzivní veličinu lze převést na intenzivní, vztáhneme-li ji na určitou konstantní hmotu systému. Jestliže je veličina vztažena na 1 mol látky, mluvíme o molární veličině. Mezi každou extenzivní veličinou X a příslušnou molární veličinou X m platívztah X= n X m, (1.7) kde n je látkové množství Stav systému a jeho změny Libovolný systém lze v každém časovém okamžiku charakterizovat pomocí určitého počtu veličin. Číselné hodnoty těchto veličin určují stav systému. Přitom je nutno brát do úvahy stupeň obecnosti, na němž systém pozorujeme. Z mikroskopického pohledu(v jazyce Newtonovy fyziky) je stav systému definován polohami a rychlostmi všech jeho částic, kdežto z hlediska termodynamiky stačí znát jen několik veličin, například teplotu, tlak a složení. Stav termodynamické rovnováhy(rovnovážný stav, rovnováha) je stav, při kterém v systému neprobíhají žádné makroskopické změny a všechny veličiny mají časově stálé hodnoty. 13
14 Poznámka: Rovnovážný stav však není nic strnulého, žádné sladké nicnedělání. Na mikroskopické úrovni kypí život. Molekuly neposedně pobíhají, strkají do sebe, tu se odpuzujíce, tu přitahujíce. Například ve stavu rovnováhy mezi kapalnou a parní fází neustále některé molekuly přebíhají z kapalné fáze do parní, jiné z parní do kapalné. Teplota a tlak systému(přesněji jejich střední hodnoty, viz 2.4 a 2.5), se však nemění. Termodynamická rovnováha zahrnuje tyto dílčí rovnováhy: mechanická(tlaková) rovnováha ve všech částech systému je stejný tlak, tepelná(teplotní) rovnováha ve všech částech systému jsou vyrovnány teploty, koncentrační rovnováha ve všech částech každé fáze systému jsou stejné koncentrace složek systému; složení různých fází se však zpravidla liší. fázová rovnováha pokud je systém heterogenní jsou jeho fáze v rovnováze, chemická rovnováha nedochází ke změnám složení vlivem chemických reakcí. Poznámka: Jestliže se systém ve stavu termodynamické rovnováhy nachází ve vnějším silovém poli, například gravitačním, nejsou tlaky ve všech částech systému stejné, ale spojitě se mění. Také koncentrace složek systému se v každé fázi spojitě mění, na fázovém rozhraní dochází ke skokové změně. Není-li systém v rovnovážném stavu, jeho vlastnosti se mění s časem tak, že systém směřuje k termodynamické rovnováze. Termodynamika postuluje(viz 1.1), že každý systém při neměnných vnějších podmínkách dospěje do stavu termodynamické rovnováhy. Doba, za kterou se ustaví rovnováha, je velmi různá, od zlomků sekund při vyrovnávání tlaků v plynech, až po stovky let při přechodu skla do krystalického stavu. Tato doba se nazývá relaxačním časem Termodynamický děj Jestliže se vlastnosti systému s časem mění, tj. dochází-li ke změně alespoň jedné termodynamické veličiny, říkáme, že v systému probíhá určitý termodynamický děj. Přitom pod pojmem děj rozumíme velmi širokou škálu nejrůznějších procesů od jednoduchých fyzikálních změn, jako je například zahřívání, přes chemické reakce, až po složité mnohostupňové procesy. 14
15 Průběh libovolného děje závisí na podmínkách, za kterých se sledovaný systém mění. Uspořádáme-li podmínky tak, že v každém okamžiku je systém téměř v rovnováze a že lze tedy velmi malou změnou podmínek směr děje obrátit, nazýváme tento děj vratným nebo též rovnovážným. Vratný děj je tedy sledem rovnovážných stavů systému. Děje v reálném světě však zpravidla probíhají tak, že alespoň na počátku je systém mimo rovnováhu. Tyto děje pak označujeme jako nevratné, nebo též spontánní, nerovnovážné. Směr děje nelze obrátit malou změnou vnějších podmínek, děj je sledem nerovnovážných stavů. Rovnovážný děj je limitním případem nerovnovážného děje. 1.3 Definice základních termodynamických veličin Mezi základní termodynamické veličiny patří teplota, tlak, objem a látkové množství. První věta termodynamická zavádí vnitřní energii a druhá věta entropii. V této podkapitole definujeme další termodynamické veličiny: entalpii, Helmholtzovu energii, Gibbsovu energii a tepelné kapacity Entalpie Entalpie H je stavová funkce definovaná vztahem H= U+ pv. (1.8) Vyměňuje-li při termodynamickém ději systém s okolím jen teplo a vratně objemovou práci, platí dh= - dq+ Vdp. (1.9) Je-li tento děj izobarický(dp = 0), je změna entalpie systému rovna teplu dodanému do systému H= q, [p]. (1.10) 15
16 1.3.2 Helmholtzova energie Helmholtzova energie F(Helmholtzova funkce, ve starší literatuře též volná energie) je stavová funkce definovaná vztahem F= U TS. (1.11) Změna Helmholtzovy energie F při vratném izotermickém ději je rovna práci dodané do systému Gibbsova energie F= w, [T, vratnýděj]. (1.12) Gibbsova energie G(Gibbsova funkce, ve starší literatuře též volná entalpie) je stavová funkce definovaná vztahem G=H TS. (1.13) Změna Gibbsovy energie G při vratném izotermickém a izobarickém ději je rovna prácijinénežobjemové, w jiná,dodanédosystému G=w jiná w w obj = w+p V, [T, p,vratnýděj]. (1.14) Tepelné kapacity Tepelná kapacita C je pro daný děj definována vztahem ( - ) dq C=. (1.15) dt Izochorickátepelnákapacita, C V,aizobarickátepelnákapacita, C p,jsoudefinovány vztahy Pro C V a C p platí C V = C p = děj ( dq - ) ( ) U =, (1.16) dt T izochor.děj V ( ) ( ) dq H =. (1.17) dt T izobar.děj p C V >0, lim T 0 C V =0, (1.18) C p C V, lim T 0 C p =0. (1.19) 16
17 1.3.5 Absolutní a relativní termodynamické veličiny Jestliže termodynamické veličině systému v daném stavu můžeme jednoznačně přiřadit číselnou hodnotu, říkáme, že veličina je absolutní. Jestliže můžeme přiřadit číselnou hodnotu jen změně termodynamické veličiny při přechodu systému z jednoho termodynamického stavu do druhého, říkáme, že veličina je relativní. Typickými absolutními veličinami jsou teplota, tlak, objem, látkové množství, tepelné kapacity. Existují pro ně přirozené a univerzální(nezávislé na látce) referenční stavy.takovýmreferenčnímstavemjeteplota0k,objem0m 3,tlak0Pa.Typickými relativními veličinami jsou vnitřní energie, entalpie, Helmholtzova energie, Gibbsova energie. Pro ně neexistují žádné univerzální referenční stavy. Zajímavým případem je entropie. Ta je II. větou termodynamickou určena jako relativní veličina. III. věta termodynamická ji však povyšuje do skupiny absolutních veličin. Pro zdůraznění této skutečnosti se někdy místo entropie používá termín absolutní entropie. 1.4 Spojené formulace I. a II. věty termodynamické V této podkapitole(pokud nebude řečeno jinak) předpokládáme, že systém je uzavřený a homogenní, vyměňuje s okolím jen objemovou práci a všechny probíhající děje jsou vratné. Pro jednoduchost nebudu tyto předpoklady explicitně vyznačovat Některé vlastnosti totálního diferenciálu Nechť M(x, y)an(x, y)jsouspojitéfunkcevjednodušesouvisléoblasti.nutnoua postačující podmínkou, aby diferenciální forma dz = M(x, y)dx + N(x, y)dy (1.20) byla totálním diferenciálem funkce z = z(x, y), je rovnost derivací ( M y ) x = 17 ( ) N x y, (1.21)
18 kde M= ( ) z x y, N= Pro totální diferenciál funkce z = z(x, y) tedy platí dz= ( ) z dx+ x y ( ) z. y x ( ) z dy. (1.22) y x Poznámka: Rovnice(1.21) požaduje, aby smíšené druhé parciální derivace nezávisely na pořadí derivování, tj. aby platilo 2 z x y = 2 z y x. (1.23) na Někdy potřebujeme znát derivaci x podle y při pevném z. Rovnice(1.22) přejde a odtud dostaneme 0= ( ) z dx+ x y ( ) x y z ( ) z dy, [z] (1.24) y x = ( ) z y ( ) x z x y. (1.25) Tento vzorec je totožný se vzorcem pro derivování implicitně zadané funkce z(x, y)=0. Integráltotálníhodiferenciáluzbodu(x 1, y 1 )dobodu(x 2, y 2 )nezávisínacestě mezitěmitobody.můžemenapříkladnejprveintegrovatpodle xpřipevném y 1 apak podle ypřipevném x 2 z(x 2, y 2 )=z(x 1, y 1 )+ x2 x 1 ( ) z y2 dx+ x y=y y 1 1 ( ) z dy (1.26) y x=x 2 nebomůžemenejprveintegrovatpodle ypřipevném x 1 apakpodle xpřipevném y 2 z(x 2, y 2 )=z(x 1, y 1 )+ y2 y 1 ( ) z x2 dy+ y x=x x 1 1 ( ) z dx (1.27) x y=y 2 nebomůžemezvolitlibovolnoujinoucestuspojujícíbody(x 1, y 1 )a(x 2, y 2 )vrovině x, y. Symbolika:Výraz ( ) z označujeparciálníderivacifunkce z= f(x, y)podle xza x y=y 1 konstantního ypřihodnotě y= y 1. 18
19 Často je třeba integrovat dz při pevné jedné nezávisle proměnné. Pro integraci od x 1 do x 2 přikonstantním yplatí z(x 2, y)=z(x 1, y)+ x2 x 1 ( ) z x y dx, [y]. (1.28) Všechnystavovéfunkce(p, V, T, n, U, H, S, F, G, C p, C V,...)majítotálnídiferenciály. Teplo a práce nejsou stavovými funkcemi a nemají totální(úplný, exaktní) diferenciál Gibbsovy rovnice Spojením rovnic(1.2) a(1.3) a definic(1.8),(1.11) a(1.13) termodynamických funkcí H, F, G dostáváme vztahy nazývané spojenými formulacemi I. a II. věty termodynamické nebo také Gibbsovými rovnicemi du= TdS pdv, (1.29) dh= TdS+ Vdp, (1.30) df= SdT pdv, (1.31) dg= SdT+ Vdp. (1.32) Vrovnici(1.29)jevnitřníenergiefunkcíproměnných Sa V.Proměnné Sa Vbudeme nazývat přirozenými proměnnými funkce U. Přirozenými proměnnými entalpie jsou Sa p,helmholtzovyenergie Ta V,Gibbsovyenergie Ta p Derivace U, H, F a G podle přirozených proměnných Uvažujeme-li vnitřní energii U jako funkci S a V, je její totální diferenciál podle(1.22) roven du= ( ) U S V Porovnáním(1.29) a(1.33) dostáváme ( ) U S V = T, ds+ ( ) U V S dv. (1.33) ( ) U = p. (1.34) V S 19
20 Podobnýmzpůsobemdostanemepro H= f(s, p), F= f(t, V), G=f(T, p) ( ) ( ) H H = T, = V, (1.35) S p p S ( ) ( ) F F = S, = p, (1.36) T V V T ( ) ( ) G G = S, = V. (1.37) T p Maxwellovy relace p Aplikací rovnosti smíšených derivací(1.23) na Gibbsovy rovnice(1.29) (1.32), tj. na totální diferenciály funkcí U, H, F, G dostaneme vztahy, zvané Maxwellovými relacemi ( ) T = V S ( ) T = p S ( ) p = T V ( ) V = T p T ( ) p, (1.38) S V ( ) V, (1.39) S p ( ) S, (1.40) V T ( ) S. (1.41) p Maxwellovy relace, zejména(1.40) a(1.41), patří mezi nejdůležitější termodynamické vztahy. Nacházejí uplatnění při odvozování mnohých dalších rovnic Totální diferenciál entropie jako funkce T, V a T, p Totálnídiferenciálentropiejakofunkceteplotyaobjemu,[S= f(t, V)],je ( ) ( ) S S ds= dt+ dv. (1.42) T V Připevnémobjemuplynez(1.3)a(1.16) ( ) S = 1 ( - ) dq T T dt V izochor.děj= 1 T V T T ( ) U T V = C V T. (1.43) Pro derivaci entropie podle objemu platí Maxwellova relace(1.40). Rovnici(1.42) můžeme přepsat na ds= C ( ) V p T dt+ T V 20 dv. (1.44)
21 Stejným způsobem dostaneme pro entropii jako funkci teploty a tlaku ( ) S T p= 1 T ( dq - ) dt izobar.děj= 1 T ( ) H = C p T T p (1.45) a s využitím Maxwellovy relace(1.41) ds= C ( ) p V T dt dp. (1.46) T p Přechod od přirozených proměnných k proměnným T, V nebo T, p Vnitřní energii můžeme transformovat z funkce přirozených proměnných na funkci proměnných T, V pomocí rovnice(1.29), do které dosadíme za ds vztah(1.44). Dostaneme du= C V dt+ [ T ( ) p T V p ] dv. (1.47) StejnýmzpůsobemlzeprovésttransformacizH= f(s, p)na H= f(t, p).kombinací rovnic(1.30) a(1.46) dostáváme dh= C p dt+ V T ( ) V dp. (1.48) T p Totálnídiferenciálfunkce U= f(t, V)jepodle(1.22)rovenvýrazu du= ( ) U T V dt+ ( ) U V T dv. (1.49) Porovnáním(1.47) a(1.49) získáme ( ) U T ( ) U V V T = C V, (1.50) = T ( ) p T V p. (1.51) Podobně dostaneme příslušné parciální derivace závislosti H = f(t, p) ( ) H T ( ) H p p T = C p, (1.52) = T 21 ( ) V + V. (1.53) T p
22 1.4.7 Podmínky termodynamické rovnováhy Z druhé věty termodynamické plyne, že při nevratných dějích entropie izolovaného systému roste ds > 0, [izolovaný systém, nevratný děj] (1.54) a ve stavu termodynamické rovnováhy má maximum ds = 0, [izolovaný systém, vratný děj]. (1.55) Odtud plynou následující podmínky termodynamické rovnováhy pro termodynamické funkce S, U, H, Fa G funkce podmínka extrému druh extrému entropie ds=0, [U, V] maximum entropie ds = 0, [H, p] maximum vnitřníenergie du=0, [S, V] minimum entalpie dh=0, [S, p] minimum Helmholtzovaenergie df=0, [T, V] minimum Gibbsova energie dg = 0, [T, p] minimum Podmínky extrémů funkcí uvedené v tabulce se nazývají extenzivními kritérii rovnováhy a dají se z nich odvodit tzv. intenzivní kritéria(rovnosti chemických potenciálů, fugacit, aktivit). Poznámka: Všimněte si souvislosti rovnic v tabulce a Gibbsových rovnic(1.29) až(1.32). Napříkladz(1.29)plyne,žepři[S, V]jedU=0apři[U, V]jedS=0. Kritéria termodynamické rovnováhy se používají při výpočtech fázových a chemických rovnováh. Závisí na podmínkách rovnováhy, které kritérium platí. Nejčastěji se studují rovnováhy při pevné teplotě a tlaku. V takovém případě se použije kritérium dg=0,[t, p]. 1.5 Může být termodynamika aplikovanou mechanikou? Již od počátku dvacátého století nikdo nepochybuje o tom, že každý termodynamický systémjetvořenvelkýmpočtem( )molekul,popřípaděatomůneboiontů. 22
23 Termodynamické(makroskopické) chování systému je determinováno chováním částic systém tvořících. Například tlak je způsoben nárazy molekul na stěny systému. Uveďte několik dalších příkladů molekulární podstaty makroskopických jevů. Mikroskopický stav systému v rámci Newtonovy mechaniky je určen polohami a rychlostmi všech částic tvořících systém. Kolikjetoveličin,je-lipočetčásticroven10 23? Pro jednoduchost předpokládejme, že molekuly nemají žádnou vnitřní strukturu a řídí se zákony klasické(newtonovy) mechaniky. Potom platí F x,i F y,i F z,i = m i d 2 x i dτ 2 = m i d 2 y i dτ 2 (1.56) = m i d 2 z i dτ 2 i=1,2,..., N, kde F x,i F y,i, F z,i jsousložkysílypůsobícínai-toumolekulu, x i, y i, z i souřadnicejejí polohyvčase τa Npočetmolekulvsystému.Původsil F i působícíchnamolekuly je v přitahování a odpuzování okolních molekul. Známe-li tyto síly a známe-li polohy a rychlosti všech částic(tj. mikroskopický stav systému) ve zvoleném počátečním časovém okamžiku τ = 0, můžeme řešit soustavu 3 N diferenciálních rovnic(1.56). Řešenímjsoupolohyarychlostičásticvlibovolnémčasovémokamžiku τ.znichlze určit hodnoty termodynamických veličin v daném čase. Například tlak se dá určit jako síla působící na jednotkovou plochu stěny nádoby. Výše nastíněný postup by dovoloval přímo určovat termodynamické veličiny systému na základě znalosti sil působících mezi molekulami. Tento postup však není uskutečnitelný ze dvou příčin: I. Příčina technická. Neexistuje a v předvídatelné době nebude existovat počítač, který by zvládl řešení obrovské soustavy diferenciálních rovnic(1.56). Především neexistuje paměťové médium, jež by bylo schopno uchovávat informace o 23
24 polohách a rychlostech částic. Rovněž doba výpočtu by značně přesáhla i nejoptimističtější odhady doby existence lidstva. Počet aritmetických operací při řešení soustavy N obyčejných lineárních rovnic Gaussovoueliminačnímetodoujeřádu N 3.Odhadnětedobupotřebnounařešení soustavy rovnic,trvá-lipočítačijednaaritmetickáoperacejednumikrosekundu. Srovnejte výsledek se střední dobou existence vesmíru(přibližně 15 miliard let od velkého třesku). II. Příčina principiální. Počáteční polohy a rychlosti částic potřebné při řešení soustavy(1.56) nejsou nikdy známy s absolutní přesností(žádná fyzikální veličina nemůže být změřena zcela přesně). Tyto malé nepřesnosti ve vstupních veličinách způsobují velké nepřesnosti ve výsledcích. Již ve zlomcích sekundy od počátku je chyba v určení polohy částic srovnatelná s velikostí nádoby. Polohy částic a termodynamické veličiny na nich závislé přestávají být přesně určenými a stávají se statistickými. Můžeme pak hovořit jen o pravděpodobnosti, že v daném místě nalezneme molekulu. Determinismus na mikroskopické úrovni je nahrazen molekulárním chaosem. Vpustíme-li na nějakém místě do evakuované nádoby molekuly, velmi rychle se rozptylí víceméně pravidelně v daném prostoru. Toto rozmístění je nezávislé na počátečních polohách molekul, tj. na místě, ve kterém byly do systému vpuštěny. Představte si kulečníkovou kouli, pohybující se na kulečníkovém stole bez tření. Pokuste se si představit, jaká je chyba v určení polohy koule po několika odrazech od mantinelů, je-li chyba v úhlu, pod kterým na počátku míří k mantinelu velmi malá. 24
25 Kapitola 2 Statistická termodynamika Cílem tohoto vědního oboru je popis termodynamických vlastností makroskopických systémů na základě znalosti vzájemného silového působení částic tvořících systém. Podobně jako fenomenologická termodynamika se statistická termodynamika dělí na rovnovážnou a nerovnovážnou. V tomto kurzu se budeme zabývat pouze rovnovážnou statistickou termodynamikou. Statistická termodynamika se dále dělí na klasickou(molekuly se řídí Newtonovými pohybovými rovnicemi) a kvantovou(molekuly se řídí Schrödingerovou rovnicí). V některých partiích(teorie ideálního plynu) budeme používat kvantovou statistickou termodynamiku, ve většině případů(reálný plyn, kapalina) však vystačíme s jednodušší klasickou statistickou termodynamikou. 2.1 Termodynamický stav systému a mikrostavy Jak již bylo řečeno dříve je termodynamický stav systému určen malým počtem nezávislých termodynamických veličin. Zvolme jako příklad adiabaticky izolovaný systém, jehož náplní je čistá látka. Termodynamický stav tohoto systému je určen hodnotou energie E, objemem V a počtem molekul N. Danému termodynamickému stavu odpovídá obrovské množství mikroskopických stavů systému. Mluvíme-li řečí klasické mechaniky, v daném objemu V může být N molekul rozmístěno nesčíslným počtem způsobů, dané hodnotě E odpovídá nesčíslné(skoro nekonečné) množství rozdělení rychlostí molekul. V řeči kvantové mechaniky pak daným hodnotám makroskopických veličin E, V, N odpovídá nepředstavitelné(skoro nekonečné) množství kvantových stavů systému. 25
26 2.2 Statistický soubor Statistickým souborem rozumíme množinu všech mikroskopických stavů systému, které jsou slučitelné s daným termodynamickým stavem systému. Podle toho, jak je termodynamický systém zadán, rozlišujeme následující statistické soubory: Mikrokanonický soubor(nve soubor) je množina všech mikroskopických stavů systému o daných hodnotách energie, objemu a počtu částic. Mikrokanonickému souboru odpovídá(adiabaticky) izolovaný termodynamický systém. Kanonický soubor(nvt soubor) je množina všech mikroskopických stavů systému o daných hodnotách teploty, objemu a počtu částic. Kanonickému souboru odpovídá izotermický a izochorický uzavřený systém. Grandkanonický soubor(µvt soubor, též velký kanonický soubor) je množina všech mikroskopických stavů systému o daných hodnotách chemického potenciálu, objemu a teploty. Grandkanonickému souboru odpovídá izotermický a izochorický systém o konstantním chemickém potenciálu. Existují i další statistické soubory, například izotermicko-izobarický(npt) soubor, jejich používání je však méně časté. V dalším textu budeme nejčastěji používat kanonický soubor. 2.3 Fázový prostor, fázový bod, fázová trajektorie Fázovýprostorje6 N-rozměrnýprostorsložekpoloh x i, y i, z i ahybností p x,i, p y,i, p z,i souboru N částic(atomů, molekul, iontů,...). Každému mikroskopickému stavu termodynamického systému odpovídá bod ve fázovém prostoru. Podprostorem fázového prostoru je konfigurační prostor, 3 N-dimenzionální prostor poloh molekul. Každý mikroskopický stav termodynamického systému může být zobrazen bodem ve fázovém prostoru, tj. každému mikrostavu odpovídá fázový bod. Polohy a hybnosti částic se mění s časem. Těmto změnám odpovídají změny polohy fázového bodu. Dráhu, kterou opisuje fázový bod, nazýváme fázovou trajektorií. 26
27 2.4 Časový průměr termodynamické veličiny Mikrosvět je v neustálém pohybu. Molekuly mění své polohy a při vzájemných srážkách si vyměňují rychlosti. Důsledkem tohoto dynamického chování je, že hodnoty termodynamických veličin se neustále mění s časem. Tyto změny nedokáže zachytit žádný měřící přístroj, například teploměr nebo tlakoměr, jednak proto, že jsou velmi rychlé, jednak proto, že jsou velmi malé. Jestliže je termodynamický systém v rovnovážném stavu, fluktuují okamžité hodnoty veličin kolem středních hodnot. To, co ukazuje měřící přístroj, jsou střední hodnoty za poměrně dlouhý čas(z hlediska mikrosvěta). Skutečnost, že měřená veličina X je časovým průměrem svých okamžitých hodnot, můžeme matematicky zapsat takto X τ = 1 τ τ 0 X(t) dt, (2.1) kde X(t)jeokamžitáhodnotavčase t, τ ječasovýintervalměřeníax τ ječasový průměr. 2.5 Souborový průměr termodynamické veličiny Mikrostavy odpovídající danému termodynamickému stavu se nevyskytují se stejnou pravděpodobností. Například mikrostav, ve kterém jsou za dané teploty a tlaku všechny molekuly soustředěny v pravém horním rohu nádoby je zřejmě mnohem méně pravděpodobný než mikrostavy, v nichž jsou molekuly rozmístěny v nádobě zhruba rovnoměrně. Stejně tak je nepravděpodobný stav systému, ve kterém má jedna molekula obrovskou rychlost a ostatní téměř stojí. Označímepravděpodobnostvýskytu i-téhomikrostavusymbolem P i ahodnotu obecnétermodynamickéveličiny X vdanémmikrostavusymbolem X i.souborový průměr X s veličiny Xjedefinovánvztahem X s = i P i X i. (2.2) Sumace se provádí přes všechny mikrostavy systému. 27
28 2.6 Postuláty statistické termodynamiky Je vysoce žádoucí rozšířit meze vypovídací schopnosti fenomenologické termodynamiky. Nejnadějnějším způsobem, jak tak učinit, je obrátit se k chování molekul, jejichž pohyby se řídí zákony mechaniky. V podkapitole 1.5 jsme si však vysvětlili, že statistickou termodynamiku nelze z principiálních i technických příčin redukovat na aplikovanou mechaniku. Jak z toho ven? Východisko se našlo v postulování dvou obecně přijatelných tvrzení, jež nás zbaví nutnosti řešit gigantické soustavy diferenciálních pohybových rovnic. Postulát o rovnosti středních hodnot termodynamických veličin Časový průměr každé termodynamické veličiny je roven jejímu souborovému průměru X τ = X s, (2.3) kde X τ jedefinovánorovnicí(2.1)ax s rovnicí(2.2).tentopostulátpředpokládá,žeza dostatečnědlouhýčasovýintervalprojdesystémvšemisvýmimikrostavy 1.Systémy, u kterých je tento postulát splněn, se nazývají ergodické. Postulát o pravděpodobnosti mikrostavu Pravděpodobnost P i,ježsevyskytujevrovnici(2.2),jepouzefunkcíenergiedaného mikrostavu P i = f(e i ). (2.4) Intuitivně je zřejmé, že systém preferuje energeticky výhodnější stavy, tj. že pravděpodobnost výskytu mikrostavu o nižší energii je větší. Velká důležitost těchto postulátů se ukáže později. Nahrazení časového průměru průměrem souborovým totiž neskonale zjednoduší výpočty. Druhý postulát nám pak dovolípočítatpravděpodobnosti P i.budou-lipravděpodobnostijakofunkceenergie známy, bude možné použít rovnici(2.2) k výpočtu souborového průměru. 1 přesněji,dostaneselibovolněmaléblízkostikaždéhomikrostavu 28
29 Kapitola 3 Pravděpodobnost výskytu mikroskopického stavu systému První postulát statistické termodynamiky umožňuje počítat termodynamické veličiny jako souborové průměry X s = i P i X i. K tomu, abychom mohli souborové průměry počítat, musíme znát vztahy pro pravděpodobnosti P i výskytumikroskopickéhostavu i.nížeodvodímevztahpropravděpodobnost v mikrokanonickém souboru a vztah pro pravděpodobnost v kanonickém souboru. 3.1 Pravděpodobnost v mikrokanonickém souboru Mikrokanonický soubor je charakterizován konstantními hodnotami energie, počtu částic a objemu. Podle druhého postulátu statistické termodynamiky je pravděpodobnostfunkcípouzeenergiedanéhomikrostavu, P i = f(e i ).Vmikrokanonickém souboru mají všechny mikrostavy stejnou energii. Proto P i = P= konst. [N, V, E]. (3.1) Všechny mikrostavy v systému o konstantní energii se tedy vyskytují se stejnou pravděpodobností. Označíme-li počet všech mikrostavů adiabaticky izolované soustavy symbolem Wavezmemevúvahu,že W i=1 P i =1,dostaneme P= 1 W [N, V, E]. (3.2) 29
30 3.2 Pravděpodobnost v kanonickém souboru Kanonický soubor je charakterizován konstantními hodnotami teploty, počtu částic a objemu. Termodynamické veličiny se obvykle neuvažují jako funkce energie, objemu a látkového množství(počtu částic), ale jako funkce teploty, objemu a látkového množství. Proto je vztah pro pravděpodobnost v kanonickém souboru pro nás užitečnější než vztah pro mikrokanonický soubor. Dokážeme, že platí P i = e βe i Q [N, V, T], (3.3) kde Q= i e βe i (3.4) se nazývá partiční funkcí kanonického souboru(sčítá se přes všechny mikrostavy systému). Pro veličinu β platí β= 1 k B T, (3.5) kde k B jeboltzmannovakonstantaatjeabsolutníteplota.odvozenívztahu(3.3)je delší než odvození vztahu(3.1) pro mikrokanonický soubor a je mu věnována zbývající část podkapitoly. Mějmesystémokonstantnímobjemu Vakonstantnímpočtučástic N.Dálejejbudemeprostručnostnazývat NVsystémem.VezmemeΠtakovýchsystémů,kdeΠ 1, a uspořádáme je do pravidelné mřížky, jak je naznačeno na obrázku 3.1. Vzniklý supersystém,jehožobjemjeπv apočetčásticπn,adiabatickyizolujemeodokolí. Celkovouenergiisupersystémuoznačíme E t.pourčitémčasesevsupersystémuustaví termodynamická rovnováha a ve všech jeho částech, tj. ve všech NV-systémech bude stejná teplota. Každý systém supersystému bude tedy systémem kanonického souboru [NVT]. Supersystému odpovídá mikrokanonický soubor(soubor stavů o konstantní energii, objemu a počtu částic). Jak bylo ukázáno výše, všechny mikrostavy supersystému, tj. členy mikrokanonického souboru, se vyskytují se stejnou pravděpodobností. V daném mikrostavu budou NV-systémy v obecně různých stavech s různými hodnotami energie. Uspořádejme členy mikrokanonického souboru do skupin podle toho, jak je 30
31 N, V tepelně vodivé stěny izolace Obrázek 3.1: Adiabaticky izolovaný supersystém. rozdělenácelkováenergie E t do NV-systémů(pravděpodobnost,kteránásbudezajímat,jefunkcíenergie).Vdanéskupiněbudouvšechnymikrostavy,vnichžmá n 1 systémůhodnotuenergie E 1, n 2 systémůhodnotuenergie E 2 atd.skupinučlenůmikrokanonického souboru budeme nazývat distribucí. Distribuce je určena hodnotami n 1, n 2, n 3,.... BudenászajímatpočetčlenůΩ(n 1, n 2,...)distribuce.JednáseokombinatorickouúlohuurčitpočetpermutacíΠelementů,znichž n 1, n 2,...jenerozlišitelných (permutace s opakováním). Lze dokázat(viz libovolná učebnice kombinatoriky), že platí Ω(n 1, n 2,...)= Π! n 1!n 2!.... (3.6) Pro každý mikrostav supersystému platí, že celková energie a celkový počet částic jsou konstantní n i E i = E t, (3.7) i n i = Π. (3.8) i Počet distribucí je obecně obrovský. Budeme se zabývat nejpočetnější distribucí slučitelnou s vaznými podmínkami(3.7) a(3.8). Ostatní distribuce jsou mnohem méně početné. Mikrostavy, jež je tvoří, jsou nerovnovážné a budeme je dále zanedbávat. Pokusím se objasnit tuto krátkou, ale obtížnou pasáž na jednoduchém příkladě: Příklad: 31
32 Uvažujme adiabaticky izolovaný supersystém skládající se ze tří NV systémů, znichžkaždýmástejnýpočetčástic Nastejnýobjem V.Abychomsystémyrozlišili, označímejepísmeny A, Ba C.Celkováenergiesupersystémunechťje3(vlibovolných jednotkách). V našem příkladě je tedy Π=3, E t =3. Dáleuvažujme,žekaždýzetřísystémůmůžebýtvněkterémzstavůshodnotami energie E 1 = 0, E 2 = 1, E 3 = 2, E 4 = 3. Členy mikrokanonického souboru patří do některé ze tří distribucí: 1.distribuceJedensystémbudevestavusenergií E 4 =3,ostatnídvasystémyvestavusenergií E 1 =0.Zjevněplatí: n 1 =2, n 2 =0, n 3 =0, n 4 =1. Podmínky(3.7) a(3.8) jsou splněny: Π = n 1 + n 2 + n 3 + n 4 = =3, E t = =3. Početčlenůdistribuceje 1 Ω(n 1, n 2, n 3, n 4 )= Π! n 1!n 2!n 3!n 4! = 3! 2!0!0!1! =3. Snadnosiověříme,žetojetak.Buďmáenergii E 4 =3systém Anebosystém Bnebosystém C(ostatnídvasystémypakmají energii E 1 =0). 1 Připomeňmesi,že0!=1. 32
33 2. distribuce n 1 =1, n 2 =1, n 3 =1, n 4 =0. Podmínky(3.7) a(3.8) jsou splněny: Π = n 1 + n 2 + n 3 + n 4 = =3, E t = =3. Počet členů distribuce je Ω(n 1, n 2, n 3, n 4 )= Ověřímesi,žeΩjeskutečně6: Π! n 1!n 2!n 3!n 4! = 3! 1!1!1!0! =6. ABC ACB BAC BCA CAB CBA 3. distribuce n 1 =0, n 2 =3, n 3 =0, n 4 =0. Podmínky(3.7) a(3.8) jsou splněny: Π = n 1 + n 2 + n 3 + n 4 = =3, E t = =3. Počet členů distribuce je Ω(n 1, n 2, n 3, n 4 )= Π! n 1!n 2!n 3!n 4! = 3! 0!3!0!0! =1. 4. distribuce Žádná čtvrtá ani další distribuce neexistují. Není například možnádistribuce n 1 = 0, n 2 = 1, n 3 = 2, n 4 = 0.Zkuste sami odpovědět proč. Nejpočetnější je distribuce 2. Bude se vyskytovat v 60% stavů. Distribuce 1 bude v30%stavůadistribuce3v10%.(proč?)vpřípaděvelkéhopočtu NV systémů, Π 1 a ještě mnohem většího počtu energetických hladin bude mikrokanonický supersystém prakticky vždy ve stavu odpovídajícím nejpočetnější distribuci. 33
34 Vraťmesekrovnici(3.6).Budemehledathodnoty n 1, n 2,...,vnejpočetnějšídistribuci,tj.budemehledatmaximumfunkceΩ=f(n 1, n 2,...)zapředpokladu,že platí vazné podmínky(3.7) a(3.8). Použijeme metodu Lagrangeových součinitelů, viz Dodatek 1. Budeme počítat extrém pomocné funkce F ( F(n 1, n 2,...,α, β)=lnω(n 1, n 2,...)+α Π ( n i )+β E t i i n i E i ), (3.9) kde αaβjsoulagrangeovymultiplikátory 2.ZalnΩdosadímezevztahu(3.6) lnω(n 1, n 2,...)=lnΠ! i ln n i!. ProtožeΠan i jsouvelkáčísla,nahradímefaktoriályjednoduššímivýrazy,vizdodatek 2, F=ΠlnΠ Π i (n i ln n i n i )+α ( Π i n i )+β ( E t i n i E i ). (3.10) Nutné podmínky extrému jsou ( ) F = ln n i 1+1 α βe i =0, i=1,2,..., (3.11) n i ( ) F = Π n i =0, (3.12) α i ( ) F = E t n i E i =0. (3.13) β i Z rovnice(3.10) dostáváme Dosadíme tento výsledek do(3.12) n i = e α e βe i. (3.14) Π i e α e βe i =0 = e α = a spojíme rovnice(3.14) a(3.15). Dostaneme Π i e βe i (3.15) n i =Π e βe i i e βe i. (3.16) Řešení je zřejmě vázaným maximem funkce Ω(nebudeme to dokazovat). Minimu funkce odpovídá mikrostav supersystému, ve kterém mají všechny NV-systémy stejnouhodnotuenergie,tj. n 1 =Π, n 2 = n 3 = =0, E 1 = E t /Π = Ω=1. 2 MístoΩjevpomocnéfunkcilnΩ.Nalezeníextrémujeoněcopohodlnější,výsledekstejný. 34
35 Nakonec určíme pravděpodobnost, že NV-systém bude ve stavu s hodnotou energie E i.tatopravděpodobnostjerovnapočtu příznivýchpřípadů dělenémucelkovým počtem případů Tím je vztah(3.3) dokázan. P i = n i Π = e βei. (3.17) i e βe i Vztah(3.5) nebudeme dokazovat, pouze ho zdůvodníme: Hodnota parametru β je ve všech NV-systémech stejná. Stejná je také, po ustavení termodynamické rovnováhy, teplota. β je tedy funkcí teploty. Protože exponenty v(3.17) musí být bezrozměrné, má β rozměr reciproké energie, což ve vztahu(3.5) platí. 35
36 36
37 Kapitola 4 Vztahy pro termodynamické funkce v kanonickém souboru V této kapitole odvodíme vztahy mezi termodynamickými veličinami(u, F, S, H, C V,...)apartičnífunkcí Q.Tytovztahymajívestatistickétermodynamicezákladní důležitost. Partiční funkce Q= i e βe i závisínateplotě,objemuapočtučástic: Q=f(T, V, N).Nateplotězávisíprostřednictvímparametru β,vizrovnice(3.5).energie E i kvantovýchstavůsystémunateplotě nezávisejí.jsouvšakfunkcemiobjemuapočtučástic: E i = f(v, N).Vnásledujících odstavcích nebudeme pro jednoduchost explicitně vypisovat závislosti na počtu částic. 4.1 Vnitřní energie Vnitřní energii snadno dostaneme spojením rovnice pro souborový průměr, X s = i P i X i,arovnice P i =exp( βe i )/ iexp( βe i )propravděpodobnostvkanonickém souboru U= E i e βe i E i e βe i i i P i E i = =. (4.1) i e βe i Q i Zde a v následujících vztazích pro jednoduchost vynecháváme dolní index s, označující souborovou veličinu. Rovnici(4.1)je výhodné přepsat tak, aby na pravé straně vystupovala jen partiční funkce, případně její derivace. Všimněme si, že derivace partiční 37
38 funkcepodleteploty(β=1/k B T)je ( ) Q T V = ( i e βe ) i = 1 T k B T 2 i E i e βe i, což je, až na násobný faktor, čitatel v(4.1); jmenovatelem je partiční funkce. Odtud plyne ( ) ln Q U= k B T 2 T V. (4.2) Vnitřní energie systému je ve fenomenologické termodynamice určena až na aditivní konstantu, viz oddíl(1.3.5). Jak je to tady? Energie i tého kvantového stavu systému, E i,jetakéznámajenrelativně.přirozenýmstandardnímstavem(přirozenounulou)jezdenejnižšíenergetickáhladina E 0,kteroumásystémpřiteplotě0 K.Vtomto standardnímstavujepartičnífunkcetvořenajedinýmčlenem, Q 0 =exp( E 0 /k B T). Dosadíme-li za tento výraz do rovnice(4.2), dostaneme, že vnitřní energie při absolutnínulejerovna U 0 = E Helmholtzova energie Helmholtzova energie je definována vztahem F= U TS. (4.3) ZGibbsovyrovnice df= SdT pdv dostáváme Spojením těchto rovnic pak máme T ( ) F T V ( ) F T V = S. (4.4) + F= U, (4.5) což je obyčejná diferenciální rovnice prvního řádu pro funkci F. Chceme znát závislost Helmholtzovy energie na partiční funkci. Dosadíme proto na pravé straně za vnitřní energii z(4.2) T ( ) F T V ( ) ln Q + F= k B T 2 T V 38. (4.6)
39 Tuto rovnici řešíme metodou variace konstant, viz Dodatek 3. Řešením homogenní rovnice je T ( ) F T V + F=0. F= C T. Dosadíme F= C Ta F = C T+ Cdorovnice(4.6)apomaléúpravědostaneme ( ) ln Q C = k B T V Po dosazení za C je Helmholtzova energie = C= k B (ln Q+I). F= k B T(ln Q+I). (4.7) Zbývá určit integrační konstantu I. Využijeme k tomu třetí větu termodynamickou lim S=0. (4.8) T 0 Spojením(4.4) a(4.7) dostáváme S= ( ) F T V = k B (ln Q+I)+k B T ( ) ln Q T V. (4.9) Co dál? Potřebujeme vědět, jak závisí partiční funkce na teplotě při nízkých teplotách. Vztah(3.4) rozepíšeme na [ Q=exp E ] [ 0 +exp E ] [ 1 +exp E ] , k B T k B T k B T kde energie kvantových stavů systému jsou uspořádány vzestupně: 0 < E 0 < E 1 < E 2 <... Jezřejmé,žesteplotoublížícíseknulesevšechnyexponenciálynapravéstraněvztahu pro partiční funkci blíží rovněž k nule, ty však, jejichž energie je vyšší, rychleji. Při velmi nízkých teplotách proto můžeme partiční funkci nahradit jediným členem [ Q=exp E ] 0, [T 0], k B T 39
40 což bude platit tím přesněji, čím je teplota nižší(fyzikální argumentace: při velmi nízkých teplotách je systém v energeticky nejnižším stavu). Potom platí máme limln Q=lim E 0 T 0 T 0 k B T, ( lim [k S=lim B E ) 0 T 0 T 0 k B T + I + k B T E ] 0 = k k B T 2 B I=0 = I=0. Dosazením I = 0 do rovnice(4.7) získáme vztah mezi Helmholtzovou energií a partiční funkcí,takjednoduchýatakdůležitý,žesijejdovolímdátdorámečku F= k B Tln Q (4.10) 4.3 Ostatní termodynamické veličiny Vztah mezi entropií a partiční funkcí dostaneme dosazením I = 0 do rovnice(4.9) ( ) ln Q S= k B ln Q+k B T. (4.11) T Tlak systému je ( ) ( ) F ln Q p= = k B T. (4.12) V V T T Další termodynamické veličiny dostaneme snadno pomocí vztahů pro U, F, S a p. Entalpie je Gibbsova energie je ( ) ln Q H= U+ pv= k B T 2 T V Izochorická tepelná kapacita je ( ) U C V = T V V + V k B T G=F+ pv= k B Tln Q+V k B T = k B T 2 2 ln Q T 2 +2k B T ( ) ln Q V ( ) ln Q V T ( ) ln Q T V T. (4.13). (4.14). (4.15) Ve spoustě rovnic této kapitoly jsme mohli přehlédnout, jak závažného výsledku bylo dosaženo: 40
41 Známe-li partiční funkci systému, můžeme určit všechny jeho termodynamické veličiny. Situace však zase není tak růžová. Partiční funkci je možno přesně určit jen v některých jednoduchých případech, pro ideální plyn, řídký reálný plyn, ideální krystal. Naučíme se to později. V řadě jiných případů, například u kapaliny, se budeme muset uchýlit k aproximacím. Také o tom bude řeč později. Závěrem bych chtěl poznamenat, že není nutné si všechny vzorce této kapitoly pamatovat. Stačí znát jednoduchý vztah pro Helmholtzovu energii(4.10). Vše ostatní lze odvodit termodynamickou cestou. 4.4 Ještě něco entropie Odvodili jsme vztah mezi entropií a partiční funkcí, viz rovnice(4.11). Nyní najdeme důležitý vztah mezi entropií a pravděpodobností. V kanonickém souboru platí Odtud dostaneme a dosadíme do(4.11) P i = e βe i Q. ln Q= βe i ln P i S = k B ( βe i ln P i ) k B T = E i T k Bln P i + E i T k B T = k B ln P i k B T P i ( Pi T ) ( ) (βei +ln P i ) V. T ( ) ln Pi T V V Levouipravoustranurovnicenásobíme P i S P i = k B P i ln P i k B T a sečteme pro všechny stavy i kanonického souboru S i P i = k B P i ln P i k B T i i ( ) Pi T V ( ) Pi T V. 41
42 Vezmemevúvahu,že i P i =1apřehodímepořadísčítáníaderivovánívedruhém členunapravéstraně ( ) Pi i = ( ) Pi =0.Dostaneme T V T V S= k B P i ln P i (4.16) i Opětjsemsidovolildátvztahdorámečku.Proč?Tatorelacemezientropiíapravděpodobnostmidovolujepřenášetpojementropieina netermodynamickésystémy. Zmínímseotomvposledníkapitole.Nežsenačasrozloučímestímtozarámovaným vzorcem, uvedu jeho speciální případ. V mikrokanonickém souboru jsou všechny pravděpodobnosti stejné, a jsou rovny převrácené hodnotě počtu dostupných mikroskopickýchstavůsystému W,vizvztah(3.2).Dosazením P i = 1 W do(4.16)dostaneme S= k B ln W. (4.17) Tento vzorec se nazývá Boltzmannovým vztahem pro entropii. Je vytesán na Boltzmannově náhrobku ve Vídni. 42
43 Kapitola 5 Ideální plyn Stavová rovnice ideálního plynu pv= nrt jepovícenežstoletíznáma.lzejizískatzempirickýchzákonů Boyleova,Gay- -Lussacova,Avogadrova.Lzejitakéodvoditpomocíkinetickéteorieideálníhoplynu 1. K popisu termodynamických veličin je vedle stavové rovnice třeba znát tepelné kapacity. Ty jsou u ideálního plynu závislé jen na teplotě. Pro závislosti tepelných kapacit na teplotě se volí různé empirické vztahy, viz například rovnice(1.1). Konstanty v těchto vztazích se určují z výsledků kalorimetrických měření. Ideální plyn je soustava částic, které se silově neovlivňují. Nabízí se otázka, jaké nové poznatky může statistická termodynamika přinést při studiu tohoto nejjednoduššího modelu. Statistická termodynamika dokáže odvodit stavovou rovnici ideálního plynu čistěji,tj.bezrůznýchdoplňujícíchpředpokladů,ježčiníkinetickáteorie 2. Hlavně však dovede odvodit přesné vztahy pro závislosti tepelných kapacit na teplotě. Jediné konstanty vystupující v těchto vztazích jsou údaje o molekulách délky vazeb, valenční úhly, frekvence vibrací vazeb mezi atomy v molekule. 1 Vkinetickéteoriisevycházízpředstavy,žetlakvznikánárazymolekulnastěnunádoby.Určíse počet nárazů na jednotkovou plochu za jednotku času a odtud síla působící na jednotkovou plochu, tj. tlak. 2 Napříkladobejdemesebezpředpokladu,žetřetinamolekulsepohybujevesměruosy x,třetina vesměru y,třetinavesměru z. 43
44 5.1 Partiční funkce ideálního plynu Jak bylo ukázáno v kapitole 4, klíčem k termodynamickým veličinám je partiční funkce Q= i e βe i. (5.1) Tento formálně jednoduchý vztah je ve skutečnosti neskutečně složitý. Vystupují vněmenergie E i kvantovýchstavůmakroskopickéhosystémuobsahujícíhonesmírný počet částic.(na řešení Schrödingerovy rovnice obecného makroskopického systému nelze ani pomyslet.) U ideálního plynu lze vztah pro partiční funkci zjednodušit natolik, že se úloha určení Q stane řešitelnou. První zjednodušení plyne z definice ideálního plynu jako soustavy neinteragujících částic: energie soustavy je součtem energií molekul. Potom platí N E i = ε i,j, (5.2) j=1 kde N jepočetmolekulideálníhoplynuaε i,j jeenergiemolekuly j,je-lisystém vkvantovémstavu i.rovnice(5.1)přejdena 3 Q= i N exp( β i,j )= j=1ε i N N e βε i,j = e βε i,j. (5.3) j=1 j=1 i Definujeme partiční funkci molekuly j vztahem q j = i e βε i,j. (5.4) Jsou-li všechny molekuly stejné, platí q 1 = q 2 = =q N = q, (5.5) kde q= i e βε i. (5.6) Dosazením do(5.3) dostaneme Q=q N (5.7) 3 Úprava nenímatematickykorektní.uvěřtemi,prosím,ževýsledekjevpořádku. Podrobnější vysvětlení by zabralo mnoho místa. 44
45 Tento vztah platí pro soustavu stejných, ale navzájem rozlišitelných molekul. Rozlišitelností zde rozumíme to, že jsme molekuly očíslovali. Ve skutečnosti nejsou molekuly rozlišitelné a nemáme právo je očíslovat. Představme si, že molekula číslo 1 je v kvantovémstavu Aamolekulačíslo2vkvantovémstavu B.Tutosituacinemůžemežádnou cestourozlišitodstavu,kdymolekula1jevestavu Bamolekula2vestavu A.Svýjimkou oblasti velmi nízkých teplot je počet kvantových stavů molekul mnohem větší než počet molekul. Potom různé molekuly jsou v různých kvantových stavech a počet nerozlišitelných stavů je roven počtu permutací N!. Z tohoto důvodu platí Q= qn N!. (5.8) Totojehledanývztahpropartičnífunkciideálníhoplynu.Vidíme,žesenámuideálního plynu podařilo redukovat nesmírně obtížnou úlohu nalezení partiční funkce systému o N částicích úlohou mnohem snažší! Stačí najít partiční funkci jedné, jediné molekuly(proto ten rámeček) Separace energie molekuly Partiční funkci molekuly můžeme přepsat do tvaru q= l g l e βε l, (5.9) kdesesčítánikolivpřeskvantovéstavy,alepřesenergetickéhladiny.veličina g l jestupeň degenerace energetické hladiny l. Je to počet kvantových stavů molekuly majících energii ε l. Uvažujme osamělou molekulu(respektive molekulu ideálního plynu, jež si ostatních molekul nevšímá) při teplotě velmi blízké absolutní nule. Taková molekula se prakticky nepohybuje. Heisenbergův princip neurčitosti však zakazuje, aby molekula měla zároveň přesně určenou polohu i rychlost. Proto i v limitě absolutní nuly má molekulajistouenergii ε 0 = 1 hν,zvanouenergiezákladníhostavunebotéženergie 2 nulového bodu. Tato energie dovoluje molekule oscilovat kolem své střední polohy, a tím vyhovět principu neurčitosti. 45
46 Představíme-li si molekulu jako živou bytost, můžeme říci, že se při teplotě blízké 0 K chvěje zimou. Dodáme-li této molekule trochu energie, začne se zvolna pohybovat. Říkáme, že molekula získala translační stupně volnosti. Dodáme-li ji více energie, zrychlí svůj translační pohyb a kromě toho se začne točit věnuje část dodané energie rotačním stupňům volnosti. Má-li energie ještě více, zrychlí své translační i rotační pohyby, a část energie věnuje na vibrace meziatomových vazeb. Aktivizovala své vibrační stupně volnosti. Energeticky velmi bohatá molekula excituje elektrony do vyšších hladin(elektronové stupně volnosti). Další příděl energie pak vede k ionizaci k destrukci molekuly. Klasická(nekvantová) mechanika předpokládala, že molekula se chová vůči svým stupňům volnosti spravedlivě. Každému z nich přidělí stejné množství energie úměrné teplotě, k B T/2,kdekonstantaúměrnosti k B jeboltzmannovakonstanta.tototvrzení se nazývá ekvipartiční princip. Výsledky měření tepelných kapacit ukazují, že ekvipartiční princip platí jen přibližně. Zvolíme méně přísný předpoklad, že se jednotlivé stupně volnosti navzájem neovlivňují. Budeme například předpokládat, že vibrace rotující molekuly jsou stejné jako umolekuly,kteránerotuje 4.Předpokladnezávislostipohybůmolekulyvedekrovnici ε=ε 0 + ε tr + ε rot + ε vib + ε el, (5.10) kde ε tr jeenergietranslačních, ε rot rotačních, ε vib vibračníchaε el elektronovýchpohybů. Dosadíme-li rovnici(5.10) do vztahu(5.6) pro partiční funkci molekuly, dostaneme q= i exp[ β(ε 0 + ε tr,i + ε rot,i + ε vib,i + ε el,i ]=exp( βε 0 ) q tr q rot q vib q el. (5.11) Slovy: partiční funkce molekuly je součinem partičních funkcí odpovídajících jednotlivým stupňům volnosti. Spojíme tuto rovnici s(5.8) Q= 1 N! exp( Nβε 0)q N tr qn rot qn vib qn el. (5.12) 4 Tentopředpokladneníúplněpravdivý,vedevšakkmnohemlepšímvýsledkůmnežekvipartiční princip. Výpočty hodnot tepelných kapacit jsou pro mnoho molekul dokonce přesnější než výsledky kalorimetrických měření! 46
47 Nyní dosadíme za Q do(4.10) F = k B Tln Q kde = k B Tln N!+U 0 Nk B Tln q tr Nk B Tln q rot Nk B Tln q vib Nk B Tln q el = k B Tln N!+U 0 + F tr + F rot + F vib + F el, (5.13) U 0 = Nε 0 senazýváenergiínulovéhobodu. F tr, F rot, F vib, F el jsoutranslační,rotační,vibrační a elektronový příspěvek k Helmholtzově energii. V následujících odstavcích budeme probírat příspěvky jednotlivých stupňů volnosti k termodynamickým funkcím. Budeme vždy vycházet z kvantověmechanického modelu daného pohybu. Ze vztahu pro energii daného modelu budeme počítat příslušnou partiční funkci. 5.2 Translační příspěvky Model: Molekulapohybujícísevsystémuoobjemu V = a bc,kde a, b, cjsoudélkyhran kvádru. Energie: ( ) ε tr = h2 n 2 x n2 8m a 2+ y n2 b 2+ z, (5.14) c 2 kde hjeplanckovakonstantaamhmotnostmolekuly.veličiny n x, n y, n z jsoukvantováčíslapohybůvesměruos x, y, z. Stupeň degenerace: Energetickéhladinynejsoudegenerovány, g tr =1. Pro translační partiční funkci plyne q tr = q tr,x q tr,y q tr,z ( = exp h2 8mk B T n x=0 n 2 ) ( x exp a 2 n y=0 h2 8mk B T n 2 ) ( y exp b 2 n z=0 h2 8mk B T n 2 ) z (5.15) c 2 47
48 Vevětšiněpřípadůlzesumyvrovnici(5.15)nahraditintegrály 5,vizDodatek2, q tr = 0 exp ( h2 8mk B T Platí,vizDodatek4,že 0 n 2 ) x a 2 exp Rovnice(5.16) potom přejde na q tr = ( ( dn x exp h2 0 8mk B T h2 8mk B T n 2 ) y b 2 ( dn y exp h2 0 8mk B T n 2 ) z c 2 (5.16) dn z. n 2 ) ( ) 1/2 x 2πmkB T dn a 2 x = a. (5.17) h 2 ( ) 3/2 ( ) 3/2 2πmkB T 2πmkB T abc= V. (5.18) h 2 Ze vztahů(5.18) a(5.13) dostaneme translační příspěvek k Helmholtzově energii h 2 F tr = Nk B Tlnq tr = Nk B Tln ( λ 3 V ), (5.19) kde λ=h/ 2πmk B T. a Spojením(5.19) a rovnic(1.36) máme S tr = ( ) Ftr T p tr = V = Nkln ( λ 3 V ) + 3 Nk (5.20) 2 ( ) Ftr V T = Nk BT V. (5.21) Rovnice(5.20) pro entropii se v literatuře nazývá Sackurova-Tetrodova. Rovnice(5.21) je známá stavová rovnice ideálního plynu, která, stejně jako(5.20), zde byla odvozena přesným statisticko termodynamickým postupem. Z rovnice je zřejmé, že celkový tlak je totožný s translačním tlakem. Rotace, vibrace a elektronové excitace k tlaku nepřispívají(viz rovněž následující odstavce věnované těmto příspěvkům). Vztahy pro ostatní termodynamické veličiny plynou z rovnic(1.1),(1.8),(1.13), (1.16) a(1.17) U tr = F tr + TS tr = 3 2 Nk BT, (5.22) H tr = U tr + p tr V = 5 2 Nk BT, (5.23) 5 Opatrnějšímusímebýtpřiteplotáchvblízkostiabsolutnínulyaumálohmotnýchmolekul (vodík, helium). 48
49 G tr = F tr + p tr V = Nk B Tln ( λ 3 V ) + Nk B T, (5.24) ) C V,tr = C p,tr = ( Utr T V ( ) Htr T p = 3 2 Nk B, (5.25) = 5 NkB. (5.26) 2 Všimněme si, že ve vztahu pro partiční funkci translačních pohybů vystupují jen univerzální konstanty(planckova a Boltzmannova) a hmotnost molekuly. K výpočtu translačních příspěvků ke všem termodynamickým funkcím tedy stačí jediný údaj o molekule její hmotnost. U látek tvořených jednoatomovými molekulami jsou rotační a vibrační příspěvky nulové. Neexistují u nich žádné meziatomové vazby, které by vibrovaly, a kolem kterých by atomy rotovaly. Ve většině případů, jestliže teplota systému není extrémně vysoká, můžeme zanedbat také elektronové příspěvky. Typickými případy jednoatomových plynů jsou helium, neon, argon, krypton, xenon a radon. U nich se vztah pro partiční funkci zjednoduší na Q= 1 N! exp( U 0/k B T)q N tr. (5.27) Pro Helmholtzovu energii systému pak platí F= k B Tln Q=U 0 + Nk B Tln N Nk B T+ F tr, (5.28) kde jsme použili vztah(d2.2) pro ln N!. Z rovnice(5.28) dostaneme vztahy pro ostatní termodynamické veličiny. Data potřebná k výpočtům: hmotnost molekuly. 5.3 Rotační příspěvky U rotačních příspěvků je třeba rozlišovat mezi rotacemi lineárních a nelineárních molekul. Lineární molekuly mohou rotovat kolem dvou os kolmých na osu procházející středy atomů molekuly. Lineární molekula má tedy dva rotační stupně volnosti. Nelineární molekuly mohou rotovat kolem tří os a mají tedy tři rotační stupně volnosti. 49
50 5.3.1 Rotace lineární molekuly Model: Tuhý lineární rotor. V tomto modelu se předpokládá, že délky meziatomových vazeb jsou stálé, nezávislé na tom, zda molekula rotuje či nerotuje. Energie: ε rot = h2 l(l+1), (5.29) 8π 2 I kde l je kvantové číslo rotace a I moment setrvačnosti molekuly. Stupeň degenerace: g rot =2l+1. Ze vztahu(5.29) plyne pro partiční funkci rotace [ ] q rot = (2l+1)exp h2 l=0 8π 2 Ik B T l(l+1). (5.30) Také zde za nepříliš nízkých teplot můžeme nahradit sumu integrálem q rot = 0 (2l+1)exp [ h2 8π 2 Ik B T l(l+1) Kvýpočtuintegrálupoužijemesubstituci y= 8π 2 Ik B T l(l+1)adostaneme q rot = 8π2 Ik b T h 2. Při odvození tohoto vztahu jsme předpokládali, že kvantové číslo l může nabývat všech nezápornýchhodnot, l=0,1,2,...paulihovylučovacíprincipvšakkladeomezenína hodnoty l. Správný vztah pro partiční funkci je h2 ] dl. q rot = 8π2 Ik b T σh 2, (5.31) kde σ je číslo symetrie, počet vzájemně nerozlišitelných poloh, do nichž lze molekulu při rotaci podle jednotlivých os natočit. Pro homonukleární dvouatomové molekuly (např.n 2 )asymetrickélineárnívíceatomovémolekuly(např.hc CH)je σ=2.pro heteronukleární dvouatomové molekuly a nesymetrické lineární víceatomové molekuly je σ=1. 50
51 Stejně jako u translačních příspěvků dostaneme ze vztahu(5.31) rotační příspěvky k termodynamickým veličinám F rot S rot ( 8π 2 ) Ik B T = Nk B Tln q rot = Nk B Tln, (5.32) σh 2 ( 8π 2 ) Ik B T = Nk B ln + Nk σh 2 B, (5.33) p rot = 0, (5.34) U rot = Nk B T, (5.35) H rot = U rot, (5.36) G rot = F rot, (5.37) C V,rot = Nk B, (5.38) C p,rot = C V,rot. (5.39) Partiční funkci rotace molekuly můžeme určit z jediného údaje jejího momentu setrvačnosti I. Moment setrvačnosti lineární molekuly je dán vztahem n I= m i ri 2, (5.40) i=1 kde njepočetatomůvmolekule, m i hmotnosti-téhoatomuar i jehosouřadnice vzhledem ke vztažné soustavě se středem v těžišti molekuly. Těžiště je určeno rovnicí n m i r i =0. (5.41) i=1 Speciálně pro dvouatomové molekuly máme m 1 r 1 + m 2 r 2 =0. Je-lidélkavazbyrovna r=r 2 r 1,vizobrázek5.1,platí r 1 = m 2r, m 1 + m 2 r 2 = m 1r m 1 + m 2. Po dosazení do(5.40) máme I= m 1m 2 m 1 + m 2 r 2. Data potřebná k výpočtům: hmotnosti atomů v molekule, délka vazby u dvouatomových molekul, délky vazeb u víceatomových. 51
52 m 1 3 r 1 O m 2 7 r 2 Obrázek 5.1: Geometrie dvouatomové molekuly Rotace nelineární molekuly Model: Tuhý nelineární rotor. Předpokládá se, že délky meziatomových vazeb jsou stálé, nezávislé na tom, zda molekula rotuje či nerotuje. Energie rotace nelineární molekuly závisí na třech hlavních momentech setrvačnosti, I A, I B, I C.Vztahneuvádíme,jesložitější.Partičnífunkcerotaceje ( 8π 2 ) 3/2 k B T (πd) 1/2, (5.42) q rot = 1 σ h 2 kde σječíslosymetrieadjesoučinhlavníchmomentůsetrvačnosti, D=I A I B I C. Z tohoto vztahu dostaneme rotační příspěvky k termodynamickým veličinám F rot S rot = Nk B Tln q rot = Nk B Tln 1 ( 8π 2 ) 3/2 k B T (πd) 1/2, (5.43) σ h 2 = Nk B ln 1 ( 8π 2 ) 3/2 k B T (πd) 1/2 + 3 Nk, (5.44) σ h 2 2 p rot = 0, (5.45) U rot = 3 2 Nk BT, (5.46) H rot = U rot, (5.47) G rot = F rot, (5.48) C V,rot = 3 2 Nk B, (5.49) C p,rot = C V,rot. (5.50) Partiční funkci rotace nelineární molekuly můžeme určit, známe-li součin hlavních 52
53 momentů setrvačnosti, D, pro který platí I xx I xy I xz D= I yx I yy I yz. (5.51) I zx I zy I zz Prvky determinantu jsou n I xx = m i (yi 2 + z2 i ), i=1 n I xy = I yx = m i x i y i, (5.52) i=1. njepočetatomůvmolekule, m i jsouhmotnostiatomů, x i, y i, z i jsoukartézskésouřadnice poloh atomů vzhledem k těžišti molekuly. Pro těžiště platí n m i x i =0, i=1 n m i y i =0, i=1 n m i z i =0. (5.53) i=1 Kvýpočtu Dpotřebujemesouřadnice x i, y i, z i atomůmolekuly.tyurčímezeznámých délek vazeb a vazebných úhlů. Data potřebná k výpočtům: hmotnost atomů v molekule, délky vazeb, vazebné úhly. 5.4 Vibrační příspěvky Zde budeme rozlišovat případ dvouatomové molekuly a případ víceatomové molekuly. U dvouatomové molekuly existuje jediná vazba mezi atomy, a tedy jediný vibrační stupeňvolnosti 6.Uvíceatomovémolekulyjsoudvamožnépřípady.Lineárnívíceatomová molekula má 3n 5 nezávislých vibrací, tj. vibračních stupňů volnosti, nelineární jichmá3n 6,kde njepočetatomůvmolekule Vibrace dvouatomové molekuly Model: Kvantověmechanický harmonický oscilátor. 6 U n atomovémolekulyjecelkovýpočetstupňůvolnostiroven3n,cožjepočetkartézských souřadnic atomů molekuly. Translační stupně volnosti jsou 3(souřadnice těžiště), rotační jsou 2 u lineárních molekul a 3 u nelineárních. 53
54 Energie: ε vib = hν ( j+ 1 ), (5.54) 2 kde ν je základní frekvence vazby a j kvantové číslo vibrace. Stupeň degenerace: Energetickéhladinynejsoudegenerovány, g vib =1. Pro partiční funkci vibrace platí q vib = exp( hνj/k B T). (5.55) j=0 Člen 1 hν vtomtovzorcinevystupuje, bylzahrnutdoenergienulovéhobodu,viz 2 (5.10). Zajisté nyní očekáváte, že budeme postupovat stejně jako u translačních a rotačních příspěvků: nahradíme sumu integrálem a tento integrál se pokusíme vyřešit. Nebude tomu tak, náhrada sumy integrálem by zde způsobila znatelnou chybu. Naštěstí lze nekonečnou sumu v(5.55) snadno sečíst. Označíme y=exp( hν/k B T) a sumu přepíšeme do tvaru exp( hνj/k B T)= [exp( hν/k B T)] j = y j. j=0 j=0 j=0 Na pravé straně rozpoznáme geometrickou řadu s prvním členem rovným 1 a kvocientem y.jejísoučetje j=0 y j = 1 1 y. Partiční funkce vibrace je tedy dána vztahem q vib = 1 1 y = 1 1 exp( hν/k B T). (5.56) Příspěvky k termodynamickým funkcím získáme obvyklým způsobem F vib = Nk B Tlnq vib = Nk B Tln ( 1 e x), (5.57) 54
55 S vib = Nk B xe x 1 e x Nkln ( 1 e x), (5.58) p vib = 0, (5.59) U vib = Nk B T xe x, (5.60) 1 e x H vib = U vib, (5.61) G vib = F vib, (5.62) C V,vib = Nk B x 2 e x (1 e x ) 2, (5.63) C p,vib = C V,vib, (5.64) kde x= hν k B T. Data potřebná k výpočtům: jedna fundamentální frekvence Vibrace víceatomové molekuly Označíme počet vibračních příspěvků symbolem f. Potom f= 3n 5 lineárnímolekula 3n 6 nelineární molekula Energie vibrace molekuly je součtem příspěvků kde f ε vib = ε vib,1 + ε vib,2 + +ε vib,f = ε vib,i, (5.65) i=1 ε vib,i = hν i ( j i) (5.66) jeenergie i-téhovibračníhopohybu, ν i jehofundamentálnívibraceaj i jeho j-té vibrační kvantové číslo. Pro partiční funkci platí Partiční funkce i-tého vibračního pohybu je Partiční funkce vibrace je pak f q vib = q vib,1 q vib,2 q vib,f = q vib,i. (5.67) i=1 q vib,i = exp( hν i j i /k B T)= j i =0 q vib = f i=1 1 1 exp( hν i /k B T). (5.68) 1 1 exp( hν i /k B T). (5.69) 55
56 Příspěvky k termodynamickým funkcím dostaneme obvyklým způsobem f F vib = Nk B Tln q vib = Nk B T ln ( 1 e i) x, (5.70) i=1 f x i e x i f S vib = Nk i=11 e Nk ln ( 1 e i) x x i, i=1 (5.71) p vib = 0, (5.72) f x i e x i U vib = Nk B T, i=11 e x i (5.73) H vib = U vib, (5.74) G vib = F vib, (5.75) C V,vib = Nk B f i=1 x 2 ie x i (1 e x i ) 2, (5.76) C p,vib = C V,vib, (5.77) kde x i = hν i k B T. Data potřebná k výpočtům: f fundamentálních frekvencí. 5.5 Příspěvky excitovaných elektronů Za běžných teplot nejsou elektrony excitovány a platí q el =1. (5.78) I při poměrně vysokých teplotách jsou elektronové příspěvky malé. Významnější jsou uatomůsneúplnouelektronovou slupkounežuatomůsuzavřenouslupkou au víceatomových molekul. Například u křemíku(neúplná slupka) je při T = 1000 K translačnípříspěvekktepelnékapacitěroven12,47jmol 1 K 1,aelektronovýpříspěvekje0,18Jmol 1 K 1,tedyjenoněcovícenežjednoprocentotranslačníhopříspěvku. Partiční funkce elektronových příspěvků se počítá(pokud se vůbec počítá) jako součet q el = g l e ε el,l/k B T, (5.79) l=0 kde ε el,l jeenergievl-témelektronovémexcitovanémstavu.početčlenů,kteréje třebauvažovat,jemalý;sčításe členpočlenu. 56
57 Data potřebná k výpočtům: stupně degenerace a energie jednotlivých excitovaných stavů. 5.6 Směs ideálních plynů Projednoduchostbudemeuvažovatbinárnísměstvořenou N 1 molekulamiprvnísložky a N 2 molekulamisložkydruhé.rozšířenínavícesložkovésoustavyjebezprostřední. Partiční funkce dvousložkové ideální směsi je Q= 1 N 1! qn N 2! qn 2 2, (5.80) kde q 1 a q 2 jsoupartičnífunkcemolekulsložky1a2.helmholtzovaenergieje F = k B Tln Q = N 1 k B TlnN 1 N 1 k B T N 1 k B Tln q 1 +N 2 k B Tln N 2 N 2 k B T N 2 k B Tln q 2. (5.81) Tuto rovnici přepíšeme do tvaru, ve kterém budou vystupovat molární zlomky složek x 1 = N 1 N, x 2= N 2 N,kde N= N 1+N 2.Pomaléúpravě(vytkneme Nk B Tapřepíšeme ln N i naln x i +ln N)dostaneme F= Nk B T(x 1 ln x 1 + x 2 lnx 2 x 1 lnq 1 x 2 ln q 2 x 1 x 2 + x 1 ln N+ x 2 ln N). Partiční funkce systému N molekul čisté látky 1 je (5.82) Q 1 = 1 N! qn 1 (5.83) aobdobnývztahplatípročistoulátku2.je-li NAvogadrovočíslo(N= ), pakjemolárníhelmholtzovaenergiečistélátky i(i=1,2)rovna F m,i = Nk B T(lnq i ln N+1) (5.84) Spojením rovnic(5.82) a(5.84) dostaneme známý vztah pro molární Helmholtzovu energii ideální směsi F m = Nk B T(x 1 ln x 1 + x 2 ln x 2 )+x 1 F m,1 + x 2 F m,2 (5.85) 57
58 Z této rovnice dostaneme vztahy pro ostatní termodynamické funkce ideální směsi ideálních plynů S = Nk B (x 1 ln x 1 + x 2 ln x 2 )+x 1 S m,1 + x 2 S m,2, (5.86) G = Nk B T(x 1 ln x 1 + x 2 ln x 2 )+x 1 G m,1 + x 2 G m,2, (5.87) Nk B T Nk B T p = x 1 p m,1 + x 2 p m,2 = x 1 + x 2, V m V m (5.88) U = x 1 U m,1 + x 2 U m,2, (5.89) H = x 1 H m,1 + x 2 H m,2, (5.90) C V = x 1 C V m,1 + x 2 C V m,2, (5.91) C p = x 1 C pm,1 + x 2 C pm,2. (5.92) 5.7 Ideální plyn závěrečné poznámky V této kapitole se nám podařilo teoreticky čistými postupy odvodit některé vztahy, které jste již znali z fenomenologické termodynamiky: stavovou rovnici ideálního plynu (5.21), Daltonův zákon pro binární směs(5.88), termodynamické funkce ideální směsi ideálních plynů(5.86) až(5.92). Na cestě, po níž jsme se vydali, jsme zároveň dokázali, že vnitřní energie, entalpie a tepelné kapacity ideálního plynu závisejí(při pevném N) jen na teplotě, a že pro Helmholtzovu energii, Gibbsovu energii a entropii platí známé závislosti na tlaku. Tyto výsledky mohou esteticky uspokojit, nejsou však nové. Z nových poznatků můžeme jmenovat skutečnost, že tlak v ideálním plynu nezávisí na tom, zda a jak molekula rotuje a vibruje. Patrně nejužitečnější jsou však zcela nové vztahy pro závislosti tepelných kapacit na teplotě. Tyto vztahy spolu se základními daty o molekulách(délky vazeb, vazebné úhly, fundamentální frekvence) dovolují určovat tepelné kapacity mnohem přesněji než pomocí tradičních kalorimetrických měření. Kalorimetrie ideálního plynu se tak stala mrtvou disciplínou. 58
59 Kapitola 6 Ideální krystal Ideální krystal je pravidelná mřížka, v jejíchž uzlových bodech kmitají molekuly. V ideálním krystalu nejsou žádné poruchy(vakance, nečistoty). Vzdálenost mezi sousedními uzlovými body je konstantní: ideální krystal nemění s teplotou ani s tlakem svůj objem a nikdy netaje. Mluvíme-li o termodynamickém chování, pak skutečné krystalické pevné látky se tomuto idealizovanému modelu více či méně blíží. Podobnost je větší při nízkých teplotách. Jediný pohyb molekul, který se v modelu uvažuje, jsou vibrace kolem uzlových bodů mřížky(máme na mysli vibrace molekuly jako celku, nikoliv vibrace uvnitř molekuly). Partiční funkci ideálního krystalu proto můžeme psát ve tvaru Q=e U 0/k B T Q vib, (6.1) kde U 0 jeenergiemřížky,potenciálníenergiemolekul,ježjsouvuzlovýchbodech vklidu. Q vib jepartičnífunkcevibracímolekulvmřížce.budemeprobíratdvěteorie,jejichžcílemjeaproximovat Q vib :staršíajednoduššíeinsteinovu,apřesnější Debyeovu. 6.1 Einsteinova teorie ideálního krystalu Einstein zavádí tři postuláty, týkající se vibrací molekul kolem uzlových bodů mřížky: 1. Vibrace jsou nezávislé. Rozumí se tím, že molekuly kmitají bez ohledu na okamžité polohy svých sousedů, tj. tak, jako by všechny ostatní molekuly seděly ve svých uzlových bodech. 59
60 2. Vibrace jsou izotropní. Všechny směry vibrací jsou rovnocenné, žádný není preferován. 3. Vibrace jsou harmonické(viz model harmonického oscilátoru). Z postulátu o nezávislosti vibrací molekul plyne Q vib = q N vib, (6.2) kde q vib jevibračnípartičnífunkcemolekuly. Poznámka: Porovnejte tento vztah s obdobným vzorcem pro partiční funkci ideálního plynu Q= 1 N! qn.faktor1/n!seuideálníhoplynuobjevujejakodůsledeknerozlišitelnosti molekul. Nelze žádným způsobem rozlišit záměnu poloh molekul. Stejně tak průměrný Evropan nerozliší záměnu poloh Číňanů stejného věku a pohlaví nebo záměnu poloh jednovaječných N-čat. Také molekuly v krystalu jsou nerozlišitelné. Rozlišitelné jsou však uzlové bodymřížky vězení,vjehožkaždécelesedíprávějeden Číňan. Vibracemolekulyvlibovolnémsměrulzesložitzvibracívesměruosy x, ya z. Vzhledem k postulátu o izotropii vibrací platí q vib = q x q y q z = q 3 x. (6.3) Nakonec vzhledem k postulátu o harmonicitě vibrací můžeme psát q x = e ǫv/k B T, (6.4) v=0 kde ǫ v = hν ( v+ 1 ) 2 je vlastní hodnota energie ve v-tém kvantovém stavu a ν je fundamentální frekvence. Ve vztahu(6.4) máme nekonečnou geometrickou řadu q x = e hν/(2k BT) y v, v=0 kde y=exp[ hν/(k B T)].Součetgeometrickéřadyje v=0 y v = 1 1 y.vztah(6.4) přejde na q x = e hν/(2k B T) 1 e hν/(k B T) = e ΘE/(2T) 1 e Θ E/T. (6.5) 60
61 VeličinaΘ E = hν/k B (mározměr[k])senazýváeinsteinovacharakteristickáteplota. Tato veličina a energie mřížky jsou jediné dva parametry, které v Einsteinově modelu charakterizují druh krystalu. Spojením rovnic(6.1) až(6.3) a rovnice(6.5) dostáváme výsledný vztah pro partiční funkci Q=e U 0/k B T ( e Θ E /(2T) 1 e Θ E/T ) 3N. (6.6) Známe-li partiční funkci, můžeme určit termodynamické veličiny. Z nich nás bude zajímat, podobně jako u ideálního plynu, především tepelná kapacita(stavové chování je nezajímavé, protože objem ideálního krystalu je konstantní). Pro izochorickou tepelnou kapacitu platí[viz vztah v(4.15)] ( C V = k B T 2 2 ) ln Q T 2 V +2k B T Dosazením za partiční funkci z rovnice(6.6) dostaneme ( ) ln Q ( ) 2 ΘE e Θ E/T C V =3Nk B T (1 e Θ E/T ) 2. (6.7) O tepelných kapacitách krystalu jsou známy tyto informace: 1. Při nulové teplotě je tepelná kapacita rovna nule T V. lim C V=0. (6.8) T 0 2. Z měření tepelných kapacit při velmi nízkých teplotách vyplývá, že tepelná kapacitarostevintervaluodabsolutnínulydoasi15kstřetímocninouteploty C V = konst. T 3. (6.9) 3. Při vysokých teplotách, pro skutečné krystaly v blízkosti bodu tání, platí empirický Dulongův-Petitův zákon. Ten říká, že tepelná kapacita je konstantní a pro atomové krystaly rovna trojnásobku univerzální plynové konstanty. Pro ideální krystal je teplota tání nekonečná. Vztah(6.7) by měl proto splňovat podmínku lim C V=3 R. (6.10) T 61
62 Uvedené tři podmínky použijeme k ověření vztahu(6.7) a tedy i Einsteinovy teorie ideálníhokrystalu.přinízkýchteplotáchječlenexp( Θ E /T)velmimalýamůžeme jej v porovnání s jedničkou ve jmenovateli vztahu zanedbat. Pro velmi nízké teploty tak dostaneme ( ) 2 ΘE C V =3Nk B e ΘE/T. T Vidíme, že tento výsledek není v souladu s kubickou závislostí tepelné kapacity(6.9). Ostatní požadavky jsou však splněny, jak uvidíme. Použitím L Hospitalova pravidla dostaneme správnou limitu(6.8). Limitu(6.10) nejpohodlněji ověříme následujícím způsobem.provysokéteplotyjeexponentθ E /T malýaexponenciálumůžemenahradittaylorovýmrozvojemdoprvníhořádu(promalá xplatí e x. =1+x).Vztah (6.7) se zjednoduší na ( ) 2 ΘE 1 C V =3Nk B ( ) T 1 1 Θ 2 =3Nk B =3R. E T Shrňme dosažené výsledky. Vztah(6.7) plynoucí z Einsteinovy teorie splňuje limitu pro nulovou teplotu(6.8) i vysokoteplotní limitu(6.10). Nesplňuje asymptotický vztah (6.9) pro nízké teploty. 6.2 Debyeova teorie ideálního krystalu Debye usoudil, že postuláty o nezávislosti a izotropii vibrací v Einsteinově modelu jsou příliš hrubé a navrhl proto odlišný model. Ideální krystal chápal jako jednu obrovskou makromolekulu a vibrace krystalu jako vnitřní vibrace této makromolekuly. Postulát o harmonicitě vibrací Debye ponechává. Krystal-makromolekula má celkem 3N stupňů volnosti, z toho 3 translační, 3 rotační a 3N 6 vibračních. Každému vibračnímu stupni volnosti odpovídá, stejně jako umolekulyideálníhoplynu,jednafundamentálnífrekvence ν i ajíodpovídajícípartičnífunkce q i.partičnífunkcikrystaluprotomůžemepsátjako(srovnejsevztahem (5.67) pro vibrace molekuly ideálního plynu) Q=e U 0/(k B T) 3N 6 i=1 q i. (6.11) 62
63 Za předpokladu, že vibrace je harmonická, platí pro partiční funkci i-tého vibračního stupně volnosti [ q i = exp hν ] i(v i +1/2). (6.12) v i =0 k B T Tuto nekonečnou harmonickou řadu lze sečíst s výsledkem q i = e hν i/(2k B T) 1 e hν i/(k B T). (6.13) Po dosazení tohoto vztahu do(6.12) a zlogaritmování dostaneme ln Q= U ( ) 3N 6 0 k B T + e hν i /(2k B T) ln. (6.14) 1 e hν i/(k B T) i=1 Abychomvztahzjednodušili,nahradímesumuintegrálem(přesfrekvence ν i,nikoliv přes sčítací index i) ln Q= U ( ) 0 k B T + νmax e hν/(2k B T) g(ν) ln dν, (6.15) 0 1 e hν/(k B T) kde ν max jenejvyššífundamentálnífrekvencevkrystalu-makromolekule.tatofrekvence,respektivedebyeovacharakteristickáteplotaθ D = hν max,amřížkováenergie U 0 jsoujedinýmidvěmaparametrycharakterizujícímikrystal. Výraz g(ν) dν udává početfrekvencí ležících vintervalu ν; ν+ dν srovnej se stupněm degenerace energetické hladiny v ideálním plynu, viz(5.9). Za určitých předpokladů lze pro g(ν) odvodit vztah Podosazeníza g(ν)do(6.15)aúpravěmáme g(ν)= 9N ν 2. (6.16) νmax 3 ln Q= U 0 k B T 9Nhν max 9N νmax ν 2 ln ( 1 e ) hν/k BT dν. (6.17) 8k B T νmax 3 0 Provedemesubstituci x=hν/(k B T)adostaneme lnq= U ( ) 0 k B T 9 8 NΘ D T 3 T 9N ΘD /T x 2 ln(1 e x )dx. (6.18) Θ D 0 Pomocí vztahu mezi vnitřní energií a partiční funkcí ( ) lnq U= k B T 2 T 63 k B
64 a rovnice(6.18) dostaneme U= U ( ) T 3 8 Nk ΘD /T BΘ D 27Nk B T x 2 ln(1 e x )dx+9nk B Tln(1 e ΘD/T ). ΘD 0 Poznámka: Při úpravě jsme využili derivování integrálu podle parametru, viz Dodatek 5. Vztah pro vnitřní energii lze ještě upravit pomocí derivování per partes na výsledný vzorec kde u=θ D /Ta U= U Nk BΘ D +3Nk B T D(u), (6.19) D(u)= 3 u 3 u 0 x 3 dx. (6.20) e x 1 Tepelná kapacita je(opět použijeme derivování integrálu podle parametru) ( ( U C V = )=3Nk B 4D(u) 3u ). (6.21) T e u 1 Kvalitu Debyeovy teorie vyzkoušíme na limitách, viz rovnice(6.8) až(6.10). Při nízkýchteplotách u aintegrálvevztahu(6.20)seblížíkekonstantě.(umíteto zdůvodnit?) Potom ( ) T 3 x 3 D(u) 3 ΘD 0 e x 1 dx=konst. T3. Dáleplatí e u 1avejmenovatelidruhéhočlenuvrovnici(6.21)můžemezanedbat jedničku. Člen se zjednoduší na 3u e u 1. =3 Θ D T e Θ D/T. S klesající teplotou se tento výraz blíží k nule mnohem rychleji než D(u)(pokuste se todokázat).ztohoplyne,žepřinízkýchteplotáchplatí(6.9)azároveňilimita(6.8). Příklad:Pokuste se odvodit, že Debyeův vzorec splňuje i vysokoteplotní limitu(6.10). Použijte L Hospitalovo pravidlo a derivování integrálu podle parametru. Závěry: Tepelná kapacita plynoucí z Debyeova modelu splňuje, stejně jako v Einsteinově modelu, vysokoteplotní i nízkoteplotní limitu. Navíc předpovídá při T 0 kubickou závislost na teplotě. Debyeův model je proto lepším přiblížením skutečného chování než model Einsteinův. Existují ještě přesnější teorie, jejich popis však není obsahem těchto skript. 64
65 Kapitola 7 Mezimolekulární síly Molekuly na sebe silově působí. Silně se odpuzují při těsném přiblížení a přitahují se, jsou-li od sebe o trochu dále. Mezimolekulární síly rychle ubývají se vzdáleností. Při vzdálenostech větších než asi 1 nm se molekuly prakticky neovlivňují. Mezimolekulární síly jsou příčinou všech makroskopických jevů. O jejich existenci se snadno přesvědčíme pozorováním věcí kolem nás. Kdyby zmizely odpudivé mezimolekulární síly, rychle bychom to poznali. Propadla by se pod námi židle i podlaha (nesedíme-li zrovna ve sklepě). Pokud by neexistovaly přitažlivé mezimolekulární síly, nebyl by důvod, aby držela sklenička s čajem pohromadě. Kdyby však přitažlivé síly klesaly s rostoucími vzdálenostmi mezi molekulami velice pomalu, celý náš svět by se zhroutil do černé díry. Poznámka: Doposud jsme se mezimolekulárními silami nemuseli zabývat. Brali jsme model ideálního plynu, soustavy částic, které spolu neinteragují. V modelu ideálního krystalu jsme chápali krystalickou mřížku jako fakt. Tento fakt je však výsledkem silového působení. Při nízkých teplotách se soustava molekul snaží dosáhnout energeticky nejvýhodnějšího uspořádání. Chceme-li popisovat reálný plyn a kapalinu, neobejdeme se bez uvažování mezimolekulárních sil. 7.1 Podstata mezimolekulárních sil Jsou známy čtyři základní síly: gravitační, elektromagnetická, slabá jaderná(rozpad neutronu), silná jaderná(přitahování nukleonů v jádrech atomů). Za mezimolekulární síly je výhradně odpovědna elektromagnetická interakce(nikoliv třeba gravitační). 65
66 7.1.1 Odpudivé síly K odpuzování(repulsi) molekul dochází při vzdálenostech, na kterých se překrývají e- lektronové obaly. Elektrony se jednak navzájem odpuzují elektrostaticky(nesou stejné náboje), jednak se projevuje Pauliho vylučovací princip dva elektrony(fermiony) se stejnýmspinemnemohoubýt nastejnémmístě,vestejnémkvantovémstavu Přitažlivé síly Přitažlivé mezimolekulární síly se dělí na multipolové, indukované a disperzní. Multipolové síly se projevují u molekul se stálým nesymetrickým rozmístěním náboje. Molekuly mohou mít permanentní dipól(například chlorovodík), kvadrupól (například oxid uhličitý), oktupól(například metan). Dochází zde k přitahování části molekuly s převládajícím záporným nábojem s kladně nabitou částí jiné molekuly, jak je znázorněno na obrázku a) b) c) Obrázek 7.1: Interakce a) dipól dipól, b) kvadrupól kvadrupól, c) dipól kvadrupól. Indukované síly se projevují při interakci molekuly s permanentním multipólem s molekulou bez multipólu(například oxid uhličitý argon). Molekula s nesymetrickým rozmístěním náboje indukuje v druhé molekule dipól. Indukovaný dipól a permanentní multipól se přitahují, viz obrázek 7.2. Přitahování molekul bez permanentních multipólů, například dvou molekul argonu, způsobují disperzní síly. V molekule argonu dochází k fluktuaci náboje. Na malý okamžik je rozmístění náboje nesymetrické, vzniká okamžitý dipól. Ten indukuje dipól v sousední molekule. Okamžitý a indukovaný dipól se přitahují, viz obrázek 7.3. Okamžitý dipól rychle zaniká. Dojde však k další fluktuaci a celá situace se opakuje. 66
67 polarizace molekuly Obrázek 7.2: Interakce permanentní kvadrupól indukovaný dipól. Disperzní síly se projevují u všech molekul, ať s multipóly nebo bez nich. Kdyby neexistovaly, nepodařilo by se nám, například, nikdy zkapalnit argon fluktuace polarizace Obrázek 7.3: Disperzní interakce mezi dvěma molekulami argonu. 7.2 Párový mezimolekulární potenciál, pravidlo párové aditivity Párový potenciál Je zvykem mluvit o silách mezi molekulami, obvykle se však pracuje s potenciální energií molekul(síla působící mezi dvěma částicemi je záporně vzatá derivace potenciální energie podle vzdálenosti). Potenciální energie dvojice izolovaných částic se nazývá párovým(mezimolekulárním) potenciálem. Párový potenciál u je funkcí pouze vzdálenosti mezi středy molekul a úhlů, charakterizujících vzájemnou polohu molekul. Volíme ho rovným nule pro dvě nekonečně vzdálené molekuly. Párový potenciál sféricky symetrických částic(argon) závisí jen na jejich vzdálenosti u=f(r), (7.1) párový potenciál lineárních molekul(oxid uhličitý) je funkcí vzdálenosti a tří úhlů, 67
68 viz obrázek 7.4, u=f(r, θ 1, θ 2, φ). (7.2) θ θ 1 2 r φ Obrázek 7.4: Vzájemná orientace dvou lineárních molekul. Párový potenciál obecných molekul s pevnými vazbami je funkcí vzdálenosti a pěti úhlů, určujících jejich vzájemnou orientaci. V dalším textu, pokud nebude řečeno jinak, budeme pro jednoduchost chápat párový potenciál jen jako funkci mezimolekulární vzdálenosti, tj. budeme uvažovat vztah (7.1). Jeho typická závislost na vzdálenosti je na obrázku 7.5. V oblasti vzdáleností od r=0,tj.úplnéhopřekryvudvoumolekul,dovzdálenosti r m,kde umáminimum, převládají odpudivé síly. Při vzdálenostech vyšších než je poloha minima převládají přitažlivésíly.je-livzdálenostdvoumolekulprávěrovna r m,molekulyseaninepřitahují, ani neodpuzují. Tato rovnovážná vzdálenost je přibližně rovna vzdálenosti mezi sousedními molekulami v krystalu Vícečásticové mezimolekulární potenciály Potenciálníenergietřímolekul u 3 vevzdálenostech r 12, r 13, r 23 jerovnasoučtupárovýchpříspěvkůakorekce u 3 : u 3 (r 12, r 13, r 23 )=u(r 12 )+u(r 13 )+u(r 23 )+ u 3 (r 12, r 13, r 23 ). Korekční člen se nazývá tříčásticový(mezimolekulární) potenciál. V porovnání s párovými potenciály je malý. Je důsledkem toho, že přítomnost třetí molekuly mění poněkud rozložení nábojů dvojice molekul a tím i jejich interakci. 68
69 3 2 u LJ (r) 1 0 odpudivé síly přitaľlivé síly r Obrázek 7.5: Závislost párového potenciálu na vzdálenosti mezi dvěma molekulami. Podobně se zavádějí čtyřčásticové a vyšší potenciály. Kromě toho, že jsou ještě menší než tříčásticové potenciály(jsou to korekce korekcí), se o nich ví velmi málo. Prakticky vždy se zanedbávají Pravidlo párové aditivity Makroskopické soustavy se neskládají ze dvou nebo tří, ale z mnoha částic. Zajímá náspotenciálníenergie u N souboru Nmolekul,kde N 1.Tajefunkcíobrovského počtu proměnných, poloh a orientací všech molekul. Protože tříčásticové potenciály, korekce, jsou malé a vyšší potenciály ještě menší, aproximuje se potenciální energie souboru N molekul obvykle vztahem, kterému se říká pravidlo párové aditivity u N = N 1 N i=1 j=i+1 u(r ij ). (7.3) Pravidlo párové aditivity tedy aproximuje potenciální energii soustavy součtem příspěvků všech dvojic molekul. Jen při vysoce přesných výpočtech se uvažují tříčásticové příspěvky. 69
70 7.3 Modelové párové potenciály Párové potenciály molekul nejsou, až na výjimky, známy. Místo nich se užívají různé modely. Níže uvádíme několik nejjednodušších modelů Ideální plyn Z hlediska statistické termodynamiky je ideální plyn soustava molekul, jež se silově neovlivňují. Pro párový potenciál platí u(r)=0, r 0, ). (7.4) Z této rovnice plyne, proč lze plyn za nízkých tlaků aproximovat ideálním. V řídkém plynu jsou molekuly většinou daleko od sebe. Při velkých mezimolekulárních vzdálenostech se párový potenciál blíží k nule Tuhé koule Je to, po ideálním plynu, druhý nejjednodušší model. Molekuly se nahrazují tuhými kuličkami o průměru σ. Při vzdálenostech mezi středy kuliček r > σ se kuličky nedotýkají a silově na sebe nepůsobí. V modelu se kuličky považují za neproniknutelné a neuvažuje se, že by rotovaly. Byla by zapotřebí nekonečná síla, aby vzdálenost jejich středů klesla pod hodnotu σ. Pro párový potenciál platí(viz obrázek 7.6 uprostřed) r < σ u(r)= (7.5) 0 r > σ Tuhé koule popisují podstatný rys chování skutečných molekul silné odpuzování při malých mezimolekulárních vzdálenostech. Přitažlivé mezimolekulární síly nepopisují, viz obrázek 7.6 uprostřed Model pravoúhlé potenciálové jámy(square well) Molekuly se v tomto modelu chovají jako tuhé koule obklopené sférou přitažlivosti. Párový potenciál, viz obrázek 7.6 vpravo, je dán rovnicí r < σ u(r)= ǫ σ < r < λσ 0 r > λσ (7.6) 70
71 3 u(r)/ε 2 1 Lennard- -Jones tuhe koule pravouhla jama r/σ r/σ r/σ Obrázek 7.6: Párové potenciály tří modelů. Tento model popisuje všechny podstatné rysy skutečného mezimolekulového působení: silné odpuzování vystřídané oblastí přitažlivých sil, jež jsou na velkých vzdálenostech nulové. Modelu lze snad vytknout jen hranatost, přehnané tíhnutí ke kubismu. Příroda totiž preferuje oblé tvary Lennard-Jonesův model Je to realistický a patrně nejznámější model. Párový potenciál se řídí vztahem u(r)=4ǫ [ (σ r ) 12 ( σ r ) 6 ]. (7.7) Tvar potenciálu je na obrázku 7.6 vlevo. Parametr ǫ udává hloubku potenciálového minima, parametr σ je zde vzdálenost, při které je potenciál nulový Lineární a obecné molekuly Výše uvedené modely jsou konstruovány pro sféricky symetrické molekuly, kde u je funkcí pouze vzdálenosti r. Obecnější modely jsou přímým rozšířením těchto jednoduchých modelů. Obdobou modelu tuhých koulí jsou modely tuhých nesférických molekul, například tuhé elipsoidy. Jiným populárním modelem jsou tuhé diatomiky, částice tvořené dvěma koulemi, jejichž středy jsou ve vzdálenosti l σ, viz obrázek 7.7. Používají se i modely tuhých triatomiků, ať lineárních, či nelineárních, a modely tvořené seskupením více tuhých koulí. 71
72 Obrázek 7.7: Model tuhých diatomiků. Obdobou Lennard-Jonesova modelu jsou Lennard-Jonesovské diatomiky, dvouatomové molekuly, jejichž atomy interagují s atomy sousedních molekul podle Lennard-Jonesova potenciálu. Také tento model se dále zobecňuje(lennard-jonesovy triatomiky, atd.). Jiným zobecněním Lennard-Jonesova potenciálu je Stockmayerův potenciál, což je Lennard-Jonesův potenciál s přidaným členem, popisujícím interakci dipól dipól Potenciály skutečných molekul Ani nejjednodušší molekuly se neřídí Lennard-Jonesovým potenciálem, natož potenciálem tuhých koulí. Určení přesných párových potenciálů reálných molekul je dosud nesplaceným dluhem kvantové chemie. V současné době jsou známy s dostatečnou přesností jen pro vzácné plyny. V praxi se proto většinou používají modelové potenciály. Jejich parametry(např. ǫ a σ v Lennard-Jonesově potenciálu) se volí tak, aby bylo dosaženo dobré shody s makroskopickými experimentálními daty(např. s hodnotami druhých viriálních koeficientů, viz následující kapitola). 72
73 Kapitola 8 Reálný plyn 8.1 Konfigurační integrál Partiční funkce ideálního plynu se zapisuje ve tvaru, viz vztah(5.12), Q= 1 N! exp( Nβǫ 0)q N vn qn tr, kde β=1/k B Ta q vn = q rot q vib q el jepartičnífunkcevnitřníchpohybůmolekulyaq tr partiční funkce jejího translačního pohybu. Pro translační partiční funkci ideálního plynu byl v odstavci 5.2 odvozen vztah q tr = ( ) 3/2 2πmkB T V. h 2 V reálném plynu nelze ignorovat mezimolekulární síly a příspěvek translačních pohybů se mění. Partiční funkce reálného plynu, a také kapaliny, má tvar Q= 1 N! exp( Nβǫ 0)q N vn ( 2πmkB T h 2 )3 2 N Z. (8.1) Poznámka: O vnitřních pohybech molekul vibracích, rotacích,... se předpokládá, že nejsou významně ovlivněny přítomností sousedních molekul; pokládají se rovny příspěvkům ideálního plynu. Veličina Z se nazývá konfigurační integrál a platí pro ni Z= (V) (V) (V) exp[ βu N ( r 1, r 2,..., r N )]d r 1 d r 2...d r N. (8.2) u N jepotenciálníenergiesouboru Nmolekul,jejichžrozmístěnívobjemu V jedáno polohovýmivektory r i.vrovnicijsmeprointegracipřesobjemsystémupoužilizkrá- 73
74 cený symbolický zápis (V) d r i L L L dx i dy i dz i, (8.3) kde Ljedélkastranykrychleoobjemu V = L 3. Můžemesesnadnopřesvědčit,žepřiabsencimezimolekulárníchsil,tj.pro u N =0, je konfigurační integrál roven objemu umocněnému na počet částic Z = = = (V) (V) (V) (V) exp[ βu N ( r 1, r 2,..., r N )]d r 1 d r 2...d r N (V) e 0 d r 1,d r 2...d r N (8.4) (V) (V) d r 1 d r 2 d r N = V N (V) (V) a vztah(8.1) přejde na vzorec pro partiční funkci ideálního plynu Q= 1 N! exp( Nβǫ 0)q N vn ( 2πmkB T h 2 )3 2 N V N. 8.2 Viriálový rozvoj ve statistické termodynamice Viriálový(též viriální) rozvoj je stavová rovnice, v níž je kompresibilitní faktor z vyjádřen jako řada v mocninách reciprokého objemu z pv Nk B T =1+ B V + C V2+ (8.5) Veličiny B, C,...jsoudruhý,třetí,...viriálovýkoeficientajsoufunkcemiteploty. Viriálový rozvoj je znám ze začátku tohoto století. Pro teplotní závislosti viriálových koeficientů se navrhovaly a navrhují různé empirické vztahy. Statistická termodynamika dokáže odvodit vztah(8.5). Hlavně však nachází přesné vztahy pro závislosti viriálových koeficientů na teplotě(k tomu ovšem potřebuje informace o mezimolekulovém působení), a u směsí také na složení. V následujícím odstavci odvodíme viriálový rozvoj končící členem s druhým viriálovým koeficientem. Odvození celého rozvoje je obtížnější a lze je najít ve specializovaných monografiích. 74
75 8.2.1 Odvození vztahu pro druhý viriálový koeficient Nejprve upravíme integrand ve vztahu(8.2) pro konfigurační integrál. Využijeme přitom pravidlo párové aditivity pro potenciální energii exp( βu N )=exp βu(r ij ) = i,j i,j exp[ βu(r ij )]. (8.6) Zavedeme veličinu f ij = e βu(r ij) 1, (8.7) jež se nazývá Mayerova funkce. Dosadíme ji do(8.6) a součin roznásobíme N 1 N i=1 j=i+1 exp[ βu(r ij )]= N 1 N i=1 j=i+1 +f f 2N + +f N 1N + +f 12 f 13 + f 12 f (f ij +1)=1+f 12 + f f 1N + +f 12 f 13 f (8.8) Než budeme pokračovat v úpravách, všimněme si jedné vlastnosti Mayerovy funkce, totiž skutečnosti, že se s rostoucí mezimolekulovou vzdáleností rychle blíží k nule, viz obrázek 8.1. Je to důsledek krátkého dosahu mezimolekulových sil. Párový potenciál je již ve vzdálenosti několika průměrů molekuly prakticky nulový, tudíž exponenciála exp( βu) je blízká jedné a Mayerova funkce je blízká nule. 1 f(r) r Obrázek 8.1: Závislost Mayerovy funkce na mezimolekulové vzdálenosti. 75
76 Jak bylo řečeno, zabýváme se případem, kdy ve viriálovém rozvoji můžeme zanedbatčlenyřádu1/v 2 avyšší,jinýmislovyřídkýmreálnýmplynem.situace,kdy jepohromadětřiavícemolekul,jsouvřídkémplynuvzácnéanemusímesejimizabývat.jsou-limolekuly1,2,3blízkousebe,jesoučin f 12 f 13 nenulový;je-liaspoň jednaznichvzdálena,blížísesoučinknule(víteproč?).řídkýreálnýplyntedy v řeči matematiky znamená, že ve vztahu(8.8) můžeme zanedbat součiny dvou a více Mayerových funkcí. Vztah se pak zjednoduší na exp( βu N ) = N 1 N i=1 j=i+1 (f ij +1)= = 1+f 12 + f f 1N + f f 2N + +f N 1N = N 1 N = 1+ f ij. (8.9) i=1 j=i+1 Výsledný tvar dosadíme za integrand do vztahu(8.2) pro konfigurační integrál a přehodímepořadísumacíaintegrace.dostaneme[integrálz1je V N,viz(8.4)] Z= V N + N 1 N i=1 j=i+1 (V) (V) (V) f ij d r 1 d r 2...d r N. (8.10) f ij závisíjenna r i, r j.můžemeprotoprointegrovatpřesostatnísouřadnice N 1 Z= V N + V N 2 N i=1 j=i+1 (V) (V) f ij d r i d r j. (8.11) Hodnota integrálu ovšem nezávisí na značení integračních proměnných. Všichni sčítancijsoutedystejníajejichpočetjerovenpočtuvšechdvojic,tj.. Vztah(8.11) ( ) N 2 přejde na ( N Z= V N + )V N 2 f 2 12 d r 1 d r 2. (8.12) (V) (V) Integrál v(8.12) můžeme zjednodušit vhodnou volbou souřadnic. Ponecháme souřadnice x 1, y 1, z 1 atransformujemekartézskésouřadnicedruhéčásticedosférické soustavy souřadnic, viz Dodatek 6, s počátkem ve středu první částice x 2 = x 1 + rsin θcosφ, y 2 = y 1 + rsin θsin φ, z 2 = z 1 + rcosθ. 76
77 rjezdevzdálenostmezistředyčástic1a2.jetojedináintegračníproměnná,nakteré integrand Mayerova funkce závisí. Vztah(8.12) přejde na Z= V N + ( ) N L L L π 2π R V N 2 f(r)r 2 sin θdrdθdφdx 2 1 dy 1 dz 1, (8.13) kdemísto f 12 jsmenapsali f(r) exp[ βu(r)] 1.Hornímezintegrálu R=R(θ, φ) můžemesklidnýmsvědomímnahraditnekonečnem 1 aintegrovatpřes x 1, y 1, z 1 (dostanemeobjem)apřesúhly θaφ(dostaneme4π).vztahsezjednodušína Z= V N + N(N 1) V N 1 4π f(r) r 2 dr, (8.14) 2 0 Protože také počet částic je velký, můžeme bez velkých výčitek svědomí aproximovat N 1. = N.Dostanemetakvýslednývztahprokonfiguračníintegrál ( Z= V N 1+2π N2 V 0 f(r) r 2 dr ). (8.15) Nezapomeňme však, že vztah platí jen při nízkých hustotách, neboť jsme při jeho odvození zanedbali shluky tří a více molekul. Stavovou rovnici dostaneme následovně. Z Gibbsovy rovnice(1.31) plyne, že tlak je záporně vzatá derivace Helmholtzovy energie podle objemu p= ( ) F V T Dosadíme-li za Helmholtzovu energii z rovnice(4.10), dostaneme Zlogaritmujeme rovnici(8.1) p=k B T ( ) ln Q V ln Q=ln 1 N! exp[ Nβǫ 0]qvn N. (8.16) T ( 2πmkB T h 2. (8.17) )3 2 N +ln Z (8.18) a derivujeme ji podle objemu. Dostaneme ( ) ln Q V T = ( ) ln Z V T. (8.19) 1 Rjerovnořádovětřetíodmocniněobjemumakroskopickéhosystému(typickyřádově1dm), kdežto integrand je prakticky nulový již při vzdálenostech jednoho či dvou nanometrů. 77
78 Dále zlogaritmujeme rovnici(8.15) ln Z= NlnV+ln(1+N 2 b/v), (8.20) kde b=2π f(r) r 2 dr. 0 Spojením rovnic(8.17) a(8.19) získáme pro tlak vztah p= Nk BT V N2 k B Tb/V 2 1+N 2 b/v, (8.21) a pro kompresibilitní faktor vztah z=1 b 1+N 2 b/v N V (8.22) Zanedbáme-ličlen N 2 b/v vejmenovateli,dostaneme z=1 Nb V. (8.23) Porovnáním tohoto výsledku s viriálovým rozvojem rezultuje vztah pro druhý viriálový koeficient B= 2πN 0 f(r) r 2 dr= 2πN 0 ( e βu(r) 1 ) r 2 dr. (8.24) Tento vztah je pro molekuly se sféricky symetrickým potenciálem přesný. Poznámka: Přesněji řečeno, ještě se předpokládá tzv. termodynamická limita N. Ta je pro systémy obsahující řádově 1 mol částic prakticky splněna. Určitá nepřesnost bysemohlaprojevitjenvsystémechsdesítkounebostovkoumolekul.takmalé systémy však termodynamika nezkoumá. 8.3 Druhý viriálový koeficient modelových párových potenciálů Pro nejjednodušší z modelů párových potenciálů lze integraci ve vzorci(8.24) provést analyticky. 78
79 Ideální plyn. Párový potenciál ideálního plynu je nulový. Z toho snadno plyne, že B=0provšechnyteploty(dokažte,jetolehké).Nulovéjsoutakévšechny vyšší viriálové koeficienty. Tuhé koule. Integrál rozdělíme na dvě části B= 2πN σ a po integraci dostaneme 0 ( e βu(r) 1 ) r 2 dr 2πN σ ( e βu(r) 1 ) r 2 dr B= 2 3 πnσ3. (8.25) Druhý viriálový koeficient tuhých koulí nezávisí na teplotě, což je ve zjevném rozporu s experimentálními výsledky. Pravoúhlá potenciálová jáma. Integrál rozdělíme na tři části(od nuly do σ, od σ do λσ a od λσ do nekonečna). Výsledkem integrace je(zkuste sami, lehké) B=2πNσ 3 [ λ3 1 3 ( 1 e βǫ )]. (8.26) Tento potenciál již dává teplotní závislost druhého viriálového koeficientu, jež není v příkrém rozporu se skutečností. Jediným kvalitativním nedostatkem je to, žehodnota Blimitujepři T (β 0)kekonstantě,viriálovémukoeficientu tuhých koulí, kdežto viriálové koeficienty reálných látek se blíží s rostoucí teplotou k nule. Poznámka: Druhé viriálové koeficienty v běžné oblasti teplot jsou záporné. Při Boyleově teplotě(je asi třikrát vyšší než kritická) je druhý viriálový koeficient nulový. Maximu odpovídají již velmi vysoké teploty, pro většinu organických látek nedostupné(rozkládají se). Při ještě vyšších teplotách druhý viriálový koeficient klesá a s rostoucí teplotou se blíží nule. Hodnoty za maximem byly však změřeny jenproněkoliklátek(helium,vodík,...). Lennard-Jonesův potenciál. Integrál B= 2πN 0 (e 4ǫβ[(σ/r)12 (σ/r) 6 ] 1 ) r 2 dr (8.27) 79
80 nelze vyjádřit v uzavřeném analytickém tvaru. Závislost na teplotě dostaneme buď rozvojem exponenciály v nekonečnou řadu a integrací člen po členu nebo numerickou integrací pro jednotlivé teploty. Teplotní závislost je pro tento potenciál realistická, viz obrázek B(T) 0-1 T B T Obrázek 8.2: Druhý viriálový koeficient z Lennard-Jonesova potenciálu. Nesféricképotenciály.Propárovépotenciálylineárníchmolekul(N 2,O 2,CO, CO 2,...jedruhýviriálovýkoeficientčtyřnásobnýmintegrálem B= N 4 π π 2π [ e βu(r,θ 1,θ 2,φ) 1 ] r 2 sin θ 1 sin θ 2 drdθ 1 dθ 2 dφ. (8.28) Analytická integrace je možná jen pro tuhá tělesa, kde párový potenciál nabývá hodnoty nula nebo nekonečno(víte proč?). Propárovépotenciálynelineárníchmolekul(např.H 2 Ojedruhýviriálovýkoeficient šestinásobným integrálem(přes co se integruje?). 8.4 Třetí viriálový koeficient. Pro sféricky symetrické potenciály je třetí viriálový koeficient roven C= 8 3 π2 N 2 r r+s 0 0 r s ( e βu(r) 1 ) ( e βu(s) 1 ) ( e βu(t) 1 ) r s tdrdsdt, (8.29) kde rjevzdálenostmezimolekulou1a2, svzdálenostmezi1a3,atvzdálenost mezi molekulami 2 a 3. Integruje se přes všechny polohy molekul. Meze integrace 80
81 jsouvolenytak,abybylasplněnatrojúhelníkovánerovnost r s t r+ s.pro nesférické molekuly je vztah ovšem složitější a neuvádím jej. Rovnice(8.29) platí za předpokladu platnosti pravidla párové aditivity potenciální energie, viz rovnice(7.3). Při přesnějších výpočtech je třeba uvažovat tříčásticové příspěvky k potenciální energii. Třetí viriálový koeficient je pak součtem dvou členů C= C add + C nadd, (8.30) kde C add jeurčenovztahem(8.29)a C nadd = 8 3 π2 N r r+s r s e βu(r) e βu(s) e βu(t) {exp[ β u 3 (r, s, t)] 1} r s tdrdsdt. (8.31) Veličina u 3 (r, s, t)jetříčásticovýpotenciál,vizodstavec Závislost třetího viriálového koeficientu na teplotě je schématicky znázorněna na obrázku C(T) T Obrázek 8.3: Třetí viriálový koeficient jako funkce teploty. 8.5 Vyšší viriálové koeficienty lesk a bída viriálového rozvoje Pro sféricky symetrické potenciály je druhý viriálový koeficient jednonásobným integrálem, třetí trojnásobným. Výpočet vyšších viriálových koeficientů je stále obtížnější. 81
82 Čtvrtý viriálový koeficient je součtem tří integrálů, čtyř, pěti a šestinásobného. Pátý je součtem 10 členů, nejsložitější z nich má násobnost 9. Statistická termodynamika zná přesné vztahy pro všechny viriálové koeficienty. To lze považovat za triumf této vědní disciplíny. Praktickému použití však brání(kromě neznalosti přesných potenciálů) dvě skutečnosti: 1) pro vysoké hustoty(kapalina, pevná látka) viriálový rozvoj diverguje; 2) pro střední hustoty je konvergence rozvoje velmi pomalá, přičemž vyčíslení vysokých viriálových koeficientů je i při použití nejmodernější výpočetní techniky nezvládnutelné. Poznámka: Pro tuhé koule, po ideálním plynu nejjednodušším modelu, jsou známy druhý až desátý viriálový koeficient; pro Lennard-Jonesův potenciál jen druhý až pátý. 82
83 Kapitola 9 Struktura tekutiny Vhodným výchozím bodem pro studium řídkého plynu je model ideálního plynu, pro studium reálného krystalu model ideálního krystalu. Neexistuje žádný jednoduchý a adekvátní molekulární model pro tekutinu a plyn za vysoké hustoty. Proto je studium kapaliny a hustého plynu obtížnější než studium krystalu a řídkého plynu. Poznámka: V hydrodynamice se zavádí termín ideální kapalina pro nestlačitelnou kapalinu bez vnitřního tření. Toto je však model makroskopický(kapalina se chápe jako kontinuum) a s našimi úvahami nesouvisí. 9.1 Pojem vnitřní struktury tekutiny Skutečnost, že molekulární modely kapalin jsou z principiálních důvodů složitější, lze navodit ještě jinak. V systému o pevném objemu, teplotě a počtu částic(kanonický soubor) je stav termodynamické rovnováhy spojen s minimem Helmholtzovy energie (viz odstavec 1.4.7) df=0, [N, V, T]. (9.1) Mluvíme-li o minimu funkce, stojí za to si položit otázku, jaké jsou proměnné, vůči nimž má funkce minimum. Nemohou to být proměnné termodynamické, neboť N, V a Tjsoukonstantní.(Pročtonemůžebýttlaknebovnitřníenergie?)Jsoutopolohy molekul v systému, jejich průměrné vzájemné rozmístění, nebo, jinými slovy, vnitřní, tj. molekulární struktura systému. 83
84 Helmholtzova energie je definována jako rozdíl dvou členů F= U TS. (9.2) Při nízkých teplotách je druhý člen v rovnici nevýznamný. Nejen teplota, ale i entropie jemalá(lim T 0 S=0).Molekulysesnažívdostupnémobjemurozmístittak,aby byla minimální vnitřní energie. Ze zkušenosti víme, že přirozeným skupenským stavem při nízkých teplotách je krystal. Krystal je soustava částic, jež jsou v energeticky nejvýhodnějších polohách. Při vysokých teplotách druhý člen v rovnici(9.2) naopak dominuje. Systém se proto snaží rozmístit molekuly tak, aby byla maximální entropie. Maximální entropie znamená absenci jakékoliv struktury. Tomu odpovídající stav systému je ideální plyn. V kapalině nepřevládá ani energetický ani entropický člen. Je v ní velká míra neuspořádanosti, ne však tak veliká jako v ideálním plynu. Kapalina má určitou vnitřní strukturu, ne však tak pevnou jako krystal. Tato vnitřní struktura je projevem kolektivní hry odpudivých a přitažlivých mezimolekulárních sil. 9.2 Párová distribuční funkce Mluvíme-li o vnitřní struktuře tekutiny, je žádoucí tento pojem nějak kvantifikovat. Za vhodnou veličinu popisující vnitřní strukturu se považuje párová distribuční funkce g, jež je definována takto g(r)= ρ(r) ρ. (9.3) Zde ρ je(střední) hustota systému, ρ(r) lokální hustota v okolí molekuly, ve vzdálenosti r od jejího středu. Párovádistribučnífunkcetekutinymácharakteristickou vlnivou závislostna vzdálenosti r od molekuly znázorněnou na obrázku 9.1. Při malých vzdálenostech od středu molekuly převládají silné odpudivé síly. Molekula se snaží vypudit okolní molekuly ze své těsné blízkosti. Lokální hustota je zde proto skoro nulová. Na obrázku jetooblast,kde g(r)jepraktickyrovnanule. Vypuzené molekuly mají tendenci se shromažďovat na okraji této oblasti, kde již 84
85 4 3 g LJ (r) r Obrázek 9.1: Závislost párové distribuční funkce na vzdálenosti. odpuzování mizí. Sem rovněž, vlivem přitažlivých sil, směřují molekuly z větších vzdáleností. Vytváří se vrstva nejbližších sousedů molekuly. Na obrázku vidíme výrazné maximum. Nejbližší sousedé mají své zóny repulse. Proto následuje minimum párové distribuční funkce. Pak následuje další maximum(sousedé sousedů), ovšem mělčí, lokálnístrukturasezačíná rozmývat. Při velkých vzdálenostech již molekula přestává ovlivňovat strukturu svého okolí. Lokální hustota se blíží průměrné a párová distribuční funkce jedničce. Lze konstatovat, že v blízkém sousedství molekuly v kapalině převládá pravidelná struktura(téměř jako v krystalu), při velkých vzdálenostech od molekuly převládá chaos(téměř jako v ideálním plynu). 9.3 Párová distribuční funkce a potenciální energie systému Definice párové distribuční funkce vztahem(9.3) je sice názorná, není však příliš užitečná, neboť z ní není vidět vztah mezi strukturou a mezimolekulárními silami, tj. vztah mezi párovou distribuční funkcí a párovým potenciálem. Budeme hledat tento vztah. Vyjdeme z ekvivalentní definice g(r)= P(r) P id, (9.4) 85
86 kde P(r) je pravděpodobnost, že se ve vzdálenosti r od středu dané molekuly vyskytuje nějakádalšímolekulaap id jestejnápravděpodobnostproideálníplynzadanéhustoty ateploty. Pravděpodobnost, že současně je molekula 1 umístěna v prostorovém elementu r 1, r 1 + d r 1,molekula2velementu r 2, r 2 + d r 2,...,molekula N velementu r N, r N + d r N jerovna kde Z je konfigurační integrál. P( r 1, r 2,..., r N )= e βu N( r 1, r 2,..., r N ), (9.5) Z Poznámka: Tento vztah je obdobou vztahu pro kvantověmechanickou pravděpodobnost systému kanonického souboru v i-tém kvantovém stavu, viz rovnice(3.17). Pravděpodobnost, že současně je molekula 1 umístěna v prostorovém elementu r 1, r 1 +d r 1 amolekula2velementu r 2, r 2 +d r 2 přilibovolnýchpoloháchostatních molekulzískámeintegracírovnice(9.5)přesvšechnypolohyčástic3,4,..., N P( r 1, r 2 )= (V) (V) e βu N( r 1, r 2,..., r N ) d r 3...d r N Z. (9.6) Pro molekuly se sféricky symetrickými párovými potenciály závisí v tekutině tato pravděpodobnost jen na vzdálenosti středů molekul a platí P( r 1, r 2 )=P(r). Promolekulyideálníhoplynu,kde u N =0,dostávámezrovnice(9.6),dokažete, P id = V N 2 V N = V 2. Po dosazení těchto výsledků do rovnice(9.4) dostaneme vztah mezi párovou distribuční funkcí a potenciální energií g(r) = V2 (V) (V) e βu N( r 1, r 2,..., r N ) d r 3...d r N Z = V 2 (V) (V) e βu N( r 1, r 2,..., r N ) d r 3...d r N (V) (V) e βu N( r 1, r 2,..., r N) d r 1...d r N. (9.7) = Tento vztah hraje základní roli ve většině teorií tekutin. 86
87 9.4 Párová distribuční funkce a termodynamické veličiny Známe-li párovou distribuční funkci, můžeme určit termodynamické veličiny systému. Lze tak učinit dokonce trojím způsobem, pomocí tlakové rovnice, rovnice energie a rovnice stlačitelnosti. Tyto rovnice se dají odvodit; nebudu vás tím zde trápit, jen je uvedu. Tlaková rovnice je vztah z=1 2 3 πρβ 0 du(r) g(r)r 3 dr, (9.8) dr kde z je kompresibilitní faktor. Je to vlastně méně obvykle zapsaná stavová rovnice. Z ní jdou určit ostatní termodynamické veličiny. Rovnice energie je U Nk B T = U0 Nk B T +2πρβ u(r)g(r)r 2 dr, (9.9) 0 kde U 0 jevnitřníenergieideálníhoplynu.takéztétorovnicesedajíurčitostatní termodynamické veličiny. Nakonec třetí cestou k termodynamickým veličinám je rovnice stlačitelnosti β ( ) { p 1 = 1+4πρ [g(r) 1] rdr} 2. (9.10) ρ β 0 Tyto tři rovnice jsou zde zapsány pro systémy se sféricky symetrickými potenciály. Zobecněné rovnice pro lineární a obecné potenciály jsou také známy. Rovnice(9.8) a (9.9) platí za předpokladu pravidla párové aditivity, viz vztah(7.3). Rovnice(9.10) párovou aditivitu nevyžaduje. 87
88 88
89 Kapitola 10 Počítačové experimenty Statistická termodynamika naráží při výpočtech termodynamických veličin na dvě základní potíže. O první již byla řeč: pro převládající většinu látek neznáme přesné párové mezimolekulární potenciály(viz 7.3.6). Druhou potíží je, že vztah pro konfigurační integrál nebo vztah pro párovou distribuční funkci, jsou sice přesné, ale pro svou složitost prakticky nepoužitelné. Tyto přesné vztahy je proto nutno nahradit vztahy přibližnými; budeme o nich mluvit v kapitole 11. Představme si, že se budeme snažit vypočítat prostředky statistické termodynamiky termodynamické vlastnosti nějaké tekutiny, například metanu. Pro metan není pravý párovýpotenciálznám,zvolímetedypotenciálmodelový,napříkladlennard-jonesův. K výpočtu použijeme některou z teorií tekutin(viz kapitola 11), jež je zatížena jistou, nám neznámou chybou. Vypočtené výsledky lze srovnat s experimentálnímidatyprometan.výsledkysenebudoushodovat 1.Jsouvšakodchylky od naměřených hodnot způsobeny hlavně nepřesným párovým potenciálem nebo nepřesnouteorií?odpověďnatutootázkudávajípočítačovéexperimenty 2,ježdovolují uvedené zdroje chyb separovat. Počítačové experimenty totiž poskytují experimentálnídata prolátkyvpříroděneexistující,napříkladlennard-jonesium,tekutinu,jejíž molekuly se řídí Lennard-Jonesovým potenciálem. Existují dvě základní skupiny počítačových experimentů: metody Monte Carlo 1 Kdybyseshodovaly,mělibychomvyhráno.Nemuselibychomhledatlepšípotenciálanipřesnější teorii. Hlavně však, nemuseli bychom měřit! 2 Jakosynonymapropočítačovýexperimentsepoužívajítermíny(počítačová)simulacenebo pseudoexperiment. 89
90 a metody molekulové dynamiky. Při experimentech Monte Carlo se simulují souborové průměry veličin, v molekulové dynamice průměry časové. Níže bude podrobněji popsán princip metody Monte Carlo. O molekulové dynamice zde bude jen krátká zmínka; detailní popis najdete ve skriptech doc. Kolafy[10]. Nejdříve si však něco povíme o integraci Monte Carlo Integrace Monte Carlo U mnoha určitých integrálů b a f(x)dxneznámeprimitivnífunkci(tj.neumímejivyjádřit v analytickém tvaru). V takových případech se uchylujeme k numerické kvadratuře a používáme lichoběžníkové pravidlo, Simpsonovo pravidlo apod. Dělíme interval a, b na n, nejčastěji ekvidistantních, dílů a počítáme hodnoty integrandu v daných bodech. Podobně můžeme postupovat u vícenásobných integrálů. Například u integrálu b d a c f(x, y)dxdymůžemerozdělitkaždýzintervalů a, b, c, d na,řekněme, stodílůapočítathodnotyintegranduve =10000bodech.Utrojného integrálu by to už bylo milión hodnot, u pětinásobného deset miliard. Z tohoto důvodu nejsou běžné metody kvadratury jednoduchých integrálů praktické při výpočtu integrálů s vyšší násobností. Místo nich se často používá jiná metoda, zvaná integrace Monte Carlo. b y neuspesny pokus uspesny pokus 0 0 a x Obrázek 10.1: Schéma integrace Monte Carlo. Princip integrace Monte Carlo ukážeme pro jednoduchost na příkladu výpočtu 90
91 jednoduchého integrálu a 0 f(x)dx,kde0 f(x) b,vizobrázek10.1.hodnota integrálujerovnaplošepodkřivkouajenaobrázkuvyšrafována.vmetoděsevolí náhodně 3 xzintervalu 0, a anáhodně yzintervalu 0, b.jestližebude y f(x), tj. jestliže bod[x, y] padne do šrafované oblasti, nazveme náhodnou dvojici [x, y] úspěšným pokusem. Provedeme více takových pokusů. Je zřejmé, že poměr počtu úspěšnýchpokusů, n u,kucelkovémupočtupokusů, n c,budepřibližněrovenpodílu šrafované plochy a celkové plochy. Tedy n a u. = 0 f(x)dx = n c a b a 0 f(x)dx. = a b n u n c. (10.1) Je rovněž zřejmé, že s rostoucím počtem pokusů bude růst přesnost výpočtu integrálu. Jednoduchý integrál jsme zvolili kvůli názornosti. Zobecnění postupu pro vícenásobné integrály je bezprostřední. Lze zhruba říci, že pro jedno- až trojnásobné integrály jsou výhodnější běžná kvadraturní pravidla, pro čtyř- a vícenásobné integrály je účinnější integrace Monte Carlo. Ve statistické termodynamice máme co činit s integrály obrovských dimenzí. Například konfigurační integrál, viz vztah(8.2), Z= (V) e βu N d r 1 r N (V) jeuběžnýchsystémů násobný!natakovétodimenzenestačíaniintegracemonte Carlo. Kdyby vyvolání generátoru náhodných čísel trvalo jen 1 mikrosekundu(obvykle jespotřebačasuvyšší),trvalbyjedenpokusasi30miliardlet(věkvesmíruodvelkého třesku je zhruba poloviční). A k výpočtu integrálu je třeba mnoha pokusů, mnoha věkůvesmíru. Druhou, skrytou, ale neméně závažnou zábranou přímého použití integrace Monte Carlo je chování integrandu, schématicky znázorněné na obrázku 10.2(šrafovaná oblast je hodnota integrálu). Integrovaná funkce nabývá velkých hodnot jen v úzké oblasti. Ve zbývající oblasti je malá, není však zanedbatelná. Strefit se náhodně do vyšrafované oblasti je již u integrálu s dimenzí 100 méně pravděpodobné než stokrát za sebou vyhrát první cenu ve Sportce. 3 Přirealizacinapočítačisepoužívajítzv.generátorypseudonáhodnýchčísel,proceduryprodukující sekvence čísel, které mají podobné vlastnosti jako skutečně náhodná čísla. 91
92 f(x) Obrázek 10.2: Typický průběh integrované funkce. x 10.2 Experiment Monte Carlo Metropolisův algoritmus Experiment Monte Carlo není totéž, co numerická integrace stejného jména, byť mají obě metody některé společné rysy. Postup předvedeme na jednoduchém modelu tuhýchkoulíoprůměru σ,vizoddíl Nejprveseomezípočetmolekul Nz10 24 obvyklena100až1000.zvolísepočáteční polohy koulí. Jejich počáteční rozložení je v zásadě libovolné, požaduje se pouze, aby se navzájem nepronikaly. Náhodně se vybere některá koule a náhodně se změní její polohazbodu x i, y i, z i do x i, y i, z i x i = x i+ p x, y i = y i+ p y, z i = z i+ p z. (10.2) p x, p y, p z jsounáhodnáčíslavintervalu 0,1, jezvolenámaximálnívelikostposunu.nynísetestuje,zdasekoulevnovépolozepřekrývásněkterousousední 4.Nová poloha koule se přijme, nedošlo-li k překryvu. Došlo-li k němu, volíme novou polohu identickousestarou.celýpostupsemnohokrát(řádově10 6 avíce)opakuje.jednotlivým konfiguracím(vzájemným rozmístěním koulí) odpovídají náhodné hodnoty sledovaných veličin, například tlaku, vnitřní energie nebo párové distribuční funkce. Výsledná hodnota sledované veličiny X je souborovým průměrem, tj. průměrem přes generované konfigurace X= nc j=1 X j n c, (10.3) 4 Počítajísevzdálenostimezistředykoulí;je-liněkterávzdálenostmenšínež σ,koulesepřekrývají. 92
93 kde n c jepočetkonfigurací. Není-li modelem tuhá koule nebo jiné tuhé těleso, rozhoduje se o přijetí nové konfiguracejinak.počításepotenciálníenergiemolekulvestarékonfiguraci, u N,s,a vkonfiguracipoposunumolekuly, u N,n.Jestližedošlopřiposunumolekulykpoklesu energie, tj. jestliže je e β(u N,n u N,s ) 1, nová konfigurace se přijme. Jestliže nedošlo k poklesu energie, generuje se náhodné číslo p z intervalu 0, 1. Potom, když exp[ β(u N,n u N,s )] p nová konfigurace se přijímá < p nová konfigurace se ztotožní se starou (10.4) Přesvědčte se, že postup při přijímání nové konfigurace tuhých koulí je speciálním případem vztahu(10.4). Návod:Vezmětevúvahu,žepřipřekryvukoulíje u N =.Nedojde-likpřekryvu,je u N =0. Tím všechny starosti nekončí. Neexistuje žádné oprávnění pro ztotožnění chování systémuostuažtisícimolekuláchschovánímmakroskopickéhosystémuo10 24 částicích.zfyzikálníhonáhledujeoprávněnépodezření 5,žemalýsystémsebudechovat dosti odlišně od velkého vlivem povrchových efektů, u makrosystémů zpravidla zanedbatelných. Studujeme-li tisíc molekul uzavřených v krychlové nádobě, je v přímém kontaktu se stěnami krychle asi polovina částic, u sta částic jich bude poblíž povrchu již80% 6. Trik, kterým se podařilo potlačit vliv malého počtu částic, se nazývá periodické okrajové podmínky. Zkoumaný malý systém, základní buňka, je ze všech stran obklopen svými kopiemi, viz obrázek Pohneme-li molekulou v základní buňce, pohnou se stejně i všechny její kopie. Stěny základní buňky jsou volně prostupné. Tím se zabrání nežádoucí interakci molekula stěna. Molekula může kdykoli opustit některou stěnou základní buňku. Zároveň však vstoupí do základní buňky protější stěnou jedna z jejích kopií. To zajišťuje konstantní počet molekul v buňce po celou dobu trvání experimentu. 5 Zmatematickéhohlediskajdeoaproximacimnohorozměrnéhointegrálusoučinemintegrálůnižší dimenze; o chybě tím způsobené nelze předem nic říci. 6 Nepomůže,kdyžzamezímeinterakcímčástice stěna,tj.nechámestěnykrychlevolněprostupné. Částice se nám rychle rozutečou. 93
94 B D A E C Obrázek 10.3: Periodické okrajové podmínky. Experimenty Monte Carlo jsou nemyslitelné bez počítačů. Nic nemluví o jejich významu a o významu statistické termodynamiky jasněji než skutečnost, že byly provedeny při první možné příležitosti. Ta nastala na začátku padesátých let minulého stoletívlaboratoříchvlosalamosvestátěnovémexiko,kdesedostaldorukou vědců počítač maniac, sloužící předtím výhradně potřebám vojenského atomového výzkumu.jižvroce1953vycházípionýrskýčlánekmetropoliseaspolupracovníků 7 snázvem EquationofStatebyFastComputingMachines.Vtomtoprvnímčlánku bylo vše podstatné generování řetězce konfigurací a periodické okrajové podmínky postup, který nyní nazýváme Metropolisův algoritmus Molekulová dynamika Tato metoda se liší od předchozí tím, že se počítají časové průměry veličin. Stejně jakoumetodymontecarlosezvolípočetčásticvzákladníbuňceajejichpočáteční polohy. Navíc se volí počáteční rychlosti částic. Pak se řeší pohybové rovnice(1.56), čímž se získávají trajektorie částic. K potlačení vlivu malého počtu částic se zde rovněž používají periodické okrajové podmínky. Molekulová dynamika umožňuje simulaci i nerovnovážných veličin, například viskozity. 7 JednímzautorůjeE.Teller,americkývědecmaďarskéhopůvodu,známýširšíveřejnostispíše jako autor vodíkové pumy. 94
95 10.4 Počítačové experimenty a reálné experimenty V předcházejících odstavcích věnovaných metodám Monte Carlo a molekulová dynamika, jsem dával přednost výrazu počítačový experiment před méně expresivním výrazem simulace. Co však má simulace společného s experimentem, vždyť jde o výpočet? Experimentem, ve smyslu měření, nazýváme proces, kdy je v přístroji určována vlastnost nějaké látky. Přístroj je opatřen čidly sloužícími k řízení podmínek experimentu a k odečítání hodnot sledované veličiny. Změřená hodnota veličiny je zatížena jednak neovlivnitelnými náhodnými chybami, jednak systematickými chybami, způsobenými například nečistotami v měřené látce nebo konstrukčními nedostatky přístroje. Při počítačovém experimentu je látka definována modelem mezimolekulového působení, například Lennard-Jonesovým párovým potenciálem a pravidlem párové aditivity. Látka, lennard-jonesium, je tedy absolutně čistá. Podmínky experimentu, teplota, složení a hustota(počet částic v základní buňce dělený jejím objemem), jsou pevné. Přístrojem je sestavený program spolu s počítačem, na kterém provozujeme. Při počítačových experimentech se dají určovat i veličiny reálnému experimentu nedostupné, například některé funkce popisující vnitřní strukturu. Je také možné zkoumat systémy v prostorech o libovolně zvoleném počtu dimenzí(tuhé koule ve čtyřrozměrném prostoru apod.). Při počítačových experimentech se rovněž vyskytují náhodné a systematické chyby. Náhodné chyby jsou dány stochastickým charakterem tvoření konfigurací. Jejich vliv lze potlačit zvyšováním počtu konfigurací. Jediným zdrojem systematických chyb, pomineme-li chyby programátorské, je omezený počet částic v základní buňce. Velikost této chyby můžeme odhadnout tak, že provedeme dva stejné experimenty s různým počtem molekul. Ukazuje se, že chyba je neveliká, u tisíce částic v základní buňce zhruba 0,1%. Podobnost počítačových a reálných experimentů je ještě hlubší. Při experimentu zjistíme,žetaatalátkazatěchatěchpodmínekmátuatuhodnotusledované 95
96 veličiny. Nezjistíme proč. Když budeme chtít změnit veličinu nebo látku nebo podmínky, budeme muset provést nový experiment. To je časově náročné a neekonomické. Proto nejsou počítačové experimenty cílem statistické termodynamiky, ale prostředkem. Prostředkem, umožňujícím navrhovat i zavrhovat teorie tekutin. O těch si krátce povíme v následující kapitole. 96
97 Kapitola 11 Teorie tekutin Teorie tekutin se dělí na dvě velké skupiny, na poruchové teorie a na teorie integrálních rovnic. Oběma skupinám teorií je věnována rozsáhlá literatura. Níže uvedeme jen jejich základní principy Poruchové teorie Základem poruchových teorií je rozdělení párového potenciálu na referenční potenciál u 0 aporuchovýpotenciál u p u(r)=u 0 (r)+u p (r). (11.1) Konfigurační integrál, viz rovnice(8.2), pak můžeme psát v tvaru Z= (V) exp [ β ( u 0 N + N)] up d r1 d r N, (11.2) (V) kde u 0 Na u p Njsoureferenčníaporuchovápotenciálníenergiesystému.Zapředpokladu, že poruchový potenciál je malý, můžeme exponenciálu z poruchové potenciální energie nahradit Taylorovým rozvojem do prvního řádu a rovnici(11.2) aproximovat vztahem Z = (V) = Z 0 (1 β (V) e βu0 N (1 βu p N)d r 1 d r N = Z 0 β ) 1 Nu p (V) (V) Z Nd r 1 d r N 0e βu0 (V) e βu0 N u p Nd r 1 d r N (V), (11.3) kde Z 0 jereferenčníkonfiguračníintegrál.zapředpokladuplatnostipravidlapárové aditivity potenciální energie, viz rovnice(7.3), dostaneme(proveďte) ( N2 ) ] Z= Z [1 0 1 β Nu p (r 12 )d r 1 d r N (V) (V) Z 0e βu0 97. (11.4)
98 S použitím definice párové distribuční funkce, viz rovnice(9.7), můžeme vztah upravit na(pokuste se sami) Z= Z 0 [1 ( N2 ) β 1 ] u p (r V 2 12 )g 0 (r 12 )d r 1 d r 2, (11.5) (V) (V) kde g 0 jepárovádistribučnífunkcereferenčníhosystému.provedemetransformaci z kartézských do sférických souřadnic(dodatek 6), v zásadě jde o stejný postup jako v odstavci 8.2.1, a dostaneme Z= Z 0 [1 2πρβN 0 ] u p (r 12 )g 0 (r 12 )r12dr 2 12, (11.6) kde ρ= N V.(Test:Jakéaproximacejsmepoužiliaproč???Víte-lito,jsteskvělí!) Logaritmujeme tento vztah. Za předpokladu, že integrál obsahující poruchový potenciál je malý, rozvedeme logaritmus v Taylorovu řadu do prvního řádu.(pro malá xjeln(1 x). = x,dokažteto.)spojenímvztahů(4.10)a(8.1)dostaneme F= k B Tln Q=F id ktln Z, kde F id jehelmholtzovaenergieideálníhoplynuzateploty Taajednotkovéhoobjemu. Po dosazení za Z z rovnice(11.6) získáme finální výsledek pro Helmholtzovu energii F Nk B T = F0 Nk B T +2πρβ u p (r)g 0 (r)r 2 dr, (11.7) 0 kde F 0 jekonfiguračníhelmholtzovaenergiereferenčníhosystému. Známe-li Helmholtzovu energii systému, můžeme snadno(termodynamickou cestou) určit ostatní termodynamické veličiny. Například pro kompresibilitní faktor dostaneme z= z 0 2πρβ 0 u p (r)g 0 (r)r 2 dr. (11.8) Z tohoto vztahu lze odvodit van der Waalsovu stavovou rovnici. Budeme předpokládat, že referenčním potenciálem je potenciál tuhých koulí. Nejjednodušší aproximací kompresibilitníhofaktorutuhýchkoulíje 1 z 0 = V V b = 1 1 ρb, kde b= 2π 3 Nσ3 jetzv.vyloučenýobjemkoulí(vyloučenýobjemječástcelkovéhoobjemu nedostupná pro střed žádné koule), což je při nízkých hustotách čtyřnásobek jejich objemu. 1 Tentovztahplatípřesněpřinízkýchhustotách. 98
99 Dále budeme předpokládat, že integrál ve druhém členu rovnice(11.8) je konstantní, tj. nezávislý na teplotě a hustotě systému. Dostaneme kde a=2π 0 z= 1 1 ρb a RT ρ, u p (r)g 0 (r)r 2 dr.přesvědčtesesami,žetentovztahjetotožnýsvander Waalsovou rovnicí, obvykle zapisovanou ve tvaru ( p+ a ) Vm 2 (V m b)=rt, kde pjetlakav m molárníobjem. Vztah(11.7) je nejjednodušším příkladem poruchového rozvoje. V poruchových teoriích se obecně předpokládá, že vlastnosti referenčního systému, jeho termodynamické veličiny a párová distribuční funkce, jsou známy, a že vlastnosti zkoumaného systému jsou blízké vlastnostem systému referenčního Teorie integrálních rovnic Integrální rovnice jsou takové rovnice, ve kterých je neznámá funkce v integrandu. Dělí se na integrální rovnice I. druhu a integrální rovnice II. druhu b a f(x) K(x, s)f(s)ds=φ(x) b a K(x, s)f(s)ds=φ(x). fjehledanáfunkce, Ka φjsouznáméfunkce; K(x, s)senazývájádremintegrální rovnice. Ve fyzikálních aplikacích se častěji setkáváme s rovnicemi II. druhu. Ve statistické termodynamice se formulují integrální rovnice, v nichž je hledanou funkcí párová distribuční funkce. Teorie integrálních rovnic se dělí do dvou tříd: a) teorie založené na Bornově-Greenově-Yvonově hierarchii integrálních rovnic, b) teorie založené na Ornsteinově-Zernikeho integrální rovnici. V této kapitole se budeme stručně zabývat jen druhou skupinou teorií, jež je v moderní statistické termodynamice velmi populární. 99
100 1 3 r 13 r 32 úplnývliv1na3 přímývliv3na2 r 12 přímývliv1na2 2 Obrázek11.1:Přímýanepřímývlivčástice1nahustotuvbodě2. Každá molekula ovlivňuje ve svém okolí hustotu částic, respektive pravděpodobnost jejich výskytu. Odchylka od střední(tj. makroskopické) hustoty ρ v bodě 2 ve vzdálenosti r 12 odmolekuly1je ρ(r 12 ) ρ=ρg(r 12 ) ρ=ρ[g(r 12 ) 1]=ρh(r 12 ), (11.9) kde g(r) je párová distribuční funkce. V rovnici je zavedená nová veličina, úplná korelačnífunkce h(r) g(r) 1,popisujícívlivčástice1nahustotuvbodě2.Tento vliv lze rozdělit na vliv přímý a na vliv nepřímý. Odchylku od střední hustoty způsobenou přímým vlivem označíme ρc(r), kde c(r) je přímá korelační funkce. Nepřímý vliv vzniká tak, že molekula 1 ovlivňuje svojí existencí změnu hustoty v bodě 3. Změna hustotyvbodě3ovlivňujepřímohustotuvbodě2.potomplatí(vizobrázek11.1) úplnázměnahustotyvbodě2=přímázměnav2 + nepřímázměnav2= =přímázměnav2 + úplnázměnav3 přímázměnav2způsobená3. Pomocí úplné a přímé korelační funkce lze tento vztah psát ρh(r 12 )=ρc(r 12 )+ (V) ρh(r 13 )ρc(r 32 )d r 3. (11.10) Vrovniciseintegrujepřesvšechnypolohybodu3vobjemusystému V.Dělíme-li rovnici hustotou, dostaneme výslednou Ornsteinovu-Zernikeho rovnici h(r 12 )=c(r 12 )+ρ h(r 13 )c(r 32 )d r 3. (11.11) (V) Mámetedyjednurovniciprodvěneznáméfunkce h(r)ac(r).ktomu,abyúloha byla řešitelná, potřebujeme ještě jednu rovnici mezi neznámými funkcemi, jež se nazývá uzávěr Ornsteinovy-Zernikeho rovnice. 100
101 Je známa řada uzávěrů. Všechny jsou přibližné. Nejjednodušší je uzávěr navržený PercusemaYevickem,kterýseprotuhékouledápsátvetvaru h(r)= 1 pro r < σ, c(r)=0 pro r > σ. (11.12) Řešením Ornsteinovy-Zernikeho integrální rovnice s uzávěrem je úplná korelační funkce h(r).znídostanemepárovoudistribučnífunkci g(r)=h(r)+1,aztéto funkce termodynamické veličiny pomocí tlakové rovnice, rovnice energie nebo rovnice stlačitelnosti. Příklad: Dokažte, že pro tuhé koule platí, viz první z rovnic(11.12), h(r)= 1 pro r < σ. Návod: Zjistěte, jaká je lokální hustota ρ(r) ve vzdálenostech r < σ a jakých hodnot nabývá při těchto vzdálenostech párová distribuční funkce. 101
102 102
103 Kapitola 12 Klasická termodynamika očima termodynamiky statistické Žijeme-li uvnitř zámku a nikdy jej neopouštíme, můžeme podrobně prohlížet zařízení komnat, neuvidíme však nikdy zámek jako celek, jeho architekturu a umístění v okolní přírodě. Ve vědě pak žádný axiomatický systém není schopen vypovídat nic o povaze svých axiomů. Klasická(fenomenologická) termodynamika je založena na několika axiomech, viz podkapitola1.1. Není schopna nic říci o tom, proč termodynamické systémy mají nutkání spět z nerovnovážných stavů do rovnováhy nebo proč neexistuje perpetuum mobiledruhéhodruhu.zezkušenostíjenví,žetomutakje,azkvádrůtétozobecněné zkušenosti, zděných aparátem matematiky, staví svůj chrám. Takéstatistickátermodynamikamásvéaxiomy 1.Jejípojetíjevšakvelmiodlišné od pojetí klasické termodynamiky pohlížející na termodynamický systém, společný předmět studia, jako na černou skříňku. Chrám statistické termodynamiky stojí na pevných základech mechaniky(klasické nebo kvantové) na pohybových rovnicích částic tvořících systém. Proto může statistická termodynamika interpretovat některé základní zákony termodynamiky fenomenologické. V této závěrečné kapitole se pokusíme o interpretaci jejich termodynamických zákonů. 1 Axiomorovnostičasovéhoasouborovéhoprůměruaaxiomopravděpodobnostijakofunkci energie, viz kapitola
104 12.1 Axiom aditivity Jestliže myšlenkově rozdělíme termodynamický systém na dvě části, pak podle tohoto axiomu platí pro vnitřní energii U= U 1 + U 2, (12.1) kde U 1 a U 2 jsouenergiepodsystému1a2,vizobrázek12.1.veskutečnostimolekuly podsystému 1 silově ovlivňují podsystém 2 a naopak. Mělo by tedy platit U= U 1 + U 2 + U 12, (12.2) kde U 12 jepříspěvekkvnitřníenergiizpůsobenývzájemnouinterakcípodsystémů. Víme však, že mezimolekulární působení má v porovnání s rozměry makroskopických soustav velmi krátký dosah(viz kapitola 7) a na sousední podsystém působí jen molekuly z úzké oblasti podél rozhraní podsystémů. Těch je v porovnání s celkovým počtem zanedbatelně málo a proto můžeme u běžných makroskopických systémů položit U 12 =0. U 12 =0 U 1 U 2 Obrázek 12.1: Vnitřní energie systému a podsystémů. Příklad:Vkrychlioobjemu1dm 3 senachází Nmolekul.Rozdělmekrychlinadvě stejnéčástitak,abyplochařezubyla1dm 2.Spočtěte,jakáčástzcelkovéhopočtu molekulsenacházívevrstvičcetloušťky1å(1å=10 10 m)podélřezu. 104
105 Řešení:Objemvrstvičkyje V =10 9 dm 1dm 2 =10 9 dm 3.Přirovnoměrném rozmístění molekul v objemu nádoby je N N = V V =10 9. V okolí rozhraní je jen jedna miliardtina celkového počtu molekul. Poznámka: Axiom o aditivitě vnitřní energie může být měřitelně narušen jen v exotických případech, například u systému hroutícího se v černou díru, kde interakci mezi podsystémyjižnelzezanedbat 2.Vtěchtopřípadechjsoupaknarušenysamyzáklady fenomenologické termodynamiky Axiom o existenci termodynamické rovnováhy Podle postulátu o rovnosti časového a souborového průměru(viz kapitola 2) procházísystémvšemibodyfázovéhoprostoru 3.Některýmbodůmfázovéhoprostoru odpovídají rovnovážné stavy systému, jiným nerovnovážné. Rovnovážná oblast fázového prostoru je zřejmě mnohem větší než oblast nerovnovážná. Proto je přechod systému z nerovnovážného stavu do rovnovážného mnohem pravděpodobnější než přechod opačný. Z výše uvedeného plyne, že statistická termodynamika, narozdíl od fenomenologické, nezakazuje spontánní přechod systému ze stavu termodynamické rovnováhy do nerovnovážného stavu. U běžných makroskopických systémů je však pravděpodobnost takového děje velmi, velmi malá. Poznámka:Představmesikádinkusvodouteplou20 0 Cvestavutermodynamické rovnováhy. Z hlediska statistické termodynamiky je možný děj, při kterém část vody zmrznenaledoteplotě0 0 Caostatnívodaseohřejena100 0 Cazačnevřít.Pravděpodobnost této události je však mizivě malá. Museli bychom pozorovat kádinku mnoho miliard let, než bychom se takového překvapení dočkali. 2 Vtomtopřípaděovšemnejdeovýšediskutovanoumezimolekulárníinterakci,aleointerakci gravitační. 3 Přesněji,dostávásedolibovolnéblízkostikaždéhobodufázovéhoprostoru. 105
106 12.3 Zobecnění pojmu teplota záporné absolutní teploty Teplota je do klasické termodynamiky zavedena nultou větou. Ve statistické termodynamice se teplota zavádí formálně, jako veličina spjatá s Lagrangeovým multiplikátorem β, viz odstavec 3.2 β= 1 k B T. Výhodou tohoto formálního zavedení je, že dovoluje rozšířit pojem teplota i na systémy, jež nejsou tvořeny částicemi, například na systém jaderných spinů. Právě u systémů jaderných spinů některých paramagnetických látek ve vnějším magnetickém poli objevili v roce 1951 Persell a Pound experimentálně stavy se zápornou absolutní teplotou. Co je to za nesmysl, řeknete si, vždyť třetí termodynamický zákon zakazuje dosažení absolutní nuly. Jak se máme dostat k teplotám ještě nižším? Abychom čtenáře ještě více zmátli, dokážeme nejprve, že záporné absolutní teploty existovat nemohou, a pak ukážeme, že existovat mohou. Při tom poznáme, že hranicí mezi kladnými a zápornými teplotami není nula, ale nekonečno. Lze snadno dokázat, že u systémů tvořených molekulami nemohou existovat záporné teploty. Partiční funkce kanonického souboru je, viz vztah(3.4), Q= i e βe i, (12.3) kde E i jeenergiei-téhokvantovéhostavusystému.tatoenergiejezdolaomezena, existujenejnižšíenergetickáhladina, E min,nenívšakomezenashora,mohouexistovat libovolně vysoké excitované stavy E min < E i <. (12.4) Vysoké energetické hladiny přispívají k partiční funkci velmi málo, neboť e βe i 0, když E i. Kdyby existovaly záporné teploty, byl by také multiplikátor β < 0. V tomto případě by členy v partiční funkci, odpovídající vysokým energiím naopak rostly nade všechny 106
107 meze. Suma(12.3) by divergovala. Neexistovala by partiční funkce a v důsledku toho by neexistovaly ani termodynamické veličiny. Tím jsme dokázali, že záporné teploty existovat nemohou. Nyní dokážeme, že záporné teploty existovat mohou. U některých systémů jsou energie omezeny nejen zdola, ale i shora. E min < E i < E max. (12.5) Mezi takové systémy patří právě systém jaderných spinů v magnetickém poli. Systém mánejnižšíenergii E min,kdyžjadernéspinyvšechatomůjsouorientoványvesměru poleanejvyššíenergii E max,jsou-lispinyorientoványprotisměrupole.aťje β >0 či β <0,žádnýzčlenůvpartičnífunkci(12.3)nerostenadevšechnymeze.Tímje dokázáno,žezápornéteplotyexistovatmohou,nevšak,žeexistují 4.Nynípopíšeme, jak se záporné teploty experimentálně realizují. Na obrázku 12.2 vlevo je schematicky znázorněn termodynamický stav krystalu paramagnetické látky v magnetickém poli při teplotě blízké 0 K. Šipkami jsou znázorněny orientace jaderných spinů. V limitě T = 0 by byly všechny spiny orientovány magnetické pole T +0K T= T 0K Obrázek 12.2: Jaderné spiny při teplotě blízké +0 K. ve směru pole. Tepelný pohyb brání, aby bylo tohoto ideálního uspořádání dosaženo. Proto jsou některé spiny orientovány proti směru pole. S rostoucí teplotou roste počet obráceně orientovaných spinů. Při teplotě T = + by byl vliv magnetického pole zcela potlačen a spiny by byly orientovány náhodně(viz obrázek 12.2 uprostřed). 4 Každýznásmůžebýtmiliardářem,nekaždýmilardářemje. 107
108 Jestliže při nízké teplotě rychle změníme směr vnějšího magnetického pole, vznikne stav znázorněný na obrázku 12.2 vpravo. Většina spinů je orientována proti směru pole, protože nestačila sledovat rychlou změnu pole. Tento stav systému odpovídá zápornéteplotě,blízké-0k.přiteplotě T= 0Kbytedybylyorientoványvšechny spiny proti směru pole. Poznámka: Je třeba si uvědomit, že zápornou teplotu mají jen jaderné spiny. Vlastní molekuly paramagnetické látky jsou stále při kladné nízké teplotě. Systém při záporné teplotě není ve stavu termodynamické rovnováhy. Časem se stále více spinů orientuje do směru pole. Teplota systému přitom stále klesá a klesá, až dosáhne hodnoty T = K, při které jsou spiny orientovány náhodně, nezávisle na směrupole.tentostavsystémujevšaktotožnýsestavempřiteplotě T=+ K,znázorněným na obrázku 12.2 uprostřed. Po dosažení nekonečné hodnoty, teplota spinů dále klesá, až se nakonec systém vrátí do původního rovnovážného stavu, znázorněného na obrázku Shrňme výše napsané. Teplotám-0 K a +0 K(obě jsou nedosažitelné) odpovídají diametrálně odlišné stavy systému. Teploty + K a K jsou naopak totožné. Není to hloupost? Není, příčina je ryze formální. Mohou za to naši předkové, kteří zavedli intenzivnítermodynamickýparametr Tanikoliv T 1 nebo β.nekonečnéteplotěodpovídá β=0ajejedno,je-litoplusnulanebominusnula.teplotě+0odpovídá β = + ; třetí termodynamický zákon by zněl triviálně: nelze dosáhnout stavu systémuonekonečnémbeta.teplotě 0pakodpovídá β= ;nikohosnadneudiví, že minus nekonečno není totéž, co plus nekonečno I. termodynamický zákon První zákon termodynamiky byl navržen v polovině devatenáctého století jako zobecnění zákona zachování energie známého z mechaniky na termodynamiku. Tím přispěl k formulování obecného zákona zachování energie ve fyzice, jehož je speciálním případem. Statistická termodynamika, vycházející ze zákonů mechaniky nemůže říci o 108
109 I. větě nic nového. Tento axiom termodynamiky je tak vlastně jediný, který statistická termodynamika nijak neobohacuje. Poznámka: O tom, jak fyzici lpějí na zákonu zachování energie, vypovídá kauza neutrino. Měření radioaktivních rozpadů beta koncem dvacátých let minulého století ukazovala, že se energie nezachovává. Vypukla panika. Nejprve byla napadena přesnost měření, ukázalo se však, že nezachování energie není způsobeno experimentálními chybami. Co dělat? Zákon zachování energie se nikomu nechtělo bourat. Východisko navrhl v roce 1930 Wolfgang Pauli. Vyslovil hypotézu, že část energie při beta rozpadu odnáší neznámá neutrální částice o velmi malé hmotě. Postupně získala Pauliho hypotéza příznivce. Enrico Fermi částici pokřtil. Nazval ji neutrinem, tj. neutronkem. Až v roce 1956 nalezli Reines a Cowan neutronek experimentálně. V současné době je neutrinová fyzika oborem, jež se experimentálně i teoreticky bouřlivě rozvíjí II. termodynamický zákon Některé slovní formulace druhé věty termodynamické, viz podkapitola 1.1, neplatí ve světě záporných absolutních teplot. V tomto světě se při odebírání tepla systém ohřívá, roste jeho teplota. Existuje zde perpetuum mobile druhého druhu. Bohužel nám chybí dostatečně velký tepelný zásobník o záporné teplotě, abychom tohoto dobrodiní využili. Krásný problém pro naše ekology, kteří se však spíše věnuji pěstování řepky nebo větrným elektrárnám. Statistická termodynamika zavádí relaci mezi entropií a pravděpodobností, viz vztah(4.16), S= k B P i ln P i. (12.6) Tento vztah dovoluje přenášet pojem entropie, a tedy II. větu termodynamickou, i na systémy, jež nejsou tvořeny molekulami. Díky tomuto vztahu existuje souvislost mezi entropií a informací vzrůst entropie znamená pokles informace. Maximální entropie jetotéžcošum žádnáinformace. Nejzajímavější je patrně souvislost mezi druhou větou termodynamickou a tokem času. Budeme o ní hovořit v posledním odstavci této poslední kapitoly. i 109
110 12.6 III. termodynamický zákon Třetívěta,pozdněnarozenédítětermodynamiky 5,jepopelkoumezijejímiaxiomy. Byla vždy chápána jako něco podřadného, pouhý doplňující předpoklad, který dovoluje výpočet absolutní entropie, viz oddíl Zajímavý snad byl její důsledek, nedosažitelnost absolutní nuly. Ten však byl znevážen ve stati o záporných teplotách, viz 12.3; zaměníme-li T za 1/T, stane se ze zajímavého důsledku triviální fakt o nedosažitelnosti nekonečna. Statistická termodynamika dokáže III. větu rigorózně odvodit. Při absolutní nule je možný jediný stav krystalu: všechny molekuly jsou v nejnižším energetickém stavu a oscilují(viz vibrace nulového bodu) v uzlových bodech mřížky. Potom P 0 =1, P 1 =0, P 2 =0, = P i = P 0 =1. (12.7) i Dosazením tohoto výsledku do rovnice(12.6) dostaneme S= k B P i ln P i = k B P 0 ln P 0 =0. (12.8) Tím je třetí věta dokázána. i 12.7 Termodynamika a běh času Termodynamika nepatří k nejromantičtějším fyzikálním oborům. Posuďte sami: Paradox dvojčat v teorii relativity, princip neurčitosti v kvantové mechanice, velký třesk vkosmologii.comůžeposkytnouttermodynamika, naukaoteple?opravdujen výpočet účinnosti Carnotova stroje nebo podklady pro návrhy destilačních kolon? Termodynamika,ajenona,vypovídáosměrutokučasu:odkolébkydohrobua nikdy jinak! O směru času hovoří postulát o termodynamické rovnováze(systém vždy přechází z nerovnovážných stavů do rovnováhy) a druhá věta(entropie adiabatického systému při nevratných dějích roste). Může nám to připadnout triviální. Na směr času jsme zvyklí odmalička. Ve skutečnosti ani klasická mechanika, ani speciální teorie relativity, obecná teorie relativity či 5 II.větabylapoprvéformulovánavroce1824,I.větavpolovinědevatenáctéhostoletí,Nernstova formulaceiii.větyjezroku1906aplanckovajezroku
111 kvantová mechanika neříkají nic o směru, kterým plyne čas. Zaměníme-li ve vzorcích těchto disciplin znaménko u času za opačné, nic se nestane. Vzorce zůstanou v platnosti. Nebo našimi slovy: všechny mikroskopické procesy jsou vratné. Nebo ještě jinak. Pustíme-li film, ve kterém se srážejí kulečníkové koule(bez tření) nebo film, ve kterém se srážejí elementární částice, nepoznáme, zda vidíme film puštěný normálně nebo časově obráceně. Vidíme-li však ve filmu, jak ze střepů rozházených na podlaze vzniká sklenička,rozlitávodasedonívléváaskleničkasamavyskakujenastůl,nicnás neošálí. Víme, že to bylo naopak. Směr času je tedy charakteristický pro makroskopické procesy, procesy spojené s disipací energie. Fenomenologická termodynamika jej zakotvila do svých zákonů. Nevysvětluje však, proč je takový a proč jej nelze obrátit. Statistická termodynamika při výkladu směru času naráží hned na začátku na paradox. Makroskopické procesy jsou důsledkem pohybů částic. Pohyby částic jsou však reversibilní, invariantní vůči změně směru času. Řešení paradoxu jsme naznačili již v podkapitole 1.5. Sebemenší odchylky v počátečních polohách a rychlostech částic vedou při řešení diferenciálních pohybových rovnic k obrovským neurčitostem, k chaosu. Heisenbergův princip neurčitosti přitom zásadně omezuje možnost přesného určení rychlosti i polohy částice v daném čase. Směr pořádek chaos neboli nerovnováha rovnováha je směrem našeho času. Statistická termodynamika vysvětluje směr nevratných procesů, zároveň jej však relativizuje. Jsou možné procesy směřující od rovnováhy do nerovnovážných stavů, i když u makroskopických systémů velmi nepravděpodobné. Vrátíme-li se k našemu příkladu se skleničkou dvacetistupňové vody, je možné, aby část vody začala spontánně vřít a část se proměnila v led. Kdybychom to však viděli nafilmované, vsázeli bychom se, že film je puštěný obráceně. Je tedy možné, byť nesmírně nepravděpodobné, že se staneme svědky gigantické fluktuace, při které bude tok času obrácen od hrobu ke kolébce. 111
112 112 skoro jistě možná?
metoda je základem fenomenologické vědy termodynamiky, statistická metoda je základem kinetické teorie plynů, na níž si princip této metody ukážeme.
 Přednáška 1 Úvod Při studiu tepelných vlastností látek a jevů probíhajících při tepelné výměně budeme používat dvě různé metody zkoumání: termodynamickou a statistickou. Termodynamická metoda je základem
Přednáška 1 Úvod Při studiu tepelných vlastností látek a jevů probíhajících při tepelné výměně budeme používat dvě různé metody zkoumání: termodynamickou a statistickou. Termodynamická metoda je základem
Fyzikální chemie. Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302. 14. února 2013
 Fyzikální chemie Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302 14. února 2013 Co je fyzikální chemie? Co je fyzikální chemie? makroskopický přístup: (klasická) termodynamika nerovnovážná
Fyzikální chemie Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302 14. února 2013 Co je fyzikální chemie? Co je fyzikální chemie? makroskopický přístup: (klasická) termodynamika nerovnovážná
Přednášky z lékařské biofyziky Biofyzikální ústav Lékařské fakulty Masarykovy univerzity, Brno
 Přednášky z lékařské biofyziky Biofyzikální ústav Lékařské fakulty Masarykovy univerzity, Brno JAMES WATT 19.1.1736-19.8.1819 Termodynamika principy, které vládnou přírodě Obsah přednášky Vysvětlení základních
Přednášky z lékařské biofyziky Biofyzikální ústav Lékařské fakulty Masarykovy univerzity, Brno JAMES WATT 19.1.1736-19.8.1819 Termodynamika principy, které vládnou přírodě Obsah přednášky Vysvětlení základních
Termodynamika materiálů. Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn
 Termodynamika materiálů Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn Důležité konstanty Standartní podmínky Avogadrovo číslo N A = 6,023.10
Termodynamika materiálů Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn Důležité konstanty Standartní podmínky Avogadrovo číslo N A = 6,023.10
ÚVOD DO TERMODYNAMIKY
 ÚVOD DO TERMODYNAMIKY Termodynamika: Nauka o obecných zákonitostech, kterými se se řídí transformace CELKOVÉ energie makroskopických systémů v její různé formy. Je založena na výsledcích experimentílních
ÚVOD DO TERMODYNAMIKY Termodynamika: Nauka o obecných zákonitostech, kterými se se řídí transformace CELKOVÉ energie makroskopických systémů v její různé formy. Je založena na výsledcích experimentílních
Termodynamika a živé systémy. Helena Uhrová
 Termodynamika a živé systémy Helena Uhrová Základní pojmy termodynamiky soustava izolovaná otevřená okolí vlastnosti soustavy znaky popisující soustavu stav rovnováhy tok m či E =0 funkce stavu - soubor
Termodynamika a živé systémy Helena Uhrová Základní pojmy termodynamiky soustava izolovaná otevřená okolí vlastnosti soustavy znaky popisující soustavu stav rovnováhy tok m či E =0 funkce stavu - soubor
Poznámky k cvičením z termomechaniky Cvičení 3.
 Vnitřní energie U Vnitřní energie U je stavová veličina U = U (p, V, T), ale závisí pouze na teplotě (experiment Gay-Lussac / Joule) U = f(t) Pro měrnou vnitřní energii (tedy pro vnitřní energii jednoho
Vnitřní energie U Vnitřní energie U je stavová veličina U = U (p, V, T), ale závisí pouze na teplotě (experiment Gay-Lussac / Joule) U = f(t) Pro měrnou vnitřní energii (tedy pro vnitřní energii jednoho
11. přednáška 10. prosince Kapitola 3. Úvod do teorie diferenciálních rovnic. Obyčejná diferenciální rovnice řádu n (ODR řádu n) je vztah
 11. přednáška 10. prosince 2007 Kapitola 3. Úvod do teorie diferenciálních rovnic. Obyčejná diferenciální rovnice řádu n (ODR řádu n) je vztah F (x, y, y, y,..., y (n) ) = 0 mezi argumentem x funkce jedné
11. přednáška 10. prosince 2007 Kapitola 3. Úvod do teorie diferenciálních rovnic. Obyčejná diferenciální rovnice řádu n (ODR řádu n) je vztah F (x, y, y, y,..., y (n) ) = 0 mezi argumentem x funkce jedné
Termodynamika (td.) se obecně zabývá vzájemnými vztahy a přeměnami různých druhů
 Termodynamika (td.) se obecně zabývá vzájemnými vztahy a přeměnami různých druhů energií (mechanické, tepelné, elektrické, magnetické, chemické a jaderné) při td. dějích. Na rozdíl od td. cyklických dějů
Termodynamika (td.) se obecně zabývá vzájemnými vztahy a přeměnami různých druhů energií (mechanické, tepelné, elektrické, magnetické, chemické a jaderné) při td. dějích. Na rozdíl od td. cyklických dějů
Mol. fyz. a termodynamika
 Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Termodynamika. Děj, který není kvazistatický, se nazývá nestatický.
 Termodynamika Zabývá se ději, při nichž se mění tepelná energie v jiné druhy energie (zejména mechanické). Studuje vlastnosti látek bez přihlédnutí k jejich mikrostruktuře. Je vystavěna na axiomech (0.,
Termodynamika Zabývá se ději, při nichž se mění tepelná energie v jiné druhy energie (zejména mechanické). Studuje vlastnosti látek bez přihlédnutí k jejich mikrostruktuře. Je vystavěna na axiomech (0.,
Fluktuace termodynamických veličin
 Kvantová a statistická fyzika (Termodynamika a statistická fyzika Fluktuace termodynamických veličin Fluktuace jsou odchylky hodnot fyzikálních veličin od svých středních (rovnovážných hodnot. Mají původ
Kvantová a statistická fyzika (Termodynamika a statistická fyzika Fluktuace termodynamických veličin Fluktuace jsou odchylky hodnot fyzikálních veličin od svých středních (rovnovážných hodnot. Mají původ
Molekulová fyzika a termodynamika
 Molekulová fyzika a termodynamika Molekulová fyzika a termodynamika Úvod, vnitřní energie soustavy, teplo, teplota, stavová rovnice ideálního plynu Termodynamické zákony, termodynamické děje Teplotní a
Molekulová fyzika a termodynamika Molekulová fyzika a termodynamika Úvod, vnitřní energie soustavy, teplo, teplota, stavová rovnice ideálního plynu Termodynamické zákony, termodynamické děje Teplotní a
Kvantová a statistická fyzika 2 (Termodynamika a statistická fyzika)
 1 Statistická fyzika Kvantová a statistická fyzika 2 (Termodynamika a statistická fyzika) Cíl statistické fyziky: vysvětlit makroskopické vlastnosti látky na základě mikroskopických vlastností jejích elementů,
1 Statistická fyzika Kvantová a statistická fyzika 2 (Termodynamika a statistická fyzika) Cíl statistické fyziky: vysvětlit makroskopické vlastnosti látky na základě mikroskopických vlastností jejích elementů,
FYZIKÁLNÍ CHEMIE I: 2. ČÁST
 Univerzita J. E. Purkyně v Ústí nad Labem Přírodovědecká fakulta FYZIKÁLNÍ CHEMIE I: 2. ČÁST KCH/P401 Ivo Nezbeda Ústí nad Labem 2013 1 Obor: Klíčová slova: Anotace: Toxikologie a analýza škodlivin, Chemie
Univerzita J. E. Purkyně v Ústí nad Labem Přírodovědecká fakulta FYZIKÁLNÍ CHEMIE I: 2. ČÁST KCH/P401 Ivo Nezbeda Ústí nad Labem 2013 1 Obor: Klíčová slova: Anotace: Toxikologie a analýza škodlivin, Chemie
Fyzikální chemie Úvod do studia, základní pojmy
 Fyzikální chemie Úvod do studia, základní pojmy HMOTA A JEJÍ VLASTNOSTI POSTAVENÍ FYZIKÁLNÍ CHEMIE V PŘÍRODNÍCH VĚDÁCH HISTORIE FYZIKÁLNÍ CHEMIE ZÁKLADNÍ POJMY DEFINICE FORMY HMOTY Formy a nositelé hmoty
Fyzikální chemie Úvod do studia, základní pojmy HMOTA A JEJÍ VLASTNOSTI POSTAVENÍ FYZIKÁLNÍ CHEMIE V PŘÍRODNÍCH VĚDÁCH HISTORIE FYZIKÁLNÍ CHEMIE ZÁKLADNÍ POJMY DEFINICE FORMY HMOTY Formy a nositelé hmoty
Molekulová fyzika a termika. Přehled základních pojmů
 Molekulová fyzika a termika Přehled základních pojmů Kinetická teorie látek Vychází ze tří experimentálně ověřených poznatků: 1) Látky se skládají z částic - molekul, atomů nebo iontů, mezi nimiž jsou
Molekulová fyzika a termika Přehled základních pojmů Kinetická teorie látek Vychází ze tří experimentálně ověřených poznatků: 1) Látky se skládají z částic - molekul, atomů nebo iontů, mezi nimiž jsou
2.4 Stavové chování směsí plynů Ideální směs Ideální směs reálných plynů Stavové rovnice pro plynné směsi
 1. ZÁKLADNÍ POJMY 1.1 Systém a okolí 1.2 Vlastnosti systému 1.3 Vybrané základní veličiny 1.3.1 Množství 1.3.2 Délka 1.3.2 Délka 1.4 Vybrané odvozené veličiny 1.4.1 Objem 1.4.2 Hustota 1.4.3 Tlak 1.4.4
1. ZÁKLADNÍ POJMY 1.1 Systém a okolí 1.2 Vlastnosti systému 1.3 Vybrané základní veličiny 1.3.1 Množství 1.3.2 Délka 1.3.2 Délka 1.4 Vybrané odvozené veličiny 1.4.1 Objem 1.4.2 Hustota 1.4.3 Tlak 1.4.4
Aplikovaná fyzikální chemie. Magda Škvorová KFCH CN463 tel. 3302
 Aplikovaná fyzikální chemie Aplikovaná fyzikální chemie Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302 1. září 2014 Aplikovaná fyzikální chemie Bylo nebylo... Bylo nebylo... Nejvzácnějšímu
Aplikovaná fyzikální chemie Aplikovaná fyzikální chemie Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302 1. září 2014 Aplikovaná fyzikální chemie Bylo nebylo... Bylo nebylo... Nejvzácnějšímu
Termodynamické zákony
 Termodynamické zákony Makroskopická práce termodynamické soustavy Již jsme uvedli, že změna vnitřní energie soustavy je obecně vyvolána dvěma ději: tepelnou výměnou mezi soustavou a okolím a konáním práce
Termodynamické zákony Makroskopická práce termodynamické soustavy Již jsme uvedli, že změna vnitřní energie soustavy je obecně vyvolána dvěma ději: tepelnou výměnou mezi soustavou a okolím a konáním práce
Matematika III. Miroslava Dubcová, Daniel Turzík, Drahoslava Janovská. Ústav matematiky
 Matematika III Řady Miroslava Dubcová, Daniel Turzík, Drahoslava Janovská Ústav matematiky Přednášky ZS 202-203 Obsah Číselné řady. Součet nekonečné řady. Kritéria konvergence 2 Funkční řady. Bodová konvergence.
Matematika III Řady Miroslava Dubcová, Daniel Turzík, Drahoslava Janovská Ústav matematiky Přednášky ZS 202-203 Obsah Číselné řady. Součet nekonečné řady. Kritéria konvergence 2 Funkční řady. Bodová konvergence.
Zákony ideálního plynu
 5.2Zákony ideálního plynu 5.1.1 Ideální plyn 5.1.2 Avogadrův zákon 5.1.3 Normální podmínky 5.1.4 Boyleův-Mariottův zákon Izoterma 5.1.5 Gay-Lussacův zákon 5.1.6 Charlesův zákon 5.1.7 Poissonův zákon 5.1.8
5.2Zákony ideálního plynu 5.1.1 Ideální plyn 5.1.2 Avogadrův zákon 5.1.3 Normální podmínky 5.1.4 Boyleův-Mariottův zákon Izoterma 5.1.5 Gay-Lussacův zákon 5.1.6 Charlesův zákon 5.1.7 Poissonův zákon 5.1.8
Úvod. Integrování je inverzní proces k derivování Máme zderivovanou funkci a integrací získáme původní funkci kterou jsme derivovali
 NEURČITÝ INTEGRÁL Úvod Integrování je inverzní proces k derivování Máme zderivovanou funkci a integrací získáme původní funkci kterou jsme derivovali Umět pracovat s integrálním počtem Je důležité pro
NEURČITÝ INTEGRÁL Úvod Integrování je inverzní proces k derivování Máme zderivovanou funkci a integrací získáme původní funkci kterou jsme derivovali Umět pracovat s integrálním počtem Je důležité pro
III. Diferenciál funkce a tečná rovina 8. Diferenciál funkce. Přírůstek funkce. a = (x 0, y 0 ), h = (h 1, h 2 ).
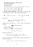 III. Diferenciál funkce a tečná rovina 8. Diferenciál funkce. Přírůstek funkce = f(x 0 + h 1, y 0 + h 2 ) f(x 0, y 0 ) f u (x 0, y 0 ), kde u = (h 1, h 2 ). ( ) = f(x 0 + h 1, y 0 ) f(x 0, y 0 ) x (x 0,
III. Diferenciál funkce a tečná rovina 8. Diferenciál funkce. Přírůstek funkce = f(x 0 + h 1, y 0 + h 2 ) f(x 0, y 0 ) f u (x 0, y 0 ), kde u = (h 1, h 2 ). ( ) = f(x 0 + h 1, y 0 ) f(x 0, y 0 ) x (x 0,
CHEMICKÁ ENERGETIKA. Celá termodynamika je logicky odvozena ze tří základních principů, které mají axiomatický charakter.
 CHEMICKÁ ENERGETIKA Energetickou stránkou soustav a změnami v těchto soustavách se zabývá fyzikální disciplína termodynamika. Z široké oblasti obecné termodynamiky se chemická termodynamika zajímá o chemické
CHEMICKÁ ENERGETIKA Energetickou stránkou soustav a změnami v těchto soustavách se zabývá fyzikální disciplína termodynamika. Z široké oblasti obecné termodynamiky se chemická termodynamika zajímá o chemické
Do známky zkoušky rovnocenným podílem započítávají získané body ze zápočtového testu.
 Podmínky pro získání zápočtu a zkoušky z předmětu Chemicko-inženýrská termodynamika pro zpracování ropy Zápočet je udělen, pokud student splní zápočtový test alespoň na 50 %. Zápočtový test obsahuje 3
Podmínky pro získání zápočtu a zkoušky z předmětu Chemicko-inženýrská termodynamika pro zpracování ropy Zápočet je udělen, pokud student splní zápočtový test alespoň na 50 %. Zápočtový test obsahuje 3
Dynamika soustav hmotných bodů
 Dynamika soustav hmotných bodů Mechanický model, jehož pohyb je charakterizován pohybem dvou nebo více bodů, nazýváme soustavu hmotných bodů. Pro každý hmotný bod můžeme napsat pohybovou rovnici. Tedy
Dynamika soustav hmotných bodů Mechanický model, jehož pohyb je charakterizován pohybem dvou nebo více bodů, nazýváme soustavu hmotných bodů. Pro každý hmotný bod můžeme napsat pohybovou rovnici. Tedy
Kinetická teorie ideálního plynu
 Přednáška 10 Kinetická teorie ideálního plynu 10.1 Postuláty kinetické teorie Narozdíl od termodynamiky kinetická teorie odvozuje makroskopické vlastnosti látek (např. tlak, teplotu, vnitřní energii) na
Přednáška 10 Kinetická teorie ideálního plynu 10.1 Postuláty kinetické teorie Narozdíl od termodynamiky kinetická teorie odvozuje makroskopické vlastnosti látek (např. tlak, teplotu, vnitřní energii) na
5.3. Implicitní funkce a její derivace
 Výklad Podívejme se na následující problém. Uvažujme množinu M bodů [x,y] R 2, které splňují rovnici F(x, y) = 0, M = {[x,y] D F F(x,y) = 0}, kde z = F(x,y) je nějaká funkce dvou proměnných. Je-li F(x,y)
Výklad Podívejme se na následující problém. Uvažujme množinu M bodů [x,y] R 2, které splňují rovnici F(x, y) = 0, M = {[x,y] D F F(x,y) = 0}, kde z = F(x,y) je nějaká funkce dvou proměnných. Je-li F(x,y)
Fáze a fázové přechody
 Kvantová a statistická fyzika 2 (Termodynamika a statistická fyzika) Fáze a fázové přechody Pojem fáze je zobecněním pojmu skupenství, označuje homogenní část makroskopického tělesa. Jednotlivé fáze v
Kvantová a statistická fyzika 2 (Termodynamika a statistická fyzika) Fáze a fázové přechody Pojem fáze je zobecněním pojmu skupenství, označuje homogenní část makroskopického tělesa. Jednotlivé fáze v
MATEMATIKA III. Olga Majlingová. Učební text pro prezenční studium. Předběžná verze
 Fakulta strojního inženýrství Univerzity J. E. Purkyně v Ústí nad Labem Pasteurova 7 Tel.: 475 285 511 400 96 Ústí nad Labem Fax: 475 285 566 Internet: www.ujep.cz E-mail: kontakt@ujep.cz MATEMATIKA III
Fakulta strojního inženýrství Univerzity J. E. Purkyně v Ústí nad Labem Pasteurova 7 Tel.: 475 285 511 400 96 Ústí nad Labem Fax: 475 285 566 Internet: www.ujep.cz E-mail: kontakt@ujep.cz MATEMATIKA III
3.1. Newtonovy zákony jsou základní zákony klasické (Newtonovy) mechaniky
 3. ZÁKLADY DYNAMIKY Dynamika zkoumá příčinné souvislosti pohybu a je tedy zdůvodněním zákonů kinematiky. K pojmům používaným v kinematice zavádí pojem hmoty a síly. Statický výpočet Dynamický výpočet -
3. ZÁKLADY DYNAMIKY Dynamika zkoumá příčinné souvislosti pohybu a je tedy zdůvodněním zákonů kinematiky. K pojmům používaným v kinematice zavádí pojem hmoty a síly. Statický výpočet Dynamický výpočet -
Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny
 Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny Hustota toku Zatím jsme studovali pouze soustavy, které byly v rovnovážném stavu není-li soustava v silovém poli, je hustota částic stejná
Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny Hustota toku Zatím jsme studovali pouze soustavy, které byly v rovnovážném stavu není-li soustava v silovém poli, je hustota částic stejná
Termodynamické potenciály
 Kapitola 1 Termodynamické potenciály 11 Vnitřní energie a U-formulace Fyzikání význam vnitřní energie: v průběhu adiabatického děje je vykonaná práce rovna úbytku vnitřní energie Platí pro vratné i pro
Kapitola 1 Termodynamické potenciály 11 Vnitřní energie a U-formulace Fyzikání význam vnitřní energie: v průběhu adiabatického děje je vykonaná práce rovna úbytku vnitřní energie Platí pro vratné i pro
5. Lokální, vázané a globální extrémy
 5 Lokální, vázané a globální extrémy Studijní text Lokální extrémy 5 Lokální, vázané a globální extrémy Definice 51 Řekneme, že f : R n R má v bodě a Df: 1 lokální maximum, když Ka, δ Df tak, že x Ka,
5 Lokální, vázané a globální extrémy Studijní text Lokální extrémy 5 Lokální, vázané a globální extrémy Definice 51 Řekneme, že f : R n R má v bodě a Df: 1 lokální maximum, když Ka, δ Df tak, že x Ka,
8.3). S ohledem na jednoduchost a názornost je výhodné seznámit se s touto Základní pojmy a vztahy. Definice
 9. Lineární diferenciální rovnice 2. řádu Cíle Diferenciální rovnice, v nichž hledaná funkce vystupuje ve druhé či vyšší derivaci, nazýváme diferenciálními rovnicemi druhého a vyššího řádu. Analogicky
9. Lineární diferenciální rovnice 2. řádu Cíle Diferenciální rovnice, v nichž hledaná funkce vystupuje ve druhé či vyšší derivaci, nazýváme diferenciálními rovnicemi druhého a vyššího řádu. Analogicky
T0 Teplo a jeho měření
 Teplo a jeho měření 1 Teplo 2 Kalorimetrie Kalorimetr 3 Tepelná kapacita 3.1 Měrná tepelná kapacita Měrná tepelná kapacita při stálém objemu a stálém tlaku Poměr měrných tepelných kapacit 3.2 Molární tepelná
Teplo a jeho měření 1 Teplo 2 Kalorimetrie Kalorimetr 3 Tepelná kapacita 3.1 Měrná tepelná kapacita Měrná tepelná kapacita při stálém objemu a stálém tlaku Poměr měrných tepelných kapacit 3.2 Molární tepelná
9. T r a n s f o r m a c e n á h o d n é v e l i č i n y
 9. T r a n s f o r m a c e n á h o d n é v e l i č i n y Při popisu procesů zpracováváme vstupní údaj, hodnotu x tak, že výstupní hodnota y závisí nějakým způsobem na vstupní, je její funkcí y = f(x).
9. T r a n s f o r m a c e n á h o d n é v e l i č i n y Při popisu procesů zpracováváme vstupní údaj, hodnotu x tak, že výstupní hodnota y závisí nějakým způsobem na vstupní, je její funkcí y = f(x).
8.2. Exaktní rovnice. F(x, y) x. dy. df = dx + y. Nyní budeme hledat odpověd na otázku, zda a jak lze od této diferenciální formule
 Cíle Ve výkladu o funkcích dvou proměnných jsme se seznámili také s jejich diferenciálem prvního řádu, který je pro funkci F(x, y) vyjádřen výrazem df dx + dy. Nyní budeme hledat odpověd na otázku, zda
Cíle Ve výkladu o funkcích dvou proměnných jsme se seznámili také s jejich diferenciálem prvního řádu, který je pro funkci F(x, y) vyjádřen výrazem df dx + dy. Nyní budeme hledat odpověd na otázku, zda
Úvodní informace. 17. února 2018
 Úvodní informace Funkce více proměnných Přednáška první 17. února 2018 Obsah 1 Úvodní informace. 2 Funkce více proměnných Definiční obor Limita a spojitost Derivace, diferencovatelnost, diferenciál Úvodní
Úvodní informace Funkce více proměnných Přednáška první 17. února 2018 Obsah 1 Úvodní informace. 2 Funkce více proměnných Definiční obor Limita a spojitost Derivace, diferencovatelnost, diferenciál Úvodní
Nultá věta termodynamická
 TERMODYNAMIKA Nultá věta termodynamická 2 Práce 3 Práce - příklady 4 1. věta termodynamická 5 Entalpie 6 Tepelné kapacity 7 Vnitřní energie a entalpie ideálního plynu 8 Výpočet tepla a práce 9 Adiabatický
TERMODYNAMIKA Nultá věta termodynamická 2 Práce 3 Práce - příklady 4 1. věta termodynamická 5 Entalpie 6 Tepelné kapacity 7 Vnitřní energie a entalpie ideálního plynu 8 Výpočet tepla a práce 9 Adiabatický
12 DYNAMIKA SOUSTAVY HMOTNÝCH BODŮ
 56 12 DYNAMIKA SOUSTAVY HMOTNÝCH BODŮ Těžiště I. impulsová věta - věta o pohybu těžiště II. impulsová věta Zákony zachování v izolované soustavě hmotných bodů Náhrada pohybu skutečných objektů pohybem
56 12 DYNAMIKA SOUSTAVY HMOTNÝCH BODŮ Těžiště I. impulsová věta - věta o pohybu těžiště II. impulsová věta Zákony zachování v izolované soustavě hmotných bodů Náhrada pohybu skutečných objektů pohybem
Průvodce studiem. do bodu B se snažíme najít nejkratší cestu. Ve firmách je snaha minimalizovat
 6. Extrémy funkcí více proměnných Průvodce studiem Hledání extrémů je v praxi často řešená úloha. Např. při cestě z bodu A do bodu B se snažíme najít nejkratší cestu. Ve firmách je snaha minimalizovat
6. Extrémy funkcí více proměnných Průvodce studiem Hledání extrémů je v praxi často řešená úloha. Např. při cestě z bodu A do bodu B se snažíme najít nejkratší cestu. Ve firmách je snaha minimalizovat
1. Obyčejné diferenciální rovnice
 & 8..8 8: Josef Hekrdla obyčejné diferenciální rovnice-separace proměnných. Obyčejné diferenciální rovnice Rovnice, ve které je neznámá funkcí a v rovnici se vyskytuje spolu se svými derivacemi, se nazývá
& 8..8 8: Josef Hekrdla obyčejné diferenciální rovnice-separace proměnných. Obyčejné diferenciální rovnice Rovnice, ve které je neznámá funkcí a v rovnici se vyskytuje spolu se svými derivacemi, se nazývá
Elektroenergetika 1. Termodynamika a termodynamické oběhy
 Termodynamika a termodynamické oběhy Termodynamika Popisuje procesy, které zahrnují změny teploty, přeměny energie a vzájemný vztah mezi tepelnou energií a mechanickou prací Opakování fyziky Termodynamický
Termodynamika a termodynamické oběhy Termodynamika Popisuje procesy, které zahrnují změny teploty, přeměny energie a vzájemný vztah mezi tepelnou energií a mechanickou prací Opakování fyziky Termodynamický
Derivace funkce. Přednáška MATEMATIKA č Jiří Neubauer
 Přednáška MATEMATIKA č. 9-11 Katedra ekonometrie FEM UO Brno kancelář 69a, tel. 973 442029 email:jiri.neubauer@unob.cz Šotová, J., Doudová, L. Diferenciální počet funkcí jedné proměnné Motivační příklady
Přednáška MATEMATIKA č. 9-11 Katedra ekonometrie FEM UO Brno kancelář 69a, tel. 973 442029 email:jiri.neubauer@unob.cz Šotová, J., Doudová, L. Diferenciální počet funkcí jedné proměnné Motivační příklady
Greenova funkce pro dvoubodové okrajové úlohy pro obyčejné diferenciální rovnice
 Greenova funkce pro dvoubodové okrajové úlohy pro obyčejné diferenciální rovnice Jan Tomeček Tento stručný text si klade za cíl co nejrychlejší uvedení do teorie Greenových funkcí pro obyčejné diferenciální
Greenova funkce pro dvoubodové okrajové úlohy pro obyčejné diferenciální rovnice Jan Tomeček Tento stručný text si klade za cíl co nejrychlejší uvedení do teorie Greenových funkcí pro obyčejné diferenciální
Elektroenergetika 1. Termodynamika
 Elektroenergetika 1 Termodynamika Termodynamika Popisuje procesy, které zahrnují změny teploty, přeměny energie a vzájemný vztah mezi tepelnou energií a mechanickou prací Opakování fyziky Termodynamický
Elektroenergetika 1 Termodynamika Termodynamika Popisuje procesy, které zahrnují změny teploty, přeměny energie a vzájemný vztah mezi tepelnou energií a mechanickou prací Opakování fyziky Termodynamický
1. Náhodný vektor (X, Y ) má diskrétní rozdělení s pravděpodobnostní funkcí p, kde. p(x, y) = a(x + y + 1), x, y {0, 1, 2}.
 VIII. Náhodný vektor. Náhodný vektor (X, Y má diskrétní rozdělení s pravděpodobnostní funkcí p, kde p(x, y a(x + y +, x, y {,, }. a Určete číslo a a napište tabulku pravděpodobnostní funkce p. Řešení:
VIII. Náhodný vektor. Náhodný vektor (X, Y má diskrétní rozdělení s pravděpodobnostní funkcí p, kde p(x, y a(x + y +, x, y {,, }. a Určete číslo a a napište tabulku pravděpodobnostní funkce p. Řešení:
Lekce 4 Statistická termodynamika
 Lekce 4 Statistická termodynamika Osnova 1. Co je statistická termodynamika 2. Mikrostav, makrostav a Gibbsův soubor 3. Příklady Gibbsových souborů 4. Souborové střední hodnoty 5. Časové střední hodnoty
Lekce 4 Statistická termodynamika Osnova 1. Co je statistická termodynamika 2. Mikrostav, makrostav a Gibbsův soubor 3. Příklady Gibbsových souborů 4. Souborové střední hodnoty 5. Časové střední hodnoty
Teplo, práce a 1. věta termodynamiky
 eplo, práce a. věta termodynamiky eplo ( tepelná energie) Nyní již víme, že látka (plyn) s vyšší teplotou obsahuje částice (molekuly), které se pohybují s vyššími rychlostmi a můžeme posoudit, co se stane
eplo, práce a. věta termodynamiky eplo ( tepelná energie) Nyní již víme, že látka (plyn) s vyšší teplotou obsahuje částice (molekuly), které se pohybují s vyššími rychlostmi a můžeme posoudit, co se stane
1.1 Existence a jednoznačnost řešení. Příklad 1.1: [M2-P1] diferenciální rovnice (DR) řádu n: speciálně nás budou zajímat rovnice typu
![1.1 Existence a jednoznačnost řešení. Příklad 1.1: [M2-P1] diferenciální rovnice (DR) řádu n: speciálně nás budou zajímat rovnice typu 1.1 Existence a jednoznačnost řešení. Příklad 1.1: [M2-P1] diferenciální rovnice (DR) řádu n: speciálně nás budou zajímat rovnice typu](/thumbs/102/155926571.jpg) [M2-P1] KAPITOLA 1: Diferenciální rovnice 1. řádu diferenciální rovnice (DR) řádu n: speciálně nás budou zajímat rovnice typu G(x, y, y, y,..., y (n) ) = 0 y (n) = F (x, y, y,..., y (n 1) ) Příklad 1.1:
[M2-P1] KAPITOLA 1: Diferenciální rovnice 1. řádu diferenciální rovnice (DR) řádu n: speciálně nás budou zajímat rovnice typu G(x, y, y, y,..., y (n) ) = 0 y (n) = F (x, y, y,..., y (n 1) ) Příklad 1.1:
Obsah Obyčejné diferenciální rovnice
 Obsah 1 Obyčejné diferenciální rovnice 3 1.1 Základní pojmy............................................ 3 1.2 Obyčejné diferenciální rovnice 1. řádu................................ 5 1.3 Exaktní rovnice............................................
Obsah 1 Obyčejné diferenciální rovnice 3 1.1 Základní pojmy............................................ 3 1.2 Obyčejné diferenciální rovnice 1. řádu................................ 5 1.3 Exaktní rovnice............................................
Diferenciální rovnice
 Obyčejné diferenciální rovnice - studijní text pro cvičení v předmětu Matematika - 2. Studijní materiál byl připraven pracovníky katedry E. Novákovou, M. Hyánkovou a L. Průchou za podpory grantu IG ČVUT
Obyčejné diferenciální rovnice - studijní text pro cvičení v předmětu Matematika - 2. Studijní materiál byl připraven pracovníky katedry E. Novákovou, M. Hyánkovou a L. Průchou za podpory grantu IG ČVUT
Extrémy funkce dvou proměnných
 Extrémy funkce dvou proměnných 1. Stanovte rozměry pravoúhlé vodní nádrže o objemu 32 m 3 tak, aby dno a stěny měly nejmenší povrch. Označme rozměry pravoúhlé nádrže x, y, z (viz obr.). ak objem této nádrže
Extrémy funkce dvou proměnných 1. Stanovte rozměry pravoúhlé vodní nádrže o objemu 32 m 3 tak, aby dno a stěny měly nejmenší povrch. Označme rozměry pravoúhlé nádrže x, y, z (viz obr.). ak objem této nádrže
9. přednáška 26. listopadu f(a)h < 0 a pro h (0, δ) máme f(a 1 + h, a 2,..., a m ) f(a) > 1 2 x 1
 9 přednáška 6 listopadu 007 Věta 11 Nechť f C U, kde U R m je otevřená množina, a a U je bod Pokud fa 0, nemá f v a ani neostrý lokální extrém Pokud fa = 0 a H f a je pozitivně negativně definitní, potom
9 přednáška 6 listopadu 007 Věta 11 Nechť f C U, kde U R m je otevřená množina, a a U je bod Pokud fa 0, nemá f v a ani neostrý lokální extrém Pokud fa = 0 a H f a je pozitivně negativně definitní, potom
8 Elasticita kaučukových sítí
 8 Elasticita kaučukových sítí Elastomerní polymerní látky (např. kaučuky) tvoří ze / chemické příčné vazby a / fyzikální uzly. Vyznačují se schopností deformovat se již malou silou nejméně o 00 % své původní
8 Elasticita kaučukových sítí Elastomerní polymerní látky (např. kaučuky) tvoří ze / chemické příčné vazby a / fyzikální uzly. Vyznačují se schopností deformovat se již malou silou nejméně o 00 % své původní
Necht tedy máme přirozená čísla n, k pod pojmem systém lineárních rovnic rozumíme rovnice ve tvaru
 2. Systémy lineárních rovnic V této kapitole se budeme zabývat soustavami lineárních rovnic s koeficienty z pole reálných případně komplexních čísel. Uvádíme podmínku pro existenci řešení systému lineárních
2. Systémy lineárních rovnic V této kapitole se budeme zabývat soustavami lineárních rovnic s koeficienty z pole reálných případně komplexních čísel. Uvádíme podmínku pro existenci řešení systému lineárních
Diferenciální rovnice a jejich aplikace. (Brkos 2011) Diferenciální rovnice a jejich aplikace 1 / 36
 Diferenciální rovnice a jejich aplikace Zdeněk Kadeřábek (Brkos 2011) Diferenciální rovnice a jejich aplikace 1 / 36 Obsah 1 Co to je derivace? 2 Diferenciální rovnice 3 Systémy diferenciálních rovnic
Diferenciální rovnice a jejich aplikace Zdeněk Kadeřábek (Brkos 2011) Diferenciální rovnice a jejich aplikace 1 / 36 Obsah 1 Co to je derivace? 2 Diferenciální rovnice 3 Systémy diferenciálních rovnic
TERMOMECHANIKA 1. Základní pojmy
 1 FSI VUT v Brně, Energetický ústav Odbor termomechaniky a techniky prostředí prof. Ing. Milan Pavelek, CSc. TERMOMECHANIKA 1. Základní pojmy OSNOVA 1. KAPITOLY Termodynamická soustava Energie, teplo,
1 FSI VUT v Brně, Energetický ústav Odbor termomechaniky a techniky prostředí prof. Ing. Milan Pavelek, CSc. TERMOMECHANIKA 1. Základní pojmy OSNOVA 1. KAPITOLY Termodynamická soustava Energie, teplo,
Věta 12.3 : Věta 12.4 (princip superpozice) : [MA1-18:P12.7] rovnice typu y (n) + p n 1 (x)y (n 1) p 1 (x)y + p 0 (x)y = q(x) (6)
![Věta 12.3 : Věta 12.4 (princip superpozice) : [MA1-18:P12.7] rovnice typu y (n) + p n 1 (x)y (n 1) p 1 (x)y + p 0 (x)y = q(x) (6) Věta 12.3 : Věta 12.4 (princip superpozice) : [MA1-18:P12.7] rovnice typu y (n) + p n 1 (x)y (n 1) p 1 (x)y + p 0 (x)y = q(x) (6)](/thumbs/96/128965676.jpg) 1. Lineární diferenciální rovnice řádu n [MA1-18:P1.7] rovnice typu y n) + p n 1 )y n 1) +... + p 1 )y + p 0 )y = q) 6) počáteční podmínky: y 0 ) = y 0 y 0 ) = y 1 y n 1) 0 ) = y n 1. 7) Věta 1.3 : Necht
1. Lineární diferenciální rovnice řádu n [MA1-18:P1.7] rovnice typu y n) + p n 1 )y n 1) +... + p 1 )y + p 0 )y = q) 6) počáteční podmínky: y 0 ) = y 0 y 0 ) = y 1 y n 1) 0 ) = y n 1. 7) Věta 1.3 : Necht
Zákony hromadění chyb.
 Zákony hromadění chyb. Zákon hromadění skutečných chyb. Zákon hromadění středních chyb. Tomáš Bayer bayertom@natur.cuni.cz Přírodovědecká fakulta Univerzity Karlovy v Praze, Katedra aplikované geoinformatiky
Zákony hromadění chyb. Zákon hromadění skutečných chyb. Zákon hromadění středních chyb. Tomáš Bayer bayertom@natur.cuni.cz Přírodovědecká fakulta Univerzity Karlovy v Praze, Katedra aplikované geoinformatiky
Matematická analýza III.
 2. Parciální derivace Miroslav Hušek, Lucie Loukotová UJEP 2010 Parciální derivace jsou zobecněním derivace funkce jedné proměnné. V této kapitole poznáme jejich základní vlastnosti a využití. Co bychom
2. Parciální derivace Miroslav Hušek, Lucie Loukotová UJEP 2010 Parciální derivace jsou zobecněním derivace funkce jedné proměnné. V této kapitole poznáme jejich základní vlastnosti a využití. Co bychom
Parciální derivace a diferenciál
 Parciální derivace a diferenciál Vyšší matematika, Inženýrská matematika LDF MENDELU Podpořeno projektem Průřezová inovace studijních programů Lesnické a dřevařské fakulty MENDELU v Brně (LDF) s ohledem
Parciální derivace a diferenciál Vyšší matematika, Inženýrská matematika LDF MENDELU Podpořeno projektem Průřezová inovace studijních programů Lesnické a dřevařské fakulty MENDELU v Brně (LDF) s ohledem
Matematika (CŽV Kadaň) aneb Úvod do lineární algebry Matice a soustavy rovnic
 Přednáška třetí (a pravděpodobně i čtvrtá) aneb Úvod do lineární algebry Matice a soustavy rovnic Lineární rovnice o 2 neznámých Lineární rovnice o 2 neznámých Lineární rovnice o dvou neznámých x, y je
Přednáška třetí (a pravděpodobně i čtvrtá) aneb Úvod do lineární algebry Matice a soustavy rovnic Lineární rovnice o 2 neznámých Lineární rovnice o 2 neznámých Lineární rovnice o dvou neznámých x, y je
Přednáška 11, 12. prosince Část 5: derivace funkce
 Přednáška 11, 12. prosince 2014 Závěrem pasáže o spojitých funkcích zmíníme jejich podtřídu, lipschitzovské funkce, nazvané podle německého matematika Rudolfa Lipschitze (1832 1903). Fukce f : M R je lipschitzovská,
Přednáška 11, 12. prosince 2014 Závěrem pasáže o spojitých funkcích zmíníme jejich podtřídu, lipschitzovské funkce, nazvané podle německého matematika Rudolfa Lipschitze (1832 1903). Fukce f : M R je lipschitzovská,
Fyzikální chemie. ochrana životního prostředí analytická chemie chemická technologie denní. Platnost: od 1. 9. 2009 do 31. 8. 2013
 Učební osnova předmětu Fyzikální chemie Studijní obor: Aplikovaná chemie Zaměření: Forma vzdělávání: Celkový počet vyučovacích hodin za studium: Analytická chemie Chemická technologie Ochrana životního
Učební osnova předmětu Fyzikální chemie Studijní obor: Aplikovaná chemie Zaměření: Forma vzdělávání: Celkový počet vyučovacích hodin za studium: Analytická chemie Chemická technologie Ochrana životního
PROCESY V TECHNICE BUDOV 8
 UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY PROCESY V TECHNICE BUDOV 8 Dagmar Janáčová, Hana Charvátová Zlín 2013 Tento studijní materiál vznikl za finanční podpory Evropského sociálního
UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY PROCESY V TECHNICE BUDOV 8 Dagmar Janáčová, Hana Charvátová Zlín 2013 Tento studijní materiál vznikl za finanční podpory Evropského sociálního
VÝUKA CHEMIE. Clausiovo kritérium a extenzivní podmínky termodynamické rovnováhy
 VÝUKA CHEMIE Chemické listy, v souladu s celosvětovým trendem v oblasti informatiky, budou postupně stále více přecházet na elektronickou formu publikování. V současnosti si lze na internetové adrese http://staff.vscht.cz/chem_listy
VÝUKA CHEMIE Chemické listy, v souladu s celosvětovým trendem v oblasti informatiky, budou postupně stále více přecházet na elektronickou formu publikování. V současnosti si lze na internetové adrese http://staff.vscht.cz/chem_listy
III. STRUKTURA A VLASTNOSTI PLYNŮ
 III. STRUKTURA A VLASTNOSTI PLYNŮ 3.1 Ideální plyn a) ideální plyn model, předpoklady: 1. rozměry molekul malé (ve srovnání se střední vzdáleností molekul). molekuly na sebe navzálem silově nepůsobí (mimo
III. STRUKTURA A VLASTNOSTI PLYNŮ 3.1 Ideální plyn a) ideální plyn model, předpoklady: 1. rozměry molekul malé (ve srovnání se střední vzdáleností molekul). molekuly na sebe navzálem silově nepůsobí (mimo
2. Statistický popis plazmatu
 Statistický popis plazmatu 60 Statistický popis plazmatu Při popisu typického plazmatu je technicky nemožné popsat trajektorie všech částic Jen v řídkém plazmatu mezihvězdného prostoru nalezneme miliony
Statistický popis plazmatu 60 Statistický popis plazmatu Při popisu typického plazmatu je technicky nemožné popsat trajektorie všech částic Jen v řídkém plazmatu mezihvězdného prostoru nalezneme miliony
Texty k přednáškám z MMAN3: 4. Funkce a zobrazení v euklidovských prostorech
 Texty k přednáškám z MMAN3: 4. Funkce a zobrazení v euklidovských prostorech 1. července 2008 1 Funkce v R n Definice 1 Necht n N a D R n. Reálnou funkcí v R n (reálnou funkcí n proměnných) rozumíme zobrazení
Texty k přednáškám z MMAN3: 4. Funkce a zobrazení v euklidovských prostorech 1. července 2008 1 Funkce v R n Definice 1 Necht n N a D R n. Reálnou funkcí v R n (reálnou funkcí n proměnných) rozumíme zobrazení
Radiologická fyzika základy diferenciálního počtu derivace a tečny, integrály a plochy diferenciální rovnice
 Radiologická fyzika základy diferenciálního počtu derivace a tečny, integrály a plochy diferenciální rovnice podzim 2008, pátá přednáška Derivace a tečny aneb matematika libovolně malých změn Nejen velké,
Radiologická fyzika základy diferenciálního počtu derivace a tečny, integrály a plochy diferenciální rovnice podzim 2008, pátá přednáška Derivace a tečny aneb matematika libovolně malých změn Nejen velké,
9. T r a n s f o r m a c e n á h o d n é v e l i č i n y
 9. T r a n s f o r m a c e n á h o d n é v e l i č i n Při popisu procesů zpracováváme vstupní údaj, hodnotu x tak, že výstupní hodnota závisí nějakým způsobem na vstupní, je její funkcí = f(x). Pokud
9. T r a n s f o r m a c e n á h o d n é v e l i č i n Při popisu procesů zpracováváme vstupní údaj, hodnotu x tak, že výstupní hodnota závisí nějakým způsobem na vstupní, je její funkcí = f(x). Pokud
Úloha č.1: Stanovení molární tepelné kapacity plynu za konstantního tlaku
 Úloha č.1: Stanovení molární tepelné kapacity plynu za konstantního tlaku Teorie První termodynamický zákon je definován du dq dw (1) kde du je totální diferenciál vnitřní energie a dq a dw jsou neúplné
Úloha č.1: Stanovení molární tepelné kapacity plynu za konstantního tlaku Teorie První termodynamický zákon je definován du dq dw (1) kde du je totální diferenciál vnitřní energie a dq a dw jsou neúplné
Funkce dvou a více proměnných
 Funkce dvou a více proměnných. Motivace V praxi nevstačíme s funkcemi jedné proměnné, většina veličin závisí více než na jedné okolnosti, např.: obsah obdélníka: S( ) kinetická energie: Ek = = x mv ekonomika:
Funkce dvou a více proměnných. Motivace V praxi nevstačíme s funkcemi jedné proměnné, většina veličin závisí více než na jedné okolnosti, např.: obsah obdélníka: S( ) kinetická energie: Ek = = x mv ekonomika:
Parciální derivace a diferenciál
 Parciální derivace a diferenciál Vyšší matematika, Inženýrská matematika LDF MENDELU Podpořeno projektem Průřezová inovace studijních programů Lesnické a dřevařské fakulty MENDELU v Brně (LDF) s ohledem
Parciální derivace a diferenciál Vyšší matematika, Inženýrská matematika LDF MENDELU Podpořeno projektem Průřezová inovace studijních programů Lesnické a dřevařské fakulty MENDELU v Brně (LDF) s ohledem
Cvičení z termodynamiky a statistické fyziky
 Cvičení termodynamiky a statistické fyiky 1Nechť F(x, y=xe y Spočtěte F/ x, F/, 2 F/ x 2, 2 F/ x, 2 F/ x, 2 F/ x 2 2 Bud dω = A(x, ydx+b(x, ydy libovolná diferenciální forma(pfaffián Ukažte, ževpřípadě,žedωjeúplnýdiferenciál(existujefunkce
Cvičení termodynamiky a statistické fyiky 1Nechť F(x, y=xe y Spočtěte F/ x, F/, 2 F/ x 2, 2 F/ x, 2 F/ x, 2 F/ x 2 2 Bud dω = A(x, ydx+b(x, ydy libovolná diferenciální forma(pfaffián Ukažte, ževpřípadě,žedωjeúplnýdiferenciál(existujefunkce
1 Mnohočleny a algebraické rovnice
 1 Mnohočleny a algebraické rovnice 1.1 Pojem mnohočlenu (polynomu) Připomeňme, že výrazům typu a 2 x 2 + a 1 x + a 0 říkáme kvadratický trojčlen, když a 2 0. Číslům a 0, a 1, a 2 říkáme koeficienty a písmenem
1 Mnohočleny a algebraické rovnice 1.1 Pojem mnohočlenu (polynomu) Připomeňme, že výrazům typu a 2 x 2 + a 1 x + a 0 říkáme kvadratický trojčlen, když a 2 0. Číslům a 0, a 1, a 2 říkáme koeficienty a písmenem
LDF MENDELU. Simona Fišnarová (MENDELU) LDR druhého řádu VMAT, IMT 1 / 22
 Lineární diferenciální rovnice druhého řádu Vyšší matematika, Inženýrská matematika LDF MENDELU Podpořeno projektem Průřezová inovace studijních programů Lesnické a dřevařské fakulty MENDELU v Brně (LDF)
Lineární diferenciální rovnice druhého řádu Vyšší matematika, Inženýrská matematika LDF MENDELU Podpořeno projektem Průřezová inovace studijních programů Lesnické a dřevařské fakulty MENDELU v Brně (LDF)
9. Struktura a vlastnosti plynů
 9. Struktura a vlastnosti plynů Osnova: 1. Základní pojmy 2. Střední kvadratická rychlost 3. Střední kinetická energie molekuly plynu 4. Stavová rovnice ideálního plynu 5. Jednoduché děje v plynech a)
9. Struktura a vlastnosti plynů Osnova: 1. Základní pojmy 2. Střední kvadratická rychlost 3. Střední kinetická energie molekuly plynu 4. Stavová rovnice ideálního plynu 5. Jednoduché děje v plynech a)
VYBRANÉ STATĚ Z PROCESNÍHO INŢENÝRSTVÍ cvičení 12
 UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY VYBRANÉ STATĚ Z PROCESNÍHO INŢENÝRSTVÍ cvičení 2 Termodynamika reálných plynů část 2 Hana Charvátová, Dagmar Janáčová Zlín 203 Tento studijní
UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY VYBRANÉ STATĚ Z PROCESNÍHO INŢENÝRSTVÍ cvičení 2 Termodynamika reálných plynů část 2 Hana Charvátová, Dagmar Janáčová Zlín 203 Tento studijní
Definice 7.1 Nechť je dán pravděpodobnostní prostor (Ω, A, P). Zobrazení. nebo ekvivalentně
 7 Náhodný vektor Nezávislost náhodných veličin Definice 7 Nechť je dán pravděpodobnostní prostor (Ω, A, P) Zobrazení X : Ω R n, které je A-měřitelné, se nazývá (n-rozměrný) náhodný vektor Měřitelností
7 Náhodný vektor Nezávislost náhodných veličin Definice 7 Nechť je dán pravděpodobnostní prostor (Ω, A, P) Zobrazení X : Ω R n, které je A-měřitelné, se nazývá (n-rozměrný) náhodný vektor Měřitelností
soustava - část prostoru s látkovou náplní oddělená od okolí skutečnými nebo myšlenými stěnami okolí prostor vně uvažované soustavy
 Soustava soustava - část prostoru s látkovou náplní oddělená od okolí skutečnými nebo myšlenými stěnami okolí prostor vně uvažované soustavy Okolí Hraniční plocha Soustava Soustava Rozdělení podle vztahu
Soustava soustava - část prostoru s látkovou náplní oddělená od okolí skutečnými nebo myšlenými stěnami okolí prostor vně uvažované soustavy Okolí Hraniční plocha Soustava Soustava Rozdělení podle vztahu
Práce, energie a další mechanické veličiny
 Práce, energie a další mechanické veličiny Úvod V předchozích přednáškách jsme zavedli základní mechanické veličiny (rychlost, zrychlení, síla, ) Popis fyzikálních dějů usnadňuje zavedení dalších fyzikálních
Práce, energie a další mechanické veličiny Úvod V předchozích přednáškách jsme zavedli základní mechanické veličiny (rychlost, zrychlení, síla, ) Popis fyzikálních dějů usnadňuje zavedení dalších fyzikálních
Nyní využijeme slovník Laplaceovy transformace pro derivaci a přímé hodnoty a dostaneme běžnou algebraickou rovnici. ! 2 "
 ŘEŠENÉ PŘÍKLADY Z MB ČÁST Příklad Nalezněte pomocí Laplaceovy transformace řešení dané Cauchyho úlohy lineární diferenciální rovnice prvního řádu s konstantními koeficienty v intervalu 0,, které vyhovuje
ŘEŠENÉ PŘÍKLADY Z MB ČÁST Příklad Nalezněte pomocí Laplaceovy transformace řešení dané Cauchyho úlohy lineární diferenciální rovnice prvního řádu s konstantními koeficienty v intervalu 0,, které vyhovuje
Vybrané kapitoly z matematiky
 Vybrané kapitoly z matematiky VŠB-TU Ostrava 2018-2019 Vybrané kapitoly z matematiky 2018-2019 1 / 18 Vektorová analýza a teorie pole Vybrané kapitoly z matematiky 2018-2019 2 / 18 Vektorová funkce jedné
Vybrané kapitoly z matematiky VŠB-TU Ostrava 2018-2019 Vybrané kapitoly z matematiky 2018-2019 1 / 18 Vektorová analýza a teorie pole Vybrané kapitoly z matematiky 2018-2019 2 / 18 Vektorová funkce jedné
Látkové množství n poznámky 6.A GVN
 Látkové množství n poznámky 6.A GVN 10. září 2007 charakterizuje látky z hlediska počtu částic (molekul, atomů, iontů), které tato látka obsahuje je-li v tělese z homogenní látky N částic, pak látkové
Látkové množství n poznámky 6.A GVN 10. září 2007 charakterizuje látky z hlediska počtu částic (molekul, atomů, iontů), které tato látka obsahuje je-li v tělese z homogenní látky N částic, pak látkové
Dnešní látka Variačně formulované okrajové úlohy zúplnění prostoru funkcí. Lineární zobrazení.
 Předmět: MA4 Dnešní látka Variačně formulované okrajové úlohy zúplnění prostoru funkcí. Lineární zobrazení. Literatura: Kapitola 2 a)-c) a kapitola 4 a)-c) ze skript Karel Rektorys: Matematika 43, ČVUT,
Předmět: MA4 Dnešní látka Variačně formulované okrajové úlohy zúplnění prostoru funkcí. Lineární zobrazení. Literatura: Kapitola 2 a)-c) a kapitola 4 a)-c) ze skript Karel Rektorys: Matematika 43, ČVUT,
INTEGRÁLY S PARAMETREM
 INTEGRÁLY S PARAMETREM b a V kapitole o integraci funkcí více proměnných byla potřeba funkce g(x) = f(x, y) dy proměnné x. Spojitost funkce g(x) = b a f(x, y) dy proměnné x znamená vlastně prohození limity
INTEGRÁLY S PARAMETREM b a V kapitole o integraci funkcí více proměnných byla potřeba funkce g(x) = f(x, y) dy proměnné x. Spojitost funkce g(x) = b a f(x, y) dy proměnné x znamená vlastně prohození limity
Teorie měření a regulace
 Ústav technologie, mechanizace a řízení staveb Teorie měření a regulace 22.z-3.tr ZS 2015/2016 2015 - Ing. Václav Rada, CSc. TEORIE ŘÍZENÍ druhá část tématu předmětu pokračuje. oblastí matematických pomůcek
Ústav technologie, mechanizace a řízení staveb Teorie měření a regulace 22.z-3.tr ZS 2015/2016 2015 - Ing. Václav Rada, CSc. TEORIE ŘÍZENÍ druhá část tématu předmětu pokračuje. oblastí matematických pomůcek
Dynamika proudících plynů
 Dynamika proudících plynů Při výpočtech se budeme zabývat prouděním ideálních plynů. Jejich vlastnosti již byly popsány na předchozích přednáškách/cvičeních. Při proudění ideálního plynu si zavedeme ještě
Dynamika proudících plynů Při výpočtech se budeme zabývat prouděním ideálních plynů. Jejich vlastnosti již byly popsány na předchozích přednáškách/cvičeních. Při proudění ideálního plynu si zavedeme ještě
Obyčejnými diferenciálními rovnicemi (ODR) budeme nazývat rovnice, ve kterých
 Obyčejné diferenciální rovnice Obyčejnými diferenciálními rovnicemi (ODR) budeme nazývat rovnice, ve kterých se vyskytují derivace neznámé funkce jedné reálné proměnné. Příklad. Bud dána funkce f : R R.
Obyčejné diferenciální rovnice Obyčejnými diferenciálními rovnicemi (ODR) budeme nazývat rovnice, ve kterých se vyskytují derivace neznámé funkce jedné reálné proměnné. Příklad. Bud dána funkce f : R R.
SVOBODA, E., BAKULE, R.
 Termodynamika 1. Termodynamika 2. Termodynamická soustava 3. Termodynamický stav 4. Veličiny: látkové množství, molární veličina, vnitřní energie, práce v termodynamice 5. Termodynamické principy: nultý
Termodynamika 1. Termodynamika 2. Termodynamická soustava 3. Termodynamický stav 4. Veličiny: látkové množství, molární veličina, vnitřní energie, práce v termodynamice 5. Termodynamické principy: nultý
TERMODYNAMIKA Ideální plyn TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY.
 TERMODYNAMIKA Ideální plyn TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY. Ideální plyn je zjednodušená představa skutečného plynu. Je dokonale stlačitelný
TERMODYNAMIKA Ideální plyn TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY. Ideální plyn je zjednodušená představa skutečného plynu. Je dokonale stlačitelný
IDEÁLNÍ PLYN. Stavová rovnice
 IDEÁLNÍ PLYN Stavová rovnice Ideální plyn ) rozměry molekul jsou zanedbatelné vzhledem k jejich vzdálenostem 2) molekuly plynu na sebe působí jen při vzájemných srážkách 3) všechny srážky jsou dokonale
IDEÁLNÍ PLYN Stavová rovnice Ideální plyn ) rozměry molekul jsou zanedbatelné vzhledem k jejich vzdálenostem 2) molekuly plynu na sebe působí jen při vzájemných srážkách 3) všechny srážky jsou dokonale
Termomechanika 6. přednáška Doc. Dr. RNDr. Miroslav Holeček
 Termomechanika 6. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Termomechanika 6. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Aplikovaná numerická matematika
 Aplikovaná numerická matematika 6. Metoda nejmenších čtverců doc. Ing. Róbert Lórencz, CSc. České vysoké učení technické v Praze Fakulta informačních technologií Katedra počítačových systémů Příprava studijních
Aplikovaná numerická matematika 6. Metoda nejmenších čtverců doc. Ing. Róbert Lórencz, CSc. České vysoké učení technické v Praze Fakulta informačních technologií Katedra počítačových systémů Příprava studijních
Derivace funkce DERIVACE A SPOJITOST DERIVACE A KONSTRUKCE FUNKCÍ. Aritmetické operace
 Derivace funkce Derivace je jedním z hlavních nástrojů matematické analýzy. V příští části ukážeme, jak mnoho různorodých aplikací derivace má. Geometricky lze derivaci funkce v nějakém bodě chápat jako
Derivace funkce Derivace je jedním z hlavních nástrojů matematické analýzy. V příští části ukážeme, jak mnoho různorodých aplikací derivace má. Geometricky lze derivaci funkce v nějakém bodě chápat jako
6. Stavy hmoty - Plyny
 skupenství plynné plyn x pára (pod kritickou teplotou) stavové chování Ideální plyn Reálné plyny Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti skupenství plynné reálný plyn ve stavu
skupenství plynné plyn x pára (pod kritickou teplotou) stavové chování Ideální plyn Reálné plyny Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti skupenství plynné reálný plyn ve stavu
