Molekuly. w konstrukce zkusmé funkce ve tvaru LCAO. atomový orbital - známe. rozvojový koeficient neznáme - počítáme
|
|
|
- Zdenka Hájková
- před 8 lety
- Počet zobrazení:
Transkript
1 Zdroje w Zdroje nejsou důsledně továny, za ož se hluboe omlouvám w Některé zdroje w L. Pela: Ideas of Quantum Chemstry w Gaussan: WhtePages w do. P. Nahtgall přednášky z podzmní školy w do. P. Jurečka přednášky z podzmní školy a UP w Dr. D. Nahtgallová přednášky z podzmní školy w Wkpeda w
2 Molekuly w konstruke zkusmé funke ve tvaru LCAO Φ ϕ atomový orbtal - známe rozvojový koefent neznáme - počítáme
3 Atomové orbtaly - báze w HTO vodíkové w STO podobné vodíkovým (stejné jádro) w GTO gaussovy funke (jné jádro) n nerespektují hování elektronu v pot. pol n STO (HTO) aproxmují rozvojem GTO e r r e e r n práe s GTO (ntegrae) je snazší
4 STO vs. GTO STO GTO
5 závsí E na báz? Φ ϕ jen obsazené AO mnmální např. pro H ( x s) obsazené + n-násobek neobs. AO n- ξ např. pro H ( x s) double-zeta obsazené + n-násobek neobs. AO + neob. orbtaly s vyšším ang. kv. číslem n-zeta + pol. např. pro H ( x s + x p) double-zeta + pol.
6 závsí E na báz? E w obeněj - varační prnp n zkusmá funke f ( V ) f fd ν ( V ) f H fd ν E 0 HF M DZ DZ+P velkost báze s rostouím počtem AO v LCAO energe konverguje ke správné hodnotě shora!!!
7 CBS Complete bass set např. ze dvou hodnot lze CBS extrapolovat pojem: varační metoda
8 GTO detalněj tvar gaussánu počet prmtvníh funkí exponenty škálovaí faktor φ µ N d e µ α µ f µ r kontrakční koefenty Popleovy (6-3G*), Dunnngovy (-pvdz)
9 Nobelova ena za hem 998 za rozvoj kvantově hemkýh výpočetníh metod Popleovy báze Podívejme se detalně na defn báze 6-3G pro H ze vstupu pro program Gaussan. H 0 S D D D D D D+00 S D D+0 **** φ S e 8.73r e.854r e 0.640r φ S r e
10 Popleovy báze 6-3++G(3df,p) polarzační funke pro vodík polarzační funke pro těžké atomy dfúzní funke pro vodík dfúzní funke pro těžké atomy valenční sféra (3++ prm. gaussány, trple-zeta) ore sféra (6-prm. gaussánů) důležté pro pops anontů, CT komplexů apod. 6-3G(d) resp. 6-3G(d,p) rozumné standardy pro QCh výpočty org. molekul
11 Báze praktky
12 Délka vazby v H-F d(hf) exp Å!
13 Jak na molekuly? w zkusmá funke ve tvaru LCAO Φ ϕ atomové orbtaly - báze rozvojové koefenty - hledáme 0 mn ) ( ) ( Φ Φ ν ϕ ϕ ν d H d d d H V j j j V
14 MO-LCAO ( ) ( ) ( ) V j j H V j V j j j j j d S d d ν ϕ ϕ ν ϕ ϕ ν ϕ ϕ,, S ʹ ʹ ʹ ʹ ʹ ʹ ʹ ʹ ʹ j j j j j j j j j j j j j j j j j j S d d B H d d A EB A B EB A B AB A B B A E B A S H d d H d d, 0 0, 0 ϕ ϕ ϕ ϕ v Draově nota
15 MO-LCAO ( ) n nn n n n n j j n j j j j E E E E H ES H ES H E H ES H S n ES H,...,, 0 det 0 (nefyzkální)...,,..., 0,! " # "! sekulární rovne ( ) E E E H H S H 0 S H v matovém zápse
16 Další aproxmae Hj počítají se velm obtížně w Hartreeho metoda separae pohybu elektronů (ztráta elektronové korelae) el ( ) ( ) ( ) r r Ψ r Ψ r Ψ...,..., n nerespektuje antsymetr vlnové funke w Fok (Fok) oprava na antsymetr zavedení Slaterova determnantu n n
17 Jednoelektronová aproxmae Hartree, metody - HF, SCF pole se počítá teratvně samokonzstentně selfonsstent feld SCF e e e e e e průměrné pole ostatníh elektronů realta jednoelektronová aprox. důsledek: ztráta elektronové korelae!
18 Metoda SCF w w w V HF metodě závsí jednoelektronové orbtaly na průměrném potenálu elektronu v pol ostatníh elektronů Průměrný potenál ale závsí na orbtaleh Musí se řešt teratvně, dokud se orbtaly a potenál nepřestanou měnt pak je dosaženo samokonzstentní pole (self-onsstent feld - SCF). Odhad rozvojovýh koefentů (např. rozšířená Hükelova metoda). Vypočte se potenál a Fokův operátor 3. Vyřeší se Fokovy rovne a vypočtou se nové orbtaly 4. Došlo ke změně ano, opakuje se od bodu č. ; ne máme řešení!
19 Slaterův determnant Ψ el ( ) r,..., r n n! Ψ Ψ ( ) ( ) r! Ψ r " ( ) ( ) r! Ψ r n # n n " n respektuje antsymetr vlnové funke Ψ el ( ) ( ) r, r Ψ r r, el
20 Aproxmae Ψ tot Born-Oppenhemerova ( r, R) Ψ ( R) Ψ ( r; R) H el Ψ el EΨ zanedbání relatvstkýh efektů, spn-orbtální vazby, spn elektronů a jader H el jad Δ + el parametr elektronká Sh. r. j r j, A Z r A A el
21 Hükelova metoda w π-elektronová aproxmae φ µχ µ µ det 0 H H S µ v µ v H µν ε Sµ v µµ α β 0 δ µ v p z orbtal na atomu µ Coulombký ntegrál mez atomy spojeným vazbou
22 Ethylen ( ) ( ) ( ) ( ) ( ) β α ε β ε α ε α β β ε α ε α ε β ε β ε α ε ε ε ε ε ε ε ε χ χ φ ± S H S H S H S H S H S H S H S H tvar MO ve formě LCAO hledáme rozvojové koef. řešíme sekulární rovne
23 Ethylen ( ) ( ) ( ), 0 0 χ χ φ χ χ χ χ χ χ χ χ χ χ φ φ χ χ φ β β ε α β β β β ε α χ χ φ β α ε obdobně pro druhé řešení β α ε π + E už jsme blízko rozvojovým koef. pomůže normovaí podmínka vypočtené rozvojové koef.
24 Butaden α ε ε ε ε ε 3 4 β 0 0 β α ε β 0 α +.68β α β α 0.68β α.68β 0 β α ε E β 0 0 β α ε π ε + DE ε ( butaden ) E ( ) 0. β E ethylen π π 47 delokalzační nebo rezonanční en. (-36 kj/mol)
25 Butaden ε ε ε ε 3 4 α +.68β, 0.37χ α β, 0.600χ α 0.68β, 0.600χ α.68β, 0.37χ q µ N µ P počet elektronů χ χ 0.37χ 0.600χ χ 0.37χ 0.37χ χ χ 0.600χ χ 0.37χ elektronová hustota na atomu µ µν N µ ν vazebný řád mez atomy µ-ν ( 0.37)( 0.600) + ( 0.600)( 0.37) P ( 0.37) + ( 0.600) q P
26 Butaden stačí Maple > wth(lnearalgebra): M : Matrx(4,[[a-e,b,0,0],[b,a-e,b,0],[0,b,a-e,b],[0,0,b,a-e]]); > Determnant(M); a e b 0 0 b a e b 0 M : 0 b a e b 0 0 b a e b 4 3 b a + 6 b a e 3 b e + 6 a e 4 a e 3 + a 4 4 a 3 e + e 4 > solve(%,e); + +,,, b a 5 b + b a 5 b + + b a 5 b + b a 5 b
27 HOMO - LUMO w ethylen β w,3-butaden.4β Name β-arotene λ max 463 (log ε 5.0); 494 (log ε 4.77) Strutural Formula λ max (nm) Energy [kj (kal)/mol] Ethylene,3-Butadene (3E)-,3,5-Hexatrene (3E,5E)-,3,5,7-Otatetraene (73) 55 (3) 448 (07) 385 (9)
28 Cyklobutaden β α ε α ε ε β α ε ε α β β β ε α β β ε α β β β ε α delokalzační en. 0
29 azulen je aromát Aromatta w Hükelovo pravdlo: + 4n π elektronů (, 6, 0 ) CH - CH + tropylovż on 4 π el. 8 π el.
30 o se spny? w RHF/UHF w spnová kontamnae ( S + ) n 0 snglet, 0.75 dublet,.00 trplet, 3.75 kvartet n tolerane 5-0% w ROHF w jeden determnant často nestačí! S, S
31 ab-nto metody w SCF metoda zanedbává korelační energ (důsledek jednoelektronové aproxmae) E DZ báze HF TZ+P+D báze HF nek. báze HF lmta CBS metody korelační energe přesné nerelatvstké řešení přesné relatvstké řešení
32 Korelační energe w rozdíl mez přesnou nerelatvstkou energí (E 0 ) a Hartree-Fokovou lmtou E (HF/CBS) E orrelaton E 0 EHF / CBS w Korelační energe bývá malá, ale v hem často praujeme se změnam energe ΔE a v takovém případě může být velm významná n např. Londonovy síly
33 Post HF metody w Mluvíme o post HF metodáh, ty zahrnují do určté míry el. korela (dynamkou, statkou) w Konfgurační nterake CI w Vázané klastry CC w Multkonfgurační SCF MCSCF w Poruhové metody
34 Jak na korelační energ? w konfgurační nterake CI n využívá ln. kombnae Slaterovýh det. ψ slat. de. k Φ k0φ0 + ksφs + kdφd + ktφt +... n základní det. obsazené MO, další zahrnují extované konfgurae (sngle, double ), až popř. full-ci n nejdřív se provede výpočet SCF a pak se konstruuje CI, ale z MO-LCAO se jž neoptmalzují
35 Extae Ref. S S S ε 7 ε 6 ε 5 ε 7 ε 6 ε 5 ε 7 ε 6 ε 5 ε 7 ε 6 ε 5 ε 4 ε 3 ε ε ε 4 ε 3 ε ε ε 4 ε 3 ε ε ε 4 ε 3 ε ε.
36 Jak s CI w Mám-l n-elektronů a M báz. fí z RHF je Slat. determnant čítajíí N spnorbtalů (tj. N/ MO) k dspoz je dalšíh M-N/ vrtuálníh MO w tj. čím ví elektronů tím ví extaí a zároveň čím větší báze tím ví extaí (D metoda... nároky rostou extrémně ryhle!)
37 CIS w CI SINGLES n Jen sngle-extované stavy n varační a sze-onsstent (vz dále) n Opt. extovanýh stavů n Velm nepřesné energe s hybou -3 ev n Špatné pořadí stavů n Nezahrnuje dynamkou elektronovou korela
38 H v CI w Jelkož H má e, je metoda CI-SD metoda full-ci pro molekulu vodíku n Korelační energe v a.u. (Hartree) l 6-3G(d) DCI , SDCI l Large DCI , SDCI (exat ) w Large 0s, 5p, d n Geometre a.u. (a 0, Bohr) l 6-3G(d) SCF.385, Full CI.396 l Exat.40
39 Cena CI w Počet konfguraí pro BeH - DZ báze n SD-CI 46 n SDT-CI 78 n SDTQ-CI 73 n Full-CI 4544
40 Konečné CI není sze-onsstent w Sze-onsstent error E ( A... B( d( AB )) E( A) + E( B) n např. důležté pro výpočet nterakčníh energí w Full-CI je sze onsstent w Konečné (trunated) CI nejsou sze onsstent (až na CIS)
41 Poruhové metody w poruhové metody n HF řešení + poruha HF H H + n metoda Moller-Plesset MP(x), x-poruha do x- HF por por3 tého řádu E E n hojně používaná metoda n není varační, je sze-onsstent n další modfkae, RI-MP, SOS-MP + H E por + E +...
42 Nevarační MP
43 MP PN podz. škola
44 Vázané klastry w metoda vázanýh klastrů - Čížek T 0 ψ e ψ, T n operátor T tvoří mono-, d-, et. extované stavy n omezujeme se na dextae - CCD n použtelná metoda CCSD(T) desítky atomů T
45 MC-SCF w Rozvoj jako u CI, ale MO-LCAO rozvoje jsou optmalzovány w Pozn. MRCI CI ale vln. fe. je MC-SCF
46 WFT známe probereme
47 Densty Funtonal Theory w než začneme: funke přřazuje funkční hodnotu proměnné, funkonál přřazuje hodnotu funk (např. určtý ntegrál..) w systém je jednoznačně popsán rozložením elektronové hustoty ρ, která je funkí souřadn x,y,z.
48 Hohenberg-Kohnův teorém w DFT Hohenberg, Kohn, Sham (965) w Energe systému v základním stavu je jednoznačným funkonálem el. hustory E[ρ 0 ]. (platí podobně pro všehny vlastnost systému) W. Kohn: Nobelova ena za hem 998 (spolu s J. Poplem) za rozvoj teore DFT ] [ ˆ ] [ ] [ ] [ ˆ ] [ ] [ ] [ ρ ρ ρ ρ ρ ρ ρ Ψ Ψ Ψ Ψ Ψ Ψ H E E o o
49 W. Kohn: Nobelova ena za hem 998 (spolu s J. Poplem) za rozvoj teore DFT Hohenberg-Kohnův teorém w Platí varační prnp w E nabývá nejnžší hodnoty energe pro skutečnou elektronovou hustotu základního stavu The mage annot be dsplayed. Your omputer may not have enough memory to open the mage, or the mage may have been orrupted. Restart your omputer, and then open the fle agan. If the red x stll appears, you may have to delete the mage and then nsert t agan. w Problém: neznáme přesný tvar funkonálu
50 W. Kohn: Nobelova ena za hem 998 (spolu s J. Poplem) za rozvoj teore DFT Hohenberg-Kohnův teorém w Složky funkonálu energe ρ e ( ρ ) + V ( ρ ) + V ( r) ρ( r) d E [ρ] E T r + ee knetká energe oulombká repulze el. oulombká nt el.-jádra výměnný-korelační funkonál ( r ) ϕ ( r ) ( ) ϕ r en Kohn-Shamovy orbtaly nejsou košer MO x
51 Tvary funkonálů Teore VF částový hamltonán Ĥ N N M Z r A Δ + + A A j> j A B> A N N r M M Z AZ R AB B DFT funknál hustoty T 3 / 3 5/ 3 (3π ) ρ ( r dr 0 TF ) Knetká E: Thomas-Ferm E ρ( r) V dr Ne Ne E? dr C? Korelae e - Coulombká nterake elektronů - pozor! obsahuje nterak elektronu sama se sebou (Self-Interaton Error, SIE) E ee ρ( r r ) ρ( r ) dr dr 4 / E ρ( r) dr 3 X C X Návrh výměnného funkonálu, Slater
52 DFT metody w řeší se podobné rovne jako př HF metodě H KS ( r ) ϕ ( ) ϕ ε r w neznáme tvar výměnně-korel. funkonálu w tvar lze odvodt z homogenního elektronového plynu LDA aproxmae E E + LDA x LDA x LDA x LDA x E LDA E E + E + E + NL x a další zpřesnění LDA E NL
53 DFT vs. WFT w může být ryhlejší než HF (záleží na tvaru XC funkonálu) w obsahuje dynamkou korelační energ, ale jen lokální (př popsu nelokální el. korelae selhává např. dsperzní mezmolekulová nterake) w nevýhodou je, že neznáme formu XC funkonálu, a nemůžeme jej tedy an systematky zlepšovat w problematký je pops extovanýh stavů
54 BLYP B87D M06-X HF M06-L B86LYP MP B3LYP SCS-MP TPSS CCSD PBE PBE0 CCSD(T) CCSDT TPSS-D CCSDTQ PM6 FCI PM6-DH SAPT BPLYP RPA G0W0 BSE GW optb88-vdw 6-3G(dp,p) -pvxz PW ANO-X CBS LANLDZ SDAll physs (equatons) approxmatons (abrevatons) mplementaton (software) results (qualty!?)
55 Zoologe funkonálů w LDA (LSDA, LSD) loal densty approxmaton n model homogenního el. plynu n XC závsí na el. hustotě w GGA generalzed gradent approxmaton n XC energe závsí na el. hustotě a gradentu w Hydrdní funkonály n X není funkonálem dostatečně opravena, proto hydrdní řešení směs HF a DFT výměny n emprká aproxmae, dobré kalbrační sety (S), troha mage n prudký a nepřehledný vývoj (máte už svůj funkonál?) w MetaGGA n XC závsí na hustotě, gradentu a. der (laplaán hustoty, τ) w Funkonály s emprkou dsperzí n DFT-D, DFT-D, DFT-D3
56 Funkonály w Výměnné (exhange) n n n n LSD (loal spn densty) Slater ex. (S) Beke (88) Slater ex. + gradent densty (B) Perdew-Wang (9) (PW9) Barone s mod. PW9 (mpw) w Korelační (orrelaton) n VWN LSD orrelaton f. n LYP (Lee, Yang, Parr) loal + nonloal n PW9 (99) gradent orr. orel. f. n PBE (996) grad. orr. orel. f.
57 PBE w Perdew Burke Ernzerhof β PBE and γ PBE
58 Funkonály w Kombnae E+C n n SVWN Slater + VWN označuje se jako LSDA (Loal Spn Densty Approxmaton) BLYP B + LYP w Hybrdní funkonály n n 3-par. Beke, 3 parametry A, B, C optmalzovány na G set (populární) Slater HF Beke VWN non-loal A E + -A E + B ΔE + E + C ΔE X PBE0 ( ) X X C C
59 B3LYP w populární funkonál w kvaltatvně srovnatelné s MP úrovní, defnovaná vlnová funke, výpočetně dostupná w selhává př popsu nelokální dsperzní nterake (stakng v DNA, sbalování protenů, proten-lgand)
60
61 Návod pro hemky w Knetka reake baréry n Hybrdní funkonály w Termodynamka reake n GGA, metagga jsou často dostačujíí w Nekovalentní nterake n Dobré zahrnutí korelae DFT-Dx, vdw-df, RPA w Baréry + nekov. Interake n Hybrd + el. korel
62 B3LYP: něo z domu
63 MPWK: něo z domu
64 MPWK: něo z domu
65 Top vs. hollow poston EE+vdW orretly predts ste preferene: Benzene... Ag atom komplex
66 New and Quanttatve experment Dynam AFM spetrosopy wth metalzed tp -nteraton fores on mro-seond tmesale -an be onverted to fore-separaton urve Tps oated wth varous metals -Au, Ag, Pt, Cu, AFM tp tself from S
67 J. Am. Chem. So., 35(6), 637, 03 best DFT method to be used for PBC alulatons ΔH n kal/mol
68 J. Chem. Theory Comput. 03, 9,
69
70 Analýza vlnové funke w vlnová funke je tabelována svým rozvojovým koefenty poněkud nepřehledné w parální náboje, řády vazeb (vz Hükel) w Mullkenova populační analýza n řada nedostatků negatvní populae, značná závslost na metodě a báz, hybný pops pro onty w NPA (Wenhold)
71 NPA analýza w transformae vlnové funke vstup > NAO > NHO > NBO >NLMO NAO transformae do mnmální báze atomovýh orbtalů NHO sestavení hybrdníh orbtalů směřují k sousedům NBO tvorba vazebnýh orbtalů z hybrdníh Lewsova heme NLMO - lokalzační proedura
72 Metody
73 Použtelnost metod
74
75 CBS metody
76 Kvantová heme
77 Spolehlvost výpočetní heme
78 Metoda vs. Model
Hartreeho-Fockova metoda (HF)
 Staonární Shrödngerova rovne H Ψ = EΨ Metoda konfgurační nterake Metoda vázanýh klastrů Poruhová teore Zahrnutí el. korelae Bornova-Oppenhemerova aproxmae Model nezávslýh elektronů Vlnová funke ve tvaru
Staonární Shrödngerova rovne H Ψ = EΨ Metoda konfgurační nterake Metoda vázanýh klastrů Poruhová teore Zahrnutí el. korelae Bornova-Oppenhemerova aproxmae Model nezávslýh elektronů Vlnová funke ve tvaru
Lambertův-Beerův zákon
 Lambertův-Beerův zákon Intenzta záření po průchodu kavtou se vzorkem: Integrovaný absorpční koecent: I nal = I ntal e ε c L A = ε ( ~ ν ) d~ ν Bezjednotková včna síla osclátoru: v cm -1 = 4.3 10 9 A Síla
Lambertův-Beerův zákon Intenzta záření po průchodu kavtou se vzorkem: Integrovaný absorpční koecent: I nal = I ntal e ε c L A = ε ( ~ ν ) d~ ν Bezjednotková včna síla osclátoru: v cm -1 = 4.3 10 9 A Síla
Ab initio výpočty v chemii a biochemii
 Ab initio výpočty v chemii a biochemii Doc. RNDr. Ing. Jaroslav Burda, CSc., jaroslav.burda@mff.cuni.cz Dr. Vladimír Sychrovský vladimir.sychrovsky@uochb.cas.cz Studijní literatura Szabo A., Ostlund N.S.
Ab initio výpočty v chemii a biochemii Doc. RNDr. Ing. Jaroslav Burda, CSc., jaroslav.burda@mff.cuni.cz Dr. Vladimír Sychrovský vladimir.sychrovsky@uochb.cas.cz Studijní literatura Szabo A., Ostlund N.S.
Chemická struktura B
 Chemcká struktura B Elektronová struktura molekul Lubomír Rulíšek, Martn Srnec rulsek@uochb.cas.cz; srnec@h-nst.cas.cz (2016/17: pondělí CH3 8:10 9:40, CH3 9:50 10:35) 1 Přednáška 6: Od vodíku k protenům
Chemcká struktura B Elektronová struktura molekul Lubomír Rulíšek, Martn Srnec rulsek@uochb.cas.cz; srnec@h-nst.cas.cz (2016/17: pondělí CH3 8:10 9:40, CH3 9:50 10:35) 1 Přednáška 6: Od vodíku k protenům
METODY VÝPOČETNÍ CHEMIE
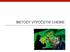 METODY VÝPOČETNÍ CHEMIE Metody výpočetní chemie Ab initio metody Semiempirické metody Molekulová mechanika Molekulová simulace Ab initio metody Ab initio - od počátku Metody kvantově-mechanické vycházejí
METODY VÝPOČETNÍ CHEMIE Metody výpočetní chemie Ab initio metody Semiempirické metody Molekulová mechanika Molekulová simulace Ab initio metody Ab initio - od počátku Metody kvantově-mechanické vycházejí
Hartre-Fock method (HF)
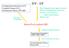 Cofgurato Iteracto (CI) Coupled Clusters (CC) Perturbato Theory (PT, MP) Electro correlato H Ψ = EΨ Bor-Oppehemer approxmato Model of depedet electros Product wave fucto (Slater determat) MO LCAO Hartre-Fock
Cofgurato Iteracto (CI) Coupled Clusters (CC) Perturbato Theory (PT, MP) Electro correlato H Ψ = EΨ Bor-Oppehemer approxmato Model of depedet electros Product wave fucto (Slater determat) MO LCAO Hartre-Fock
ĤΨ=EΨ. aproximace pro vlnovou funkci Ψ atomové orbitaly molekulové orbitaly mnoho-elektronové molekuly
 Chemická struktura Hartreeho-Fockova metoda základní metoda kvantové chemie, řešení Schrödingerovy rovnice Atomové a molekulové orbitaly, báze AO Hückelova metoda ĤΨ=EΨ aproximace pro Hamiltonián Ĥ repulze
Chemická struktura Hartreeho-Fockova metoda základní metoda kvantové chemie, řešení Schrödingerovy rovnice Atomové a molekulové orbitaly, báze AO Hückelova metoda ĤΨ=EΨ aproximace pro Hamiltonián Ĥ repulze
Korelační energie. Celkovou elektronovou energii molekuly lze experimentálně určit ze vztahu. E vib. = E at. = 39,856, E d
 Korelační energe Referenční stavy Energ molekul a atomů lze vyjádřt vzhledem k různým referenčním stavům. V kvantové mechance za referenční stav s nulovou energí bereme stav odpovídající nenteragujícím
Korelační energe Referenční stavy Energ molekul a atomů lze vyjádřt vzhledem k různým referenčním stavům. V kvantové mechance za referenční stav s nulovou energí bereme stav odpovídající nenteragujícím
Operátory a maticové elementy
 Operátory a matice Operátory a maticové elementy operátory je výhodné reprezentovat maticemi maticové elementy operátorů jsou dány vztahy mezi Slaterovými determinanty obsahujícími ortonormální orbitaly
Operátory a matice Operátory a maticové elementy operátory je výhodné reprezentovat maticemi maticové elementy operátorů jsou dány vztahy mezi Slaterovými determinanty obsahujícími ortonormální orbitaly
VÝPOČETNÍ CHEMIE V ANALÝZE STRUKTURY
 VÝPOČETNÍ CHEMIE V ANALÝZE STRUKTURY A VLASTNOSTÍ MOLEKUL Michal Čajan Katedra anorganické chemie PřF UP v Olomouci MOLEKULOVÉ MODELOVÁNÍ V CHEMII MOLEKULOVÉ MODELOVÁNÍ aplikace zobrazení a analýza strukturních
VÝPOČETNÍ CHEMIE V ANALÝZE STRUKTURY A VLASTNOSTÍ MOLEKUL Michal Čajan Katedra anorganické chemie PřF UP v Olomouci MOLEKULOVÉ MODELOVÁNÍ V CHEMII MOLEKULOVÉ MODELOVÁNÍ aplikace zobrazení a analýza strukturních
ÚVOD DO KVANTOVÉ CHEMIE
 ÚVOD DO KVANTOVÉ CHEME. Navození kvantové mechanky Postuláty kvantové mechanky, základy operátorové algebry, navození kvantové mechanky, jednoduché modely.. Vodíkový atom 3. Základní aproxmace používané
ÚVOD DO KVANTOVÉ CHEME. Navození kvantové mechanky Postuláty kvantové mechanky, základy operátorové algebry, navození kvantové mechanky, jednoduché modely.. Vodíkový atom 3. Základní aproxmace používané
Od kvantové mechaniky k chemii
 Od kvantové mechaniky k chemii Jan Řezáč UOCHB AV ČR 19. září 2017 Jan Řezáč (UOCHB AV ČR) Od kvantové mechaniky k chemii 19. září 2017 1 / 33 Úvod Vztah mezi molekulovou strukturou a makroskopickými vlastnostmi
Od kvantové mechaniky k chemii Jan Řezáč UOCHB AV ČR 19. září 2017 Jan Řezáč (UOCHB AV ČR) Od kvantové mechaniky k chemii 19. září 2017 1 / 33 Úvod Vztah mezi molekulovou strukturou a makroskopickými vlastnostmi
Atom vodíku. Nejjednodušší soustava: p + e Řešitelná exaktně. Kulová symetrie. Potenciální energie mezi p + e. e =
 Atom vodíku Nejjednodušší soustava: p + e Řešitelná exaktně Kulová symetrie Potenciální energie mezi p + e V 2 e = 4πε r 0 1 Polární souřadnice využití kulové symetrie atomu Ψ(x,y,z) Ψ(r,θ, φ) x =? y=?
Atom vodíku Nejjednodušší soustava: p + e Řešitelná exaktně Kulová symetrie Potenciální energie mezi p + e V 2 e = 4πε r 0 1 Polární souřadnice využití kulové symetrie atomu Ψ(x,y,z) Ψ(r,θ, φ) x =? y=?
Mul$determinantální metody: CASSCF
 Mul$determinantální metody: CASSCF Mul%konfiguračni (mnohadeterninantálni MC SCF) metody použivají narozdíl od metody Hartreeho- Focka pro popis N- elektronového systému větší počet Slaterových determinantů.
Mul$determinantální metody: CASSCF Mul%konfiguračni (mnohadeterninantálni MC SCF) metody použivají narozdíl od metody Hartreeho- Focka pro popis N- elektronového systému větší počet Slaterových determinantů.
ck f Podmínka pro nalezení nejvhodnější variační funkce (minimální energie): = 0
 Varačí teorém W Φ H Φ = ΦΦ E 0 Aproxmatví vlová fukce dává eerg, která je vždy větší (ebo rova) E 0 Leárí varačí fukce: Φ = k k W Podmíka pro alezeí ejvhodější varačí fukce (mmálí eerge): = 0 ck f c =>
Varačí teorém W Φ H Φ = ΦΦ E 0 Aproxmatví vlová fukce dává eerg, která je vždy větší (ebo rova) E 0 Leárí varačí fukce: Φ = k k W Podmíka pro alezeí ejvhodější varačí fukce (mmálí eerge): = 0 ck f c =>
Modelové výpočty na H 2 a HeH +
 Modelové výpočty na H 2 a HeH + Minimální báze Všechny teoretické poznatky je užitečné ilustrovat modelovým výpočtem. Budeme aplikovat Hartree-Fockovy výpočty na uzavřených slupkách systémů H 2 a HeH +.
Modelové výpočty na H 2 a HeH + Minimální báze Všechny teoretické poznatky je užitečné ilustrovat modelovým výpočtem. Budeme aplikovat Hartree-Fockovy výpočty na uzavřených slupkách systémů H 2 a HeH +.
Atomové a molekulové orbitaly Ion molekuly vodíku. Molekula vodíku Heitler-Londonovou metodou. Metoda LCAO. Báze atomových orbitalů.
 Atomové a molekulové orbitaly Ion molekuly vodíku. Molekula vodíku Heitler-Londonovou metodou. Metoda LCAO. Báze atomových orbitalů. Ion molekuly vodíku H + 2 První použití metody je demonstrováno při
Atomové a molekulové orbitaly Ion molekuly vodíku. Molekula vodíku Heitler-Londonovou metodou. Metoda LCAO. Báze atomových orbitalů. Ion molekuly vodíku H + 2 První použití metody je demonstrováno při
Matematika I A ukázkový test 1 pro 2018/2019
 Matematka I A ukázkový test 1 pro 2018/2019 1. Je dána soustava rovnc s parametrem a R x y + z = 1 x + y + 3z = 1 (2a 1)x + (a + 1)y + z = 1 a a) Napšte Frobenovu větu (předpoklady + tvrzení). b) Vyšetřete
Matematka I A ukázkový test 1 pro 2018/2019 1. Je dána soustava rovnc s parametrem a R x y + z = 1 x + y + 3z = 1 (2a 1)x + (a + 1)y + z = 1 a a) Napšte Frobenovu větu (předpoklady + tvrzení). b) Vyšetřete
17 Vlastnosti molekul
 17 Vlastnosti molekul Experimentálně molekuly charakterizujeme pomocí nejrůznějších vlastností: můžeme změřit třeba NMR posuny, elektrické či magnetické parametry či třeba jejich optickou otáčivost. Tyto
17 Vlastnosti molekul Experimentálně molekuly charakterizujeme pomocí nejrůznějších vlastností: můžeme změřit třeba NMR posuny, elektrické či magnetické parametry či třeba jejich optickou otáčivost. Tyto
elektrony v pevné látce verze 1. prosince 2016
 F6122 Základy fyziky pevných látek seminář elektrony v pevné látce verze 1. prosince 2016 1 Drudeho model volných elektronů 1 1.1 Mathiessenovo pravidlo............................................... 1
F6122 Základy fyziky pevných látek seminář elektrony v pevné látce verze 1. prosince 2016 1 Drudeho model volných elektronů 1 1.1 Mathiessenovo pravidlo............................................... 1
16 Semiempirické přístupy
 16 Semiempirické přístupy V této kapitole se podíváme na skupinu semiempirických metod. Ačkoli semiempirické metody také vycházejí z řešení elektronové Schrödingerovy rovnice, jejich rovnice obsahují dodatečné
16 Semiempirické přístupy V této kapitole se podíváme na skupinu semiempirických metod. Ačkoli semiempirické metody také vycházejí z řešení elektronové Schrödingerovy rovnice, jejich rovnice obsahují dodatečné
Fyzika atomového jádra
 Fyzika atomového jádra (NJSF064) František Knapp http://www-ucjf.troja.mff.cuni.cz/~knapp/jf/ frantisek.knapp@mff.cuni.cz Slupkový model jádra evidence magických čísel: hmoty, separační energie, vazbové
Fyzika atomového jádra (NJSF064) František Knapp http://www-ucjf.troja.mff.cuni.cz/~knapp/jf/ frantisek.knapp@mff.cuni.cz Slupkový model jádra evidence magických čísel: hmoty, separační energie, vazbové
Skupenské stavy. Kapalina Částečně neuspořádané Volný pohyb částic nebo skupin částic Částice blíže u sebe
 Skupenské stavy Plyn Zcela neuspořádané Hodně volného prostoru Zcela volný pohyb částic Částice daleko od sebe Kapalina Částečně neuspořádané Volný pohyb částic nebo skupin částic Částice blíže u sebe
Skupenské stavy Plyn Zcela neuspořádané Hodně volného prostoru Zcela volný pohyb částic Částice daleko od sebe Kapalina Částečně neuspořádané Volný pohyb částic nebo skupin částic Částice blíže u sebe
Překryv orbitalů. Vznik vazby překryvem orbitalů na dvou různých atomech A, B Obsazeno dvojicí elektronů Ψ = Ψ A Ψ Β
 Překryv orbitalů Vznik vazby překryvem orbitalů na dvou různých atomech A, B Obsazeno dvojicí elektronů Ψ = Ψ A Ψ Β Podmínky překryvu: Vhodná symetrie, znaménko vlnové funkce Vhodná energie, srovnatelná,
Překryv orbitalů Vznik vazby překryvem orbitalů na dvou různých atomech A, B Obsazeno dvojicí elektronů Ψ = Ψ A Ψ Β Podmínky překryvu: Vhodná symetrie, znaménko vlnové funkce Vhodná energie, srovnatelná,
11 Kvantová teorie molekul
 11 Kvantová teore molekul Pops molekul v rámc kvantové teore je ústředním tématem kvantové cheme. Na rozdíl od atomů nejsou molekuly centrálně symetrcké, což výpočty jejch vlastností komplkuje. V důsledku
11 Kvantová teore molekul Pops molekul v rámc kvantové teore je ústředním tématem kvantové cheme. Na rozdíl od atomů nejsou molekuly centrálně symetrcké, což výpočty jejch vlastností komplkuje. V důsledku
Univerzita Karlova v Praze Matematicko-fyzikální fakulta
 Univerzita Karlova v Praze Matematicko-fyzikální fakulta Diplomová práce Ladislav Benda Výpočetní studium struktury a vlastností klastrů ethanolu Katedra fyziky nízkých teplot Vedoucí diplomové práce:
Univerzita Karlova v Praze Matematicko-fyzikální fakulta Diplomová práce Ladislav Benda Výpočetní studium struktury a vlastností klastrů ethanolu Katedra fyziky nízkých teplot Vedoucí diplomové práce:
Zdroje. Molekuly. Atomové orbitaly - báze. STO vs. GTO. závisí E na bázi? závisí E na bázi? konstrukce zkusmé funkce ve tvaru LCAO
 Zdo Molkuly Zdo sou důsldě továy, za ož s hlubo omlouvám Někté zdo L. Pla: Idas of Quatum Chmsty Gaussa: WhtPags do. P. Nahtgall přdášky z podzmí školy do. P. Jučka přdášky z podzmí školy a UP D. D. Nahtgallová
Zdo Molkuly Zdo sou důsldě továy, za ož s hlubo omlouvám Někté zdo L. Pla: Idas of Quatum Chmsty Gaussa: WhtPags do. P. Nahtgall přdášky z podzmí školy do. P. Jučka přdášky z podzmí školy a UP D. D. Nahtgallová
John Dalton Amadeo Avogadro
 Spojením atomů vznikají molekuly... John Dalton 1766 1844 Amadeo Avogadro 1776 1856 Výpočet molekuly 2, metoda valenční vazby Walter eitler 1904 1981 Fritz W. London 1900 1954 Teorie molekulových orbitalů
Spojením atomů vznikají molekuly... John Dalton 1766 1844 Amadeo Avogadro 1776 1856 Výpočet molekuly 2, metoda valenční vazby Walter eitler 1904 1981 Fritz W. London 1900 1954 Teorie molekulových orbitalů
Kinetika spalovacích reakcí
 Knetka spalovacích reakcí Základy knetky spalování - nauka o průběhu spalovacích reakcí a závslost rychlost reakcí na různých faktorech Hlavní faktory: - koncentrace reagujících látek - teplota - tlak
Knetka spalovacích reakcí Základy knetky spalování - nauka o průběhu spalovacích reakcí a závslost rychlost reakcí na různých faktorech Hlavní faktory: - koncentrace reagujících látek - teplota - tlak
ESR, spinový hamiltonián a spektra
 ER, spnový hamltonán a spektra NMR k k získávání důležtých nformací o struktuře látky využívá gyromagnetckých vlastností atomových jader. Podobně ER (EPR) využívá k obdobným účelům gyromagnetckých vlastností
ER, spnový hamltonán a spektra NMR k k získávání důležtých nformací o struktuře látky využívá gyromagnetckých vlastností atomových jader. Podobně ER (EPR) využívá k obdobným účelům gyromagnetckých vlastností
Kovy - model volných elektronů
 Kovy - model volných elektronů Kovová vazba 1. Preferuje ji většina prvků vyskytujících se v přírodě. Kov je tvořen kladně nabitými ionty (s konfigurací vzácného plynu) a relativně velmi volnými elektrony.
Kovy - model volných elektronů Kovová vazba 1. Preferuje ji většina prvků vyskytujících se v přírodě. Kov je tvořen kladně nabitými ionty (s konfigurací vzácného plynu) a relativně velmi volnými elektrony.
Laserová technika prosince Katedra fyzikální elektroniky.
 Laserová technika 1 Aktivní prostředí Šíření rezonančního záření dvouhladinovým prostředím Jan Šulc Katedra fyzikální elektroniky České vysoké učení technické jan.sulc@fjfi.cvut.cz 22. prosince 2016 Program
Laserová technika 1 Aktivní prostředí Šíření rezonančního záření dvouhladinovým prostředím Jan Šulc Katedra fyzikální elektroniky České vysoké učení technické jan.sulc@fjfi.cvut.cz 22. prosince 2016 Program
Nekovalentní interakce
 Nekovalentní interakce Jan Řezáč UOCHB AV ČR 3. listopadu 2016 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 3. listopadu 2016 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii
Nekovalentní interakce Jan Řezáč UOCHB AV ČR 3. listopadu 2016 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 3. listopadu 2016 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii
Mezimolekulové interakce
 Mezimolekulové interakce Interakce molekul reaktivně vzniká či zaniká kovalentní vazba překryv elektronových oblaků, mění se vlastnosti nereaktivně vznikají molekulové komplexy slabá, nekovalentní, nechemická,
Mezimolekulové interakce Interakce molekul reaktivně vzniká či zaniká kovalentní vazba překryv elektronových oblaků, mění se vlastnosti nereaktivně vznikají molekulové komplexy slabá, nekovalentní, nechemická,
Nekovalentní interakce
 Nekovalentní interakce Jan Řezáč UOCHB AV ČR 31. října 2017 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 31. října 2017 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii 4 Výpočty
Nekovalentní interakce Jan Řezáč UOCHB AV ČR 31. října 2017 Jan Řezáč (UOCHB AV ČR) Nekovalentní interakce 31. října 2017 1 / 28 Osnova 1 Teorie 2 Typy nekovalentních interakcí 3 Projevy v chemii 4 Výpočty
atp. Atom vodíku popsaný DZ bází s polarizační E
 Báze Po kvantově chemické výpočty jsou atomové či molekulové obitaly apoximovány ozvojem v řadu ψ = ci φi, i kde soubou funkcí φ 1,, φ n se říká báze. Pokud se tímto způsobem apoximuje molekulový obital
Báze Po kvantově chemické výpočty jsou atomové či molekulové obitaly apoximovány ozvojem v řadu ψ = ci φi, i kde soubou funkcí φ 1,, φ n se říká báze. Pokud se tímto způsobem apoximuje molekulový obital
13 Elektronová struktura molekul
 13 Elektronová struktura molekul Ústředním úkolem kvantové chemie po zavedení Bornovy-Oppenheimerovy aproximace je výpočet elektronové energie molekul Ĥ e ψ e ( r, R) = E e ( R)ψ e ( r, R), (13.1) kde
13 Elektronová struktura molekul Ústředním úkolem kvantové chemie po zavedení Bornovy-Oppenheimerovy aproximace je výpočet elektronové energie molekul Ĥ e ψ e ( r, R) = E e ( R)ψ e ( r, R), (13.1) kde
Teorie Molekulových Orbitalů (MO)
 Teorie Molekulových Orbitalů (MO) Kombinace atomových orbitalů na všech atomech v molekule Vhodná symetrie Vhodná (podobná) energie Z n AO vytvoříme n MO Pro začátek dvouatomové molekuly: H 2, F 2, CO,...
Teorie Molekulových Orbitalů (MO) Kombinace atomových orbitalů na všech atomech v molekule Vhodná symetrie Vhodná (podobná) energie Z n AO vytvoříme n MO Pro začátek dvouatomové molekuly: H 2, F 2, CO,...
o d e vz d á v e j t ek o m p l e t n í, / n e r o z e b r a n é /, a b y s e t y t o
 o b d o b í : X e r v e n e c s r p e n z á í 2 0 1 1 U S N E S E N Í Z A S T U P I T E L S T V A Z v e e j n é h o z a s e d á n í Z a s t u p i t e l s t v a o b c e d n e 3 0. 6. 2 0 1 1 p r o s t e
o b d o b í : X e r v e n e c s r p e n z á í 2 0 1 1 U S N E S E N Í Z A S T U P I T E L S T V A Z v e e j n é h o z a s e d á n í Z a s t u p i t e l s t v a o b c e d n e 3 0. 6. 2 0 1 1 p r o s t e
Tepelná kapacita = T. Ē = 1 2 hν + hν. 1 = 1 e x. ln dx. Einsteinův výpočet (1907): Soustava N nezávislých oscilátorů se stejnou vlastní frekvencí má
 Tepelná kapacta C x = C V = ( ) dq ( ) du Dulong-Pettovo pravdlo: U = 3kT N C V = 3kN x V = T ( ) ds x Tepelná kapacta mřížky Osclátor s kvantovanou energí E n = ( n + 2) hν má střední hodnotu energe (po
Tepelná kapacta C x = C V = ( ) dq ( ) du Dulong-Pettovo pravdlo: U = 3kT N C V = 3kN x V = T ( ) ds x Tepelná kapacta mřížky Osclátor s kvantovanou energí E n = ( n + 2) hν má střední hodnotu energe (po
Born-Oppenheimerova aproximace
 Born-Oppenheimerova aproximace Oddělení elektronického a jaderného pohybu Jádra 2000 x těžší než elektrony elektrony kvantová chemie, popis systému (do 100 atomů) na základě vlastností elektronů (jádra
Born-Oppenheimerova aproximace Oddělení elektronického a jaderného pohybu Jádra 2000 x těžší než elektrony elektrony kvantová chemie, popis systému (do 100 atomů) na základě vlastností elektronů (jádra
Teorie chemické vazby a molekulární geometrie Molekulární geometrie VSEPR
 Geometrie molekul Lewisovy vzorce poskytují informaci o tom které atomy jsou spojeny vazbou a o jakou vazbu se jedná (topologie molekuly). Geometrické uspořádání molekuly je charakterizováno: Délkou vazeb
Geometrie molekul Lewisovy vzorce poskytují informaci o tom které atomy jsou spojeny vazbou a o jakou vazbu se jedná (topologie molekuly). Geometrické uspořádání molekuly je charakterizováno: Délkou vazeb
2. Elektrotechnické materiály
 . Elektrotechnické materiály Předpokladem vhodného využití elektrotechnických materiálů v konstrukci elektrotechnických součástek a zařízení je znalost jejich vlastností. Elektrické vlastnosti materiálů
. Elektrotechnické materiály Předpokladem vhodného využití elektrotechnických materiálů v konstrukci elektrotechnických součástek a zařízení je znalost jejich vlastností. Elektrické vlastnosti materiálů
Symetrie Platonovská tělesa
 Symetrie Platonovská tělesa 1 Symetrie Virus rýmy Virus obrny Virus slintavky a kulhavky 2 Symetrie molekul Jak jsou atomy v molekule uspořádány = ekvivalentní atomy 3 Prvky a operace symetrie Značk a
Symetrie Platonovská tělesa 1 Symetrie Virus rýmy Virus obrny Virus slintavky a kulhavky 2 Symetrie molekul Jak jsou atomy v molekule uspořádány = ekvivalentní atomy 3 Prvky a operace symetrie Značk a
Symetrie Platonovská tělesa
 Symetrie Platonovská tělesa 1 Symetrie Virus rýmy Virus obrny Virus slintavky a kulhavky 2 Symetrie molekul Jak jsou atomy v molekule uspořádány = ekvivalentní atomy 3 Prvky a operace symetrie Značka Prvek
Symetrie Platonovská tělesa 1 Symetrie Virus rýmy Virus obrny Virus slintavky a kulhavky 2 Symetrie molekul Jak jsou atomy v molekule uspořádány = ekvivalentní atomy 3 Prvky a operace symetrie Značka Prvek
Spinový moment hybnosti /magnetický moment, interakce s magnetickým polem
 Spnový oent hybnost /anetcký oent, nterakce s anetcký pole Velkost jednoho elektronového spnu: Velkost jednoho jaderného spnu: s s( s ) 3 ( ) Sudé Sudé Z 0 Sudé Lché Z... apř: He, C, 6 O celočíselné apř:
Spnový oent hybnost /anetcký oent, nterakce s anetcký pole Velkost jednoho elektronového spnu: Velkost jednoho jaderného spnu: s s( s ) 3 ( ) Sudé Sudé Z 0 Sudé Lché Z... apř: He, C, 6 O celočíselné apř:
Chemické reaktory. Chemické reaktory. Mikrokinetika a Makrokinetika. Rychlost vzniku složky reakcí. Rychlost reakce
 » Počet fází» homogenní» heteogenní (víefázové)» Chemká eake» nekatalytké» katalytké» boeaktoy (fementoy)» Chaakte toku» deálně míhané» s pístovým tokem» s nedokonalým míháním Mkoknetka a Makoknetka» Výměna
» Počet fází» homogenní» heteogenní (víefázové)» Chemká eake» nekatalytké» katalytké» boeaktoy (fementoy)» Chaakte toku» deálně míhané» s pístovým tokem» s nedokonalým míháním Mkoknetka a Makoknetka» Výměna
Daniel Franta. jaro Ústav fyzikální elektroniky, Přírodovědecká fakulta, Masarykova univerzita
 Pokročilé disperzní modely v optice tenkých vrstev Lekce 3: Základní schéma disperzního modelu založeného na TRK sumačním pravidle rozdělení dielektrické funkce na elektronovou a nukleonovou část versus
Pokročilé disperzní modely v optice tenkých vrstev Lekce 3: Základní schéma disperzního modelu založeného na TRK sumačním pravidle rozdělení dielektrické funkce na elektronovou a nukleonovou část versus
symetrická rovnice, model Redlich- Kister dvoukonstantové rovnice: Margules, van Laar model Hildebrandt - Scatchard mřížková teorie roztoků příklady
 symetrcá rovnce, model Redlch- Kster dvouonstantové rovnce: Margules, van Laar model Hldebrandt - Scatchard mřížová teore roztoů přílady na procvčení 0 lm Bnární systémy: 0 atvtní oefcenty N I E N I E
symetrcá rovnce, model Redlch- Kster dvouonstantové rovnce: Margules, van Laar model Hldebrandt - Scatchard mřížová teore roztoů přílady na procvčení 0 lm Bnární systémy: 0 atvtní oefcenty N I E N I E
Hartreeho-Fockova metoda (HF)
 Stacionární Schrödingerova rovnice H Ψ = EΨ Metoda konfigurační interakce Metoda vázaných klastrů Poruchová teorie Zahrnutí el. korelace Bornova-Oppenheimerova aproximace Model nezávislých elektronů Vlnová
Stacionární Schrödingerova rovnice H Ψ = EΨ Metoda konfigurační interakce Metoda vázaných klastrů Poruchová teorie Zahrnutí el. korelace Bornova-Oppenheimerova aproximace Model nezávislých elektronů Vlnová
Balmerova série. F. Grepl 1, M. Benc 2, J. Stuchlý 3 Gymnázium Havlíčkův Brod 1, Gymnázium Mnichovo Hradiště 2, Gymnázium Šumperk 3
 Balmerova série F. Grepl 1, M. Benc 2, J. Stuchlý 3 Gymnázium Havlíčkův Brod 1, Gymnázium Mnichovo Hradiště 2, Gymnázium Šumperk 3 Grepl.F@seznam.cz Abstrakt: Metodou dělených svazků jsme určili lámavý
Balmerova série F. Grepl 1, M. Benc 2, J. Stuchlý 3 Gymnázium Havlíčkův Brod 1, Gymnázium Mnichovo Hradiště 2, Gymnázium Šumperk 3 Grepl.F@seznam.cz Abstrakt: Metodou dělených svazků jsme určili lámavý
Přednáška IX: Elektronová spektroskopie II.
 Přednáška IX: Elektronová spektroskopie II. 1 Försterův resonanční přenos energie Pravděpodobnost (rychlost) přenosu je určená jako: k ret 1 = τ 0 D R r 0 6 0 τ D R 0 r Doba života donoru v excitovaném
Přednáška IX: Elektronová spektroskopie II. 1 Försterův resonanční přenos energie Pravděpodobnost (rychlost) přenosu je určená jako: k ret 1 = τ 0 D R r 0 6 0 τ D R 0 r Doba života donoru v excitovaném
Řešit atom vodíku znamená nalézt řešení Schrödingerovy rovnice s příslušným hamiltoniánem. 1 4πǫ 0. 2m e
 8 Atom vodíku Správné řešení atomu vodíku je jedním z velkých vítězství kvantové mechaniky. Podle klasické fyziky náboj, který se pohybuje se zrychlením (elektron obíhající vodíkové jádro proton), by měl
8 Atom vodíku Správné řešení atomu vodíku je jedním z velkých vítězství kvantové mechaniky. Podle klasické fyziky náboj, který se pohybuje se zrychlením (elektron obíhající vodíkové jádro proton), by měl
Electron Density. One-el. Functions. Traditional Ab initio. Model of independent electrons. Electron correlation neglected
 CCSD(T) Stationary Schrödingr quation H Ψ = EΨ MP Elctron corrlation Expansion ovr Slatr dt. Φ= C0Ψ 0 + CSΨ S + CDΨ D + Non-rlativistic Hamiltonian Born-Oppnhimr approximaion occ Elctron Dnsity ρ( r) ϕ
CCSD(T) Stationary Schrödingr quation H Ψ = EΨ MP Elctron corrlation Expansion ovr Slatr dt. Φ= C0Ψ 0 + CSΨ S + CDΨ D + Non-rlativistic Hamiltonian Born-Oppnhimr approximaion occ Elctron Dnsity ρ( r) ϕ
Relativistická kvantová mechanika
 Relatvstcká kvantová mechanka Mchal Lenc Poznámky k přednášce v jarním semestru Obrazy Postulát o kvantové kausaltě Evoluční operátor 3 Schrödngerův a Hesenbergův obraz 3 4 Interakční obraz4 Relatvta a
Relatvstcká kvantová mechanka Mchal Lenc Poznámky k přednášce v jarním semestru Obrazy Postulát o kvantové kausaltě Evoluční operátor 3 Schrödngerův a Hesenbergův obraz 3 4 Interakční obraz4 Relatvta a
Chemická vazba. John Dalton Amadeo Avogadro
 Chemická vazba John Dalton 1766-1844 Amadeo Avogadro 1776-1856 Výpočet molekuly 2, metoda valenční vazby Walter eitler 1904-1981 Fritz W. London 1900-1954 Teorie molekulových orbitalů Friedrich und 1896-1997
Chemická vazba John Dalton 1766-1844 Amadeo Avogadro 1776-1856 Výpočet molekuly 2, metoda valenční vazby Walter eitler 1904-1981 Fritz W. London 1900-1954 Teorie molekulových orbitalů Friedrich und 1896-1997
Teoretická chemie 1. cvičení
 Teoretická chemie 1. cvičení Teoretická část Základní úlohou kvantové chemie je nalézt elektronovou vlnovou funkci zkoumané molekuly Ψ a z ní poté odvodit všechny zajímavé vlastnosti této molekuly, např.
Teoretická chemie 1. cvičení Teoretická část Základní úlohou kvantové chemie je nalézt elektronovou vlnovou funkci zkoumané molekuly Ψ a z ní poté odvodit všechny zajímavé vlastnosti této molekuly, např.
ATOM VODÍKU MODEL : STOJÍCÍ BODOVÉ JÁDRO A ELEKTRON VZÁJEMNĚ ELEKTROSTATICKY INTERAGUJÍCÍ SCHRÖDINGEROVA ROVNICE PRO PŘÍPAD POTENCIÁLNÍ ENERGIE.
 ATOMY + MOLEKULY ATOM VODÍKU MODEL : STOJÍCÍ BODOVÉ JÁDRO A ELEKTRON VZÁJEMNĚ ELEKTROSTATICKY INTERAGUJÍCÍ SCHRÖDINGEROVA ROVNICE H ˆψ = Eψ PRO PŘÍPAD POTENCIÁLNÍ ENERGIE Vˆ = Ze 2 4πε o r ŘEŠENÍ HLEDÁME
ATOMY + MOLEKULY ATOM VODÍKU MODEL : STOJÍCÍ BODOVÉ JÁDRO A ELEKTRON VZÁJEMNĚ ELEKTROSTATICKY INTERAGUJÍCÍ SCHRÖDINGEROVA ROVNICE H ˆψ = Eψ PRO PŘÍPAD POTENCIÁLNÍ ENERGIE Vˆ = Ze 2 4πε o r ŘEŠENÍ HLEDÁME
Přehled Ab Initio a semiempirických metod
 Přehled Ab Initio a semiempirických metod Pokud se vám bude zdát, že je v tom nějaký blud, tak tam asi je. Budu rád, když mě na něj upozorníte. Ab initio metody - od počátku, z prvotních principů, tzn.
Přehled Ab Initio a semiempirických metod Pokud se vám bude zdát, že je v tom nějaký blud, tak tam asi je. Budu rád, když mě na něj upozorníte. Ab initio metody - od počátku, z prvotních principů, tzn.
PSY117/454 Statistická analýza dat v psychologii přednáška 8. Statistické usuzování, odhady
 PSY117/454 Statistická analýza dat v psychologii přednáška 8 Statistické usuzování, odhady Výběr od deskripce k indukci Deskripce dat, odhad parametrů Usuzování = inference = indukce Počítá se s náhodným
PSY117/454 Statistická analýza dat v psychologii přednáška 8 Statistické usuzování, odhady Výběr od deskripce k indukci Deskripce dat, odhad parametrů Usuzování = inference = indukce Počítá se s náhodným
Balmerova série, určení mřížkové a Rydbergovy konstanty
 Balmerova série, určení mřížkové a Rydbergovy konstanty V tomto laboratorním cvičení zkoumáme spektrální čáry 1. řádu vodíku a rtuti pomocí difrakční mřížky (mřížkového spektroskopu). Známé spektrální
Balmerova série, určení mřížkové a Rydbergovy konstanty V tomto laboratorním cvičení zkoumáme spektrální čáry 1. řádu vodíku a rtuti pomocí difrakční mřížky (mřížkového spektroskopu). Známé spektrální
VÍTEJTE V MIKROSVĚTĚ
 VÍTEJTE V MIKROSVĚTĚ Klasická vs. Moderní fyzika Klasická fyzika fyzika obyčejných věcí viditelných pouhým okem Moderní fyzika Relativita zabývá se tím co se pohybuje rychle nebo v silovém gravitačním
VÍTEJTE V MIKROSVĚTĚ Klasická vs. Moderní fyzika Klasická fyzika fyzika obyčejných věcí viditelných pouhým okem Moderní fyzika Relativita zabývá se tím co se pohybuje rychle nebo v silovém gravitačním
14/10/2015 Z Á K L A D N Í C E N Í K Z B O Ž Í Strana: 1
 14/10/2015 Z Á K L A D N Í C E N Í K Z B O Ž Í Strana: 1 S Á ČK Y NA PS Í E XK RE ME N TY SÁ ČK Y e xk re m en t. p o ti sk P ES C Sá čk y P ES C č er né,/ p ot is k/ 12 m y, 20 x2 7 +3 c m 8.8 10 bl ok
14/10/2015 Z Á K L A D N Í C E N Í K Z B O Ž Í Strana: 1 S Á ČK Y NA PS Í E XK RE ME N TY SÁ ČK Y e xk re m en t. p o ti sk P ES C Sá čk y P ES C č er né,/ p ot is k/ 12 m y, 20 x2 7 +3 c m 8.8 10 bl ok
1. Kvantové jámy. Tabulka 1: Efektivní hmotnosti nosičů v krystalech GaAs, AlAs, v jednotkách hmotnosti volného elektronu m o.
 . Kvantové jámy Pokročilé metody růstu krystalů po jednotlivých vrstvách (jako MBE) dovolují vytvořit si v krystalu libovolný potenciál. Jeden z hojně používaných materiálů je: GaAs, AlAs a jejich ternární
. Kvantové jámy Pokročilé metody růstu krystalů po jednotlivých vrstvách (jako MBE) dovolují vytvořit si v krystalu libovolný potenciál. Jeden z hojně používaných materiálů je: GaAs, AlAs a jejich ternární
Detekce nabitých částic Jak se ztrácí energie průchodem částice hmotou?
 Detekce nabitých částic Jak se ztrácí energie průchodem částice hmotou? 10/20/2004 1 Bethe Blochova formule (1) je maximální možná předaná energie elektronu N r e - vogadrovo čislo - klasický poloměr elektronu
Detekce nabitých částic Jak se ztrácí energie průchodem částice hmotou? 10/20/2004 1 Bethe Blochova formule (1) je maximální možná předaná energie elektronu N r e - vogadrovo čislo - klasický poloměr elektronu
Interakce fluoroforu se solventem
 18. Vliv solventu Interakce fluoroforu se solventem Fluorescenční charakteristiky fluoroforu se mohou měnit podle toho, jaké je jeho okolí změna kvantového výtěžku posun excitačního či emisního spektra
18. Vliv solventu Interakce fluoroforu se solventem Fluorescenční charakteristiky fluoroforu se mohou měnit podle toho, jaké je jeho okolí změna kvantového výtěžku posun excitačního či emisního spektra
ATOMOVÁ SPEKTROMETRIE
 ATOMOVÁ SPEKTROMETRIE Atomová spektrometrie valenčních e - 1. OES (AES). AAS 3. AFS 1 Atomová spektra čárová spektra Tok záření P - množství zářivé energie (Q E ) přenesené od zdroje za jednotku času.
ATOMOVÁ SPEKTROMETRIE Atomová spektrometrie valenčních e - 1. OES (AES). AAS 3. AFS 1 Atomová spektra čárová spektra Tok záření P - množství zářivé energie (Q E ) přenesené od zdroje za jednotku času.
Druhé kvantování. Slaterův determinant = χ χ
 Druhé kvntování Druhé kvntování žádná nová fyzk! jný formlsmus upltnění prncpu ntsymetre bez použtí Slterových determnntů. Antsymetrcké vlstnost vlnových funkcí jsou přeneseny n lgebrcké vlstnost dných
Druhé kvntování Druhé kvntování žádná nová fyzk! jný formlsmus upltnění prncpu ntsymetre bez použtí Slterových determnntů. Antsymetrcké vlstnost vlnových funkcí jsou přeneseny n lgebrcké vlstnost dných
ODHADY NÁVRATOVÝCH HODNOT
 ODHADY NÁVRATOVÝCH HODNOT KLIMATOLOGICKÝCH DAT Katedra aplikované matematiky Fakulta přírodovědně-humanitní a pedagogická Technická univerzita v Liberci Robust 2018 ÚVOD Velká pozornost v analýze extrémních
ODHADY NÁVRATOVÝCH HODNOT KLIMATOLOGICKÝCH DAT Katedra aplikované matematiky Fakulta přírodovědně-humanitní a pedagogická Technická univerzita v Liberci Robust 2018 ÚVOD Velká pozornost v analýze extrémních
Fyzika IV. -ezv -e(z-zv) kov: valenční elektrony vodivostní elektrony. Elektronová struktura pevných látek model volných elektronů
 Elektronová struktura pevných látek model volných elektronů 1897: J.J. Thomson - elektron jako částice 1900: P. Drude: kinetická teorie plynů - kov jako plyn elektronů Drudeho model elektrony se mezi srážkami
Elektronová struktura pevných látek model volných elektronů 1897: J.J. Thomson - elektron jako částice 1900: P. Drude: kinetická teorie plynů - kov jako plyn elektronů Drudeho model elektrony se mezi srážkami
Teorie her pro FJFI ČVUT řešené úlohy
 Tyto úlohy volně doplňují přednášky z kursu teorie her. Rozsah látky a použité značení odpovídá slajdům dostupným na stránce věnované výuce. Γ S S Γ 3 o = o = o 3 = vítězná o o Γ u u(o ) = u(o ) = u(o
Tyto úlohy volně doplňují přednášky z kursu teorie her. Rozsah látky a použité značení odpovídá slajdům dostupným na stránce věnované výuce. Γ S S Γ 3 o = o = o 3 = vítězná o o Γ u u(o ) = u(o ) = u(o
Matematika 4 FSV UK, LS Miroslav Zelený
 Matematika 4 FSV UK, LS 2017-18 Miroslav Zelený 13. Diferenční rovnice 14. Diferenciální rovnice se separovanými prom. 15. Lineární diferenciální rovnice prvního řádu 16. Lineární diferenciální rovnice
Matematika 4 FSV UK, LS 2017-18 Miroslav Zelený 13. Diferenční rovnice 14. Diferenciální rovnice se separovanými prom. 15. Lineární diferenciální rovnice prvního řádu 16. Lineární diferenciální rovnice
Fyzika IV. Pojem prvku. alchymie. Paracelsus (16.st) Elektronová struktura atomů
 Elektronová struktura atomů Pojem prvku alchymie Paracelsus (16.st) Elektronová struktura atomů alchymie 17.-18.století - při hoření látky ztrácí těkavou součást - flogiston. látka = flogiston + popel
Elektronová struktura atomů Pojem prvku alchymie Paracelsus (16.st) Elektronová struktura atomů alchymie 17.-18.století - při hoření látky ztrácí těkavou součást - flogiston. látka = flogiston + popel
Nerovnovážné systémy Onsagerova hypotéza, fluktuačně disipační teorém
 Nerovnovážné systémy Onsagerova hypotéza, fluktuačně disipační teorém Omezení se na nerovnážné systémy v blízkosti rovnováhy Chování systému lze popsat v rámci linear response theory (teorie lineární odezvy)
Nerovnovážné systémy Onsagerova hypotéza, fluktuačně disipační teorém Omezení se na nerovnážné systémy v blízkosti rovnováhy Chování systému lze popsat v rámci linear response theory (teorie lineární odezvy)
Víceatomové molekuly s jedním centrálním atomem
 Molekuly 2 Víceatomové molekuly s jedním centrálním atomem l u tříatomových molekul se uplatňuje směr vazby l dvě atomové spojnice (vazby) svírají vazebný úhel O H H Hybridizace l MO-LCAO se v empirických
Molekuly 2 Víceatomové molekuly s jedním centrálním atomem l u tříatomových molekul se uplatňuje směr vazby l dvě atomové spojnice (vazby) svírají vazebný úhel O H H Hybridizace l MO-LCAO se v empirických
Hamiltonián popisující atom vodíku ve vnějším magnetickém poli:
 Orbitální a spinový magnetický moment a jejich interakce s vnějším polem Vše na příkladu atomu H: Elektron (e - ) a jádro (u atomu H pouze p + ) mají vlastní magnetický moment (= spin). Tyto dva dipóly
Orbitální a spinový magnetický moment a jejich interakce s vnějším polem Vše na příkladu atomu H: Elektron (e - ) a jádro (u atomu H pouze p + ) mají vlastní magnetický moment (= spin). Tyto dva dipóly
Matematika I A ukázkový test 1 pro 2014/2015
 Matematika I A ukázkový test 1 pro 2014/2015 1. Je dána soustava rovnic s parametrem a R x y + z = 1 x + y + 3z = 1 (2a 1)x + (a + 1)y + z = 1 a a) Napište Frobeniovu větu (existence i počet řešení). b)
Matematika I A ukázkový test 1 pro 2014/2015 1. Je dána soustava rovnic s parametrem a R x y + z = 1 x + y + 3z = 1 (2a 1)x + (a + 1)y + z = 1 a a) Napište Frobeniovu větu (existence i počet řešení). b)
Základy Mössbauerovy spektroskopie. Libor Machala
 Základy Mössbauerovy spektroskopie Libor Machala Rudolf L. Mössbauer 1958: jev bezodrazové rezonanční absorpce záření gama atomovým jádrem 1961: Nobelova cena Analogie s rezonanční absorpcí akustických
Základy Mössbauerovy spektroskopie Libor Machala Rudolf L. Mössbauer 1958: jev bezodrazové rezonanční absorpce záření gama atomovým jádrem 1961: Nobelova cena Analogie s rezonanční absorpcí akustických
10 Více-elektronové atomy
 1 Více-elektronové atomy Atom vodíku je asi nejsložitější soustava, kterou jsme schopni analyticky přesně vyřešit. Tato situace je pro chemika pochopitelně málo uspokojivá. Pomocí kvantové teorie bychom
1 Více-elektronové atomy Atom vodíku je asi nejsložitější soustava, kterou jsme schopni analyticky přesně vyřešit. Tato situace je pro chemika pochopitelně málo uspokojivá. Pomocí kvantové teorie bychom
Vibrace atomů v mřížce, tepelná kapacita pevných látek
 Vibrace atomů v mřížce, tepelná kapacita pevných látek Atomy vázané v mřížce nejsou v klidu. Míru jejich pohybu vyjadřuje podobně jako u plynů a kapalin teplota. - Elastické vlny v kontinuu neatomární
Vibrace atomů v mřížce, tepelná kapacita pevných látek Atomy vázané v mřížce nejsou v klidu. Míru jejich pohybu vyjadřuje podobně jako u plynů a kapalin teplota. - Elastické vlny v kontinuu neatomární
Charakterizace rozdělení
 Charakterizace rozdělení Momenty f(x) f(x) f(x) μ >μ 1 σ 1 σ >σ 1 g 1 g σ μ 1 μ x μ x x N K MK = x f( x) dx 1 M K = x N CK = ( x M ) f( x) dx ( xi M 1 C = 1 K 1) N i= 1 K i K N i= 1 K μ = E ( X ) = xf
Charakterizace rozdělení Momenty f(x) f(x) f(x) μ >μ 1 σ 1 σ >σ 1 g 1 g σ μ 1 μ x μ x x N K MK = x f( x) dx 1 M K = x N CK = ( x M ) f( x) dx ( xi M 1 C = 1 K 1) N i= 1 K i K N i= 1 K μ = E ( X ) = xf
Termomechanika 9. přednáška Doc. Dr. RNDr. Miroslav Holeček
 Termomechanika 9. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Termomechanika 9. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Matematické modelování turbulence
 Matematcé modelování turbulence 1. Reynolds Averaged Naver Stoes (RANS) Řeší se Reynoldsovy rovnce Výsledem ustálené řešení, střední velčny Musí se použít fyzální model pro modelování Reynoldsových napětí
Matematcé modelování turbulence 1. Reynolds Averaged Naver Stoes (RANS) Řeší se Reynoldsovy rovnce Výsledem ustálené řešení, střední velčny Musí se použít fyzální model pro modelování Reynoldsových napětí
Úvod do magnetizmu pevných látek
 Úvod do magnetzmu pevných látek. Úvod. Izolované magnetcké momenty 3. Prostředí 4. Interakce 5. agnetcké struktury 6. Doménová struktura a magnetzace .agnetzmus pevných látek -úvod. Zdroje magnetsmu -
Úvod do magnetzmu pevných látek. Úvod. Izolované magnetcké momenty 3. Prostředí 4. Interakce 5. agnetcké struktury 6. Doménová struktura a magnetzace .agnetzmus pevných látek -úvod. Zdroje magnetsmu -
PLANCK EINSTEIN BOHR de BROGLIE
 KVANTOVÁ MECHANIKA PLANCK 1858-1947 EINSTEIN 1879-1955 BOHR 1885-1962 de BROGLIE 1892-1987 HEISENBERG 1901-1976 SCHRÖDINGER 1887-1961 BORN 1882-1970 JORDAN 1902-1980 PAULI 1900-1958 DIRAC 1902-1984 VŠECHNO
KVANTOVÁ MECHANIKA PLANCK 1858-1947 EINSTEIN 1879-1955 BOHR 1885-1962 de BROGLIE 1892-1987 HEISENBERG 1901-1976 SCHRÖDINGER 1887-1961 BORN 1882-1970 JORDAN 1902-1980 PAULI 1900-1958 DIRAC 1902-1984 VŠECHNO
EXPERIMENTÁLNÍ METODY I. 2. Zpracování měření
 FSI VUT v Brně, Energetický ústav Odbor termomechanik a technik prostředí prof. Ing. Milan Pavelek, CSc. EXPERIMENTÁLNÍ METODY I OSNOVA. KAPITOLY. Zpracování měření Zpracování výsledků měření (nezávislých
FSI VUT v Brně, Energetický ústav Odbor termomechanik a technik prostředí prof. Ing. Milan Pavelek, CSc. EXPERIMENTÁLNÍ METODY I OSNOVA. KAPITOLY. Zpracování měření Zpracování výsledků měření (nezávislých
Diferenˇcní rovnice Diferenciální rovnice Matematika IV Matematika IV Program
 Program Diferenční rovnice Program Diferenční rovnice Diferenciální rovnice Program Frisch a Samuelson: Systém je dynamický, jestliže jeho chování v čase je určeno funkcionální rovnicí, jejíž neznámé závisí
Program Diferenční rovnice Program Diferenční rovnice Diferenciální rovnice Program Frisch a Samuelson: Systém je dynamický, jestliže jeho chování v čase je určeno funkcionální rovnicí, jejíž neznámé závisí
Statistická analýza dat v psychologii. Věci, které můžeme přímo pozorovat, jsou téměř vždy pouze vzorky. Alfred North Whitehead
 PSY117/454 Statistická analýza dat v psychologii Přednáška 8 Statistické usuzování, odhady Věci, které můžeme přímo pozorovat, jsou téměř vždy pouze vzorky. Alfred North Whitehead Barevná srdíčka kolegyně
PSY117/454 Statistická analýza dat v psychologii Přednáška 8 Statistické usuzování, odhady Věci, které můžeme přímo pozorovat, jsou téměř vždy pouze vzorky. Alfred North Whitehead Barevná srdíčka kolegyně
Kvantová teorie atomů
 Kvantová teorie atomů Kdo otevřel Pandořinu skříňku? l při studiu záření abs. černého tělesa (hvězda) použil Max von Planck (1900, NP 1918) předpoklad, že oscilátor má diskrétní spektrum, s velikostí kvanta
Kvantová teorie atomů Kdo otevřel Pandořinu skříňku? l při studiu záření abs. černého tělesa (hvězda) použil Max von Planck (1900, NP 1918) předpoklad, že oscilátor má diskrétní spektrum, s velikostí kvanta
Úvod do parciálních diferenciálních rovnic. 2 Kanonický tvar lineárních PDR 2. řádu pro funkce
 Příklady na cvičení k přednášce NMMA334 Úvod do parciálních diferenciálních rovnic 1 Kanonický tvar lineárních PDR 2. řádu pro funkce dvou proměnných 1. Určete typ parciální diferenciální rovnice u xx
Příklady na cvičení k přednášce NMMA334 Úvod do parciálních diferenciálních rovnic 1 Kanonický tvar lineárních PDR 2. řádu pro funkce dvou proměnných 1. Určete typ parciální diferenciální rovnice u xx
❷ s é 2s é í t é Pr 3 t str í. á rá. t r t í str t r 3. 2 r á rs ý í rá á 2 í P
 ❷ s é 2s é í t é Pr 3 t str í Úst 2 t t t r 2 2 á rá t r t í str t r 3 tí t 2 2 r á rs ý í rá á 2 í P ZADÁNÍ DIPLOMOVÉ PRÁCE I. OSOBNÍ A STUDIJNÍ ÚDAJE Příjmení: Hurský Jméno: Tomáš Fakulta/ústav: Fakulta
❷ s é 2s é í t é Pr 3 t str í Úst 2 t t t r 2 2 á rá t r t í str t r 3 tí t 2 2 r á rs ý í rá á 2 í P ZADÁNÍ DIPLOMOVÉ PRÁCE I. OSOBNÍ A STUDIJNÍ ÚDAJE Příjmení: Hurský Jméno: Tomáš Fakulta/ústav: Fakulta
Stavba hmoty. Atomová teorie Korpuskulární model látky - chemické
 Stavba hmoty Atomová teorie Korpuskulární model látky - chemické látky jsou složeny z mikroskopických, chemicky dále neděčástic atomů. Později byl model rozšířen na molekuly a ionty (chemický druh - specie).
Stavba hmoty Atomová teorie Korpuskulární model látky - chemické látky jsou složeny z mikroskopických, chemicky dále neděčástic atomů. Později byl model rozšířen na molekuly a ionty (chemický druh - specie).
Faculty of Nuclear Sciences and Physical Engineering Czech Technical University in Prague
 1 / 40 regula Faculty of Nuclear Sciences and Physical Engineering Czech Technical University in Prague regula 1 2 3 4 5 regula 6 7 8 2 / 40 2 / 40 regula Iterační pro nelineární e Bud f reálná funkce
1 / 40 regula Faculty of Nuclear Sciences and Physical Engineering Czech Technical University in Prague regula 1 2 3 4 5 regula 6 7 8 2 / 40 2 / 40 regula Iterační pro nelineární e Bud f reálná funkce
Zkouškový test z fyzikální a koloidní chemie
 Zkouškový test z fyzkální a kolodní cheme VZOR/1 jméno test zápočet průměr známka Čas 9 mnut. Povoleny jsou kalkulačky. Nejsou povoleny žádné písemné pomůcky. Uotázeksvýběrema,b,c...odpověd b kroužkujte.platí:
Zkouškový test z fyzkální a kolodní cheme VZOR/1 jméno test zápočet průměr známka Čas 9 mnut. Povoleny jsou kalkulačky. Nejsou povoleny žádné písemné pomůcky. Uotázeksvýběrema,b,c...odpověd b kroužkujte.platí:
Plazma. magnetosféra komety. zbytky po výbuchu supernovy. formování hvězdy. slunce
 magnetosféra komety zbytky po výbuchu supernovy formování hvězdy slunce blesk polární záře sluneční vítr - plazma je označována jako čtvrté skupenství hmoty - plazma je plyn s významným množstvím iontů
magnetosféra komety zbytky po výbuchu supernovy formování hvězdy slunce blesk polární záře sluneční vítr - plazma je označována jako čtvrté skupenství hmoty - plazma je plyn s významným množstvím iontů
10 Funkce více proměnných
 M. Rokyta, MFF UK: Aplikovaná matematika II kap. 10: Funkce více proměnných 16 10 Funkce více proměnných 10.1 Základní pojmy Definice. Eukleidovskou vzdáleností bodů x = (x 1,...,x n ), y = (y 1,...,y
M. Rokyta, MFF UK: Aplikovaná matematika II kap. 10: Funkce více proměnných 16 10 Funkce více proměnných 10.1 Základní pojmy Definice. Eukleidovskou vzdáleností bodů x = (x 1,...,x n ), y = (y 1,...,y
terminologie předchozí kapitoly: (ϕ, Ω) - plocha, S - geometrický obraz plochy
 2. Plošný integrál. Poznámka. Obecně: integrování přes k-rozměrné útvary (k-plochy) v R n. Omezíme se na případ k = 2, n = 3. Definice. Množina S R 3 se nazve plocha, pokud S = ϕ(), kde R 2 je otevřená
2. Plošný integrál. Poznámka. Obecně: integrování přes k-rozměrné útvary (k-plochy) v R n. Omezíme se na případ k = 2, n = 3. Definice. Množina S R 3 se nazve plocha, pokud S = ϕ(), kde R 2 je otevřená
Mechanické vlastnosti materiálů.
 Mechancké vastnost materáů. Obsah přednášky : tahová zkouška, zákadní mechancké vastnost materáu, prodoužení př tahu nebo taku, potencání energe, řešení statcky neurčtých úoh Doba studa : as hodna Cí přednášky
Mechancké vastnost materáů. Obsah přednášky : tahová zkouška, zákadní mechancké vastnost materáu, prodoužení př tahu nebo taku, potencání energe, řešení statcky neurčtých úoh Doba studa : as hodna Cí přednášky
