Aflibercept v současné léčbě solidních nádorů
|
|
|
- Helena Horáková
- před 7 lety
- Počet zobrazení:
Transkript
1 Aflibercept v současné léčbě solidních nádorů doc. MUDr. Luboš Holubec, Ph.D., MBA 1,2 ; MUDr. Václav Liška, Ph.D. 2 ; prof. MUDr. Jindřich Fínek, Ph.D. 1 1 Radioterapeutická a onkologická klinika, FN a LF v Plzni, UK v Praze, 2 Biomedicínské centrum, LF v Plzni, UK v Praze Souhrn Holubec L, Liška V.. Remedia 2014; 24: V souhrnném článku autoři podrobně popisují cílený biologický lék blokátor angiogeneze aflibercept (VEGF trap). V přehledném sdělení jsou uvedeny chemické a fyzikální vlastnosti afliberceptu, mechanismus účinku na molekulární úrovni, farmakodynamika a farmakokinetika. Dále se autoři zabývají potenciálním klinickým významem a postavením tohoto nového přípravku ve spektru současných protinádorových léků, a to především u metastatického kolorektálního karcinomu (mcrc), kde bylo dosaženo nejlepších výsledků. V článku nechybí popis bezpečnostního profilu léku, jeho možné nežádoucí účinky a z toho vyplývající indikace a kontraindikace. Aflibercept představuje jako nový blokátor angiogeneze další možnosti účinné cílené protinádorové léčby, zejména v kombinaci s režimem FOLFIRI u nemocných s pokročilým mcrc, kteří jsou rezistentní na léčbu režimem obsahujícím oxaliplatinu nebo u nich po této léčbě došlo k progresi onemocnění. Klíčová slova: aflibercept angiogeneze cílená léčba kolorektální karcinom VEGF trap. Summary Holubec L, Liska V. Aflibercept in the current treatment of solid tumors. Remedia 2014; 24: In general, the authors describe in detail the targeted biological drug blocking angiogenesis aflibercept (VEGF trap). The review article describes the chemical and physical properties of aflibercept, the mechanism of action at the molecular level, pharmacodynamics and pharmacokinetics. Furthermore, the authors deal with potential clinical importance and status of this new product in the spectrum of current anticancer drugs, especially in metastatic colorectal cancer (mcrc), where it achieved the best results. This review article also includes a description of the safety profile of the drug, its possible adverse effects and the resulting indications and contraindications. As a new angiogenesis blocker, aflibercept represents further possibilities of effective targeted anticancer therapy, particularly in combination with FOLFIRI regimen for patients with advanced mcrc who are resistant to treatment regimen containing oxaliplatin, progression of the disease has occurred after this treatment. Key words: aflibercept angiogenesis targeted therapy colorectal cancer VEGF trap. Úvod Česká republika zaujímá v celosvětových statistikách přední místo ve výskytu kolorektálního karcinomu (colorectal cancer, CRC). Z hlediska incidence jsme v Evropě na třetím místě, celosvětově na místě pátém [1]. Nepříznivý je fakt, že více než 50 % nových pacientů s CRC je diagnostikováno v pokročilém stadiu onemocnění (stadium III a IV), což významně zhoršuje prognózu pacientů a dosažené výsledky léčby. U poloviny všech nemocných s CRC se v průběhu onemocnění objeví vzdálené metastázy vyžadující systémovou protinádorovou léčbu [2]. Základními chemoterapeutickými režimy v léčbě metastatického kolorektálního karcinomu (metastatic colorectal cancer, mcrc) jsou FOLFOX (oxaliplatina v kombinaci s 5-fluorouracilem 5-FU a leukovorinem) a FOLFIRI (irinotekan v kombinaci s 5-FU a leukovorinem). V současné době již toto základní schéma onkologické léčby významně obohacuje tzv. cílená léčba monoklonálními protilátkami bevacizumabem, panitumumabem a cetuximabem. Tyto protilátky jsou namířeny buď proti vaskulárnímu endotelovému růstovému faktoru (VEGF bevacizumab), nebo u nemocných s divokým typem genu RAS se uplatňují monoklonální protilátky proti receptoru pro epidermální růstový faktor (anti-egfr cetuxi- mab, panitumumab). Spektrum cílené léčby pro pacienty s mcrc rozšiřují nově registrované léky regorafenib a aflibercept. Především u nemocných s mutovaným genem RAS představuje základ cílené onkologické léčby bevacizumab. Jedná se o první biologické agens, které bylo využito k blokádě angiogeneze v kombinaci s chemoterapií u nemocných s mcrc [3]. Bevacizumab je humanizovaná monoklonální protilátka, která se váže na cirkulující vaskulární endotelový růstový faktor A (vascular endothelial growth factor A, VEGF-A). Dochází tak k blokádě intracelulární signální dráhy, jejíž vedení do buněčného jádra zprostředkovává ligand VEGF-A pomocí receptorů označených jako VEGFR-1 a VEGFR-2. Tím, že bevacizumab blokuje pouze VEGF-A, může u této protilátky dojít ke vzniku nádorové rezistence navzdory faktu, že bevacizumab prokázal v klinických studiích léčebnou odpověď v první i druhé linii léčby mcrc, pokud byla provedena změna (switch) chemoterapie (FOLFOX a FOLFIRI a jejich rotace během první a druhé linie paliativní léčby). Slibným lékem léčby mcrc v kombinaci s chemoterapií režimem FOLFIRI (irinotekan/5-fu/leukovorin) u pacientů, u nichž selhala léčba obsahující oxaliplatinu, je nový blokátor angiogeneze aflibercept [4]. Farmakologická skupina Aflibercept patří do farmakoterapeutické skupiny cytostatika, jiná cytostatika, ATC kód L01XX44. Chemické a fyzikální vlastnosti Aflibercept (VEGF trap, tzn. VEGF-past ) je rekombinantní, plně humánní, solubilní fúzní protein, který se skládá z extracelulární domény lidského VEGFR-1 a VEGFR-2 a z Fc části fragmentu lidského imunoglobulinu IgG1. Aflibercept se vyrábí technologií rekombinantní DNA, a to buněčnými liniemi savčích expresních buněk získaných z ovarií křečíka čínského [5]. Následně je protilátka purifikována za pomoci standardních chromatografických a filtračních metod. Aflibercept je dimerní glykoprotein s molekulární hmotností proteinové části 97 kilodaltonů (kda), glykosylace zvyšuje celkovou molekulární hmotnost o 15 %, na hodnotu 115 kda. Roztok pro použití v onkologii je čirý, bezbarvý až světle žlutý a je hyperosmolární. Mechanismus účinku, farmakodynamika Neoangiogeneze (vznik nových cév) je nezbytnou podmínkou růstu a metastazování nádoru. VEGF je hlavním angiogenním faktorem, který je produkován nádorem od 434
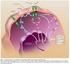
2 časného stadia jeho vývoje. Zatímco fyziologická angiogeneze je řízena celou řadou proangiogenních a antiangiogenních faktorů, cévní síť v nádoru vzniká pod převažujícím vlivem VEGF. Endotelové buňky těchto cév jsou plně závislé na trvalé stimulaci pomocí VEGF. Vaskulární endotelový růstový faktor A a B (VEGF-A, VEGF-B) a placentární růstový faktor (placental growth factor, PlGF) patří do rodiny angiogenních faktorů VEGF. VEGF-A působí prostřednictvím dvou receptorových tyrosinkináz VEGFR-1 a VEGFR-2, které jsou přítomny na povrchu endotelových buněk. PlGF a VEGF-B se vážou pouze na VEGFR-1, který je rovněž přítomen na povrchu leukocytů. VEGF-A, VEGF-B a PlGF působí jako silné mitogenní a chemotaktické faktory a jako faktory cévní permeability pro endotelové buňky. Zablokování signální dráhy VEGF-VEGFR proto vede k zániku převažující části nádorových cév. Angiogenní signální cestu je možno blokovat více způsoby [6]. Jednou z možností je vychytání VEGF volným (cirkulujícím) receptorem, respektive jeho extracelulární doménou navázanou na vhodný nosič. Takto funguje aflibercept. Aflibercept působí jako falešný (decoy) receptor, který váže VEGF-A a příbuzné ligandy PlGF a VEGF-B s vyšší afinitou, než mají přirozené receptory. Aflibercept tak blokuje všechny izoformy VEGF-A, VEGF-B a PlGF, čímž brání aktivaci VEGFR-1 a VEGFR-2 nepřítomností těchto volných ligandů, viz obr. 1. Tímto způsobem dochází ke snížené proliferaci endotelových buněk a tím k inhibici růstu nových cév, které zásobují nádor kyslíkem a živinami. Výsledkem je majoritní blokáda nádorové angiogeneze [7, 8]. Farmakokinetické vlastnosti Farmakokinetické vlastnosti afliberceptu byly odvozeny z populační farmakokinetické analýzy dat získaných od 1507 pacientů s různými typy pokročilých malignit. Farmakokinetické studie prokázaly, že poločas eliminace volného afliberceptu je 1 3 dny, poločas eliminace komplexu VEGF s navázaným afliberceptem je 18 dní. Distribuční objem volného afliberceptu v rovnovážném stavu činí přibližně 8 litrů [9]. Studie s eskalací dávkování afliberceptu byly provedeny u pacientů s pokročilým CRC v kombinaci s irinotekanem, leukovorinem a 5-FU. Eskalace afliberceptu 3 mg/kg, 4 mg/kg, 5 mg/kg a 6 mg/kg byly aplikovány jako DLTs (dose limiting toxicities, toxicity limitované dávkou). Jako doporučená byla dle DLTs stanovena dávka 4 mg/kg afliberceptu v kombinaci s chemoterapií FOLFIRI a aplikací každé dva týdny. Z hlediska biotransformace afliberceptu nebyly provedeny žádné studie, protože se jedná o protein. Lze předpokládat, že aflibercept je degradován na malé peptidy a jednotlivé aminokyseliny. Eliminace z organismu je primárně zajištěna navázáním na endogenní VEGF za vzniku stabilního inaktivního komplexu. Stejně jako u jiných velkých proteinů se předpokládá, že jak volný, tak i vázaný aflibercept bude metabolizován, byť pomaleji, dalšími biologickými mechanismy, jako je například proteolytické štěpení [9]. Proteiny s vysokou molekulární hmotností nejsou odstraňovány renální cestou, proto se očekává, že renální eliminace afliberceptu bude minimální [10]. Podání u starších pacientů Věk neměl žádný vliv na farmakokinetiku volného afliberceptu. Studie zaměřené speciálně na posouzení farmakokinetiky u starších pacientů nebyly prováděny [11]. Porucha funkce jater a ledvin U nemocných s mírnou nebo středně závažnou poruchou funkce jater nebyl zjištěn žádný vliv na clearance afliberceptu. Pro pacienty se závažnou poruchou funkce jater nejsou k dispozici žádné údaje, protože doposud nebyly provedeny žádné formální studie u těchto nemocných [11]. PlGF aflibercept VEGF-B aflibercept VEGF-A Majoritní blokáda nádorové angiogeneze Aflibercept: působí jako falešný receptor, který váže VEGF-A a příbuzné ligandy PlGF a VEGF-B s vyšší afinitou, než mají přirozené receptory působí jako lapač VEGF-A, VEGF-B a PlGF, čímž brání aktivaci VEGFR-1 a VEGFR-2 nepřítomností těchto volných ligandů blokuje signální dráhy zprostředkované aktivací VEGF receptorů. Tímto způsobem dochází ke snížené proliferaci endotelových buněk a tím k inhibici růstu nových cév, které zásobují nádor kyslíkem a živinami VEGFR-1 VEGFR-2 Obr. 1 Mechanismus účinku afliberceptu; volně podle [5, 7] Holash, et al., 2002; Wang, et al., VEGF-A vazba VEGF-A na receptor VEGFR bez přítomnosti afliberceptu VEGF vaskulární endotelový růstový faktor, vascular endothelial growth factor; VEGFR receptor pro vaskulární endotelový růstový faktor; PlGF placentární růstový faktor, placental growth factor 435
3 436 primární cíl: celkové přežití (OS) sekundární cíle: bezpříznakové přežití (PFS), léčebná odpověď (ORR), bezpečnost stratifikační faktory -- ECOG (0 vs. 1 vs. 2) -- předchozí aplikace bevacizumabu (ano/ne) randomizace 1 : 1 n = 612 n = 614 aflibercept 4 mg/kg (i.v.) v den 1 v jednohodinové infuzi ve dvoutýdenních intervalech placebo v den 1 ve dvoutýdenních intervalech + + FOLFIRI FOLFIRI režim FOLFIRI: irinotekan 180 mg/m2 i.v. 90 minut podávaný souběžně s infuzí leukovorinu 400 mg/m2 i.v. 120 minut, následně s bolusovým podáním 5-FU v dávce 400 mg/m2 i.v. následovaným kontinuální 46hodinovou infuzí 5-FU v dávce 2400 mg/m2 i.v. ve dvoutýdenních intervalech Obr. 2 Uspořádání klinické studie VELOUR; podle [21] Tabernero, et al., ECOG Eastern Cooperative Oncology Group; HR hazard ratio, poměr rizik; mcrc metastatic colorectal cancer, metastatický kolorektální karcinom; OS overall survival, celkové přežití; ORR overall response rate, celková léčebná odpověď; PFS progression-free survival, bezpříznakové přežití EM ED IA Studie fáze III Z klinických studií fáze III (dvojitě slepé, placebem kontrolované) stojí za zmínku klinická studie fáze III VANILLA u pacientů s pokročilým adenokarcinomem pankreatu v první linii paliativní léčby s rameny gemcitabin plus aflibercept versus gemcitabin plus placebo [18]; dále je to klinická studie fáze III VITAL pro druhou linii paliativní léčby pacientů s pokročilým nemalobuněčným karcinonem plic rezistentním k platině s rameny docetaxel plus aflibercept versus docetaxel plus placebo [19]. Přínosná byla rovněž klinická studie fáze III VENICE u pacientů s metastatickým kastračně rezistentním adenokarcinomem prostaty s rameny docetaxel/ prednison plus aflibercept versus docetaxel/ prednison plus placebo [20]. R bez známek choroby ve 12. měsíci 21,2 % nemocných, v rameni s léčbou afliberceptem a chemoterapií FOLFOX6 pak 25,8 % nemocných. Sekundární cíle nebyly splněny PFS dosahovala v rameni se samotnou chemoterapií 8,8 měsíce, v rameni s kombinací afliberceptu a chemoterapie FOLFOX6 pak 8,5 měsíce. Celkové léčebné odpovědi (overall response rate, ORR) bylo v rameni se samotnou chemoterapií dosaženo u 45,9 % nemocných a v rameni s kombinovanou léčbou u 49,1 % nemocných. Celkové přežití (overall survival, OS) představovalo v rameni se samotnou chemoterapií 22,3 měsíce, v kombinovaném rameni s afliberceptem 19,5 měsíce [17]. Jednalo se tedy o nesignifikantní výsledky, které prozatím vylučují podání afliberceptu v první linii. D Studie fáze II u pacientů s mcrc U pacientů s mcrc byla provedena studie fáze II AFFIRM (Study of Aflibercept a Modified FOLFOX6 as First-Line in Patients with Metastatic Colorectal Cancer). Jak je z názvu zjevné, předmětem klinické studie bylo podání afliberceptu v kombinaci s modifikovaným režimem FOLFOX6 v první linii léčby. Celkem 236 tzv. chemonaivních nemocných bylo randomizovaně rozděleno v poměru 1 : 1 do dvou ramen se samotnou chemoterapií FOLFOX6 a s kombinovanou léčbou afliberceptem a chemoterapií FOLFOX6. Zde však aflibercept nenaplnil očekávání. Primárním cílem studie byla doba přežití pacientů bez známek progrese onemocnění (progression-free survival, PFS) ve 12. měsíci po zařazení do studie. Výsledky byly následující: v rameni se samotnou chemoterapií FOLFOX6 bylo nemocní s mcrc, u kterých došlo k progresi onemocnění v průběhu léčby režimem s oxaliplatinou nebo po této léčbě LE In vivo aflibercept signifikantně inhiboval růst a nádorovou angiogenezi u celé řady nádorových linií (např. melanom, rhabdomyosarkom, gliom, neuroblastom) na myším xenograftovém modelu [12, 13]. Lockhart a kol. publikovali iniciální klinickou studii fáze I, do níž byli zařazeni nemocní po vyčerpání protinádorové léčby. Jednalo se o 47 pacientů s pokročilými solidními tumory a Hodgkinovou chorobou. Aflibercept byl aplikován v monoterapii v dávkovém rozmezí od 0,3 mg/kg do 7,0 mg/kg každé dva týdny a limitacemi dávky se ukázaly být ulcerace rekta a proteinurie [7, 14]. Jako optimální pro klinické studie fáze II a III byla následně stanovena dávka 4 mg/kg afliberceptu podávaná každé 2 týdny. Byly provedeny další klinické studie fáze I, kdy byl aflibercept kombinován s celou řadou léků (cisplatina, gemcitabin, docetaxel, pemetrexed, temozolomid) [15]. Nejlepších výsledků bylo dosaženo u nemocných s pokročilým CRC. V kombinaci s chemoterapií FOLFOX a s irinotekanem byly u pacientů s pokročilými CRC zaznamenány parciální léčebné odpovědi [16]. Následně proběhly klinické studie fáze II, kde byl aflibercept testován u ovariálního karcinomu, sarkomů ženských pohlavních orgánů, maligního melanomu a u maligního glioblastomu [15]. Ve zmíněných klinických studiích s afliberceptem nebylo dosaženo očekávaných výsledků. multicentrická, randomizovaná, dvojitě slepá, placebem kontrolovaná studie fáze III H Klinické zkušenosti STUDIE VELOUR Á Populační farmakokinetická analýza (1507 nemocných s různými typy pokročilých malignit) neodhalila žádné klinicky významné rozdíly v clearance nebo systémové expozici (area under curve, AUC) volného afliberceptu u nemocných se středně závažnou a mírnou poruchou funkce ledvin léčených dávkou 4 mg/kg afliberceptu oproti celkové studované populaci [9]. U pacientů se závažnou poruchou funkce ledvin nelze činit žádné závěry vzhledem k velmi omezenému množství dostupných údajů. N
4 Studie fáze III u pacientů s mcrc Nadějné výsledky klinických studií fáze II s použitím afliberceptu v kombinaci s režimem FOLFIRI v léčbě pacientů s pokročilým mcrc, u nichž došlo při chemoterapii založené na bázi 5-FU, leukovorinu a oxaliplatiny k progresi onemocnění, se staly podkladem multicentrické klinické studie fáze III VELOUR, která byla zároveň studií registrační [21]. Cílem klinické dvojitě slepé, randomizované, multicentrické a placebem kontrolované studie fáze III nazvané VELOUR bylo srovnání kombinace chemoterapie režimem FOLFIRI s afliberceptem a kombinace chemoterapie FOLFIRI s placebem u pacientů po předchozí progresi pokročilého mcrc. Nemocní s progresí mcrc po chemoterapii založené na bázi oxaliplatiny, 5-FU a leukovorinu byli randomizovaně rozděleni v poměru 1 : 1 do ramene s afliberceptem plus FOLFIRI (rameno aflibercept) a do ramene placebo plus FOLFIRI (kontrolní rameno). Stratifikace probíhala dle výkonnostního stavu (WHO 0 1 versus WHO 2) a předchozí aplikace bevacizumabu (ano versus ne). Nemocní starší 18 let v dobrém výkonnostním stavu (WHO 0 2) byli léčeni afliberceptem podávaným v dávce 4 mg/kg intravenózně (i.v.) v den 1 v jednohodinové infuzi ve dvoutýdenních intervalech. Režim FOLFIRI sestával z dávky irinotekanu 180 mg/m 2 i.v. 90 minut podávané souběžně s infuzí leukovorinu 400 mg/m 2 i.v. 120 minut, následně s bolusovým podáním 5-FU v dávce 400 mg/m 2 i.v. následovaným kontinuální 46hodinovou infuzí 5-FU v dávce 2400 mg/m 2 i.v. ve dvoutýdenních intervalech. Pro dostatečnou statistickou sílu bylo požadováno zařazení 1200 nemocných a dosažení 863 událostí. Zařazeno bylo 1401 nemocných, z toho bylo 1226 nemocných randomizovaně rozděleno do dvou ramen studie do kontrolního ramene s placebem bylo zařazeno 614 nemocných, do ramene s afliberceptem 612 nemocných, viz obr. 2. Medián dávkové denzity v rameni s afliberceptem dosahoval 83 %, v rameni s placebem 92 %. Oddálení léčebných cyklů bylo zaznamenáno u 77,7 % nemocných v rameni s afliberceptem a u 69,4 % nemocných v rameni s placebem. Medián follow-up ve studii dosahoval 22,28 měsíce. Celkové přežití bylo signifikantně prodlouženo v rameni s afliberceptem oproti kontrolnímu rameni 13,50 měsíce versus 12,06 měsíce (poměr rizik, hazard ratio, HR: 0,817; p = 0,0032). Dvouleté přežití bylo rovněž častější v rameni s afliberceptem (28,0 %) oproti kontrolnímu rameni (18,7 %). Rovněž hodnota PFS byla signifikantně vyšší v rameni s afliberceptem a dosahovala 6,9 měsíce; naproti tomu v kontrolním rameni s placebem dosahovala PFS 4,7 měsíce (HR: 0,758; p < 0,00007). Rovněž i dosažené počty ORR byly vyšší v rameni s afliberceptem oproti kontrolnímu rameni s placebem (19,8 % vs. 11,1 %; p < 0,001) viz graf 1, tab. 1. Zde je ale nutno uvést, že celkem 165 nemocných pravděpodobnost přežití 1 0,9 0,8 0,7 0,6 0,5 0,4 0,3 aflibercept/folfiri 0,2 0,1 placebo/folfiri 0, čas (měsíce) pacienti v ohrožení placebo aflibercept pravděpodobnost přežití (%) placebo 79,1 50,3 30,9 18,7 12,0 aflibercept 81,9 56,1 38,5 28,0 22,3 Graf 1 Kaplanovy-Meierovy křivky celkového přežití (v měsících) v jednotlivých léčebných skupinách (ITT populace); podle [11] Režim FOLFIRI: irinotekan 180 mg/m 2 i.v. 90 minut podávaný souběžně s infuzí leukovorinu 400 mg/m 2 i.v. 120 minut, následně s bolusovým podáním 5-FU v dávce 400 mg/m 2 i.v. následovaným kontinuální 46hodinovou infuzí 5-FU v dávce 2400 mg/m 2 i.v. ve dvoutýdenních intervalech. HR poměr rizik, hazard ratio; ITT intention to treat; OS overall survival, celkové přežití Tab. 1 Výsledky účinnosti léčby ve studii VELOUR celkové přežití, OS bylo vyřazeno z analýzy hodnocení léčebné odpovědi pro neměřitelnou chorobu během výchozího hodnocení (rameno s afliberceptem 13,2 % a kontrolní rameno 13,7 %) [21]. Indikace Z onkologického hlediska je aflibercept v kombinaci s chemoterapií režimem FOLFIRI (irinotekan/5-fu/leukovorin) indikován k léčbě dospělých pacientů s mcrc, který je rezistentní k léčbě režimem obsahujícím placebo/folfiri aflibercept/folfiri medián OS (měsíce) 12,06 (11,07 13,08) 13,5 (12,52 14,95) (HR: 0,817; p = 0,0032) aflibercept 4 mg/kg v den 1 ve dvoutýdenních intervalech/folfiri n = 612 placebo v den 1 ve dvoutýdenních intervalech/folfiri n = 614 počet úmrtí, % 403 (65,8) 460 (74,9) medián doby celkového přežití (95% CI), měsíce 13,5 (12,52 14,95) 12,06 (11,07 13,08) stratifikovaný poměr rizik (95% CI) 0,817 (p = 0,0032) přežití bez progrese, PFS počet příhod, % 393 (64,2) 454 (73,9) medián doby PFS (95% CI), měsíce 6,90 (6,51 7,2) 4,67 (4,21 5,36) stratifikovaný poměr rizik (95% CI) 0,758 (p < 0,00007) celkový výskyt odpovědi, ORR (95% CI), % 19,8 (16,4 23,2) 11,1 (8,5 13,8) CI konfidenční interval; n počet; OS overall survival, celkové přežití; ORR overall response rate, celková léčebná odpověď; PFS progression-free survival, bezpříznakové přežití podle [21] Tabernero, et al., 2014 oxaliplatinu nebo po této léčbě progredoval. Podmínkou je výkonnostní stav pacientů hodnocený stupněm 0 1dle ECOG (Eastern Cooperative Oncology Group), tab. 2. Zařazení do současné palety léčiv U nemocných s mcrc jsou v první linii léčby většinou podávány chemoterapeutické režimy založené na oxaliplatině. Je to dáno možnou reindukcí léčby první linie, obecně nižší toxicitou v průběhu aplikace a relativně 438
5 Tab. 2 Klasifikace hodnocení celkového stavu pacienta podle kritérií ECOG za 4 týdny po rozsáhlé operaci, dokud nedojde k úplnému zhojení operační rány. stupeň stav pacienta 0 Bez symptomů. Pacient plně aktivní, schopen všech aktivit bez omezení. Symptomy nemoci přítomny. Pacient je fyzicky omezen, ale dochází na ambulantní léčbu, je schopen 1 vykonávat lehčí práci nebo práci v kanceláři. 2 3 Symptomy nemoci přítomny. Pacient tráví méně než 50 % denního času v posteli. Je schopen docházet na ambulantní léčbu, je soběstačný, ale není schopen práce. Symptomy nemoci přítomny. Pacient tráví více než 50 % denního času v posteli, ale není upoután na lůžko. Je schopen docházet na ambulantní léčbu, není schopen se plně obsloužit. Není schopen práce. 4 Pacient plně upoután na lůžko. Není schopen sebeobsluhy. 5 Smrt. Posouzení celkového stavu a kondice pacienta se vyjadřuje pomocí kritérií WHO nebo ECOG. Tato kritéria mohou být vodítkem při rozhodování, zda je pacient schopen léčby a v jaké intenzitě mu má být léčba podávána. ECOG Eastern Cooperative Oncology Group; WHO World Health Organisation podle [27] ECOG, 1982 vyšším počtem léčebných odpovědí [22]. Léčba druhé linie je definována změnou struktury režimu první linie. Složení chemoterapie ve druhé linii je tedy závislé na typu chemoterapie v první linii. Pokud tedy použijeme v první linii režim FOLFOX (oxaliplatina, 5-FU, leukovorin), nejčastěji se ve druhé linii používá režim FOLFIRI (irinotekan, 5-FU, leukovorin) [23]. Pokud není tato chemoterapie ve druhé linii kombinována s cílenou léčbou, je její účinnost velmi nízká. Kombinace s anti-egfr protilátkami jsou účinné pouze u nemocných s nemutovaným genem RAS. Pro velkou skupinu pacientů s mutací genu RAS tedy nemáme kromě možnosti reindukce bevacizumabu skutečně účinnou cílenou léčbu druhé linie [24, 25]. Alternativu k bevacizumabu tak představuje ve druhé linii léčby aflibercept, který v kombinaci s režimem FOLFIRI prokázal signifikantní prodloužení PFS i OS [26], a stává se novou terapeutickou možností pro výše definované pacienty. Kontraindikace Léčba je kontraindikována při hypersenzitivitě na léčivou látku aflibercept nebo na kteroukoli pomocnou látku přípravku. Léčba je rovněž kontraindikována při nesnášenlivosti jakékoliv látky z cytostatické kombinace režimu FOLFIRI. Aflibercept je registrován také v oftalmologické indikaci, ale u přípravku Zaltrap je vzhledem k hyperosmotickým vlastnostem kontraindikováno oftalmologické/intravitreální podání. Nežádoucí účinky Účinnost a bezpečnost afliberceptu byla hodnocena v randomizované, dvojitě zaslepené, placebem kontrolované studii u pacientů s mcrc, kteří byli dříve léčeni terapií na bázi oxaliplatiny s předchozí léčbou bevacizumabem nebo bez bevacizumabu (studie VELOUR, fáze III). Profil nežádoucích účinků byl shodný s předchozími zjištěními (studie fáze I a II) a nebyla pozorována žádná nová toxicita [21]. Nežádoucí účinky se projevily u 99,2 % nemocných ve skupině léčené afliberceptem s chemoterapií a u 97,9 % nemocných v kontrolním rameni. K nežádoucím účinkům stupně 3 4 došlo u 83,5 % nemocných, respektive u 62,5 % nemocných. Profil nežádoucích účinků byl shodný s předchozími zjištěními a nebyla pozorována žádná nová toxicita. Nejčastěji hlášenými nežádoucími účinky stupně 3 4 ve skupině léčené afliberceptem oproti skupině s placebem byly neutropenie (36,7 % vs. 29,5 %), průjem (19,3 % vs. 7,8 %), hypertenze (19,3 % vs. 1,5 %), astenie (16,8 % vs. 10,6 %), stomatitida/ulcerace (13,8 % vs. 5 %), infekce (12,3 % vs. 6,9 %), palmární a plantární erytrodysestezie (2,8 % vs. 0,5 %), proteinurie (7,8 % vs. 1,2 %), neutropenické komplikace (5,7 % vs. 2,8 %), tromboembolické komplikace (7,9 % vs. 6,3 %) a bolesti břicha (5,4 % vs. 3,3 %). Kvůli nežádoucím účinkům ukončilo léčbu 26,8 % nemocných ve skupině s afliberceptem a 12,1 % nemocných v kontrolní skupině s chemoterapií. Nejčastějšími nežádoucími účinky (všech stupňů) vedoucími k ukončení terapie byly astenie (3,8 % vs. 1,3 %), infekce (3,4 % vs. 1,7 %), průjem (2,3 % vs. 0,7 %) a hypertenze (2,3 % vs. 0 %). Kvůli progresi nemoci ukončilo léčbu více pacientů v kontrolní větvi oproti rameni s afliberceptem (71,2 % vs. 49,8 %). Bezpečnostní profil režimu aflibercept plus FOLFIRI ve studii VELOUR ukázal, že nežádoucí účinky byly všeobecně reverzibilní, zvládnutelné při užití současných klinických metod a doporučení. Nežádoucí účinky neovlivnily schopnost nemocných podstoupit léčbu, nevedly k redukci souhrnné expozice chemoterapii a nezamezily pacientům možnost užití další systémové protinádorové léčby [21]. Vzhledem k vyššímu riziku krvácení a zhoršenému hojení ran by měla být léčba afliberceptem dočasně přerušena aspoň na 4 týdny před elektivní operací a zahájena minimálně Lékové interakce Populační farmakokinetická analýza a srovnání mezi studiemi neodhalily žádnou farmakokinetickou lékovou interakci mezi afliberceptem a chemoterapeutickým režimem FOLFIRI. Nebyly provedeny žádné studie, které by se zaměřovaly na jiné lékové interakce afliberceptu. Riziko vzniku interakcí se současně užívanými léky však nelze vyloučit. Těhotenství, kojení a plodnost Nejsou k dispozici žádná data o používání afliberceptu u gravidních žen. Aflibercept se nemá používat během gravidity, pokud to není jednoznačně nevyhnutelné. Tento přípravek může závažně poškodit plod, protože brání tvoření nových cév. Není známo, zda aflibercept přechází v průběhu laktace do mateřského mléka. Aflibercept může mít vliv na plodnost mužů i žen, v průběhu fertilního věku je nutno užívat účinnou antikoncepci. Dávkování a způsob podání Aflibercept se podává formou intravenózní infuze po dobu jedné hodiny. Vzhledem k hyperosmolaritě (1000 mosmol/kg) není možné používat přípravek neředěný, např. formou nitrožilního bolusu. Doporučená dávka přípravku je 4 mg/kg tělesné hmotnosti, s následnou terapií režimem FOLFIRI. Předepsaný režim FOLFIRI zahrnuje irinotekan 180 mg/m 2 ve formě nitrožilní infuze trvající 90 minut a kyselinu folinovou (DL, racemická směs) 400 mg/m 2 ve formě nitrožilní infuze trvající 2 hodiny ve stejnou dobu v den 1 za použití Y linky, s následným podáním nitrožilního bolusu 5 FU v dávce 400 mg/m² a následně 5-FU 2400 mg/m² ve formě kontinuální nitrožilní infuze trvající 46 hodin. Tato léčba je považována za jeden léčebný cyklus. Léčba se opakuje každé dva týdny a probíhá do progrese onemocnění či do výskytu neakceptovatelné toxicity léčby. Stabilita Po naředění v infuzním vaku byla chemická a fyzikální stabilita po otevření před použitím (in-use stability) prokázána na dobu 24 hodin při teplotě 2 C až 8 C a na dobu 8 hodin při teplotě 25 C. Závěr Aflibercept představuje jako nový blokátor angiogeneze další možnosti účinné cílené protinádorové léčby, zejména v kombinaci s režimem FOLFIRI u nemocných s pokročilým mcrc, kteří jsou rezistentní na léčbu režimem obsahujícím oxaliplatinu nebo u nich po této léčbě došlo k progresi nádorového onemocnění. Práce byla podpořena projektem ED2.1.00/ Evropského fondu pro regionální rozvoj. 439
6 Literatura [1] Zavoral M, Suchanek S, Majek O, et al. Colorectal cancer screening: 20 years of development and recent progress. World J Gastroenterol 2014; 20: [2] Abdalla EK, Bauer TW, Chun YS, et al. Locoregional surgical and interventional therapies for advanced colorectal cancer liver metastases: expert consensus statements. HPB (Oxford) 2013; 15: [3] Hurwitz H. Integrating the anti-vegf-a humanized monoclonal antibody bevacizumab with chemotherapy in advanced colorectal cancer. Clin Colorectal Cancer 2004; 4 (Suppl 2): S [4] Prenen H, Vecchione L, Van Cutsem E. Role of targeted agents in metastatic colorectal cancer. Target Oncol 2013; 8: [5] Holash J, Davis S, Papadopoulos N, et al. VEGF-Trap: a VEGF blocker with potent antitumor effects. Proc Natl Acad Sci USA 2002; 99: [6] Mittal K, Ebos J, Rini B. Angiogenesis and the tumor microenvironment: vascular endothelial growth factor and beyond. Semin Oncol 2014; 41: [7] Wang TF, Lockhart AC. Aflibercept in the treatment of metastatic colorectal cancer. Clin Med Insights Oncol 2012; 6: [8] Zatloukal P. Biologická léčba nemalobuněčného karcinomu plic. Onkologie 2009; 3: [9] Gaya A, Tse V. A preclinical and clinical review of aflibercept for the management of cancer. Cancer Treat Rev 2012; 38: [10] Teng LS, Jin KT, He KF, et al. Clinical applications of VEGF-trap (aflibercept) in cancer treatment. J Chin Med Assoc 2010; 73: [11] European Medicines Agency, Zaltrap (aflibercept) EU Summary of Product Charakteristics. WC pdf Navštíveno [12] Kim ES, Serur A, Huang J, et al. Potent VEGF blockade causes regression of coopted vessels in a model of neuroblastoma. Proc Natl Acad Sci U S A 2002; 99: [13] Huang J, Soffer SZ, Kim ES, et al. Vascular remodeling marks tumors that recur during chronic suppression of angiogenesis. Mol Cancer Res 2004; 2: [14] Lockhart AC, Rothenberg ML, Dupont J, et al. Phase I study of intravenous vascular endothelial growth factor trap, aflibercept, in patients with advanced solid tumors. J Clin Oncol 2010; 28: [15] Patricia A, Tang MD, Malcom J, et al. Aflibercept in the Treatment of Patients with Metastatic Colorectal Cancer. Ther Adv Gastroenterol 2013; 6: [16] Limentani SA Jr, Purdham A. A phase I dose escalation and pharmacokinetic (PK) study of intravenous (IV) aflibercept (VEGF Trap) plus FOLFOX4 in patient (pts) with advanced solid tumor. J Clin Oncol 2008; 26: abstract [17] US National Institute of Health. Study of Aflibercept And Modified FOLFOX6 As First-Line Treatment In Patients With Metastatic Colorectal Cancer (AFFIRM). Available from: show/nct [18] US National Institute of Health. Aflibercept compared placebo in term of efficacy patients treated with gemcitabine for metastatic pancreatic cancer (VANILLA). Available from: gov/ct2/show/nct [19] US National Institute of Health. A study of aflibercept versus placebo with second-line docetaxel for locally advanced or metastatic non-small-lung cancer (VITAL). Available from: gov/ct2/show/nct [20] Tannock IK, Fizazi K, Ivanov S, et al. Aflibercept versus placebo in combination with docetaxel and prednisone for treatment of men with metastatic castration-resistant prostate cancer (VENICE): a phase 3, double-blind randomised trial. Lancet Oncol 2013; 14: [21] Tabernero J, Van Cutsem E, Lakomý R, et al. Aflibercept versus placebo in combination with fluorouracil, leucovorin and irinotecan in the treatment of previously treated metastatic colorectal cancer: prespecified subgroup analyses from the VELOUR trial. Eur J Cancer 2014; 50: [22] Petera J. ESMO doporučení pro léčbu metastatického kolorektálního karcinomu. Colorectal News 2013; 2: [23] Schmoll HJ, Van Cutsem E, Stein A, et al. ESMO Consensus Guidelines for management of patients with colon and rectal cancer. A personalized approach to clinical decision making. Ann Oncol 2012; 23: [24] Kubicka S, Greil R, André T, et al. ML18147 study investigators including AIO, GERCOR, FFCD, UNICANCER GI, TTD, BGDO, GEMCAD, and AGMT groups. Bevacizumab plus chemotherapy continued beyond first progression in patients with metastatic colorectal cancer previously treated with bevacizumab plus chemotherapy: ML18147 study KRAS subgroup findings. Ann Oncol 2013; 24: [25] Chibaudel B, Tournigand C, André T, et al. Therapeutic strategy in unresectable metastatic colorectal cancer. Ther Adv Med Oncol 2012; 4: [26] Rodriguez M. Ziv-aflibercept use in metastatic colorectal cancer. J Adv Pract Oncol 2013; 4: [27] Oken MM, Creech RH, Tormey DC, et al. Toxicity And Response Criteria Of The Eastern Cooperative Oncology Group. Am J Clin Oncol 1982; 5: Doručeno do redakce: Přijato k publikaci: doc. MUDr. Luboš Holubec, Ph.D., MBA Radioterapeutická a onkologická klinika Fakultní nemocnice Plzeň alej Svobody 80, Plzeň holubec@fnplzen.cz 440
Chemoterapie pokročil kolorektáln. karcinomu
 Chemoterapie pokročil ilého kolorektáln lního karcinomu Jindřich ich FínekF Chemoterapie pokročil ilého kolorektáln lního karcinomu v prvé linii Incidence ve světě Incidence a mortalita v ČR Stádia onemocnění
Chemoterapie pokročil ilého kolorektáln lního karcinomu Jindřich ich FínekF Chemoterapie pokročil ilého kolorektáln lního karcinomu v prvé linii Incidence ve světě Incidence a mortalita v ČR Stádia onemocnění
Lze předvídat výsledek léčby bevacizumabem u metastatického kolorektálního karcinomu na základě stavu onkogenu K-ras? Komentář
 Lze předvídat výsledek léčby bevacizumabem u metastatického kolorektálního karcinomu na základě stavu onkogenu K-ras? MUDr. Jiří Tomášek Komentář MUDr. Pavel Vítek, Ph.D. Lze předvídat výsledek léčby
Lze předvídat výsledek léčby bevacizumabem u metastatického kolorektálního karcinomu na základě stavu onkogenu K-ras? MUDr. Jiří Tomášek Komentář MUDr. Pavel Vítek, Ph.D. Lze předvídat výsledek léčby
Bevacizumab u starších pacientů s kolorektálním karcinomem
 Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
Biologická léčba karcinomu prsu. Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN)
 Biologická léčba karcinomu prsu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN) Cílená léčba Ca prsu Trastuzumab (HercepNn) AnN HER2 neu pronlátka LapaNnib (Tyverb)
Biologická léčba karcinomu prsu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN) Cílená léčba Ca prsu Trastuzumab (HercepNn) AnN HER2 neu pronlátka LapaNnib (Tyverb)
Možnosti léčby CRPC s časem přibývají
 Možnosti léčby CRPC s časem přibývají Jana Katolická Onkologicko-chirurgické oddělení Fakultní nemocnice u Sv. Anny Mnoho studií - jen čtyři nové léky Enzalutamid Abirateron + prednison Cabazitaxel Radium-223
Možnosti léčby CRPC s časem přibývají Jana Katolická Onkologicko-chirurgické oddělení Fakultní nemocnice u Sv. Anny Mnoho studií - jen čtyři nové léky Enzalutamid Abirateron + prednison Cabazitaxel Radium-223
3.3 KARCINOM SLINIVKY BŘIŠNÍ
 3.3 KARCINOM SLINIVKY BŘIŠNÍ Epidemiologie Zhoubné nádory pankreatu se vyskytují převážně ve vyšším věku po 60. roce života, převážně u mužů. Zhoubné nádory pankreatu Incidence a mortalita v České republice
3.3 KARCINOM SLINIVKY BŘIŠNÍ Epidemiologie Zhoubné nádory pankreatu se vyskytují převážně ve vyšším věku po 60. roce života, převážně u mužů. Zhoubné nádory pankreatu Incidence a mortalita v České republice
Hodnocení segmentu centrové léčby z dat plátců zdravotní péče. Společné pracoviště ÚZIS ČR a IBA MU
 Hodnocení segmentu centrové léčby z dat plátců zdravotní péče Společné pracoviště ÚZIS ČR a IBA MU Realita současné české medicíny: úspěšné výsledky léčby = podstatné prodlužování doby života pacienta
Hodnocení segmentu centrové léčby z dat plátců zdravotní péče Společné pracoviště ÚZIS ČR a IBA MU Realita současné české medicíny: úspěšné výsledky léčby = podstatné prodlužování doby života pacienta
R.A. Burger, 1 M.F. Brady, 2 J. Rhee, 3 M.A. Sovak, 3 H. Nguyen, 3 M.A. Bookman 4
 NEZÁVISLÉ RADIOLOOGICKÉ HODNOCENÍ STUDIE FÁZE III GOG218 S BEVACIZUMABEM (BEV) V PRIMÁRNÍ LÉČBĚ POKROČILÉHO EPITELOVÉHO NÁDORU VAJEČNÍKŮ, PRIMÁRNÍHO NÁDORU PERITONEA NEBO VEJCOVODŮ. R.A. Burger, 1 M.F.
NEZÁVISLÉ RADIOLOOGICKÉ HODNOCENÍ STUDIE FÁZE III GOG218 S BEVACIZUMABEM (BEV) V PRIMÁRNÍ LÉČBĚ POKROČILÉHO EPITELOVÉHO NÁDORU VAJEČNÍKŮ, PRIMÁRNÍHO NÁDORU PERITONEA NEBO VEJCOVODŮ. R.A. Burger, 1 M.F.
Východiska. Čtvrtá nejčastější příčina úmrtí na nádorová onemocní u žen, v celém světě je ročně nových onemocnění a úmrtí
 ICON7: studie fáze III Gynaecologic Cancer InterGroup (GCIG) s přidáním bevacizumabu ke standardní chemoterapii u žen s nově diagnostikovaným epitelovým nádorem vaječníků, primárním nádorem pobřišnice
ICON7: studie fáze III Gynaecologic Cancer InterGroup (GCIG) s přidáním bevacizumabu ke standardní chemoterapii u žen s nově diagnostikovaným epitelovým nádorem vaječníků, primárním nádorem pobřišnice
Urychlení úpravy krvetvorby poškozené cytostatickou terapií (5-fluorouracil a cisplatina) p.o. aplikací IMUNORu
 Urychlení úpravy krvetvorby poškozené cytostatickou terapií (5-fluorouracil a cisplatina) p.o. aplikací IMUNORu Úvod Myelosuprese (poškození krvetvorby) patří mezi nejčastější vedlejší účinky chemoterapie.
Urychlení úpravy krvetvorby poškozené cytostatickou terapií (5-fluorouracil a cisplatina) p.o. aplikací IMUNORu Úvod Myelosuprese (poškození krvetvorby) patří mezi nejčastější vedlejší účinky chemoterapie.
STIVARGA (REGORAFENIB)
 NÁDORY TLUSTÉHO STŘEVA A REKTA 31 STIVARGA (REGORAFENIB) Kolektiv autorů Úvod Regorafenib (Stivarga ) je nový perorální multikinázový inhibitor, který byl v roce 2013 registrován pro léčbu dospělých pacientů
NÁDORY TLUSTÉHO STŘEVA A REKTA 31 STIVARGA (REGORAFENIB) Kolektiv autorů Úvod Regorafenib (Stivarga ) je nový perorální multikinázový inhibitor, který byl v roce 2013 registrován pro léčbu dospělých pacientů
Co mě může potkat při návratu onemocnění. Nové přístupy biologická léčba karcinomu prostaty. MUDr. Hana Študentová, Ph.D.
 Co mě může potkat při návratu onemocnění. Nové přístupy biologická léčba karcinomu prostaty MUDr. Hana Študentová, Ph.D. Obsah Obecný úvod Androgenní signalizace Možnosti systémové léčby Závěr Koho se
Co mě může potkat při návratu onemocnění. Nové přístupy biologická léčba karcinomu prostaty MUDr. Hana Študentová, Ph.D. Obsah Obecný úvod Androgenní signalizace Možnosti systémové léčby Závěr Koho se
Udržovací léčba: zamířeno na anti-vegf léčbu Alan Sandler
 Udržovací léčba: zamířeno na anti-vegf léčbu Alan Sandler Department of Hematology/Oncology Oregon Health and Science University Knight Cancer Institute Portland, OR, USA Medián OS (měsíce) Studie v 1.linii
Udržovací léčba: zamířeno na anti-vegf léčbu Alan Sandler Department of Hematology/Oncology Oregon Health and Science University Knight Cancer Institute Portland, OR, USA Medián OS (měsíce) Studie v 1.linii
The Cost Study of First- line Treatment of Metastatic Colorectal Carcinoma with Bevacizumab- containing Regimen in the Czech Republic
 PŮVODNÍ PRÁCE Analýza nákladů na 1. linii léčby metastatického kolorektálního karcinomu při podání režimů s bevacizumabem data z reálné klinické praxe v České republice The Cost Study of First- line Treatment
PŮVODNÍ PRÁCE Analýza nákladů na 1. linii léčby metastatického kolorektálního karcinomu při podání režimů s bevacizumabem data z reálné klinické praxe v České republice The Cost Study of First- line Treatment
Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky
 Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky Prof. MUDr. Jitka Abrahámová, DrSc Onkologická klinika TN a 1. LF UK KOC (NNB + VFN + TN) St Gallén 2011 Rozsah onemocnění T, N, M ER, PgR
Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky Prof. MUDr. Jitka Abrahámová, DrSc Onkologická klinika TN a 1. LF UK KOC (NNB + VFN + TN) St Gallén 2011 Rozsah onemocnění T, N, M ER, PgR
ŽIVOTNÍ CYKLUS LÉKŮ KLINICKÉ HODNOCENÍ STUDIE. Kateřina Kopečková FN Motol, Praha
 ŽIVOTNÍ CYKLUS LÉKŮ KLINICKÉ HODNOCENÍ STUDIE Kateřina Kopečková FN Motol, Praha Klinická hodnocení LP Nedílnou součásti vývoje léčiva Navazují na preklinický výzkum Pacienti jsou subjekty hodnocení V
ŽIVOTNÍ CYKLUS LÉKŮ KLINICKÉ HODNOCENÍ STUDIE Kateřina Kopečková FN Motol, Praha Klinická hodnocení LP Nedílnou součásti vývoje léčiva Navazují na preklinický výzkum Pacienti jsou subjekty hodnocení V
Profil nemocn ch vhodn ch k léãbû chemobioterapií
 Profil nemocn ch vhodn ch k léãbû chemobioterapií MUDr. Marta Holíková / Oddûlení klinické onkologie Krajské nemocnice, Liberec Většina pacientů s kolorektálním karcinomem (CRC) stadia I nebo II je trvale
Profil nemocn ch vhodn ch k léãbû chemobioterapií MUDr. Marta Holíková / Oddûlení klinické onkologie Krajské nemocnice, Liberec Většina pacientů s kolorektálním karcinomem (CRC) stadia I nebo II je trvale
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Statistická analýza dat k
 ANALÝZA VÝSLEDKŮ LÉČBY AVASTINEM Statistická analýza dat k 30. 9. 2006 R. Vyzula, D. Némethová, A. Svobodník et al. I ZÁKLADNÍ POPIS SOUBORU I.1. Počet pacientů v jednotlivých centrech Celkový počet zařazených
ANALÝZA VÝSLEDKŮ LÉČBY AVASTINEM Statistická analýza dat k 30. 9. 2006 R. Vyzula, D. Némethová, A. Svobodník et al. I ZÁKLADNÍ POPIS SOUBORU I.1. Počet pacientů v jednotlivých centrech Celkový počet zařazených
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
CORECT - VECTIBIX. Klinický registr pacientů s metastatickým kolorektálním karcinomem. Stav registru k datu
 CORECT - VECTIBIX Klinický registr pacientů s metastatickým kolorektálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr
CORECT - VECTIBIX Klinický registr pacientů s metastatickým kolorektálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr
Avastin v léčbě karcinomu prsu
 PŘEHLED Avastin v léčbě karcinomu prsu Avastin in the Treatment of Breast Cancer Petráková K. Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno Souhrn Pacientky s metastatickým karcinomem
PŘEHLED Avastin v léčbě karcinomu prsu Avastin in the Treatment of Breast Cancer Petráková K. Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno Souhrn Pacientky s metastatickým karcinomem
Přípravek Avastin se společně s jinými protinádorovými léčivými přípravky používá u dospělých k léčbě těchto typů rakoviny:
 EMA/175824/2015 EMEA/H/C/000582 Souhrn zprávy EPAR určený pro veřejnost bevacizumabum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro přípravek.
EMA/175824/2015 EMEA/H/C/000582 Souhrn zprávy EPAR určený pro veřejnost bevacizumabum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro přípravek.
Nano World Cancer Day 2014
 31. ledna 2014 Celoevropská akce ETPN pořádaná současně ve 13 členských zemích Evropské unie Rakousko (Štýrský Hradec), Česká republika (Praha), Finsko (Helsinky), Francie (Paříž), Německo (Erlangen),
31. ledna 2014 Celoevropská akce ETPN pořádaná současně ve 13 členských zemích Evropské unie Rakousko (Štýrský Hradec), Česká republika (Praha), Finsko (Helsinky), Francie (Paříž), Německo (Erlangen),
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
Nové léčebné možnosti v terapii metastazujícího karcinomu žaludku
 Nové léčebné možnosti v terapii metastazujícího karcinomu žaludku Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1. LF UK a TN KOC (NNB+VFN+TN) Žaludek pravidla klasifikace Klasifikace se používá
Nové léčebné možnosti v terapii metastazujícího karcinomu žaludku Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1. LF UK a TN KOC (NNB+VFN+TN) Žaludek pravidla klasifikace Klasifikace se používá
v praxi Aktuality v léčbě metastatického kolorektálního karcinomu Supplementum onkologie 1/ aflibercept
 v praxi Supplementum onkologie 1/2016 Aktuality v léčbě metastatického kolorektálního karcinomu 5 aflibercept MUDr. Eugen Kubala 11 Aflibercept u pacientky s metastatickým kolorektálním karcinomem MUDr.
v praxi Supplementum onkologie 1/2016 Aktuality v léčbě metastatického kolorektálního karcinomu 5 aflibercept MUDr. Eugen Kubala 11 Aflibercept u pacientky s metastatickým kolorektálním karcinomem MUDr.
Protokol pro léčbu karcinomu tlustého střeva
 1 Klinika onkologie a radioterapie FN Hradec Králové Platnost od: 2.1.2013 Dokument: standardní léčebný postup - verze 2013 Počet stran: 6 Přílohy: nejsou Protokol pro léčbu karcinomu tlustého střeva Schválili:
1 Klinika onkologie a radioterapie FN Hradec Králové Platnost od: 2.1.2013 Dokument: standardní léčebný postup - verze 2013 Počet stran: 6 Přílohy: nejsou Protokol pro léčbu karcinomu tlustého střeva Schválili:
XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY
 NÁDORY PROSTATY 63 XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY Kolektiv autorů Úvod Léčivý přípravek (radium-223 dichlorid) byl 13. listopadu 2013 schválen
NÁDORY PROSTATY 63 XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY Kolektiv autorů Úvod Léčivý přípravek (radium-223 dichlorid) byl 13. listopadu 2013 schválen
9. ZHOUBNÝ NOVOTVAR OVARIÍ A TUBY (C56-57)
 9. ZHOUBNÝ NOVOTVAR OVARIÍ A TUBY (C56-57) 9.1 Epiteliální 9.1.1 Chemoterapie jako součást primární léčby Po chirurgické léčbě epiteliálních ovariálních ZN nutno považovat primární chemoterapii za kurativní.
9. ZHOUBNÝ NOVOTVAR OVARIÍ A TUBY (C56-57) 9.1 Epiteliální 9.1.1 Chemoterapie jako součást primární léčby Po chirurgické léčbě epiteliálních ovariálních ZN nutno považovat primární chemoterapii za kurativní.
STRUKTURA REGISTRU MPM
 STRUKTURA REGISTRU MPM 1. Vstupní parametry 1. Kouření (výběr) 1. Kuřák 2. Bývalý kuřák (rok před stanovením DG - dle WHO) 3. Nekuřák 4. Neuvedeno 2. Výška [cm] (reálné číslo) 3. Hmotnost pacienta v době
STRUKTURA REGISTRU MPM 1. Vstupní parametry 1. Kouření (výběr) 1. Kuřák 2. Bývalý kuřák (rok před stanovením DG - dle WHO) 3. Nekuřák 4. Neuvedeno 2. Výška [cm] (reálné číslo) 3. Hmotnost pacienta v době
DVĚ STUDIE UKAZUJÍ VÝRAZNĚ PŘÍZNIVÉ VÝSLEDKY CHEMOTERAPIE ZALOŽENÉ NA Eloxatinu V KOMBINACI S BEVACIZUMABEM U POKROČILÉHO KOLOREKTÁLNÍHO KARCINOMU
 DVĚ STUDIE UKAZUJÍ VÝRAZNĚ PŘÍZNIVÉ VÝSLEDKY CHEMOTERAPIE ZALOŽENÉ NA Eloxatinu V KOMBINACI S BEVACIZUMABEM U POKROČILÉHO KOLOREKTÁLNÍHO KARCINOMU Pozitivní výsledky studií TREE-2 a ECOG 3200 oznámeny
DVĚ STUDIE UKAZUJÍ VÝRAZNĚ PŘÍZNIVÉ VÝSLEDKY CHEMOTERAPIE ZALOŽENÉ NA Eloxatinu V KOMBINACI S BEVACIZUMABEM U POKROČILÉHO KOLOREKTÁLNÍHO KARCINOMU Pozitivní výsledky studií TREE-2 a ECOG 3200 oznámeny
Rozdíly mezi novými a klasickými léky u mnohočetného myelomu Luděk Pour IHOK FN Brno
 C Z E C H G R O U P CZECH GROUP 1 Rozdíly mezi novými a klasickými léky u mnohočetného myelomu Luděk Pour IHOK FN Brno C M G M Y E L O M A Č E S K Á M YE LO M O VÁ S K U P IN A Setkání klubu pacientů 11.5.2016
C Z E C H G R O U P CZECH GROUP 1 Rozdíly mezi novými a klasickými léky u mnohočetného myelomu Luděk Pour IHOK FN Brno C M G M Y E L O M A Č E S K Á M YE LO M O VÁ S K U P IN A Setkání klubu pacientů 11.5.2016
Elektronická knihovna chemoterapeutických režimů a její využití ve vzdělávání lékařů
 Elektronická knihovna chemoterapeutických režimů a její využití ve vzdělávání lékařů D. Klimeš, L. Dušek, J. Fínek, M. Kubásek,J. Koptíková, L. Šnajdrová, P. Brabec,J. Novotný, R. Vyzula, J. Abrahámová,
Elektronická knihovna chemoterapeutických režimů a její využití ve vzdělávání lékařů D. Klimeš, L. Dušek, J. Fínek, M. Kubásek,J. Koptíková, L. Šnajdrová, P. Brabec,J. Novotný, R. Vyzula, J. Abrahámová,
Interaktivní nástroje pro výuku léčebných standardů cytostatické léčby zhoubných nádorů Portál DIOS
 Interaktivní nástroje pro výuku léčebných standardů cytostatické léčby zhoubných nádorů Portál DIOS Klimeš D., Dušek L., Kubásek J., Fínek J., Petruželka L., Zoláková A., Vyzula R. Historie projektu Snaha
Interaktivní nástroje pro výuku léčebných standardů cytostatické léčby zhoubných nádorů Portál DIOS Klimeš D., Dušek L., Kubásek J., Fínek J., Petruželka L., Zoláková A., Vyzula R. Historie projektu Snaha
Kongres medicíny pro praxi IFDA Praha, Hotel Hilton 27.září 2014
 Kongres medicíny pro praxi IFDA Praha, Hotel Hilton 27.září 2014 Co znamená cílená terapie karcinomu plic v roce 2014? František Salajka Plicní klinika FN Hradec Králové Co může pneumoonkologické centrum
Kongres medicíny pro praxi IFDA Praha, Hotel Hilton 27.září 2014 Co znamená cílená terapie karcinomu plic v roce 2014? František Salajka Plicní klinika FN Hradec Králové Co může pneumoonkologické centrum
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu
 Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
RENIS - Votrient. Klinický registr pacientů s renálním karcinomem. Stav registru k datu 26. 3. 2012
 RENIS - Votrient Klinický registr pacientů s renálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr. Zbyněk
RENIS - Votrient Klinický registr pacientů s renálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr. Zbyněk
SYSTÉMOVÁ LÉČBA NÁDORŮ MOČOVÉHO MĚCHÝŘE
 SYSTÉMOVÁ LÉČBA NÁDORŮ MOČOVÉHO MĚCHÝŘE Jana Katolická FN u svaté Anny, Brno CZ/ONCO/617/0088 1 UROTELIÁLNÍ KARCINOM MOČOVÉHO MĚCHÝŘE CHEMOSENZITIVNÍ ONEMOCNĚNÍ. V době stanovení diagnózy je 15 % lokálně
SYSTÉMOVÁ LÉČBA NÁDORŮ MOČOVÉHO MĚCHÝŘE Jana Katolická FN u svaté Anny, Brno CZ/ONCO/617/0088 1 UROTELIÁLNÍ KARCINOM MOČOVÉHO MĚCHÝŘE CHEMOSENZITIVNÍ ONEMOCNĚNÍ. V době stanovení diagnózy je 15 % lokálně
2. pražské mezioborové onkologické kolokvium Prague ONCO 2011
 Záštitu nad kolokviem převzaly: Evropská onkologická společnost Ministerstvo školství, mládeže a tělovýchovy ČR Ministerstvo zdravotnictví ČR Česká onkologická společnost Česká urologická společnost Česká
Záštitu nad kolokviem převzaly: Evropská onkologická společnost Ministerstvo školství, mládeže a tělovýchovy ČR Ministerstvo zdravotnictví ČR Česká onkologická společnost Česká urologická společnost Česká
Přínos molekulární genetiky pro diagnostiku a terapii malignit GIT v posledních 10 letech
 Přínos molekulární genetiky pro diagnostiku a terapii malignit GIT v posledních 10 letech Minárik M. Centrum aplikované genomiky solidních nádorů (CEGES), Genomac výzkumný ústav, Praha XXIV. JARNÍ SETKÁNÍ
Přínos molekulární genetiky pro diagnostiku a terapii malignit GIT v posledních 10 letech Minárik M. Centrum aplikované genomiky solidních nádorů (CEGES), Genomac výzkumný ústav, Praha XXIV. JARNÍ SETKÁNÍ
ANALÝZA VÝSLEDKŮ LÉČBY HERCEPTINEM
 ANALÝZA VÝSLEDKŮ LÉČBY HERCEPTINEM Statistická analýza dat k 30. 4. 2006 AUTOŘI: R. Vyzula, D. Némethová, O. Coufal I. ZÁKLADNÍ POPIS SOUBORU I.1. Počet pacientek v jednotlivých centrech Celkový počet
ANALÝZA VÝSLEDKŮ LÉČBY HERCEPTINEM Statistická analýza dat k 30. 4. 2006 AUTOŘI: R. Vyzula, D. Némethová, O. Coufal I. ZÁKLADNÍ POPIS SOUBORU I.1. Počet pacientek v jednotlivých centrech Celkový počet
Význam časné nádorové regrese a hloubky léčebné odpovědi při hodnocení účinnosti systémové léčby metastazujícího kolorektálního karcinomu
 PŘEHLED Význam časné nádorové regrese a hloubky léčebné odpovědi při hodnocení účinnosti systémové léčby metastazujícího kolorektálního karcinomu The Importance of Early Tumor Shrinkage and Deepness of
PŘEHLED Význam časné nádorové regrese a hloubky léčebné odpovědi při hodnocení účinnosti systémové léčby metastazujícího kolorektálního karcinomu The Importance of Early Tumor Shrinkage and Deepness of
Možnosti léčby kastračně rezistentního metastatického karcinomu prostaty
 Možnosti léčby kastračně rezistentního metastatického karcinomu prostaty Iveta Kolářová Oddělení klinické a radiační onkologie Pardubice Multiscan s.r.o. Pardubická krajská nemocnice, a.s. Pardubice 19.9.2012
Možnosti léčby kastračně rezistentního metastatického karcinomu prostaty Iveta Kolářová Oddělení klinické a radiační onkologie Pardubice Multiscan s.r.o. Pardubická krajská nemocnice, a.s. Pardubice 19.9.2012
Časné fáze klinických studií
 Časné fáze klinických studií Mikulov, 13.4.2012 Regina Demlová, FÚ LF MU a MOÚ Stávající situace v klinickém výzkumu Počet nových látek v klinickém výzkumu (NMEs) v posledních 15-20-ti letech narůstá Počet
Časné fáze klinických studií Mikulov, 13.4.2012 Regina Demlová, FÚ LF MU a MOÚ Stávající situace v klinickém výzkumu Počet nových látek v klinickém výzkumu (NMEs) v posledních 15-20-ti letech narůstá Počet
TARCEVA klinický registr
 TARCEVA klinický registr Karcinom pankreatu Stav k datu 10. 10. 2011 Analýza dat: Mgr. Zbyněk Bortlíček Informační technologie: RNDr. Daniel Klimeš, Ph.D. Management projektu: Ing. Petr Brabec, Mgr. Karel
TARCEVA klinický registr Karcinom pankreatu Stav k datu 10. 10. 2011 Analýza dat: Mgr. Zbyněk Bortlíček Informační technologie: RNDr. Daniel Klimeš, Ph.D. Management projektu: Ing. Petr Brabec, Mgr. Karel
Role kombinace cílené léãby a chemoterapie v léãbû metastatického kolorektálního karcinomu
 Role kombinace cílené léãby a chemoterapie v léãbû metastatického kolorektálního karcinomu Prof. MUDr. Bohuslav Melichar, Ph.D. / Onkologická klinika Lékafiské fakulty Univerzity Palackého a Fakultní nemocnice,
Role kombinace cílené léãby a chemoterapie v léãbû metastatického kolorektálního karcinomu Prof. MUDr. Bohuslav Melichar, Ph.D. / Onkologická klinika Lékafiské fakulty Univerzity Palackého a Fakultní nemocnice,
Pomalidomid první rok léčby v ČR
 C Z E C H G R O U P CZECH GROUP 1 Pomalidomid první rok léčby v ČR Luděk Pour IHOK FN Brno XIII. Výroční setkání CMG 10. 4. 2015 Mikulov C M G M Y E L O M A Č E S K Á M YE LO M O VÁ S K U P IN A CMG ČESKÁ
C Z E C H G R O U P CZECH GROUP 1 Pomalidomid první rok léčby v ČR Luděk Pour IHOK FN Brno XIII. Výroční setkání CMG 10. 4. 2015 Mikulov C M G M Y E L O M A Č E S K Á M YE LO M O VÁ S K U P IN A CMG ČESKÁ
Opakované resekce jater pro metastázy kolorektálního karcinomu
 Opakované resekce jater pro metastázy kolorektálního karcinomu Visokai V., Lipská L., Mráček M., Levý M. Chirurgická klinika 1. LF UK a Fakultní Thomayerovy nemocnice v Praze přednosta Doc. MUDr. V. Visokai,
Opakované resekce jater pro metastázy kolorektálního karcinomu Visokai V., Lipská L., Mráček M., Levý M. Chirurgická klinika 1. LF UK a Fakultní Thomayerovy nemocnice v Praze přednosta Doc. MUDr. V. Visokai,
Analýza dat z klinického registru RenIS České onkologické společnosti ČLS JEP shrnutí výsledků pro elektronický report
 Účinnost a bezpečnost přípravku Afinitor (everolimus) v léčbě pacientů s pokročilým karcinomem ledviny v podmínkách reálné klinické praxe v České republice Analýza dat z klinického registru RenIS České
Účinnost a bezpečnost přípravku Afinitor (everolimus) v léčbě pacientů s pokročilým karcinomem ledviny v podmínkách reálné klinické praxe v České republice Analýza dat z klinického registru RenIS České
Standard NLPP 3.5 SEKCE: NLPP STRANA PROCEDURY: 1/7. PŘEDMĚT/VÝKON/PROCEDURA Kolorektální karcinom
 1/7 1. Epidemiologie: Česká republika zaujímá ve statistikách dlouhodobě jedno z předních míst při hodnocení incidence tohoto onemocnění v zemích, kde jsou vedeny registry. V roce 2014 byla incidence KRK
1/7 1. Epidemiologie: Česká republika zaujímá ve statistikách dlouhodobě jedno z předních míst při hodnocení incidence tohoto onemocnění v zemích, kde jsou vedeny registry. V roce 2014 byla incidence KRK
Jak dlouho podávat adjuvantní LHRH analoga? Stanislav Batko Radioterap.-onkol. Odd FNM
 Jak dlouho podávat adjuvantní LHRH analoga? Stanislav Batko Radioterap.-onkol. Odd FNM Krátce na úvod hypothalamus hypofýza ovarium X X X Pokles tvorby estradiolu Goserelin Blokáda tvorby LH mamma LHRH
Jak dlouho podávat adjuvantní LHRH analoga? Stanislav Batko Radioterap.-onkol. Odd FNM Krátce na úvod hypothalamus hypofýza ovarium X X X Pokles tvorby estradiolu Goserelin Blokáda tvorby LH mamma LHRH
Vývoj nových léčiv. Preklinický výzkum Klinický výzkum
 Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
Analýzy pro Kraj Vysočina
 Příloha č. 10 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Kraj Vysočina Koncept zprávy, metodika výpočtů a celkové populační
Příloha č. 10 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Kraj Vysočina Koncept zprávy, metodika výpočtů a celkové populační
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
Analýzy pro Hlavní město Praha
 Příloha č. 01 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Hlavní město Praha Koncept zprávy, metodika výpočtů a celkové populační
Příloha č. 01 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Hlavní město Praha Koncept zprávy, metodika výpočtů a celkové populační
Analýzy pro Zlínský kraj
 Příloha č. 13 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Zlínský kraj Koncept zprávy, metodika výpočtů a celkové populační
Příloha č. 13 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Zlínský kraj Koncept zprávy, metodika výpočtů a celkové populační
Analýzy pro Plzeňský kraj
 Příloha č. 04 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Plzeňský kraj Koncept zprávy, metodika výpočtů a celkové populační
Příloha č. 04 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Plzeňský kraj Koncept zprávy, metodika výpočtů a celkové populační
Analýzy pro Liberecký kraj
 Příloha č. 07 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Liberecký kraj Koncept zprávy, metodika výpočtů a celkové populační
Příloha č. 07 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Liberecký kraj Koncept zprávy, metodika výpočtů a celkové populační
Edukační materiály. KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře
 Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Analýzy pro Jihočeský kraj
 Příloha č. 0 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Jihočeský kraj Koncept zprávy, metodika výpočtů a celkové populační
Příloha č. 0 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Jihočeský kraj Koncept zprávy, metodika výpočtů a celkové populační
Analýzy pro Středočeský kraj
 Příloha č. 02 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Středočeský kraj Koncept zprávy, metodika výpočtů a celkové populační
Příloha č. 02 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Středočeský kraj Koncept zprávy, metodika výpočtů a celkové populační
Analýzy pro Olomoucký kraj
 Příloha č. 12 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Olomoucký kraj Koncept zprávy, metodika výpočtů a celkové populační
Příloha č. 12 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Olomoucký kraj Koncept zprávy, metodika výpočtů a celkové populační
Analýzy pro Moravskoslezský kraj
 Příloha č. 14 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Moravskoslezský kraj Koncept zprávy, metodika výpočtů a celkové populační
Příloha č. 14 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Moravskoslezský kraj Koncept zprávy, metodika výpočtů a celkové populační
TARCEVA klinický registr
 TARCEVA klinický registr Karcinom pankreatu Stav k datu 10. 4. 2011 Registr Tarceva je podporován výzkumným ý grantem firmy Roche. Česká onkologická společnost Institut biostatistiky a analýz Stav registru
TARCEVA klinický registr Karcinom pankreatu Stav k datu 10. 4. 2011 Registr Tarceva je podporován výzkumným ý grantem firmy Roche. Česká onkologická společnost Institut biostatistiky a analýz Stav registru
Karbapenemy v intenzivní péči K. Urbánek
 Karbapenemy v intenzivní péči K. Urbánek Ústav farmakologie Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc Rozdělení Skupina I Skupina II ertapenem, panipenem, tebipenem omezený účinek
Karbapenemy v intenzivní péči K. Urbánek Ústav farmakologie Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc Rozdělení Skupina I Skupina II ertapenem, panipenem, tebipenem omezený účinek
Analýzy pro Karlovarský kraj
 Příloha č. 05 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Karlovarský kraj Koncept zprávy, metodika výpočtů a celkové populační
Příloha č. 05 zprávy ČOS: Podklady pro plánování nákladů léčebné péče v onkologii - analýzy dostupných populačních dat v ČR Analýzy pro Karlovarský kraj Koncept zprávy, metodika výpočtů a celkové populační
Klinická dozimetrie v NM 131. I-MIBG terapie neuroblastomu
 Klinická dozimetrie v NM 131 I-MIBG terapie neuroblastomu Prchalová D., Solný P., Kráčmerová T. Klinika nukleární medicíny a endokrinologie 2. LF UK a FN Motol 7. Konference radiologické fyziky Harrachov,
Klinická dozimetrie v NM 131 I-MIBG terapie neuroblastomu Prchalová D., Solný P., Kráčmerová T. Klinika nukleární medicíny a endokrinologie 2. LF UK a FN Motol 7. Konference radiologické fyziky Harrachov,
STUDIE 2014 KLINIKA ONKOLOGIE A RADIOTERAPIE AKTIVNÍ NÁBOR PACIENTŮ
 STUDIE 2014 KLINIKA ONKOLOGIE A RADIOTERAPIE AKTIVNÍ NÁBOR PACIENTŮ KARCINOM PRSU Spoluzkoušející: MUDr.Iva Slánská, MUDr.Peter Priester,MUDr.Adam Paulík Název studie : PH3-01 Studie Present Prevence recidivy
STUDIE 2014 KLINIKA ONKOLOGIE A RADIOTERAPIE AKTIVNÍ NÁBOR PACIENTŮ KARCINOM PRSU Spoluzkoušející: MUDr.Iva Slánská, MUDr.Peter Priester,MUDr.Adam Paulík Název studie : PH3-01 Studie Present Prevence recidivy
Rozbor léčebné zátěže Thomayerovy nemocnice onkologickými pacienty a pilotní prezentace výsledků péče
 Rozbor léčebné zátěže Thomayerovy nemocnice onkologickými pacienty a pilotní prezentace výsledků péče Výstupy analýzy dat zdravotnického zařízení a Národního onkologického registru ČR Prof. MUDr. Jitka
Rozbor léčebné zátěže Thomayerovy nemocnice onkologickými pacienty a pilotní prezentace výsledků péče Výstupy analýzy dat zdravotnického zařízení a Národního onkologického registru ČR Prof. MUDr. Jitka
TULUNG - AVASTIN. Klinický registr pacientů s nemalobuněčným karcinomem plic. Stav registru k datu 26. 3. 2012
 TULUNG - AVASTIN Klinický registr pacientů s nemalobuněčným karcinomem plic Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr.
TULUNG - AVASTIN Klinický registr pacientů s nemalobuněčným karcinomem plic Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr.
Elementy signálních drah. cíle protinádorové terapie
 Elementy signálních drah cíle protinádorové terapie Martin Pešta, Ondřej Topolčan Department of Internal Medicine II, Faculty of Medicine in Pilsen, Charles University in Prague, Czech Republic Cílená
Elementy signálních drah cíle protinádorové terapie Martin Pešta, Ondřej Topolčan Department of Internal Medicine II, Faculty of Medicine in Pilsen, Charles University in Prague, Czech Republic Cílená
Lékový registr ALIMTA
 Lékový registr Pravidelný report Maligní pleurální mezoteliom (MPM) Stav registru k datu 31. 3. 2014 Pneumoonkologická centra zapojená v projektu Alimta 1. FN Brno Jihlavská 20, 625 00 Brno - Bohunice
Lékový registr Pravidelný report Maligní pleurální mezoteliom (MPM) Stav registru k datu 31. 3. 2014 Pneumoonkologická centra zapojená v projektu Alimta 1. FN Brno Jihlavská 20, 625 00 Brno - Bohunice
Nové možnosti. terapeutického ovlivnění pokročilého karcinomu prostaty. Mám nádor prostaty a co dál? Jana Katolická
 MEZINÁRODNÍ CENTRUM KLINICKÉHO VÝZKUMU Nové možnosti TVOŘÍME BUDOUCNOST MEDICÍNY terapeutického ovlivnění pokročilého karcinomu prostaty Jana Katolická Primář onkologicko-chirurgické oddělení Mám nádor
MEZINÁRODNÍ CENTRUM KLINICKÉHO VÝZKUMU Nové možnosti TVOŘÍME BUDOUCNOST MEDICÍNY terapeutického ovlivnění pokročilého karcinomu prostaty Jana Katolická Primář onkologicko-chirurgické oddělení Mám nádor
Keytruda (pembrolizumabum)
 EMA/235911/2019 EMEA/H/C/003820 Přehled pro přípravek Keytruda a proč byl přípravek registrován v EU Co je přípravek Keytruda a k čemu se používá? Keytruda je protinádorový léčivý přípravek používaný k
EMA/235911/2019 EMEA/H/C/003820 Přehled pro přípravek Keytruda a proč byl přípravek registrován v EU Co je přípravek Keytruda a k čemu se používá? Keytruda je protinádorový léčivý přípravek používaný k
TULUNG - AVASTIN. Klinický registr pacientů s nemalobuněčným karcinomem plic. Stav registru k datu 17. 9. 2012
 TULUNG - AVASTIN Klinický registr pacientů s nemalobuněčným karcinomem plic Stav registru k datu 17. 9. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr.
TULUNG - AVASTIN Klinický registr pacientů s nemalobuněčným karcinomem plic Stav registru k datu 17. 9. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr.
Lékový registr ALIMTA
 Lékový registr Pravidelný report Maligní pleurální mezoteliom (MPM) Stav registru k datu 19. 10. 2015 Pneumoonkologická centra zapojená v projektu Alimta 1. FN Brno Jihlavská 20, 625 00 Brno - Bohunice
Lékový registr Pravidelný report Maligní pleurální mezoteliom (MPM) Stav registru k datu 19. 10. 2015 Pneumoonkologická centra zapojená v projektu Alimta 1. FN Brno Jihlavská 20, 625 00 Brno - Bohunice
Vliv způsobu podání bortezomibu na účinnost a bezpečnost léčby pacientů s mnohočetným myelomem. MUDr. P. Pavlíček FN KV a 3.
 Vliv způsobu podání bortezomibu na účinnost a bezpečnost léčby pacientů s mnohočetným myelomem MUDr. P. Pavlíček FN KV a 3. LF UK Praha Tato prezentace vznikla s finanční podporou společnosti Johnson &
Vliv způsobu podání bortezomibu na účinnost a bezpečnost léčby pacientů s mnohočetným myelomem MUDr. P. Pavlíček FN KV a 3. LF UK Praha Tato prezentace vznikla s finanční podporou společnosti Johnson &
IMUNOTERAPIE NÁDORŮ MOČOVÉHO MĚCHÝŘE. Michaela Matoušková
 IMUNOTERAPIE NÁDORŮ MOČOVÉHO MĚCHÝŘE Michaela Matoušková IMUNOTERAPIE ZN Z UROTELU lokalizovaná onemocnění - BCG VAKCÍNA pokročilá onemocnění BCG VAKCÍNA po instilaci vazba BCG k fibronektinu produkovanému
IMUNOTERAPIE NÁDORŮ MOČOVÉHO MĚCHÝŘE Michaela Matoušková IMUNOTERAPIE ZN Z UROTELU lokalizovaná onemocnění - BCG VAKCÍNA pokročilá onemocnění BCG VAKCÍNA po instilaci vazba BCG k fibronektinu produkovanému
EDUKAČNÍ MATERIÁLY. KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
Metastatický renální karcinom Andrašina Tomáš
 Metastatický renální karcinom Andrašina Tomáš Department of Radiology and Nuclear Medicine, University Hospital Brno and Medical Faculty, Masaryk University, Brno, Czech Republic Renální karcinom 25-30
Metastatický renální karcinom Andrašina Tomáš Department of Radiology and Nuclear Medicine, University Hospital Brno and Medical Faculty, Masaryk University, Brno, Czech Republic Renální karcinom 25-30
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
AKTUÁLNÍ VÝSLEDKY KLINICKÝCH STUDIÍ
 SEKCE NÁDORY PRSU PŮVODNÍ SDĚLENÍ AKTUÁLNÍ VÝSLEDKY KLINICKÝCH STUDIÍ Letošní konference ASCO 2017 přinesla řadu zajímavých výsledků a naději na opětovné zlepšení přežití pacientů so solidními nádory,
SEKCE NÁDORY PRSU PŮVODNÍ SDĚLENÍ AKTUÁLNÍ VÝSLEDKY KLINICKÝCH STUDIÍ Letošní konference ASCO 2017 přinesla řadu zajímavých výsledků a naději na opětovné zlepšení přežití pacientů so solidními nádory,
Nádory podjaterní krajiny Onkologická terapie. Doc. MUDr. Martina Kubecová, Ph.D. Radioterapeutická a onkologická klinika 3. LF UK a FNKV, Praha
 Nádory podjaterní krajiny Onkologická terapie Doc. MUDr. Martina Kubecová, Ph.D. Radioterapeutická a onkologická klinika 3. LF UK a FNKV, Praha Český a slovenský gastroenterologický kongres 13.11.2015
Nádory podjaterní krajiny Onkologická terapie Doc. MUDr. Martina Kubecová, Ph.D. Radioterapeutická a onkologická klinika 3. LF UK a FNKV, Praha Český a slovenský gastroenterologický kongres 13.11.2015
Karcinomy u dětí a dospívajících v letech na Klinice dětské hematologie a onkologie 2. LF UK a FN Motol
 Karcinomy u dětí a dospívajících v letech 2007-2012 na Klinice dětské hematologie a onkologie 2. LF UK a FN Motol L. Cingrošová 1, V. Šmelhaus 1 D. Sumerauer 1, J. Šnajdauf 2, P. Vlček 3, M. Kynčl 4, R.
Karcinomy u dětí a dospívajících v letech 2007-2012 na Klinice dětské hematologie a onkologie 2. LF UK a FN Motol L. Cingrošová 1, V. Šmelhaus 1 D. Sumerauer 1, J. Šnajdauf 2, P. Vlček 3, M. Kynčl 4, R.
Registr Herceptin Karcinom prsu
 I. Primární diagnostika Registr Herceptin Karcinom prsu Vstupní parametry Rok narození Věk Kód zdravotní pojišťovny (výběr) o 111 o 201 o 205 o 207 o 209 o 211 o 213 o 217 o 222 Datum stanovení diagnózy
I. Primární diagnostika Registr Herceptin Karcinom prsu Vstupní parametry Rok narození Věk Kód zdravotní pojišťovny (výběr) o 111 o 201 o 205 o 207 o 209 o 211 o 213 o 217 o 222 Datum stanovení diagnózy
Všechno co jste kdy chtěli vědět o onkologii, ale báli jste se zeptat. David Feltl Fakultní nemocnice Ostrava
 Všechno co jste kdy chtěli vědět o onkologii, ale báli jste se zeptat. David Feltl Fakultní nemocnice Ostrava Obsah Proč jsou zhoubné nádory zhoubné? Stručná historie oboru a jednotlivých léčebných metod
Všechno co jste kdy chtěli vědět o onkologii, ale báli jste se zeptat. David Feltl Fakultní nemocnice Ostrava Obsah Proč jsou zhoubné nádory zhoubné? Stručná historie oboru a jednotlivých léčebných metod
Personalizovaná medicína Roche v oblasti onkologie. Olga Bálková, Roche s.r.o., Diagnostics Division Pracovní dny, Praha, 11.
 Personalizovaná medicína Roche v oblasti onkologie Olga Bálková, Roche s.r.o., Diagnostics Division Pracovní dny, Praha, 11. listopadu 2013 Personalizovaná vs standardní péče Cílená léčba Spojení diagnostiky
Personalizovaná medicína Roche v oblasti onkologie Olga Bálková, Roche s.r.o., Diagnostics Division Pracovní dny, Praha, 11. listopadu 2013 Personalizovaná vs standardní péče Cílená léčba Spojení diagnostiky
ANASTROZOL MEDAC 1 mg POTAHOVANÁ TABLETA ESCITALOPRAM MYLAN 10 mg
 ANASTROZOL MEDAC 1 mg POTAHOVANÁ TABLETA 44/369/09-C DR: O RP: 44/1296/97-C D: MEDAC, GESELLSCHAFT FÜR KLINISCHE SPEZIALPRÄPARATE MBH, HAMBURG, Německo S: Anastrozolum 1 mg PP: Bílé kulaté bikonvexní potahované
ANASTROZOL MEDAC 1 mg POTAHOVANÁ TABLETA 44/369/09-C DR: O RP: 44/1296/97-C D: MEDAC, GESELLSCHAFT FÜR KLINISCHE SPEZIALPRÄPARATE MBH, HAMBURG, Německo S: Anastrozolum 1 mg PP: Bílé kulaté bikonvexní potahované
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Avastin 25 mg/ml koncentrát pro přípravu infuzního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 25 mg bevacizumabu. Jedna injekční
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Avastin 25 mg/ml koncentrát pro přípravu infuzního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 25 mg bevacizumabu. Jedna injekční
Léčba MM LP Revlimid v ČR - aktuální analýza dat RMG
 Léčba MM LP Revlimid v ČR - aktuální analýza dat RMG Statistická analýza 262 pacientů Vladimír Maisnar za II. interní klinika OKH FN a LF UK Hradec Králové Léčba MM LP Revlimid v ČR Látka patřící do skupiny
Léčba MM LP Revlimid v ČR - aktuální analýza dat RMG Statistická analýza 262 pacientů Vladimír Maisnar za II. interní klinika OKH FN a LF UK Hradec Králové Léčba MM LP Revlimid v ČR Látka patřící do skupiny
Důležité bezpečnostní informace pro zdravotnické pracovníky
 Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Avastin 25 mg/ml koncentrát pro přípravu infuzního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bevacizumabum 25mg v 1 ml. Jedna injekční lahvička
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Avastin 25 mg/ml koncentrát pro přípravu infuzního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bevacizumabum 25mg v 1 ml. Jedna injekční lahvička
HIV (z klinického pohledu)
 HIV (z klinického pohledu) David Jilich HIV centrum, Nemocnice Na Bulovce, Praha 11.12. 2014 Vývoj situace ve světě Changes in incidance rate 2001 to 2009 zdroj: UNAIDS Zákadní charakteristika virová infekce
HIV (z klinického pohledu) David Jilich HIV centrum, Nemocnice Na Bulovce, Praha 11.12. 2014 Vývoj situace ve světě Changes in incidance rate 2001 to 2009 zdroj: UNAIDS Zákadní charakteristika virová infekce
Testování biomarkerů u kolorektálního karcinomu.
 Testování biomarkerů u kolorektálního karcinomu. Milada Matějčková (1), Pavel Fabian (2) Lenka Dubská (2), Eva Parobková(1), Martin Beránek(3), Monika Drastíková(3), Daniel Tvrdík(4)), Jiří Drábek(6),
Testování biomarkerů u kolorektálního karcinomu. Milada Matějčková (1), Pavel Fabian (2) Lenka Dubská (2), Eva Parobková(1), Martin Beránek(3), Monika Drastíková(3), Daniel Tvrdík(4)), Jiří Drábek(6),
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU VPRIV 200 U prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 200 jednotek* (U) velaglucerasum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU VPRIV 200 U prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 200 jednotek* (U) velaglucerasum
Režimy s nízkým rizikem FN riziko do 10 % Režimy se středním rizikem FN riziko 10 19% Režimy s vysokým rizikem FN riziko 20 a více procent
 Portál DIOS verze II Druhá verze portálu DIOS a jeho elektronické knihovny chemorežimů přináší nové informace a nové nástroje týkající se problematiky toxicity chemoterapie. Jde především o problematiku
Portál DIOS verze II Druhá verze portálu DIOS a jeho elektronické knihovny chemorežimů přináší nové informace a nové nástroje týkající se problematiky toxicity chemoterapie. Jde především o problematiku
LÉČBA BOLESTI - POHLED SÚKL NA KLINICKÁ HODNOCENÍ
 Léčba bolesti pohled SÚKL na klinická hodnocení 1 LÉČBA BOLESTI - POHLED SÚKL NA KLINICKÁ HODNOCENÍ MUDr. Alice Němcová MUDr. Alena Trunečková Léčba bolesti pohled SÚKL na klinická hodnocení 2 Klinická
Léčba bolesti pohled SÚKL na klinická hodnocení 1 LÉČBA BOLESTI - POHLED SÚKL NA KLINICKÁ HODNOCENÍ MUDr. Alice Němcová MUDr. Alena Trunečková Léčba bolesti pohled SÚKL na klinická hodnocení 2 Klinická
Jedna injekční lahvička obsahuje buď 100 mg panitumumabu v 5 ml, 200 mg v 10 ml nebo 400 mg ve 20 ml koncentrátu.
 1. NÁZEV PŘÍPRAVKU Vectibix 20 mg/ml koncentrát pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu obsahuje 20 mg panitumumabum. Jedna injekční lahvička obsahuje
1. NÁZEV PŘÍPRAVKU Vectibix 20 mg/ml koncentrát pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu obsahuje 20 mg panitumumabum. Jedna injekční lahvička obsahuje
Klinická data bevacizumabu v úvodní léčbě karcinomu vaječníků: GOG-0218
 Klinická data bevacizumabu v úvodní léčbě karcinomu vaječníků: GOG-0218 Professor Bradley J. Monk Division of Gynecologic Oncology Department of Obstetrics and Gynecology Creighton University School of
Klinická data bevacizumabu v úvodní léčbě karcinomu vaječníků: GOG-0218 Professor Bradley J. Monk Division of Gynecologic Oncology Department of Obstetrics and Gynecology Creighton University School of
