v praxi Aktuality v léčbě metastatického kolorektálního karcinomu Supplementum onkologie 1/ aflibercept
|
|
|
- Marcel Vítek
- před 8 lety
- Počet zobrazení:
Transkript
1 v praxi Supplementum onkologie 1/2016 Aktuality v léčbě metastatického kolorektálního karcinomu 5 aflibercept MUDr. Eugen Kubala 11 Aflibercept u pacientky s metastatickým kolorektálním karcinomem MUDr. Stanislav Batko 13 Pozice afliberceptu v dlouhodobé kontrole nemoci u pacienta s metastatickým kolorektálním karcinomem Doc. MUDr. Ilona Kocáková, Ph.D.; MUDr. Ivo Kocák, Ph.D. 16 Aflibercept v léčbě metastazujícího karcinomu kolorekta 17 Dlouhodobá účinnost a bezpečnost afliberceptu v kombinaci s FOLFIRI u pacientů s metastatickým kolorektálním karcinomem analýza studie VELOUR 19 Komentář ke studii Prof. MUDr. Jindřich Fínek, Ph.D. 20 Současný pohled na farmakoterapii metastatického inoperabilního kolorektálního karcinomu Prof. MUDr. Luboš Petruželka, CSc.; MUDr. Patrik Georgiev; MUDr. Michal Vočka; MUDr. Jan Špaček, Ph.D.
2 v praxi Supplementum onkologie 1/2016 vydavatel Farmakon Press, spol. s r.o. Václavská Praha 2 tel.: fax: šéfredaktor zástupkyně šéfredaktora obchodní ředitelka redakční rada MUDr. Tomáš Doležal, Ph.D. Mgr. Kateřina Daňhová Bc. Petra Hakavcová MUDr. David Doležil, Ph.D. Prof. MUDr. Robert Hatala, Ph.D., FESC, FACC MUDr. Stanislav Konštacký, CSc. Prof. MUDr. Milan Kvapil, CSc. MUDr. Radek Litvik Prof. MUDr. Milan Lukáš, CSc. Doc. MUDr. Norbert Pauk, Ph.D. Prof. MUDr. Karel Pavelka, DrSc. Prof. MUDr. Hana Rosolová, DrSc., FESC Prof. MUDr. Jaromír Švestka, DrSc. Prof. MUDr. Jan Švihovec, DrSc. Prof. MUDr. Jiří Vorlíček, CSc. Prof. MUDr. Jiří Widimský, jr., CSc. MUDr. Libor Zámečník odborná redakce jazyková redakce Mgr. Kateřina Daňhová, danhova@farmakoterapie.cz MUDr. Jana Fabiánová MUDr. Jiří Slíva, Ph.D. Mgr. Eva Kantorová marketing Bc. Petra Hakavcová, hakavcova@farmakoterapie.cz a inzerce mobil: Jakub Štěpánovský, stepanovsky@farmakoterapie.cz mobil: grafická úprava ročník Věra Horáčková, verkahor@farmakoterapie.cz Helena Mešková registrace MK ČR E ISSN copyright 2016 Farmakon Press, spol. s r.o. Články publikované v tomto časopise reprezentují názor autora či autorů. Jakákoli část obsahu časopisu nesmí být kopírována nebo rozmnožována s cílem dalšího rozšiřování jakýmkoli způsobem a v jakékoli formě bez souhlasu Farmakon Press, spol. s r.o. Redakce nezodpovídá za obsah inzerce a reklamy.
3 v praxi 3
4 4 v praxi
5 VEGF aflibercept Aflibercept MUDr. Eugen Kubala Klinika onkologie a radioterapie FN, Hradec Králové Souhrn Kubala E. Aflibercept. Farmakoterapie v praxi 2016;5(Suppl 1):5 10. Aflibercept je nový rekombinantní fúzní protein, který se zaměřuje na signální dráhy angiogeneze nádorových buněk blokováním vaskulárního endoteliálního růstového faktoru (VEGF), který stimuluje receptory, jež hrají klíčovou úlohu v růstu nádoru a metastáz. Je silnějším blokátorem VEGF než bevacizumab. Je používán v kombinaci s fluorouracilem, irinotecanem a leucovorinem (FOLFIRI) ve 2. linii léčby pacientů s metastatickým kolorektálním karcinomem (mcrc), u nichž onemocnění progredovalo během 1. linie chemoterapie na bázi oxaliplatiny. Výsledky studie III. fáze prokázaly, že aflibercept v kombinaci s režimem FOLFIRI proti FOLFIRI samotnému dosahuje vyššího počtu celkových odpovědí, prodloužení celkového přežití a přežití bez progrese onemocnění u pacientů s mcrc, včetně těch, kteří absolvovali předchozí léčbu s bevacizumabem. Aflibercept je podobný ostatním antiangiogenním lékům a nežádoucí vedlejší účinky zahrnují hypertenzi, proteinurii, únavu a bolest hlavy. Nejčastějšími nežádoucími účinky stupně 3 a 4 spojenými s afliberceptem v klinických studiích byly hypertenze, proteinurie a průjem. Byla také prokázána možnost krvácení. V České republice je kombinace FOLFIRI s afliberceptem standardně řazena do 2. linie léčby mcrc. Klíčová slova aflibercept, angiogeneze, metastatický kolorektální karcinom, 2. linie léčby Summary Kubala E. Aflibercept. Farmakoterapie v praxi 2016;5(Suppl 1):5 10. Aflibercept is a new recombinant fusion protein targeting angiogenesis signal pathways in tumour cells where it blocks vascular endothelial growth factor (VEGF) that stimulates key receptors for tumour growth and metastases. Its VEGF blocking activity exceeds that of bevacizumab. It is used in combination with fluorouracil, irinotecan and leucovorin (FOLFIRI) as part of second-line treatment of patients with metastatic colorectal cancer (mcrc) after disease progression over the course of firstline oxaliplatin-based chemotherapy. Results of a phase III study have shown that aflibercept combined with FOLFIRI vs. FOLFIRI alone results in higher overall response rates, longer-lasting extension of overall survival and progression- -free survival in patients with mcrc, including those after previous therapy with bevacizumab. Aflibercept is similar to other anti-angiogenesis drugs and its undesirable effects include arterial hypertension, proteinuria, fatigue and headache. Most common grade 3 and 4 undesirable associated with aflibercept encountered in clinical trials included arterial hypertension, proteinuria and diarrhoea. A potential to cause bleeding has also been shown. In the Czech Republic, the combination of FOLFIRI with aflibercept is a standard part of second-line therapy of mcrc. Key words aflibercept, angiogenesis, metastatic colorectal cancer, second-line therapy Úvod Angiogeneze je klíčovým mechanismem růstu a diseminace u všech nádorů. Její regulace je rozhodující pro vývoj nádorového onemocnění. 1 Nástup antiangiogenní terapie znamenal velký průlom v léčbě metastatického kolorektálního karcinomu (mcrc). U nemocných s mcrc je standardní úspěšnou léčbou blokáda angiogeneze bevacizumabem v kombinaci s chemoterapií. Bohužel vývoj rezistence vůči bevacizumabu je nevyhnutelný, a bylo potřeba najít novou strategii léčby. Fyziologická angiogeneze je přísně regulována. 2 Signální dráhy, které jsou zapojeny do regulace angiogeneze, zahrnují vaskulární endoteliální růstový faktor (VEGF), angiopoetiny, receptory NOTCH a integriny. 3 Rodina VEGF se skládá z pěti růstových faktorů: VEGF-A, VEGF-B, VEGF-C, VEGF-D a placentárního růstového faktoru (PlGF). 4 K aktivaci angiogeneze dochází, když se tyto růstové faktory navážou na specifické buněčné povrchové tyrosinkinázové receptory VEGFR-1, VEGFR-2 a VEGFR-3. VEGF-A je nejvíce proangiogenní faktor, může se vázat na VEGFR-1 nebo VEGFR-2, což vede k proliferaci endoteliálních buněk, jejich zlepšenému přežívání, migraci a zvýšené invazivitě nádoru. Stimuluje progenitorové buňky kostní dřeně a navozuje zvýšenou vaskulární permeabilitu a vazodilataci. 4 Další VEGF, jako jsou například VEGF-B a PIGF, také přispívají k nádorem indukované angiogenezi. 5 PlGF, který se váže na VEGFR1, má čtyři izoformy: PlGF1, PlGF2, PlGF3 a PlGF4. 6 Výsledkem jsou pak pozměněné cévy, které zásobují tumor, s četnými funkčními a strukturálními abnormalitami a nepřítomností normální vaskulární hierarchie a funkčních lymfatických cév. Projevují se zvýšenou propustností endoteliální vrstvy a abnormálním průtokem krve, což způsobuje zvýšený intersticiální tlak v tumoru a jeho okolí (obrázek 1). 4,7 v praxi 5
6 obrázek 1 Mechanismy angiogeneze (Podle 4) V současné době je velmi obtížné odhalit vznik rezistence vůči antiangiogenní léčbě. S ohledem na inhibici angiogeneze byly navrženy dva mechanismy rezistence: vnitřní a adaptivní. Vnitřní rezistence existuje v nádorech před léčbou, zatímco adaptivní rezistence vzniká po počáteční reakci na antiangiogenní terapii. 8 Oba typy rezistence se vyvíjejí prostřednictvím alternativních kompenzačních cest, remodelací cév, aktivací progenitorových angiogenních buněk v nádoru nebo zvyšováním počtu pericytů. Placentární obrázek 2 Mechanismy tvorby a struktura afliberceptu růstový faktor (PlGF) podporuje angiogenezi a nádorový růst. 9,10 PlGF může zprostředkovat rezistenci vůči antiangiogenním lékům tím, že podporuje proangiogenní signály i přes blokování VEGF. 9,10 Léčba bevacizumabem a kombinační chemoterapií je spojena se zvýšením hladin cirkulujících PlGF u pacientů s mkrk Zvýšená imunohistochemická exprese PlGF1 a PlGF2 u mcrc byla spojena se špatnou prognózou (n = 94). 14 Blokáda PlGF inhibovala růst nádoru na modelu xenoštěpu karcinomu tračníku člověka, což ukazuje terapeutický potenciál inhibice PlGF. 9 Léčba antiangiogenními léky tak probíhá ve dvou fázích. V první fázi dochází ke stabilizaci endoteliálních buněk cév, normalizaci funkce cévní stěny a úpravě cévního řečiště se snížením intersticiálního tlaku. To vede k lepší dostupnosti cytostatik pro nádor. 15,16 Ve druhé fázi pak je blokována tvorba nových cév, snižuje se permeabilita cév a dochází k regresi tvorby kapilárního řečiště v nové nádorové tkáni. 4,17 Bevacizumab jako první použitá antiangiogenní látka blokuje účinek VEGF-A, ale jeho účinek lze obejít dalšími mechanismy stimulace angiogeneze. Právě tuto rezistenci je schopen překonat aflibercept. Mechanismus účinku Venózní endoteliální růstový faktor (VEGF) je zodpovědný za stimulaci proliferace, migrace a přežívání aktivovaných endoteliálních buněk (varianty VEGF-A až -D, PIGF) zprostředkovává přenos signálu do buňky. Působí prostřednictvím dvou receptorů VEGFR-1 a VEGFR-2 (přítomny na povrchu endoteliálních buněk). Nadměrná aktivace těchto receptorů vede k patologické neovaskularizaci a vaskulární permeabilitě. VEGF-A se váže na VEGFR-2 s relativně nejvyšší afinitou. 5 V angiogenním procesu jsou ale kromě VEGF-A zahrnuty i další faktory včetně PlGF a VEGF-B. 4,5 Aflibercept je rekombinantní fúzní protein, který se skládá z VEGF-vazebných částí tvořených extracelulárními doménami lidských VEGFR-1 a VEGFR-2, fúzovaných k Fc části lidského IgG1. Váže se na VEGF-A s vyšší afinitou než přirozené receptory, stejně jako příbuzné ligandy PlGF a VEGF-B, a tím potenciálně blokuje aktivaci VEGFR-1 a VEGFR-2. Působí jako lapač ligandů (ligand trap), a tím brání vazbě endogenních ligandů na jejich vlastní receptory, čímž blokuje signální dráhy zprostředkované receptorem. Tato antiangiogenní látka se váže s vysokou afinitou na VEGF-A, VEGF-B a na růstové placentární faktory PlGF-1 a PlGF-2, a inhibuje tak s vysokou účinností angiogenezi (obrázek 2). Blokuje aktivaci receptorů VEGF a proliferaci endoteliálních buněk, a tím inhibuje růst nových cév, které zásobují nádor kyslíkem a živinami. Schopnost afliberceptu vázat se na VEGF-B a PIGF, kromě vysoké vazebné afinity pro VEGF-A, může poskytnout kompletní blokádu angiogeneze. Preklinická léčba afliberceptem vedla k inhibici růstu nádoru u různých xenografových modelů, včetně lidského karcinomu tlustého střeva Aflibercept prokázal synergický účinek s 5FU a s irinotecanem na zvířecích modelech. 22 Úroveň hladiny VEGF vázaného afliberceptem se může hodnotit stanovením množství endogenního VEGF 6 v praxi
7 v normálních a nádorových tkáních. Volný aflibercept se může vázat na nově secernovaný VEGF. In vivo biologické účinky afliberceptu korelovaly s přítomností nadbytku volného afliberceptu nad afliberceptem vázaným na VEGF. 19 Účinnost a bezpečnost afliberceptu samotného nebo v kombinaci s chemoterapií byla prozkoumána v několika klinických studiích. Aflibercept je nová molekula, která je schopna blokovat angiogenezi tak jako bevacizumab, a to s vyšší účinností a rozsahem. Farmakologické vlastnosti a lékové interakce Výsledky analýz vycházejí z výsledků od pacientů s různými typy pokročilých malignit (SPC). Aflibercept je absorbován na základě poměru volného afliberceptu a afliberceptu vázaného na VEGF. Cirkulující koncentrace afliberceptu vázaného na VEGF se zvyšují s dávkou afliberceptu, dokud nedojde k navázání na většinu dostupného VEGF. Další zvyšování dávky afliberceptu vedlo k růstu koncentrací cirkulujícího volného afliberceptu v závislosti na velikosti dávky, ale jen k nevýraznému dalšímu zvyšování koncentrací afliberceptu vázaného na VEGF. Aflibercept se podává pacientům nitrožilně v dávce 4 mg/kg jednou za dva týdny, a po tuto dobu je přítomno více volného cirkulujícího afliberceptu než afliberceptu vázaného na VEGF. Při použití režimu s doporučenou dávkou 4 mg/kg jednou za dva týdny se množství volného afliberceptu dostalo prakticky na rovnovážné koncentrace do druhého cyklu léčby v podstatě bez akumulace (poměr akumulace 1,2 v rovnovážném stavu v porovnání s prvním podáním). Distribuční objem volného afliberceptu v rovnovážném stavu je přibližně 8 litrů. U afliberceptu nebyly provedeny žádné metabolické studie, protože se jedná o protein. Lze předpokládat, že aflibercept je degradován na malé peptidy a jednotlivé aminokyseliny. Volný aflibercept je primárně odstraňován navázáním na endogenní VEGF za vzniku stabilního inaktivního komplexu. Stejně jako u jiných velkých proteinů se předpokládá, že jak volný, tak i vázaný aflibercept bude metabolizován, byť pomaleji, dalšími biologickými mechanismy, jako je například proteolytické štěpení. Při dávkách vyšších než 2 mg/kg činila clearance volného afliberceptu přibližně 1,0 l/den s terminálním poločasem 6 dnů. Proteiny s vysokou molekulární hmotností nejsou odstraňovány renální cestou, proto se očekává, že renální eliminace afliberceptu bude minimální. Interakce s jinými léčivy nebyly v analýze zaznamenány. Klinické studie Ve studii I. fáze byly vyhodnoceny různé dávky afliberceptu v kombinaci s chemoterapií FOLFOX. Aflibercept byl podáván v postupně se zvyšujících dávkách (2 5 mg/kg) pacientům s pokročilými solidními nádory. 23 Nebyla pozorována žádná toxicita limitující dávku a farmakokinetický profil afliberceptu nebyl ovlivněn chemoterapií FOLFOX. Objektivní odpovědi byly zaznamenány u 16 % pacientů. Doporučená dávka afliberceptu pro studie II. fáze u mcrc byla stanovena na 4 mg/kg. Monoterapie afliberceptem u nemocných s mcrc byla zkoumána ve studii II. fáze, 24 v níž se hodnotila bezpečnost a účinnost. Pacienti zařazení do studie byli již předléčeni chemoterapií a biologickou léčbou. Byla sledována zvlášť kohorta pacientů, kteří jako předchozí léčbu dostávali bevacizumab (50 pacientů z celkového počtu 75). Jeden pacient byl vyloučen pro mozkové metastázy, a bylo tedy vyhodnoceno celkem 74 pacientů. Aflibercept byl podáván ve standardní dávce 4 mg/kg hmotnosti 1x za 2 týdny intravenózně. Cílem studie bylo stanovit počet objektivních odpovědí a období bez progrese v průběhu 16 týdnů léčby. Ve skupině 24 pacientů, kteří předtím nebyli léčeni bevacizumabem, dosáhlo stabilizace onemocnění v 8. týdnu 8 pacientů (33,3 %) a za 16 týdnů 5 pacientů (20,8 %). Žádná další odpověď nebyla zaznamenána. Ve skupině 50 pacientů léčených předtím bevacizumabem dosáhlo stabilizace onemocnění v 8. týdnu 21 pacientů (42,0 %) a za 16 týdnů 6 pacientů. Jeden pacient v této skupině dosáhl částečné odpovědi (PR). Medián doby bez progrese onemocnění byl 2 měsíce (95% CI: 1,7 8,6 měsíce) u pacientů dříve neléčených bevacizumabem a 2,4 měsíce (95% CI: 1,9 až 3,7 měsíce) ve skupině pacientů předléčených bevacizumabem. V rámci této studie aflibercept v monoterapii neprokázal pozitivní výsledky. Studie AFFIRM (Aflibercept and Modified FOLFOX6 as First-Line Treatment in Patients with Metastatic Colorectal Cancer) hodnotila 236 pacientů s mcrc, kterým byl v 1. linii léčby v jednom ramenu podán aflibercept (4 mg/kg) v kombinaci s chemoterapií FOLFOX a ve druhém byla podána jen chemoterapie FOLFOX. 25 Primárním sledovaným ukazatelem v této studii II. fáze bylo přežívání bez progrese onemocnění (PFS) po 12 měsících. Výchozí charakteristiky pacientů byly podobné v obou větvích, 61 % pacientů bylo v dobrém výkonnostním stavu (ECOG 0 1) a 97,5 % dostávalo předtím adjuvantní terapii. PFS po 12 měsících bylo podobné v obou větvích (FOLFOX + aflibercept 25,8 % vs. FOLFOX 21,2 %). Počet odpovědí (RR) byl také podobný v obou větvích (FOLFOX + aflibercept 49,1 % vs. FOLFOX 45,9 %). V prospektivní randomizované dvojitě zaslepené studii III. fáze VELOUR 26 bylo zahrnuto celkem pacientů. Cílem studie bylo zhodnotit účinnost a bezpečnost kombinace FOLFIRI + aflibercept v porovnání s chemoterapií FOLFIRI samotnou u pacientů s mcrc. U všech zařazených pacientů onemocnění progredovalo na chemoterapii na bázi oxaliplatiny. Pacienti byli náhodně rozděleni do ramena FOLFIRI + aflibercept (n = 612) nebo ramena FOLFIRI + placebo (n = 614). Pacienti v ramenu s afliberceptem dostávali 4 mg/kg intravenózně a následně kombinaci FOLFIRI (irinotecan, leucovorin a fluorouracil). Léčba ve skupině FOLFIRI + aflibercept byla podávána celkově v 9 cyklech (medián 7 cyklů) a ve skupině FOLFIRI + placebo celkově v 8 cyklech (medián 8 cyklů). 30,5 % pacientů ve skupině FOLFIRI + placebo a 30,4 % pacientů ve skupině FOLFIRI + aflibercept bylo léčeno v jedné předchozí linii v praxi 7
8 obrázek 3 Design studie VELOUR (Podle 26) bevacizumabem. Primárním sledovaným ukazatelem bylo celkové přežití (OS), jako sekundární ukazatele byly sledovány délka PFS, celková objektivní odpověď (ORR) a toxicita a bezpečnost podání. Design studie VELOUR je znázorněn na obrázku 3. Analýza výsledků (tabulka 1) prokázala, že přidání afliberceptu k chemoterapii FOLFIRI významně prodloužilo medián OS na 13,5 měsíce v porovnání s 12,06 měsíce v kontrolní skupině FOLFIRI + placebo (HR: 0,817; 95,34% CI: 71,3 93,7; p = 0,0032). Velmi výrazného rozdílu bylo dosaženo u dvouletého přežití 28,0 % pacientů ve skupině s afliberceptem a pouze 18,7 % pacientů v kontrolní skupině. Statisticky významný rozdíl byl zaznamenán v době do progrese 6,9 měsíce ve skupině s afliberceptem a 4,7 měsíce v kontrolní skupině. Podíl ORR (kompletní odpověď [CR] a částečná odpověď [PR]) byl 19,8 % v ramenu s afliberceptem a 11,1 % v kontrolním ramenu. CR nebyla v ramenu s afliberceptem dosažena a ve skupině kontrolní byla zaznamenána pouze u 0,4 % pacientů. Nebyl prokázán vliv předchozí léčby s bevacizumabem na výsledky ani na bezpečnostní profil afliberceptu. 27 Bezpečnost a snášenlivost Inhibice angiogeneze je spojena se specifickými nežádoucími vedlejšími účinky. Hypertenze je skupinový účinek antiangiogenních léků, a je zvládnutelná standardní antihypertenzní terapií. Hypertenze stupně 3/4 jako projev toxicity léčby byla v pilotních studiích pozorována u 4 16 % pacientů léčených chemoterapií a bevacizumabem Další závažné nežádoucí účinky spojené s antiangiogenní terapií se objevují méně často (< 5 %) a zahrnují protein urii (ve 2 % stupně 3/4), 34 krvácení, opožděné hojení ran, gastrointestinální perforace a arteriální tromboembolické příhody Metaanalýzy ukázaly rozporuplné výsledky, pokud jde o vztah mezi bevacizumabem a vznikem žilní tromboembolické nemoci Ve studii VELOUR 26 se v ramenu FOLFIRI + aflibercept vyskytly nežádoucí účinky, které vedly k přerušení léčby, u 26,8 % pacientů a v kontrolním ramenu u 12,1 %. Nejčastějšími nežádoucími účinky (všech stupňů) vedoucími k trvalému přerušení studijní léčby byly astenické stavy (3,8 % vs. 1,3 %), infekce (3,4 % vs. 1,7 %), průjem (2,3 % vs. 0,7 %), a hypertenze (2,3 % vs. 0 %). Nežádoucí účinky byly hlášeny u 99,2 % pacientů v ramenu s afliberceptem a u 97,9 % pacientů v kontrolním ramenu, nežádoucí účinky stupně 3 a 4 u 83,5 % pacientů v ramenu s afliberceptem a 62,5 % pacientů v kontrolním ramenu. Jedná se o typické projevy toxicity anti-vegf terapie (tabulka 2). Zejména hypertenze stupně 3 (tj. hypertenze vyžadující úpravu stávající antihypertenzní terapie nebo léčbu více než jedním lékem) se vyskytla u 19,1 % pacientů v ramenu s afliberceptem a 1,5 % pacientů v kontrolním ramenu. Pouze jeden pacient (0,2 %) v ramenu s afliberceptem měl hypertenzi stupně 4. Vyšší výskyt nežádoucích příhod stupně 3 a 4 při léčbě afliberceptem v porovnání s kontrolním ramenem byl zaznamenán pro krvácení (2,9 % vs. 1,7 %), arteriální tromboembolické příhody (1,8 % vs. 0,5 %) a žilní tromboembolické příhody (7,9 % vs. 6,3 %). Výskyt gastrointestinální píštěle stupně 3 nebo 4, jiné píštěle a gastrointestinální perforace byl méně než 2 % tabulka 1 Účinnost léčby ve studii VELOUR (Podle 26) Aflibercept + FOLFIRI (n = 612) Placebo + FOLFIRI (n = 614) Medián OS 13,5 měs. 12,6 měs. HR: 0,82 (0,71 0,94) p = 0,0032 Průměrný OS 22,8 měs. 18,5 měs. - Medián PFS 6,9 měs. 4,6 měs. HR: 0,76 (0,58 1,00) p = 0,00007 Dvouleté přežití 28 % 18,7 % Celkový počet odpovědí 19,8 % (95% CI: 16,4 23,2) 11,1 % (95% CI: 8,5 13,8) p > 0,001 8 v praxi
9 tabulka 2 Nežádoucí vedlejší účinky při léčbě afliberceptem zaznamenané ve studii VELOUR (Podle 26) Placebo + FOLFIRI (n = 172) Předchozí bevacizumab Aflibercept + FOLFIRI (n = 171) Bez předchozího bevacizumabu Placebo + FOLFIRI (n = 433) Aflibercept + FOLFIRI (n = 440) Stupně toxicity 3/4 3/4 3/4 3/4 Proteinurie 0,6 % 9,4 % 1,4 % 7,3 % Hypertenze 0,6 % 16,4 % 1,8 % 20,5 % Krvácení 1,2 % 3,5 % 1,8 % 2,7 % Gastrointestinální obtíže 0,6 % 3,5 % 1,2 % 1,4 % Bolesti hlavy 0 % 0,6 % 0,5 % 2,0 % Žilní tromboembolická 5,8 % 7,0 % 6,5 % 8,2 % příhoda Plicní embolie 2,9 % 2,3 % 3,7 % 5,5 % Arteriální tromboembolická 0,6 % 1,8 % 0,5 % 1,8 % příhoda Gastrointestinální perforace 0 % 0 % 0,5 % 0,7 % v obou léčebných skupinách; akutní nežádoucí účinky stupně 3 a 4 byly uváděny u 0,5 % pacientů v obou ramenech. Protein urie byla hlášena u 7,9 % pacientů v ramenu s afliberceptem (včetně dvou pacientů s nefrotickým syndromem) a 1,2 % pacientů v kontrolní skupině. Některé nežádoucí účinky běžně spojené s chemoterapií, včetně stupně 3 a 4, byly hlášeny s vyšším výskytem v ramenu s afliberceptem: průjem (19,3 % vs. 7,8 %), astenické stavy (16,9 % vs. 10,6 %), stomatitida a ulcerace (13,7 % vs. 5,0 %), infekce (12,3 % vs. 6,9 %) a palmoplantární erytrodysestezie (2,8 % vs. 0,5 %). Neutropenie stupně 3/4 (36,7 % vs. 29,5 %) a febrilní neutropenie (5,7 % vs. 2,8 %) a trombocytopenie (3,3 % vs. 1,7 %) byly rovněž častější při léčbě afliberceptem. Praktické aspekty Aflibercept (Zaltrap, 4 mg/kg) se podává jako intravenózní infuze během jedné hodiny každé dva týdny v kombinaci s FOLFIRI (5-fluorouracil, leucovorin a irinotecan). Aflibercept je k dispozici v lahvičkách po 100 mg/4 ml (25 mg/ml), nebo 200 mg/8 ml (25 mg/ml). Závěr Aflibercept (Zaltrap) byl schválen EMA (v únoru 2013) a FDA (v březnu 2012) v kombinaci s FOLFIRI k léčbě metastatického kolorektálního karcinomu po progresi onemocnění v průběhu léčby v 1. linie chemoterapie na bázi oxaliplatiny a biologické léčby. Registrace byla udělena na základě výsledků studie III. fáze VELOUR, v níž ve 2. linii léčby přidání afliberceptu vedlo k prodloužení celkového přežití o 1,44 měsíce a k významnému prodloužení doby do progrese onemocnění. Tento výsledek byl částečně vykoupen vyšším výskytem nežádoucích účinků, především hypertenze a proteinurie. Jak již bylo uvedeno, použití bevacizumabu je standardní možností pro 2. linii léčby mcrc. Bezpečnostní profily afliberceptu a bevacizumabu jsou téměř identické, s výjimkou hypertenze a proteinurie, které jsou častější v ramenu s afliberceptem. Nicméně detailní porovnání afliberceptu a bevacizumabu není možné, protože chybí přímé srovnávací studie. Proč bychom měli tedy podávat aflibercept? Jde především o možnost překonání rezistence vzniklé vůči antiangiogenní léčbě bevacizumabem. Aflibercept má potenciál překonat a zablokovat mechanismy, které navodily tuto rezistenci, a to je jeho výhoda v zařazování do léčby metastazujícího kolorektálního karcinomu. Na základě porovnání výsledků studie VELOUR se studiemi ve 2. linii léčby mcrc lze konstatovat, že aflibercept v kombinaci s FOLFIRI je lékem volby pro pacienty předléčené režimem obsahujícím oxaliplatinu. Hledá se uplatnění afliberceptu u dalších typů nádorových onemocnění, a proto probíhají studie hodnotící účinnost afliberceptu u zhoubných nádorů štítné žlázy, vaječníků, metastatického nemalobuněčného karcinomu plic, pokročilých nádorů jícnu/žaludku či metastatického karcinomu pankreatu. Literatura na následující straně. v praxi 9
10 Literatura 1 Folkman J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med 1995;1: Folkman J. Fundamental concepts of the angiogenic process. Curr Mol Med 2003;3: Carmeliet P. (2005) Angiogenesis in life, disease and medicine. Nature 438: Ellis L, Hicklin D. VEGF-targeted therapy: mechanisms of anti-tumour activity. Nat Rev Cancer 2008;8: Fischer C, Mazzone M, Jonckx B, et al. FLT1 and its ligands VEGFB and PIGF: drug targets for anti-angiogenic therapy? Nat Rev Cancer 2008;8: Yang W, Ahn H, Hinrichs M, et al. Evidence of a novel isoform of placenta growth factor (PlGF-4) expressed in human trophoblast and endothelial cells. J Reprod Immunol 2003;60: Fukumura D, Duda D, Munn L, et al. Tumor microvasculature and microenvironment: novel insights through intravital imaging in pre-clinical models. Microcirculation 2010;17: Bergers G, Hanahan D. Modes of resistance to anti-angiogenic therapy. Nat Rev Cancer 2008;8: Fischer C, Jonckx B, Mazzone M, et al. Anti-PLGF inhibits growth of VEGF(R)-inhibitor-resistant tumors without affecting healthy vessels. Cell 2007;131: Yao J, Wu X, Zhuang G, et al. Expression of a functional VEGFR-1 in tumor cells is a major determinant of Anti-PLGF antibodies efficacy. Proc Natl Acad Sci U S A 2011;108: Willett C, Duda D, Di Tomaso E, et al. Efficacy, safety, and biomarkers of neoadjuvant bevacizumab, radiation therapy, and fluorouracil in rectal cancer: a multidisciplinary phase II study. J Clin Oncol 2009;27: Kopetz S, Hoff P, Morris J, et al. Phase II trial of infusional fluorouracil, irinotecan, and bevacizumab for metastatic colorectal cancer: efficacy and circulating angiogenic biomarkers associated with therapeutic resistance. J Clin Oncol 2010;28: Loupakis F, Cremolini C, Fioravanti A, et al. Pharmacodynamic and pharmacogenetic angiogenesis-related markers of first- -line Folfoxiri plus bevacizumab schedule in metastatic colorectal cancer. Br J Cancer 2011;104: Escudero-Esparza A, Martin T, Davies M, et al. PGF isoforms, PLGF-1 and PGF-2, in colorectal cancer and the prognostic significance. Cancer Genomics Proteomics 2009;6: Jain R. Normalization of tumor vasculature: an emerging concept in antiangiogenic therapy. Science 2005;307: Jain R, Duda D, Willett C, et al. Biomarkers of response and resistance to antiangiogenic therapy. Nat Rev Clin Oncol 2009;6: O Connor J, Carano R, Clamp A, et al. Quantifying antivascular effects of monoclonal antibodies to vascular endothelial growth factor: insights from imaging. Clin Cancer Res 2009;15: Holash J, Davis S, Papadopoulos N, et al. VEGF-Trap: a VEGF blocker with potent antitumor effects. Proc Natl Acad Sci U S A 2002;99: Kim E, Serur A, Huang J, et al. Potent VEGF blockade causes regression of coopted vessels in a model of neuroblastoma. Proc Natl Acad Sci U S A 2002;99: Rudge J, Holash J, Hylton D, et al. Inaugural article: VEGF trap complex formation measures production rates of VEGF, providing a biomarker for predicting efficacious angiogenic blockade. Proc Natl Acad Sci U S A 2007;104: Gomez-Manzano C, Holash J, Fueyo J, et al. VEGF Trap induces antiglioma effect at different stages of disease. Neurol Oncol 2008;10: Chiron M, Vrignaud P, Lejeune P, et al. Synergistic activity of aflibercept (VEGF Trap) in combination with 5-fluorouracil and irinotecan in preclinical tumor models. AACR Meeting Abstracts San Francisco, CA, October 2007:Abstract A Limentani S, Just R, Purdham A, et al. A phase I dose escalation and pharmacokinetic (PK) study of intravenous (IV) aflibercept (VEGF Trap) plus FOLFOX4 in patients (Pts) with advanced solid tumors: preliminary results. J Clin Oncol 2008;26(Suppl ASCO Meeting Abstracts):Abstract Tang PA, Cohen SJ, Kollmannsberger C, et al, Phase II clinical and pharmacokinetic study of aflibercept in patients with previously treated metastatic colorectal cancer. Clin Cancer Res 2012;18: Pericay C, Folprecht G, Saunders M, et al. Phase 2 randomized, noncomparative open-label study of aflibercept and modified FOLFOX6 in the first line treatment of metastatic colorectal cancer (AFFIRM). Ann Oncol 2012;23(Suppl 4):iv16, Abstract Van Cutsem, E, Tabernero J, Lakomy R, et al, Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxalinplatin-based regimen. J Clin Oncol 2012;30: Allegra CJ, Lakomy R, Tabernero J, et al. Effects of prior bevacizumab (B) use on outcomes from the VELOUR study: A phase III study of aflibercept (Afl) and FOLFIRI in patients (pts) with metastatic colorectal cancer (mcrc) after failure of an oxaliplatin regimen. J Clin Oncol 2012;30(Suppl): Abstract Hurwitz H, Fehrenbacher L, Novotny W, et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 2004;350: Hurwitz H, Fehrenbacher L, Hainsworth J, et al. Bevacizumab in combination with fluorouracil and leucovorin: an active regimen for first-line metastatic colorectal cancer. J Clin Oncol 2005;23: Kabbinavar F, Schulz J, McCleod M, et al. Addition of bevacizumab to bolus fluorouracil and leucovorin in first-line metastatic colorectal cancer: results of a randomized phase II trial. J Clin Oncol 2005;23: Giantonio B, Catalano P, Meropol N, et al. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol 2007;25: Saltz L, Clarke S, Diaz-Rubio E, et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol 2008;26: Arnold D, Andre T, Bennouna J, et al. Bevacizumab (BEV) plus Chemotherapy (CT) continued beyond first progression in patients with metastatic colorectal cancer (mcrc) previously treated with BEV plus CT: results of a randomized phase III intergroup study (TML study). J Clin Oncol 2012;30(Suppl): Abstract CRA Wu S, Kim C, Baer L, et al. Bevacizumab increases risk for severe proteinuria in cancer patients. J Am Soc Nephrol 2010;21: Scappaticci F, Skillings J, Holden S, et al. Arterial thromboembolic events in patients with metastatic carcinoma treated with chemotherapy and bevacizumab. J Natl Cancer Inst 2007;99: Nalluri S, Chu D, Keresztes R, et al. Risk of venous thromboembolism with the angiogenesis inhibitor bevacizumab in cancer patients: a meta-analysis. JAMA 2008;300: Hurwitz H, Saltz L, Van Cutsem E, et al. Venous thromboembolic events with chemotherapy plus bevacizumab: a pooled analysis of patients in randomized phase II and III studies. J Clin Oncol 2011;29: Převzato z Farmakoterapie 2015;11(5): v praxi
11 Aflibercept u pacientky s metastatickým kolorektálním karcinomem MUDr. Stanislav Batko Radioterapeuticko-onkologické oddělení FN Motol, Praha Úvod Metastatický kolorektální karcinom v současné době i přes zařazení moderních biologických léčiv a prohlubující se spolupráci s chirurgy a intervenčními radiology stále patří mezi onemocnění, při němž lze u většiny pacientů dosáhnout významného prodloužení přežití, nikoli však vyléčení. Medián celkového přežití se v rámci publikovaných studií pohybuje v širokém rozmezí měsíců, v závislosti na velikosti studiové populace, selekci pacientů dle mutačního stavu RAS a BRAF a dalších faktorů. Kolorektální karcinomy s přítomností mutace RAS jsou spojeny s agresivnějším chováním a kratším celkovým přežitím. Medián celkového přežití pacientů, u nichž došlo k progresi onemocnění během 1. linie paliativní léčby, se ve studiích mapujících účinnost anti-vegf a anti-egfr léčiv pohybuje v rozmezí měsíců, medián přežití bez progrese činí 5,7 7,3 měsíce a četnost objektivních léčebných odpovědí dosahuje 5,4 33 %. Popis případu Tato kazuistika popisuje nadmíru dobrý účinek afliberceptu ve 2. linii paliativní léčby metastatického karcinomu kolorekta u pacientky s agresivním průběhem onemocnění. U pacientky, do doby diagnózy onkologického onemocnění léčené pouze s arteriální hypertenzí, bez výskytu malignit v příbuzenstvu, byl ve věku 59 let diagnostikován pokročilý středně diferencovaný karcinom sigmatu (stadium pt3 N2 M0). Pacientka v srpnu 2012 podstoupila resekci sigmatu pro nález malignizovaného polypu. V rámci předoperačního vyšetření bylo zachyceno ložiskové postižení jater, které však bylo dle CT hodnoceno jako kavernózní hemangiomy. Peroperačně se již nález na játrech palpačně jevil jako maligní, což pooperačně potvrdila elevace onkomarkerů a kontrolní CT, na němž byl již nález hodnocen jako vícečetné metastatické postižení jater. Překvapením byl i definitivní histologický staging primárního tumoru, který byl předběžně dle zobrazovacích metod, endoskopického nálezu i histologického vyšetření polypu původně předpokládán jako T1. Mutační analýza prokázala mutaci KRAS. Případ byl konzultován na multidisciplinárním semináři v ÚVN, přičemž metastatické postižení jater bylo kategorizováno jako potenciálně resekabilní. Proto v době od září do října 2012 pacientka absolvovala neoadjuvantní chemoterapii FOLFOX a následně metastazektomii centrální resekci čtyř ložisek a resekci jednoho ložiska v levém jaterním laloku. Pooperačně bylo podáno dalších 10 cyklů FOLFOX do dubna 2013 a pacientka byla dále sledována. V lednu 2014 došlo k elevaci onkomarkerů (CEA 27), PET/CT vyšetření z prokázalo tři ložiska v játrech. Pacientka byla opět konzultována v rámci onkoboardu a byla doporučena metastazektomie. Druhý operační výkon byl proveden , a to s použitím kombinace metastazektomie s radiofrekvenční ablací. Pooperační průběh byl komplikován bronchopneumonií a pacientka byla vzhledem k celkovému stavu, nevhodnému k zahájení pooperační chemoterapie, indikována ke sledování. Časně provedené PET/CT vyšetření v rámci dispenzarizace však ukázalo recidivu ložiskového postižení v játrech (obrázek 1). Nález byl konzultován v rámci onkoboardu. Byl shledán inoperabilním a byla indikována 1. linie obrázek 1 Kontrolní CT vyšetření z progrese ložiskového postižení jater v praxi 11
12 obrázek 2 Kontrolní CT vyšetření ze stabilizace onemocnění paliativní chemoterapie FOLFOX + bevacizumab, jež byla zahájena Po 4. cyklu bioterapie, podaném , bylo provedeno restagingové CT vyšetření, jež prokázalo velikostní i početní progresi ložiskového postižení jater. Od pacientka zahájila 2. linii paliativní chemoterapie FOLFIRI + aflibercept. Přešetření účinku po pěti cyklech léčby ukázalo stabilizaci onemocnění a pacientka v této léčbě dále pokračovala. Do března 2015 absolvovala celkem 10 cyklů léčby, kontrolní CT z nadále prokazovalo stabilizaci onemocnění. Snášenlivost 2. linie biochemoterapie se v průběhu podávání postupně zhoršovala, přičemž nejvýznamnějším projevem toxicity byla progredující únava. Na základě indikační vizity pak pacientka pokračovala ve 2. linii léčby od aplikací afliberceptu bez chemoterapie. Pokračování léčby samotným afliberceptem vedlo ke kompletnímu ústupu únavy i dalších projevů toxicity a značnému zlepšení kvality života pacientky. Pravidelná restagingová přešetření (naposledy v říjnu 2015) potvrzují stabilizaci onemocnění (obrázek 2). Pacientka nadále pokračuje v léčbě afliberceptem, přičemž doposud (do listopadu 2015) bylo aplikováno 26 cyklů. Závěr Popsaný případ dokládá vynikající účinek léčby afliberceptem (Zaltrap) u pacientky s velmi agresivním průběhem onemocnění, charakterizovaným generalizací onemocnění záhy po stanovení úvodní diagnózy, dvěma recidivami po metastazektomiích, přičemž progrese po druhém chirurgickém výkonu nastala do dvou měsíců, a primární progresí při 1. linii paliativní léčby. Nejlepší odpovědí v průběhu léčby kombinací FOLFIRI + aflibercept byla stabilizace onemocnění a jako pravděpodobná se jevila progrese záhy po vysazení chemoterapie. V současnosti stále probíhá léčba afliberceptem se stabilizací onemocnění trvající 15 měsíců, což více než dvakrát přesahuje výsledky přežití bez progrese popsané ve studii VELOUR, navíc již osmým měsícem je aflibercept podáván v monoterapii. Převzato z Farmakoterapie 2015;11(6): v praxi
13 Pozice afliberceptu v dlouhodobé kontrole nemoci u pacienta s metastatickým kolorektálním karcinomem Doc. MUDr. Ilona Kocáková, Ph.D.; MUDr. Ivo Kocák, Ph.D. Klinika komplexní onkologické péče LF MU a MOÚ, Brno Úvod Kolorektální karcinom (CRC) je jedním z nejčastějších nádorových onemocnění vůbec. Ještě v devadesátých letech minulého století byl považován za chemorezistentní nádor, jedinou aktivní cytotoxickou látkou byl 5-fluorouracil (5-FU) modulovaný leukovorinem (FA), podávaný bolusově nebo v kontinuální infuzi, a medián přežití nepřesahoval jeden rok. Ta doba je naštěstí dávno pryč. Dnes máme k dispozici několik cytostatik (irinotekan, oxaliplatinu, kapecitabin) a monoklonálních protilátek (bevacizumab, aflibercept, cetuximab, panitumumab). Není tedy divu, že byla postupně iniciována celá řada klinických studií, které měly dát odpověď na základní otázky týkající se optimální léčby pacienta s metastazujícím onemocněním, tj. monoterapie versus kombinovaná cytotoxická léčba v 1. linii (dublety nebo triplety), jaká je optimální sekvence léčiv v 1. a 2. linii, kdy včlenit biologickou terapii do léčebného algoritmu. Komplexní charakter volby terapeutického postupu v sobě zahrnuje individuální léčebný postup, který je založen na sledování léčebného záměru tedy zda je cíl léčby potenciálně kurativní, nebo paliativní. V čistě paliativní léčbě užíváme strategické plánování terapeutických sekvencí podle koncepce kontinuity péče s ohledem na toxicitu chemoterapie, která může limitovat trvání terapie, a zasáhnout tak do její účinnosti (kumulativní toxicita oxaliplatiny). Neméně důležité je i pečlivé hodnocení biologických vlastností tumoru (např. exprese RAS, BRAF) k individualizaci léčebného přístupu, což přispívá k optimalizaci léčebných výsledků a přínosu pro pacienta. Popis případu Pacientem je muž, kterému byl v srpnu 2014 ve věku 55 let diagnostikován karcinom rektosigmatu. Pro asi dva měsíce trvající bolesti břicha lokalizované do pravého podžebří provázené pocitem plnosti a nepravidelnou stolici s příměsí krve navštívil v červnu svého praktického lékaře, který jej ihned odeslal na sektorovou chirurgii. Bylo provedeno ultrazvukové vyšetření břicha s nálezem ložisek na játrech charakteru metastáz. Následné CT vyšetření břicha nález potvrdilo. Byla patrná mnohočetná ložiska v levém laloku jaterním a dvě suspektní ložiska vpravo. Koncem srpna bylo provedeno kolonoskopické vyšetření, které prokázalo semicirkulární tumorózní infiltraci sahající od 16 cm do 20 cm od anokutánní linie. Z biopsie byl verifikován fokálně nekrotizující tubulární adenokarcinom G2. Další CT vyšetření ukázalo progresi biologicky aktivního onemocnění. Byl popsán výrazně zvětšený levý lalok jaterní, difuzně prostoupený splývajícími metastatickými ložisky, vpravo ložisko v S8 velikosti 21 mm a v S5/7 18 mm. Vzhledem k progredujícímu abdominálnímu algickému syndromu, nechutenství a úbytku hmotnosti (7 kg za 3 měsíce) se nemocný objednává do konziliární ambulance Masarykova onkologického ústavu v Brně. Při první návštěvě v MOÚ ve druhé polovině září 2014 v klinickém obrazu dominovala hepatomegalie a počínající ascites. U pacienta bez dalších interkurencí bylo ten den provedeno základní laboratorní a hematologické vyšetření a odběr nádorových markerů. Byla patrná lehčí anemie (111 g/l), leukocytóza (14,88 x 10 9 /l), jaterní testy byly v normě vyjma hodnoty AST (1,70 µkat/l) a laktátdehydrogenázy (16,06 µkat/l). Nádorové markery byly zvýšené, CEA 804,4 µg/l (norma do 4,6) a CA ,3 ku/l (norma do 40,0). Doplnili jsme rentgen plic, který byl bez nálezu metastáz. EKG křivka byla v normě. Bylo vyžádáno zaslání CT snímků do PACS. K vyloučení rizika střevní obstrukce jsme provedli rektoskopii. Chirurg popsal tumorózní infiltraci začínající ve 13 cm, postihující maximálně 1/3 obvodu střeva, lumen volně průchodné, bez rizika střevní obstrukce. Bylo vyžádáno doplnění mutační analýzy RAS. Při PET vyšetření byla znázorněna patologická akumulace FDG v levé plíci v S4 parakardiálně, dále pak masivně prakticky v celém levém laloku jater (s přesahem do přilehlých částí laloku pravého), SUV až 10,93, v dolním okraji pravého laloku jaterního mediálně (S5/6) a v oblasti rektosigmatu. Vzhledem k rychle progredujícímu symptomatickému onemocnění u pacienta s výkonnostním stavem PS 1 byla ihned zahájena léčba kombinací per os kapecitabin a oxaliplatina (režim Xelox) v intervalu 3 týdnů. v praxi 13
14 Od června 2015 do současnosti Za 9 měsíců od zahájení léčby dochází k velikostní progresi nálezu na játrech a k početní progresi ložisek na plicích. Výkonnostní stav pacienta je i přes značný rozsah onemocnění stále 100 %, laboratorní hematologické a biochemické parametry jsou bez abnormalit, byl prokázán vzestup CEA na 120,0 µg/l. Vzhledem k výsledku muobrázek 1A CT vyšetření břicha před zahájením léčby kombinací FOLFIRI a aflibercept obrázek 1B CT vyšetření břicha po 6 cyklech léčby kombinací FOLFIRI a aflibercept obrázek 2A CT plic a mediastina před zahájením léčby kombinací FOLFIRI a aflibercept obrázek 2B CT plic a mediastina po 6 cyklech léčby kombinací FOLFIRI a aflibercept Průběh léčby Září 2014 až červen 2015 Výkonnostní stav pacienta při další kontrole za 3 týdny se zlepšil na PS 0, došlo k normalizaci hodnoty AST (0,53 µkat/l ) a poklesu LDH (3,70 µkat/l), rovněž tak byl dokumentován pokles hodnoty CEA (218,9 µg/l). Pacient přibral 3 kg, byl asymptomatický. Klinicky došlo k významné regresi hepatomegalie. Od druhého cyklu vzhledem k mutaci KRAS byla k chemoterapii XELOX přidána monoklonální anti-vegf protilátka bevacizumab (Avastin). Přešetření pomocí CT bylo indikováno po 3 a 6 měsících a ukázalo regresi a následně stabilizaci metastatického postižení. Vzhledem k vícečetnému metastatickému postižení jater a plic komise digestivní onkologie neindikovala resekční výkon. Od 8. série bylo pro neurotoxicitu oxaliplatiny pokračováno v léčbě jen kapecitabinem a bevacizumabem, při stále se snižující hodnotě CEA nejnižší dosažená hodnota byla 35,2 µg/l. Během léčby se objevil hand foot syndrom maximálně stupně 2 a hypertenze reagující dobře na farmakologickou léčbu. 14 v praxi
15 tační analýzy byla ve 2. linii léčby po inzerci centrálního žilního katetru aplikována sekvenční chemoterapie režimem FOLFIRI (fluorouracil/leukovorin/irinotekan) s afliberceptem (Zaltrap) v intervalu 2 týdny (studie VELOUR). Účinek léčby je monitorován pomocí CT vyšetření každé 3 měsíce. Již při prvním přešetření je patrná regrese jaterních i plicních metastáz (obrázek 1 a 2). V průběhu terapie dochází k poklesu nádorových markerů. Od 16. série pokračuje pacient pro zhoršující se gastrointestinální toxicitu v léčbě bez irinotekanu. Nyní je po 20. sérii, poslední hodnota CEA je 9,5 µg/l. Závěr Námi prezentovaný pacient se dostává až vlastním přičiněním k onkologické léčbě za 3 měsíce od průkazu jaterních metastáz na zobrazovacích metodách. I přes všechny nepříznivé skutečnosti, zapříčiněné mimo jiné i opožděnou diagnostikou (ponechaný primární tumor, značný rozsah onemocnění provázený úbytkem hmotnosti a symptomatologií, počínající alterace jaterních testů, přítomnost mutace KRAS) byla aplikovaná kombinovaná a sekvenční chemoterapie s cílenou léčbou anti-vegf monoklonálními protilátkami bevacizumabem a následně afliberceptem. Tato léčba umožnila našemu pacientovi prožít od zahájení onkologické léčby dosud 19 měsíců kvalitního plnohodnotného života. Převzato z Farmakoterapia 2016;6(1). v praxi 15
16 Aflibercept v léčbě metastazujícího karcinomu kolorekta Angiogeneze je proces tvorby nových cév na podkladě již preexistující vaskulatury. Vaskulární endoteliální růstový faktor (VEGF) působí na buňky cévního endotelu jako specifický mitogen. Abnormální angiogeneze je přitom hlavním patofyziologickým procesem řady onemocnění, zejména pak v onkologii. Vznikající tumory využívají nově vytvořené cévy za účelem pokrytí své poptávky po kyslíku a živinách, respektive pro jejich růst a množení. Proces angiogeneze se zde vymyká poměrně komplexní kontrole nejrůznějšími signálními molekulami, jako jsou právě VEGF, angiopoetiny, integriny aj. Tyto faktory jsou produkovány jednak samotnými nádorovými buňkami, ovšem tvořeny jsou rovněž okolní tkání či infiltrovanými makrofágy a fibroblasty. V naprosté většině tyto působky interagují s povrchovými receptory na buňkách endotelu, kde působí jako ligandy, důsledkem čehož je mj. uvolnění dalších angiogenních faktorů. Terapeutické snahy o ovlivnění růstu tumoru se tak v posledních letech logicky zaměřují právě na snahu o potlačení angiogeneze. Dosud nejlépe popsaným a klinicky již bohatě využívaným cílem je blokáda VEGF. Tato cesta je však důležitá nejen při patologické angiogenezi, ale rovněž při zcela fyziologickém vzniku cév ve zdravé tkáni. Aflibercept (VEGF-trapAB12) je látka cíleně vyvinutá k vazbě plazmatického VEGF s minimalizací interakcí na úrovni extracelulární matrix. Vedle vysoké afinity k VEGF jej charakterizuje příznivý farmakokinetický a bezpečnostní profil s nízkou pravděpodobností rozvoje alergických reakcí. Jde o fúzní protein vyráběný technologií DNA, který se skládá z částí extracelulárních domén humánních receptorů 1 a 2 pro VEGF fúzovaných na Fc fragment humánního IgG1. Ve studiích na myších bylo podávání afliberceptu provázeno účinným potlačením nádorového růstu při testování různých typů tumorů implantovaných subkutánně nebo ortotopicky. Z testovaných nádorů byla jeho účinnost pozorována u melanomu, glioblastomu, neuroblastomu, rhabdomyosarkomu a karcinomů ovaria, ledviny a pankreatu. Účinný byl rovněž v potlačení nádorového růstu v kombinaci s radioterapií, paclitaxelem nebo 5-fluorouracilem. S odkazem na tyto povzbudivé výsledky začal být následně hodnocen v klinických studiích (včetně oftalmologických indikací nenádorové povahy, ve kterých je mj. dnes rovněž bohatě využíván). Ve studiích III. fáze byla jeho účinnost hodnocena u nemocných se zaměřením na léčbu karcinomu kolorekta (CRC), který je stále i navzdory osvětě a preventivním vyšetřením často zjišťován až v okamžiku, kdy jsou přítomny metastázy, s pravděpodobností pětiletého přežití pod hranicí 5 %. Současné možnosti léčby tohoto onemocnění zahrnují jednak chemoterapii (5-fluorouracil, capecitabin, oxaliplatinu a irinotecan), jednak cílenou léčbu (bevacizumab). 16 v praxi V rámci klinické studie VELOUR byla hodnocena účinnost afliberceptu přidaného ke kombinaci FOLFIRI (leucovorin, 5-fluorouracil a irinotecan) u nemocných s metastazujícím CRC dosud neléčených režimem obsahujícím oxaliplatinu (n = 1 401), nicméně nemocní mohli být již předléčeni bevacizumabem (n = 373). Zařazení pacienti byli randomizováni v poměru 1 : 1 k léčbě afliberceptem (4 mg/kg každé 2 týdny) + FOLFIRI, nebo FOLFIRI + placebo. Režim FOLFIRI byl podáván po dobu s mediánem 21 týdnů v experimentálním ramenu a 18,1 týdne v ramenu placeba. Úprava dávky byla potřebná častěji u nemocných léčených současně afliberceptem. Nemocní léčení kombinací afliberceptu a FOLFIRI přežívali signifikantně déle 13,5 měsíce vs. 12 měsíců (HR: 0,817; 95% CI: 0,73 0,937; p = 0,003). Dvouletého přežití bylo dosaženo u 28 % nemocných vs. 18,7 % v kontrolní skupině, přičemž přínos užívání afliberceptu byl patrný ve všech předem definovaných hodnocených skupinách. Rozdíl v přežívání ve prospěch afliberceptu byl pozorován i v 18. (38,5 % vs. 30,9 %), 24. (28 % vs. 18,7 %) a 30. (22,3 % vs. 12 %) měsíci. Léčba afliberceptem byla provázena také delším přežíváním bez progrese onemocnění (PFS) (HR: 0,758; 95% CI: 0,661 0,869; p = 0,000 07). Medián PFS činil 6,9 měsíce vs. 4,7 měsíce. Kladná odpověď na léčbu tak byla rovněž vyšší při podávání afliberceptu (19 % vs. 11,1 %; p = 0,0001). Výskyt nežádoucích příhod byl sice numericky vyšší při léčbě afliberceptem, ale nikterak výrazně 99,2 % vs. 97,9 %. Častější však v experimentální skupině byly příhody hodnocené stupněm 3 a 4 vyskytly se zejména hypertenze, hemoragická proteinurie a arteriální či venózní tromboembolické příhody. V této skupině nemocných byl rovněž vyšší podíl případů ukončení léčby 26,8 % vs. 12,1 %. V další velké studii ACCENT bylo zjištěno, že pacienti, u nichž onemocnění rychle progreduje na adjuvantní léčbě, mají horší prognózu, z čehož lze odvodit, že zahrnutí těchto nemocných bude zhoršovat také výsledky při léčbě afliberceptem. I navzdory této skutečnosti však v rámci ITT (intention-to-treat) analýzy měl aflibercept signifikantní přínos pro přežití. Jistě zajímavé budou výsledky právě probíhající analýzy účinnosti dle molekulární analýzy tumorů a krevních vzorků ve smyslu možné definice prognostických a prediktivních markerů, které by mohly pomoci určit vhodného nemocného pro léčbu afliberceptem. Aflibercept byl nedávno schválen Úřadem pro potraviny a léčiva USA (FDA Food and Drug Administration) i Evropskou lékovou agenturou (EMA European Medicines Agency) ke kombinační léčbě s režimem FOLFIRI u nemocných s mcrc, u nichž onemocnění progreduje při chemoterapii obsahující oxaliplatinu. Zpracoval MUDr. Jiří Slíva, Ph.D. Literatura 1 Macarulla T, Sauri T, Tabernero J. Evaluation of aflibercept in the treatment of metastatic colorectal cancer. Expert Opin Biol Ther 2014;14:
17 Dlouhodobá účinnost a bezpečnost afliberceptu v kombinaci s FOLFIRI u pacientů s metastatickým kolorektálním karcinomem analýza studie VELOUR Úvod Aflibercept (VEGF trap) je rekombinantní fúzní protein, který se skládá z VEGF-vazebných částí tvořených extracelulárními doménami lidských receptorů VEGFR-1 a VEGFR-2 a z Fc části lidského IgG1. Působí jako solubilní receptor, který váže VEGF-A, VEGF-B a PlGF, a to s vyšší afinitou než přirozené receptory těchto ligandů. Brání tak vazbě uvedených ligandů na jejich receptory, čímž blokuje signální dráhy zprostředkované těmito receptory. Studie VELOUR (Aflibercept with irinotecan in colorectal cancer after failure of oxaliplatin regimen) byla první randomizovanou placebem kontrolovanou studií III. fáze, která prokázala statisticky významné zlepšení celkového přežití (OS), přežití bez progrese (PFS) a četnosti objektivních léčebných odpovědí (ORR) při použití antiangiogenně působícího léku v kombinaci s režimem FOLFIRI v porovnání se samotnou chemoterapií FOLFIRI u nemocných s metastatickým kolorektálním karcinomem (mcrc), u nichž selhala léčba založená na oxaliplatině při mediánu sledování 22,3 měsíce činil medián OS 13,5 měsíce vs. 12,0 měsíců, což představuje 18,3% snížení rizika úmrtí. Křivky přežití dále naznačily, že přínos afliberceptu se bude v průběhu času zvyšovat. zařazeno dospělých pacientů s mcrc, u nichž selhala chemoterapie na bázi oxaliplatiny. Pacienti byli randomizováni k terapii afliberceptem v dávce 4 mg/kg (n = 612) nebo k podávání placeba (n = 614) i. v. každé 2 týdny a zároveň byli léčeni chemoterapeutickým režimem FOLFIRI (irinotecan v dávce 180 mg/m 2 i. v. v 90minutové infuzi, leucovorin v dávce 400 mg/m 2 i. v. ve dvouhodinové infuzi, 5-fluorouracil v dávkách 400 mg/m 2 bolusově mg/m 2 ve 46hodinové infuzi). Terapie byla podávána do progrese nebo výskytu nepřijatelných nežádoucích účinků (NÚ). obrázek 1 Vliv léčby na celkové přežití (Podle 1) Primárním sledovaným parametrem studie bylo OS, k sekundárním sledovaným parametrům patřily PFS, ORR a výskyt NÚ. Výsledky Výchozí charakteristiky nemocných v obou skupinách byly vyrovnané. Při delším mediánu sledování byl dokumentován narůstající rozdíl z hlediska přežívání mezi oběma léčebnými rameny po 6 měsících přežívalo 81,9 % pacientů léčených FOLFIRI v kombinaci s afliberceptem vs. 79,1 % nemocných léčených FOLFIRI v kombinaci s placebem, po 12 měsících Cíl studie Cílem této analýzy bylo zhodnotit účinnost a bezpečnost afliberceptu v kombinaci s FOLFIRI oproti samotné chemoterapii FOLFIRI u pacientů s mcrc, u nichž selhala léčba založená na oxaliplatině, v delším časovém horizontu. Metodika Studie VELOUR byla multicentrická randomizovaná dvojitě zaslepená placebem kontrolovaná studie III. fáze, do které bylo Pravděpodobnost přežití Absolutní zvýšení pravděpodobnosti přežití Proporcionální zvýšení pravděpodobnosti přežití 79,1 % 50,3 % 30,9 % 18,7 % 12,0 % Placebo/ FOLFIRI 81,9 % 56,1 % 38,5 % 28,0 % 22,3 % Aflibercept/ FOLFIRI 2,8 % 5,8 % 7,6 % 9,3 % 10,3 % 3,54 % 11,53 % 24,6 % 49,3 % 85,83 % v praxi 17
18 obrázek 2 Výskyt vybraných nežádoucích účinků dle typu a cyklu léčby (Podle 1) přežívalo 56,1 % vs. 50,3 %, po 18 měsících 38,5 % vs. 30,9 %, po 24 měsících 28,0 % vs. 18,7 % a po 30 měsících 22,3 % vs. 12,0 % (obrázek 1). Protinádorová léčba po ukončení studie byla v obou léčebných ramenech podobná, což vylučuje její vliv na výsledky týkající se přežití. Nejméně jeden NÚ v souvislosti s léčbou se vyskytl u 99,2 % pacientů z ramena FOLFIRI + aflibercept vs. u 97,9 % nemocných z ramena FOLFIRI + placebo; NÚ stupně 3 4 byly zaznamenány u 83,5 % vs. 62,5 %. Nejčastěji byly popsány NÚ typické pro anti-vegf léčbu (proteinurie, hypertenze, žilní tromboembolismus, krvácení) a chemoterapii (průjem, stomatitida, infekce, neutropenie). Výskyt NÚ, včetně NÚ stupně 3 4, byl obecně nejvyšší iniciálně, tj. v časných cyklech léčby, a v dalším průběhu studie postupně klesal (obrázek 2); mnohé z běžných NÚ (např. průjem, stomatitida, infekce, hypertenze) se v průběhu celé studie objevily pouze jednou. Většina NÚ byla reverzibilních, rovněž NÚ stupně 3 4 u většiny nemocných vymizely, s výjimkou proteinurie. Proteinurie jakéhokoliv stupně byla zjištěna u 62 % pacientů léčených afliberceptem, avšak ve většině případů byla pouze mírná či středně závažná (tj. stupně 1 2, proteinurie stupně 3 4 se vyskytla u 8,2 % nemocných). Závěr Tato analýza studie VELOUR dokládá, že přidání afliberceptu k chemoterapeutickému režimu FOLFIRI u pacientů s mcrc, u nichž selhala chemoterapie na bázi oxaliplatiny, je spojeno s trvalým, progresivním zlepšováním celkového přežití ve srovnání se samotnou chemoterapií. Incidence nežádoucích účinků stupně 3 4 byla vyšší v ramenu s afliberceptem, avšak většina z nich se objevila pouze iniciálně a v dalším průběhu studie jejich výskyt klesal. Zpracovala MUDr. Jana Fabiánová Literatura 1 Ruff P, Ferry DR, Lakomý R, et al. Time course of safety and efficacy of aflibercept in combination with FOLFIRI in patients with metastatic colorectal cancer who progressed on previous oxaliplatin-based therapy. Eur J Cancer 2015;51: Zaltrap, Souhrn informací o přípravku, v praxi
19 Komentář ke studii Prof. MUDr. Jindřich Fínek, Ph.D. Onkologická a radioterapeutická klinika FN a LF UK, Plzeň Kolorektální karcinom je jednou z celosvětově nejčastějších malignit. Nemocní s neresekabilním či metastatickým onemocněním (mcrc) jsou nyní indikováni k několika liniím protinádorové léčby dle svého výkonnostního stavu. Mezi hlavní cytostatika v léčbě mcrc patří 5-fluorouracil (5-FU), irinotecan a oxaliplatina, léky cílené proti vaskulárnímu endoteliálnímu růstovému faktoru bevacizumab a aflibercept a dva inhibitory receptoru pro epidermální růstový faktor cetuximab a panitumumab. Pokud vyčerpáme všechny zmíněné léčebné modality, zbývá nám regorafenib, který je ještě schopen prodloužit život našich nemocných. Novou molekulou v léčbě relabujícího kolorektálního karcinomu je ziv-aflibercept. Je indikován k léčbě mcrc u nemocných, u nichž onemocnění progredovalo při léčbě režimem s oxaliplatinou či jsou vůči němu rezistentní. Aflibercept, známý jako VEGF trap ( VEGF past ), je rekombinantní fúzní protein sestávající z VEGF vazebné části tvořené extracelulárními doménami lidských receptorů VEGF1 a VEGF2 fúzované k Fc (fragment crystalizable) části lidského IgG1. Ziv-aflibercept je indikován v kombinaci s chemoterapií FOLFIRI k léčbě dospělých pacientů s metastatickým kolorektálním karcinomem (mcrc), u nichž onemocnění progredovalo při léčbě režimem obsahujícím oxaliplatinu či jsou vůči němu rezistentní. Aflibercept je podáván v dávce 4 mg/kg tělesné hmotnosti v jednohodinové nitrožilní infuzi s následným podáním chemoterapie FOLFIRI irinotecan 180 mg/m 2 ve formě nitrožilní infuze po 90 minut a leucovorin 400 mg/m 2 v nitrožilní infuzi po dobu 2 hodin s následným podáním nitrožilního bolusu 5-fluorouracilu (5-FU) v dávce 400 mg/m 2, následovaným kontinuálním podáním 5-FU mg po 46 hodin. Tato léčba je považována za jeden léčebný cyklus. Léčba se opakuje každé dva týdny a probíhá do progrese onemocnění či výskytu neakceptovatelných projevů toxicity léčby. Aflibercept byl zkoušen ve studii III. fáze, v níž bylo nemocných randomizováno do ramena s režimem FOLFIRI se ziv-afliberceptem, či bez něho. Ziv-aflibercept byl podáván v dávce 4 mg/m 2 v jednohodinové infuzi předcházející podání chemoterapie. Cykly se opakovaly každé 2 tý dny do progrese onemocnění nebo neakceptovatelné toxicity. Hlavním cílem studie bylo monitorovat celkové přežití nemocných. Nemocní byli stratifikováni podle výkonnostního stavu a předchozí expozice bevacizumabu. Medián věku nemocných byl 61 let, 59 % nemocných byli muži, ve výkonnostním stavu podle ECOG v 98 % případů 0 1. Všichni nemocní byli dříve léčeni režimem s oxaliplatinou. Bylo zaznamenáno statisticky významné prodloužení přežití ve skupině se ziv-afliberceptem ve srovnání se skupinou s placebem, medián přežití byl 13,5 měsíce vs. 12,06 měsíce (HR: 0,82; 95% CI: 0,71 0,94; p = 0,0032), medián času do progrese činil 6,9 měsíce ve skupině se ziv-afliberceptem a 4,37 měsíce ve skupině s placebem (HR: 0,76; 95% CI: 0,66 0,87; p = 0,00007). Aflibercept je hrazen v kombinaci s režimem FOLFIRI k léčbě pacientů se stavem výkonnosti (dle ECOG) 0 1 s metastazujícím kolorektálním karcinomem, který je rezistentní vůči léčbě režimem obsahujícím oxaliplatinu nebo po ní progredoval. Toto omezení dává v Čechách, kde je v 1. linii oxaliplatina velice oblíbená, afliberceptu možnost širokého uplatnění. Léčba kolorektálního karcinomu stojí již přes 50 let na podání 5-FU. Tato molekula se dostala do klinické praxe v roce 1956 a dodnes neztratila nic na svém významu. Její samotné podání v 80. letech zabezpečovalo nemocným s mcrc přežití 6 8 měsíců. S rozvojem chemoterapie a přidáním cílených léků se tato hranice posunula až za 30 měsíců. To dokazuje potřebu dalších linií v terapii tohoto refrakterního onemocnění. Převzato z Farmakoterapie 2015;11(2): v praxi 19
20 Současný pohled na farmakoterapii metastatického inoperabilního kolorektálního karcinomu Prof. MUDr. Luboš Petruželka, CSc.; MUDr. Patrik Georgiev; MUDr. Michal Vočka; MUDr. Jan Špaček, Ph.D. Onkologická klinika 1. LF UK ÚVN a VFN, Praha Souhrn Petruželka L, Georgiev P, Vočka M, Špaček J. Současný pohled na farmakoterapii metastatického inoperabilního kolorektálního karcinomu. Farmakoterapie v praxi 2016;5(Suppl 1): V posledních dvaceti letech byl zaznamenán významný pokrok v léčbě kolorektálního karcinomu, který vedl k výraznému prodloužení mediánu přežití pacientů. Režimy FOLFOX (5-FU, leucovorin, oxaliplatina), FOLFIRI (5-FU, leucovorin, irinotecan), XELOX (capecitabin, oxaliplatina) a FOLFIRINOX (5-FU, leucovorin, irinotecan, oxaliplatina) jsou v klinické praxi léčebným standardem. Pokrok v rozpoznávání klíčových molekulárních struktur v nádorové buňce (EGFR receptor pro epidermální růstový faktor; RAS klíčový onkogen signální transdukce) a nádorovém mikroprostředí (VEGFR receptor pro vaskulární endotelový růstový faktor) vedl k rozvoji cílené léčby a do klinické praxe přibyly kromě bevacizumabu, cetuximabu a panitumumabu později ještě aflibercept, ramucirumab a regorafenib. Klíčová slova kolorektální karcinom, farmakoterapie, chemoterapie, cílená léčba Summary Petruželka L, Georgiev P, Vočka M, Špaček J. Current perspective on the pharmacotherapy of inoperable metastatic colorectal cancer. Farmakoterapie v praxi 2016;5(Suppl 1): Marked advances in the treatment of colorectal cancer recorded over the last 20 years resulted in significantly extended median survival of the patients. FOLFOX (5-FU, leucovorin, oxaliplatin), FOLFIRI (5-FU, leucovorin, irinotecan), XELOX (capecitabine, oxaliplatin) and FOLFIRINOX (5-FU, leucovorin, irinotecan, oxaliplatin) regimens are now established clinical practice standards. Advances in recognising the key molecular structures in the tumour cell (EGFR epidermal growth factor receptor; RAS a key signal transduction oncogene) as well as the tumour microenvironment (VEGFR vascular endothelial growth factor receptor) resulted in the development of targeted therapy, and clinical practice has been further extended adding aflibercept, ramucirumab and regorafenib to bevacizumab, cetuximab and panitumumab. Key words colorectal cancer, pharmacotherapy, chemotherapy, targeted therapy Úvod V posledních 20 letech byl zaznamenán významný pokrok v léčbě kolorektálního karcinomu. Medián přežití metastazujícího onemocnění, který činil u neléčeného onemocnění 3 6 měsíců, dosahuje v současnosti až 30 měsíců. 1 3 Historickým standardem léčby metastazujícího kolorektálního karcinomu byla systémová chemoterapie 5-fluorouracilem (5-FU). V metaanalýze bylo prokázáno, že přidání leucovorinu k 5-FU zvyšuje počty objektivních léčebných odpovědí z 11 % na 21 % a prodlužuje medián doby přežití na téměř 12 měsíců. Zavedení účinnějšího a lépe snášeného kontinuálního podání 5-FU a začlenění irinotecanu a oxaliplatiny do režimů kombinační léčby představovalo počátek nové éry chemoterapie metastazujícího kolorektálního karcinomu (mcrc). 4 Po inovaci režimů chemoterapie dosahuje počet objektivních léčebných odpovědí (ORR) v 1. linii % i více a medián doby přežití 20 měsíců. Nové léky měly původně nahradit 5-FU, ale u žádného z nich nebyla prokázána v monoterapii větší účinnost, a tak cesta byla nalezena v jejich kombinaci s 5-FU. Režimy FOLFOX (5-FU, leucovorin, oxaliplatina) a FOLFIRI (5-FU, leucovorin, irinotecan), XELOX (capecitabin, oxaliplatina) a později FOLFIRINOX (5-FU, leucovorin, irinotecan, oxaliplatina) jsou v klinické praxi léčebným standardem. Postupné rozpoznávání klíčových molekulárních struktur v nádorové buňce (EGFR receptor pro epidermální růstový faktor; RAS klíčový onkogen signální transdukce) a nádorovém mikroprostředí (VEGFR receptor pro vaskulární endotelový růstový faktor) urychlilo nástup cílené léčby a do léčebného armamentaria kolorektálního karcinomu přibyly kromě bevacizumabu, cetuximabu a panitumumabu později ještě ziv-aflibercept, ramucirumab a regorafenib. 5 Kromě tyrosinkinázového inhibitoru regorafenibu jsou všechny ostatní léky 20 v praxi
21 na bázi monoklonálních protilátek a potřebují k vyjádření účinnosti partnerský chemoterapeutický režim. Chemoterapeutické režimy FOLFOX, FOLFIRI a FOLFIRINOX jsou patrně maximem možného účinku konvenční chemoterapie, a tak další zlepšení spočívá v kombinaci chemoterapie s cílenou biologickou léčbou (chemoterapie plus cetuximab/panitumumab nebo bevacizumab/aflibercept). Současné armamentarium konvenční chemoterapie metastatického kolorektálního karcinomu Účinnost základních kombinačních režimů FOLFOX nebo FOLFIRI je ekvivalentní, avšak při rozdílném profilu nežádoucích účinků. Přehled všech režimů včetně jejich modifikací uvádí tabulka 1. Nejčastějšími nežádoucími účinky při režimu FOLFIRI jsou průjmy, alopecie a výskyt afebrilní neutropenie (stupně 3 nebo 4). Toxicita není kumulativní, a irinotecan proto může být podáván až do progrese onemocnění. Ve srovnání s oxaliplatinou je FOLFIRI více emetogenní. Tato kombinace může být hůře snášena u nemocných s Gilbertovým syndromem a při polymorfismu UGT1A1. Irinotecan je metabolizován v játrech a při hyperbilirubinemii je nutné snížení dávky. 6 Oxaliplatina nezpůsobuje průjmy ani alopecii. Při kombinaci s bolusovým podáním 5-FU je též výskyt neutropenie poměrně častý, febrilní neutropenie je vzácná. Riziko myelosuprese je výrazně nižší při režimech bez bolusové aplikace 5-FU (např. modifikovaný FOLFOX7, existující ve dvou verzích [tabulka 1]) nebo XELOX. Oxaliplatinu lze podávat i u nemocných s hepatální nebo renální dysfunkcí, ovšem s nutnou úpravou dávky podle laboratorních hodnot. 7,8 Dávku limitujícím nežádoucím účinkem je senzorická neuropatie, která někdy vyžaduje přerušení léčby i při trvající léčebné odpovědi. Výskyt je kumulativní a prudce narůstá při překročení celkové kumulativní dávky 680 mg/m 2. 9 Riziko se zvyšuje s délkou podávání. Na rozdíl od ostatních nežádoucích účinků chemoterapie (alopecie, nevolnost) mohou tyto účinky přetrvávat měsíce a roky po léčbě a u některých pacientů (< 5 %) nedojde k úplnému zotavení. Neurotoxicita je pro oxaliplatinu dávku limitujícím specifickým nežádoucím účinkem. U nemocných s preexistující neuropatií a u osob, u nichž může senzorická neuropatie ovlivnit profesní život (např. profesionální hudebník), je upřednostnění režimu s irinotecanem před režimy s oxaliplatinou zřejmé. FOLFIRI je režimem volby u nemocných, kteří dostávali adjuvantní chemoterapii v posledních 12 měsících. V klinické studii CALGB/SWOG 80405, provedené v USA (viz dále), v níž měla zúčastněná centra možnost vlastní volby mezi kombinacemi FOLFOX a FOLFIRI, byl upřednostňován režim FOLFOX (73 % vs. 27 %). Ne u všech cytostatik používaných v protinádorové terapii u nemocných s mcrc je přesvědčivě doložena účinnost v monoterapii tak jako u fluoropyrimidinů a irinotecanu. Oxaliplatina samotná má nízkou účinnost, a proto je nejlépe podávána v kombinaci s využitím synergického působení fluoropyrimidinů. Jakákoliv léčebná sekvence využívající v 1. linii oxaliplatinu musí být použita v rámci kombinace tabulka 1 Základní režimy konvenční chemoterapie Režim Irinotecan Oxaliplatina Leucovorin 5-fluorouracil/capecitabin Režim FOLFIRI mg/m mg/m 2 během 5-FU 400 mg/m 2 bolus 1. den, Každé 2 týdny 1. den 2 hodin 1. den následně mg/m 2 46 hodin CIV podle Douillarda mg/m 2 1. den 200 mg/m 2 během 2 hodin 1. a 2. den před 5-FU 5-FU 400 mg/m 2 bolus, pak 600 mg/m 2 během 22 hodin 1. a 2. den Každé 2 týdny FOLFOX mg/m 2 1. den FOLFOX mg/m 2 1. den Modif. FOLFOX6 15,16 85 mg/m 2 1. den FOLFOX mg/m 2 1. den Modif. FOLFOX7 18 (Optimox) 100 mg/m 2 1. den 85 mg/m 2 Modif. FOLFOX7 19 (CONcePT) 1. den XELOX mg/m 2 1. den FOLFOXIRI mg/m 2 85 mg/m 2 1. den 1. den Pozn. Aplikace všech cytostatik je i. v. (kromě capecitabinu) 400 mg/m 2 během 2 hodin 1. a 2. den před 5-FU 400 mg/m 2 během 2 hodin 1. den 350 mg celková dávka během 2 hodin 1. den 400 mg/m 2 během 2 hodin 1. den 400 mg/m 2 během 2 hodin 1. den 200 mg/m 2 během 2 hodin 1. den 400 mg/m 2 během 2 hodin 1. den 5-FU 400 mg/m 2 bolus, pak 600 mg/m 2 během 22 hodin 1. a 2. den 5-FU 400 mg/m 2 bolus 1. den, pak mg/m 2 během 46 hodin 5-FU 400 mg/m 2 bolus 1. den, pak mg/m 2 během 46 hodin 5-FU 400 mg/m 2 bolus, pak mg/m 2 během 46 hodin 5-FU mg/m 2 během 46 hodin 5-FU mg/m 2 během 46 hodin Capecitabin mg/m 2 p. o. 2x denně den Každé 2 týdny Každé 2 týdny Každé 2 týdny Každé 2 týdny Každé 2 týdny Každé 2 týdny Každé 3 týdny Každé 2 týdny v praxi 21
22 FOLFOX nebo XELOX. Fluoro pyrimidiny a irinotecan mohou být použity samostatně jako alternativa ke kombinačním režimům FOLFIRI nebo infuzní fluorouracil/leucovorin. Jednoznačná data, jež by dokládala synergii mezi fluoropyrimidiny a irinotecanem, chybí, a tak monoterapii irinotecanem namísto FOLFIRI po chemoterapii FOLFOX lze zdůvodnit rezistencí vůči fluoropyrimidinům. Pro kombinaci oxaliplatiny a irinotecanu bez fluoropyrimidinů (IROX) není jednoznačný doklad o vyšší účinnosti (IROX vs. FOLFOX4, IROX vs. FOLFIRI). 10,11 Režim IROX je možno zvažovat pouze u nemocných s významným deficitem dihydropyrimidindehydrogenázy (DPD). Zvláště u starších pacientů je třeba tuto kombinaci podávat se zvýšenou opatrností. Účinnost režimu FOLFOXIRI (tabulka 1) limituje vyšší výskyt nežádoucích účinků a jeho nejpravděpodobnější místo v léčebném algoritmu je v kombinaci s bevacizumabem u vybraných pacientů s mcrc s BRAF. 20 Konvenční chemoterapie dosáhla mezí svých možností, ale v cytostatickém armamentariu se objevuje nově v minulosti zapomenuté cytostatikum TAS-102, syntetizované v roce 1964 Charlesem Heidelbergerem. TAS-102 je perorální cytostatikum sestávající ze dvou aktivních částí: nukleosidového analoga trifluridinu (trifluorothymidin, antimetabolit s potenciálním antiangiogenním účinkem inhibicí destičkového endotelového růstového faktoru) a účinného inhibitoru thymidinfosforylázy tipiracilu, který inhibuje metabolismus trifluridinu. Účinnost TAS-102 u refrakterních mcrc byla doložena v klinických studiích. Klinická studie II. fáze kontrolovaná placebem, prováděná v Japonsku u 172 nemocných s refrakterním mcrc, ukázala prodloužení mediánu celkového přežití (mos) při léčbě TAS-102 na 9 měsíců vs. 6,6 měsíce ve skupině placeba. Nejzávažnějšími nežádoucími účinky byly hematologická toxicita stupně 3 a 4 a gastrointestinální projevy stupně 1 a 2. Účinnost byla následně potvrzena v klinické studii III. fáze CONCOURSE, do níž bylo zařazeno 800 nemocných (7,1 měsíce vs. 5,3 měsíce; HR: 0,68; 95% CI: 0,58 0,81). TAS-102 byl podáván v dávce 35 mg/m 2 2x denně p. o. 1. až 5. a 8. až 12. den každé čtyři týdny. Prodloužení mos nezáviselo na předchozím podávání regorafenibu. TAS-102 není zatím komerčně dostupný lék Současné armamentarium cílené biologické léčby metastatického kolorektálního karcinomu Bevacizumab je MoAb cílená proti vaskulárnímu endotelovému faktoru (VEGF) a je standardně používaný v 1. nebo 2. léčebné linii u mcrc nezávisle na stavu onkogenu RAS. Cetuximab a panitumumab jsou monoklonální protilátky (MoAb) cílené proti EGFR. Cetuximab je chimérická MoAb, panitumumab je kompletně humánní MoAb. Obě MoAb jsou prakticky použitelné ve všech liniích léčby mcrc s nemutovaným ( divokým ) typem RAS. Aflibercept (VEGF Trap) je rekombinantní fúzní protein obsahující VEGF vazebnou část pro VEGFR-1 a -2 fúzovanou Fc frakcí lidského imunoglobulinu G1. 24 Na podkladě výsledků klinické studie VELOUR je možné aflibercept indikovat v kombinaci s režimem FOLFIRI při selhání chemoterapie na bázi oxaliplatiny (může předcházet podávání bevacizumabu). Do této klinické studie bylo zařazeno celkem nemocných randomizovaných k afliberceptu (4 mg/kg i. v.) nebo placebu plus FOLFIRI každé dva týdny do progrese. Medián celkové doby přežití byl signifikantně delší u nemocných léčených kombinací s afliberceptem (13,5 měsíce vs. 12,1 měsíce) i při předchozí expozici bevacizumabu. 25 Profil nežádoucích účinků při kombinaci aflibercept plus FOLFIRI ve studii VELOUR byl obdobný jako u ostatních léků zasahujících VEGF, zastoupení průjmů, mukozitid, komplikovaných neutropenií, infekcí, a únavy bylo vyšší, než je obvyklé při použití bevacizumabu, obdobně jako přerušení léčby pro projevy toxicity (30 % vs. 12 %). Ramucirumab je rekombinantní MoAb IgG1 s vazbou na VEGFR-2 blokující aktivaci tohoto receptoru, využitelná podle výsledků klinické studie III. fáze RAISE ve 2. linii léčby mcrc s FOLFIRI. Tato klinická studie porovnávala režim FOLFIRI s ramucirumabem nebo bez něho ve 2. linii léčby metastazujícího kolorektálního karcinomu (n = 1 050, randomizace 1 : 1) po selhání bevacizumabu plus chemoterapeutického režimu s oxaliplatinou. Gen KRAS byl mutován v 50 % případů. Bylo dosaženo primárního cíle, prodloužení mediánu OS 13,3 měsíce vs. 11,7 měsíce (p = 0,021). Rozdíl v mediánu PFS byl rovněž statisticky významný, 5,7 měsíce vs. 4,5 měsíce (p = 0,0005). Podíl odpovědí byl srovnatelný, 13,4 % vs. 12,5 %, a podobný byl i podíl kontroly onemocnění, 74,1 % vs. 68,8 %. Nejčastějšími nežádoucími účinky v ramenu s ramucirumabem byly neutropenie, únava, hypertenze a trombocytopenie. 26 Regorafenib je perorálně podávaný účinný inhibitor angiogenních tyrosinových kináz (včetně VEGFR-1 až VEGFR-3), stejně jako dalších membránových a intracelulárních kináz. Je jediným multikinázovým tyrosinkinázovým inhibitorem registrováným pro léčbu mcrc. V současných algoritmech léčby metastazujícího kolorektálního karcinomu je zařazován u nemocných s progresí onemocnění po nejméně dvou předcházejících liniích systémové léčby. Léčebný účinek je nezávislý na stavu onkogenu RAS. Prodloužení celkové doby přežití bylo prokázáno ve dvou randomizovaných placebem kontrolovaných studiích, CORRECT a CONCUR (druhá studie proběhla kompletně v Asii). 27,28 Nejčastěji se vyskytujícími nežádoucími účinky ve studii CORRECT byly chrapot, hand-foot syndrom (označovaný též jako palmární-plantární erytrodysestezie), mukozitida, průjmy a hypertenze. Vzhledem k riziku hepatotoxicity je nutné monitorovat jaterní funkce během léčby a při známkách hepatotoxicity, manifestující se elevací jaterních enzymů nebo vznikem hepatocelulárních nekróz. Regorafenib je inhibitor angiogeneze účinný v monoterapii mcrc. V probíhajících klinických studiích je hodnocen v časných indikacích, včetně kombinace s chemoterapií. 29 Porovnání klinických studií III. fáze s MoAb zasahujícími proces angiogeneze je uvedeno v tabulce 2. Otevřenou otázkou zůstává, zda použití všech tří MoAb je klinicky relevantní pro klinickou praxi. 22 v praxi
23 tabulka 2 Porovnání klinických studií III. fáze s monoklonálními protilátkami zasahujícími proces angiogeneze Agens Bevacizumab Aflibercept Ramucirumab Studie TML VELOUR RAISE 1. linie Chemoterapie + bevacizumab Fluoropyrimidin-oxaliplatina ± bevacizumab Chemoterapie + bevacizumab Chemoterapie FOLFIRI + aflibercept FOLFIRI + placebo Fluoropyrimidin-oxaliplatina + bevacizumab FOLFIRI + ramucirumab FOLFIRI + placebo Počet nemocných Medián OS 11,2 měs. 9,8 měs. 13,5 měs. 12,1 měs. 13,3 měs. 11,7 měs. HR 0,81 HR 0,82 HR 0,84 Medián PFS 5,7 měs. 4,1 měs. 6,9 měs. 4,7 měs. 5,7 měs. 4,5 měs. HR 0,68 HR 0,76 HR 0,78 Model kontinuální systémové léčby V léčbě mcrc ustupuje a přestává být aktuální model označování jednotlivých linií systémové léčby (tzn. postupné nasazování režimů s nezkříženou rezistencí až do progrese onemocnění) a je nahrazován novým modelem kontinuálně prováděné léčby. 30 Tento inovativní přístup je odrazem individualizované léčebné strategie, která umožňuje použít méně agresivní režimy i při zahájení léčby, včetně období udržovací léčby, a při kombinaci s cílenou biologickou léčbou pak pokračovat v terčové léčbě se záměnou chemoterapeutického partnera. Další možností je opětovné nasazení účinného režimu léčby použitého v úvodní fázi. Individualizovaný přístup umožňuje dlouhodobou kontrolu nemoci. Inkrementální prodloužení celkového přežití pacientů s mcrc v poslední dekádě je evidentní, jak dokládají zásadní klinické studie III. fáze FIRE-3 a CALGB/SWOG Poslední prezentovaná velká klinická studie s mediánem přežití 30 měsíců CALGB/SWOG je toho důkazem. Ekvivalentní výsledky všech čtyř ramen otvírají pro onkology a jejich pacienty možnost uplatnění principů personalizované medicíny jak pro volbu cílené léčby, tak pro volbu chemoterapeutického partnera při léčbě metastazujícího onemocnění. Výsledky zásadních klinických studií bez možnosti identifikace optimálního režimu paradoxně tento koncept potvrzují 31 (tabulka 3). tabulka 3 Výsledky zásadních klinických studií systémové léčby Studie FIRE-3 a CALGB/SWOG Charakteristika klinické studie FIRE-3 CALGB/SWOG Primární sledovaný ukazatel Počet objektivních léčebných odpovědí (ORR) Celková doba přežití (OS) Režim chemoterapie Chemoterapie + bevacizumab vs. chemoterapie + cetuximab Chemoterapie + bevacizumab vs. chemoterapie + cetuximab Chemoterapeutický partner FOLFIRI FOLFOX 74 %; FOLFIRI 26 % Kohorty ITT (nemutovaný KRAS v exonu 2) Počet nemocných 295 vs vs. 578 RR 58 % vs. 62 %; p = 0,183 57,2 % vs. 65,6 %; p = 0,02 PFS 10,3 měs. vs. 10,0 měs. (HR: 1,06; p = 0,547) 29,0 měs. vs. 29,9 měs. (HR: 0,92; p = 0,34) Medián OS 25,0 měs. vs. 28,7 měs. (HR: 0,77; p = 0,017) 29,0 měs. vs. 29,9 měs. (HR: 0,92; p = 0,34) Kohorty s nemutovaným RAS Počet nemocných 201 vs vs. 270 RR 58,7 % vs. 65,3 % (OR: 1,33; p = 0,18) 53,8 % vs. 68,6 % (p < 0,01) PFS 10,2 měs. vs. 10,3 měs. (HR: 0,97; p = 0,77) 11,3 vs. 11,4 (HR: 1,1; p = 0,31) Medián OS 25,0 měs. vs. 33,1 měs. (HR: 0,70; p = 0,006) 31,2 měs. vs. 32,0 měs. (HR: 0,9; p = 0,40) Kohorty s mutovaným RAS Počet nemocných 91 vs vs. 53 RR 50,5 % vs. 38,1 % (OR: 0,60; p = 0,11) NR PFS 9,6 měs. vs. 7,5 měs. (HR: 1,25; p = 0,14) NR Medián OS 20,6 měs. vs. 20,2 měs. (HR: 1,05; p = 0,75) 22,3 měs. vs. 28,7 měs. (HR: 0,74; p = 0,21) Vysvětlivky HR poměr rizik (hazard ratio); ITT soubor podle léčebného záměru (intention-to-treat); NR neuvedeno; OR poměr šancí (odds ratio); OS celkové přežití (overall survival); PFS doba bez progrese (progression-free survival); RR podíl léčebných odpovědí (response ratio) v praxi 23
24 tabulka 4 Možné sekvence farmakoterapie metastazujícího inoperabilního kolorektálního karcinomu (Podle 5) Molekulární charakteristika mras (55 %) wtras (40 %) mbraf (5 %) Bevacizumab Bevacizumab Inhibitor EGFR Bevacizumab + FOLFOXIRI + chemoterapie dublet + chemoterapie dublet + chemoterapie dublet Inhibitor VEGF + chemoterapie dublet Inhibitor VEGF + chemoterapie dublet Bevacizumab + chemoterapie dublet Inhibitor EGFR + chemoterapie?? Regorafenib Inhibitor EGFR + irinotecan Regorafenib Regorafenib BSC/TAS-102? Regorafenib BSC/TAS-102? BSC/TAS-102? Mitomycin C? BSC/TAS-102? Mitomycin C? Mitomycin C? Vysvětlivky BSC nejlepší podpůrná péče (best supportive care) Tento koncept neznamená zánik klinických doporučených postupů, které spíše než rigidním návodem jsou flexibilním vodítkem pro léčebný postup. 32 V tabulce 4 jsou uvedeny příklady možných léčebných sekvencí, které mohou vést k dlouhodobé kontrole choroby. Závěr V klinické praxi musí interdisciplinární týmy řešit tři základní modelové situace: 1. pacient s primárně resekabilními jaterními metastázami; 2. pacient s primárně neresekabilními metastázami, u kterého lze předpokládat možnost dosažení sekundární resekability; 3. pacient s metastázami, u kterého nelze předpokládat, že bude dosaženo resekability. Scénář číslo 3 se vyskytuje nejčastěji. Kritickým faktorem, který musí být vzat v úvahu při volbě terapeutického postupu, je výkonnostní stav nemocného (PS performance status). Výběr léčby u nemocných v příznivém PS (PS 0 nebo PS 1) se liší od výběru u nemocných se sníženým stavem výkonnosti (PS 2 nebo PS 3). Důležité je vyhodnocení jak PS, tak komorbidit. Přidružená onemocnění jsou definována jako zdravotní problémy nesouvisející s nádorovým onemocněním, které ale mohou ovlivnit PS. U nemocných s PS > 2 nebo se závažnými komorbiditami není možné podat agresivní léčbu, a pro některé nemocné tak může být největším přínosem léčba podpůrná. Přítomnost klinických příznaků je známkou agresivního průběhu onemocnění. U nemocných s horším PS v důsledku symptomatologie nádorového onemocnění by měla být jako první zvažována agresivnější kombinace chemoterapie s přidáním cílené biologické léčby. Cílem je rychlé zmenšení nádorové masy a symptomatická úleva. Pro systémovou léčbu mcrc 1. linie existuje řada možností od monochemoterapie přes triplety až po biochemoterapii. Definitivní výběr léčby vychází z týmového rozhodnutí při skloubení klinické a molekulární predikce. Výběr a načasování optimálního režimu mají stále řadu neznámých a je zde poměrně široká paleta víceméně rovnocenných možností parenterální léčby, včetně kombinací obsahujících capecitabin. Ani výsledky klinických studií III. fáze zatím nepřinesly jednoznačnou odpověď na otázku optimální volby léčebného režimu. 24 v praxi
25 Literatura 1 Heinemann V, von Weikersthal LF2, Decker T3, et al. FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE 3): a randomised, open-label, phase 3 trial. Lancet Oncol 2014;15: Stintzing S, Modest DP, von Weikersthalet F, et al. Independent radiological evaluation of objective response, early tumor shrinkage, and depth of response in FIRE-3 (AIO KRK 0306) in the final RAS evaluable population [abstract LBA11]. Ann Oncol 2014;25(Suppl 5): Venook AP, Niedzwiecki D, Lenz H-J, et al. CALGB/SWOG 80405: phase III trial of irinotecan/5-fu/leucovorin (FOLFIRI) or oxaliplatin/5-fu/leucovorin (mfolfox6) with bevacizumab (BV) or cetuximab (CET) for patients (pts) with KRAS wild-type (wt) untreated metastatic adenocarcinoma of the colon or rectum (mcrc) [abstract]. J Clin Oncol 2014;32(5s Suppl): Abstract LBA3. 4 Venook A, Weiser MR, Tepper JE, et al. Colorectal cancer: all hands on deck. Am Soc Clin Oncol Educ Book 2014:83 9. doi: /EdBook_AM Sridharan M, Hubbard JM, Grothey A. Colorectal cancer: how emerging molecular understanding affects treatment decisions. Oncology 2014;28: Meyerhardt JA, Kwok A, Ratain MJ, et al. Relationship of baseline serum bilirubin to efficacy and toxicity of single- -agent irinotecan in patients with metastatic colorectal cancer. J Clin Oncol 2004;22: Doroshow JH, Synold TW, Gandara D, et al. Pharmacology of oxaliplatin in solid tumor patients with hepatic dysfunction: a preliminary report of the National Cancer Institute Organ Dysfunction Working Group. Semin Oncol 2003;30: Takimoto CH, Remick SC, Sharma S, et al. Dose-escalating and pharmacological study of oxaliplatin in adult cancer patients with impaired renal function: a National Cancer Institute Organ Dysfunction Working Group Study. J Clin Oncol 2003;21: Green E, Sargent DJ, Goldberg RM, et al. Detailed analysis of oxaliplatin-associated neurotoxicity in Intergroup trial N9741 [abstract]. Data presented at the 2005 ASCO Gastrointestinal Cancers Symposium, Hollywood, Florida, January 28, Schalhorn A, Ludwig F, Quietzsch D, et al. Phase III trial of irinotecan plus oxalipatin (IROX) versus irinotecan plus 5-FU/ folinic acid (FOLFIRI) as first-line treatment of metastatic colorectal cancer (CRC): The FIRE-Trial (abstract). J Clin Oncol 2005;23:250s. 11 Falcone A, Ricci S, Brunetti I, et al. Phase III trial of infusional fluorouracil, leucovorin, oxaliplatin, and irinotecan (FOLFOXIRI) compared with infusional fluorouracil, leucovorin, and irinotecan (FOLFIRI) as first-line treatment for metastatic colorectal cancer: the Gruppo Oncologico Nord Ovest. J Clin Oncol 2007;25: Tournigand C, André T, Achille E, et al. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol 2004; 22: Douillard JY, Cunningham D, Roth AD, et al. Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer: a multicentre randomised trial. Lancet 2000; 355: Goldberg R, Sargent DJ, Morton RF, et al. A randomized controlled trial of fluorouracil plus leucovorin, irinotecan, and oxaliplatin combinations in patients with previously untreated metastatic colorectal cancer. J Clin Oncol 2004;22: Cheeseman SL, Joel SP, Chester JD, et al. A modified de Gramont regimen of fluorouracil, alone and with oxaliplatin, for advanced colorectal cancer. Br J Cancer 2002;87: Hochster HS, Hart LL, Ramanathan RK, et al. Safety and efficacy of oxaliplatin and fluoropyrimidine regimens with or without bevacizumab as first-line treatment of metastatic colorectal cancer: Results of the TREE Study. J Clin Oncol 2008;26: Maindrault-Goebel F, De Gramont A, Louvet C, et al. High- -dose intensity oxaliplatin added to the simplified bimonthly leucovorin and 5-fluorouracil regimen as second-line therapy for metastatic colorectal cancer (FOLFOX 7). Eur J Cancer 2001;37: Chibaudel B, Maindrault-Goebel F, Lledo G, et al. Can chemotherapy be discontinued in unresectable metastatic colorectal cancer? The GERCOR OPTIMOX2 Study. J Clin Oncol 2009;27: Grothey A, Hart LL, Rowland KM, et al. Intermittent oxaliplatin administration and time-to-treatment-failure in metastatic colorectal cancer: Final results of the phase III CONcePT trial. J Clin Oncol 2008;26(Suppl 15S):180s: Abstract Cremolini C, Loupakis F, Masi G, et al. FOLFOXIRI plus bevacizumab (bev) versus FOLFIRI plus bev as first-line treatment of metastatic colorectal cancer (mcrc): Updated survival results of the phase III TRIBE trial by the GONO group (abstract). J Clin Oncol 2015;33(Suppl 3):Abstract 657. Abstract available online at content/ (Accessed on January 15, 2015) 21 Yoshino T, Mizunuma N, Yamazaki K, et al. TAS-102 monotherapy for pretreated metastatic colorectal cancer: a double-blind, randomised, placebo-controlled phase 2 trial. Lancet Oncol 2012;13: Van Cutsem E, Ohtsu A, Falcone A, et al. Phase III RECOURSE trial of TAS-102 vs placebo, with best supportive care, in patients with metastatic colorectal cancer (mcrc) refractory to standard therapies (abstract LBA13). Data presented at the 2014 ESMO Congress, September 27, 2014, Madrid, Spain. Abstract available online at library/esmo/browse/search/gow#9f8u02vn (Accessed on December 04, 2014). 23 Yoshino T, Mayer R, Falcone A, et al. Results of a multicenter, randomised, double-blind, phase III study of TAS-102 vs. placebo, with best supportive care, in patients with metastatic colorectal cancer (mcrc) refractory to standard therapies (RECOURSE). (abstract O-022). Data presented at the 16 th ESMO World Congress on Gastrointestinal Cancer, June 28, 2014, Barcelona, Spain. Abstract available online at -Office/Press-Releases/Phase-III-Trial-Shows-Improved- -Survival-with-TAS-102-in-Metastatic-Colorectal-Cancer- -Refractory-to-Standard-Therapies (Accessed on December 04, 2014). 24 Holash J, Davis S, Papadopoulos N, et al. VEGF-Trap: a VEGF blocker with potent antitumor effects. Proc Natl Acad Sci U S A 2002;99: Tabernero J, Van Cutsem E, Lakomý R, et al. Aflibercept versus placebo in combination with fluorouracil, leucovorin and irinotecan in the treatment of previously treated metastatic colorectal cancer: prespecified subgroup analyses from the VELOUR trial. Eur J Cancer 2014;50: Tabernero J, Cohn AL, Obermannova R, et al. RAISE: a randomized, double-blind multicenter phase III study of irinotecan, folinic acid, and 5-fluorouracil (FOLFIRI) plus ramucirumab or placebo in pateints with metastatic colorectal carcinoma progressive during or following first-line combination chemotherapy with bevacizumab, oxaliplatin, and fluoropyrimidine (abstract). J Clin Oncol 2015;33(Suppl 3):Abstract 512. Abstract available online at meetinglibrary.asco.org/content/ (Accessed on January 21, 2015). 27 Grothey A, Van Cutsem E, Sobrero A, et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2013;381: Kim T, Xu R, Yau T, et al. CONCUR: a randomized, placebo- -controlled phase 3 study of regorafenib (REG) monotherapy in Asian patients with previously treated metastatic colorectal cancer (mcrc) [abstract 5000]. Ann Oncol 2014;25(Suppl 4): Khan G, Moss RA, Braiteh F, et al. Proactive strategies for regorafenib in metastatic colorectal cancer: implications for optimal patient management. Cancer Manag Res 2014; 6: Goldberg RM, Rothenberg ML, Van Cutsem E, et al. The continuum of care: a paradigm for the management of metastatic colorectal cancer. Oncologist 2007;12: Stevens EA, Rodriguez CP. Genomic medicine and targeted therapy for solid tumor. J Surg Oncol 2015;111: Van Cutsem E, Cervantes A, Nordlinger B, et al, on behalf of the ESMO Guidelines Working Group. Metastatic colorectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2014;25(Suppl 3):1 9. Převzato z Farmakoterapie 2015;11 (2): v praxi 25
26 poznámky 26 v praxi
Chemoterapie pokročil kolorektáln. karcinomu
 Chemoterapie pokročil ilého kolorektáln lního karcinomu Jindřich ich FínekF Chemoterapie pokročil ilého kolorektáln lního karcinomu v prvé linii Incidence ve světě Incidence a mortalita v ČR Stádia onemocnění
Chemoterapie pokročil ilého kolorektáln lního karcinomu Jindřich ich FínekF Chemoterapie pokročil ilého kolorektáln lního karcinomu v prvé linii Incidence ve světě Incidence a mortalita v ČR Stádia onemocnění
Protokol pro léčbu karcinomu tlustého střeva
 1 Klinika onkologie a radioterapie FN Hradec Králové Platnost od: 2.1.2013 Dokument: standardní léčebný postup - verze 2013 Počet stran: 6 Přílohy: nejsou Protokol pro léčbu karcinomu tlustého střeva Schválili:
1 Klinika onkologie a radioterapie FN Hradec Králové Platnost od: 2.1.2013 Dokument: standardní léčebný postup - verze 2013 Počet stran: 6 Přílohy: nejsou Protokol pro léčbu karcinomu tlustého střeva Schválili:
Lze předvídat výsledek léčby bevacizumabem u metastatického kolorektálního karcinomu na základě stavu onkogenu K-ras? Komentář
 Lze předvídat výsledek léčby bevacizumabem u metastatického kolorektálního karcinomu na základě stavu onkogenu K-ras? MUDr. Jiří Tomášek Komentář MUDr. Pavel Vítek, Ph.D. Lze předvídat výsledek léčby
Lze předvídat výsledek léčby bevacizumabem u metastatického kolorektálního karcinomu na základě stavu onkogenu K-ras? MUDr. Jiří Tomášek Komentář MUDr. Pavel Vítek, Ph.D. Lze předvídat výsledek léčby
R.A. Burger, 1 M.F. Brady, 2 J. Rhee, 3 M.A. Sovak, 3 H. Nguyen, 3 M.A. Bookman 4
 NEZÁVISLÉ RADIOLOOGICKÉ HODNOCENÍ STUDIE FÁZE III GOG218 S BEVACIZUMABEM (BEV) V PRIMÁRNÍ LÉČBĚ POKROČILÉHO EPITELOVÉHO NÁDORU VAJEČNÍKŮ, PRIMÁRNÍHO NÁDORU PERITONEA NEBO VEJCOVODŮ. R.A. Burger, 1 M.F.
NEZÁVISLÉ RADIOLOOGICKÉ HODNOCENÍ STUDIE FÁZE III GOG218 S BEVACIZUMABEM (BEV) V PRIMÁRNÍ LÉČBĚ POKROČILÉHO EPITELOVÉHO NÁDORU VAJEČNÍKŮ, PRIMÁRNÍHO NÁDORU PERITONEA NEBO VEJCOVODŮ. R.A. Burger, 1 M.F.
Východiska. Čtvrtá nejčastější příčina úmrtí na nádorová onemocní u žen, v celém světě je ročně nových onemocnění a úmrtí
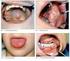 ICON7: studie fáze III Gynaecologic Cancer InterGroup (GCIG) s přidáním bevacizumabu ke standardní chemoterapii u žen s nově diagnostikovaným epitelovým nádorem vaječníků, primárním nádorem pobřišnice
ICON7: studie fáze III Gynaecologic Cancer InterGroup (GCIG) s přidáním bevacizumabu ke standardní chemoterapii u žen s nově diagnostikovaným epitelovým nádorem vaječníků, primárním nádorem pobřišnice
Biologická léčba karcinomu prsu. Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN)
 Biologická léčba karcinomu prsu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN) Cílená léčba Ca prsu Trastuzumab (HercepNn) AnN HER2 neu pronlátka LapaNnib (Tyverb)
Biologická léčba karcinomu prsu Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1.LF UK a TN KOC (NNB+VFN+TN) Cílená léčba Ca prsu Trastuzumab (HercepNn) AnN HER2 neu pronlátka LapaNnib (Tyverb)
3.3 KARCINOM SLINIVKY BŘIŠNÍ
 3.3 KARCINOM SLINIVKY BŘIŠNÍ Epidemiologie Zhoubné nádory pankreatu se vyskytují převážně ve vyšším věku po 60. roce života, převážně u mužů. Zhoubné nádory pankreatu Incidence a mortalita v České republice
3.3 KARCINOM SLINIVKY BŘIŠNÍ Epidemiologie Zhoubné nádory pankreatu se vyskytují převážně ve vyšším věku po 60. roce života, převážně u mužů. Zhoubné nádory pankreatu Incidence a mortalita v České republice
Bevacizumab u starších pacientů s kolorektálním karcinomem
 Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
Standard NLPP 3.5 SEKCE: NLPP STRANA PROCEDURY: 1/7. PŘEDMĚT/VÝKON/PROCEDURA Kolorektální karcinom
 1/7 1. Epidemiologie: Česká republika zaujímá ve statistikách dlouhodobě jedno z předních míst při hodnocení incidence tohoto onemocnění v zemích, kde jsou vedeny registry. V roce 2014 byla incidence KRK
1/7 1. Epidemiologie: Česká republika zaujímá ve statistikách dlouhodobě jedno z předních míst při hodnocení incidence tohoto onemocnění v zemích, kde jsou vedeny registry. V roce 2014 byla incidence KRK
Profil nemocn ch vhodn ch k léãbû chemobioterapií
 Profil nemocn ch vhodn ch k léãbû chemobioterapií MUDr. Marta Holíková / Oddûlení klinické onkologie Krajské nemocnice, Liberec Většina pacientů s kolorektálním karcinomem (CRC) stadia I nebo II je trvale
Profil nemocn ch vhodn ch k léãbû chemobioterapií MUDr. Marta Holíková / Oddûlení klinické onkologie Krajské nemocnice, Liberec Většina pacientů s kolorektálním karcinomem (CRC) stadia I nebo II je trvale
Hodnocení segmentu centrové léčby z dat plátců zdravotní péče. Společné pracoviště ÚZIS ČR a IBA MU
 Hodnocení segmentu centrové léčby z dat plátců zdravotní péče Společné pracoviště ÚZIS ČR a IBA MU Realita současné české medicíny: úspěšné výsledky léčby = podstatné prodlužování doby života pacienta
Hodnocení segmentu centrové léčby z dat plátců zdravotní péče Společné pracoviště ÚZIS ČR a IBA MU Realita současné české medicíny: úspěšné výsledky léčby = podstatné prodlužování doby života pacienta
Urychlení úpravy krvetvorby poškozené cytostatickou terapií (5-fluorouracil a cisplatina) p.o. aplikací IMUNORu
 Urychlení úpravy krvetvorby poškozené cytostatickou terapií (5-fluorouracil a cisplatina) p.o. aplikací IMUNORu Úvod Myelosuprese (poškození krvetvorby) patří mezi nejčastější vedlejší účinky chemoterapie.
Urychlení úpravy krvetvorby poškozené cytostatickou terapií (5-fluorouracil a cisplatina) p.o. aplikací IMUNORu Úvod Myelosuprese (poškození krvetvorby) patří mezi nejčastější vedlejší účinky chemoterapie.
Nádory podjaterní krajiny Onkologická terapie. Doc. MUDr. Martina Kubecová, Ph.D. Radioterapeutická a onkologická klinika 3. LF UK a FNKV, Praha
 Nádory podjaterní krajiny Onkologická terapie Doc. MUDr. Martina Kubecová, Ph.D. Radioterapeutická a onkologická klinika 3. LF UK a FNKV, Praha Český a slovenský gastroenterologický kongres 13.11.2015
Nádory podjaterní krajiny Onkologická terapie Doc. MUDr. Martina Kubecová, Ph.D. Radioterapeutická a onkologická klinika 3. LF UK a FNKV, Praha Český a slovenský gastroenterologický kongres 13.11.2015
Kongres medicíny pro praxi IFDA Praha, Hotel Hilton 27.září 2014
 Kongres medicíny pro praxi IFDA Praha, Hotel Hilton 27.září 2014 Co znamená cílená terapie karcinomu plic v roce 2014? František Salajka Plicní klinika FN Hradec Králové Co může pneumoonkologické centrum
Kongres medicíny pro praxi IFDA Praha, Hotel Hilton 27.září 2014 Co znamená cílená terapie karcinomu plic v roce 2014? František Salajka Plicní klinika FN Hradec Králové Co může pneumoonkologické centrum
Aflibercept v současné léčbě solidních nádorů
 Aflibercept v současné léčbě solidních nádorů doc. MUDr. Luboš Holubec, Ph.D., MBA 1,2 ; MUDr. Václav Liška, Ph.D. 2 ; prof. MUDr. Jindřich Fínek, Ph.D. 1 1 Radioterapeutická a onkologická klinika, FN
Aflibercept v současné léčbě solidních nádorů doc. MUDr. Luboš Holubec, Ph.D., MBA 1,2 ; MUDr. Václav Liška, Ph.D. 2 ; prof. MUDr. Jindřich Fínek, Ph.D. 1 1 Radioterapeutická a onkologická klinika, FN
Přínos molekulární genetiky pro diagnostiku a terapii malignit GIT v posledních 10 letech
 Přínos molekulární genetiky pro diagnostiku a terapii malignit GIT v posledních 10 letech Minárik M. Centrum aplikované genomiky solidních nádorů (CEGES), Genomac výzkumný ústav, Praha XXIV. JARNÍ SETKÁNÍ
Přínos molekulární genetiky pro diagnostiku a terapii malignit GIT v posledních 10 letech Minárik M. Centrum aplikované genomiky solidních nádorů (CEGES), Genomac výzkumný ústav, Praha XXIV. JARNÍ SETKÁNÍ
Registr Herceptin Karcinom prsu
 I. Primární diagnostika Registr Herceptin Karcinom prsu Vstupní parametry Rok narození Věk Kód zdravotní pojišťovny (výběr) o 111 o 201 o 205 o 207 o 209 o 211 o 213 o 217 o 222 Datum stanovení diagnózy
I. Primární diagnostika Registr Herceptin Karcinom prsu Vstupní parametry Rok narození Věk Kód zdravotní pojišťovny (výběr) o 111 o 201 o 205 o 207 o 209 o 211 o 213 o 217 o 222 Datum stanovení diagnózy
Avastin na kongresu WCGIC Barcelona 2009
 Avastin na kongresu WCGIC Barcelona 2009 Komentář k přednáškám Jiří Tomášek, Klinika komplexní onkologické péče MOÚ, Brno 1. Operace s kurativním záměrem u mcrc V přednášce profesora Thomase Grünbergra
Avastin na kongresu WCGIC Barcelona 2009 Komentář k přednáškám Jiří Tomášek, Klinika komplexní onkologické péče MOÚ, Brno 1. Operace s kurativním záměrem u mcrc V přednášce profesora Thomase Grünbergra
Registr Avastin Nemalobuněčný karcinom plic
 Registr Avastin Nemalobuněčný karcinom plic Formulář: Vstupní parametry Rok narození Věk Pohlaví Kouření o Kuřák o Bývalý kuřák o Nekuřák Hmotnost pacienta v době diagnózy (kg) Hmotnost pacienta v době
Registr Avastin Nemalobuněčný karcinom plic Formulář: Vstupní parametry Rok narození Věk Pohlaví Kouření o Kuřák o Bývalý kuřák o Nekuřák Hmotnost pacienta v době diagnózy (kg) Hmotnost pacienta v době
Personalizovaná medicína Roche v oblasti onkologie. Olga Bálková, Roche s.r.o., Diagnostics Division Pracovní dny, Praha, 11.
 Personalizovaná medicína Roche v oblasti onkologie Olga Bálková, Roche s.r.o., Diagnostics Division Pracovní dny, Praha, 11. listopadu 2013 Personalizovaná vs standardní péče Cílená léčba Spojení diagnostiky
Personalizovaná medicína Roche v oblasti onkologie Olga Bálková, Roche s.r.o., Diagnostics Division Pracovní dny, Praha, 11. listopadu 2013 Personalizovaná vs standardní péče Cílená léčba Spojení diagnostiky
Přípravek Avastin se společně s jinými protinádorovými léčivými přípravky používá u dospělých k léčbě těchto typů rakoviny:
 EMA/175824/2015 EMEA/H/C/000582 Souhrn zprávy EPAR určený pro veřejnost bevacizumabum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro přípravek.
EMA/175824/2015 EMEA/H/C/000582 Souhrn zprávy EPAR určený pro veřejnost bevacizumabum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro přípravek.
Statistická analýza dat k
 ANALÝZA VÝSLEDKŮ LÉČBY AVASTINEM Statistická analýza dat k 30. 9. 2006 R. Vyzula, D. Némethová, A. Svobodník et al. I ZÁKLADNÍ POPIS SOUBORU I.1. Počet pacientů v jednotlivých centrech Celkový počet zařazených
ANALÝZA VÝSLEDKŮ LÉČBY AVASTINEM Statistická analýza dat k 30. 9. 2006 R. Vyzula, D. Némethová, A. Svobodník et al. I ZÁKLADNÍ POPIS SOUBORU I.1. Počet pacientů v jednotlivých centrech Celkový počet zařazených
Udržovací léčba: zamířeno na anti-vegf léčbu Alan Sandler
 Udržovací léčba: zamířeno na anti-vegf léčbu Alan Sandler Department of Hematology/Oncology Oregon Health and Science University Knight Cancer Institute Portland, OR, USA Medián OS (měsíce) Studie v 1.linii
Udržovací léčba: zamířeno na anti-vegf léčbu Alan Sandler Department of Hematology/Oncology Oregon Health and Science University Knight Cancer Institute Portland, OR, USA Medián OS (měsíce) Studie v 1.linii
Opakované resekce jater pro metastázy kolorektálního karcinomu
 Opakované resekce jater pro metastázy kolorektálního karcinomu Visokai V., Lipská L., Mráček M., Levý M. Chirurgická klinika 1. LF UK a Fakultní Thomayerovy nemocnice v Praze přednosta Doc. MUDr. V. Visokai,
Opakované resekce jater pro metastázy kolorektálního karcinomu Visokai V., Lipská L., Mráček M., Levý M. Chirurgická klinika 1. LF UK a Fakultní Thomayerovy nemocnice v Praze přednosta Doc. MUDr. V. Visokai,
PET při stagingu a recidivě kolorektálního karcinomu
 PET při stagingu a recidivě kolorektálního karcinomu Visokai V., Lipská L., *Skopalová M., *Bělohlávek O. Chirurgické oddělení Fakultní Thomayerovy nemocnice Praha *Oddělení nukleární medicíny - PET centrum
PET při stagingu a recidivě kolorektálního karcinomu Visokai V., Lipská L., *Skopalová M., *Bělohlávek O. Chirurgické oddělení Fakultní Thomayerovy nemocnice Praha *Oddělení nukleární medicíny - PET centrum
Rozbor léčebné zátěže Thomayerovy nemocnice onkologickými pacienty a pilotní prezentace výsledků péče
 Rozbor léčebné zátěže Thomayerovy nemocnice onkologickými pacienty a pilotní prezentace výsledků péče Výstupy analýzy dat zdravotnického zařízení a Národního onkologického registru ČR Prof. MUDr. Jitka
Rozbor léčebné zátěže Thomayerovy nemocnice onkologickými pacienty a pilotní prezentace výsledků péče Výstupy analýzy dat zdravotnického zařízení a Národního onkologického registru ČR Prof. MUDr. Jitka
CORECT - VECTIBIX. Klinický registr pacientů s metastatickým kolorektálním karcinomem. Stav registru k datu
 CORECT - VECTIBIX Klinický registr pacientů s metastatickým kolorektálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr
CORECT - VECTIBIX Klinický registr pacientů s metastatickým kolorektálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr
Modul obecné onkochirurgie
 Modul obecné onkochirurgie 1. Principy kancerogeneze, genetické a epigenetické faktory 2. Onkogeny, antionkogeny, reparační geny, instabilita nádorového genomu 3. Nádorová proliferace a apoptóza, důsledky
Modul obecné onkochirurgie 1. Principy kancerogeneze, genetické a epigenetické faktory 2. Onkogeny, antionkogeny, reparační geny, instabilita nádorového genomu 3. Nádorová proliferace a apoptóza, důsledky
Metastatický renální karcinom Andrašina Tomáš
 Metastatický renální karcinom Andrašina Tomáš Department of Radiology and Nuclear Medicine, University Hospital Brno and Medical Faculty, Masaryk University, Brno, Czech Republic Renální karcinom 25-30
Metastatický renální karcinom Andrašina Tomáš Department of Radiology and Nuclear Medicine, University Hospital Brno and Medical Faculty, Masaryk University, Brno, Czech Republic Renální karcinom 25-30
ŽIVOTNÍ CYKLUS LÉKŮ KLINICKÉ HODNOCENÍ STUDIE. Kateřina Kopečková FN Motol, Praha
 ŽIVOTNÍ CYKLUS LÉKŮ KLINICKÉ HODNOCENÍ STUDIE Kateřina Kopečková FN Motol, Praha Klinická hodnocení LP Nedílnou součásti vývoje léčiva Navazují na preklinický výzkum Pacienti jsou subjekty hodnocení V
ŽIVOTNÍ CYKLUS LÉKŮ KLINICKÉ HODNOCENÍ STUDIE Kateřina Kopečková FN Motol, Praha Klinická hodnocení LP Nedílnou součásti vývoje léčiva Navazují na preklinický výzkum Pacienti jsou subjekty hodnocení V
POOPERAČNÍ ANALGEZIE MORPHINEM NEGATIVNĚ OVLIVŇUJE MINIMÁLNÍ REZIDUÁLNÍ CHOROBU A PŘEŽÍVÁNÍ PACIENTŮ PO RADIKÁLNÍ RESEKCI KOLOREKTÁLNÍHO KARCINOMU
 POOPERAČNÍ ANALGEZIE MORPHINEM NEGATIVNĚ OVLIVŇUJE MINIMÁLNÍ REZIDUÁLNÍ CHOROBU A PŘEŽÍVÁNÍ PACIENTŮ PO RADIKÁLNÍ RESEKCI KOLOREKTÁLNÍHO KARCINOMU RETROSPEKTIVNÍ STUDIE Petr Prášil 1, Emil Berta 2,3 1
POOPERAČNÍ ANALGEZIE MORPHINEM NEGATIVNĚ OVLIVŇUJE MINIMÁLNÍ REZIDUÁLNÍ CHOROBU A PŘEŽÍVÁNÍ PACIENTŮ PO RADIKÁLNÍ RESEKCI KOLOREKTÁLNÍHO KARCINOMU RETROSPEKTIVNÍ STUDIE Petr Prášil 1, Emil Berta 2,3 1
5. ZHOUBNÝ NOVOTVAR KOLOREKTA (C18-20)
 5. ZHOUBNÝ NOVOTVAR KOLOREKTA (C18-20) 5.1 Stadium 0 (Tis, N0, M0) chirurgie: lokální excize polypektomie do zdravé tkáně adjuvantní chemoterapie: není indikována 5.2 Stadium I (T1-2, N0, M0, Dukes A)
5. ZHOUBNÝ NOVOTVAR KOLOREKTA (C18-20) 5.1 Stadium 0 (Tis, N0, M0) chirurgie: lokální excize polypektomie do zdravé tkáně adjuvantní chemoterapie: není indikována 5.2 Stadium I (T1-2, N0, M0, Dukes A)
Radioterapie po radikální prostatektomii
 Radioterapie po radikální prostatektomii Štěpán Veselý Urologická klinika UK 2. LF a FN Motol, Praha ART po RRP - ART (aplikace u high-risk do 90 dnů po operaci) high-risk: - pozitivní chirurgické okraje
Radioterapie po radikální prostatektomii Štěpán Veselý Urologická klinika UK 2. LF a FN Motol, Praha ART po RRP - ART (aplikace u high-risk do 90 dnů po operaci) high-risk: - pozitivní chirurgické okraje
Úloha laboratorní medicíny v komplexní léčbě nádorových onemocnění. Bohuslav Melichar Onkologická klinika LF UP a FN Olomouc
 Úloha laboratorní medicíny v komplexní léčbě nádorových onemocnění Bohuslav Melichar Onkologická klinika LF UP a FN Olomouc Léčba nádorových onemocnění je multidisciplinárním problémem Základem léčby je
Úloha laboratorní medicíny v komplexní léčbě nádorových onemocnění Bohuslav Melichar Onkologická klinika LF UP a FN Olomouc Léčba nádorových onemocnění je multidisciplinárním problémem Základem léčby je
Přínos farmakokinetického monitorování pro optimalizaci biologické léčby ISZ. T. Vaňásek (Hradec Králové)
 Přínos farmakokinetického monitorování pro optimalizaci biologické léčby ISZ T. Vaňásek (Hradec Králové) Farmakokinetické monitorování BL Biologická léčba Cílená modifikace imunitní reakce spojené s patogenezí
Přínos farmakokinetického monitorování pro optimalizaci biologické léčby ISZ T. Vaňásek (Hradec Králové) Farmakokinetické monitorování BL Biologická léčba Cílená modifikace imunitní reakce spojené s patogenezí
Chirurgické možnosti řešení rhabdomyosarkomu pánve u mladé pacientky v rámci multimodálního přístupu
 Chirurgické možnosti řešení rhabdomyosarkomu pánve u mladé pacientky v rámci multimodálního přístupu Macík D. 1, Doležel J. 1, Múdry P. 2, Zerhau P. 3, Staník M. 1, Čapák I. 1 1 ODDĚLENÍ UROLOGICKÉ ONKOLOGIE,
Chirurgické možnosti řešení rhabdomyosarkomu pánve u mladé pacientky v rámci multimodálního přístupu Macík D. 1, Doležel J. 1, Múdry P. 2, Zerhau P. 3, Staník M. 1, Čapák I. 1 1 ODDĚLENÍ UROLOGICKÉ ONKOLOGIE,
Nano World Cancer Day 2014
 31. ledna 2014 Celoevropská akce ETPN pořádaná současně ve 13 členských zemích Evropské unie Rakousko (Štýrský Hradec), Česká republika (Praha), Finsko (Helsinky), Francie (Paříž), Německo (Erlangen),
31. ledna 2014 Celoevropská akce ETPN pořádaná současně ve 13 členských zemích Evropské unie Rakousko (Štýrský Hradec), Česká republika (Praha), Finsko (Helsinky), Francie (Paříž), Německo (Erlangen),
Obsah. Autoři. Předmluva. Introduction. Úvod. 1. Patogeneze a biologie metastatického procesu (Aleš Rejthar) 1.1. Typy nádorového růstu
 Obsah Autoři Předmluva Introduction Úvod 1. Patogeneze a biologie metastatického procesu (Aleš Rejthar) 1.1. Typy nádorového růstu 1.2. Šíření maligních nádorů 1.3. Souhrn 1.4. Summary 2. Obecné klinické
Obsah Autoři Předmluva Introduction Úvod 1. Patogeneze a biologie metastatického procesu (Aleš Rejthar) 1.1. Typy nádorového růstu 1.2. Šíření maligních nádorů 1.3. Souhrn 1.4. Summary 2. Obecné klinické
Vliv způsobu podání bortezomibu na účinnost a bezpečnost léčby pacientů s mnohočetným myelomem. MUDr. P. Pavlíček FN KV a 3.
 Vliv způsobu podání bortezomibu na účinnost a bezpečnost léčby pacientů s mnohočetným myelomem MUDr. P. Pavlíček FN KV a 3. LF UK Praha Tato prezentace vznikla s finanční podporou společnosti Johnson &
Vliv způsobu podání bortezomibu na účinnost a bezpečnost léčby pacientů s mnohočetným myelomem MUDr. P. Pavlíček FN KV a 3. LF UK Praha Tato prezentace vznikla s finanční podporou společnosti Johnson &
The Cost Study of First- line Treatment of Metastatic Colorectal Carcinoma with Bevacizumab- containing Regimen in the Czech Republic
 PŮVODNÍ PRÁCE Analýza nákladů na 1. linii léčby metastatického kolorektálního karcinomu při podání režimů s bevacizumabem data z reálné klinické praxe v České republice The Cost Study of First- line Treatment
PŮVODNÍ PRÁCE Analýza nákladů na 1. linii léčby metastatického kolorektálního karcinomu při podání režimů s bevacizumabem data z reálné klinické praxe v České republice The Cost Study of First- line Treatment
Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky
 Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky Prof. MUDr. Jitka Abrahámová, DrSc Onkologická klinika TN a 1. LF UK KOC (NNB + VFN + TN) St Gallén 2011 Rozsah onemocnění T, N, M ER, PgR
Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky Prof. MUDr. Jitka Abrahámová, DrSc Onkologická klinika TN a 1. LF UK KOC (NNB + VFN + TN) St Gallén 2011 Rozsah onemocnění T, N, M ER, PgR
Nové chemoterapeutické režimy u karcinomu prsu. Miloš Holánek, Ji í Vysko il KKOP, MOÚ Brno
 Nové chemoterapeutické režimy u karcinomu prsu Miloš Holánek, Jií Vyskoil KKOP, MOÚ Brno Úvod Terapeutické modality u karcinomu prsu: - chirurgická léba -hormonoterapie -radioterapie - chemoterapie - cílená
Nové chemoterapeutické režimy u karcinomu prsu Miloš Holánek, Jií Vyskoil KKOP, MOÚ Brno Úvod Terapeutické modality u karcinomu prsu: - chirurgická léba -hormonoterapie -radioterapie - chemoterapie - cílená
Role kombinace cílené léãby a chemoterapie v léãbû metastatického kolorektálního karcinomu
 Role kombinace cílené léãby a chemoterapie v léãbû metastatického kolorektálního karcinomu Prof. MUDr. Bohuslav Melichar, Ph.D. / Onkologická klinika Lékafiské fakulty Univerzity Palackého a Fakultní nemocnice,
Role kombinace cílené léãby a chemoterapie v léãbû metastatického kolorektálního karcinomu Prof. MUDr. Bohuslav Melichar, Ph.D. / Onkologická klinika Lékafiské fakulty Univerzity Palackého a Fakultní nemocnice,
STIVARGA (REGORAFENIB)
 NÁDORY TLUSTÉHO STŘEVA A REKTA 31 STIVARGA (REGORAFENIB) Kolektiv autorů Úvod Regorafenib (Stivarga ) je nový perorální multikinázový inhibitor, který byl v roce 2013 registrován pro léčbu dospělých pacientů
NÁDORY TLUSTÉHO STŘEVA A REKTA 31 STIVARGA (REGORAFENIB) Kolektiv autorů Úvod Regorafenib (Stivarga ) je nový perorální multikinázový inhibitor, který byl v roce 2013 registrován pro léčbu dospělých pacientů
Avastin v léčbě karcinomu prsu
 PŘEHLED Avastin v léčbě karcinomu prsu Avastin in the Treatment of Breast Cancer Petráková K. Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno Souhrn Pacientky s metastatickým karcinomem
PŘEHLED Avastin v léčbě karcinomu prsu Avastin in the Treatment of Breast Cancer Petráková K. Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno Souhrn Pacientky s metastatickým karcinomem
Léčba endokrinních nádorů-máme co nabídnout?
 Léčba endokrinních nádorů-máme co nabídnout? MUDr. Eugen Kubala Klinika Radioterapie a Onkologie Fakultní nemocnice Hradec Králové Sokolská 581, 500 05 Hradec Králové Co jsou neuroendokrinní tumory? Heterogenní
Léčba endokrinních nádorů-máme co nabídnout? MUDr. Eugen Kubala Klinika Radioterapie a Onkologie Fakultní nemocnice Hradec Králové Sokolská 581, 500 05 Hradec Králové Co jsou neuroendokrinní tumory? Heterogenní
DVĚ STUDIE UKAZUJÍ VÝRAZNĚ PŘÍZNIVÉ VÝSLEDKY CHEMOTERAPIE ZALOŽENÉ NA Eloxatinu V KOMBINACI S BEVACIZUMABEM U POKROČILÉHO KOLOREKTÁLNÍHO KARCINOMU
 DVĚ STUDIE UKAZUJÍ VÝRAZNĚ PŘÍZNIVÉ VÝSLEDKY CHEMOTERAPIE ZALOŽENÉ NA Eloxatinu V KOMBINACI S BEVACIZUMABEM U POKROČILÉHO KOLOREKTÁLNÍHO KARCINOMU Pozitivní výsledky studií TREE-2 a ECOG 3200 oznámeny
DVĚ STUDIE UKAZUJÍ VÝRAZNĚ PŘÍZNIVÉ VÝSLEDKY CHEMOTERAPIE ZALOŽENÉ NA Eloxatinu V KOMBINACI S BEVACIZUMABEM U POKROČILÉHO KOLOREKTÁLNÍHO KARCINOMU Pozitivní výsledky studií TREE-2 a ECOG 3200 oznámeny
SYSTÉMOVÁ LÉČBA NÁDORŮ MOČOVÉHO MĚCHÝŘE
 SYSTÉMOVÁ LÉČBA NÁDORŮ MOČOVÉHO MĚCHÝŘE Jana Katolická FN u svaté Anny, Brno CZ/ONCO/617/0088 1 UROTELIÁLNÍ KARCINOM MOČOVÉHO MĚCHÝŘE CHEMOSENZITIVNÍ ONEMOCNĚNÍ. V době stanovení diagnózy je 15 % lokálně
SYSTÉMOVÁ LÉČBA NÁDORŮ MOČOVÉHO MĚCHÝŘE Jana Katolická FN u svaté Anny, Brno CZ/ONCO/617/0088 1 UROTELIÁLNÍ KARCINOM MOČOVÉHO MĚCHÝŘE CHEMOSENZITIVNÍ ONEMOCNĚNÍ. V době stanovení diagnózy je 15 % lokálně
Lékařská sekce... 3 Středa 22. 1. 2014... 3 17:00 18:30 Aktuálně z kongresu ASCO GIT 2014 HOT NEWS... 3 Čtvrtek 23. 1. 2014... 3 08:30 Slavnostní
 Lékařská sekce... 3 Středa 22. 1. 2014... 3 17:00 18:30 Aktuálně z kongresu ASCO GIT 2014 HOT NEWS... 3 Čtvrtek 23. 1. 2014... 3 08:30 Slavnostní zahájení... 3 09:00 10:30 State of Art v onkologii... 3
Lékařská sekce... 3 Středa 22. 1. 2014... 3 17:00 18:30 Aktuálně z kongresu ASCO GIT 2014 HOT NEWS... 3 Čtvrtek 23. 1. 2014... 3 08:30 Slavnostní zahájení... 3 09:00 10:30 State of Art v onkologii... 3
4. ZHOUBNÝ NOVOTVAR KOLOREKTA (C18-20)
 4. ZHOUBNÝ NOVOTVAR KOLOREKTA (C18-20) 4.1 Stadium 0 (Tis, N0, M0) chirurgie: lokální excize polypektomie do zdravé tkáně adjuvantní chemoterapie: není indikována 4.2 Stadium I (T1-2, N0, M0, Dukes A)
4. ZHOUBNÝ NOVOTVAR KOLOREKTA (C18-20) 4.1 Stadium 0 (Tis, N0, M0) chirurgie: lokální excize polypektomie do zdravé tkáně adjuvantní chemoterapie: není indikována 4.2 Stadium I (T1-2, N0, M0, Dukes A)
Časné fáze klinických studií
 Časné fáze klinických studií Mikulov, 13.4.2012 Regina Demlová, FÚ LF MU a MOÚ Stávající situace v klinickém výzkumu Počet nových látek v klinickém výzkumu (NMEs) v posledních 15-20-ti letech narůstá Počet
Časné fáze klinických studií Mikulov, 13.4.2012 Regina Demlová, FÚ LF MU a MOÚ Stávající situace v klinickém výzkumu Počet nových látek v klinickém výzkumu (NMEs) v posledních 15-20-ti letech narůstá Počet
Skalický Tomáš,Třeška V.,Liška V., Fichtl J., Brůha J. CHK LFUK a FN Plzeň Loket 2015
 Skalický Tomáš,Třeška V.,Liška V., Fichtl J., Brůha J. CHK LFUK a FN Plzeň Loket 2015 Kdy můžeme resekovat jaterní metastázy KRCa? 1. synchronně s primárním karcinomem 2. po resekci primárního karcinomu
Skalický Tomáš,Třeška V.,Liška V., Fichtl J., Brůha J. CHK LFUK a FN Plzeň Loket 2015 Kdy můžeme resekovat jaterní metastázy KRCa? 1. synchronně s primárním karcinomem 2. po resekci primárního karcinomu
Léčba DLBCL s nízkým rizikem
 Léčba DLBCL s nízkým rizikem Jan Hudeček Klinika hematológie a transfuziológie JLF UK a UNM, Martin Lymfómové fórum 2014 Bratislava, 21. 23. 3. 2014 Difuzní velkobuněčný B-lymfom (DLBCL) heterogenní skupina
Léčba DLBCL s nízkým rizikem Jan Hudeček Klinika hematológie a transfuziológie JLF UK a UNM, Martin Lymfómové fórum 2014 Bratislava, 21. 23. 3. 2014 Difuzní velkobuněčný B-lymfom (DLBCL) heterogenní skupina
Možnosti léčby CRPC s časem přibývají
 Možnosti léčby CRPC s časem přibývají Jana Katolická Onkologicko-chirurgické oddělení Fakultní nemocnice u Sv. Anny Mnoho studií - jen čtyři nové léky Enzalutamid Abirateron + prednison Cabazitaxel Radium-223
Možnosti léčby CRPC s časem přibývají Jana Katolická Onkologicko-chirurgické oddělení Fakultní nemocnice u Sv. Anny Mnoho studií - jen čtyři nové léky Enzalutamid Abirateron + prednison Cabazitaxel Radium-223
M. Babjuk Urologická klinika 2.LF UK a FN Motol
 Operační léčba jako součást multimodálního přístupu k léčbě vysocerizikového karcinomu prostaty M. Babjuk Urologická klinika 2.LF UK a FN Motol Synopse Definice Výsledky a místo operační léčby Kombinace
Operační léčba jako součást multimodálního přístupu k léčbě vysocerizikového karcinomu prostaty M. Babjuk Urologická klinika 2.LF UK a FN Motol Synopse Definice Výsledky a místo operační léčby Kombinace
Klinická dozimetrie v NM 131. I-MIBG terapie neuroblastomu
 Klinická dozimetrie v NM 131 I-MIBG terapie neuroblastomu Prchalová D., Solný P., Kráčmerová T. Klinika nukleární medicíny a endokrinologie 2. LF UK a FN Motol 7. Konference radiologické fyziky Harrachov,
Klinická dozimetrie v NM 131 I-MIBG terapie neuroblastomu Prchalová D., Solný P., Kráčmerová T. Klinika nukleární medicíny a endokrinologie 2. LF UK a FN Motol 7. Konference radiologické fyziky Harrachov,
STUDIE 2014 KLINIKA ONKOLOGIE A RADIOTERAPIE AKTIVNÍ NÁBOR PACIENTŮ
 STUDIE 2014 KLINIKA ONKOLOGIE A RADIOTERAPIE AKTIVNÍ NÁBOR PACIENTŮ KARCINOM PRSU Spoluzkoušející: MUDr.Iva Slánská, MUDr.Peter Priester,MUDr.Adam Paulík Název studie : PH3-01 Studie Present Prevence recidivy
STUDIE 2014 KLINIKA ONKOLOGIE A RADIOTERAPIE AKTIVNÍ NÁBOR PACIENTŮ KARCINOM PRSU Spoluzkoušející: MUDr.Iva Slánská, MUDr.Peter Priester,MUDr.Adam Paulík Název studie : PH3-01 Studie Present Prevence recidivy
ProGastrin-Releasing Peptide (ProGRP) u nemocných s malobuněčným karcinomem plic
 ProGastrin-Releasing Peptide (ProGRP) u nemocných s malobuněčným karcinomem plic FONS Symposium klinické biochemie Pardubice, 23.9. 25.9.202 M. Tomíšková, J. Skřičková, I. Klabenešová, M. Dastych 2 Klinika
ProGastrin-Releasing Peptide (ProGRP) u nemocných s malobuněčným karcinomem plic FONS Symposium klinické biochemie Pardubice, 23.9. 25.9.202 M. Tomíšková, J. Skřičková, I. Klabenešová, M. Dastych 2 Klinika
Parenterální výživa v paliativní onkologické péči. Eva Meisnerová
 Parenterální výživa v paliativní onkologické péči Eva Meisnerová Výživa v paliativní onkologické péči Většina pacientů s pokročilým nádorovým onemocněním - má poruchy příjmu potravy a malnutrici Fakt nedostatečného
Parenterální výživa v paliativní onkologické péči Eva Meisnerová Výživa v paliativní onkologické péči Většina pacientů s pokročilým nádorovým onemocněním - má poruchy příjmu potravy a malnutrici Fakt nedostatečného
ANALÝZA VÝSLEDKŮ LÉČBY HERCEPTINEM
 ANALÝZA VÝSLEDKŮ LÉČBY HERCEPTINEM Statistická analýza dat k 30. 4. 2006 AUTOŘI: R. Vyzula, D. Némethová, O. Coufal I. ZÁKLADNÍ POPIS SOUBORU I.1. Počet pacientek v jednotlivých centrech Celkový počet
ANALÝZA VÝSLEDKŮ LÉČBY HERCEPTINEM Statistická analýza dat k 30. 4. 2006 AUTOŘI: R. Vyzula, D. Némethová, O. Coufal I. ZÁKLADNÍ POPIS SOUBORU I.1. Počet pacientek v jednotlivých centrech Celkový počet
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu
 Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Interaktivní nástroje pro výuku léčebných standardů cytostatické léčby zhoubných nádorů Portál DIOS
 Interaktivní nástroje pro výuku léčebných standardů cytostatické léčby zhoubných nádorů Portál DIOS Klimeš D., Dušek L., Kubásek J., Fínek J., Petruželka L., Zoláková A., Vyzula R. Historie projektu Snaha
Interaktivní nástroje pro výuku léčebných standardů cytostatické léčby zhoubných nádorů Portál DIOS Klimeš D., Dušek L., Kubásek J., Fínek J., Petruželka L., Zoláková A., Vyzula R. Historie projektu Snaha
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Nově diagnostikovaný nádor vaječníků: kasuistika
 Nově diagnostikovaný nádor vaječníků: kasuistika Nicoletta Colombo University of Milan-Bicocca European Institute of Oncology Milan, Italy Upozornění Informace uvedené v této prezentaci mohou odkazovat
Nově diagnostikovaný nádor vaječníků: kasuistika Nicoletta Colombo University of Milan-Bicocca European Institute of Oncology Milan, Italy Upozornění Informace uvedené v této prezentaci mohou odkazovat
CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT IKARUS. Neintervenční epidemiologická studie
 CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT Neintervenční epidemiologická studie PROTOKOL PROJEKTU Verze: 4.0 Datum: 26.09.2006 Strana 2 PROTOKOL PROJEKTU
CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT Neintervenční epidemiologická studie PROTOKOL PROJEKTU Verze: 4.0 Datum: 26.09.2006 Strana 2 PROTOKOL PROJEKTU
Grantové projekty řešené OT v současnosti
 Grantové projekty řešené OT v současnosti Grantové projekty řešené OT v současnosti GAČR č. P303/12/G163: Centrum interakcí potravních doplňků s léčivy a nutrigenetiky Doc. Doba řešení: 2012-2018 Potravní
Grantové projekty řešené OT v současnosti Grantové projekty řešené OT v současnosti GAČR č. P303/12/G163: Centrum interakcí potravních doplňků s léčivy a nutrigenetiky Doc. Doba řešení: 2012-2018 Potravní
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Avastin 25 mg/ml koncentrát pro přípravu infuzního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 25 mg bevacizumabu. Jedna injekční
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Avastin 25 mg/ml koncentrát pro přípravu infuzního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 25 mg bevacizumabu. Jedna injekční
Analýza dat z klinického registru RenIS České onkologické společnosti ČLS JEP shrnutí výsledků pro elektronický report
 Účinnost a bezpečnost přípravku Afinitor (everolimus) v léčbě pacientů s pokročilým karcinomem ledviny v podmínkách reálné klinické praxe v České republice Analýza dat z klinického registru RenIS České
Účinnost a bezpečnost přípravku Afinitor (everolimus) v léčbě pacientů s pokročilým karcinomem ledviny v podmínkách reálné klinické praxe v České republice Analýza dat z klinického registru RenIS České
IMUNOTERAPIE NÁDORŮ MOČOVÉHO MĚCHÝŘE. Michaela Matoušková
 IMUNOTERAPIE NÁDORŮ MOČOVÉHO MĚCHÝŘE Michaela Matoušková IMUNOTERAPIE ZN Z UROTELU lokalizovaná onemocnění - BCG VAKCÍNA pokročilá onemocnění BCG VAKCÍNA po instilaci vazba BCG k fibronektinu produkovanému
IMUNOTERAPIE NÁDORŮ MOČOVÉHO MĚCHÝŘE Michaela Matoušková IMUNOTERAPIE ZN Z UROTELU lokalizovaná onemocnění - BCG VAKCÍNA pokročilá onemocnění BCG VAKCÍNA po instilaci vazba BCG k fibronektinu produkovanému
2. pražské mezioborové onkologické kolokvium Prague ONCO 2011
 Záštitu nad kolokviem převzaly: Evropská onkologická společnost Ministerstvo školství, mládeže a tělovýchovy ČR Ministerstvo zdravotnictví ČR Česká onkologická společnost Česká urologická společnost Česká
Záštitu nad kolokviem převzaly: Evropská onkologická společnost Ministerstvo školství, mládeže a tělovýchovy ČR Ministerstvo zdravotnictví ČR Česká onkologická společnost Česká urologická společnost Česká
Národní onkologické centrum V. A. Fanardžyana
 Národní onkologické centrum V. A. Fanardžyana Klinické studie provedené v Národním onkologickém centru, s nádorovým onemocněním mléčné žlázy, konečníku, střeva, plic a děložního čípku. STANDARDNÍ CHEMOTERAPIE,
Národní onkologické centrum V. A. Fanardžyana Klinické studie provedené v Národním onkologickém centru, s nádorovým onemocněním mléčné žlázy, konečníku, střeva, plic a děložního čípku. STANDARDNÍ CHEMOTERAPIE,
LÉKAŘSKÁ VYŠETŘENÍ A LABORATORNÍ TESTY
 LÉKAŘSKÁ VYŠETŘENÍ A LABORATORNÍ TESTY Pokud čtete tento text, pravděpodobně jste v kontaktu s odborníkem na léčbu mnohočetného myelomu. Diagnóza mnohočetného myelomu je stanovena pomocí četných laboratorních
LÉKAŘSKÁ VYŠETŘENÍ A LABORATORNÍ TESTY Pokud čtete tento text, pravděpodobně jste v kontaktu s odborníkem na léčbu mnohočetného myelomu. Diagnóza mnohočetného myelomu je stanovena pomocí četných laboratorních
Pomalidomid první rok léčby v ČR
 C Z E C H G R O U P CZECH GROUP 1 Pomalidomid první rok léčby v ČR Luděk Pour IHOK FN Brno XIII. Výroční setkání CMG 10. 4. 2015 Mikulov C M G M Y E L O M A Č E S K Á M YE LO M O VÁ S K U P IN A CMG ČESKÁ
C Z E C H G R O U P CZECH GROUP 1 Pomalidomid první rok léčby v ČR Luděk Pour IHOK FN Brno XIII. Výroční setkání CMG 10. 4. 2015 Mikulov C M G M Y E L O M A Č E S K Á M YE LO M O VÁ S K U P IN A CMG ČESKÁ
Nové léčebné možnosti v terapii metastazujícího karcinomu žaludku
 Nové léčebné možnosti v terapii metastazujícího karcinomu žaludku Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1. LF UK a TN KOC (NNB+VFN+TN) Žaludek pravidla klasifikace Klasifikace se používá
Nové léčebné možnosti v terapii metastazujícího karcinomu žaludku Prof. MUDr. Jitka Abrahámová, DrSc. Onkologická klinika 1. LF UK a TN KOC (NNB+VFN+TN) Žaludek pravidla klasifikace Klasifikace se používá
The Role of Chemotherapy and Targeted antivegfand antiegfr-therapy in Metastatic Colorectal Cancer: a Case Report of Long-Term and Intensive Response
 KAZUISTIKA Použití chemoterapie v kombinaci s cílenou biologickou léčbou u diseminovaného kolorektálního karcinomu: kazuistika dlouhodobé a výrazné klinické odpovědi The Role of Chemotherapy and Targeted
KAZUISTIKA Použití chemoterapie v kombinaci s cílenou biologickou léčbou u diseminovaného kolorektálního karcinomu: kazuistika dlouhodobé a výrazné klinické odpovědi The Role of Chemotherapy and Targeted
Protokol pro léčbu kožního maligního melanomu
 1 Klinika onkologie a radioterapie FN Hradec Králové Platnost od: 2.1.2013 Dokument: standardní léčebný postup - verze 2013 Počet stran: 5 Přílohy: nejsou Protokol pro léčbu kožního maligního melanomu
1 Klinika onkologie a radioterapie FN Hradec Králové Platnost od: 2.1.2013 Dokument: standardní léčebný postup - verze 2013 Počet stran: 5 Přílohy: nejsou Protokol pro léčbu kožního maligního melanomu
Nové možnosti. terapeutického ovlivnění pokročilého karcinomu prostaty. Mám nádor prostaty a co dál? Jana Katolická
 MEZINÁRODNÍ CENTRUM KLINICKÉHO VÝZKUMU Nové možnosti TVOŘÍME BUDOUCNOST MEDICÍNY terapeutického ovlivnění pokročilého karcinomu prostaty Jana Katolická Primář onkologicko-chirurgické oddělení Mám nádor
MEZINÁRODNÍ CENTRUM KLINICKÉHO VÝZKUMU Nové možnosti TVOŘÍME BUDOUCNOST MEDICÍNY terapeutického ovlivnění pokročilého karcinomu prostaty Jana Katolická Primář onkologicko-chirurgické oddělení Mám nádor
Současné postavení anti VEGF protilátek v léčbě nádorových onemocnění
 Současné postavení anti VEGF protilátek v léčbě nádorových onemocnění Kurdějov, 29.4.2014 MUDr. Jitka Růžičková Roche Pharma Metastatická nádorová onemocnění: Stanovení prognózy není vždy snadné 2 Cílená
Současné postavení anti VEGF protilátek v léčbě nádorových onemocnění Kurdějov, 29.4.2014 MUDr. Jitka Růžičková Roche Pharma Metastatická nádorová onemocnění: Stanovení prognózy není vždy snadné 2 Cílená
RENIS - Votrient. Klinický registr pacientů s renálním karcinomem. Stav registru k datu 26. 3. 2012
 RENIS - Votrient Klinický registr pacientů s renálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr. Zbyněk
RENIS - Votrient Klinický registr pacientů s renálním karcinomem Stav registru k datu 26. 3. 2012 Management projektu: Analýza dat: Technické zajištění: Mgr. Karel Hejduk, Ing. Petr Brabec Mgr. Zbyněk
Onemocnění střev. Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje. PhDr.
 Onemocnění střev Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Říjen 2010 PhDr. Markéta Bednářová Onemocnění střev Dle etiologie dělíme: A. Zánětlivá
Onemocnění střev Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Říjen 2010 PhDr. Markéta Bednářová Onemocnění střev Dle etiologie dělíme: A. Zánětlivá
= lokálně pokročilý CaP + lokalizovaný (ct1, ct2) se špatnými prognostickými faktory ct3a PSA > 20 ng/ml GS > 7
 Léčba vysocerizikového karcinomu prostaty pohled urologa M. Babjuk Urologická klinika 2.LF UK a FN Motol High-risk CaP = lokálně pokročilý CaP + lokalizovaný (ct1, ct2) se špatnými prognostickými faktory
Léčba vysocerizikového karcinomu prostaty pohled urologa M. Babjuk Urologická klinika 2.LF UK a FN Motol High-risk CaP = lokálně pokročilý CaP + lokalizovaný (ct1, ct2) se špatnými prognostickými faktory
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
STRUKTURA REGISTRU CORECT
 Vstupní parametry a diagnostika STRUKTURA REGISTRU CORECT 1. Vstupní parametry 1. Kód zdravotní pojišťovny (výběr) 1. 111 2. 201 3. 205 4. 207 5. 209 6. 211 7. 213 8. 217 - do 1.10.2012 9. 222 - do 1.10.2009
Vstupní parametry a diagnostika STRUKTURA REGISTRU CORECT 1. Vstupní parametry 1. Kód zdravotní pojišťovny (výběr) 1. 111 2. 201 3. 205 4. 207 5. 209 6. 211 7. 213 8. 217 - do 1.10.2012 9. 222 - do 1.10.2009
Metastatický karcinom prsu Kasuistické sdělení Česlarová K., Erhart D.
 Metastatický karcinom prsu Kasuistické sdělení Česlarová K., Erhart D. Chirurgická klinika 2. LFUK a ÚVN Praha Přednosta plk. prof. MUDr. Ryska M., CSc. Kasuistika č. 1: K.I., r. 1946 Onkologická anamnéza:
Metastatický karcinom prsu Kasuistické sdělení Česlarová K., Erhart D. Chirurgická klinika 2. LFUK a ÚVN Praha Přednosta plk. prof. MUDr. Ryska M., CSc. Kasuistika č. 1: K.I., r. 1946 Onkologická anamnéza:
Antiangiogenní léčba metastatického kolorektálního karcinomu analýza dat z dvou center
 202 Antiangiogenní léčba metastatického kolorektálního karcinomu analýza dat z dvou center Radka Obermannová 1, Tomáš Büchler 2, Michal Štícha 3, Jiří Navrátil 1, Lenka Slamová 1, Jana Kaňáková 2, Jitka
202 Antiangiogenní léčba metastatického kolorektálního karcinomu analýza dat z dvou center Radka Obermannová 1, Tomáš Büchler 2, Michal Štícha 3, Jiří Navrátil 1, Lenka Slamová 1, Jana Kaňáková 2, Jitka
Mikromorfologická diagnostika bronchogenního karcinomu z pohledu pneumologické cytodiagnostiky
 Mikromorfologická diagnostika bronchogenního karcinomu z pohledu pneumologické cytodiagnostiky P. Žáčková Pneumologická klinika 1. LFUK Thomayerova nemocnice Úvod a definice Každá buňka obsahuje informace
Mikromorfologická diagnostika bronchogenního karcinomu z pohledu pneumologické cytodiagnostiky P. Žáčková Pneumologická klinika 1. LFUK Thomayerova nemocnice Úvod a definice Každá buňka obsahuje informace
Co nás učí nádory? Prof. RNDr. Jana Šmardová, CSc. Ústav patologie FN Brno Přírodovědecká a Lékařská fakulta MU Brno
 Co nás učí nádory? Prof. RNDr. Jana Šmardová, CSc. Ústav patologie FN Brno Přírodovědecká a Lékařská fakulta MU Brno Brno, 17.5.2011 Izidor (Easy Door) Osnova přednášky 1. Proč nás rakovina tolik zajímá?
Co nás učí nádory? Prof. RNDr. Jana Šmardová, CSc. Ústav patologie FN Brno Přírodovědecká a Lékařská fakulta MU Brno Brno, 17.5.2011 Izidor (Easy Door) Osnova přednášky 1. Proč nás rakovina tolik zajímá?
ČETNOST METASTÁZ V PÁTEŘI PODLE LOKALIZACE
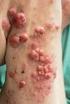 1 ČETNOST METASTÁZ V PÁTEŘI PODLE LOKALIZACE C 15% Th 70% L a S 15% 2 POKROKY V LÉČBĚ PÁTEŘNÍCH METASTÁZ Meta ca tlustého střeva v těle L3 a L4 3 POKROKY V LÉČBĚ PÁTEŘNÍCH METASTÁZ Exstirpace metastázy
1 ČETNOST METASTÁZ V PÁTEŘI PODLE LOKALIZACE C 15% Th 70% L a S 15% 2 POKROKY V LÉČBĚ PÁTEŘNÍCH METASTÁZ Meta ca tlustého střeva v těle L3 a L4 3 POKROKY V LÉČBĚ PÁTEŘNÍCH METASTÁZ Exstirpace metastázy
Terapie hairy-cell leukémie
 Terapie hairy-cell leukémie David Belada, II.interní klinika, OKH FN a LF v Hradci Králové Lymfomové fórum 2010 Grand Hotel Bellevue, Vysoké Tatry 12.-14.3.2010 Úvod Poprvé popsána v roce 1958 (Bouroncle
Terapie hairy-cell leukémie David Belada, II.interní klinika, OKH FN a LF v Hradci Králové Lymfomové fórum 2010 Grand Hotel Bellevue, Vysoké Tatry 12.-14.3.2010 Úvod Poprvé popsána v roce 1958 (Bouroncle
Druhá anonce. 3. pražské mezioborové onkologické kolokvium. 1. LF UK pořádá ve spolupráci s 2. a 3. LF UK
 Druhá anonce 1. LF UK pořádá ve spolupráci s 2. a 3. LF UK 3. pražské mezioborové onkologické kolokvium Lékaři a sestry společně proti zhoubným nádorům 26. 27. leden 2012 Clarion Congress Hotel Prague****
Druhá anonce 1. LF UK pořádá ve spolupráci s 2. a 3. LF UK 3. pražské mezioborové onkologické kolokvium Lékaři a sestry společně proti zhoubným nádorům 26. 27. leden 2012 Clarion Congress Hotel Prague****
RMG = nutná součást dalšího zlepšování péče o pacienty s MM
 RMG = nutná součást dalšího zlepšování péče o pacienty s MM V. Maisnar za Českou myelomovou skupinu Epidemiologická data MM (dle NOR) 1% všech malignit, 10% hematologických Muži/Ženy = 3/2, medián věku:
RMG = nutná součást dalšího zlepšování péče o pacienty s MM V. Maisnar za Českou myelomovou skupinu Epidemiologická data MM (dle NOR) 1% všech malignit, 10% hematologických Muži/Ženy = 3/2, medián věku:
1. EPIDEMIOLOGIE ZHOUBNÉHO NOVOTVARU MOČOVÉHO MĚCHÝŘE (C67) V ČESKÉ REPUBLICE - AKTUÁLNÍ STAV 12
 OBSAH KARCINOM MOČOVĚHO MĚCHÝŘE I 1. EPIDEMIOLOGIE ZHOUBNÉHO NOVOTVARU MOČOVÉHO MĚCHÝŘE (C67) V ČESKÉ REPUBLICE - AKTUÁLNÍ STAV 12 2. DIAGNOSTIKA A SLEDOVÁNI PACIENTŮ S TUMORY MĚCHÝŘE SYSTÉMEM EVIS EXERA
OBSAH KARCINOM MOČOVĚHO MĚCHÝŘE I 1. EPIDEMIOLOGIE ZHOUBNÉHO NOVOTVARU MOČOVÉHO MĚCHÝŘE (C67) V ČESKÉ REPUBLICE - AKTUÁLNÍ STAV 12 2. DIAGNOSTIKA A SLEDOVÁNI PACIENTŮ S TUMORY MĚCHÝŘE SYSTÉMEM EVIS EXERA
Patologie a klasifikace karcinomu prostaty, Gleasonův systém. MUDr. Marek Grega. Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole
 Patologie a klasifikace karcinomu prostaty, Gleasonův systém MUDr. Marek Grega Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole Nádory prostaty v z každé buňky, která vytváří komplexní uspořádání
Patologie a klasifikace karcinomu prostaty, Gleasonův systém MUDr. Marek Grega Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole Nádory prostaty v z každé buňky, která vytváří komplexní uspořádání
9. ZHOUBNÝ NOVOTVAR OVARIÍ A TUBY (C56-57)
 9. ZHOUBNÝ NOVOTVAR OVARIÍ A TUBY (C56-57) 9.1 Epiteliální 9.1.1 Chemoterapie jako součást primární léčby Po chirurgické léčbě epiteliálních ovariálních ZN nutno považovat primární chemoterapii za kurativní.
9. ZHOUBNÝ NOVOTVAR OVARIÍ A TUBY (C56-57) 9.1 Epiteliální 9.1.1 Chemoterapie jako součást primární léčby Po chirurgické léčbě epiteliálních ovariálních ZN nutno považovat primární chemoterapii za kurativní.
Elecsys SCC první zkušenosti z rutinní praxe. Ing. Pavla Eliášová Oddělení klinické biochemie Masarykova nemocnice v Ústí nad Labem
 Elecsys SCC první zkušenosti z rutinní praxe Ing. Pavla Eliášová Oddělení klinické biochemie Masarykova nemocnice v Ústí nad Labem Antigen SCC Glykoprotein s molekulovou hmotností 42 kd dva základní typy
Elecsys SCC první zkušenosti z rutinní praxe Ing. Pavla Eliášová Oddělení klinické biochemie Masarykova nemocnice v Ústí nad Labem Antigen SCC Glykoprotein s molekulovou hmotností 42 kd dva základní typy
Časná a pozdní toxicita léčby lymfomů. David Belada FN a LF UK v Hradci Králové
 Časná a pozdní toxicita léčby lymfomů David Belada FN a LF UK v Hradci Králové Co je to toxicita léčby? Toxicita léčby lymfomů Jaký je rozdíl mezi časnou a pozdní toxicitou? Dá se toxicita předvídat? Existuje
Časná a pozdní toxicita léčby lymfomů David Belada FN a LF UK v Hradci Králové Co je to toxicita léčby? Toxicita léčby lymfomů Jaký je rozdíl mezi časnou a pozdní toxicitou? Dá se toxicita předvídat? Existuje
Nové možnosti v terapii PCNSL kazuistika
 Nové možnosti v terapii PCNSL kazuistika Vladimíra Vosáhlová Novinky v léčbě lymfomů a CLL Hotel Tereziánský Dvůr, 11. 10. 2018 Anamnéza J.A., muž, 60 let OA: st.p. appendektomii, hypercholesterolemie
Nové možnosti v terapii PCNSL kazuistika Vladimíra Vosáhlová Novinky v léčbě lymfomů a CLL Hotel Tereziánský Dvůr, 11. 10. 2018 Anamnéza J.A., muž, 60 let OA: st.p. appendektomii, hypercholesterolemie
TARCEVA klinický registr
 TARCEVA klinický registr Karcinom pankreatu Stav k datu 10. 4. 2011 Registr Tarceva je podporován výzkumným ý grantem firmy Roche. Česká onkologická společnost Institut biostatistiky a analýz Stav registru
TARCEVA klinický registr Karcinom pankreatu Stav k datu 10. 4. 2011 Registr Tarceva je podporován výzkumným ý grantem firmy Roche. Česká onkologická společnost Institut biostatistiky a analýz Stav registru
Velcade První výsledky z IHOK FN Brno. Luděk Pour. Roman Hájek, Marta Krejčí,Andrea Křivanová, Lenka Zahradová, Zdeněk Adam CMG
 Velcade První výsledky z IHOK FN Brno Luděk Pour Roman Hájek, Marta Krejčí,Andrea Křivanová, Lenka Zahradová, Zdeněk Adam CZECH CMG M Y E L O M A GROUP Č ESKÁ MYELOMOVÁ SKUPINA Velcade = bortezomib Nobelova
Velcade První výsledky z IHOK FN Brno Luděk Pour Roman Hájek, Marta Krejčí,Andrea Křivanová, Lenka Zahradová, Zdeněk Adam CZECH CMG M Y E L O M A GROUP Č ESKÁ MYELOMOVÁ SKUPINA Velcade = bortezomib Nobelova
Staging adenokarcinomu pankreatu
 Staging adenokarcinomu pankreatu Litavcová, A. Radiologická klinika FN Brno a LF MU Brno Přednosta: prof. MUDr. V. Válek, CSc., MBA Epidemiologie patří k malignitám s nejvyšší letalitou Příčinou je biologická
Staging adenokarcinomu pankreatu Litavcová, A. Radiologická klinika FN Brno a LF MU Brno Přednosta: prof. MUDr. V. Válek, CSc., MBA Epidemiologie patří k malignitám s nejvyšší letalitou Příčinou je biologická
