II. termodynamický zákon a entropie
|
|
|
- Kateřina Beranová
- před 8 lety
- Počet zobrazení:
Transkript
1 Přednášk 5 II. termodynmický zákon entropie he lw tht entropy lwys increses holds, I think, the supreme position mong the lws of Nture. If someone points out to you tht your pet theory of the universe is in disgreement with Mxwell s equtions then so much the worse for Mxwell s equtions. If it is found to be contrdicted by observtion well, these experimentlists do bungle things sometimes. But if your theory is found to be ginst the second lw of thermodynmics I cn give you no hope; there is nothing for it but to collpse in deepest humilition. Sir Arthur Stnley Eddington, (1915) 5.1 II. termodynmický zákon Úvodní úvhy I. termodynmický zákon omezuje všechny předstvitelné změny stvu systému jen n ty, při nichž pltí zákon zchování energie. V přírodě všk existuje všk celá řd dějů, při nichž by se energie zchovávl, le přesto se nepozorují. Z prxe víme, že děje v přírodě mjí tendenci probíht jen v jednom směru (nevrtně) k termodynmické rovnováze nikdy ne nopk. Vyjímku tvoří vrtné (kvzisttické) děje, které všk jk víme jsou jen určitou idelizcí velmi pomlu probíhjících (ve srovnání s relxčním čsem soustvy) dějů nevrtných. II. termodynmický zákon vnáší do termodynmiky novou informci o směru tepelné výměny, tedy že teplo smovolně přechází vždy od těles s vyšší teplotou n těleso s 5 57
2 Michl Vrdy Přednášk 5: II. termodynmický zákon entropie nižší teplotou. Směr tepelné výměny je dán novou veličinou, která v I. termodynmickém zákonu vůbec nevystupuje teplotou. Podobně jko I. termodynmický zákon zvádí vnitřní energii, jkožto novou stvovou funkci, II. termodynmický zákon zvádí tké novou stvovou funkci entropii. Ztímco z I. termodynmického zákon vyplývá, že vnitřní energie je v izolovných systémech konstntní, z II. termodynmického zákon vyplývá, že entropie v izolovných systémech nemůže nikdy klest. Určení směru tepelné výměny má zásdní význm pro procesy při nichž se mění práce v teplo teplo v mechnickou práci. Z hledisk termodynmiky jsou dleko důležitější procesy druhé jmenovné, protože se vzthují k principům účinnostem strojů trnsformujících teplo n mechnickou práci, tedy k tk zvným tepelným motorům, které spolu s ledničkmi tepelnými čerpdly ptří k tzv. tepelným strojům. Jk jsme již uvedli, přeměn práce v teplo, tk i přeměn tepl v práci jsou možné prxi probíhjí. Jko příkld prvního procesu můžeme uvést všechny disiptivní procesy při nichž se mění npříkld kinetická energie těles v teplo, třeb v ložiscích nebo v brzdových kotoučích destičkách při brzdění utomobilu. Druhý proces probíhá npříkld v motoru utomobilu, kde se teplo vzniklé spálením pliv trnsformuje v mechnickou práci, která roztáčí klikový hřídel motoru tto rotční kinetická energie pk utomobil pohání. Položme si nyní tři zásdní otázky: 1. Je relizce obou výše uvedené procesů, tedy W Q Q W stejně sndná? 2. Lze přeměnit všechnu mechnickou práci, kterou vykonáme n tělese v teplo, tedy může pltit W = Q? 3. Lze přeměnit veškeré teplo, které dodáme nějkému tělesu v mechnickou práci, tedy může pltit Q = W? Odpověd n první otázku lze vyvodit ze skutečnosti, že ztímco teplo je veličin týkjícící se neuspořádného mikroskopického pohybu částic z nichž je dné těleso složeno, mechnická práce vykonná n tělese může vést k mkroskopickému pohybu celého těles nebo ke změně jeho pohybového stvu. Mikroskopicky to odpovídá společné změně vektorů rychlostí neuspořádného pohybu částic o konstntní hodnotu odpovídjící mkroskopické rychlosti celého těles. V tomto smyslu, práce předstvuje jkousi ušlechtilejší formu energie než teplo můžeme tedy dovodit, že přeměn npříkld kinetické energie těles, tedy energie uspořádného pohybu v chotický pohyb jeho částic (npříkld třením) bude zřejmě snzší než proces obrácený, tedy přeměn tepl jkožto energie neuspořádného pohybu mikroskopických částic v mechnickou práci, tedy v energii uspořádného pohybu mkroskopického těles či těles. Odpovědi n druhou třetí otázku lze dát n zákldě pozorování procesů konverze mezi oběm veličinmi v přírodě v technické prxi. Přípdem přeměny práce (npř. mechnické energie kinetické) v teplo, tedy proces W Q, je třeb disipce kinetické energie těles třením. ento proces většinou končí zstvením těles tedy stvem, kdy se veškerá jeho kinetická energie přemění v teplo, které zvýší vnitřní energii těles, mezi nimiž dochází ke tření přípdně okolí. Z toho vyplývá, že v přírodě existují smovolně probíhjí procesy, kdy se veškerá mechnická práce (kinetická energie těles) přemění v teplo. uto skutečnost můžeme schémticky zpst jko W = Q. (5.1) Rozeberme nyní opčný proces, přeměnu tepl v mechnickou práci Q W, tedy proces konverze 5 58
3 II. termodynmický zákon Michl Vrdy méně ušlechtilého druhu energie (energie neuspořádného pohybu částic) v ušlechtilejší energii uspořádného pohybu částic těles při jeho mkroskopickém pohybu. Z pozorování technické prxe vyplývá, že nelze veškerou energii neuspořádného pohybu částic (teplo) přeměnit v uspořádný pohyb částic těles při jeho mkroskopickém pohybu. to skutečnost je zásdní, je i hlvní myšlenkou II. termodynmického zákon. Můžeme ji vyjádřit zápisem Q >W, (5.2) který vyjdřuje, že mechnická práce vykonná tepelným strojem je vždy menší než teplo, které stroj přijl Některé formulce II. termodynmického zákon jejich rozbor Druhý termodynmický zákon lze vyjádřit velkým množstvím nvzájem ekvivlentních tvrzení. Uved me si některá z nich: Clusiův princip (1850) Neexistuje žádný cyklický proces, jehož jediným výsledkem by byl přenos tepl ze studenějšího těles n teplejší. Clusiův princip vyjdřuje skutečnost dobře známou z kždodenní prxe týkjící se směru toku tepl při smovolné tepelné výměně mezi tělesy. V Clusiově formulci je důležité neopomenout slovo smovolně, protože přenos tepl z chldnějšího těles n teplejší probíhjící npříkld v ledničkách tepelných čerpdlech II. termodynmický zákon nezkzuje, jen říká není smovolný - může probíht díky mechnické práci, kterou dnému tepelnému stroji dodáváme z venčí. Plnckův princip (1930) Je nemožné sestrojit tkový periodicky prcující stroj, který by trvle konl kldnou mechnickou práci pouze ochlzováním jednoho těles, niž by přitom docházelo ke změnám n osttních tělesech. Plnckův princip vyjdřuje objev Sdiho Crnot z roku 1824, že má-li tepelný motor kont nenulovou práci musí nutně prcovt mezi dvěm tepelnými lázněmi různé teploty, přičemž jedn lázeň funguje jko ohřívč druhá jko chldič. Není tedy bohužel možné sestrojit stroj, který by fungovl pouze tk, že by z jedné tepelné lázně (třeb z oceánu) odebírl teplo konl by tomuto teplu ekvivletní práci. kový stroj se nzývá perpetuum mobile II. druhu (viz obr. 5.1) II. termodynmický zákon vylučuje jeho existenci. 5 59
4 Michl Vrdy Přednášk 5: II. termodynmický zákon entropie Ostwldův princip Není možné sestrojit perpetuum mobile II. druhu. to formulce je vpodsttě zkrácenou verzí Plnckov principu. Crthéodoryho princip (1909) V kždém libovolném okolí libovolně dného stvu termicky homogenního systému existují stvy nedosžitelné vrtnou dibtickou cestou. (Existují dibticky nedosžitelné stvy.) Crthéodoryho princip je opět ekvivletní všem osttním formulcím II. termodynmického zákon. Crtheodóryho princip je výchozím bodem pro mtemtické odvození existence entropie pro mtemtickou formulci II. termodynmického zákon. Princip růstu entropie Celková entropie jkéhokoli izolovného systému se může pouze zvyšovt blížit se své mximální hodnotě. Po dosžení mxim zůstává celková entropie systému konstntní. ento princip si dokážeme později po zvedení entropie pomocí mtemtické formulce II. termodynmického zákon. ento princip má ve fyzice ve filozofii výlučné postvení, protože určuje tzv. termodynmickou šipku čsu, tedy směr jkým se ubírá vývoj procesů v přírodě. 5.2 Entropie termodynmická teplot Důležitou stvovou funkcí v termodynmice je entropie. Při odvození existence entropie, které je vlstně určením integrčního fktoru pro teplo se vyjde z Crtheodóryho principu. en jinými slovy říká, že Pffov diferenciální form pro teplo, jkkoli je komplikovná je vždy holonomní, tedy že k ní vždy existuje integrční fktor. Připomeňme, že skutečnost, že diferenciální form pro teplo má integrční fktor znmená, že Pfffov rovnice + n i=1 i, j = i + A i d i =0 (5.3) obdržená z diferenciální formy pro teplo je po vynásobení integrčním fktorem integrovtelná její integrál je roven funkci kterou nzveme entropie systému. o znmená, že v prostoru prmetrů systému 5 60
5 Entropie termodynmická teplot Michl Vrdy Obrázek 5.1: Schémt tepelných strojů: ) perpetuum mobile II. druhu, jehož funkčnost je v rozporu s II. termodynmickým zákonem, b) funkční tepelný stroj fungující v souldu s II. termodynmickým zákonem. 1, 2,..., n, existují tzv. dibtické plochy z nichž se libovolným dibtickým dějem nemůžeme vzdálit. Odvození existence entropie není triviální probíhá tk, že se nejprve ukáže, že integrční fktor ve formě integrčního dělitele pro d Q je funkcí pouze empirické teploty, tedy nezávisí n osttních prmetrech systému 1, 2,..., n že tento integrční dělitel je lze povžovt z tzv. termodynmickou teplotu, což je teplot zcel nezávislá n způsobu jejího měření (srovnej se zvedením empirické teploty). Diferenciální form ds = d Q = n i=1 i, j = i + A i d i (5.4) je potom úplným diferenciálem. Pro vrtné děje tk dostáváme novou stvovou funkci definovnou ds (vr) d Q, (5.5) která se nzývá entropie. Vzhledem k tomu, že ds je úplným diferenciálem funkce S pltí pro libovolný vrtný kruhový děj (viz článek 2.4) (vr) d Q ds = (vr) =0. (5.6) to rovnice se nzývá I. Clusiov vět je mtemtickým vyjádřením II. termodynmického zákon pro vrtné procesy. 5 61
6 Michl Vrdy Přednášk 5: II. termodynmický zákon entropie Existence entropie Nyní s pomocí mtemtického prátu z článku 2.3 ukážeme, že integrční fktor pro teplo je funkcí pouze empirické teploty t umožňuje definovt novou stvovou funkci entropii systému. Budeme přitom sledovt postup ze skvělé Bzrovovy knihy ermodynmik. Mějme systém, který se skládá ze dvou podsystémů (viz obr 5.2). Prmetry prvního podsystému oznčíme jko t, 1,..., n prmetry druhého podsystému jko t, b 1,...,b m. Celý systém je tedy popsán prmetry t, 1,..., n,b 1,...,b m. Necht nyní tento systém přijme během nějkého rovnovážného děje teplo δq, které se rozdělí mezi ob systémy tk, že první systém obdrží teplo δq 1 druhý δq 2. Smozřejmě pltí δq = δq 1 + δq 2. (5.7) Z Crtheodóryho principu víme, že Pfffov form pro teplo je z kždých okolností pro rovnovážné děje holonomní, že tedy pro kždé z tepel δq 1, δq 2 δq existuje integrční fktor tkový 1,že kde dσ 1 = δq 1 λ 1, dσ 2 = δq 2 λ 2, dσ = δq λ, (5.8) σ 1 = σ 1 (t, 1,..., n ), σ 2 = σ 2 (t, b 1,...,b m ), (5.9) σ = σ(t, 1,..., n,b 1,...,b m ), jsou stvové funkce prvního druhého podsystému celého systému vzniklé integrcí Pfffových forem pro odpovídjící tepl vydělená odpovídjícími integrčními děliteli λ 1 = λ 1 (t, 1,..., n ), λ 2 = λ 2 (t, b 1,...,b m ), (5.10) λ = λ(t, 1,..., n,b 1,...,b m ). Z první rovnice (5.9) lze vyjádřit proměnnou npříkld 1 = 1 (t, σ 1, 2,..., n ) z druhé b 1 = b 1 (t, σ 1,b 2,...,b m ). Integrční fktory poslední rovnice pro σ lze potom zpst tkto λ 1 = λ 1 (t, σ 1, 2,..., n ), λ 2 = λ 2 (t, σ 2,b 2,...,b m ), (5.11) λ = λ(t, σ 1,σ 2, 2,..., n,b 2,...,b m ), σ = σ(t, σ 1,σ 2, 2,..., n,b 2,...,b m ). Úplný diferenciál funkce σ dostneme n jednu strnu diferencováním poslední rovnice, tedy 1 Zde ve formě integrčních dělitelů. dσ = σ σ dt + dσ 1 + σ dσ 2 + t σ 1 σ 2 n i=2 σ i d i + m j=2 σ b j db j, (5.12) 5 62
7 Entropie termodynmická teplot Michl Vrdy Obrázek 5.2: Schém systému složeného ze dvou podsystémů pro odvození existence entropie. n druhou strnu doszením vzthů pro jednotlivá tepl vyjádřených z (5.8) do rovnice (5.7) Srovnáním posledních dvou rovnic okmžitě vidíme, že σ σ 1 = λ 1 λ, dσ = λ 1 λ dσ 1 + λ 2 λ dσ 2. (5.13) σ σ 2 = λ 2 λ, (5.14) že osttní koeficienty (prciální derivce) v rovnici (5.12) stojící u dt, d i db j jsou rovny nule. Proto tké musí být všechny smíšené druhé derivce funkce σ rovny nule 2. Pro smíšené druhé derivce σ tedy dostáváme (bereme pouze ty členy, jejichž první derivce jsou nenulové) t σ σ 1 σ i σ 1 σ b j σ 1 = t λ1 λ = λ1 i λ = λ1 b j λ =0, =0, =0, t σ σ 2 σ i σ 2 σ b j σ 2 = t λ2 λ = λ2 i λ = λ2 b j λ =0, =0, =0, (5.15) pro i =2,...,n j =2,...,m. Vzhledem k prvním dvěm rovnicím je jsné, že má-li λ 1, λ 2 λ záviset n t musí být všechny integrční fktory stejnou funkcí t npříkld λ 1 = ϕ(t) f 1 (σ 1, 2,..., n ), λ 2 = ϕ(t) f 2 (σ 2,b 2,...,b m ), (5.16) λ = ϕ(t) f(σ 1,σ 2, 2,..., n,b 2,...,b m ), jink by se uvedené derivce nemohly rovnt nule. Z dlších dvou rovnic je ptrné, že vzhledem k tomu, ž e λ 2 není funkcí i tké λ tké nemůže být funcí i stejně tk λ 1 nemůže být funcí i. Z posledních dvou rovnic plyne totéž pro prmetry b j. Závislost integrčních fktorů n vnějších prmetrech se nám tedy dále zjednodušil λ 1 = ϕ(t) f 1 (σ 1 ), λ 2 = ϕ(t) f 2 (σ 2 ), (5.17) λ = ϕ(t) f(σ 1,σ 2 ). 2 Jde o důsledek podmínky nutné postčující pro to, by form dσ byl úplným diferenciálem. o le víme, že je. 5 63
8 Michl Vrdy Přednášk 5: II. termodynmický zákon entropie Obrázek 5.3: Schém systému složeného ze tří podsystémů. K důkzu λ = ϕ(t). Funkce f 1 (σ 1 ), f 2 (σ 2 ) mohou být libovolné přitom λ 1, λ 2 stále zůstávjí integrujícími děliteli dné formy, viz poznámk 1 pod črou v článku yto funkce lze tedy položit rovny jedné dostáváme tk důležitý výsledek, že integrující dělitel pro tepl jednotlivých podsystémů je pouze funkcí empirické teploty t λ 1 = λ 2 = ϕ(t). (5.18) Lze sndno ukázt, že tké λ = ϕ(t). Vezměme systém, který se skládá ze tří podsystémů, které oznčíme čísly 1, 2 3 (viz obr. 5.3, které jsou v termodynmické rovnováze. Ve shodě s již dokázným viz rovnice (5.18) dostáváme pro kždý pár systémů λ 1 = λ 2 = ϕ(t), λ 2 = λ 3 = ϕ(t), λ = λ 3 = ϕ(t), (5.19) kde λ odpovídá spojeným systémům 1 2. Dokázli jsme tk, že λ = λ 1 = λ 2 = ϕ(t). Funkce S 1 S 2 definovné ds 1 = δq 1 ϕ(t), ds 2 = δq ϕ(t), (5.20) se nzývjí entropiemi prvního druhého podsystému. Vezmeme-li v úvhu rovnici (5.7) dostneme δq ϕ(t) = δq 1 ϕ(t) + δq 2 ϕ(t) = ds 1 + ds 2 = d(s 1 + S 2 )= ds, (5.21) kde S = S 1 + S 2 je entropie celého systému. Entropie je tedy ditivní, neboli extenzivní veličinou. Shrňme hlvní výsledky, které jsme získli v tomto článku: 1. Podřilo se nám dokázt, že mezi integrujícími děliteli pro δq existuje tkový, který je funkcí pouze empirické teploty λ = ϕ(t) je stejný pro libovolné systémy v termodynmické rovnováze. 2. Prokázli jsme existenci nové stvové funkce entropie. 3. Dokázli jsme, že entropie je ditivní ptří tedy k extenzivním termodynmickým veličinám. 5 64
9 Entropie termodynmická teplot Michl Vrdy ermodynmická teplot Při odvození existence entropie jsme ztím jko jeden z prmetrů systémů používli empirickou teplotu t. Určení empirické teploty systému se npříkld u kplinových teploměrů převádí n měření teplotně závislého objemu teploměrné kpliny v kpiláře teploměru. Z termiky víme, že hodnot empirické teploty dného systému, měřená kplinovými teploměry s různými teploměrnými kplinmi, se kromě dvou klibrčních bodů 0 C100 C bude lišit. Dochází k tomu díky různým teplotním závislostem koeficientů izobrické teplotní roztžnosti pro různé kpliny. to skutečnost je smozřejmě fyzikálně velmi neuspokojivá. Zvedení termodynmické (bsolutní) teploty Pomocí II. termodynmického zákon lze tuto svízel vyřešit definováním bsolutní termodynmické teploty (krátce termodynmické teploty), která nezávisí n vlstnostech teploměrných látek v teploměrech. Vzhledem k tomu, že integrční dělitel pro teplo je funkcí pouze teploty je možné celou tuto funkci vzít z míru teploty systému = ϕ(t). (5.22) Njděme nyní vzth mezi termodynmickou empirickou teplotou určenou n zákldě nějké libovolné teploměrné veličiny. Vezmeme jednoduchý systém, jehož stv je dán jedním vnějším prmetrem bsolutní teplotou = (t), která je funkcí empirické teploty změřené n zákldě libovolné teploměrné veličiny 3. Vyjdeme z prvního δq = du + A d (5.23) druhého termodynmického zákon ds = δq. (5.24) Rozepsáním diferenciálu vnitřní energie v prvním termodynmickém zákonu jeho vydělením bsolutní teplotou dostneme diferenciál entropie ds = δq = d + + A d, (5.25) tedy Pfffovu formu, která je úplným diferenciálem nutně musí splňovt podmínky pro úplný diferenciál, tedy 1 = 1 + A. (5.26) Provedením derivcí dostáváme A = + A. (5.27) 3 Převodní funkci mezi empirickou termodynmickou teplotou (zároveň integrční fktor pro teplo) = ϕ(t) pro přehlednost dále nhrdíme symbolem = (t). Smozřejmě pltí (t) =ϕ(t). 5 65
10 Michl Vrdy Přednášk 5: II. termodynmický zákon entropie Nyní vezmeme termodynmickou teplotu jko funkci empirické, tedy = (t), d = d dt dt, provedeme substituci do předchozího vzthu. Dostneme (t) A t dt d = + A. (5.28) t Z této rovnice dostneme diferenciální rovnici pro vzth mezi termodynmickou empirickou t teplotou A d (t) = t t + A dt, (5.29) přičemž prciální derivci vnitřní energie podle vnějšího prmetu, lze brát při konstntních jk tk i t, protože obě teploty jsou svázány jednoznčnou funkcí je li tedy konstntní jedn bude i druhá. Získnou rovnici lze bez potíží integrovt ln 0 = t t 0 A t t + A dt = I (5.30) dostneme výsledný vzth kde bsolutní teploty 0 odpovídjí empirickým teplotám t t 0. = 0 e I, (5.31) Z tvru funkční závislosti pro bsolutní termodynmickou teplotu (5.31) okmžitě vyplývá, že teplot nemůže změnit znménko musí tedy být pouze kldná nebo záporná podle volby znménk prmetru 0. Dokázt, že teplot je kldná nebo záporná není možné je potřeb doplnit určení znménk teploty dlší podmínkou, že přijímá-li těleso teplo při konstntních vnějších prmetrech, jeho teplot roste tedy, že tepelná kpcit C = > 0, (5.32) t je vždy kldná. ím jsme vyloučili možnost existence záporných teplot. Vzth mezi empirickou bsolutní termodynmickou teplotou Vezměme nyní rovnici (5.31) pro bsolutní termodynmickou teplotu 1 odečtěme od ní 0. Dostneme kde 1 0 = 0 ( e I 1 1), (5.33) I 1 = t 1 A t t t 0 Dělíme-li nyní vzth (5.31) rovnicí (5.33) dostneme + A dt. (5.34) e I = 1 0 ( e I (5.35) 1 1) 5 66
11 Entropie termodynmická teplot Michl Vrdy po úprvě e I =( 1 0 ) ( e I. (5.36) 1 1) Vezmeme-li tedy empirickou bsolutní teplotní stupnici tk, že t 1 t 0 = 100 C zároveň 1 0 = 100 K dostneme e I = 100 ( e I. (5.37) 1 1) ento vzth umožňuje určit bsolutní termodynmickou teplotu podle dné empirické teploty t určené pomocí libovolné teploměrné veličiny. Jednoznčnost termodynmické teploty Nyní ukážeme, že bsolutní termodynmická teplot je jednoznčná nezávisí n výběru druhu teploměru nebo teploměrné látky. Mějme nějkou soustvu v termodynmické rovnováze změřme její teplotu pomocí dvou různých teploměrů (třeb rtut ový plynový). Obecně tk získáme dvě různé empirické teploty t τ mezi nimiž předpokládáme jednoznčný vzth t = t(τ). ermodynmickou teplotu definovnou pomocí empirické teploty t oznčíme termodynmickou teplotu definovnou pomocí empirické teploty τ oznčíme. Je-li termodynmická teplot jednoznčná závisí pouze n stvu systému ne n teploměru musí pltit =. (5.38) Nším cílem je dokázt pltnost tohoto tvrzení. Předpokládejme, že rozdíl bsolutních termodynmických teplot mezi dvěm klibrčními body obou termodynmických teplot bude stejný, tkže 1 0 = 1 0 = 100. (5.39) ermodynmické teploty jsou pro obě empirické dány rovnicemi (5.37) e I = 100 ( e I, (5.40) 1 1) e Iτ = 100 ( e I. (5.41) 1τ 1) Pltí-li tedy I = I τ I 1 = I 1τ jsou tké obě termodynmické teploty stejné. Abychom to dokázli npíšeme vzthy pro integrály I τ I 1τ, provedeme substituci τ = τ(t), tkže dτ = dτ dt dt přepočítáme meze integrálů I τ = I 1τ = τ A τ τ 0 τ 1 A τ τ 0 τ + A dτ = τ + A dτ = t A t t 0 t 1 A t t 0 dt dτ t + A dt dτ t + A dτ t dt = dt t 0 dτ t 1 dt = dt t 0 A t t A t + A dt = I, t + A dt = I
12 Michl Vrdy Přednášk 5: II. termodynmický zákon entropie Dokázli jsme tk, že = (5.42) tkže bsolutní termodynmická teplot nezávisí výběru teploměru teploměrné látky veličny, le výhrdně n stvu termodynmické soustvy. Odvození vzthu mezi t dnou plynovým teploměrem Vezměme z teploměrnou látku ideální plyn teploměrnou veličinu tlk P ideálního plynu při V = konst. lk ideálního plynu při konstntním objemu souvisí s empirickou teplotou t vzthem P (t) =P 0 (1 + γt), kde γ = 1 273, 15. (5.43) Podle termodynmické definice ideálního plynu je =0 (5.44) V t integrál I lze spočíst jednoduchou substitucí I = t P t V t V t + P dt = γp t 0 P 0 0 t 0 Stejně pro I 1 (horní mez předchozího integrálu je nyní rovn t 1 ) máme Dosdíme-li hodnoty integrálů I I 1 do (5.37) dostneme 1 1+γt dt =ln. (5.45) (1 + γt) 1+γt 0 I 1 =ln 1+γt 1 1+γt 0. (5.46) = γt γ(t 1 t 0 ). (5.47) Pro rozdíl teplot t 1 t 0 = 100 C dostneme notoricky známý vzth termodynmickou bsolutní teplotou empirickou Celsiovou teplotou = 1 + t = 273, 15 + t. (5.48) γ Definice vlstnosti entropie shrnutí V předešlém článku jsme dokázli, že integrujícím fktorem pro teplo předné při vrtných (kvzisttických) dějích je funkce µ =1/, kde jsme definovli jko termodynmickou bsolutní teplotu. 5 68
13 Entropie termodynmická teplot Michl Vrdy Vynásobením Pfffovy formy pro teplo touto funkcí obdržíme úplný diferenciál nové stvové funkce entropie: tedy pro teplo při vrtných dějích pltí ds (vr) d Q, (5.49) d Q (vr) = ds. (5.50) Integrcí vzthu (5.80) dostneme výrz pro entropii systému, kde konstnt S 0 může mít význm npříkld entropie systému při teplotě 0 K d Q S = (vr) + S 0. (5.51) Hodnotu konstnty S 0 nelze metodmi termodynmiky určit, nicméně v termodynmice se budeme stejně spíše než konkrétními hodnotmi entropie systémů v dném stvu zjímt o její změnu při nějkém vrtném termodynmickém ději. Pro změnu entropie S pltí S = (vr) (2) (1) d Q = S 2 S 1, (5.52) kde symbol (vr) před integrálem vyjdřuje, že cest po níž integrujeme může sice být nprosto libovolná 4, le vždy vrtná. Důsledkem je nutná podmínk pro zvedení entropie tedy, že libovolné dv stvy lze vždy spojit lespoň jednou vrtnou cestou. Dosdíme-li rovnici pro teplo (5.50) do I. termodynmického zákon dostneme zákldní rovnici termodynmiky pro vrtné (kvzisttické děje) ds = du + i A i d i. (5.53) Pro změnu entropie při libovolném vrtném ději pk z této rovnice dostneme S 2 S 1 = (2) (1) 1 du + i A i d i, (5.54) přičemž pro doszení potřebujeme znát jk klorickou tk termickou stvovou rovnici. Vlstnosti entropie Z rovnice (5.21) vyplývá, že entropie je extenzivní veličin. o znmená, že máme-li dv oddělené systémy se stejným druhem nvzájem nerozlišitelnýc částic v termodynmické rovnováze s jednotlivými 4 Viz vět o křivkovém integrálu II. druhu (článek 2.4). 5 69
14 Michl Vrdy Přednášk 5: II. termodynmický zákon entropie entropiemi S 1 S 2 spojíme je, do jednoho systému, jeho výsledná entropie bude éto vlstnosti se ké někdy říká ditivnost entropie. S = S 1 + S 2. (5.55) Zmysleme se nyní při kterém termodynmickém ději se entropie nemění, tedy ds =0. Z rovnice (5.80) vyplývá že tímto dějem je vrtný dibtický děj, tedy tzv. izentropický děj Entropie ideálního plynu Vyjdeme z I. termodynmického zákon d Q = du + d W (5.56) do něhož dosdíme z diferenciál vnitřní energie známý výrz plynoucí z I. termodynmického postulátu z práci plynu p dv. Podělením I. termodynmického zákon teplotou dostneme ds = d Q = 1 d P dv. (5.57) V V Vzhledem k tomu, že C V = V (5.58) že podle termodynmické definice ideálního plynu je V 0 (5.59) dostáváme s využitím termické stvové rovnice ideálního plynu P = Rn/V Integrcí tohoto vzthu dostneme ds = C V d + p dv = C V d + Rn V dv. (5.60) S = c Vm n ln + Rn ln V + S 0. (5.61) Zbývá ještě ověřit, zd je námi odvozená entropie ideálního plynu extenzivní veličinou, tedy zd je ditivní. Gibbsův prdox Vezměme dv identické systémy v DR (viz obr. 5.4) s entropiemi S 1 = c Vm n ln + Rn ln V + S 0. (5.62) 5 70
15 Entropie termodynmická teplot Michl Vrdy Obrázek 5.4: Ilustrce ke Gibbsovu prdoxu. Spojením obou systémů vznikne systém nový, který vzhedem k ditivnosti entropie musí mít entropii S rovnu součtu obou entropií, tedy S =2S 1 =2c Vm n ln +2Rn ln V +2S 0. (5.63) Je tomu skutečně tk? Spojený systém má dvojnásobný počet částic dvojnásobný objem ve srovnání s původním systémem. Jeho entropie tedy podle vzthu (5.61) musí být liší se tedy od entropie S =2S 1 o fktor S =2c Vm n ln +2Rn ln 2V + S 0. (5.64) S 2S 1 =2Rn(ln 2V ln V )+S 0 2S 0 =2Rn ln 2. (5.65) Aby byl entropie ditivní je nutno modifikovt rovnici (5.61) tkto S = c Vm n ln + Rn ln V n + S 0. (5.66) Vzth mezi klorickými termickými stvovými rovnicemi Vyjd eme z I. termodynmického zákon pro vrtné procesy, který pro jeho větší obecnost zpíšeme pomocí zobecněné síly A souřdnice ds = du + A d. (5.67) S využitím II. postulátu termodynmiky vyjádříme diferenciál vnitřní energie dosdíme do rovnice pro diferenciál entropie ds = 1 d A d. (5.68) Protože ds je úplným diferenciálem (entropie je stvovou funkcí), musí podle podmínky nutné postčující pro úplný diferenciál pltit 1 = 1 + A. (5.69) 5 71
16 Michl Vrdy Přednášk 5: II. termodynmický zákon entropie Provedeme-li derivce n obou strnách rovnice dostneme n levé strně rovnice 1 = 1 2 U, (5.70) n prvé strně rovnice 1 + A = A U + A. (5.71) Porovnáním obou výsledků, s využitím prvidl o záměnnosti pořdí derivování smíšených derivcí II. řádu dostneme výsledný vzth, který se pro svou mimořádnou důležitost někdy oznčuje jko rovnice 90% termodynmiky 5 = A A. (5.72) to rovnice hrje v termodynmice klíčovou roli, protože umožňuje z termických stvových rovnic systémů odvodit rovnice klorické zjednodušit tk řdu termodynmických vzthů, pro jejichž použití bychom jink potřebovli znát jk termickou tk i klorickou stvovou rovnici dného systému. Některé příkldy použití rovnice 90% termodynmiky 1. Odvození klorické stvové rovnice z termické: Podle II. postulátu termodynmiky pltí tedy du = d + U = U(, ), (5.73) d = C d + d. (5.74) Dosdíme-li do druhého členu této rovnice rovnici 90% termodynmiky obdržíme prostou integrcí hlednou klorickou stvovou rovnici systému U = C d + d = C d + A A d + U 0, (5.75) kde U 0 je konstnt. Vidíme tedy, že pro odvození klorické stvové rovnice systému stčí znát pouze termickou stvovou rovnici systému. 2. Výpočet C A C pouze z termické stvové rovnice: V článku jsme odvodili vzth pro C A C, který lze opět s využitím rovnice 90% termodynmiky sndno uprvit tk, že k urcění rozdílu tepených kpcit konkrétního systému stčí opět znát pouze termickou stvovou rovnici dného systému: C A C = + A A = A A 5 oto neformální pojmenování odvozeného vzthu souvisí s jeho fundmentální rolí v termodynmice.. (5.76) 5 72
17 Mtemtické formulce II. termodynmického zákon shrnutí Michl Vrdy 3. Výpočet entropie systému pouze z termické stvové rovnice: Při výpočtu entropie systému vyjdeme ze spojeného vzthu pro I. II. termodynmický zákon km opět dosdíme rovnici 90% termodynmiky ds = 1 4. Vzth pro ( C /) : tkže C = d + 1 = C = + A d = C d + A A = 2 A 2 A d. (5.77) 2 A 2, (5.78). (5.79) 5.3 Mtemtické formulce II. termodynmického zákon shrnutí Vzhledem k důležitosti náročnosti probírného témtu uvedeme i z cenu opkování ješte jednou mtemtické formulce II. termodynmického zákon pro vrtné děje nově odvodíme uvedeme několik ekvivlentních mtemtických formulcí II. termodynmického zákon pro nevrtné děje II. termodynmický zákon pro rovnovážné děje II. termodynmický zákon pro vrtnéné děje lze vyjádřit vzthem ds (vr) d Q, (5.80) který vyjdřuje, že entropie při vrtných dějích je stvovou funkcí systému. Ekvivlentním vzthem je d Q (vr) = ds. (5.81) Dosdíme-li tuto rovnici pro teplo do I. termodynmického zákon dostneme rovnici, která spojuje I. II. termodynmický zákon tzv. zákldní rovnici termodynmiky pro vrtné (kvzisttické děje) ds = du + i A i d i. (5.82) Z rovnice (5.80) vyplývá, že vezmeme li libovolný vrtný kruhový děj po ukončení celého cyklu je změn entropie (stejně jko změn vnitřní energie) systému nulová. Proto křivkový integrál po uzvřené křivce odpovídjící libovolnému vrtnému ději je nulový, tedy d Q (vr) =0. (5.83) 5 73
18 Michl Vrdy Přednášk 5: II. termodynmický zákon entropie Obrázek 5.5: Ilustrce k odvození II. termodynmického zákon pro nevrtné děje. ento vzth se nzývá Clusiov rovnost, tké I. Clusiov vět čsto se uvádí jko mtemtické vyjádření II. termodynmického zákon pro vrtné děje. Z věty o křivkovém integrálu II. druhu (článek 2.4) všk víme, že vzthy (5.80), (5.81) (5.83) jsou ekvivlentní lze je tedy všechny povžovt z mtemtické vyjádření II. termodynmického zákon pro rovnovážné děje II. termodynmický zákon pro nerovnovážné děje Nyní odvodíme II. termodynmický zákon pro nevrtné děje. Vezmeme nějký termodynmický systém v termodynmické rovnováze provedeme s ním následující dvojici dějů. Nejprve necháme systém přejít nevrtně z stvu (1) do nějkého infinitezimálně blízkého stvu (2) pk s tímtéž systémem přejdeme po nějké vrtné cestě opět ze stvu stvu (1) do stvu (2) (viz obr. 5.5). Předpokládejme, že při obou dějích systém přijme kldné teplo vykoná kldnou mechnickou práci. Zároveň při obou dějích musí být splněn zákon zchování energie. Pro první nevrtný děj máme pro druhý vrtný děj d Q nv = du + d W nv (5.84) d Q = du + d W. (5.85) Protože změn vnitřní energie je v obou přípdech stejná (jde o stvovou funkci záviskou pouze n stvech (1) (2)), odečtením obou rovnic dostneme d Q nv d Q = d W nv d W. (5.86) to rovnice popisuje kruhový děj s první nevrtnou větví ze stvu 1 2, kdy ve shodě s předešlým textem systém přijímá kldné nevrtné teplo koná kldnou nevrtnou mechnickou práci. Kruhový děj se ukončí vrtným dějem, kdy se systém vrcí ze stvu 2 1 předá přitom do okolí vrtné teplo vrtnou práci. Nyní budeme zkoumt, jké má tto rovnice znménko, tedy zd je rovn nule, je kldná nebo záporná. 1. Předpokládejme nejprve, že vzth (5.86) je roven nule, tedy d W nv d W =0. Pk ovšem tké d Q nv d Q =0. o by všk znmenlo, že nevrtný proces 1 2 lze obrátit projít jej zpět 5 74
19 Mtemtické formulce II. termodynmického zákon shrnutí Michl Vrdy vrtnou cestou bez jkýchkoli změn n okolních tělěsech, tedy n zpáteční cestě by systém vrátil do okolí teplo d Q = d Q nv vykonl práci n okolí d W = dw nv. 2. Kdyby byl vzth (5.86) větší než nul znmenlo by to, že část z rozdílu prcí d W = d W nv d W > 0 by během cyklu byl vykonán pouze n úkor části kldného rozdílu tepel d Q = d Q nv d Q >0 což je ve sporu s II. termodynmickým zákonem, tedy systém by přijl kldné teplo vykonl ekvivlentní práci bez jkýchkoli změn n okolních tělesech. 3. Dokázli jsme tedy, že vzth (5.86) musí být menší než nul, tedy pltí d Q nv d Q = d W nv d W <0. (5.87) Z výše uvedeného rozboru vyplývjí důležité relce pro tepl práce při vrtných nevrtných dějích mezi dvěm pevně dnými stvy II. termodynmický zákon pro nevrtné děje lze tedy vyjádřit nerovnicí δq > δq nv, (5.88) δq > δq nv. (5.89) ds >δq nv, (5.90) kde n levé strně vystupuje teplo, které by si systém vyměnil při přechodu mezi dvěm pevně dnými stvy s okolím v přípdě, že by tepelná výměn probíhl kvzistticky. N prvé strně je teplo, které by si systém vyměnil s okolím, kdyby mezi mezi oběm výše zmíněmnými stvy přešel po libovolné nevrtné cestě. Spojením I. (doszením ZZE z nevrtné teplo) II. termodynmického zákon dostneme zákldní rovnici termodynmiky pro nevrtné procesy ds >du + i A i d i. (5.91) Ze vzthu (5.90) okmžitě dostáváme nerovnici změnu entropie systému při libovolném nevrtném ději tedy pro entropii po integrci ds > d Q nv S = S 2 S 1 > (2) (1), (5.92) d Q nv. (5.93) ento vzth má očividný důsledek. Uskutečníme-li se systémem kruhový děj, je změn entropie po uzvření cyklu S =0(jde o stvovou veličinu srovnej s vnitřní energií). Dostáváme tk tzv. Clusiovu nerovnost, neboli II. Clusiovu větu d Q (nv) < 0, (5.94) která se rovněž čsto uvádí jko mtemtické vyjádření II. termodynmického zákon pro nevrtné (nerovnovážné) děje. Lze tedy shrnout, že z mtemtické vyjádření II. termodynmického zákon můžeme povžovt kterýkoli ze vzthů (5.90), (5.92) (5.93). Opět pltí, že všechny tyto vzthy jsou podle věty o křivkovém integrálu II. druhu (článek 2.4) zcel ekvivlentní. 5 75
20 Michl Vrdy Přednášk 5: II. termodynmický zákon entropie Princip růstu entropie Rovnice (5.93) má ještě jeden zásdní důsledek. Použijeme-li ji pro izolovný systém, kdy si systém nemůže vyměňovt teplo s okolím, tkže d Q nv (stčí dibtická izolce) dostneme ds >0, S 2 S 1 > 0. (5.95) Vezmeme-li v úvhu ještě vrtné děje je nutno modifikovt relční znménko > n dostneme tkzvný princip růstu entropie: V izolovných soustvách entropie nikdy neklesá, tedy S = S 2 S 1 0. (5.96) Probíhjí-li tedy v izolovné soustvě libovolné, le vrtné děje, celková entropie soustvy zůstává konstntní, probíhá-li tm lespoň jeden nevrtný děj, výsledná entropie soustvy s čsem nevyhnutelně roste. ento výrok je dlším vyjádřením II. termodynmického zákon má hluboký fyzikální filozofický smysl protože určuje směr plynutí čsu, tkzvnou šipku čsu. Princip růstu entropie vyjdřuje II. termodynmický zákon jk pro vrtné tk i pro nevrtné děje. Spolu s ním je možno vyjádřit II. termodynmický zákon zcel obecně jk pro vrtné tk i nevrtné děje těmito ekvivlentními vzthy ds δq, (5.97) S = S 2 S 1 spojení I. druhého termodynmického zákon (2) (1) d Q, (5.98) d Q 0, (5.99) ds >du + i A i d i. (5.100) 5.4 Přeměn tepl v mechnickou práci Kruhové děje Pro konverzi tepl v práci hrjí klíčovou roli kruhové děje. Kruhové děje jsou děje, kdy se systém po ukončení jednoho cyklu vrátí do původního stvu. V článku 4.1 jsme ukázli, že pro práci vykonnou po 5 76
I. termodynamický zákon
 řednášk 4 I. termodynmický zákon I. termodynmický zákon jkožto nejobecnější zákon zchování energie je jedním ze zákldních stvebních kmenů termodynmiky. této přednášce zopkujeme znění tohoto zákon n jeho
řednášk 4 I. termodynmický zákon I. termodynmický zákon jkožto nejobecnější zákon zchování energie je jedním ze zákldních stvebních kmenů termodynmiky. této přednášce zopkujeme znění tohoto zákon n jeho
Obecně: K dané funkci f hledáme funkci ϕ z dané množiny funkcí M, pro kterou v daných bodech x 0 < x 1 <... < x n. (δ ij... Kroneckerovo delta) (4)
 KAPITOLA 13: Numerická integrce interpolce [MA1-18:P13.1] 13.1 Interpolce Obecně: K dné funkci f hledáme funkci ϕ z dné množiny funkcí M, pro kterou v dných bodech x 0 < x 1
KAPITOLA 13: Numerická integrce interpolce [MA1-18:P13.1] 13.1 Interpolce Obecně: K dné funkci f hledáme funkci ϕ z dné množiny funkcí M, pro kterou v dných bodech x 0 < x 1
LINEÁRNÍ DIFERENCIÁLNÍ ROVNICE 2.ŘÁDU
 LINEÁRNÍ DIFERENCIÁLNÍ ROVNICE 2.ŘÁDU ZDENĚK ŠIBRAVA 1. Obecné řešení lin. dif. rovnice 2.řádu s konstntními koeficienty 1.1. Vrice konstnt. Příkld 1.1. Njděme obecné řešení diferenciální rovnice (1) y
LINEÁRNÍ DIFERENCIÁLNÍ ROVNICE 2.ŘÁDU ZDENĚK ŠIBRAVA 1. Obecné řešení lin. dif. rovnice 2.řádu s konstntními koeficienty 1.1. Vrice konstnt. Příkld 1.1. Njděme obecné řešení diferenciální rovnice (1) y
Zavedení a vlastnosti reálných čísel PŘIROZENÁ, CELÁ A RACIONÁLNÍ ČÍSLA
 Zvedení vlstnosti reálných čísel Reálná čísl jsou zákldním kmenem mtemtické nlýzy. Konstrukce reálných čísel sice není náplní mtemtické nlýzy, le množin reálných čísel R je pro mtemtickou nlýzu zákldním
Zvedení vlstnosti reálných čísel Reálná čísl jsou zákldním kmenem mtemtické nlýzy. Konstrukce reálných čísel sice není náplní mtemtické nlýzy, le množin reálných čísel R je pro mtemtickou nlýzu zákldním
4. přednáška 22. října Úplné metrické prostory. Metrický prostor (M, d) je úplný, když každá cauchyovská posloupnost bodů v M konverguje.
 4. přednášk 22. říjn 2007 Úplné metrické prostory. Metrický prostor (M, d) je úplný, když kždá cuchyovská posloupnost bodů v M konverguje. Příkldy. 1. Euklidovský prostor R je úplný, kždá cuchyovská posloupnost
4. přednášk 22. říjn 2007 Úplné metrické prostory. Metrický prostor (M, d) je úplný, když kždá cuchyovská posloupnost bodů v M konverguje. Příkldy. 1. Euklidovský prostor R je úplný, kždá cuchyovská posloupnost
Jak již bylo uvedeno v předcházející kapitole, můžeme při výpočtu určitých integrálů ze složitějších funkcí postupovat v zásadě dvěma způsoby:
 .. Substituční metod pro určité integrály.. Substituční metod pro určité integrály Cíle Seznámíte se s použitím substituční metody při výpočtu určitých integrálů. Zákldní typy integrálů, které lze touto
.. Substituční metod pro určité integrály.. Substituční metod pro určité integrály Cíle Seznámíte se s použitím substituční metody při výpočtu určitých integrálů. Zákldní typy integrálů, které lze touto
Matice. a B =...,...,...,...,..., prvků z tělesa T (tímto. Definice: Soubor A = ( a. ...,..., ra
 Definice: Soubor A ( i j ) Mtice 11 12 1n 21 22 2n m 1 m2 prvků z těles T (tímto tělesem T bude v nší prxi nejčstěji těleso reálných čísel R resp těleso rcionálních čísel Q či těleso komplexních čísel
Definice: Soubor A ( i j ) Mtice 11 12 1n 21 22 2n m 1 m2 prvků z těles T (tímto tělesem T bude v nší prxi nejčstěji těleso reálných čísel R resp těleso rcionálních čísel Q či těleso komplexních čísel
OBECNÝ URČITÝ INTEGRÁL
 OBECNÝ URČITÝ INTEGRÁL Zobecnění Newtonov nebo Riemnnov integrálu se definují různým způsobem dostnou se někdy různé, někdy stejné pojmy. V tomto textu bude postup volen jko zobecnění Newtonov integrálu,
OBECNÝ URČITÝ INTEGRÁL Zobecnění Newtonov nebo Riemnnov integrálu se definují různým způsobem dostnou se někdy různé, někdy stejné pojmy. V tomto textu bude postup volen jko zobecnění Newtonov integrálu,
Zkoušku snadno provedeme tak, že do soustavy (1), která je ekvivalentní dané soustavě rovnic, dosadíme příslušné hodnoty s a p.
 1. V oboru reálných čísel řešte soustvu rovnic x 2 xy + y 2 = 7, x 2 y + xy 2 = 2. (J. Földes) Řešení. Protože druhou rovnici můžeme uprvit n tvr xy(x + y) = 2, uprvme podobně i první rovnici: (x + y)
1. V oboru reálných čísel řešte soustvu rovnic x 2 xy + y 2 = 7, x 2 y + xy 2 = 2. (J. Földes) Řešení. Protože druhou rovnici můžeme uprvit n tvr xy(x + y) = 2, uprvme podobně i první rovnici: (x + y)
DERIVACE A INTEGRÁLY VE FYZICE
 DOPLŇKOVÉ TEXTY BB0 PAVEL SCHAUER INTERNÍ MATERIÁL FAST VUT V BRNĚ DERIVACE A INTEGRÁLY VE FYZICE Obsh Derivce... Definice derivce... Prciální derivce... Derivce vektorů... Výpočt derivcí... 3 Algebrická
DOPLŇKOVÉ TEXTY BB0 PAVEL SCHAUER INTERNÍ MATERIÁL FAST VUT V BRNĚ DERIVACE A INTEGRÁLY VE FYZICE Obsh Derivce... Definice derivce... Prciální derivce... Derivce vektorů... Výpočt derivcí... 3 Algebrická
Příklad 22 : Kapacita a rozložení intenzity elektrického pole v deskovém kondenzátoru s jednoduchým dielektrikem
 Příkld 22 : Kpcit rozložení intenzity elektrického pole v deskovém kondenzátoru s jednoduchým dielektrikem Předpokládné znlosti: Elektrické pole mezi dvěm nbitými rovinmi Příkld 2 Kpcit kondenzátoru je
Příkld 22 : Kpcit rozložení intenzity elektrického pole v deskovém kondenzátoru s jednoduchým dielektrikem Předpokládné znlosti: Elektrické pole mezi dvěm nbitými rovinmi Příkld 2 Kpcit kondenzátoru je
V předchozích kapitolách byla popsána inverzní operace k derivování. Zatím nebylo jasné, k čemu tento nástroj slouží.
 NEWTONŮV INTEGRÁL V předchozích kpitolách byl popsán inverzní operce k derivování Ztím nebylo jsné, k čemu tento nástroj slouží Uvžujme trmvj, která je poháněn elektřinou při brždění vyrábí dynmem elektřinu:
NEWTONŮV INTEGRÁL V předchozích kpitolách byl popsán inverzní operce k derivování Ztím nebylo jsné, k čemu tento nástroj slouží Uvžujme trmvj, která je poháněn elektřinou při brždění vyrábí dynmem elektřinu:
x + F F x F (x, f(x)).
 I. Funkce dvou více reálných proměnných 8. Implicitně dné funkce. Budeme se zbývt úlohou, kdy funkce není zdná přímo předpisem, který vyjdřuje závislost její hodnoty n hodnotách proměnných. Jeden z možných
I. Funkce dvou více reálných proměnných 8. Implicitně dné funkce. Budeme se zbývt úlohou, kdy funkce není zdná přímo předpisem, který vyjdřuje závislost její hodnoty n hodnotách proměnných. Jeden z možných
(1) přičemž všechny veličiny uvažujeme absolutně. Její úpravou získáme vztah + =, (2) Přímé zvětšení Z je dáno vztahem Z = =, a a
 Úloh č. 3 Měření ohniskové vzdálenosti tenkých čoček 1) Pomůcky: optická lvice, předmět s průhledným milimetrovým měřítkem, milimetrové měřítko, stínítko, tenká spojk, tenká rozptylk, zdroj světl. ) Teorie:
Úloh č. 3 Měření ohniskové vzdálenosti tenkých čoček 1) Pomůcky: optická lvice, předmět s průhledným milimetrovým měřítkem, milimetrové měřítko, stínítko, tenká spojk, tenká rozptylk, zdroj světl. ) Teorie:
2. Funkční řady Studijní text. V předcházející kapitole jsme uvažovali řady, jejichž členy byla reálná čísla. Nyní se budeme zabývat studiem
 2. Funkční řd Studijní text 2. Funkční řd V předcházející kpitole jsme uvžovli řd, jejichž člen bl reálná čísl. Nní se budeme zbývt studiem obecnějšího přípdu, kd člen řd tvoří reálné funkce. Definice
2. Funkční řd Studijní text 2. Funkční řd V předcházející kpitole jsme uvžovli řd, jejichž člen bl reálná čísl. Nní se budeme zbývt studiem obecnějšího přípdu, kd člen řd tvoří reálné funkce. Definice
NEWTONŮV INTEGRÁL. V předchozích kapitolách byla popsána inverzní operace k derivování. Zatím nebylo jasné, k čemu tento nástroj slouží.
 NEWTONŮV INTEGRÁL V předchozích kpitolách byl popsán inverzní operce k derivování. Ztím nebylo jsné, k čemu tento nástroj slouží. Uvžujme trmvj, která je poháněn elektřinou při brždění vyrábí dynmem elektřinu:
NEWTONŮV INTEGRÁL V předchozích kpitolách byl popsán inverzní operce k derivování. Ztím nebylo jsné, k čemu tento nástroj slouží. Uvžujme trmvj, která je poháněn elektřinou při brždění vyrábí dynmem elektřinu:
Jsou to rovnice, které obsahují neznámou nebo výraz s neznámou jako argument logaritmické funkce.
 Logritmické rovnice Jsou to rovnice, které oshují neznámou neo výrz s neznámou jko rgument ritmické funkce. Zákldní rovnice, 0 řešíme pomocí vzthu. Složitější uprvit n f g potom f g (protože ritmická funkce
Logritmické rovnice Jsou to rovnice, které oshují neznámou neo výrz s neznámou jko rgument ritmické funkce. Zákldní rovnice, 0 řešíme pomocí vzthu. Složitější uprvit n f g potom f g (protože ritmická funkce
( t) ( t) ( t) Nerovnice pro polorovinu. Předpoklady: 7306
 7.3.8 Nerovnice pro polorovinu Předpokldy: 736 Pedgogická poznámk: Příkld 1 není pro dlší průěh hodiny důležitý, má smysl pouze jko opkování zplnění čsu při zpisování do třídnice. Nemá smysl kvůli němu
7.3.8 Nerovnice pro polorovinu Předpokldy: 736 Pedgogická poznámk: Příkld 1 není pro dlší průěh hodiny důležitý, má smysl pouze jko opkování zplnění čsu při zpisování do třídnice. Nemá smysl kvůli němu
+ c. n x ( ) ( ) f x dx ln f x c ) a. x x. dx = cotgx + c. A x. A x A arctgx + A x A c
 ) INTEGRÁLNÍ POČET FUNKCE JEDNÉ PROMĚNNÉ ) Pojem neurčitého integrálu Je dán funkce Pltí všk tké F tk, y pltilo F ( ) f ( ) Zřejmě F ( ), protože pltí, 5,, oecně c, kde c je liovolná kon- stnt f ( ) nším
) INTEGRÁLNÍ POČET FUNKCE JEDNÉ PROMĚNNÉ ) Pojem neurčitého integrálu Je dán funkce Pltí všk tké F tk, y pltilo F ( ) f ( ) Zřejmě F ( ), protože pltí, 5,, oecně c, kde c je liovolná kon- stnt f ( ) nším
URČITÝ INTEGRÁL FUNKCE
 URČITÝ INTEGRÁL FUNKCE Formulce: Nším cílem je určit přibližnou hodnotu určitého integrálu I() = () d, kde předpokládáme, že unkce je n intervlu, b integrovtelná. Poznámk: Geometrický význm integrálu I()
URČITÝ INTEGRÁL FUNKCE Formulce: Nším cílem je určit přibližnou hodnotu určitého integrálu I() = () d, kde předpokládáme, že unkce je n intervlu, b integrovtelná. Poznámk: Geometrický význm integrálu I()
2.1 - ( ) ( ) (020201) [ ] [ ]
![2.1 - ( ) ( ) (020201) [ ] [ ] 2.1 - ( ) ( ) (020201) [ ] [ ]](/thumbs/102/155984102.jpg) - FUNKCE A ROVNICE Následující zákldní znlosti je nezbytně nutné umět od okmžiku probrání ž do konce studi mtemtiky n gymnáziu. Vyždováno bude porozumění schopnost plikovt ne pouze mechnicky zopkovt. Některé
- FUNKCE A ROVNICE Následující zákldní znlosti je nezbytně nutné umět od okmžiku probrání ž do konce studi mtemtiky n gymnáziu. Vyždováno bude porozumění schopnost plikovt ne pouze mechnicky zopkovt. Některé
ANALYTICKÁ GEOMETRIE V PROSTORU
 ANALYTICKÁ GEOMETRIE V PROSTORU 3. přednášk Vektorová lger Prvoúhlé souřdnice odu v prostoru Poloh odu v prostoru je vzhledem ke třem osám k soě kolmým určen třemi souřdnicemi, které tvoří uspořádnou trojici
ANALYTICKÁ GEOMETRIE V PROSTORU 3. přednášk Vektorová lger Prvoúhlé souřdnice odu v prostoru Poloh odu v prostoru je vzhledem ke třem osám k soě kolmým určen třemi souřdnicemi, které tvoří uspořádnou trojici
Ohýbaný nosník - napětí
 Pružnost pevnost BD0 Ohýbný nosník - npětí Teorie Prostý ohb, rovinný ohb Při prostém ohbu je průřez nmáhán ohbovým momentem otáčejícím kolem jedné z hlvních os setrvčnosti průřezu, obvkle os. oment se
Pružnost pevnost BD0 Ohýbný nosník - npětí Teorie Prostý ohb, rovinný ohb Při prostém ohbu je průřez nmáhán ohbovým momentem otáčejícím kolem jedné z hlvních os setrvčnosti průřezu, obvkle os. oment se
1.1 Numerické integrování
 1.1 Numerické integrování 1.1.1 Úvodní úvhy Nším cílem bude přibližný numerický výpočet určitého integrálu I = f(x)dx. (1.1) Je-li znám k integrovné funkci f primitivní funkce F (F (x) = f(x)), můžeme
1.1 Numerické integrování 1.1.1 Úvodní úvhy Nším cílem bude přibližný numerický výpočet určitého integrálu I = f(x)dx. (1.1) Je-li znám k integrovné funkci f primitivní funkce F (F (x) = f(x)), můžeme
VIII. Primitivní funkce a Riemannův integrál
 VIII. Primitivní funkce Riemnnův integrál VIII.2. Riemnnův integrál opkování Vět. Nechť f je spojitá funkce n intervlu, b nechť c, b. Oznčíme-li F (x) = x (, b), pk F (x) = f(x) pro kždé x (, b). VIII.3.
VIII. Primitivní funkce Riemnnův integrál VIII.2. Riemnnův integrál opkování Vět. Nechť f je spojitá funkce n intervlu, b nechť c, b. Oznčíme-li F (x) = x (, b), pk F (x) = f(x) pro kždé x (, b). VIII.3.
Souhrn základních výpočetních postupů v Excelu probíraných v AVT 04-05 listopad 2004. r r. . b = A
 Souhrn zákldních výpočetních postupů v Ecelu probírných v AVT 04-05 listopd 2004. Řešení soustv lineárních rovnic Soustv lineárních rovnic ve tvru r r A. = b tj. npř. pro 3 rovnice o 3 neznámých 2 3 Hodnoty
Souhrn zákldních výpočetních postupů v Ecelu probírných v AVT 04-05 listopd 2004. Řešení soustv lineárních rovnic Soustv lineárních rovnic ve tvru r r A. = b tj. npř. pro 3 rovnice o 3 neznámých 2 3 Hodnoty
NMAF061, ZS Písemná část zkoušky 25. leden 2018
 Jednotlivé kroky při výpočtech stručně, le co nejpřesněji odůvodněte. Pokud používáte nějké tvrzení, nezpomeňte ověřit splnění předpokldů. Jméno příjmení: Skupin: Příkld 3 4 5 6 Celkem bodů Bodů 6 6 4
Jednotlivé kroky při výpočtech stručně, le co nejpřesněji odůvodněte. Pokud používáte nějké tvrzení, nezpomeňte ověřit splnění předpokldů. Jméno příjmení: Skupin: Příkld 3 4 5 6 Celkem bodů Bodů 6 6 4
INTEGRACE KOMPLEXNÍ FUNKCE KŘIVKOVÝ INTEGRÁL
 INTEGRAE KOMPLEXNÍ FUNKE KŘIVKOVÝ INTEGRÁL N konci kpitoly o derivci je uveden souvislost existence derivce s potenciálním polem. Existuje dlší chrkterizce potenciálného pole, která nebyl v kpitole o derivci
INTEGRAE KOMPLEXNÍ FUNKE KŘIVKOVÝ INTEGRÁL N konci kpitoly o derivci je uveden souvislost existence derivce s potenciálním polem. Existuje dlší chrkterizce potenciálného pole, která nebyl v kpitole o derivci
Větu o spojitosti a jejich užití
 0..7 Větu o spojitosti jejich užití Předpokldy: 706, 78, 006 Pedgogická poznámk: Při proírání této hodiny je tře mít n pměti, že všechny věty, které studentům sdělujete z jejich pohledu neuvěřitelně složitě
0..7 Větu o spojitosti jejich užití Předpokldy: 706, 78, 006 Pedgogická poznámk: Při proírání této hodiny je tře mít n pměti, že všechny věty, které studentům sdělujete z jejich pohledu neuvěřitelně složitě
56. ročník Matematické olympiády. b 1,2 = 27 ± c 2 25
 56. ročník Mtemtické olympiády Úlohy domácí části I. kol ktegorie 1. Njděte všechny dvojice (, ) celých čísel, jež vyhovují rovnici + 7 + 6 + 5 + 4 + = 0. Řešení. Rovnici řešíme jko kvdrtickou s neznámou
56. ročník Mtemtické olympiády Úlohy domácí části I. kol ktegorie 1. Njděte všechny dvojice (, ) celých čísel, jež vyhovují rovnici + 7 + 6 + 5 + 4 + = 0. Řešení. Rovnici řešíme jko kvdrtickou s neznámou
3. Kvadratické rovnice
 CZ..07/..08/0.0009. Kvdrtické rovnice se v tetice oznčuje lgebrická rovnice druhého stupně, tzn. rovnice o jedné neznáé, ve které neznáá vystupuje ve druhé ocnině (²). V zákldní tvru vypdá následovně:
CZ..07/..08/0.0009. Kvdrtické rovnice se v tetice oznčuje lgebrická rovnice druhého stupně, tzn. rovnice o jedné neznáé, ve které neznáá vystupuje ve druhé ocnině (²). V zákldní tvru vypdá následovně:
13. Exponenciální a logaritmická funkce
 @11 1. Eponenciální logritmická funkce Mocninná funkce je pro r libovolné nenulové reálné číslo dán předpisem f: y = r, r R, >0 Eponent r je konstnt je nezávisle proměnná. Definičním oborem jsou pouze
@11 1. Eponenciální logritmická funkce Mocninná funkce je pro r libovolné nenulové reálné číslo dán předpisem f: y = r, r R, >0 Eponent r je konstnt je nezávisle proměnná. Definičním oborem jsou pouze
Hlavní body - magnetismus
 Mgnetismus Hlvní body - mgnetismus Projevy mgt. pole Zdroje mgnetického pole Zákldní veličiny popisující mgt. pole Mgnetické pole proudovodiče - Biotův Svrtův zákon Mgnetické vlstnosti látek Projevy mgnetického
Mgnetismus Hlvní body - mgnetismus Projevy mgt. pole Zdroje mgnetického pole Zákldní veličiny popisující mgt. pole Mgnetické pole proudovodiče - Biotův Svrtův zákon Mgnetické vlstnosti látek Projevy mgnetického
je jedna z orientací určena jeho parametrizací. Je to ta, pro kterou je počátečním bodem bod ϕ(a). Im k.b.(c ) ( C ) (C ) Obr Obr. 3.5.
 10. Komplexní funkce reálné proměnné. Křivky. Je-li f : (, b) C, pk lze funkci f povžovt z dvojici (u, v), kde u = Re f v = Im f. Rozdíl proti vektorovému poli je v tom, že jsou pro komplexní čísl definovány
10. Komplexní funkce reálné proměnné. Křivky. Je-li f : (, b) C, pk lze funkci f povžovt z dvojici (u, v), kde u = Re f v = Im f. Rozdíl proti vektorovému poli je v tom, že jsou pro komplexní čísl definovány
Definice limit I
 08 Definice limit I Předpokld: 006 Pedgogická poznámk: N úvod je třeb upozornit, že tto hodin je ze strn studentů snd nejvíce sbotovnou látkou z celé studium (podle rekcí 4B009) Jejich ochot brát n vědomí
08 Definice limit I Předpokld: 006 Pedgogická poznámk: N úvod je třeb upozornit, že tto hodin je ze strn studentů snd nejvíce sbotovnou látkou z celé studium (podle rekcí 4B009) Jejich ochot brát n vědomí
Diferenciální počet. Spojitost funkce
 Dierenciální počet Spojitost unkce Co to znmená, že unkce je spojitá? Jký je mtemtický význm tvrzení, že gr unkce je spojitý? Jké jsou vlstnosti unkce v bodě? Jké jsou vlstnosti unkce v intervlu I? Vlstnosti
Dierenciální počet Spojitost unkce Co to znmená, že unkce je spojitá? Jký je mtemtický význm tvrzení, že gr unkce je spojitý? Jké jsou vlstnosti unkce v bodě? Jké jsou vlstnosti unkce v intervlu I? Vlstnosti
KŘIVKOVÉ INTEGRÁLY. Křivka v prostoru je popsána spojitými funkcemi ϕ, ψ, τ : [a, b] R jako množina bodů {(ϕ(t), ψ(t), τ(t)); t
![KŘIVKOVÉ INTEGRÁLY. Křivka v prostoru je popsána spojitými funkcemi ϕ, ψ, τ : [a, b] R jako množina bodů {(ϕ(t), ψ(t), τ(t)); t KŘIVKOVÉ INTEGRÁLY. Křivka v prostoru je popsána spojitými funkcemi ϕ, ψ, τ : [a, b] R jako množina bodů {(ϕ(t), ψ(t), τ(t)); t](/thumbs/88/114636682.jpg) KŘIVKOVÉ INTEGRÁLY Má-li se spočítt npř. spotřeb betonu n rovný plot s měnící se výškou, stčí spočítt integrál z této výšky podle zákldny plotu. o když je le zákldnou plotu nikoli rovná úsečk, le křivá
KŘIVKOVÉ INTEGRÁLY Má-li se spočítt npř. spotřeb betonu n rovný plot s měnící se výškou, stčí spočítt integrál z této výšky podle zákldny plotu. o když je le zákldnou plotu nikoli rovná úsečk, le křivá
4. cvičení z Matematiky 2
 4. cvičení z Mtemtiky 2 14.-18. březn 2016 4.1 Njděte ity (i (ii (iii (iv 2 +(y 1 2 +1 1 2 +(y 1 2 z 2 y 2 z yz 1 2 y 2 (,y (0,0 2 +y 2 2 y 2 (,y (0,0 2 +y 3 (i Pro funkci f(, y = 2 +(y 1 2 +1 1 2 +(y
4. cvičení z Mtemtiky 2 14.-18. březn 2016 4.1 Njděte ity (i (ii (iii (iv 2 +(y 1 2 +1 1 2 +(y 1 2 z 2 y 2 z yz 1 2 y 2 (,y (0,0 2 +y 2 2 y 2 (,y (0,0 2 +y 3 (i Pro funkci f(, y = 2 +(y 1 2 +1 1 2 +(y
integrovat. Obecně lze ale říct, že pokud existuje určitý integrál funkce podle různých definic, má pro všechny takové definice stejnou hodnotu.
 Přednášk 1 Určitý integrál V této přednášce se budeme zbývt určitým integrálem. Eistuje několik definic určitého integrálu funkce jedné reálné proměnné. Jednotlivé integrály se liší v tom, jké funkce lze
Přednášk 1 Určitý integrál V této přednášce se budeme zbývt určitým integrálem. Eistuje několik definic určitého integrálu funkce jedné reálné proměnné. Jednotlivé integrály se liší v tom, jké funkce lze
ZÁKLADY. y 1 + y 2 dx a. kde y je hledanou funkcí proměnné x.
 VARIAČNÍ POČET ZÁKLADY V prxi se čsto hledjí křivky nebo plochy, které minimlizují nebo mximlizují jisté hodnoty. Npř. se hledá nejkrtší spojnice dvou bodů n dné ploše, nebo tvr zvěšeného ln (má minimální
VARIAČNÍ POČET ZÁKLADY V prxi se čsto hledjí křivky nebo plochy, které minimlizují nebo mximlizují jisté hodnoty. Npř. se hledá nejkrtší spojnice dvou bodů n dné ploše, nebo tvr zvěšeného ln (má minimální
Komplexní čísla tedy násobíme jako dvojčleny s tím, že použijeme vztah i 2 = 1. = (a 1 + ia 2 )(b 1 ib 2 ) b 2 1 + b2 2.
 7 Komplexní čísl 71 Komplexní číslo je uspořádná dvojice reálných čísel Komplexní číslo = 1, ) zprvidl zpisujeme v tzv lgebrickém tvru = 1 + i, kde i je imginární jednotk, pro kterou pltí i = 1 Číslo 1
7 Komplexní čísl 71 Komplexní číslo je uspořádná dvojice reálných čísel Komplexní číslo = 1, ) zprvidl zpisujeme v tzv lgebrickém tvru = 1 + i, kde i je imginární jednotk, pro kterou pltí i = 1 Číslo 1
26. listopadu a 10.prosince 2016
 Integrální počet Přednášk 4 5 26. listopdu 10.prosince 2016 Obsh 1 Neurčitý integrál Tbulkové integrály Substituční metod Metod per-prtes 2 Určitý integrál Geometrické plikce Fyzikální plikce K čemu integrální
Integrální počet Přednášk 4 5 26. listopdu 10.prosince 2016 Obsh 1 Neurčitý integrál Tbulkové integrály Substituční metod Metod per-prtes 2 Určitý integrál Geometrické plikce Fyzikální plikce K čemu integrální
Až dosud jsme se zabývali většinou reálnými posloupnostmi, tedy zobrazeními s definičním
 Limit funkce. Zákldní pojmy Až dosud jsme se zbývli většinou reálnými posloupnostmi, tedy zobrzeními s definičním oborem N. Nyní obrátíme svou pozornost n širší třídu zobrzení. Definice.. Zobrzení f, jehož
Limit funkce. Zákldní pojmy Až dosud jsme se zbývli většinou reálnými posloupnostmi, tedy zobrzeními s definičním oborem N. Nyní obrátíme svou pozornost n širší třídu zobrzení. Definice.. Zobrzení f, jehož
Křivkový integrál funkce
 Kpitol 6 Křivkový integrál funkce efinice způsob výpočtu Hlvním motivem pro definici určitého integrálu funkce jedné proměnné byl úloh stnovit obsh oblsti omezené grfem dné funkce intervlem n ose x. Řd
Kpitol 6 Křivkový integrál funkce efinice způsob výpočtu Hlvním motivem pro definici určitého integrálu funkce jedné proměnné byl úloh stnovit obsh oblsti omezené grfem dné funkce intervlem n ose x. Řd
Matematika 1A. PetrSalačaJiříHozman Fakulta přírodovědně-humanitní a pedagogická Technická univerzita v Liberci
 Mtemtik 1A. PetrSlčJiříHozmn Fkult přírodovědně-humnitní pedgogická Technická univerzit v Liberci petr.slc@tul.cz jiri.hozmn@tul.cz 21.11.2016 Fkult přírodovědně-humnitní pedgogická TUL ZS 2016-2017 1/
Mtemtik 1A. PetrSlčJiříHozmn Fkult přírodovědně-humnitní pedgogická Technická univerzit v Liberci petr.slc@tul.cz jiri.hozmn@tul.cz 21.11.2016 Fkult přírodovědně-humnitní pedgogická TUL ZS 2016-2017 1/
Logaritmická funkce teorie
 Výukový mteriál pro předmět: MATEMATIKA reg. č. projektu CZ..07/..0/0.0007 Logritmická funkce teorie Eponenciální funkce je funkce prostá, proto k ní eistuje inverzní funkce. Tto inverzní funkce se nzývá
Výukový mteriál pro předmět: MATEMATIKA reg. č. projektu CZ..07/..0/0.0007 Logritmická funkce teorie Eponenciální funkce je funkce prostá, proto k ní eistuje inverzní funkce. Tto inverzní funkce se nzývá
14. cvičení z Matematické analýzy 2
 4. cvičení z temtické nlýzy 2 22. - 26. květn 27 4. Greenov vět) Použijte Greenovu větu k nlezení práce síly F x, y) 2xy, 4x 2 y 2 ) vykonné n částici podél křivky, která je hrnicí oblsti ohrničené křivkmi
4. cvičení z temtické nlýzy 2 22. - 26. květn 27 4. Greenov vět) Použijte Greenovu větu k nlezení práce síly F x, y) 2xy, 4x 2 y 2 ) vykonné n částici podél křivky, která je hrnicí oblsti ohrničené křivkmi
4.4.3 Kosinová věta. Předpoklady:
 443 Kosinová vět Předpokldy 44 Př Rozhodni zd dokážeme spočítt zývjíí strny úhly u všeh trojúhelníků zdnýh pomoí trojie prvků (délek strn velikostí úhlů) V sinové větě vystupují dvě dvojie strn-protější
443 Kosinová vět Předpokldy 44 Př Rozhodni zd dokážeme spočítt zývjíí strny úhly u všeh trojúhelníků zdnýh pomoí trojie prvků (délek strn velikostí úhlů) V sinové větě vystupují dvě dvojie strn-protější
Křivkový integrál prvního druhu verze 1.0
 Křivkový integrál prvního druhu verze. Úvod Následující text popisuje výpočet křivkového integrálu prvního druhu. Měl by sloužit především studentům předmětu MATEMAT k příprvě n zkoušku. Mohou se v něm
Křivkový integrál prvního druhu verze. Úvod Následující text popisuje výpočet křivkového integrálu prvního druhu. Měl by sloužit především studentům předmětu MATEMAT k příprvě n zkoušku. Mohou se v něm
Logaritmické rovnice I
 .9.9 Logritmické rovnice I Předpokldy: 95 Pedgogická poznámk: Stejně jko u eponenciálních rovnic rozkldů n součin bereme ritmické rovnice jko nácvik výběru metody. Sestvujeme si rzenál metod n konci máme
.9.9 Logritmické rovnice I Předpokldy: 95 Pedgogická poznámk: Stejně jko u eponenciálních rovnic rozkldů n součin bereme ritmické rovnice jko nácvik výběru metody. Sestvujeme si rzenál metod n konci máme
R n výběr reprezentantů. Řekneme, že funkce f je Riemannovsky integrovatelná na
 Mtemtik II. Určitý integrál.1. Pojem Riemnnov určitého integrálu Definice.1.1. Říkáme, že funkce f( x ) je n intervlu integrovtelná (schopná integrce), je-li n něm ohrničená spoň po částech spojitá.
Mtemtik II. Určitý integrál.1. Pojem Riemnnov určitého integrálu Definice.1.1. Říkáme, že funkce f( x ) je n intervlu integrovtelná (schopná integrce), je-li n něm ohrničená spoň po částech spojitá.
NMAF061, ZS Písemná část zkoušky 16. leden 2018
 Jednotlivé kroky při výpočtech stručně, le co nejpřesněji odůvodněte. Pokud používáte nějké tvrzení, nezpomeňte ověřit splnění předpokldů. Jméno příjmení: Skupin: Příkld 1 3 4 5 6 Celkem bodů Bodů 7 6
Jednotlivé kroky při výpočtech stručně, le co nejpřesněji odůvodněte. Pokud používáte nějké tvrzení, nezpomeňte ověřit splnění předpokldů. Jméno příjmení: Skupin: Příkld 1 3 4 5 6 Celkem bodů Bodů 7 6
2.5.9 Vztahy mezi kořeny a koeficienty kvadratické rovnice
 59 Vzth mezi kořen koefiient kvdrtiké rovnie Předpokld:, 57, 58 Pedgogiká poznámk: Náplň zřejmě přeshuje možnost jedné vučoví hodin Příkld 8 9 zůstávjí n vičení nebo polovinu hodin při píseme + b + - zákldní
59 Vzth mezi kořen koefiient kvdrtiké rovnie Předpokld:, 57, 58 Pedgogiká poznámk: Náplň zřejmě přeshuje možnost jedné vučoví hodin Příkld 8 9 zůstávjí n vičení nebo polovinu hodin při píseme + b + - zákldní
2.5.9 Vztahy mezi kořeny a koeficienty kvadratické rovnice
 59 Vzth mezi kořen koefiient kvdrtiké rovnie Předpokld:, 57, 58 Pedgogiká poznámk: Náplň zřejmě přeshuje možnost jedné vučoví hodin Příkld 8 9 zůstávjí n vičení nebo polovinu hodin při píseme + b + - zákldní
59 Vzth mezi kořen koefiient kvdrtiké rovnie Předpokld:, 57, 58 Pedgogiká poznámk: Náplň zřejmě přeshuje možnost jedné vučoví hodin Příkld 8 9 zůstávjí n vičení nebo polovinu hodin při píseme + b + - zákldní
Úlohy školní klauzurní části I. kola kategorie C
 52. ročník mtemtické olympiády Úlohy školní kluzurní části I. kol ktegorie 1. Odtrhneme-li od libovolného lespoň dvojmístného přirozeného čísl číslici n místě jednotek, dostneme číslo o jednu číslici krtší.
52. ročník mtemtické olympiády Úlohy školní kluzurní části I. kol ktegorie 1. Odtrhneme-li od libovolného lespoň dvojmístného přirozeného čísl číslici n místě jednotek, dostneme číslo o jednu číslici krtší.
LDF MENDELU. Simona Fišnarová (MENDELU) Určitý integrál ZVMT lesnictví 1 / 26
 Určitý integrál Zákldy vyšší mtemtiky LDF MENDELU Podpořeno projektem Průřezová inovce studijních progrmů Lesnické dřevřské fkulty MENDELU v Brně (LDF) s ohledem n discipĺıny společného zákldu http://kdemie.ldf.mendelu.cz/cz
Určitý integrál Zákldy vyšší mtemtiky LDF MENDELU Podpořeno projektem Průřezová inovce studijních progrmů Lesnické dřevřské fkulty MENDELU v Brně (LDF) s ohledem n discipĺıny společného zákldu http://kdemie.ldf.mendelu.cz/cz
1. LINEÁRNÍ ALGEBRA 1.1. Matice
 Lineární lgebr LINEÁRNÍ LGEBR Mtice Zákldní pojmy Mticí typu m/n nzýváme schém mn prvků, které jsou uspořádány do m řádků n sloupců: n n m/n = = = ( ij ) m m mn V tomto schémtu pro řádky sloupce užíváme
Lineární lgebr LINEÁRNÍ LGEBR Mtice Zákldní pojmy Mticí typu m/n nzýváme schém mn prvků, které jsou uspořádány do m řádků n sloupců: n n m/n = = = ( ij ) m m mn V tomto schémtu pro řádky sloupce užíváme
Integrální počet - IV. část (aplikace na určitý vlastní integrál, nevlastní integrál)
 Integrální počet - IV. část (plikce n určitý vlstní integrál, nevlstní integrál) Michl Fusek Ústv mtemtiky FEKT VUT, fusekmi@feec.vutbr.cz 9. přednášk z AMA Michl Fusek (fusekmi@feec.vutbr.cz) / 4 Obsh
Integrální počet - IV. část (plikce n určitý vlstní integrál, nevlstní integrál) Michl Fusek Ústv mtemtiky FEKT VUT, fusekmi@feec.vutbr.cz 9. přednášk z AMA Michl Fusek (fusekmi@feec.vutbr.cz) / 4 Obsh
Neurčité výrazy
 .. Neurčité výrzy Předpokldy: Př. : Vypočti ity: ) d) ) d) neeistuje,, Zjímvé. Získli jsme čtyři nprosto rozdílné výsledky, přestože přímým doszením do všech výrzů získáme to smé: výrz může při výpočtu
.. Neurčité výrzy Předpokldy: Př. : Vypočti ity: ) d) ) d) neeistuje,, Zjímvé. Získli jsme čtyři nprosto rozdílné výsledky, přestože přímým doszením do všech výrzů získáme to smé: výrz může při výpočtu
6. Setrvačný kmitový člen 2. řádu
 6. Setrvčný kmitový člen. řádu Nejprve uvedeme dynmické vlstnosti kmitvého členu neboli setrvčného členu. řádu. Předstviteli těchto členů jsou obvody nebo technická zřízení, která obshují dvě energetické
6. Setrvčný kmitový člen. řádu Nejprve uvedeme dynmické vlstnosti kmitvého členu neboli setrvčného členu. řádu. Předstviteli těchto členů jsou obvody nebo technická zřízení, která obshují dvě energetické
Nerovnosti a nerovnice
 Nerovnosti nerovnice Doc. RNDr. Leo Boček, CSc. Kurz vznikl v rámci projektu Rozvoj systému vzdělávcích příležitostí pro ndné žáky studenty v přírodních vědách mtemtice s využitím online prostředí, Operční
Nerovnosti nerovnice Doc. RNDr. Leo Boček, CSc. Kurz vznikl v rámci projektu Rozvoj systému vzdělávcích příležitostí pro ndné žáky studenty v přírodních vědách mtemtice s využitím online prostředí, Operční
17 Křivky v rovině a prostoru
 17 Křivky v rovině prostoru Definice 17.1 (rovinné křivky souvisejících pojmů). 1. Nechť F (t) [ϕ(t), ψ(t)] je 2-funkce spojitá n, b. Rovinnou křivkou nzveme množinu : {F (t) : t, b } R 2. 2-funkce F [ϕ,
17 Křivky v rovině prostoru Definice 17.1 (rovinné křivky souvisejících pojmů). 1. Nechť F (t) [ϕ(t), ψ(t)] je 2-funkce spojitá n, b. Rovinnou křivkou nzveme množinu : {F (t) : t, b } R 2. 2-funkce F [ϕ,
8. cvičení z Matematiky 2
 8. cvičení z Mtemtiky 2 11.-1. dubn 2016 8.1 Njděte tři pozitivní čísl jejichž součin je mximální, jejichž součet je roven 100. Zdání příkldu lze interpretovt tké tk, že hledáme mximální objem kvádru,
8. cvičení z Mtemtiky 2 11.-1. dubn 2016 8.1 Njděte tři pozitivní čísl jejichž součin je mximální, jejichž součet je roven 100. Zdání příkldu lze interpretovt tké tk, že hledáme mximální objem kvádru,
2.2.9 Grafické řešení rovnic a nerovnic
 ..9 Grfické řešení rovnic nerovnic Předpokldy: 0, 06 Př. : Řeš početně i grficky rovnici x + = x. Početně: Už umíme. x + = x x = x = K = { } Grficky: Kždá ze strn rovnice je výrzem pro lineární funkci
..9 Grfické řešení rovnic nerovnic Předpokldy: 0, 06 Př. : Řeš početně i grficky rovnici x + = x. Početně: Už umíme. x + = x x = x = K = { } Grficky: Kždá ze strn rovnice je výrzem pro lineární funkci
množina, na které je zavedena určitá struktura. Zejména, součet každých dvou prvků X = [x 1,..., x n ] R n,
![množina, na které je zavedena určitá struktura. Zejména, součet každých dvou prvků X = [x 1,..., x n ] R n, množina, na které je zavedena určitá struktura. Zejména, součet každých dvou prvků X = [x 1,..., x n ] R n,](/thumbs/99/140214707.jpg) Náplní předmětu bude klkulus R n R (přípdně R m ). Proč se zbývt funkcemi více proměnných? V prxi je čsto třeb uvžovt veličiny, které závisejí n více než jedné proměnné, npř. objem rotčního kužele závisí
Náplní předmětu bude klkulus R n R (přípdně R m ). Proč se zbývt funkcemi více proměnných? V prxi je čsto třeb uvžovt veličiny, které závisejí n více než jedné proměnné, npř. objem rotčního kužele závisí
Matematické metody v kartografii
 Mtemtické metody v krtogrfii. Přednášk Referenční elipsoid zákldní vzthy. Poloměry křivosti. Délky poledníkového rovnoběžkového oblouku. 1. Zákldní vzthy n rotčním elipoidu Rotční elipsoid dán následujícími
Mtemtické metody v krtogrfii. Přednášk Referenční elipsoid zákldní vzthy. Poloměry křivosti. Délky poledníkového rovnoběžkového oblouku. 1. Zákldní vzthy n rotčním elipoidu Rotční elipsoid dán následujícími
( ) ( ) Sinová věta II. β je úhel z intervalu ( 0;π ). Jak je vidět z jednotkové kružnice, úhly, pro které platí. Předpoklady:
 4.4. Sinová vět II Předpokldy 44 Kde se stl hy? Námi nlezené řešení je správné, le nenšli jsme druhé hy ve hvíli, kdy jsme z hodnoty sin β určovli úhel β. β je úhel z intervlu ( ;π ). Jk je vidět z jednotkové
4.4. Sinová vět II Předpokldy 44 Kde se stl hy? Námi nlezené řešení je správné, le nenšli jsme druhé hy ve hvíli, kdy jsme z hodnoty sin β určovli úhel β. β je úhel z intervlu ( ;π ). Jk je vidět z jednotkové
VIII. Primitivní funkce a Riemannův integrál
 VIII. Primitivní funkce Riemnnův integrál VIII.2. Primitivní funkce Definice. Nechť funkce f je definován n neprázdném otevřeném intervlu I. Řekneme, že funkce F : I R je primitivní funkce k f n intervlu
VIII. Primitivní funkce Riemnnův integrál VIII.2. Primitivní funkce Definice. Nechť funkce f je definován n neprázdném otevřeném intervlu I. Řekneme, že funkce F : I R je primitivní funkce k f n intervlu
{ } ( ) ( ) 2.5.8 Vztahy mezi kořeny a koeficienty kvadratické rovnice. Předpoklady: 2301, 2508, 2507
 58 Vzth mezi kořen koefiient kvdrtiké rovnie Předpokld:, 58, 57 Pedgogiká poznámk: Náplň zřejmě přeshuje možnost jedné vučoví hodin, příkld 8 9 zůstvjí n vičení neo polovinu hodin při píseme + + - zákldní
58 Vzth mezi kořen koefiient kvdrtiké rovnie Předpokld:, 58, 57 Pedgogiká poznámk: Náplň zřejmě přeshuje možnost jedné vučoví hodin, příkld 8 9 zůstvjí n vičení neo polovinu hodin při píseme + + - zákldní
M - Příprava na 3. zápočtový test pro třídu 2D
 M - Příprv n. ápočtový test pro třídu D Autor: Mgr. Jromír JUŘEK Kopírování jkékoliv dlší využití výukového mteriálu je povoleno poue s uvedením odku n www.jrjurek.c. VARIACE 1 Tento dokument byl kompletně
M - Příprv n. ápočtový test pro třídu D Autor: Mgr. Jromír JUŘEK Kopírování jkékoliv dlší využití výukového mteriálu je povoleno poue s uvedením odku n www.jrjurek.c. VARIACE 1 Tento dokument byl kompletně
Svazy. Def Svaz je algebra S ( M ;, ) = se dvěma binárními operacemi taková, že pro libovolné prvky c M platí následující podmínky axiomy svazu:
 vz je lgebr ( M ; ) vzy = se dvěm binárními opercemi tková že pro libovolné prvky b c M pltí následující podmínky xiomy svzu: ( b) c = ( b c) ( b) c = ( b c) b = b b = b ( ) ( ) b = b =. Operce se nzývá
vz je lgebr ( M ; ) vzy = se dvěm binárními opercemi tková že pro libovolné prvky b c M pltí následující podmínky xiomy svzu: ( b) c = ( b c) ( b) c = ( b c) b = b b = b ( ) ( ) b = b =. Operce se nzývá
( ) ( ) ( ) Exponenciální rovnice. 17.3. Řeš v R rovnici: 3 + 9 + 27 = ŘEŠENÍ: Postup z předešlého výpočtu doplníme využitím dalšího vztahu: ( ) t s t
 7. EXPONENCIÁLNÍ ROVNICE 7.. Řeš v R rovnice: ) 5 b) + c) 7 0 d) ( ) 0,5 ) 5 7 5 7 K { } c) 7 0 K d) ( ) b) + 0 + 0 K ( ) 5 0 5, 7 K { 5;7} Strtegie: potřebujeme zíkt tkový tvr rovnice, kd je n obou trnách
7. EXPONENCIÁLNÍ ROVNICE 7.. Řeš v R rovnice: ) 5 b) + c) 7 0 d) ( ) 0,5 ) 5 7 5 7 K { } c) 7 0 K d) ( ) b) + 0 + 0 K ( ) 5 0 5, 7 K { 5;7} Strtegie: potřebujeme zíkt tkový tvr rovnice, kd je n obou trnách
( ) 1.5.2 Mechanická práce II. Předpoklady: 1501
 1.5. Mechnická práce II Předpokldy: 1501 Př. 1: Těleso o hmotnosti 10 kg bylo vytženo pomocí provzu do výšky m ; poprvé rovnoměrným přímočrým pohybem, podruhé pohybem rovnoměrně zrychleným se zrychlením
1.5. Mechnická práce II Předpokldy: 1501 Př. 1: Těleso o hmotnosti 10 kg bylo vytženo pomocí provzu do výšky m ; poprvé rovnoměrným přímočrým pohybem, podruhé pohybem rovnoměrně zrychleným se zrychlením
m n. Matice typu m n má
 MATE ZS KONZ B Mtice, hodnost mtice, Gussův tvr Mtice uspořádné schém reálných čísel: m m n n mn Toto schém se nzývá mtice typu m řádků n sloupců. m n. Mtice typu m n má Oznčujeme ji A, B,někdy používáme
MATE ZS KONZ B Mtice, hodnost mtice, Gussův tvr Mtice uspořádné schém reálných čísel: m m n n mn Toto schém se nzývá mtice typu m řádků n sloupců. m n. Mtice typu m n má Oznčujeme ji A, B,někdy používáme
Definice. Nechť k 0 celé, a < b R. Definujeme. x < 1. ϕ(x) 0 v R. Lemma [Slabá formulace diferenciální rovnice.] x 2 1
![Definice. Nechť k 0 celé, a < b R. Definujeme. x < 1. ϕ(x) 0 v R. Lemma [Slabá formulace diferenciální rovnice.] x 2 1 Definice. Nechť k 0 celé, a < b R. Definujeme. x < 1. ϕ(x) 0 v R. Lemma [Slabá formulace diferenciální rovnice.] x 2 1](/thumbs/103/161289080.jpg) 9. Vriční počet. Definice. Nechť k 0 celé, < b R. Definujeme C k ([, b]) = { ỹ [,b] : ỹ C k (R) } ; C 0 ([, b]) = { y C ([, b]) : y() = y(b) = 0 }. Důležitá konstrukce. Shlzovcí funkce (molifiér, bump
9. Vriční počet. Definice. Nechť k 0 celé, < b R. Definujeme C k ([, b]) = { ỹ [,b] : ỹ C k (R) } ; C 0 ([, b]) = { y C ([, b]) : y() = y(b) = 0 }. Důležitá konstrukce. Shlzovcí funkce (molifiér, bump
6. a 7. března Úloha 1.1. Vypočtěte obsah obrazce ohraničeného parabolou y = 1 x 2 a osou x.
 KMA/MAT Přednášk cvičení č. 4, Určitý integrál 6. 7. březn 17 1 Aplikce určitého integrálu 1.1 Počáteční úvhy o výpočtu obshu geometrických útvrů v rovině Úloh 1.1. Vypočtěte obsh obrzce ohrničeného prbolou
KMA/MAT Přednášk cvičení č. 4, Určitý integrál 6. 7. březn 17 1 Aplikce určitého integrálu 1.1 Počáteční úvhy o výpočtu obshu geometrických útvrů v rovině Úloh 1.1. Vypočtěte obsh obrzce ohrničeného prbolou
Laboratorní práce č. 6 Úloha č. 5. Měření odporu, indukčnosti a vzájemné indukčnosti můstkovými metodami:
 Truhlář Michl 3 005 Lbortorní práce č 6 Úloh č 5 p 99,8kP Měření odporu, indukčnosti vzájemné indukčnosti můstkovými metodmi: Úkol: Whetstoneovým mostem změřte hodnoty odporů dvou rezistorů, jejich sériového
Truhlář Michl 3 005 Lbortorní práce č 6 Úloh č 5 p 99,8kP Měření odporu, indukčnosti vzájemné indukčnosti můstkovými metodmi: Úkol: Whetstoneovým mostem změřte hodnoty odporů dvou rezistorů, jejich sériového
Přehled základních vzorců pro Matematiku 2 1
 Přehled zákldních vzorců pro Mtemtiku 1 1. Limity funkcí definice Vlstní it v bodě = : f() = ɛ > 0, δ > 0 tk, že pro : ( δ, δ), pltí f() ( ɛ, ɛ) Vlstní it v bodě = : f() = ɛ > 0, c > 0 tk, že pro : > c,
Přehled zákldních vzorců pro Mtemtiku 1 1. Limity funkcí definice Vlstní it v bodě = : f() = ɛ > 0, δ > 0 tk, že pro : ( δ, δ), pltí f() ( ɛ, ɛ) Vlstní it v bodě = : f() = ɛ > 0, c > 0 tk, že pro : > c,
Úlohy krajského kola kategorie A
 67. ročník mtemtické olympiády Úlohy krjského kol ktegorie A 1. Pvel střídvě vpisuje křížky kolečk do políček tbulky (zčíná křížkem). Když je tbulk celá vyplněná, výsledné skóre spočítá jko rozdíl X O,
67. ročník mtemtické olympiády Úlohy krjského kol ktegorie A 1. Pvel střídvě vpisuje křížky kolečk do políček tbulky (zčíná křížkem). Když je tbulk celá vyplněná, výsledné skóre spočítá jko rozdíl X O,
A DIRACOVA DISTRIBUCE 1. δ(x) dx = 1, δ(x) = 0 pro x 0. (1) Graficky znázorňujeme Diracovu distribuci šipkou jednotkové velikosti (viz obr. 1).
 A DIRACOVA DISTRIBUCE A Dircov distribuce A Definice Dircovy distribuce Dircovu distribuci δx) lze zvést třemi ekvivlentními způsoby ) Dirc [] ji zvedl vzthy δx) dx, δx) pro x ) Grficky znázorňujeme Dircovu
A DIRACOVA DISTRIBUCE A Dircov distribuce A Definice Dircovy distribuce Dircovu distribuci δx) lze zvést třemi ekvivlentními způsoby ) Dirc [] ji zvedl vzthy δx) dx, δx) pro x ) Grficky znázorňujeme Dircovu
5.2. Určitý integrál Definice a vlastnosti
 Určitý intgrál Dfinic vlstnosti Má-li spojitá funkc f() n otvřném intrvlu I primitivní funkci F(), pk pro čísl, I j dfinován určitý intgrál funkc f() od do vzthm [,, 7: [ F( ) = F( ) F( ) f ( ) d = (6)
Určitý intgrál Dfinic vlstnosti Má-li spojitá funkc f() n otvřném intrvlu I primitivní funkci F(), pk pro čísl, I j dfinován určitý intgrál funkc f() od do vzthm [,, 7: [ F( ) = F( ) F( ) f ( ) d = (6)
II. 5. Aplikace integrálního počtu
 494 II Integrální počet funkcí jedné proměnné II 5 Aplikce integrálního počtu Geometrické plikce Určitý integrál S b fx) dx lze geometricky interpretovt jko obsh plochy vymezené grfem funkce f v intervlu
494 II Integrální počet funkcí jedné proměnné II 5 Aplikce integrálního počtu Geometrické plikce Určitý integrál S b fx) dx lze geometricky interpretovt jko obsh plochy vymezené grfem funkce f v intervlu
2.8.5 Lineární nerovnice s parametrem
 2.8.5 Lineární nerovnice s prmetrem Předpokldy: 2208, 2802 Pedgogická poznámk: Pokud v tom necháte studenty vykoupt (což je, zdá se, jediné rozumné řešení) zere tto látk tk jednu půl vyučovcí hodiny (první
2.8.5 Lineární nerovnice s prmetrem Předpokldy: 2208, 2802 Pedgogická poznámk: Pokud v tom necháte studenty vykoupt (což je, zdá se, jediné rozumné řešení) zere tto látk tk jednu půl vyučovcí hodiny (první
Integrální počet - III. část (určitý vlastní integrál)
 Integrální počet - III. část (určitý vlstní integrál) Michl Fusek Ústv mtemtiky FEKT VUT, fusekmi@feec.vutbr.cz 8. přednášk z AMA1 Michl Fusek (fusekmi@feec.vutbr.cz) 1 / 18 Obsh 1 Určitý vlstní (Riemnnův)
Integrální počet - III. část (určitý vlstní integrál) Michl Fusek Ústv mtemtiky FEKT VUT, fusekmi@feec.vutbr.cz 8. přednášk z AMA1 Michl Fusek (fusekmi@feec.vutbr.cz) 1 / 18 Obsh 1 Určitý vlstní (Riemnnův)
( a, { } Intervaly. Předpoklady: , , , Problém zapíšeme snadno i výčtem: { 2;3; 4;5}?
 1.3.8 Intervly Předpokldy: 010210, 010301, 010302, 010303 Problém Množinu A = { x Z;2 x 5} zpíšeme sndno i výčtem: { 2;3; 4;5} Jk zpst množinu B = { x R;2 x 5}? A =. Jde o nekonečně mnoho čísel (2, 5 všechno
1.3.8 Intervly Předpokldy: 010210, 010301, 010302, 010303 Problém Množinu A = { x Z;2 x 5} zpíšeme sndno i výčtem: { 2;3; 4;5} Jk zpst množinu B = { x R;2 x 5}? A =. Jde o nekonečně mnoho čísel (2, 5 všechno
Petriho sítě PES 2007/2008. ceska@fit.vutbr.cz. Doc. Ing. Tomáš Vojnar, Ph.D. vojnar@fit.vutbr.cz
 PES Petriho sítě p. 1/34 Petriho sítě PES 2007/2008 Prof. RNDr. Miln Češk, CS. esk@fit.vutr.z Do. Ing. Tomáš Vojnr, Ph.D. vojnr@fit.vutr.z Sz: Ing. Petr Novosd, Do. Ing. Tomáš Vojnr, Ph.D. (verze 06.04.2010)
PES Petriho sítě p. 1/34 Petriho sítě PES 2007/2008 Prof. RNDr. Miln Češk, CS. esk@fit.vutr.z Do. Ing. Tomáš Vojnr, Ph.D. vojnr@fit.vutr.z Sz: Ing. Petr Novosd, Do. Ing. Tomáš Vojnr, Ph.D. (verze 06.04.2010)
P2 Číselné soustavy, jejich převody a operace v čís. soustavách
 P Číselné soustvy, jejich převody operce v čís. soustvách. Zobrzení čísl v libovolné číselné soustvě Lidé využívjí ve svém životě pro zápis čísel desítkovou soustvu. V této soustvě máme pro zápis čísel
P Číselné soustvy, jejich převody operce v čís. soustvách. Zobrzení čísl v libovolné číselné soustvě Lidé využívjí ve svém životě pro zápis čísel desítkovou soustvu. V této soustvě máme pro zápis čísel
ÚVOD DO TERMODYNAMIKY
 ÚVOD DO TERMODYNAMIKY Termodynamika: Nauka o obecných zákonitostech, kterými se se řídí transformace CELKOVÉ energie makroskopických systémů v její různé formy. Je založena na výsledcích experimentílních
ÚVOD DO TERMODYNAMIKY Termodynamika: Nauka o obecných zákonitostech, kterými se se řídí transformace CELKOVÉ energie makroskopických systémů v její různé formy. Je založena na výsledcích experimentílních
Integrální počet - II. část (určitý integrál a jeho aplikace)
 Integrální počet - II. část (určitý integrál jeho plikce) Michl Fusek Ústv mtemtiky FEKT VUT, fusekmi@feec.vutbr.cz 7. přednášk z ESMAT Michl Fusek (fusekmi@feec.vutbr.cz) 1 / 23 Obsh 1 Určitý vlstní (Riemnnův)
Integrální počet - II. část (určitý integrál jeho plikce) Michl Fusek Ústv mtemtiky FEKT VUT, fusekmi@feec.vutbr.cz 7. přednášk z ESMAT Michl Fusek (fusekmi@feec.vutbr.cz) 1 / 23 Obsh 1 Určitý vlstní (Riemnnův)
Přednáška 9: Limita a spojitost
 4 / XI /, 5: Přednášk 9: Limit spojitost V minulých přednáškách jsme podrobněji prozkoumli důležitý pojem funkce. Při řešení konkrétních problémů se nše znlosti (npř. nměřená dt) zpisují jko funkční hodnoty
4 / XI /, 5: Přednášk 9: Limit spojitost V minulých přednáškách jsme podrobněji prozkoumli důležitý pojem funkce. Při řešení konkrétních problémů se nše znlosti (npř. nměřená dt) zpisují jko funkční hodnoty
( a) Okolí bodu
 0..5 Okolí bodu Předpokldy: 40 Pedgogická poznámk: Hodin zjevně překrčuje možnosti většiny studentů v 45 minutách. Myslím, že nemá cenu přethovt do dlší hodiny, příkldy s redukovnými okolími nejsou nutné,
0..5 Okolí bodu Předpokldy: 40 Pedgogická poznámk: Hodin zjevně překrčuje možnosti většiny studentů v 45 minutách. Myslím, že nemá cenu přethovt do dlší hodiny, příkldy s redukovnými okolími nejsou nutné,
2.9.11 Logaritmus. Předpoklady: 2909
 .9. Logritmus Předpokld: 909 Pedgogická poznámk: Následující příkld vždují tk jeden půl vučovcí hodin. V přípdě potřeb všk stčí dojít k příkldu 6 zbtek jen ukázt, což se dá z jednu hodinu stihnout (nedoporučuji).
.9. Logritmus Předpokld: 909 Pedgogická poznámk: Následující příkld vždují tk jeden půl vučovcí hodin. V přípdě potřeb všk stčí dojít k příkldu 6 zbtek jen ukázt, což se dá z jednu hodinu stihnout (nedoporučuji).
ŘEŠENÍ JEDNODUCHÝCH LOGARITMICKÝCH ROVNIC. Řešme na množině reálných čísel rovnice: log 5. 3 log x. log
 Řešme n množině reálných čísel rovnice: ) 6 b) 8 d) e) c) f) ŘEŠENÍ JEDNODUCHÝCH LOGARITMICKÝCH ROVNIC Co budeme potřebovt? Chápt definici ritmu. Znát průběh ritmické funkce. Znát jednoduché vět o počítání
Řešme n množině reálných čísel rovnice: ) 6 b) 8 d) e) c) f) ŘEŠENÍ JEDNODUCHÝCH LOGARITMICKÝCH ROVNIC Co budeme potřebovt? Chápt definici ritmu. Znát průběh ritmické funkce. Znát jednoduché vět o počítání
vás seznámí s učivem, které v dané kapitole poznáte a které byste po jejím prostudování měli umět.
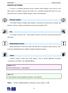 POKYNY KE STUDIU Pokyny ke studiu V úvodu si vysvětlíme jednotnou pevnou strukturu kždé kpitoly tetu, která by vám měl pomoci k rychlejší orientci při studiu Pro zvýrznění jednotlivých částí tetu jsou
POKYNY KE STUDIU Pokyny ke studiu V úvodu si vysvětlíme jednotnou pevnou strukturu kždé kpitoly tetu, která by vám měl pomoci k rychlejší orientci při studiu Pro zvýrznění jednotlivých částí tetu jsou
11. cvičení z Matematické analýzy 2
 11. cvičení z Mtemtické nlýzy 1. - 1. prosince 18 11.1 (cylindrické souřdnice) Zpište integrály pomocí cylindrických souřdnic pk je spočítejte: () x x x +y (x + y ) dz dy dx. (b) 1 1 x 1 1 x x y (x + y
11. cvičení z Mtemtické nlýzy 1. - 1. prosince 18 11.1 (cylindrické souřdnice) Zpište integrály pomocí cylindrických souřdnic pk je spočítejte: () x x x +y (x + y ) dz dy dx. (b) 1 1 x 1 1 x x y (x + y
Řešené příklady k MAI III.
 Řešené příkldy k MAI III. Jkub Melk 28. říjn 2007 1 Obsh 1 Metrické prostory 2 1.1 Teoretickéotázky.... 2 1.2 Metriky..... 4 1.3 Anlýzmnožin... 4 1.3.1 Uzávěry... 4 1.3.2 Zkoumejtenásledujícímnožiny....
Řešené příkldy k MAI III. Jkub Melk 28. říjn 2007 1 Obsh 1 Metrické prostory 2 1.1 Teoretickéotázky.... 2 1.2 Metriky..... 4 1.3 Anlýzmnožin... 4 1.3.1 Uzávěry... 4 1.3.2 Zkoumejtenásledujícímnožiny....
Převody Regulárních Výrazů. Minimalizace Konečných. Regulární jazyky 2 p.1/35
 Převody Regulárních Výrzů Minimlizce Konečných Automtů Regulární jzyky 2 p.1/35 Kleeneho lger Definice 2.1 Kleeneho lger sestává z neprázdné množiny se dvěm význčnými konstntmi 0 1, dvěm inárními opercemi
Převody Regulárních Výrzů Minimlizce Konečných Automtů Regulární jzyky 2 p.1/35 Kleeneho lger Definice 2.1 Kleeneho lger sestává z neprázdné množiny se dvěm význčnými konstntmi 0 1, dvěm inárními opercemi
3. ROVNICE A NEROVNICE 85. 3.1. Lineární rovnice 85. 3.2. Kvadratické rovnice 86. 3.3. Rovnice s absolutní hodnotou 88. 3.4. Iracionální rovnice 90
 ROVNICE A NEROVNICE 8 Lineární rovnice 8 Kvdrtické rovnice 8 Rovnice s bsolutní hodnotou 88 Ircionální rovnice 90 Eponenciální rovnice 9 Logritmické rovnice 9 7 Goniometrické rovnice 98 8 Nerovnice 0 Úlohy
ROVNICE A NEROVNICE 8 Lineární rovnice 8 Kvdrtické rovnice 8 Rovnice s bsolutní hodnotou 88 Ircionální rovnice 90 Eponenciální rovnice 9 Logritmické rovnice 9 7 Goniometrické rovnice 98 8 Nerovnice 0 Úlohy
M A = M k1 + M k2 = 3M k1 = 2400 Nm. (2)
 5.3 Řešené příkldy Příkld 1: U prutu kruhového průřezu o průměrech d d b, který je ztížen kroutícími momenty M k1 M k2 (M k2 = 2M k1 ), viz obr. 1, vypočítejte rekční účinek v uložení prutu, vyšetřete
5.3 Řešené příkldy Příkld 1: U prutu kruhového průřezu o průměrech d d b, který je ztížen kroutícími momenty M k1 M k2 (M k2 = 2M k1 ), viz obr. 1, vypočítejte rekční účinek v uložení prutu, vyšetřete

 Riemnnův určitý integrál. Definice 1. Budiž
Riemnnův určitý integrál. Definice 1. Budiž